Abstract
目的
探讨调节Lnk/干细胞因子(SCF)-干细胞因子受体(cKit)通路对糖尿病状态大鼠骨髓间充质干细胞(BMSCs)成骨功能的影响。
方法
分离糖尿病大鼠BMSCs,免疫细胞化学染色鉴定后,将细胞分为空白对照组、阴性对照组、RNA干扰组,并用免疫印迹实验检测干扰效果。体外模拟糖尿病状态下诱导BMSCs成骨分化,并检测Lnk/SCF-cKit通路主要蛋白Lnk、SCF、cKit及成骨相关蛋白碱性磷酸酶(ALP)、骨钙素(OCN)、Ⅰ型胶原蛋白a1(ColⅠa1)的表达。
结果
分离培养的细胞表达CD44、CD90,不表达CD11b、CD45,符合BMSCs表面标记物特征。与其他糖尿病状态BMSCs相比,RNA干扰组Lnk表达降低,SCF、cKit表达增加(P<0.05)。成骨诱导分化28 d,与其他糖尿病状态BMSCs相比,RNA干扰组细胞Lnk表达降低,SCF、cKit、ALP、OCN、ColⅠa1表达增加(P<0.05)。
结论
抑制Lnk表达、激活SCF-cKit通路可改善糖尿病状态大鼠BMSCs的成骨功能。
Keywords: Lnk, 干细胞因子-干细胞因子受体通路, 骨髓间充质干细胞, 糖尿病, 成骨
Abstract
Objective
Changes in the osteogenesis of diabetic rat bone marrow mesenchymal stem cells (BMSCs) by the regulation of Lnk/stem cell factor (SCF)-cKit signaling were investigated.
Methods
BMSCs were isolated from diabetic rats and identified by immunocytochemical staining. These cells were divided into the control group (untransfected group), negative control group (transfected with control plasmid), and RNA interference group (transfected with Lnk-targeting RNA interference plasmid). Western blot was performed to analyze the effect of interference. The BMSCs were induced for osteogenic differentiation under diabetic conditions, and Western blot was used to examine the expressions of Lnk, SCF, and cKit in Lnk/SCF-cKit signaling and osteogenic proteins alkaline phosphatase (ALP), osteocalcin (OCN), and collagen type Ⅰ a1 (ColIa1).
Results
Isolated cells expressed CD44 and CD90 but not CD11b or CD45. This phenomenon was characteristic of BMSCs. Compared with other diabetic BMSCs, cells in the RNA interference group expressed low Lnk but high SCF and cKit (P<0.05). Thereafter, 28 days after induction of osteogenic differentiation, cells in the RNA interference group expressed low Lnk but high SCF, cKit, ALP, OCN, and ColIa1 compared with other diabetic BMSCs (P<0.05).
Conclusion
The inhibition of Lnk expression and activation of SCF-cKit pathway may improve the osteogenic differentiation of BMSCs under diabetic conditions.
Keywords: Lnk, stem cell factor-cKit signaling, bone marrow mesenchymal stem cells, diabetes, osteogenesis
近年来,糖尿病在人群中的发病率逐年升高。糖尿病患者长期高血糖状态可引起身体多种组织、器官发生病变,糖尿病性骨疾病就是重要的并发症之一。糖尿病患者易罹患骨质疏松、骨缺损愈合障碍等骨性疾病,导致牙槽骨快速吸收、拔牙创愈合迟缓等不良后果,严重影响多种口腔疾病治疗的实施,其发病机制复杂,且常规治疗往往效果不佳,如何治疗糖尿病性骨疾病已成为临床工作的难点之一。
随着研究不断深入,越来越多的资料显示,糖尿病状态下细胞成骨功能障碍是此类疾病发生的重要原因。作为新兴细胞生物学研究中的重要细胞,骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)在牙槽骨等骨形成过程中的作用倍受瞩目。连接蛋白Lnk是新发现的在干细胞信号转导中有重要桥梁作用的蛋白,在多种病理状态下高表达[1]–[2],其下游的干细胞因子(stem cell factor,SCF)-干细胞因子受体(cKit)通路在多种干细胞迁移、分化等过程中起关键作用[3]。既往研究[4]表明,抑制Lnk的表达,调节Lnk/SCF-cKit信号通路可在骨折愈合过程中促进成骨。本研究拟用靶向Lnk的RNA干扰技术调节糖尿病状态BMSCs的Lnk/SCF-cKit通路,并检测BMSCs成骨功能的变化,探讨改善糖尿病状态BMSCs成骨功能的方法,为探寻糖尿病性骨疾病的治疗措施提供新思路。
1. 材料和方法
1.1. 主要试剂和仪器
靶向干扰Lnk基因的shRNA(Dharmacon公司,美国),正义链5′-CGAGUUACCUCUUUCCUUA-3′。链脲佐菌(Sigma公司,美国),小鼠抗大鼠单克隆抗体Lnk、SCF、碱性磷酸酶(alkaline phosphatase,ALP)、骨钙素(osteocalcin,OCN)、Ⅰ型胶原蛋白a1(collagen typeⅠ a1,ColⅠa1)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(Santa Cruz公司,美国),兔抗大鼠多克隆抗体cKit(Abcam公司,美国),小鼠抗大鼠单克隆抗体CD11b、CD44、CD45、CD90、羊抗小鼠IgG抗体、羊抗兔IgG抗体、SP染色试剂盒(北京中杉金桥生物技术有限公司),Nikon 80i型显微镜(Nikon公司,日本),BIO-RAD Gel Doc XR+凝胶成像系统(BIO-RAD公司,美国)。
1.2. 构建大鼠糖尿病模型并分离培养BMSCs
SPF级4周龄SD雄性大鼠8只经过高糖食物喂养4周,空腹12 h后腹腔注射链脲佐菌素(35 mg·kg−1体重),1周后取尾静脉血检测空腹血糖值,超过11.1 mmol·L−1者视为糖尿病模型构建成功[5]。大鼠形成糖尿病后,以常规鼠饲料喂养4周(每周测血糖确定糖尿病状态),处死大鼠。
处死糖尿病大鼠后无菌条件下分离四肢长骨,放入αMEM培养基中漂洗。然后将长骨放入含10%青霉素/链霉素的αMEM培养基中去除表面软组织,更换培养基后切断干骺端并冲出骨髓,经过滤、离心后将所得细胞重悬于含10%胎牛血清及10%青霉素/链霉素的αMEM培养基中,置于37 °C、5%CO2的培养箱中贴壁培养,获得BMSCs。
正常BMSCs以相同方法取自与糖尿病大鼠相同周龄的8只正常大鼠(正常大鼠处死前均以常规鼠饲料喂食,处死前测定血糖确定未患糖尿病)。
1.3. 免疫细胞化学染色鉴定BMSCs
如文献[6]所述方法,将生长状态良好的糖尿病大鼠及正常大鼠第3代细胞接种于盖玻片上,制备细胞爬片。细胞爬片经40 g·L−1多聚甲醛固定,5 g·L−1 Triton X-100孵育后,使用3%H2O2、封闭血清孵育,CD11b、CD44、CD45、CD90小鼠抗大鼠单克隆抗体(1︰200)作为一抗孵育,PBS代替一抗作为空白对照,二抗工作液孵育后进行DAB显色剂显色,采用免疫细胞化学技术检测细胞表面标记物来鉴定细胞。阳性信号为细胞质或细胞核出现棕黄色颗粒。
1.4. RNA干扰BMSCs
选取生长状态良好的第3代糖尿病大鼠BMSCs进行转染。转染前24 h将干细胞接种至24孔板,每孔接种3×105个细胞,细胞分为空白对照组、阴性对照组和RNA干扰组。空白对照组:不加任何干预措施;阴性对照组:用空载体质粒转染BMSCs;RNA干扰组:用靶向Lnk基因的shRNA重组质粒转染BMSCs。转染后用含有4 mg·L−1嘌呤霉素的培养基进行阳性细胞筛选,获得稳定转染细胞。正常大鼠的BMSCs按相同方法进行转染及筛选,细胞分为正常对照组、正常阴性组和正常干扰组。正常对照组:不加任何干预措施;正常阴性组:用空载体质粒转染BMSCs;正常干扰组:用靶向Lnk基因的shRNA重组质粒转染BMSCs。
获得稳定转染细胞后在成骨诱导前用免疫印迹实验检测BMSCs的Lnk及其下游SCF-cKit通路主要蛋白SCF、cKit的表达,检测RNA干扰效果。收集各组细胞抽提蛋白后,以BCA法定量,即在96孔板中每孔加入蛋白标准品或蛋白样品20 µL,每孔加入200 µL的BCA工作试剂,37 °C温育30 min,用酶标仪在562 nm检测吸光度值,制作标准曲线并根据标准曲线计算蛋白样品浓度。以每孔50 µg的上样量加入各组蛋白,进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gelelectrophoresis,SDS-PAGE),湿转后50 g·L−1脱脂牛奶封闭l h,Lnk、SCF、GAPDH小鼠抗大鼠单克隆抗体(1︰500)、cKit兔抗大鼠多克隆抗体(1︰600)作为一抗孵育2 h,羊抗小鼠或羊抗兔IgG抗体作为二抗(1︰3 000)孵育2 h,增强化学发光法(enhanced chemiluminescence,ECL)显影,分析BIO-RAD Gel Doc XR+凝胶成像系统分析目的蛋白与内参GAPDH条带的相对灰度值。每组细胞蛋白免疫印迹实验重复6次。
1.5. 诱导细胞成骨分化
获得稳定转染细胞后,将空白对照组、阴性对照组和RNA干扰组大鼠BMSCs在模拟糖尿病状态的高糖成骨培养基中培养,进行成骨诱导,培养液为:含12 mmol·L−1葡萄糖的αMEM培养基,加入10%胎牛血清、10 nmol·L−1地塞米松、0.1 mmol·L−1抗坏血酸、1 mol·L−1 β-甘油磷酸钠。正常对照组、正常阴性组和正常干扰组BMSCs在普通成骨培养基中培养,进行成骨诱导,培养液为:标准αMEM培养基,加入10%胎牛血清、10 nmol·L−1地塞米松、0.1 mmol·L−1抗坏血酸、1 mol·L−1 β-甘油磷酸钠。
1.6. 免疫印迹实验检测成骨诱导分化后细胞蛋白的表达
于成骨诱导28 d用免疫印迹实验检测各组BMSCs中Lnk及其下游SCF-cKit通路主要蛋白SCF、cKit以及成骨相关蛋白ALP、OCN、ColⅠa1的表达。收集细胞抽提蛋白,如1.4部分所述用BCA法定量后,进行SDS-PAGE凝胶电泳,Lnk、SCF、GAPDH小鼠抗大鼠单克隆抗体(1︰500),cKit兔抗大鼠多克隆抗体(1︰600),ALP、OCN、ColⅠa1小鼠抗大鼠单克隆抗体(1︰600)作为一抗孵育2 h,二抗(1︰3 000)孵育2 h,ECL显影,分析目的蛋白与内参GAPDH条带的相对灰度值。每组细胞蛋白免疫印迹实验重复6次。
1.7. 统计学分析
采用SPSS 18.0软件进行统计学分析,数据以均数±标准差表示,采用成组设计方差分析进行各组间的比较,两两比较采用t检验,P<0.05为差异有统计学意义。
2. 结果
2.1. 免疫细胞化学染色鉴定BMSCs
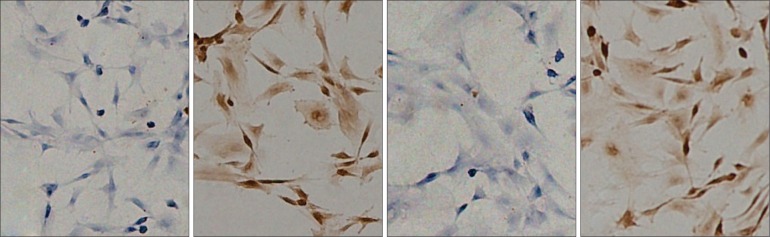
染色结果显示,分离培养的细胞表达CD44、CD90,不表达CD11b、CD45,符合BMSCs表面标记物特征(图1)。
图 1. BMSCs中CD11b、CD44、CD45、CD90的表达 SP × 400.
Fig 1 Expression of CD11b, CD44, CD45 and CD90 in BMSCs SP × 400
从左到右依次为CD11b、CD44、CD45、CD90的表达。
2.2. 大鼠的空腹血糖值
注射链脲佐菌素1周以后,糖尿病大鼠的空腹血糖值均高于11.1 mmol·L−1,平均值为(15.207±1.535) mmol·L−1,符合糖尿病模型构建成功标准。而正常大鼠的空腹血糖值均低于11.1 mmol·L−1,平均值为(5.416±1.102) mmol·L−1。处死大鼠当日,糖尿病大鼠的空腹血糖值均高于11.1 mmol·L−1,平均值为(17.362±2.217) mmol·L−1;正常大鼠的空腹血糖值均低于11.1 mmol·L−1,平均值为(5.791±0.834) mmol·L−1。
2.3. 免疫印迹实验检测靶向Lnk的RNA干扰效果
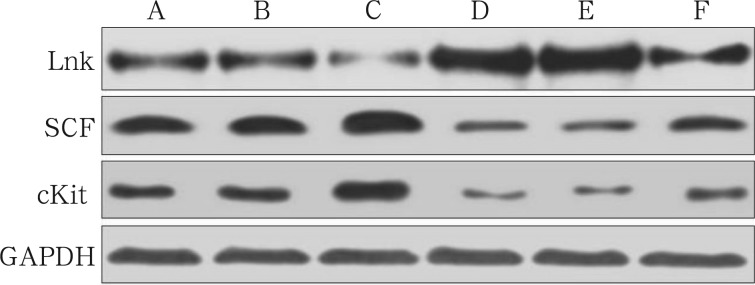
与糖尿病各组相比,正常对照组低表达Lnk,高表达SCF、cKit(P<0.05);与空白对照组、阴性对照组BMSCs相比,RNA干扰组Lnk表达降低,SCF、cKit表达升高(P<0.05);空白对照组与阴性对照组相比,Lnk、SCF、cKit的表达无统计学差异(P>0.05);与正常对照组、正常阴性组BMSCs相比,正常干扰组Lnk表达降低,SCF、cKit表达升高(P<0.05);正常对照组与正常阴性组相比,Lnk、SCF、cKit的表达无统计学差异(P>0.05)(图2,表1)。
图 2. 免疫印迹实验检测成骨诱导前各组BMSCs的蛋白表达.
Fig 2 Western blot analysis of different protein expression in BMSCs before osteogenic differentiation
A~F:正常对照组、正常阴性组、正常干扰组、空白对照组、阴性对照组、RNA干扰组。
表 1. 成骨诱导前各组BMSCs的蛋白表达.
Tab 1 Protein expression in BMSCs before osteogenic differentiation
| 组别 | 相对灰度值 |
||
| Lnk | SCF | cKit | |
| 正常对照组 | 0.452±0.036 b | 0.904±0.073 b | 0.675±0.044 b |
| 正常阴性组 | 0.517±0.041 b | 0.881±0.045 b | 0.732±0.061 b |
| 正常干扰组 | 0.294±0.025 ab | 1.237±0.064 ab | 1.105±0.072 ab |
| 空白对照组 | 1.261±0.044 ab | 0.521±0.047 ab | 0.317±0.053 ab |
| 阴性对照组 | 1.244±0.053 ab | 0.516±0.051 ab | 0.335±0.056 ab |
| RNA干扰组 | 0.693±0.011 a | 0.745±0.042 a | 0.486±0.035 a |
注:a为与正常对照组相比,P<0.05;b为与RNA干扰组相比,P<0.05。
2.4. 免疫印迹实验检测诱导成骨分化后细胞蛋白的表达
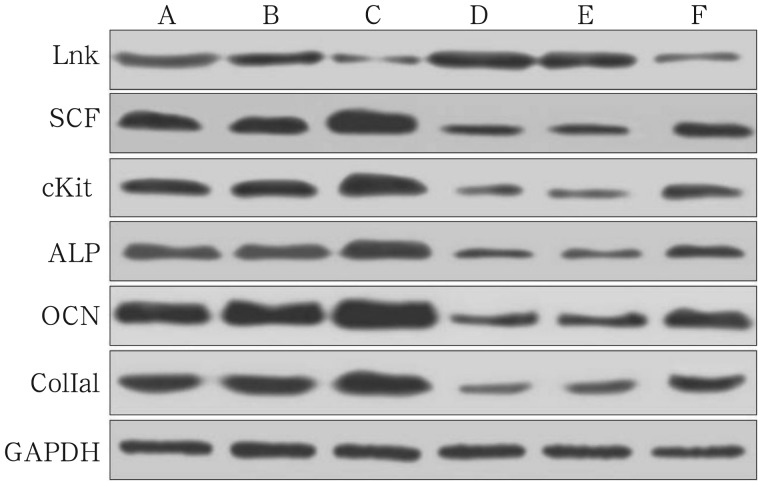
诱导成骨分化28 d,与正常对照组BMSCs相比,糖尿病状态各组BMSCs的Lnk表达水平高,SCF、cKit表达水平低,成骨相关蛋白ALP、OCN、ColⅠa1表达少(P<0.05);与空白对照组、阴性对照组BMSCs相比,RNA干扰组细胞Lnk表达减少,SCF、cKit、ALP、OCN、ColⅠa1的表达增加(P<0.05);空白对照组与阴性对照组相比,Lnk、SCF、cKit、ALP、OCN、ColⅠa1的表达均无统计学差异(P>0.05);与正常对照组、正常阴性组BMSCs相比,正常干扰组Lnk表达降低,SCF、cKit、ALP、OCN、ColⅠa1表达升高(P<0.05);正常对照组与正常阴性组相比,Lnk、SCF、cKit、ALP、OCN、ColⅠa1的表达无统计学差异(P>0.05)(图3,表2)。
图 3. 免疫印迹实验检测成骨诱导28 d各组BMSCs的蛋白表达.
Fig 3 Western blot analysis of different protein expression in BMSCs 28 days after osteogenic differentiation
A~F:正常对照组、正常阴性组、正常干扰组、空白对照组、阴性对照组、RNA干扰组。
表 2. 成骨诱导28 d各组BMSCs的蛋白表达.
Tab 2 Protein expression in BMSCs 28 days after osteogenic differentiation
| 组别 | 相对灰度值 |
|||||
| Lnk | SCF | cKit | ALP | OCN | ColⅠa1 | |
| 正常对照组 | 0.403±0.031 b | 1.542±0.095 b | 1.385±0.112 b | 1.216±0.063 b | 1.086±0.059 b | 1.135±0.062 b |
| 正常阴性组 | 0.438±0.052 b | 1.496±0.067 b | 1.327±0.094 b | 1.117±0.078 b | 1.153±0.092 b | 1.088±0.086 b |
| 正常干扰组 | 0.215±0.022 ab | 1.764±0.073 ab | 1.632±0.085 ab | 1.461±0.046 ab | 1.571±0.063 ab | 1.367±0.072 ab |
| 空白对照组 | 0.892±0.063 ab | 0.947±0.102 ab | 0.596±0.051 ab | 0.734±0.042 ab | 0.683±0.047 ab | 0.575±0.035 ab |
| 阴性对照组 | 0.924±0.071 ab | 0.925±0.087 ab | 0.626±0.032 ab | 0.742±0.057 ab | 0.671±0.056 ab | 0.643±0.026 ab |
| RNA干扰组 | 0.617±0.024 a | 1.306±0.091 a | 0.853±0.045 a | 0.905±0.051 a | 0.845±0.038 a | 0.828±0.033 a |
注:a为与正常对照组相比,P<0.05;b为与RNA干扰组相比,P<0.05。
3. 讨论
糖尿病状态使细胞成骨功能障碍,是糖尿病性骨疾病发生发展的重要原因。BMSCs存在于全身多个部位的骨组织中,可分化为成骨细胞、成软骨细胞等,近年来发现BMSCs也存在于牙槽骨组织中,是牙槽骨生长代谢与缺损修复的细胞储库[7],细胞外糖状态、细胞因子等因素可影响BMSCs的成骨功能,进而改变骨组织的生长及缺损修复进程[8]。
近年来,Lnk因在多种干细胞的迁移、分化等过程中起重要调节作用受到越来越多的关注[1]–[2]。Lnk在其介导的细胞信号转导系统中起重要的桥梁作用,沟通整条信号转导通路。Lnk的表达变化能调节造血干细胞的增殖、内皮祖细胞的分化等多种病理生理过程[9]。有研究[2]显示,靶向抑制正常成骨细胞的Lnk表达,可促进其骨向分化,并且抑制Lnk的表达可改善小鼠骨折愈合过程,促进骨折部位的骨形成,但其中的作用机制尚不明确。SCF-cKit信号通路是Lnk蛋白重要的下游通路之一,与组织细胞分化再生障碍关系密切[3]–[4]。Lnk蛋白Src同源区2结构可活化SCF,影响SCF与cKit特异性结合,激活cKit,介导下游通路细胞分化信号的转导[10]。
本研究构建大鼠糖尿病模型并分离培养BMSCs,在体外RNA干扰Lnk的表达,观察到在诱导成骨分化前后,与正常对照组相比,糖尿病状态各组BMSCs高表达Lnk,低表达SCF、cKit;与空白对照组、阴性对照组相比,RNA干扰组Lnk表达减少,SCF、cKit表达增加,提示在糖尿病状态下BMSCs的Lnk表达过度,下游SCF-cKit通路受到抑制,而靶向Lnk的RNA干扰能有效抑制BMSCs的Lnk表达,激活SCF-cKit通路。对正常大鼠BMSCs进行靶向Lnk的RNA干扰后,在诱导成骨分化前后,Lnk的表达降低,SCF、cKit的表达增加,提示在正常血糖状态下抑制BMSCs的Lnk表达也可激活下游SCF-cKit通路。
目前已证实,ALP、OCN、ColⅠa1是成骨过程中的重要蛋白,ALP是骨形成所必需的酶,能反映细胞骨向分化、促进成骨的能力,是生物矿化和成骨样细胞的特征性标记[11];OCN是成骨过程中的一种特异蛋白,伴随细胞向成骨细胞分化、成熟而逐渐表达增加;ColⅠa1是由骨形成细胞生产到骨基质中的主要有机成分,是成骨分化的又一重要标志物[12]。本研究结果可见,与正常对照组BMSCs相比,糖尿病状态各组BMSCs表达ALP、OCN、ColⅠa1减少,且Lnk表达水平升高,SCF、cKit表达水平降低,提示在糖尿病状态下存在BMSCs成骨分化障碍,并可能与Lnk/SCF-cKit信号通路激活异常有关。有研究[2],[4]显示,调节Lnk/SCF-cKit通路可促进成骨细胞形成钙化结节,并促进骨形成。本实验也观察到,靶向抑制正常大鼠BMSCs的Lnk表达,可使细胞SCF、cKit、ALP、OCN、ColⅠa1的表达增加,提示调节Lnk/SCF-cKit信号通路可以促进正常BMSCs的成骨分化;而与糖尿病状态其他各组细胞相比,RNA干扰组Lnk表达减少,SCF、cKit、ALP、OCN、ColⅠa1的表达增加,提示抑制Lnk的表达、激活下游SCF-cKit通路可能改善糖尿病状态BMSCs的成骨分化,调节Lnk/SCF-cKit通路可能为治疗糖尿病性骨疾病提供新思路。
Acknowledgments
本研究在广西重点实验室口腔颌面修复与重建研究实验室中完成,感谢杨亦萍、卿海云、曹阳老师的实验指导。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81200794);广西自然科学基金资助项目(2015GXNSFBA139140);广西高校科学技术研究项目(KY2015YB060);广西医科大学青年科学基金资助项目(GXMUYSF2014017);广西医科大学大学生课外创新科研课题(WLXSZX1538);大学生创新创业训练计划(桂医大教[2015]27号-73)
References
- 1.Bersenev A, Rozenova K, Balcerek J, et al. Lnk deficiency partially mitigates hematopoietic stem cell aging[J] Aging Cell. 2012;11(6):949–959. doi: 10.1111/j.1474-9726.2012.00862.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Kawakami Y, Ii M, Matsumoto T, et al. A small interfering RNA targeting Lnk accelerates bone fracture healing with early neovascularization[J] Lab Invest. 2013;93(9):1036–1053. doi: 10.1038/labinvest.2013.93. [DOI] [PubMed] [Google Scholar]
- 3.Guijarro P, Wang Y, Ying Y, et al. In vivo knockdown of cKit impairs neuronal migration and axonal extension in the cerebral cortex[J] Dev Neurobiol. 2013;73(12):871–887. doi: 10.1002/dneu.22107. [DOI] [PubMed] [Google Scholar]
- 4.Matsumoto T, Ii M, Nishimura H, et al. Lnk-dependent axis of SCF-cKit signal for osteogenesis in bone fracture healing[J] J Exp Med. 2010;207(10):2207–2223. doi: 10.1084/jem.20100321. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Lambertucci AC, Lambertucci RH, Hirabara SM, et al. Glutamine supplementation stimulates protein-synthetic and inhibits protein-degradative signaling pathways in skeletal muscle of diabetic rats[J] PLoS ONE. 2012;7(12):e50390. doi: 10.1371/journal.pone.0050390. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.范 敬静, 李 东良, 何 秀华, et al. 骨髓间充质干细胞向肝样细胞的诱导及分化[J] 中国组织工程研究与临床康复. 2011;15(14):2491–2494. [Google Scholar]
- 7.Kim SH, Kim KH, Seo BM, et al. Alveolar bone regeneration by transplantation of periodontal ligament stem cells and bone marrow stem cells in a canine peri-implant defect model: a pilot study[J] J Periodontol. 2009;80(11):1815–1823. doi: 10.1902/jop.2009.090249. [DOI] [PubMed] [Google Scholar]
- 8.Du J, Shan Z, Ma P, et al. Allogeneic bone marrow mesenchymal stem cell transplantation for periodontal regeneration[J] J Dent Res. 2014;93(2):183–188. doi: 10.1177/0022034513513026. [DOI] [PubMed] [Google Scholar]
- 9.Kwon SM, Suzuki T, Kawamoto A, et al. Pivotal role of lnk adaptor protein in endothelial progenitor cell biology for vascular regeneration[J] Circ Res. 2009;104(8):969–977. doi: 10.1161/CIRCRESAHA.108.192856. [DOI] [PubMed] [Google Scholar]
- 10.Simon C, Dondi E, Chaix A, et al. Lnk adaptor protein down-regulates specific Kit-induced signaling pathways in primary mast cells[J] Blood. 2008;112(10):4039–4047. doi: 10.1182/blood-2008-05-154849. [DOI] [PubMed] [Google Scholar]
- 11.赵 海霞, 马 肃, 陈 力, et al. 尼古丁对大鼠不同部位骨钙磷含量和碱性磷酸酶活性的差异影响[J] 华西口腔医学杂志. 2013;32(3):225–227. [Google Scholar]
- 12.Frith JE, Titmarsh DM, Padmanabhan H, et al. Microbioreactor array screening of Wnt modulators and microenvironmental factors in osteogenic differentiation of mesenchymal progenitor cells[J] PLoS ONE. 2013;8(12):e82931. doi: 10.1371/journal.pone.0082931. [DOI] [PMC free article] [PubMed] [Google Scholar]