Abstract
牙髓组织具有形成牙本质、提供营养、传导痛觉和对外界刺激产生保护性反应的功能。牙髓组织病理学改变性质是决定牙齿治疗方案的选择和治疗效果评估的组织学基础。当牙髓病变可逆或局限时,应消除感染,保存活髓,维护牙髓的功能。长久以来,活髓保存治疗的临床诊治,特别是其适应证和预后因素,一直是临床医生争论的热点话题,且常常给很多医生造成困惑。本文从适应证、牙髓状态评估、感染消除、盖髓材料选择等方面对活髓保存治疗中存在的困惑以及解决方法进行介绍,同时提出了活髓保存治疗的临床路径和操作规范,以便临床上更好地开展活髓保存治疗。
Keywords: 活髓保存治疗, 适应证, 预后因素, 激光多普勒血流检测仪
Abstract
Dental pulp tissue plays a role in forming dentin, providing nutrition, conducting pain, and generating protective responses to environmental stimuli. Bacterial infection is the main cause of pulp disease, where histopathological changes are the histological basis for determining the choice of treatment and the evaluation of therapeutic effect. Thus, particular attention should be given to eliminate infection, as well as preserve and maintain pulpal health in teeth that show reversible or limited pulpal injuries. Vital pulp therapy, especially its indications and prognostic factors, has been a research hotspot that often causes confusion among clinicians. In this paper, we briefly introduce the confusion and solution for vital pulp therapy in terms of indications, pulp condition assessment, infection elimination, and capping material selection. In addition, we develop a clinical pathway and an operation normalization of vital pulp therapy to better perform the therapy.
Keywords: vital pulp therapy, indication, prognostic factor, laser Doppler flowmetry
牙髓组织具有形成牙本质、提供营养、传导痛觉和对外界刺激产生保护性反应的功能[1]。细菌感染是引发牙髓疾病的罪魁祸首,牙髓组织病理学改变性质是决定其治疗方案的选择和治疗效果评估的组织学基础。因而当牙髓病变是可逆或局限时,首先应消除感染,保存活髓,维护牙髓的功能。长久以来,活髓保存治疗的临床诊治,特别是其适应证和预后因素,一直是临床医生争论的热点话题,且常常给很多医生造成困惑。本文就活髓保存治疗的适应证和预后因素中所存在的困惑及解决方法进行介绍。
1. 活髓保存治疗之惑
1.1. 适应证之惑
活髓保存治疗包括间接盖髓术、直接盖髓术和活髓切断术,适用于所有诊断为可逆性牙髓炎或部分牙髓局限性炎症,但剩余牙髓仍存有健康组织的患牙[2]。目前临床上关于龋源性露髓的活髓保存治疗一直存在争议。美国牙髓病学协会[3]认为“龋源性露髓时,龋坏下牙髓组织的炎症程度是未知的”。因此不少临床医生主张龋源性露髓时应采取根管治疗术。Aguilar等[4]通过系统性回顾分析发现,龋源性露髓时采用活髓保存治疗可取得成功的治疗效果,其认为活髓保存治疗可被视为牙髓摘除术的一种替代治疗方法。故临床上针对龋源性露髓的患牙,应采用何种治疗方法?在怎样的适宜条件下,选择活髓保存治疗可取得好的治疗效果?
1.2. 感染消除临床判定之惑
彻底消除感染源是活髓保存治疗取得成功的前提和根本保证。对于已经感染的牙体组织,临床上常使用挖匙等手用工具和慢速钻针,根据牙体组织的颜色、硬度以及龋齿检测染料染色试验,区别感染牙体组织是否去除干净。然而这种方法较多依赖于临床医生的主观性判断,存在感染去除不彻底或过度去除有矿化潜能的软化牙本质的风险。一旦牙髓暴露,口腔细菌已经侵入牙髓组织,临床上采取活髓切断术去除感染牙髓组织,然而如何确定活髓切除的范围以及如何判定感染物被彻底去净,目前尚缺乏可执行方法和标准。
1.3. 预后之惑
影响预后的因素复杂多样往往是造成临床医生对活髓保存治疗存有困惑的重要原因之一,同时也给治疗的有效性带来阻碍。那么临床医生对于活髓保存治疗的预后因素存在哪些困惑?
1.3.1. 牙髓状态
牙髓状态的评估是影响患牙活髓保存治疗预后的核心因素。目前临床常用的评估方法如牙髓电测试、温度测试等多依赖于患者的主观感受和临床医生的诊断经验,难以准确地判断牙髓的炎症状态,特别是对于龋源性露髓的患牙和根尖孔未发育完全的年轻恒牙。如何正确评估牙髓活力状态是很多临床医生时常需要面临的困惑和挑战之一。
1.3.2. 盖髓材料
盖髓材料一方面可以促进牙髓组织的愈合,另一方面可以严密封闭窝洞,通过形成硬组织屏障,避免微渗漏造成牙髓组织再感染。目前临床上常用的盖髓材料包括氢氧化钙、生物陶瓷材料Mineral Trioxide Aggregate(MTA)和新型纳米生物陶瓷材料iRoot BP等。氢氧化钙盖髓后,初始的高pH值可中和炎性组织中的酸,刺激成纤维细胞和酶系统,杀灭牙髓创面上残存的感染物,促进牙髓组织的防御和修复功能[2],[5]。MTA作为一种无机三氧化物聚合物,具有良好的生物相容性、抗菌性和边缘封闭性,可减少牙髓组织的炎症反应[6]–[7]。MTA置于创面后,不受周围组织液或血液的影响,可缓慢地释放钙离子,产生的氢氧化钙和水合硅酸钙形成高pH环境,可诱导细胞聚集,促进矿化细胞因子表达,实现牙本质的修复[7]–[8]。iRoot BP无毒性,具有良好的生物相容性、抗菌性、流动性、亲水性等,同时可促进与矿化相关的基因表达上调[7],[9]–[11]。面对众多具有良好生物性能的盖髓材料,在活髓保存治疗中如何抉择也是临床医生常需考虑和困惑的问题之一。
1.3.3. 患者的年龄和根尖孔的状态
以往观点认为年轻患者的牙髓组织愈合能力较强,活髓保存治疗后可取得较高的成功率,但目前尚缺乏足够的研究数据支持这一说法。此外研究[4],[12]发现,6~70岁大年龄跨度的患者活髓保存治疗后都可获得较成功的治疗效果。这说明牙髓组织的愈合能力与年龄之间的相关性不强。研究[4]发现,在活髓切断术中,根尖孔的状态对治疗的间接加权成功率影响无统计学差异。分析原因,治疗成功的关键可能在于病因即感染组织的清除,而不是根尖孔的状态。目前对于患者的年龄和患牙根尖孔的状态对活髓保存治疗预后的影响还需要进一步研究。
2. 活髓保存治疗解决之道
2.1. 适应证和牙髓评估
患牙特别是龋源性露髓者是否采用活髓保存治疗主要取决于牙髓状态的正确评估。近年来有学者主张治疗前用激光多普勒血流检测仪(laser Doppler flowmetry,LDF)监测牙髓组织的血运状况,进而反映其活性状态。LDF可不依赖于患者的主观感受,客观、有效、无创地判断牙髓的真实状态[13]。但LDF测量结果的准确性一直存在争议,因为其结果受到多种因素的影响,包括非牙髓组织血流信号的干扰、探头的使用方法、患者测试时的基础状态(体位、心率等)、局麻药物等。近年来,随着仪器设备的改良和操作的规范化,混杂因素的影响不断地最小化,LDF测量结果的可信性被越来越多的学者们认可,认为LDF判断牙髓活力状态上的可靠性高于传统方法牙髓电测试、温度测试[14]。笔者课题组使用LDF追踪检测了1例冠折露髓后行部分活髓切断术治疗的患牙牙髓血流(pulp blood flow,PBF)的变化,探究iRoot BP盖髓后牙髓活力的恢复趋势。该患者,男,8岁,21牙外伤1 d就诊,无自发痛和夜间痛等症状。临床检查可见21牙从唇侧冠中1/3向腭侧斜向折断,牙髓暴露,冷热(+-),探(++),叩(+),松(-),PBF均值为11.3 PU。正常对照牙PBF均值为8.7 PU。冠折后1 d,短暂的血流值升高,说明牙髓处于炎症期。iRoot BP盖髓后2周,21牙冷热(-),探(-),叩(+-),PBF均值为5.8 PU。盖髓后6月,21牙无变色,冷热(-),叩(-),PBF均值为4.6 PU。盖髓后1年,冷热(-),叩(-),PBF均值为4.4 PU。21牙外伤后因切除了较多的冠部牙髓组织,所以盖髓后PBF均值一直低于正常对照牙。盖髓后2周的PBF均值大于盖髓后6月,说明盖髓后2周21牙牙髓仍处于炎症期。盖髓后6~12月的血流值变化趋于稳定,说明牙髓已基本恢复正常状态(图1)。术后12月内随访的临床检查和X线片证实了LDF检测结果的可信性,X线片可见根尖孔有闭合发育的趋势(图2)。外伤后牙髓会处于局部的炎症期,血流值短暂地升高。活髓保存治疗iRoot BP盖髓后3~6月牙髓活力逐渐恢复,牙髓血流值变化逐渐趋于稳定。本课题组还会后续进一步更长时间地追踪评估牙髓状态。由此可见,LDF在牙髓状态的判断和活髓保存治疗预后效果的评估方面有着令人期待的发展前景。
图 1. LDF追踪评估冠折露髓行部分活髓切断术的患牙牙髓血流.
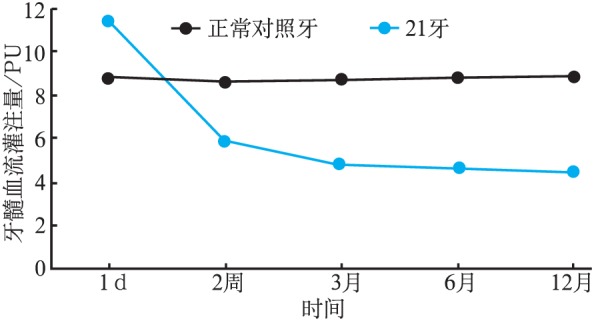
Fig 1 Track and assess the pulp blood flow of the tooth with crown fracture which has been performed partial pulpotomy by LDF
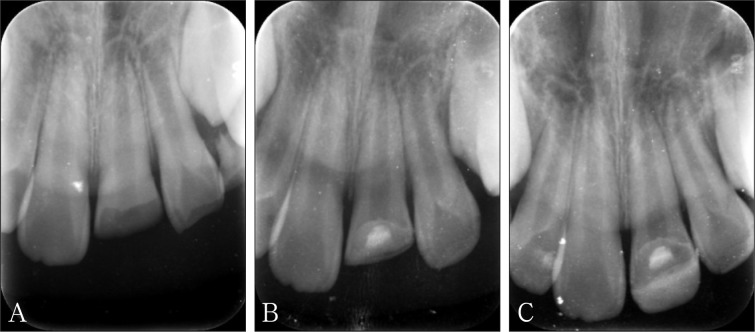
图 2. X线片追踪评估冠折露髓行部分活髓切断术的患牙牙髓根尖周情况.
Fig 2 Track and assess the pulpal and periapical tissue of the tooth with crown fracture which has been performed partial pulpotomy by X ray
A:21牙术前X线片,冠部缺损至髓腔,未见根折影像,根尖孔未发育完全;B:iRoot BP盖髓后6月X线片,冠部可见高密度盖髓材料影像,根尖孔未发育完全;C:iRoot BP盖髓后1年X线片,21牙根尖孔有闭合发育的趋势。
此外,Matsuo等[15]认为在治疗中观察牙髓的出血程度和止血能力比观察患者临床症状和体征来判断牙髓状态更加可靠。止血后5~10 min,若暴露的牙髓创面仍在出血,说明炎症性的牙髓组织未完全去除或牙髓炎症已进入根髓,此时需修改活髓保存治疗的方案,部分或完全去除冠髓,直至出血止住,甚至考虑更有效的牙髓摘除术[4],[16](图3)。用于活髓保存治疗的止血剂有很多种,包括各种浓度的次氯酸钠(NaClO)、2%氯己定、30%过氧化氢、硫酸铁、肾上腺素等。目前缺乏证据哪种止血剂效果最好,但1.5%~6%的NaClO是常被推荐的有效、安全和便宜的止血剂[16]–[18] 。研究[18]表明,1.5%~6%的NaClO与牙髓组织直接接触,不会对牙髓细胞的募集、分化和硬组织沉积造成不良影响。
图 3. 牙冠折露髓后行局部活髓切断术——评估牙髓炎症程度.
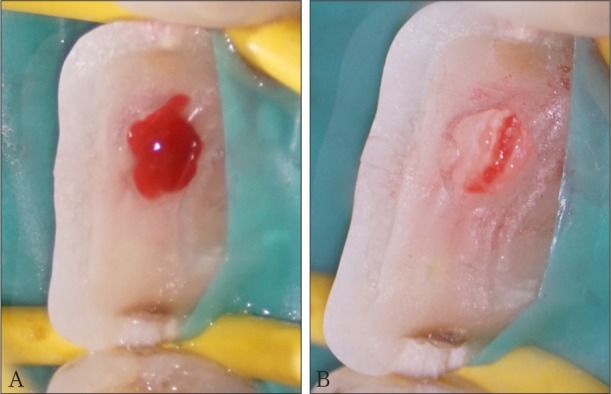
Fig 3 Partial pulpotomy for teeth with exposed pulps in crown——evaluating pulp status of infection
A:11牙止血后牙髓组织仍在出血,判断感染的牙髓组织未彻底去除;B:进一步切断牙髓组织,出血止住,可视为感染的牙髓组织已去除。
2.2. 感染消除
活髓保存治疗时,“无菌”观念应贯穿临床医生的整个治疗操作过程,不仅要清除牙髓组织中的感染物,而且要严防唾液细菌对牙髓组织再感染。严格的隔湿和消毒是实现感染彻底消除和控制的前提。隔湿的方法包括棉卷隔离法和橡皮障隔离法。棉卷隔离法虽简单易行,但对于儿童和唾液较多的患者隔湿效果差,故临床上活髓保存治疗隔湿时不推荐使用。安置橡皮障隔离患牙一方面可以避免唾液、血液的污染,防止牙科器械对患者的误伤,另一方面可保持医生的视野清晰度,避免频繁地更换棉卷,提高工作效率(图4)。
图 4. 牙冠折露髓后行局部活髓切断术——消除感染.
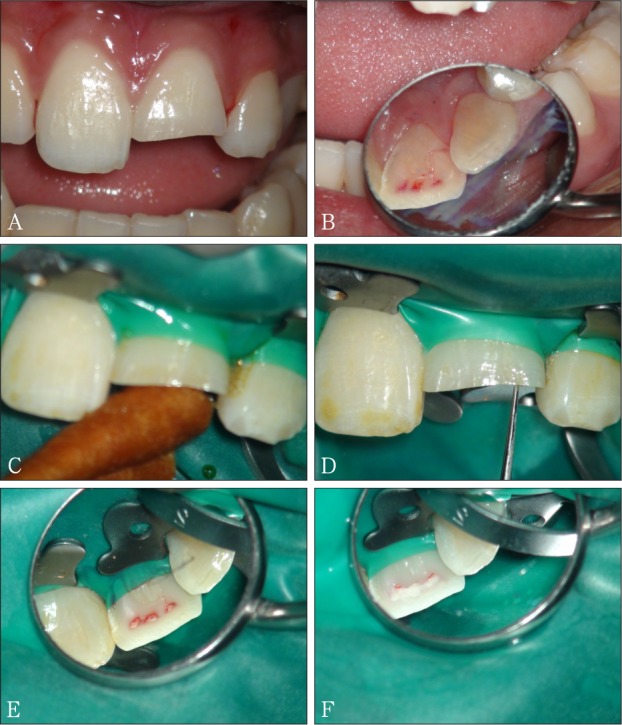
Fig 4 Partial pulpotomy for teeth with exposed pulps in crown——eradicating the infection
A、B:21牙冠折露髓; C:安置橡皮障隔离21牙,术区牙碘伏消毒;D:无菌微创车针去除感染组织;E:术中切断感染的牙髓组织;F:完全切除感染的牙髓组织,次氯酸钠棉球消毒后。
为提高感染消除效果,有些医生建议使用显微镜等光学放大设备和龋齿检测染料[19]。但有研究[20]显示,牙体组织被龋齿检测染料染色不能说明有微生物的感染而只能表明其矿化水平较低,因此使用龋齿检测染料可能会造成过度地去除健康的牙体组织。近年来各种激光系统越来越多地成功应用于活髓保存治疗,如:二极管激光、钕激光、铒激光、铒-铬激光等。研究[21]表明,激光治疗可增强表面感染清除和止血效果,减轻患者的不适感,发挥生物刺激效应,促进牙髓组织形成牙本质。相比于传统治疗方法,激光辅助治疗能够更有效地提高治疗效果[21]。
间接盖髓时感染组织的消除可以分为一步法和逐步法。以往观点认为逐步法可降低牙髓暴露的风险,提高临床远期成功率[17]。近年来有学者[22]提出相反观点,认为从成本-效益学的角度,一步法在经济成本和患牙长期保存方面要优于逐步法。回顾性数据统计分析发现,一步法直接盖髓的加权成功率为81.7%,这与逐步法81.9%的加权成功率相似[2]。
2.3. 盖髓材料选择
氢氧化钙曾被普遍认为是用于活髓保存治疗的“黄金标准”材料,但氢氧化钙具有一些明显的缺点,如:细胞毒性;形成不完整的牙本质桥,存在管状缺陷和微渗漏的情况;缺乏黏附性;溶解性高并随着时间降解,不能长期发挥作用。氢氧化钙盖髓治疗后存在患牙术后长久不适、牙根内吸收、牙髓退行性变及钙化等后遗症。Dammaschke等[23]研究报道氢氧化钙盖髓治疗的成功率为76.3%。
与氢氧化钙相比,MTA形成的修复性牙本质桥更加完整(管状缺陷较少)和更厚[6]。Aguilar等[4]对MTA和氢氧化钙临床治疗的加权成功率进行比较,结果表明MTA较氢氧化钙可取得较高的成功率。Bogen等[24]报道MTA直接盖髓的成功率为97.96%。尽管有很多优点,但MTA也有些不足,如:牙变色、难处理、硬化时间长和治疗后去除难度大等。
新型生物陶瓷材料iRoot BP因具有良好的生物性能逐渐引起临床医生的关注。Liu等[25]研究发现,无论是MTA还是iRoot BP Plus都能促进人牙髓细胞增殖,且iRoot BP Plus促增殖能力更强。体内动物实验发现,牙髓暴露后使用MTA或iRoot BP Plus盖髓处理,4周后断面处可观察到完整的修复牙本质桥和极化的成牙本质样细胞。与MTA相比,因成分、颗粒大小及生物活性的差异,iRoot BP Plus具有更强的形成羟磷灰石的能力,可更早的形成修复性牙本质。故现今越来越多的临床医生认为氢氧化钙已不作为首选盖髓材料,而更加青睐于生物活性材料。
3. 活髓保存治疗临床路径
牙髓活力的保存对牙齿功能的发挥和远期的生存具有重要意义,而活髓保存治疗正是一种保存牙髓活力的治疗方法。活髓保存治疗通过覆盖盖髓材料,诱导牙髓组织中干细胞分化为成牙本质细胞,促进创面形成硬组织屏障,封闭并保护牙髓组织,抵制微生物的入侵,进而避免或延迟根管治疗,提高患牙的远期生存率[2]。为了临床上更好地开展活髓保存治疗,并获得良好的治疗效果,特制定活髓保存治疗的临床路径和操作规范,供大家参考。1)术前牙髓状态评估。根据患者的病史、临床症状、体征和影像学信息,结合LDF监测的牙髓血运状况初步评估牙髓状态。2)感染清除。局麻,橡皮障隔离,碘伏术区消毒。硬组织的清除以牙体硬组织的颜色和硬度作为标准,辅助使用光学放大设备、龋齿检测染料和激光,提高清除效果。感染的牙髓组织使用高速车针(或微创车针)在显微镜下精准微创去除,并用无菌水或生理盐水冷却。推荐使用一步法消除感染。3)术中牙髓状态评估。小棉球(或小毛刷)蘸取止血药物,推荐3%次氯酸钠或2%氯己定溶液,置于牙髓创面5 min左右,消毒压迫止血,观察。根据牙髓创面的出血情况再次评估牙髓状态。若出血止住,可继续行活髓保存治疗;若出血无法止住,则需更改活髓保存治疗方案,甚至考虑更有效的牙髓摘除术。4)覆盖盖髓材料。无菌棉球干燥,首选推荐使用具有生物活性的材料。盖髓材料要与牙髓组织直接紧密接触,不留空腔。5)冠部修复。冠部修复材料要求具有良好的封闭性,避免微生物渗漏。流体树脂垫底,复合树脂分层充填,对于有美观要求的前牙考虑使用不着色的修复材料修复。6)术后牙髓状态评估。术后随访时间为6周、12周、6月、12月、24月或更长的时间。评估治疗后的牙髓状态至少需要随访12月。随访时,除了检查患者的症状、体征和影像学信息(包括牙髓电测试、温度测试、X线片等)外,还需使用LDF长期监测牙髓的血运状况。7)活髓保存治疗成功标准。牙髓活力测试反应正常;无疼痛、软组织肿胀或窦道等症状;牙髓愈合,牙本质桥形成;年轻恒牙牙根继续发育,根尖孔闭合;影像学证据无牙根内或外吸收、根尖周透射影像和异常钙化等病理改变。
References
- 1.樊 明文, 周 学东. 牙体牙髓病学[M] 北京: 人民卫生出版社; 2000. pp. 170–174. [Google Scholar]; Fan MW, Zhou XD. Cariology and endodontics[M] Beijing: People's Medical Publishing House; 2000. pp. 170–174. [Google Scholar]
- 2.Hargreaves KM, Berman LH, Rotstein I. Cohen's pathways of the pulp[M] St Louis: Elsevier Inc; 2016. pp. 849–858. [Google Scholar]
- 3.American Association of Endodontists. Glossary of endodontic terms[Z]. 8 ed. 2012. [Google Scholar]
- 4.Aguilar P, Linsuwanont P. Vital pulp therapy in vital permanent teeth with cariously exposed pulp: a systematic review[J] J Endod. 2011;37(5):581–587. doi: 10.1016/j.joen.2010.12.004. [DOI] [PubMed] [Google Scholar]
- 5.Mohammadi Z, Dummer PM. Properties and applications of calcium hydroxide in endodontics and dental traumatology[J] Int Endod J. 2011;44(8):697–730. doi: 10.1111/j.1365-2591.2011.01886.x. [DOI] [PubMed] [Google Scholar]
- 6.Nair P, Duncan HF, Ford T, et al. Histological, ultrastructural and quantitative investigations on the response of healthy human pulps to experimental capping with mineral trioxide aggregate: a randomized controlled trial[J] Int Endod J. 2008;41(2):128–150. doi: 10.1111/j.1365-2591.2007.01329.x. [DOI] [PubMed] [Google Scholar]
- 7.Okiji T, Yoshiba K. Reparative dentinogenesis induced by mineral trioxide aggregate: a review from the biological and physicochemical points of view[J] Int J Dent. 2009;2009:464280. doi: 10.1155/2009/464280. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Torabinejad M, Higa RK, Mckendry DJ, et al. Dye leakage of four root end filling materials: effects of blood contamination[J] J Endod. 1994;20(4):159–163. doi: 10.1016/S0099-2399(06)80326-2. [DOI] [PubMed] [Google Scholar]
- 9.Jiang Y, Zheng Q, Zhou X, et al. A comparative study on root canal repair materials: a cytocompatibility assessment in L929 and MG63 cells[J] Sci World J. 2014:463826. doi: 10.1155/2014/463826. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Zhang H, Shen Y. Antibacterial activity of endodontic sealers by modified direct contact test against enterococcus faecalis[J] J Endod. 2009;35(7):1051–1055. doi: 10.1016/j.joen.2009.04.022. [DOI] [PubMed] [Google Scholar]
- 11.Zhang W, Li Z, Peng B. Effects of iRoot SP on mineralization-related genes expression in MG63 cells[J] J Endod. 2010;36(12):1978–1982. doi: 10.1016/j.joen.2010.08.038. [DOI] [PubMed] [Google Scholar]
- 12.Asgary S, Eghbal MJ. Five-year results of vital pulp therapy in permanent molars with irreversible pulpitis: a non-inferiority multicenter randomized clinical trial[J] Clin Oral Investig. 2015;19(2):335–341. doi: 10.1007/s00784-014-1244-z. [DOI] [PubMed] [Google Scholar]
- 13.Jafarzadeh H, Abbott PV. Review of pulp sensibility tests. Part Ⅰ: general information and thermal tests[J] Int Endod J. 2010;43(9):738–762. doi: 10.1111/j.1365-2591.2010.01754.x. [DOI] [PubMed] [Google Scholar]
- 14.Karayilmaz H, Kirzioglu Z. Comparison of the reliability of laser Doppler flowmetry, pulse oximetry and electric pulp tester in assessing the pulp vitality of human teeth[J] J Oral Rehabil. 2011;38(5):340–347. doi: 10.1111/j.1365-2842.2010.02160.x. [DOI] [PubMed] [Google Scholar]
- 15.Matsuo T, Nakanishi T, Shimizu H, et al. A clinical study of direct pulp cappingapplied to carious-exposed pulps[J] J Endod. 1996;22(10):551–556. doi: 10.1016/S0099-2399(96)80017-3. [DOI] [PubMed] [Google Scholar]
- 16.Witherspoon DE. Vital pulp therapy with new materials: new directions and treatment perspectives—permanent teeth[J] Pediatr Dent. 2008;30(3):220–224. [PubMed] [Google Scholar]
- 17.Bjorndal L, Reit C, Bruun G, et al. Treatment of deep caries lesions in adults: randomized clinical trials comparing stepwise vs. direct complete excavation, and direct pulp capping vs. partial pulpotomy[J] Eur J Oral Sci. 2010;118(3):290–297. doi: 10.1111/j.1600-0722.2010.00731.x. [DOI] [PubMed] [Google Scholar]
- 18.Moharnmadi Z. Sodium hypochlorite in endodontics: an update review[J] Int Dent J. 2008;58(6):329–341. doi: 10.1111/j.1875-595x.2008.tb00354.x. [DOI] [PubMed] [Google Scholar]
- 19.Iwami Y, Yamamoto H, Hayashi M, et al. Relationship between laser fluorescence and bacterial invasion in arrested dentinal carious lesions[J] Lasers Med Sci. 2011;26(4):439–444. doi: 10.1007/s10103-010-0798-5. [DOI] [PubMed] [Google Scholar]
- 20.Mccomb D. Caries-detector dyes—how accurate and useful are they[J] J Can Dent Assoc. 2000;66(4):195–198. [PubMed] [Google Scholar]
- 21.Yazdanfar I, Gutknecht N, Franzen R. Effects of diode laser on direct pulp capping treatment a pilot study[J] Lasers Med Sci. 2015;30(4):1237–1243. doi: 10.1007/s10103-014-1574-8. [DOI] [PubMed] [Google Scholar]
- 22.Maltz M, Garcia R, Jardim JJ, et al. Randomized trial of partial vs. stepwise caries removal: 3-year follow-up[J] J Dent Res. 2012;91(11):1026–1031. doi: 10.1177/0022034512460403. [DOI] [PubMed] [Google Scholar]
- 23.Dammaschke T, Leidinger J, Schaefer E. Long-term evaluation of direct pulp capping-treatment outcomes over an average period of 6.1 years[J] Clin Oral Investig. 2010;14(5):559–567. doi: 10.1007/s00784-009-0326-9. [DOI] [PubMed] [Google Scholar]
- 24.Bogen G, Kim JS, Bakland LK. Direct pulp capping with mineral trioxide aggregate: an observational study[J] J Am Dent Assoc. 2008;139(3):305–315. doi: 10.14219/jada.archive.2008.0160. [DOI] [PubMed] [Google Scholar]
- 25.Liu SY, Wang SN, Dong YM. Evaluation of a bioceramic as a pulp capping agent in vitro and in vivo[J] J Endod. 2015;41(5):652–657. doi: 10.1016/j.joen.2014.12.009. [DOI] [PubMed] [Google Scholar]