Abstract
目的
研究柚皮苷(NAR)联合骨形态发生蛋白(BMP)-2对体外培养的成骨前体细胞MC3T3-E1增殖、碱性磷酸酶(ALP)活性及成骨相关基因ALP、骨钙素(OCN)、成骨特异性转录因子(Runx2)、Ⅰ型胶原(ColⅠ)表达的影响。
方法
以成骨细胞株MC3T3-E1为体外药效的试验模型,通过Alamar blue法检测第1、4和7天3种不同浓度NAR(10、100和1 000 µmol·L−1)单独作用以及分别与50 ng·mL−1 BMP-2联合诱导对MC3T3-E1细胞增殖能力的影响。同时在第4天和7天测定成骨细胞内ALP活性,采用实时定量聚合酶链反应(qRT-PCR)检测成骨相关基因ALP、OCN、Runx2、ColⅠ的表达。
结果
单纯NAR刺激及联合BMP-2刺激能够促进细胞增殖,在NAR浓度为100 µmol·L−1时达到高峰(P<0.05),且该浓度NAR与BMP-2联合作用时增殖效果大于两者单独作用(P<0.05)。单纯NAR刺激及联合BMP-2刺激4 d和7 d时均能促进细胞ALP活性,100 µmol·L−1 NAR与BMP-2联合作用时ALP活性最强(P<0.05)。100~1 000 µmol·L−1的NAR单独及联合作用在不同程度上能促进ALP、OCN、Runx2、ColⅠ成骨相关基因表达。
结论
NAR能有效促进成骨细胞株MC3T3-E1增殖、分化,且适宜浓度的NAR和BMP-2有协同和促进作用。
Keywords: 成骨细胞, 柚皮苷, 骨形态发生蛋白-2, 增殖, 分化
Abstract
Objective
This study evaluates the biological effects of naringin (NAR) joint bone morphogenetic protein (BMP)-2 on the proliferation, alkaline phosphatase (ALP) activity, and expression of osteoblastogenic genes, such as Runt-related transcription factor 2 (Runx2), collagen Ⅰ (ColⅠ), ALP, and osteocalcin (OCN) of pre-osteoblasts.
Methods
Three different NAR concentrations (10, 100, and 1 000 µmol·L−1) were applied, alone or combined with BMP-2(50 ng·mL−1), to restore the osteoblastogenesis of pre-osteoblasts (MC3T3-E1 cell line). Cell numbers (proliferation) were evaluated at first, fourth, and seventh days by Alamar blue assay. ALP activity and the expression of osteoblastogenic genes, such as Runx2, ColⅠ, ALP, and OCN were analyzed by quantitative real-time polymerase chain reaction (qRT-PCR) at fourth and seventh day.
Results
Stimulation by NAR alone and in combination with BMP-2 for 1 day and 4 days could promote cell proliferation, which peaked at a concentration of 100 µmol·L−1 NAR combined with BMP-2 could promote cell proliferation significantly (P<0.05). Stimulation by NAR alone and in combination with BMP-2 for 4 and 7 days could promote ALP activity and bone-related gene(ALP, OCN, Runx2, ColⅠ) expression. ALP expression was significantly promoted after stimulation of 100 µmol·L−1 NAR and BMP-2 (P<0.05).
Conclusion
NAR exhibits promising potential for improving MC3T3-E1 proliferation and differentiation, and appropriate concentrations of NAR and BMP-2 show synergistic effect.
Keywords: osteoblast, naringin, bone morphogenetic protein-2, proliferation, differentiation
足量骨组织是获得颌面部美学和肌肉骨骼功能的前提条件,腭裂及牙槽嵴裂等是口腔颌面高发疾病,现今临床上的修复方式主要是自体骨移植,但其有一定的局限性,往往会引起植骨供区并发症[1]。修复骨缺损在口腔种植、颌面外科等领域仍然是个巨大的挑战,且随着口腔种植学的快速发展,牙槽骨再生和改建已成为国内外研究的热点。生长因子是促进组织再生的条件之一,骨形态发生蛋白(bone morphogenetic protein,BMP)是一种多功能生长因子,BMP-2是诱导成骨细胞成骨最重要的细胞外信号分子之一[2],参与骨形成和重建[3],主要通过调控成骨特异性转录因子(Runt-related transcription factor 2,Runx2)、骨钙素(osteocalin,OCN)、碱性磷酸酶(alkaline phosphatase,ALP)、Ⅰ型胶原酶(collagen Ⅰ,ColⅠ)等成骨相关基因的表达,参与成骨细胞分化,促进骨形成和抑制骨吸收[4]–[6]。且大量研究[7]表明,用重组人骨形态发生蛋白(recombinant human bone morphogenetic protein,rhBMP)-2进行骨缺损移植与自体骨无明显差异。然而BMP-2的临床有效使用剂量非常高[8]–[9],这不仅加大了患者的治疗成本,同时也带来高剂量副作用的可能性,因此其临床应用也较为局限。中药是我国传统医学的精髓,且在治疗骨缺损方面具有悠久的历史考证。柚皮苷(naringin,NAR)是骨碎补中含量最为丰富的黄酮类物质,具有补肾强骨、治疗骨质疏松、促进骨折愈合等功效[10]。目前研究显示NAR对成骨细胞的增殖有一定的促进作用[11],也可通过磷脂酰肌醇3-激酶(phosphoinositide-3 kinase,PI3K)、苏氨酸激酶(threonine kinases,Akt)、c-Fos/c-Jun和激活蛋白-1(activator protein-1,AP-1)旁路诱导BMP-2的表达,促进成骨细胞的增殖、分化和成熟[12]。且其来源广泛,药效作用和化学结构基本明确,符合现代中药的发展趋势,有较好的临床运用前景。
本实验采用成骨前体细胞MC3T3-E1进行培养,观察不同浓度NAR及与BMP-2联合作用时对成骨细胞增殖、ALP活性以及成骨相关基因ALP、OCN、Runx2、ColⅠ表达的影响,为NAR和BMP-2在临床牙槽骨缺损的应用提供实验依据。
1. 材料和方法
1.1. 试剂和仪器
成骨前体细胞系MC3T3-E1(上海中科院细胞库);中药NAR单体(南京泽朗医药科技有限公司);细胞培养基α-MEM和胎牛血清(Gibco™ Invitrogen公司,美国);rhBMPs(R&D Systems Inc,美国);细胞裂解液(Sigma-Aldrich公司,美国);ALP检测试剂盒(Wako Pure Chemicals公司,日本);BCA蛋白检测试剂盒(上海碧云天生物技术公司);总RNA抽提试剂盒(Giagen GmbH公司,德国);逆转录反应和实时定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)试剂盒(TaKaRa公司,日本)。
1.2. 方法
1.2.1. 实验设计分组
实验共分8组:1)对照组(A组);2)50 ng·mL−1 BMP-2(B组);3)10 µmol·L−1 NAR(C组);4)10 µmol·L−1 NAR+50 ng·mL−1 BMP-2(D组);5)100 µmol·L−1 NAR(E组);6)100 µmol·L−1 NAR+50 ng·mL−1 BMP-2(F组);7)1 000 µmol·L−1 NAR(G组);8)1 000 µmol·L−1 NAR+50 ng·mL−1 BMP-2(H组),每组均设6个复孔。
1.2.2. 细胞培养
成骨前体细胞MC3T3-E1培养于含有10%胎牛血清(fetal bovine serum,FBS)的α-MEM培养基中,每3 d更换培养基。处于指数生长期的细胞接种24 h后予以1%FBS-α-MEM饥饿培养24 h,使细胞状态基本一致,然后分别在各培养孔中加入不同浓度的NAR单体和rhBMPs进行诱导刺激,每3 d更新培养基以及细胞因子,用于细胞增殖、ALP活性及成骨相关基因检测。
1.2.3. 细胞增殖检测
采用Alamar blue方法检测不同浓度NAR单体和rhBMP-2对MC3T3-E1细胞增殖的影响,细胞以每孔1×104个接种于24孔板,收取各组经刺激培养1、4和7 d后的细胞裂解液,根据Quant-iT™ PicoGreen dsDNA Reagent and kits试剂盒使用说明配制反应体系,Ex480 nm/Em520 nm读取荧光密度,测得各组细胞DNA含量,用来反映细胞增殖数量。
1.2.4. ALP活性检测
细胞以每孔2×105个接种于6孔板,收取各组经刺激培养4 d和7 d后的细胞裂解液,采用LabAssay™ ALP检测试剂盒检测细胞裂解液中的ALP活性,用BCA蛋白浓度测定试剂盒检测细胞总蛋白浓度。各组细胞裂解液的ALP活性值均用相应的细胞总蛋白浓度予以校准,求得各组相对ALP活性值。
1.2.5. qRT-PCR检测成骨相关基因的表达
细胞以每孔2×105个接种于6孔板,各组经刺激培养4 d和7 d后弃去培养基,PBS清洗3遍,采用RNeasy Mini Kit和RNase-Free DNase Set试剂盒抽提细胞总RNA,检测基因浓度及完整性,经逆转录反应合成相应cDNA,以β-actin为管家基因。配制real-time PCR 20 µL反应体系,进行qRT-PCR检测(反应参数均根据试剂盒使用说明),反应完成后进行扩增曲线和熔解曲线分析。基因表达量以检测基因的初始模板量表示(2-ΔΔCt)。全部引物序列由上海皓嘉科技发展有限公司合成,引物序列见表1。
表 1. 引物序列.
Tab 1 Primer sequences
| 基因 | 编号 | 引物序列 |
| ALP | NM_007431 | F:5′-tgcctacttgtgtggcgtgaa-3′ |
| R:5′-tcacccgagtggtagtcacaatg-3′ | ||
| OCN | NM_007541 | F:5′-agcagcttggcccagaccta-3′ |
| R:5′-tagcgccggagtctgttcactac-3′ | ||
| ColⅠ | NM_007742 | F:5′-atgccgcgacctcaagatg-3′ |
| R:5′-tgaggcacagacggctgagta-3′ | ||
| Runx2 | NM_009820 | F:5′-cactggcggtgcaacaaga-3′ |
| R:5′-tttcataacagcggaggcatttc-3′ | ||
| β-actin | NM_007393 | F:5′-aggagcaatgatcttgatctt-3′ |
| R:5′-tgccaacacagtgctgtct-3′ |
1.3. 统计学分析
采用SPSS 16.0软件进行分析,行单因素方差分析,以LSD法进行两两比较,以P<0.05为差异具有统计学意义。
2. 结果
2.1. 细胞增殖效应
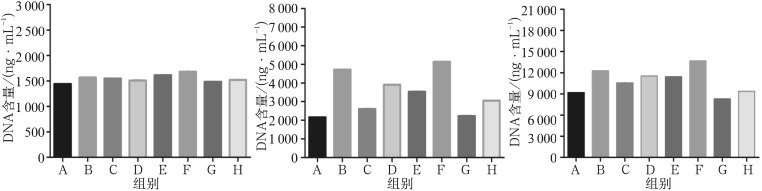
Alamar blue法结果表明:单纯NAR刺激1 d和4 d时均能促进细胞增殖(P<0.05),表现为先上升后下降的趋势,NAR浓度为100 µmol·L−1时达到高峰。然而在培养7 d后,10~100 µmol·L−1的NAR均能够促进细胞增殖(P<0.05),而1 000 µmol·L−1的NAR对细胞增殖有抑制作用,且有统计学意义(P<0.05)。不同浓度NAR与BMP-2联合作用时较NAR单独作用更能促进细胞增殖,100 µmol·L−1的NAR与BMP-2联合作用时增殖效果最明显(P<0.05)(图1)。
图 1. NAR单独及联合BMP-2刺激成骨前体细胞MC3T3-E1后细胞DNA含量.
Fig 1 DNA content of pre-osteoblasts (MC3T3-E1 cells) after NAR alone and combined with BMP-2 stimulation
左:1 d;中:4 d;右:7 d。
2.2. 细胞ALP活性检测结果
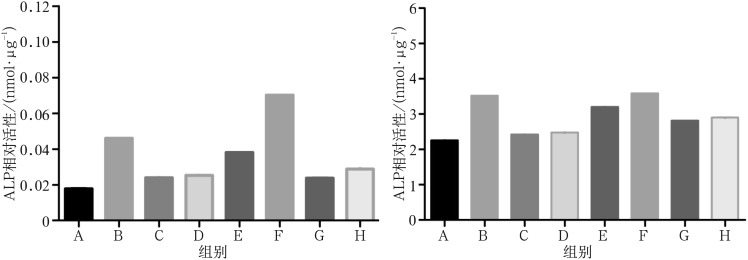
ALP活性是评价细胞成骨分化的早期指标。ALP活性检测中,NAR单独及联合BMP-2作用时,ALP活性的表达随着NAR浓度呈先上升后下降趋势,在NAR浓度为100 µmol·L−1时达到了峰值(P<0.05)。100 µmol·L−1的NAR与BMP-2联合作用时ALP活性上调最明显,显著高于其他组(图2)。
图 2. NAR单独及联合BMP-2刺激成骨前体细胞MC3T3-E1后细胞ALP活性情况.
Fig 2 The ALP activity of pre-osteoblasts (MC3T3-E1 cells) after NAR alone and combined with BMP-2 stimulation
左:4 d;右:7 d。
2.3. 成骨相关基因的表达结果
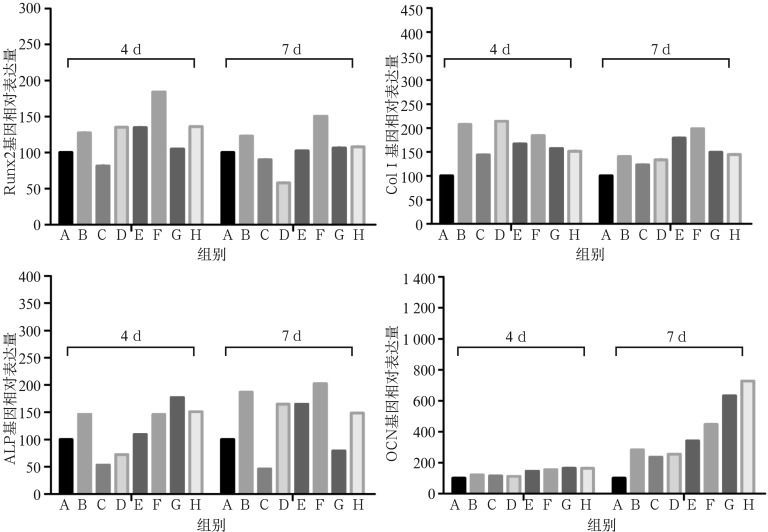
根据上述ALP活性检测结果,NAR单体在一定浓度范围内呈浓度依赖效应曲线,故后期用于基因表达水平比较研究的NAR浓度范围为10~1 000 µmol·L−1。从荧光定量PCR显示的结果可见:NAR在100~1 000 µmol·L−1时能促进Runx2表达,100 µmol·L−1浓度的NAR与BMP-2有协同促进作用,尤其是4 d时联合使用的效果远大于两者单独使用(P<0.05)。在10~1 000 µmol·L−1的浓度范围内,NAR上调细胞ALP基因表达的浓度效应关系呈现直线型,4 d时1 000 µmol·L−1对ALP基因的表达效果最明显(P<0.05)。单纯NAR刺激及NAR联合BMP-2刺激4 d和7 d时均能促进细胞ColⅠ mRNA的表达。4 d时10 µmol·L−1的NAR联合BMP-2能明显促进ColⅠ mRNA的表达(P<0.05),7 d时100 µmol·L−1的NAR单独使用及与BMP-2联合均有显著促进作用(P<0.05)。单纯NAR刺激及NAR联合BMP-2刺激4 d和7 d均能够明显促进细胞OCN mRNA的表达,呈浓度依赖型。随着浓度的增大,优势更明显,尤其在第7天时,100~1 000 µmol·L−1的NAR单独刺激与联合BMP-2均有显著作用(P<0.05)(图3)。
图 3. NAR单独及联合BMP-2刺激成骨前体细胞MC3T3-E1后成骨相关基因表达情况.
Fig 3 The relative expression of osteogenic genes after NAR alone and combined with BMP-2 stimulation
第一行:左:Runx2;右:Col Ⅰ。第二行:左:ALP;右:OCN。
3. 讨论
随着口腔种植修复技术的快速发展,种植也成为了更多临床医生及患者修复牙列缺损及缺失的选择,然而骨缺损、骨质疏松等严重影响种植体的骨结合及初期稳定性,甚至导致修复失败。临床上采用了不同的骨增量方法和植骨材料,促进种植体周围缺损区的骨形成。骨碎补是治疗骨相关性疾病常用的中药,NAR是其主要活性成分,普遍存在于柑橘类水果和许多中药中。Wong等[13]通过向兔颅骨缺损区域移植不同材料,发现NAR联合胶原基质能有效地促进新骨组织生成,且成骨作用优于自体骨移植,从而说明NAR可被作为骨移植材料使用。NAR可以明显地提高骨钙素、骨桥蛋白和BMP-2的分泌量,促进与成骨相关因子:碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF)、胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1)、Runx2、成骨细胞特异基因(Osterix)和雌激素受体(estrogen receptor,ER)α及ERβ mRNA的表达,同时也可以增强ERα、ERβ和ColⅠ的分泌,通过雌激素信号通路来发挥其成骨作用[14]。另一方面NAR可以通过抑制核因子κB受体活化因子配体(receptor activator for nuclear factor-κ B ligand,RANKL)诱导的核转录因子(nuclear factor-kappa B,NF-κB)和细胞外信号调节激酶(extracellular signal-regulated kinas,ERK)的活性来阻止破骨细胞的形成以减少骨吸收的发生[15]。NAR可以通过调节成骨细胞及破骨细胞之间的平衡来调节骨代谢,促进骨形成,从而修复骨缺损。
BMP-2通路是最主要的成骨信号通路之一,可通过上调Msx2基因刺激Wnt信号通路促进骨祖细胞成骨性分化,还可激活诱导信号转导蛋白Smads调控基因和Osterix基因,并调节ALP、ColⅠ、OCN、骨桥蛋白(osteoprontin,OPN)等多种细胞因子的表达促进成骨[16]。然而BMP-2的临床有效使用剂量非常高,达到毫克级别[8],这对患者来说是个巨大的经济负担,且大剂量使用BMP会有一定的不良反应,如刺激破骨细胞活性、异位骨生成。因此其临床应用较为局限。
MC3T3-E1细胞株具有体外培养成骨细胞的各种生物学特性,是良好的体外培养成骨细胞株,已经成为了研究药物对成骨细胞影响的有价值的体外细胞模型[17]。本研究结果发现在第1天和第4天时,10~1 000 µmol·L−1浓度范围内,NAR单独作用和NAR与BMP-2联合作用均能够显著地促进成骨细胞增殖,且在100 µmol·L−1时达到峰值,可见NAR对细胞增殖的促进作用有一定的浓度依赖性。然而在第7天时,1 000 µmol·L−1的NAR对细胞的增殖有抑制作用,可能提示在第7天时高浓度的NAR以促进细胞分化为主。
ALP的活性是衡量成骨细胞早期分化的指标,本实验中在第4、7天中随着时间的延长ALP活性增强,表现出时间依赖性。ALP、OCN、Runx2、COlⅠ均是成骨细胞分化的指标。Runx2是骨形成最早的标志基因,是成骨细胞开始分化的标志,能够激活骨钙蛋白、骨桥素、骨涎蛋白(bone sialoprotein,BSP)和COlⅠ基因的转录和表达[18]。ColⅠ则由成熟成骨细胞分泌[19]。实验中Runx2与COlⅠ表现出相同的趋势提示Runx2与COlⅠ为2个相关联指标,存在级联反应,这也跟文献研究[20]一致。ALP是成骨细胞早期分化标志。OCN是由分化期成骨细胞分泌的蛋白,可反映成骨细胞的活跃程度[21],是成骨细胞成熟的标志[22]。实验中发现总体上而言随着药物浓度升高,刺激细胞分化的能力也相应增加。然而NAR和BMP-2在促进ALP、Runx2、ColⅠ、OCN均表现出不同作用,提示适宜浓度的NAR单独及联合BMP-2能够从早期到晚期提高MC3T3-E1细胞分化。并且在实验中,100 µmol·L−1的NAR联合BMP-2联合刺激成骨细胞,增殖活性,ALP活性以及分化能力明显高于单纯100 µmol·L−1的NAR刺激和单纯的BMP-2刺激,提示该浓度的NAR与BMP-2对成骨细胞具有协同作用,可能两者共同促进激活某一信号通路有关,其具体机制有待进一步研究。
本实验初步研究了NAR与BMP-2的联合诱导作用,发现适宜浓度的NAR与BMP-2具有协同作用,可促进成骨细胞的增殖、分化和成熟。中药NAR来源广泛,不良反应小,而BMP-2被认为是活性最强的诱导成骨因子之一。两者的联合诱导作用,不但能有效促进骨形成,而且也大大降低了临床治疗骨缺损的成本,缩短了治疗的时间,扩大治疗骨缺损的适应证,为临床治疗骨缺损提供新的思路和研究方向。
Funding Statement
[基金项目] 浙江省中医药科技计划项目(2014ZB028)
Supported by: Zhejiang Medical Science and Technology Plan Project (2014ZB028).
References
- 1.Rawashdeh MA, Telfah H. Secondary alveolar bone grafting: the dilemma of donor site selection and morbidity[J] Br J Oral Maxillofac Surg. 2008;46(8):665–670. doi: 10.1016/j.bjoms.2008.07.184. [DOI] [PubMed] [Google Scholar]
- 2.Liu Y, Wu G, de Groot K. Biomimetic coatings for bone tissue engineering of critical-sized defects[J] J R Soc Interface. 2010;7(Suppl 5):S631–S647. doi: 10.1098/rsif.2010.0115.focus. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Park KH, Kang JW, Lee EM, et al. Melatonin promotes osteoblastic differentiation through the BMP/ERK/Wnt signaling pathways[J] J Pineal Res. 2011;51(2):187–194. doi: 10.1111/j.1600-079X.2011.00875.x. [DOI] [PubMed] [Google Scholar]
- 4.Phimphilai M, Zhao Z, Boules H, et al. BMP signaling is required for RUNX2-dependent induction of the osteoblast phenotype[J] J Bone Miner Res. 2006;21(4):637–646. doi: 10.1359/JBMR.060109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Yoon HJ, Seo CR, Kim M, et al. Dichloromethane extracts of Sophora japonica L. stimulate osteoblast differentiation in mesenchymal stem cells[J] Nutr Res. 2013;33(12):1053–1062. doi: 10.1016/j.nutres.2013.08.004. [DOI] [PubMed] [Google Scholar]
- 6.Zhang R, Oyajobi BO, Harris SE, et al. Wnt/β-catenin signaling activates bone morphogenetic protein 2 expression in osteoblasts[J] Bone. 2013;52(1):145–156. doi: 10.1016/j.bone.2012.09.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Fiorellini JP, Howell TH, Cochran D, et al. Randomized study evaluating recombinant human bone morphogenetic protein-2 for extraction socket augmentation[J] J Periodontol. 2005;76(4):605–613. doi: 10.1902/jop.2005.76.4.605. [DOI] [PubMed] [Google Scholar]
- 8.McKay WF, Peckham SM, Badura JM. A comprehensive clinical review of recombinant human bone morphogenetic protein-2 (INFUSE® Bone Graft)[J] Int Orthop. 2007;31(6):729–734. doi: 10.1007/s00264-007-0418-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Groeneveld EH, Burger EH. Bone morphogenetic proteins in human bone regeneration[J] Eur J Endocrinol. 2000;142(1):9–21. doi: 10.1530/eje.0.1420009. [DOI] [PubMed] [Google Scholar]
- 10.Pang WY, Wang XL, Mok SK, et al. Naringin improves bone properties in ovariectomized mice and exerts oestrogen-like activities in rat osteoblast-like (UMR-106) cells[J] Br J Pharmacol. 2010;159(8):1693–1703. doi: 10.1111/j.1476-5381.2010.00664.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Xu Z, Li N, Wooley PH, et al. Naringin promotes osteoblast differentiation and effectively reverses ovariectomy-associated osteoporosis[J] J Orthop Sci. 2013;18(3):478–485. doi: 10.1007/s00776-013-0362-9. [DOI] [PubMed] [Google Scholar]
- 12.Zhou X, Zhang P, Zhang C, et al. Promotion of bone formation by naringin in a titanium particle-induced diabetic murine calvarial osteolysis model[J] J Orthop Res. 2010;28(4):451–456. doi: 10.1002/jor.21002. [DOI] [PubMed] [Google Scholar]
- 13.Wong RW, Rabie AB. Effect of naringin collagen graft on bone formation[J] Biomaterials. 2006;27(9):1824–1831. doi: 10.1016/j.biomaterials.2005.11.009. [DOI] [PubMed] [Google Scholar]
- 14.翟 远坤, 牛 银波, 潘 亚磊, et al. 柚皮苷对体外培养乳鼠颅骨成骨细胞增殖和分化成熟的影响[J] 中国中药杂志. 2013;38(1):105–111. [Google Scholar]; Zhai YK, Niu YB, Pan YL, et al. Effects of naringin on proliferation, differentiation and maturation of rat calvarial osteoblasts in vitro[J] China J Chin Materia Medica. 2013;38(1):105–111. [PubMed] [Google Scholar]
- 15.Ang ES, Yang X, Chen H, et al. Naringin abrogates osteoclastogenesis and bone resorption via the inhibition of RANKL-induced NF-κB and ERK activation[J] FEBS Lett. 2011;585(17):2755–2762. doi: 10.1016/j.febslet.2011.07.046. [DOI] [PubMed] [Google Scholar]
- 16.Sun P, Wang J, Zheng Y, et al. BMP2/7 heterodimer is a stronger inducer of bone regeneration in peri-implant bone defects model than BMP2 or BMP7 homodimer[J] Dent Mater J. 2012;31(2):239–248. doi: 10.4012/dmj.2011-191. [DOI] [PubMed] [Google Scholar]
- 17.Owen TA, Aronow M, Shalhoub V, et al. Progressive development of the rat osteoblast phenotype in vitro: reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix[J] J Cell Physiol. 1990;143(3):420–430. doi: 10.1002/jcp.1041430304. [DOI] [PubMed] [Google Scholar]
- 18.Pan K, Yan S, Ge S, et al. Effects of core binding factor alpha1 or bone morphogenic protein-2 overexpression on osteoblast/cementoblast-related gene expressions in NIH3T3 mouse cells and dental follicle cells[J] Cell Prolif. 2009;42(3):364–372. doi: 10.1111/j.1365-2184.2009.00599.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Hosoi T. Bone and bone related biochemical examinations. Bone and collagen related metabolites. Structure and metabolisms of collagen[J] Clin Calcium. 2006;16(6):971–976. [PubMed] [Google Scholar]
- 20.Zhang X, Aubin JE, Inman RD. Molecular and cellular biology of new bone formation: insights into the ankylosis of ankylosing spondylitis[J] Curr Opin Rheumatol. 2003;15(4):387–393. doi: 10.1097/00002281-200307000-00004. [DOI] [PubMed] [Google Scholar]
- 21.Lin L, Chen L, Wang H, et al. Adenovirus-mediated transfer of siRNA against Runx2/Cbfa1 inhibits the formation of heterotopic ossification in animal model[J] Biochem Biophys Res Commun. 2006;349(2):564–572. doi: 10.1016/j.bbrc.2006.08.089. [DOI] [PubMed] [Google Scholar]
- 22.Ducy P, Desbois C, Boyce B, et al. Increased bone formation in osteocalcin-deficient mice[J] Nature. 1996;382(6590):448–452. doi: 10.1038/382448a0. [DOI] [PubMed] [Google Scholar]