Abstract
目的
研究Zeste基因增强子人类同源物2(EZH2)抑制剂GSK343调节巨噬细胞亚群的分化,探讨EZH2在牙周炎中潜在的治疗作用。
方法
将巨噬细胞RAW264.7分为4组:空白组(A组)、对照组(B组)、内毒素(LPS)刺激组(C组)、LPS+GSK343组(D组)。细胞经培养及相应处理后,利用免疫印迹和酶联免疫吸附试验检测其表型生物学标志变化,包括肿瘤坏死因子-α(TNF-α)、诱导型一氧化氮合酶(iNOS)、白细胞介素-10(IL-10)和精氨酸酶-1(Arg-1)。利用大肠杆菌吞噬试验检测巨噬细胞RAW264.7在不同条件下对大肠杆菌的吞噬作用。
结果
LPS可以诱导RAW264.7产生M1表型生物标志(TNF-α和iNOS表达增加),在加入EZH2抑制GSK343后,IL-10和Arg-1表达升高,提示EZH2抑制剂GSK343可以诱导RAW264.7细胞由M1型向M2型转化;RAW264.7细胞具有吞噬大肠杆菌的作用,加入LPS的条件下吞噬大肠杆菌作用加强,而EZH2抑制剂GSK343可以调节RAW264.7细胞对大肠杆菌的吞噬作用。
结论
EZH2抑制剂GSK343可以调节巨噬细胞的分化,在牙周炎的治疗中可能具有潜在作用。
Keywords: 巨噬细胞, 牙周炎, 表观遗传学, 微环境
Abstract
Objective
To explore the therapeutic effect of enhancer of Zeste homolog 2 (EZH2) inhibitor GSK343 on periodontitis by regulating microphage differentiation.
Methods
Macrophage RAW264.7 cells were divided into the blank (A group), control (B group), lipopolysaccharide (LPS) stimulation (C group), and LPS+GSK343 (D group) groups. Phenotype transformations was determined through Western blot analysis and enzyme-linked immunosorbent assay by detecting the differentiation of phenotypic biological markers, including tumor necrosis factor-α (TNF-α), inducible nitric oxide synthase (iNOS), interleukin-10 (IL-10), and Arginase-1 (Arg-1). Metergasis was identified by performing a phagocytosis test on Escherichia coli (E. coli).
Results
Macrophage RAW264.7 cells produced classical phenotypic biomarkers (M1) TNF-α and iNOS under LPS stimulation. The expression levels of IL-10 and Arg-1 increased after adding GSK343 into the culture medium. GSK343 also induced the conversion of M1 macrophages into M2 macrophages. Macrophage RAW264.7 cells exerted a phagocytic effect on E. coli, and this effect was enhanced after adding LPS into the culture medium. GSK343 regulated the macrophage RAW264.7 phagocytosis of E. coli.
Conclusion
GSK343 possibly participates in the regulation of macrophage differentiation and, consequently, in the latent treatment of periodontitis.
Keywords: macrophage, periodontitis, epigenetic, microenvironment
巨噬细胞是免疫系统的重要成分之一,在机体的先天性免疫反应和获得性免疫反应中起着关键作用,对机体内稳态环境平衡具有重要意义。它能够侦测入侵病原体和异质性抗原,启动先天性免疫反应,且其抗原加工递呈作用对获得性免疫反应的启动也十分重要,在维持促炎和抗炎的免疫平衡中可能起到控制开关的作用[1]–[2]。在炎症状态下,单核细胞到达病灶,并进一步分化为M1和/或M2型巨噬细胞,不同分化状态下其细胞表面的主要生物学标志物不同,其中M1型为经典活化型,其表面主要生物学标志物为肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)等,主要功能是促炎和介导吞噬等;M2型为选择性活化型,其表面主要生物学标志物为白细胞介素-10(interleukin-10,IL-10)和精氨酸酶-1(Arginase-1,Arg-1),其主要功能是调节免疫反应和促进组织修复。牙周炎是一个复杂的慢性感染性疾病,其特征为产生炎症及造成牙齿支持组织的破坏。巨噬细胞参与的免疫反应在牙周炎的发生发展过程中起着非常重要的作用,是防止细菌侵入牙周组织的防线,与此同时,过度的免疫反应也可能会破坏牙周组织,最终导致附着丧失和牙槽骨的吸收[3]。因此,在牙周炎的治疗中,如果巨噬细胞能转化为M2型,那么既能发挥抗炎及免疫调节的作用,又可以防止对牙周组织的破坏,达到最佳的治疗效果。Zeste基因增强子人类同源物2(enhancer of Zeste homolog 2,EZH2)属于多梳基因家族,是一种重要的组蛋白,具有甲基转移酶作用,能够抑制其下游靶基因的转录,调节干细胞的自我更新。本文通过研究EZH2抑制剂GSK343诱导巨噬细胞亚群分化的作用,探讨其在牙周炎中潜在的治疗作用。
1. 材料和方法
1.1. 主要试剂
大肠杆菌内毒素(lipopolysaccharide,LPS)及胎牛血清(Sigma公司,美国),TNF-α及IL-10酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(BioLegend公司,美国),β-actin、Arg-1和iNOS免疫印迹抗体(Cell Signaling Technology公司,美国)。
1.2. 细胞培养[4]
RAW264.7小鼠巨噬细胞购于西南医科大学基础医学院。培养于含10%胎牛血清的DMEM培养基中,提前12 h以密度为每孔1×106个细胞接种于六孔板中。
1.3. 细菌培养[5]
大肠杆菌(0111:B4)由西南医科大学微生物实验室提供,培养于pH=7的LB(Luria-Bertani)培养基中。取400 mL液体培养基,加琼脂粉6 g,溶解,灭菌,灭菌温度121 °C,时间20 min。将菌落接种到装有5 mL种子培养基的具塞试管中,在37 °C、200 r·min−1的摇床上培养。
1.4. 实验方法
实验分4组:A组,空白组,仅为大肠杆菌,不添加巨噬细胞;B组,对照组,大肠杆菌和巨噬细胞共培养;C组,LPS刺激组,大肠杆菌和巨噬细胞共培养基础上加入100 ng·L−1 LPS刺激细胞;D组,LPS+GSK343组,在C组基础上添加3 µg·L−1 EZH2抑制剂GSK343共培养。利用免疫印迹和ELISA检测细胞表型生物学标志变化,包括TNF-α、iNOS、IL-10和Arg-1;利用大肠杆菌吞噬试验检测细胞在不同条件下对大肠杆菌的吞噬作用。
1.4.1. ELISA法检测TNF-α和IL-10的表达
分别收集LPS刺激24 h的RAW264.7细胞培养上清,检测巨噬细胞TNF-α和IL-10的表达情况。按照TNF-α及IL-10 ELISA试剂盒说明操作,以1︰250稀释包被抗体200 µL,4 °C包被过夜,洗板3次,加入培养上清100 µL,室温孵育1 h后洗板3次,加入以1︰250稀释的生物素标记检测抗体100 µL,室温孵育1 h后洗板3次,加入以1︰300稀释的亲和素标记辣根过氧化物酶100 µL,室温孵育30 min后洗板7次,加入底物液100 µL,室温避光孵育15 min后加入2 mol·L−1的H2SO4终止反应,450 nm波长检测光密度(optical density,OD)值。
1.4.2. 免疫印迹法测定iNOS和Arg-1活性
1)iNOS活性测定。LPS刺激RAW264.7细胞24 h后收集培养液上清,按检测试剂盒的操作程序,取200 µL培养液上清,加入100 µL Griess Reagent R1,再加入等体积Griess Reagent R2,混匀,室温静置10 min,于540 nm处检测各样品OD值,以β-actin为基准。2)Arg-1活性测定。参照Lumeng等[6]的方法,加入100 µL 0.1%Triton X-100裂解液,LPS刺激细胞48 h后,加入150 mmol·L−1 Tris-HCl和10 mmol·L−1 MnCl2共100 µL,56 °C温育10 min,加入100 µL 0.5 mol·L−1 Arg-1,37 °C温育30 min,加入800 µL H2SO4/H3PO4混合液终止反应。随后加50 µL 9% α-异亚硝基苯丙酮,95 °C温育30 min,于540 nm处检测各样品OD值,以β-actin为基准。
1.4.3. 荧光标记大肠杆菌吞噬试验[7]
加入大肠杆菌前,RAW264.7细胞饥饿2 h,以100 ng·L−1 LPS和3 µg·L−1 GSK343刺激24 h。刺激完成后,使用100 µL PBS重悬大肠杆菌至终质量浓度20 g·L−1,低速超声混匀20 s,共3次,然后加入100 µL IgG,37 °C下涡旋振荡孵育1 h,以4 °C PBS清洗20 min,洗3次,移出上清液,同2 mL PBS及2 mg处理完成的大肠杆菌加入玻璃试管中,超声振荡5 min,加入到刺激完毕的细胞中,每孔100 µL,作用1~2 h,PBS洗3 min,共3次,再加入100 µL PBS读数,照相,在吞噬荧光标记大肠杆菌后测量OD值进行荧光定量分析。
1.5. 统计学分析
采用SPSS 10.0统计学软件处理数据,统计方法采用单因素方差分析,多重比较采用LSD检验,检验水准为双侧α=0.05。
2. 结果
2.1. LPS可以诱导RAW264.7产生M1型生物标志
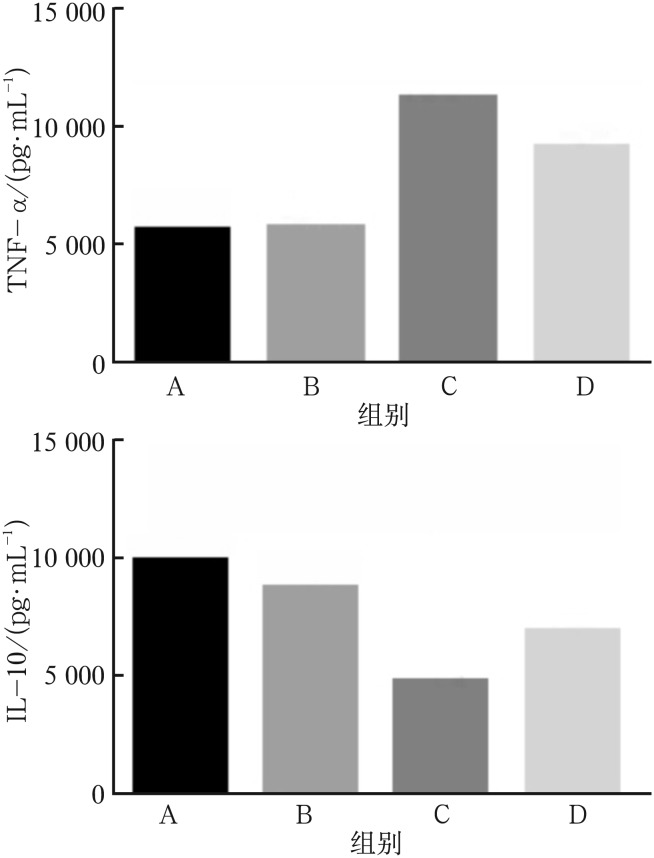
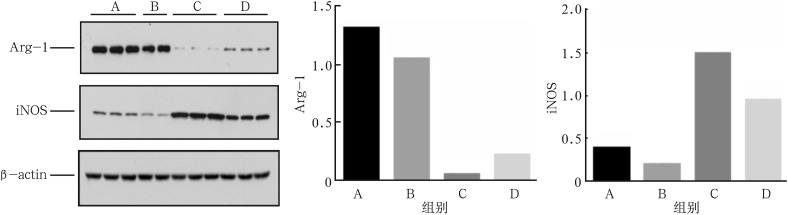
如图1所示,在LPS刺激下(C组),巨噬细胞产生的TNF-α较对照组和空白组升高,IL-10较对照组和空白组降低(P<0.05);图2显示,在LPS刺激下(C组),巨噬细胞iNOS的表达水平较对照组和空白组升高,Arg-1的表达水平较对照组和空白组降低,以上差异均有统计学意义(P<0.05)。该结果提示,在LPS刺激下,巨噬细胞具有异质性,在局部炎症反应特异性微环境中可以活化成M1型巨噬细胞,具有促炎功能,引起组织破坏。
图 1. ELISA检测TNF-α及IL-10的结果.
Fig 1 The results of ELISA on TNF-α and IL-10
上:TNF-α;下:IL-10。
图 2. 免疫印迹测定法结果.
Fig 2 The results of the Western blotting
左:电泳图;中:Arg-1相对表达量;右:iNOS相对表达量。
2.2. GSK343抑制LPS诱导的M1型标志物并使RAW264.7产生M2型生物标志物
如图1所示,在LPS刺激后,加入EZH2抑制剂GSK343(D组),巨噬细胞产生的TNF-α较对照组和空白组明显升高,较LPS刺激组明显降低,IL-10较对照组和空白组明显降低,较LPS刺激组明显升高;图2显示,在LPS+GSK343刺激下,巨噬细胞iNOS表达水平较对照组和空白组明显升高,较LPS刺激组明显降低,Arg-1的表达水平较对照组和空白组明显降低,较LPS刺激组明显升高(P<0.05),以上差异均有统计学意义(P<0.05)。由此可以推测,EZH2抑制剂GSK343可以介导巨噬细胞由M1型向M2型转化,从而发挥抗炎和组织修复的作用。
2.3. GSK343同时介导LPS导致的巨噬细胞RAW264.7吞噬功能的改变
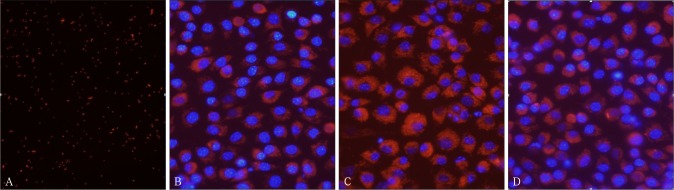
在LPS刺激下,巨噬细胞活化成M1型,而GSK343可以介导巨噬细胞由M1型向M2型转化。如图3所示,巨噬细胞活化成M1型,吞噬功能增强,细胞核外吞噬的红色的大肠杆菌颗粒增多,在加入EZH2抑制剂GSK343后,巨噬细胞的吞噬功能恢复到与对照组相似。经统计学分析,LPS刺激组吞噬功能增加(P<0.05),而LPS+GSK343组吞噬功能与对照组无明显差异(P>0.05),提示巨噬细胞M1型的促炎状态被抑制,而恢复到M2型的抗炎状态。
图 3. 巨噬细胞的吞噬功能变化 荧光显微镜 × 200.
Fig 3 Changes in phagocytic function of macrophages fluorescence microscope × 200
A:A组;B:B组;C:C组;D:D组。
3. 讨论
牙周炎可以造成牙周支持组织的破坏。牙菌斑生物膜是最主要的致病因素,菌斑的细菌及其产物是引发牙周炎必不可少的始动因子。LPS是革兰阴性细菌独有的一类具有高度活性的致病物质,对牙周组织有很高的毒性和抗原性,在牙周炎的发生发展过程中起重要作用。牙周炎的发生是细菌、毒素因子和机体之间防御功能的平衡被打破所致,是一种复杂的免疫炎症反应。目前有研究[8]证实,一些编码抗体反应以及炎症介质的重要基因,包括IL-1、IL-6、TNF-α、维生素D受体等,其基因序列的变异可能会改变机体某些组织结构、抗体反应以及炎症介质的调控,从而对牙周炎的易患性及其严重程度产生影响。除了基因多态性对牙周炎易患性的影响,个体在环境因素的作用下,一些与牙周炎相关基因的甲基化状态也可能影响疾病的发生和发展,并且这种改变是可以遗传的。牙周组织中特定的基因启动子感应激素而引起表观遗传学方面的改变可能是牙周炎发病的重要原因。在牙周炎中,基因表达的改变是由于表观遗传的修饰。Gomez等[9]研究发现,细胞因子基因表达改变导致的甲基化模式可能导致炎症疾病。在牙周炎中发现,炎症细胞因子如IL-1、IL-4、IL-6和IL-10存在过表达。Stenvinkel等[10]发现,持续性的炎症导致DNA甲基化,使细胞因子信号传导抑制剂沉默,诱导细胞因子信号的活跃表达。细胞因子如IL-6和干扰素 -γ(interferon-γ,IFN -γ)在慢性牙周炎患者的炎症组织中过表达[11]。IFN-γ启动子的低甲基化可能会增加IFN-γ在慢性牙周炎的转录,从而导致IFN-γ过表达[12]–[13]。相反,一些基因[8],例如TNF-α和环氧合酶-2在CpG位点的甲基化则抑制其表达。Zhang等[14]报道,甲基化模式的改变可能是牙周炎中调节TNF-α转录的关键因素。
巨噬细胞是具有异质性的细胞,在不同环境中可以发生不同性质的活化,成为具有不同表型和功能特征的亚群。从活化途径看,至少包括M1和M2两种类型[15]。M1型巨噬细胞,即经典活化的巨噬细胞(classically activated macrophage),其活化需双信号,包括IFN-γ、外源性或内源性TNF-α的诱导剂如细菌LPS等;其基本表现是IL-12高表达和IL-10低表达,较特异的标志物有人白细胞抗原(human leukocyte antigen,HLA)-DR、CD40L、iNOS等;其功能是参与Th1型免疫应答,抗感染和抗肿瘤。M1型巨噬细胞具有促炎的功能,不但能分泌大量促炎因子(主要包括TNF-α、IL-1β、IL-6、IL-12和IL-23等)发挥促炎作用,而且能产生一氧化氮和活性氧(reactive oxygen species,ROS)来杀伤溶酶体内的细胞和病原体。但M1型巨噬细胞的促炎功能亢进会加重组织破坏,甚至发展成为全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)导致死亡。M2型巨噬细胞,即替代性活化的巨噬细胞(alternatively activated macrophage),包括3种亚型,分别为M2a、M2b、M2c,其活化不需要双信号,由IL-4、IL-13等诱导分化;其基本表现为IL-10高表达和IL-12低表达,较特异的标志物有CD163、CD206等;其功能是参与Th2型免疫应答,抑制Th1型免疫应答和炎症,诱导局部的免疫耐受状态,促进组织重建以及修复,促进新生血管生成进而促进肿瘤细胞增殖和转移。M2a型细胞主要发挥促基质重建和组织修复功能,其生成的纤维连接蛋白1属于细胞外基质结构元件,能连接糖蛋白和细胞基质,二者都有利于基质重建和组织修复。此外,M2a型细胞合成的聚胺类物质,能影响细胞因子的生成并抑制邻近淋巴细胞的增殖,进而发挥一定的免疫调节功能。M2b和M2c型细胞主要发挥免疫调节功能,两者均表达大量的IL-10,而IL-10能通过抑制多种促炎因子的生成及其功能抑制炎症反应,发挥免疫调节作用。
EZH2是一种甲基化酶[16]–[18],属于多梳基因家族,是一种重要的组蛋白,具有甲基转移酶活性,能够抑制其下游靶基因的转录,并调节干细胞的自我更新。在胚胎发育、肿瘤进展及干细胞维持中发挥重要作用。EZH2通过H3K27侧链上的ε氨基使组蛋白发生甲基化,参与基因的转录抑制,通过抑制染色体中的靶基因而调节细胞增殖,可能参与了肿瘤的增殖、侵袭与转移等过程。
本研究利用免疫印迹及ELISA检测RAW264.7细胞表型生物学标志变化,大肠杆菌吞噬试验检测RAW264.7细胞功能变化,结果显示,GSK343可以诱导RAW264.7细胞由M1型向M2型转化,因此可以推论,EZH2抑制剂GSK343可抑制巨噬细胞甲基化,在牙周炎的治疗中具有潜在作用,这为牙周炎的治疗提供了一种可能的思路和方法。
遗传信息,如DNA序列已不能完全解释基因调控和疾病过程的机制。表观遗传学,包括DNA甲基化、组蛋白修饰和非编码RNA,可以调节基因表达和影响疾病的进展[19]。目前口腔表观遗传学研究尚处于早期阶段,认识遗传因素和表观遗传因素的作用,对开发口腔疾病预防和治疗有不可忽视的价值。
Funding Statement
[基金项目] 泸州市科技局基金[2016-S-66(1/3)]
Supported by: Fund of Science and Technology Bureau of Luzhou [2016-S-66(1/3)].
References
- 1.Chang ZL. Recent development of the mononuclear phagocyte system: in memory of metchnikoff and ehrlich on the 100th anniversary of the 1908 Nobel Prize in physiology or medicine[J] Biol Cell. 2009;101(12):709–721. doi: 10.1042/BC20080227. [DOI] [PubMed] [Google Scholar]
- 2.Gordon S, Taylor PR. Monocyte and macrophage heterogeneity[J] Nat Rev Immunol. 2005;5(12):953–964. doi: 10.1038/nri1733. [DOI] [PubMed] [Google Scholar]
- 3.孟 焕新. 牙周病学[M] 北京: 人民卫生出版社; 2012. pp. 86–88. [Google Scholar]; Meng HX. Periodontology[M] Beijing: People's Medical Publishing House; 2012. pp. 86–88. [Google Scholar]
- 4.Vats D, Mukundan L, Odegaard JI, et al. Oxidative metabolism and PGC-1beta attenuate macrophage-mediated inflammation[J] Cell Metab. 2006;4(1):13–24. doi: 10.1016/j.cmet.2006.05.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.黄 秀梨. 微生物学实验指导[M] 北京: 高等教育出版社; 1999. pp. 114–116. [Google Scholar]; Huang XL. Microbiological experimental instruction[M] Beijing: Higher Education Press; 1999. pp. 114–116. [Google Scholar]
- 6.Lumeng CN, Bodzin JL, Saltiel AR. Obesity induces a phenotypic switch in adipose tissue macrophage polarization[J] J Clin Invest. 2007;117(1):175–184. doi: 10.1172/JCI29881. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Qazi SN, Rees CE, Mellits KH, et al. Development of gfp vectors for expression in listeria monocytogenes and other low G+C gram positive bacteria[J] Microb Ecol. 2001;41(4):301–309. doi: 10.1007/s002480000091. [DOI] [PubMed] [Google Scholar]
- 8.Lindroth AM, Park YJ. Epigenetic biomarkers: a step forward for understanding periodontitis[J] J Periodontal Implant Sci. 2013;43(3):111–120. doi: 10.5051/jpis.2013.43.3.111. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Gomez RS, Dutra WO, Moreira PR. Epigenetics and periodontal disease: future perspectives[J] Inflamm Res. 2009;58(10):625–629. doi: 10.1007/s00011-009-0041-7. [DOI] [PubMed] [Google Scholar]
- 10.Stenvinkel P, Karimi M, Johansson S, et al. Impact of inflammation on epigenetic DNA methylation—a novel risk factor for cardiovascular disease[J] J Intern Med. 2007;261(5):488–499. doi: 10.1111/j.1365-2796.2007.01777.x. [DOI] [PubMed] [Google Scholar]
- 11.Kinane DF, Hart TC. Genes and gene polymorphisms associated with periodontal disease[J] Crit Rev Oral Biol Med. 2003;14(6):430–449. doi: 10.1177/154411130301400605. [DOI] [PubMed] [Google Scholar]
- 12.Zhang S, Crivello A, Offenbacher S, et al. Interferon-gamma promoter hypomethylation and increased expression in chronic periodontitis[J] J Clin Periodontol. 2010;37(11):953–961. doi: 10.1111/j.1600-051X.2010.01616.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Babel N, Cherepnev G, Babel D, et al. Analysis of tumor necrosis factor-alpha, transforming growth factor-beta, interleukin-10, IL-6, and interferon-gamma gene polymorphisms in patients with chronic periodontitis[J] J Periodontol. 2006;77(12):1978–1983. doi: 10.1902/jop.2006.050315. [DOI] [PubMed] [Google Scholar]
- 14.Zhang S, Barros SP, Moretti AJ, et al. Epigenetic regulation of TNFA expression in periodontal disease[J] J Periodontol. 2013;84(11):1606–1616. doi: 10.1902/jop.2013.120294. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Bonecchi R, Locati M, Mantovani A. Chemokines and cancer: a fatal attraction[J] Cancer Cell. 2011;19(4):434–435. doi: 10.1016/j.ccr.2011.03.017. [DOI] [PubMed] [Google Scholar]
- 16.刘 莹, 高 庆, 高 艳娥, et al. 宫颈癌中EZH2的表达与细胞增殖和血管生成的关系[J] 西安交通大学学报(医学版) 2013;34(5):580–584. [Google Scholar]; Liu Y, Gao Q, Gao YE, et al. Expression of EZH2 in cervical cancer and its relationship with cell proliferation angiogenesis[J] J Xi'an Jiaotong Univ (Med Sci) 2013;34(5):580–584. [Google Scholar]
- 17.Alimova I, Venkataraman S, Harris P, et al. Targeting the enhancer of zeste homologue 2 in medulloblastoma[J] Int J Cancer. 2012;131(8):1800–1809. doi: 10.1002/ijc.27455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Kemp CD, Rao M, Xi S, et al. Polycomb repressor complex-2 is a novel target for mesothelioma therapy[J] Clin Cancer Res. 2012;18(1):77–90. doi: 10.1158/1078-0432.CCR-11-0962. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Susol E, Rands AL, Herrick A, et al. Association of markers for TGFbeta3, TGFbeta2 and TIMP1 with systemic sclerosis[J] Rheumatology (Oxford) 2000;39(12):1332–1336. doi: 10.1093/rheumatology/39.12.1332. [DOI] [PubMed] [Google Scholar]