Abstract
目的
通过成骨细胞的体外培养,初步探讨钛及钛合金微-纳米三维形貌对成骨细胞生物学行为的影响。
方法
采用电解蚀刻法在纯钛及钛合金表面构建出不同尺寸的微-纳米三维形貌,并观察其三维结构表面对成骨细胞黏附、增殖、细胞形态、碱性磷酸酶(ALP)活性的影响。
结果
在成骨细胞的黏附和增殖方面,纯钛组和钛合金组表面均高于纯钛机械抛光组。纯钛组表面细胞胞体饱满,伸出大量伪足,并可见大量功能颗粒。ALP活性显著高于钛合金和纯钛机械抛光组表面。
结论
通过电解蚀刻法在纯钛和钛合金表面可形成不同直径和深度的碗形巢样及纳米结构;两个表面即30~50 µm和5~8 µm的表面和光滑表面相比,都明显促进了细胞的附着;30~50 µm的纯钛表面更有利于促进细胞的增殖和分化。
Keywords: 纯钛, 钛合金, 种植体, 成骨细胞, 生物学行为, 电解蚀刻
Abstract
Objective
This preliminary study aims to investigate the effects of titanium and titanium alloy micro-nano-dimensional topography on the biological behavior of osteoblasts in vitro.
Methods
Electrolytic etching (EE) method was used to produce micro-nano dimensional titanium surfaces. The surfaces were observed to determine their effects on the adhesion, proliferation, cell morphology, and alkaline phosphatase (ALP) activity of osteoblasts.
Results
The surfaces of the titanium and titanium alloy groups exhibited higher adhesion and proliferation of osteoblasts than those of the mechanical group. The titanium surface was covered with a group of cells, a large number of filopodia, and functional particles. The ALP activity of the titanium group was significantly higher than that of the titanium alloy and mechanical groups.
Conclusion
EE method in pure titanium and titanium alloy surfaces result in bowl-like nests and nanostructures of different diameters and depths. The diameters of the pure titanium and titanium alloy surfaces range from 30 to 50 µm and 5 to 8 µm, respectively. The former is more conducive to promote the proliferation and differentiation of cells.
Keywords: titanium, titanium alloy, implant, osteoblast, biological behavior, electrolytic etching
纯钛及钛合金以其良好的机械性能和生物相容性,可与骨组织形成骨结合,作为人工种植体被广泛应用于口腔种植领域。研究[1]证实钛及钛合金种植体表面特性影响骨整合率,尤其表面形貌影响成骨细胞的生物学行为及功能状态。目前对种植体表面形貌的研究主要集中在微米形貌和纳米形貌两个方面。研究[2]认为微米形貌能增强机械固位,促进成骨细胞的黏附、分化和细胞外基质的形成和矿化,改变蛋白的构象,促进成骨细胞的定向、黏附、增殖,提高骨整合率。但Meirelles等[3]认为仅有纳米形貌是不足以保证骨整合的,微米形貌对骨整合也非常重要。因此兼具有微纳米三维结构的种植体表面成为未来发展的趋势及研究的热点。本研究采用电解蚀刻法(electrolytic etching,EE)在纯钛及钛合金表面构建出微-纳米三维形貌,研究成骨细胞在两种金属表面的不同生物学行为,初步探讨了纯钛及钛合金微纳米三维结构表面对成骨细胞黏附、增殖、细胞形态、碱性磷酸酶(alkaline phosphatase,ALP)活性的影响。
1. 材料和方法
1.1. 材料和仪器
DMEM培养基、胎牛血清(Gibco公司,美国),胰蛋白酶、噻唑蓝(methyl thiazolyl tetrazolium,MTT)、乙二胺四乙酸钠(ethylenediamine tetraacetic acid,EDTA)(Merke公司,西德),ALP检测试剂盒(南京建成生物生物工程研究所),圆柱形的纯钛及钛合金试件(沈阳中航钛业公司)。JSM-6700场发射扫描电镜(scanning electron microscope,SEM)、HHW21.420电解仪及电解槽(自制)、Allegra X-12台式离心机、UV-260紫外可见光分光光度计(Beckman公司,美国)。
1.2. 纯钛及钛合金粗化表面的构建
采用EE法处理圆柱形的纯钛和钛合金试件(直径为4 mm×10 mm)底面,以钛为阳极,铂片为阴极,酸为电解液,在一定时间和电流作用下对金属表面进行蚀刻,获得兼具有微-纳米三维形貌的表面。在距电解蚀刻处理面约2 mm处切割,形成直径为4 mm×2 mm试件。试件的一面为电解蚀刻面,另一面是切割形成的表面。实验分为纯钛组(EE1)、钛合金组(EE2)、纯钛机械抛光组(M组)。将上述3组试件用丙酮、无水乙醇、去离子水分别超声清洗10 min,干燥塑封,高压锅灭菌消毒,备用。
1.3. 两种表面的成骨细胞生物学行为
1.3.1. MG-63细胞培养
37 °C,5%CO2和100%饱和湿度条件下,用含10%胎牛血清、60 U·mL−1青霉素、100 U·mL−1链霉素的DMEM全营养培养基培养MG-63细胞。在玻璃培养瓶中加入0.25%胰酶后离心,收集细胞,加入细胞冻存液(含70%培养液、20%胎牛血清和10%二甲基亚砜混匀。置于4 °C条件下40 min,-20 °C条件下2 h,然后置于-70 °C过夜,最后置于液氮中,长期保存。
1.3.2. 两种不同表面的MG-63细胞增殖能力
将经过EE法处理的纯钛及钛合金试件经过高温、高压消毒后,放入到已消毒的96孔培养板中,每孔放置1个试验件,以正常组为对照。用0.25%胰蛋白酶将对数期的MG-63细胞制成单细胞悬液,加入96孔培养板。每孔0.1 mL,每个实验组设6复孔。分别于第1、3、5、7天取出一块板后每孔加入10 µL MTT(5 g·L−1)溶液后继续培养4 h,吸出原培养液后每孔加入二甲基亚砜150 µL,室温下振荡器振荡15 min,使结晶物充分溶解,用酶标仪测定各孔吸光度(A)值,实验波长为490 nm,按照公式计算细胞增殖率,细胞增殖率=(An-A0)/A0,An为某时间点的A值,A0为1 d时A值(设为基础值)。
1.3.3. 不同表面对MG-63细胞贴壁率的影响
将3组试件放到24孔培养板中,每孔放置10个试件,设3复孔。将0.25%胰酶消化后的细胞制成细胞悬液,每孔放入悬液1 mL,细胞浓度为每孔1×105个,以正常组为对照。细胞接种后分别在1、2、6、12、24 h终止培养,0.01 mol·L−1的PBS轻轻冲洗试件3次后,转入另一个24孔培养板中,每孔加0.3 mL 0.25%胰酶消化3 min,加0.7 mL含10%胎牛血清的DMEM终止消化,轻轻吹打实验件,制成单细胞悬液,台盼兰染色,显微镜下计细胞数,按照公式计算细胞贴壁率,细胞贴壁率=(贴壁细胞数/接种细胞数)×(培养孔底面积/钛试验件表面积)×100%。
1.3.4. 不同表面对MG-63细胞形态的影响
将3组试件放入到已消毒的96孔培养板中,每孔放置1个试件,设6复孔,以正常组为对照。将培养瓶内对数期生长的细胞以0.25%胰酶消化,制成细胞悬液,每孔加入0.l mL,接种后在第1、3、5天终止培养,0.01 mol·L−1的PBS轻轻冲洗3次;2.5%戊二醛固定过夜后,0.1 mol·L−1 PBS冲洗3次,每次15 min;1%锇酸固定60 min,0.1 mol·L−1 PBS冲洗3次,每次15 min;分别以50%、70%、80%、90%、100%乙醇依次脱水各15 min;100%乙酸异戊酯处理15 min,干燥;经黏台,喷金后SEM观察。
1.3.5. 不同表面对ALP活性的影响
将3组试件放入到已消毒的24孔培养板中,每孔放置10个试验件,设3复孔,以正常组为对照。将培养瓶内对数期生长的细胞以0.25%胰酶消化,制成细胞悬液,每孔加入l mL,细胞接种后分别在第1、3、5、7天终止培养。用超声破裂细胞,每次10 s,共3次,冰上操作,将细胞液转移到1.5 mL的EP管内,此时的ALP为细胞内和培养上清内ALP。
1.4. 统计学分析
采用SPSS 13.0软件对实验数据进行分析,均数两两比较采用单因素方差分析检验。
2. 结果
2.1. 经EE法处理后试件表面形貌
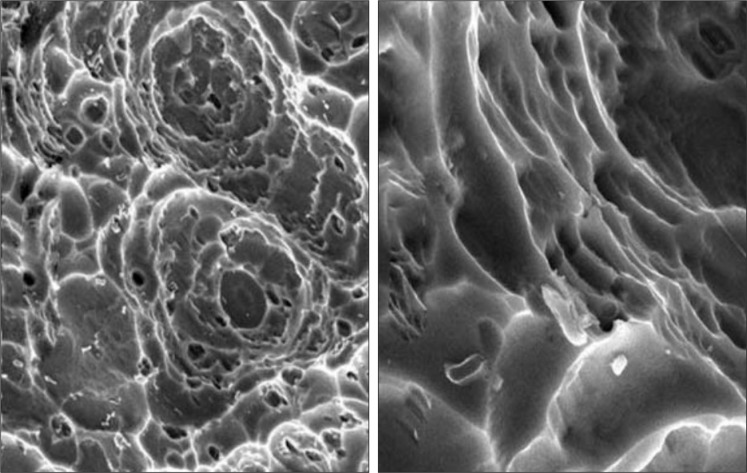
在1 000倍SEM下,纯钛试件表面呈较均匀的碗状微米凹,直径30~50 µm;其上可见不规则浅碟状凹,直径8~10 µm。在4 000倍SEM下,在凹的侧壁以及底部可见清晰的纳米凹、纳米孔和纳米台阶,大小100~600 nm,边缘圆钝(图1)。2 000倍电镜下,钛合金试件表面呈比较均匀的、碗状的微米孔结构,直径5~8 µm,其上布满二级纳米孔。在8 000倍SEM下,二级孔分布均匀,直径为60~500 nm(图2)。1 000倍电镜下,纯钛机械抛光组试件表面见平行排列的沟纹。4 000倍SEM下,试件表面见平行排列的沟纹以及金属本身形成的少量微孔隙(图3)。EE1组、EE2组、M组试件与水的接触角分别为56.60°±3.81°、62.52°±2.79°、60.77°±1.07°;激光共聚焦显微镜测得EE1组、EE2组、M组试件表面的粗糙度分别为(5.56±1.00)、(3.93±0.21)、(0.77±0.23)µm。
图 1. EE1组试件的表面形貌 SEM.
Fig 1 The surface morphology of EE1 group SEM
左:× 1 000;右:× 4 000。
图 2. EE2组试件的表面形貌 SEM.
Fig 2 The surface morphology of EE2 group SEM
左:× 2 000;右:× 8 000。
图 3. M组试件的表面形貌 SEM.
Fig 3 The surface morphology of M group SEM
左:× 1 000;右:× 4 000。
2.2. 3种试件表面的成骨细胞生物学行为
2.2.1. 不同表面的MG-63细胞增殖能力
M组、EE1组和EE2组MG-63细胞的A值检测结果见表1。由表1可见,第1天EE1组与EE2组及M组相比差异无统计学意义,第3、5和7天EE1组A值明显高于M组,且有统计学差异(P<0.05),虽然也高于EE2组但在第7天才看出显著性差异(P<0.05)。
表 1. 各组A值的检测结果.
Tab 1 A value of test results of each group
| 分组 |
A值 |
|||
| 1 d | 3 d | 5 d | 7 d | |
| M组 | 0.35±0.03 | 0.34±0.03* | 0.48±0.09* | 0.55±0.04* |
| EE1组 | 0.32±0.07 | 0.53±0.07 | 0.60±0.08 | 0.75±0.14 |
| EE2组 | 0.34±0.03 | 0.45±0.09 | 0.51±0.12 | 0.62±0.19* |
注:*与EE1组相比较,P<0.05。
n=6
2.2.2. 不同表面的MG-63细胞黏附率
各组MG-63细胞的黏附率见表2。MG-63细胞接种1 h,EE2组表面细胞黏附率最高,EE1组次之,M组最低,差异有统计学意义(P<0.05)。接种2 h时,EE1组表面最低,EE2组最高,差异有统计学意义(P<0.05)。随后的6、12、24 h,EE1组表面细胞黏附率明显增高,大于EE2组和M组,但与EE2组比较差异无统计学意义,与M组比较差异有统计学意义(P<0.05)。
表 2. 各组MG-63细胞黏附率.
Tab 2 The MG-63 cells adhesion rate of each group
| 分组 | 黏附率/% |
||||
| 1 h | 2 h | 6 h | 12 h | 24 h | |
| M组 | 0.16±0.04* | 0.34±0.02 | 0.60±0.03* | 0.82±0.02* | 0.80±0.03* |
| EE1组 | 0.33±0.03 | 0.26±0.17 | 0.93±0.07 | 1.19±0.04 | 1.33±0.05 |
| EE2组 | 0.35±0.02* | 0.45±0.03* | 0.88±0.07 | 0.93±0.29 | 1.32±0.09 |
注:*与EE1组相比较,P<0.05。
n=3
2.2.3. 不同表面的MG-63细胞形态变化
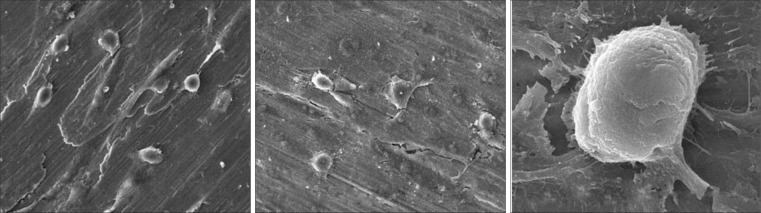
SEM下观察可见,第1天EE1组MG-63细胞位于碗型凹内,细胞胞体较大且饱满;周围伸出很多粗大的伪足,牢牢抓在周围的碗型凹内壁及边缘。第3天EE1组MG-63细胞在表面充分伸展,细胞更加扁平,可见大量的功能颗粒和线粒体样的棒状小体。第5天表面已被MG-63细胞及分泌的基质覆盖,可见新增殖的细胞成球形(图4)。
图 4. EE1组MG-63细胞形态的观察结果 SEM.
Fig 4 The MG-63 cell morphology of EE1 group SEM
左:1 d;中:3 d;右:5 d。
第1天EE2组MG-63细胞为多边形或星形,附着在微米凹的上方,细胞较扁平;伸出的伪足较少,并附着在微米孔边缘,或跨过微米孔之间的脊向远处伸展。第3天,细胞伸展较好,表面可见功能颗粒,说明功能较旺盛。第5天表面被细胞分泌的基质覆盖,可见新增殖的细胞(图5)。
图 5. EE2组MG-63细胞形态的观察结果 SEM.
Fig 5 The MG-63 cell morphology of EE2 group SEM
左:1 d;中:3 d;右:5 d。
第1、3、5天M组细胞主要为球形及少量梭形,主要以微绒毛的形式附着在表面,少见伪足(图6)。
图 6. M组MG-63细胞形态的观察结果 SEM.
Fig 6 The MG-63 cell morphology of M group SEM
左:1 d;中:3 d;右:5 d。
2.2.4. 不同表面MG-63细胞的ALP活性
第1天EE1组ALP水平高于EE2组和M组,并与M组有显著性差异。第3、5、7天ALP水平EE1组明显比EE2组和M组高,差异显著(P<0.05),说明纯钛组有最佳的功能状态(表3)。
表 3. 各组ALP活性.
Tab 3 ALP activity of each group
| 分组 | ALP活性 |
|||
| 1 d | 3 d | 5 d | 7 d | |
| M组 | 1.37±0.06* | 1.35±0.01* | 1.58±0.77* | 1.59±0.09* |
| EE1组 | 1.88±0.18 | 2.17±0.08 | 2.14±0.30 | 2.51±0.11 |
| EE2组 | 1.71±0.19 | 1.81±0.09* | 1.82±0.12* | 1.99±0.10* |
注:*与EE1组相比较,P<0.05。
U·100 mL−1
3. 讨论
种植体表面特性可驱动成骨细胞活性[4],特别是表面微观几何形貌影响种植体和成骨细胞相互作用,并因此引导随后的细胞反应。体外研究[5]证实,钛表面形貌影响细胞和生物材料相互作用如细胞的附着、增殖和分化。细胞的附着和黏附与整合素受体有关,整合素受体(穿膜蛋白)其亚单位(β1-整合素)是成骨细胞重要的黏附分子,在细胞附着和伸展过程中起关键作用[6]。当整合素和成骨细胞合成的细胞外基质蛋白(纤维连接蛋白、Ⅰ型胶原蛋白)结合,形成黏着斑,把细胞骨架和细胞外基质蛋白粘接在一起,使细胞黏附于材料表面[7]。整合素与基质蛋白的粘接激活了信号传递系统,将表面形貌信号传递到细胞内直到细胞核。此信号能调节细胞形状、迁移、增殖、分化及基因表达[8]。细胞黏附后,整合素活化不仅影响信号传导和转录因子的表达,还影响细胞骨架的结构排列,从而影响细胞的形态和伸展。与整合素连接的肌动蛋白在表面信号的驱动下重新分布、排列,驱使细胞浆前移使细胞伸展、形态改变[9]。不同的表面整合素亚单位反应及表达方式不同,局部动力不同,因而细胞形状、伸展和转录分子的表达不同。本研究中,3种表面在最初的1~2 h,EE2组试件表面的黏附率高于EE1组和M组,M组最低,差异有统计学意义。但在随后的6~12 h,EE1组略高于EE2组,但差异无统计学意义。两组都明显地高于M组。说明粗糙的表面比光滑表面更有利于细胞的黏附。在这里微米凹尺寸的大小对于细胞的附着没有明显的影响。从细胞的增殖结果可见,纯钛表面的细胞增殖高于钛合金表面,尤其在第7天出现显著的差异。两者表面的细胞增殖又明显高于机械表面,说明30~50 µm的碗型微米凹比5~8 µm直径的碗型凹,更有利于细胞的增殖。两个表面的碗型凹内都具有纳米结构,促进了细胞的增殖。但30~50 µm的凹促进作用更为明显,可能与其暴露更多的纳米结构有关。此外,这种碗型巢可使纤维蛋白血凝块在种植体表面稳定沉积,并使脆弱的细胞外基质支架固定,从而形成稳定的微环境,有利于细胞沿着纤维蛋白支架向种植体表面迁移和生长,使细胞形态发生变化。此外,从细胞形态变化可见,30~50 µm凹的纯钛表面上的细胞胞体巨大、饱满,伪足粗壮,牢牢附着在碗型凹侧壁和边缘,伸展充分,表面具有大量的分泌颗粒和线粒体一样的结构,说明30~50 µm的充满纳米结构的“纳米巢”,可使细胞处在最佳的活性和功能状态。
ALP是参与骨形成的重要物质,是成骨细胞分化的重要标志物。纯钛表面的ALP活性明显高于钛合金表面和机械表面,这与细胞的活性和功能状态密切相关,说明30~50 µm碗型凹的粗糙表面更能刺激成骨细胞的功能,促进其分化。
Funding Statement
[基金项目] 吉林省科技厅基金资助项目(200905175)
References
- 1.Lee BH, Lee CY, Kim DG, et al. Effect of surface structureon biomechanical properties and osseointegration[J] Materials Science Engineering. 2008;28:1448–1461. [Google Scholar]
- 2.Abron A, Hopfensperger M, Thompson J, et al. Evaluation of a predictive model for implant surface topography effects on early osseointegration in the rat tibia model[J] J Prosthet Dent. 2001;85(1):40–46. doi: 10.1067/mpr.2001.112415. [DOI] [PubMed] [Google Scholar]
- 3.Meirelles L, Arvidsson A, Albrektsson T, et al. Increased bone formation to unstable nano rough titanium implants[J] Clin Oral Implants Res. 2007;18(3):326–332. doi: 10.1111/j.1600-0501.2006.01308.x. [DOI] [PubMed] [Google Scholar]
- 4.Watanabe I, McBride M, Newton P, et al. Laser surface treatment to improve mechanical properties of cast titanium[J] Dent Mater. 2009;25(5):629–633. doi: 10.1016/j.dental.2008.11.006. [DOI] [PubMed] [Google Scholar]
- 5.Bowers KT, Keller JC, Randolph BA, et al. Optimization of surface micromorphology for enhanced osteoblast responses in vitro[J] Int J Oral Maxillofac Implants. 1992;7(3):302–310. [PubMed] [Google Scholar]
- 6.Lincks J, Boyan BD, Blanchard CR, et al. Response of MG63 osteoblast-like cells to titanium and titanium alloy is dependent on surface roughness and composition[J] Biomaterials. 1998;19(23):2219–2232. doi: 10.1016/s0142-9612(98)00144-6. [DOI] [PubMed] [Google Scholar]
- 7.García AJ. Get a grip: integrins in cell-biomaterial interactions[J] Biomaterials. 2005;26(36):7525–7529. doi: 10.1016/j.biomaterials.2005.05.029. [DOI] [PubMed] [Google Scholar]
- 8.Clark EA, Brugge JS. Integrins and signal transduction pathways: the road taken[J] Science. 1995;268(5208):233–239. doi: 10.1126/science.7716514. [DOI] [PubMed] [Google Scholar]
- 9.Yamada KM, Geiger B. Molecular interactions in cell adhesion complexes[J] Curr Opin Cell Biol. 1997;9(1):76–85. doi: 10.1016/s0955-0674(97)80155-x. [DOI] [PubMed] [Google Scholar]