Abstract
目的
构建一种长效、靶向的携带促骨形成药物HU-308的药物缓释种植体,观察其体外缓释特性。
方法
采用层层静电自组装技术制备不同层数的肝素/壳聚糖涂层,以物理吸附的方式装载促骨形成药物HU-308,构建载药种植并进行体外释放实验。通过紫外可见光分光光度计测定药物浓度,分析不同涂层数载药种植体的加载效率及释放规律。用扫描电镜、原子力显微镜观察涂层表面形貌和结构的变化。
结果
成功地制备了载HU-308涂层种植体。体外释放实验表明,随着涂层层数的增加,载药量逐渐增加,但T20组略有下降。随着层数的增加,HU-308的释放速度随之减缓,缓释能力增强。扫描电镜、原子力显微镜结果表明种植体表面肝素/壳聚糖涂层逐渐形成。
结论
层层静电自组装技术成功构建载有HU-308的涂层种植体,可长期有效释放达30 d以上,这有望为临床上提高骨质疏松症患者种植体骨整合率提供一种新的可能。
Keywords: 钛种植体, 药物缓释, HU-308, 层层静电自组装, 肝素, 壳聚糖
Abstract
Objective
This study aims to construct a long-term, osteogenesis-targeting HU-308 drug delivery implant by the layer-by-layer electrostatic self-assembly (LBL) technique, and observe the features of its delayed release in vitro.
Methods
A heparin (Hep) and chitosan (Chi) multilayer was coated on pure titanium using the LBL technique, and the titanium implants were dipped into the solution to load HU-308. The amount of loaded drug and release rates were measured using a UV-Vis spectrophotometer. The relationships between the loading efficiency, release time, and multilayer films were evaluated. The morphology of all the multilayers was characterized by scanning electron microscopy (SEM) and atomic force microscopy (AFM).
Results
The results showed that the Hep/Chi self-assembly multilayer was gradually fabricated on the titanium surface. HU-308 was successfully loaded on the titanium implants. The amount of loaded drug increased with the amount of multilayer films, except in the T20 group. In vitro drug release study showed that drug release was more difficult in the system with thicker films, and large amounts of multilayer films decreased the release speed. Both SEM and AFM measurements showed typical LBL deposition of Hep and Chi.
Conclusion
The HU-308 drug delivery implant is successfully fabricated via LBL technology. It could provide sustained release of HU-308 over 30 d. This type of implant may provide a new possibility of promoting implant–bone osseointegration for osteoporotic patients.
Keywords: titanium implant, drug delivery, HU-308, layer-by-layer electrostatic self-assembly, heparin, chitosan
骨质疏松症作为一种全身系统性疾病,影响了颌骨的骨质量和骨密度[1],进而影响了颌骨种植体的成功率,如何提高骨质疏松症患者的种植成功率一直以来都是人们关注的焦点。传统的全身给药不仅用药量大、有不良反应且作用于种植体局部的效果不佳。纯钛作为牙种植材料,有着良好的机械性能和生物相容性,但其属于惰性材料,缺乏生物活性,无骨诱导和骨传导能力且植入后愈合周期长[2];因此,很多学者开始研究对种植体表面进行处理,尝试在种植体局部载药来解决这些问题。层层静电自组装技术(layer-by-layer electrostatic self-assembly,LBL)[3]是基于聚电解质阴阳离子所带正负电荷间相互作用的一种自组装超分子技术。其原理[4]是分子静电自组装,通过静电力的作用依次吸附上带异种电荷的聚电解质,交替沉积形成自组装多层涂层,而同时电荷间的排斥力又使每一层的吸附量不会无限增加,而是在一定时间内达到饱和。本实验的研究目的在于构建一种肝素(heparin,Hep)/壳聚糖(chitosan,Chi)涂层种植体,并装载促骨形成药物HU-308,使其在种植体周围形成较高药物浓度的同时亦可进行缓慢持久的释放,以诱导种植体周围成骨细胞的分化,促进新骨的形成,以期为今后提高骨质疏松患者的种植骨整合率提供一种新的可能。
1. 材料和方法
1.1. 实验材料和仪器
商业纯钛微种植体,直径2 mm,长4 mm(TA2,纯度99.9%,陕西宝鸡力华公司)。多聚左旋赖氨酸(Sigma公司,美国),肝素钠(上海国药集团化学试剂有限公司),壳聚糖(浙江澳兴生物科技有限公司),HU-308(Cayman公司,美国)。
双光束紫外可见分光光度计(TU-1901,北京普析通用仪器有限责任公司),扫描电镜(scanning electron microscope,SEM)(VEGA3,TESCAN公司,捷克),原子力显微镜(atomic force microscope,AFM)(Ntmdt公司,俄罗斯)。
1.2. 钛种植体的碱热水处理
取50颗钛种植体依次置于丙酮-无水乙醇-去离子水中超声清洗,40 °C干燥。再浸入5 mol·L−1的NaOH溶液中80 °C活化24 h,然后使用去离子水超声清洗3次,每次10 min。接着将碱处理后的钛种植体浸入60 °C去离子水中陈化24 h,用去离子水超声清洗,40 °C干燥备用。
1.3. 肝素/壳聚糖涂层的制备及分组
将壳聚糖在1%乙酸中溶解,制成pH=4、质量浓度为5 g·L−1的聚阳离子溶液;肝素溶解在去离子水中,制成pH=4、质量浓度为5 g·L−1的聚阴离子溶液;多聚左旋赖氨酸(Poly-L-Lysine,PLL)溶解于磷酸盐缓冲液(PBS)中,制成pH=7.2、质量浓度为2.5 g·L−1的聚阳离子溶液。将碱热水处理过后的样品浸入PLL溶液中30 min,获得一个稳定的带正电的前驱体层,为LBL[3]自组装程序的初始层,去离子水漂洗5 min,氮气吹干;再将样品依次浸入肝素、壳聚糖溶液中,每次浸泡10 min,去离子水漂洗1 min,氮气吹干。重复上述循环n次即可得到最终所要求的自组装涂层Ti/PLL/(Hep/Chi)n,每次循环最后一层以壳聚糖层终止。
本实验中50颗钛种植体平均分为5组: T0组(对照组、无涂层)、T5组(5层涂层)、T10组(10层涂层)、T15组(15层涂层)、T20组(20层涂层),每组10颗。按照上述方法制备所需涂层种植体,室温干燥后待用。
1.4. HU-308标准曲线的制作
1.4.1. HU-308吸收标准曲线
将乙醇和PBS按1︰2的比例混合配制成标准的稀释溶剂。然后取一定量的HU-308溶于标准的稀释溶剂中,分别配制成0.25、0.125、0.062 5、0.031 3、0.015 6、0.007 8 g·L−1的一系列梯度浓度的标准液,不含药物的溶液作为空白对照,采用紫外分光光度计测定所配标准溶液在233 nm波长处的光密度值(A值),以A值对浓度C进行回归,获得回归方程A=8.914 3C+0.031 4,R²=0.999 2。
1.4.2. HU-308释放标准曲线
释放标准曲线的制备方法同吸收曲线,释放溶剂为pH=7.2的PBS缓冲溶液。用同样的方式配制一系列梯度浓度的标准液,紫外分光光度计在233 nm波长处测定A值,以A值对浓度C进行回归,获得回归方程A=4.138 8C-0.027 9,R²=0.999 1。
1.5. HU-308的装载
将各组钛种植体浸没于促骨形成药物HU-308溶液中,常温下静置,利用物理吸附法负载药物,间隔一定时间取出部分溶液用紫外分光光度计于选定波长处测定其光密度值,直至光密度值无明显变化时停止测量。对照HU-308吸收标准曲线计算出HU-308的浓度。
1.6. HU-308体外释放实验
常温下配制释放介质PBS缓冲溶液,pH值为7.2。将装载有HU-308的钛种植体浸没到1 mL的PBS缓冲溶液中进行药物体外释放实验,36.5 °C±0.5 °C、50 r·min−1 转速的水浴环境下,分别于1~30 d中每隔2 d定时取样,并更换等量PBS溶液1 mL,用紫外分光光度计测量每个时段样品溶液在233 nm处的紫外光密度值,直到无药物释放为止。对照药物释放标准曲线得出每个时点样品浓度C,可以计算出每个时段下的累积释放百分率,绘制累积释放药物质量百分率-时间的药物体外释放曲线,从而分析自组装层数对释药行为的影响。
1.7. 表面形貌观察
从每组钛种植体中随机抽取2颗,分别用作SEM和AFM观察。对碱处理以及涂层改性后纯钛种植体表面进行表征,观察钛种植体表面微观形貌结构的变化。
2. 结果
2.1. 各组钛种植体HU-308装载量
T0、T5、T10、T15、T20组钛种植体的平均载药量分别为0.140 2、0.163 8、0.164 6、0.167 2、0.164 1 mg;载药百分比分别为61.40%、71.72%、72.09%、73.22%、71.87%。随着涂层层数的不断增加,T0至T15组载药量逐渐增加,但T20组有轻微下降。T0组与实验各组之间载药量差异均有统计学意义(P<0.05),T5、T10、T20组间载药量差异无统计学意义(P>0.05),T15组与其他组载药量差异均有统计学意义(P<0.05)。
2.2. HU-308的体外释药实验结果
HU-308的释放曲线见图1。由图1可见,各组均为逐渐上升的曲线。当释放第1天时,对照组T0组即表现出明显的药物突释现象,释放出药物总量的28.22%;T5、T10、T15、T20组分别释放出药物总量的19.24%、17.29%、15.46%、11.36%。当释放第2天时,T0组已累积释放超过50%的药量,而T5、T10、T15、T20组释放出50%药物的时间分别是4、8、12、14 d。随着钛种植体涂层层数的增加,早期突释现象逐渐减弱。T0组在第10天时已经释放出载药总量的95.93%,然而T20组30 d的累积释放量仅是总量的64.93%,且仍有药物释出的迹象。由此可见,随着涂层数的不断增加,HU-308的释放速度随之减缓,缓释能力不断增强。
图 1. HU-308累计释放曲线.
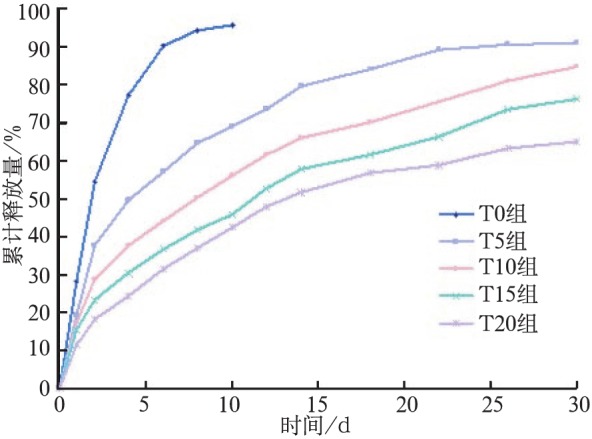
Fig 1 Cumulative percentage release profile of HU-308
2.3. 钛种植体表面形貌和显微结构
2.3.1. SEM下观察
3组不同层数涂层种植体的表面形貌见图2。SEM(10 000倍)下可见:碱处理后的T0组种植体表面形成多孔,孔隙大小约为微米到亚微米级(图2左);随着涂层层数的增加,表面多孔结构逐渐消失,钛种植体表面逐渐被层层覆盖(图2中),当组装到20个循环时种植体表面已被完全覆盖,原凹凸不平的表面已逐渐均匀、平整(图2右)。
图 2. 3组涂层种植体表面形貌 SEM × 10 000.
Fig 2 Surface topography of the samples of three groups SEM × 10 000
左:T0;中:T10;右:T20。
2.3.2. AFM下观察
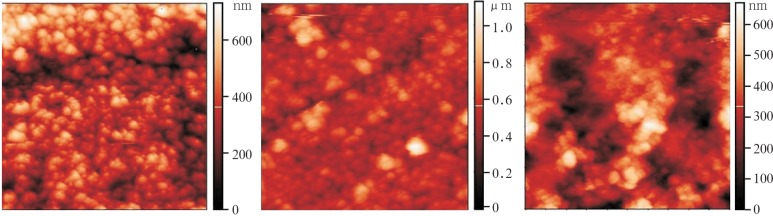
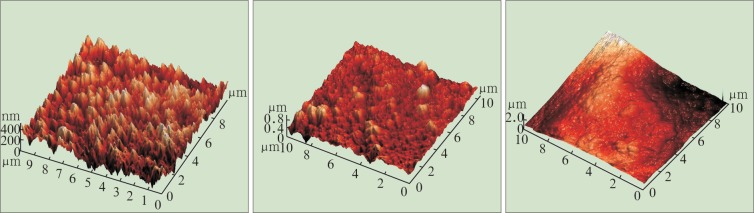
用AFM观察涂层种植体表面微观形貌,轻敲模式下随机选择10 µm×10 µm的微范围进行图像采集。AFM二维图片显示:NaOH处理后钛种植体表面是由卵圆形和圆形颗粒组成;随着涂层层数的增加,卵圆形颗粒集聚重叠,种植体表面越来越平滑(图3)。从AFM三维立体图可见,随着层数的增加,碱处理后所形成的岛状/球形排列的粗糙突起逐渐平滑、均匀(图4)。AFM测得T0、T10、T20的钛种植体表面微观粗糙度分别为(102.72±1.3)、(71.87±1.7)、(45.20±0.9) nm,各组间差异均有统计学意义(P<0.05)。
图 3. 3组涂层种植体表面形貌 AFM.
Fig 3 Surface topography of the samples of three groups AFM
左:T0;中:T10;右:T20。
图 4. 3组种植体三维图片 AFM.
Fig 4 3D images of the samples of three groups AFM
左:T0;中:T10;右:T20。
3. 讨论
本实验利用静电的相互作用,在钛种植体表面交替吸附聚阴离子肝素与聚阳离子壳聚糖,所形成的涂层比普通的物理吸附更加稳定[5];而实验前期对钛种植体的碱热水陈化处理可以使种植体表面形成均匀、多孔的结构,从而增加了表面亲水性和电荷密度,形成富含羟基的活性表面[6]–[8],可以组装更多的聚电解质,有利于涂层与种植体的结合,使肝素/壳聚糖涂层能够良好的吸附于钛种植体表面。
涂层的层数与药物的装载量及释放能力有关。Haidar等[9]利用层层静电自主装技术包覆生物大分子药物,交替沉积的藻酸盐/壳聚糖多层膜提高了聚电解质稳定性从而增强了药物装载率。Ye等[10]将壳聚糖和海藻酸钠层包覆吲哚美辛缓释药物,结果表明聚电解质层数和微胶囊缓释性能有关。有学者制备了不同涂层的壳聚糖乙酸盐/葡聚糖硫酸钠涂层来装载布洛芬,并在PBS溶液和HCl溶液中进行释放,研究得出涂层厚度与组装量成正比,当层数增加时,涂层厚度增加,布洛芬释放速率减慢。为了研究二者之间的关系,本实验通过改变肝素/壳聚糖涂层的层数来观察其对药物装载和释放的能力。选择HU-308作为本研究的加载药物,HU-308是一种特殊的CB2大麻素受体激动剂,它通过激活不同分化能力的成骨细胞和抑制破骨细胞的形成来维持正常的骨量和骨密度[11]–[13]。本实验通过LBL技术构建肝素/壳聚糖生物活性涂层,并用物理吸附的方式将HU-308负载至种植体表面,涂层表面的层状水凝胶结构可使药物富集形成局部高浓度,从而靶向的将药物向周围传递,局部的高浓度药物可以提高治疗的有效性,降低系统毒性。从本研究结果可见,T0与实验各组HU-308装载量差异均有统计学意义(P<0.05),这说明肝素/壳聚糖自组装涂层有利于促骨形成药物HU-308的吸附和装载。随着涂层层数的不断增加,T0到T15组载药量逐渐增加,这与Ye等[10]的研究结果类似;然而当组装层数达到20层时,种植体的载药量却轻微下降,当自组装层数到20层时,过大的分子链密度影响了涂层的透过性,部分HU-308分子无法进入,因而T20组HU-308装载量有所下降。李小燕等[14]亦报道随着自组装层数的增加,增大了分子链堆积密度,药物较难透过缓释体系膜。
体外释放实验显示T0组在释放初期突释现象明显,当释放第2天时,T0组已累积释放超过50%的药量,在第10天时几乎已无药物释出,释放量为95.93%。而实验组则表现出不同程度的缓释能力,随着肝素/壳聚糖涂层数的增加,初期突释的现象得到缓解,缓释能力不断增强,T5、T10、T15、T20组释放出50%药物的时间分别是4、8、12、14 d。本研究只测试了药物释放30 d的曲线,从释放曲线可见,T10、T15、T20组均可持续释放达30 d之久。破骨细胞吸收期约在骨重建开始后维持1个月的时间,因此若在此阶段进行干预,载药种植体的药物释放时间可以满足需要;然而何种浓度是抑制破骨细胞,促进成骨细胞的最佳浓度,从而最终达到有效提高骨质疏松症患者种植体骨整合的目的,本课题组将在后续的研究中进一步探索。
Funding Statement
[基金项目] 广西医疗卫生重点科研课题基金资助项目(重2010083)
References
- 1.Streckfus CF, Johnson RB, Nick T, et al. Comparison of alveolar bone loss, alveolar bone density and second meta-carpal bone density, salivary and gingival crevicular fluid interleukin-6 concentrations in healthy premenopausal and postmenopausal women on estrogen therapy[J] J Gerontol A Biol Sci Med Sci. 1997;52(6):M343–M351. doi: 10.1093/gerona/52a.6.m343. [DOI] [PubMed] [Google Scholar]
- 2.Le Guéhennec L, Soueidan A, Layrolle P, et al. Surface treatments of titanium dental implants for rapid osseointegration[J] Dent Mater. 2007;23(7):844–854. doi: 10.1016/j.dental.2006.06.025. [DOI] [PubMed] [Google Scholar]
- 3.Decher G, Hong JD. Buildup of ultrathin multilayer films by a self-assembly process, consecutive adsorption of anionic and cationic bipolar amphiphiles on charged surfaces[J] Makromol Chem. 1991;46(1):321–327. [Google Scholar]
- 4.余 海湖. 静电自组装纳米复合薄膜研究[D] 武汉: 武汉理工大学材料科学与工程学院; 2002. [Google Scholar]
- 5.陈 佳龙, 李 全利, 陈 俊英, et al. 利用胶原-肝素自组装多层膜改善纯钛表面血液相容性的研究[J] 功能材料. 2008;39(8):1363–1366. [Google Scholar]
- 6.Wu J M, Hayakaw S, Tsuru K, et al. Crystallization of anatase from amorphous titania in hot water and in vitro biomineralization[J] J Cerma Soc Jpn. 2002;110:78–80. [Google Scholar]
- 7.舒 瑶, 欧 国敏, 宫 苹. 钛种植体表面生物化修饰方法研究进展[J] 实用医院临床杂志. 2008;5(3):115–117. [Google Scholar]
- 8.Kim HM, Miyaji F, Kokubo T, et al. Preparation of bioactive Ti and its alloys via simple chemical surface treatment[J] J Biomed Mater Res. 1996;32(3):409–417. doi: 10.1002/(SICI)1097-4636(199611)32:3<409::AID-JBM14>3.0.CO;2-B. [DOI] [PubMed] [Google Scholar]
- 9.Haidar ZS, Hamdy RC, Tabrizian M. Protein release kinetics for core-shell hybrid nanoparticles based on the layer-by-layer assembly of alginate and chitosan on liposomes[J] Biomaterials. 2008;29(9):1207–1215. doi: 10.1016/j.biomaterials.2007.11.012. [DOI] [PubMed] [Google Scholar]
- 10.Ye S, Wang C, Liu X, et al. Deposition temperature effect on release rate of indomethacin microcrystals from microcapsules of layer-by-layer assembled chitosan and alginate multilayer films[J] J Control Release. 2005;106(3):319–328. doi: 10.1016/j.jconrel.2005.05.006. [DOI] [PubMed] [Google Scholar]
- 11.Karsak M, Cohen-Solal M, Freudenberg J, et al. Cannabinoid receptor type 2 gene is associated with human osteoporosis[J] Hum Mol Genet. 2005;14(22):3389–3396. doi: 10.1093/hmg/ddi370. [DOI] [PubMed] [Google Scholar]
- 12.Hanus L, Breuer A, Tchilibon S, et al. HU-308: a specific agonist for CB(2), a peripheral cannabinoid receptor[J] Proc Natl Acad Sci USA. 1999;96(25):14228–14233. doi: 10.1073/pnas.96.25.14228. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ofek O, Karsak M, Leclerc N, et al. Peripheral cannabinoid receptor, CB2, regulates bone mass[J] Proc Natl Acad Sci USA. 2006;103(3):696–701. doi: 10.1073/pnas.0504187103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.李 小燕, 谢 安建. 聚电解质膜的制备及其在药物缓释方面的应用[D] 合肥: 安徽大学化学化工学院; 2006. [Google Scholar]