Abstract
目的
探讨上颌快速扩弓扩张期和固定期兔腭中缝组织血管内皮生长因子(VEGF)的时空表达模式以及新骨形成情况。
方法
将44只新西兰大白兔随机分为11组:实验组(共5组)、对照组(共5组)、对照0组,每组4只。用螺旋分裂基托扩大矫治器(Haas矫正器)扩张兔上牙弓,快速扩张2周,固定4周。在安装扩张器当天(对照0组)、快速扩张第1、2周、固定第1、2、4周(实验组和对照组)取兔上颌骨腭中缝组织块,采用免疫组织化学法检测VEGF在腭中缝组织中的分布和表达变化,采用过碘酸-Schiff染色法观测新骨形成。
结果
快速扩张的腭中缝可见高水平的VEGF表达,VEGF阳性信号主要定位于血管内皮细胞胞浆和增殖活跃的成骨细胞胞浆。对照组VEGF在整个实验过程中均呈弱阳性表达。实验组快速扩张第1周、快速扩张第2周、固定第1周、固定第2周VEGF蛋白表达量均高于对照组。随着机械应力快速扩张,实验组VEGF蛋白表达量逐渐上升,固定1周达峰值后逐渐下降。实验组新骨形成的量均高于对照组,新骨形成的量逐渐上升,固定2周达峰值后逐渐下降。
结论
上颌快速扩弓产生的机械牵张力可以导致VEGF生成增加从而促进血管及新骨的生成。
Keywords: 上颌快速扩弓, 血管内皮生长因子, 免疫组织化学, 新骨形成
Abstract
Objective
This study aims to investigate the temporal pattern of expression of vascular endothelial growth factor (VEGF) and new bone formation during midpalatal suture expansion osteogenesis for rapid maxillary expansion.
Methods
A total of 44 New Zealand white rabbits were randomly assigned to 11 groups, namely, five experimental groups, five control groups, and one control 0 group. A Haas appliance was used for the rapid expansion of the midpalatal suture; rapid expansion was set for 2 weeks and fixed for 4 weeks. The tissue of the maxillary midpalatal suture was harvested on the day of installing rapid expansion (control 0 group), on weeks 1 and 2 for rapid expansion, and on weeks 1, 2, and 4 for fixed (experimental group and control group, respectively). The immunohistochemical method was used to detect distribution and expression of VEGF, and new bone formation was observed with periodic acid-Schiff.
Results
Higher VEGF expressions are observed after midpalatal suture distraction osteogenesis. Positive staining for VEGF is mainly noted in the vascular endothelial cells, and the active osteoblasts are at the edge of a newborn trabecular bone. A weak VEGF expression is detected among cells in the control group. The VEGF expression of the experimental group is higher than that of the control group in rapid expansion weeks 1 and 2 and in fixed weeks 1 and 2. The expression of VEGF in the experimental group increases significantly and peaks at fixed week 1, and then gradually decreases. The amount of newly formed bone in the experimental groups is always higher than that in the control group; moreover, it increases significantly and peaks at fixed week 2, and then gradually decreases.
Conclusion
The mechanical strain created by rapid maxillary expansion generates a sequence of VEGF cellular events that lead to increased vascularization and subsequent new bone formation.
Keywords: rapid maxillary expansion, vascular endothelial growth factor, immunohistochemistry, new bone formation
上颌快速扩张腭中缝的愈合过程受到多种因素的调节,研究[1]–[2]表明,转化生长因子、骨形成蛋白等在上颌快速扩张腭中缝组织改建过程中起重要的调控作用。然而,上颌快速扩张腭中缝牵张成骨是一个血管生成依赖性过程,在骨改建中需要有足够的血运供应,而且血管生成要早于新骨形成。研究[3]发现血管内皮生长因子(vascular endothelial growth factor,VEGF)在血管生成和新骨形成中扮演十分重要的角色,但是其在上颌快速扩张腭中缝组织改建过程中的作用尚未见报道。本课题拟采用兔上颌快速扩张模型,用免疫组织化学方法检测VEGF在腭中缝组织中的分布和表达变化,并采用过碘酸-Schiff(periodic acid-Schiff,PAS)染色法观测新骨形成,为研究VEGF与上颌快速扩张腭中缝牵张成骨的关系提供实验依据。
1. 材料和方法
1.1. 实验动物及分组
雄性8周龄健康新西兰大白兔44只,由南京金陵种兔场提供,质量合格证编号SCXK(苏)0205,清洁级,质量1.4~1.75 kg。动物实验室:南京医科大学实验动物中心兔实验室。动物分笼饲养,标准饮食喂养。分组应用随机数字表按质量分为11 组,每组4只;再用随机数字表定其中1组为对照0组,实验组和对照组各5组。
1.2. 动物模型的建立与标本制备
动物模型按文献[4]建立。采用杭州西湖生物材料研究所特制螺旋扩大器,在干燥的兔上颌模型上制作螺旋分裂基托扩大矫治器(Haas矫正器)。用Haas矫正器扩张兔上牙弓,快速扩张2周,扩张速率为每12 h 0.25 mm,固定4周。扩张期时实验组戴用扩大器,对照组不戴扩大器;固定期时实验组及对照组则均戴用固定器。
在安装扩张器当天(对照0组)、快速扩张第1、2周、固定第1、2、4周(实验组和对照组),全身麻醉下切取动物上颌骨腭中缝组织块,PBS水洗3次,4%甲醛固定,置入15%乙二胺四乙酸中脱钙3周。针刺组织块柔软后,常规脱水、透明、浸渍、包埋,沿牵张方向冠状切开,将石蜡切片制成4 µm连续切片。
1.3. 免疫组织化学法观察VEGF的表达
免疫组织化学检测试剂:羊抗VEGF多克隆抗体(Santa Cruz公司,美国),生物素化羊抗兔/鼠IgG(Dako公司,丹麦),DAB显色液(Santa Cruz公司,美国)。
免疫组织化学方法:1)石蜡切片脱蜡和水化;2)加入过氧化物酶阻断溶液(试剂A);3)组织抗原胰蛋白酶修复;4)滴加动物血清封闭液(试剂B);5)滴加1︰200稀释的羊抗VEGF一抗,4 °C下过夜;6)滴加生物素标记的兔抗羊IgG二抗(试剂C),室温孵育;7)滴加链酶亲合素-过氧化物酶复合物(试剂D);8)滴加DAB液显色,自来水冲洗;9)常规脱水,透明,封片。
免疫组织化学阳性结果判定与半定量分析:用已知的VEGF含量极高的正常兔肝脏作为阳性对照,以PBS代替一抗作阴性对照,以棕色颗粒代表生长因子的阳性信号。LuzexF型多功能图像分析仪测量20倍下3个不同视野,分别测定染色区和空白区的灰度值,取差值作为该视野的光密度(optical density,OD)值,3个视野染色强度的平均值即为其OD值。
1.4. PAS染色法观测新骨形成
PAS染色[5]:1)石蜡切片常规脱蜡至水;2)0.5%高碘酸氧化液孵育;3)入Schiff液于暗处并加盖染色;4)用Harris明矾苏木素液染核;5)0.5%盐酸乙醇分化;6)脱水,透明,封片;7)设立阴性对照,用唾液消化后染色。所有切片PAS染色在同一条件下完成。
计算机辅助图像分析计算新骨形成面积:LuzexF型多功能图像分析仪通过颜色、密度的差别,区分出被观察物体内不同的组成成分,计算新骨形成的面积,进行精确的定量分析。为排除由于切片部位不同对新骨形成量的影响,采用以下公式进行校正:个体校正新骨面积=(个体实测新骨面积/个体实测腭中缝冠状面骨组织面积)×全部实测腭中缝冠状面骨组织面积的平均值。
1.5. 统计分析
采用SPSS 11.0软件进行统计分析。对数据进行正态性检验及方差齐性检验,正态分布、方差齐时,组间两两比较采用t检验,方差不齐时两两比较的秩和检验采用Nemenyi法。
2. 结果
2.1. 免疫组织化学法观察VEGF的表达
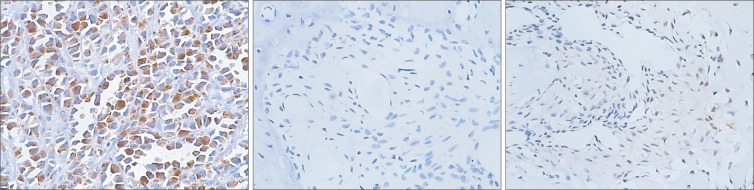
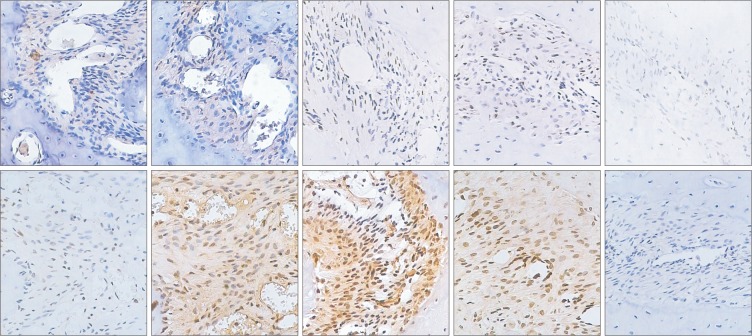
VEGF的蛋白表达分布情况见图1和2。阳性对照组染色结果表明抗体对VEGF蛋白的标记染色是有效的。对照0组的VEGF仅呈弱阳性表达。快速扩张第1周,对照组VEGF呈弱阳性表达,实验组阳性染色主要定位于血管内皮细胞和未分化的间充质细胞胞浆中;快速扩张第2周,对照组VEGF呈弱阳性表达,实验组大量增殖的未分化的间充质细胞胞浆、成骨样细胞胞浆和血管内皮细胞胞浆呈强阳性染色;固定第1周,对照组VEGF仅呈弱阳性表达,实验组成骨细胞VEGF强阳性,阳性信号主要定位于成骨细胞和血管内皮细胞胞浆;固定第2周,对照组VEGF呈弱阳性表达,实验组阳性信号仍主要定位于成骨细胞及血管内皮细胞胞浆;固定第4周,对照组和实验组VEGF在成熟骨小梁周围的成骨细胞胞浆中仅有微弱表达。图1和2表明,快速扩张的腭中缝可见高水平的VEGF表达,VEGF阳性信号主要定位于血管内皮细胞胞浆和增殖活跃的成骨细胞胞浆,对照组VEGF均呈弱阳性表达。
图 1. VEGF的表达 免疫组织化学 × 20.
Fig 1 Expression of VEGF immunohistochemistry × 20
图 2. VEGF的表达 免疫组织化学 × 20.
Fig 2 Expression of VEGF immunohistochemistry × 20
上:对照组;下:实验组。从左到右依次为:快速扩张第1周、快速扩张第2周、固定第1周、固定第2周、固定第4周。
各组不同时间VEGF蛋白的表达变化见表1。实验组与对照组VEGF的OD值比较表明,实验组快速扩张第1周、快速扩张第2周、固定第1周、固定第2周VEGF蛋白表达量均高于对照组。对照组在快速扩张第2周时表达最高,然后逐渐下降。实验组在快速扩张第2周至固定第2周VEGF表达均保持在高水平,VEGF表达变化趋势为,随着机械应力快速扩张,VEGF蛋白表达量逐渐上升,固定1周时达峰值,然后逐渐下降,固定第4周时表达水平接近于对照组。
表 1. 各组不同时间VEGF蛋白表达的OD值.
Tab 1 OD value of the expression of VEGF in each group at different time
| 时间 | 对照组 | 实验组 |
| 对照0组 | 15.895 5±0.235 3 | - |
| 快速扩张第1周 | 16.627 3±0.462 4 | 28.262 9±0.491 3* |
| 快速扩张第2周 | 18.931 0±0.166 8 | 34.935 1±0.572 6* |
| 固定第1周 | 16.731 3±0.170 6 | 46.095 7±0.703 4* |
| 固定第2周 | 16.331 2±0.205 4 | 28.076 1±0.535 3* |
| 固定第4周 | 15.563 6±0.292 3 | 17.078 5±0.176 7 |
注:与对照组比较,*P<0.01。
2.2. PAS染色法观测新骨形成
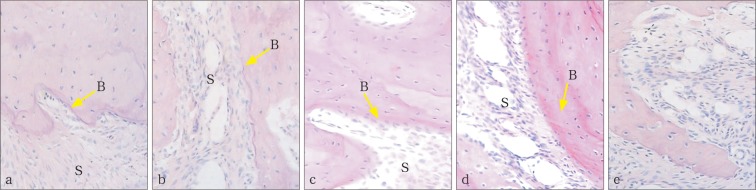
PAS染色可见,新骨被染成明显的紫红色,实验组新骨形成沉积比对照组更明显(图3)。实验组新骨形成的量均高于对照组(P<0.05),随着机械应力快速扩张,新骨形成的量逐渐上升,固定2周达峰值后逐渐下降,对照组新骨形成的量保持在相近的水平(表2)。
图 3. 新骨形成 PAS染色 × 20.
Fig 3 New bone formation PAS staining × 20
a:对照组快速扩张第2周;b:对照组固定第2周;c:实验组快速扩张第2周;d:实验组固定第2周;e:阴性对照组。B:骨组织;S:腭中缝;黄色箭头所指为新生骨组织。
表 2. 各组不同时间新骨形成的量.
Tab 2 Amount of new bone formation in each group at different time
| 时间 | 对照组 | 实验组 |
| 对照0组 | 0.032 5±0.000 7 | - |
| 快速扩张第1周 | 0.033 2±0.001 0 | 0.037 9±0.000 8* |
| 快速扩张第2周 | 0.033 5±0.000 7 | 0.048 3±0.000 8* |
| 固定第1周 | 0.036 0±0.000 9 | 0.058 6±0.001 0** |
| 固定第2周 | 0.032 4±0.000 9 | 0.073 1±0.000 9** |
| 固定第4周 | 0.031 9±0.001 5 | 0.044 9±0.000 3** |
注:与对照组比较,*P<0.05,**P<0.01。
mm2
3. 讨论
本研究免疫组织化学方法检测VEGF在腭中缝组织中的分布和表达变化的情况,采用PAS染色法观测新骨形成,来探讨VEGF在上颌快速扩张腭中缝牵张成骨中的生物学意义。
上颌快速扩张腭中缝牵张成骨的方式为膜内成骨,在腭中缝骨边缘部位血管增生,间充质细胞密集并分化为骨原细胞,其中部分骨原细胞成为成骨细胞,并且分泌出细胞间质的有机成分,形成类骨质,此过程为新骨形成。此时骨细胞间质(又称骨基质)的有机成分中富含有糖-蛋白质复合物[6],经过碘酸的氧化,再与染色剂结合,能够清楚地显示为红色,所以PAS染色法[5]可用来显示新骨形成。
近年来关于血管生成在骨生长发育和修复再生中的意义越来越受到重视,现已证实新生血管的长入是骨发育、修复再生的必需过程[7],骨组织重建或适应性增生依赖于新生毛细血管的快速形成与分布,新生血管形成对新骨形成起了关键作用[8]–[9]。
机械力调节骨缝生长如前方牵引施加矫形力于上颌颌周骨缝和上颌快速扩张腭中缝等,是经过一系列复杂的细胞和分子生物学行为完成的,涉及到诸如血管生成、间质细胞分化迁移、细胞外基质合成和矿化及骨改建等多个生理过程,且都由许多生长因子通过分子信号转导途径精细调节[10]。在矫形扩大骨缝组织的改建中,血管生成和骨生成是协调进行和相互影响的,新形成的血管促进新骨的形成,在新骨形成之前,首先发生的是血管的侵袭,新骨发生在新生的血管附近,血管转运骨祖细胞,分泌分裂原始成骨细胞,并提供养分和氧气[11]。VEGF则是血管生长的重要调节因子。VEGF是一种多功能的细胞因子,具有增加微血管通透性和促进血管内皮细胞增殖、迁移,诱导血管生成的作用[12]。VEGF还参与骨形成与代谢,Nakagawa等[13]研究表明阻断内源性VEGF的活性,骨形成与骨吸收就停止。VEGF可通过自分泌、旁分泌作用于成骨细胞和破骨细胞,在调节血管生成的同时,对骨组织的再生、修复发挥非常重要的作用。关于VEGF在上颌快速扩张腭中缝组织中的表达模式及作用尚不清楚。
本研究结果显示,实验组新骨形成的量均高于对照组,同时机械力刺激可以导致内源性VEGF的生成增加,实验组VEGF的表达水平显著高于对照组。在实验组中随着机械应力快速扩张,VEGF蛋白的表达量逐渐上升,第3周即固定第1周达峰值后逐渐下降。新骨形成则是从快速扩张第1周到固定第1周逐渐增加,在VEGF最高水平表达的1周后即固定第2周达峰值。牵张成骨过程中VEGF的显著表达同时伴随着新骨形成的增加,可见快速扩张兔腭中缝牵张成骨过程中VEGF的表达同新骨的形成呈正相关性。体外实验证实VEGF对培养的成骨细胞有促进趋化和增生的作用[14],成骨细胞本身可表达VEGF,成骨细胞本身也表达其受体Flt-1和Flk-1[15]。VEGF既能以旁分泌,又能以自分泌作用方式调节成骨细胞功能。本研究中观察到在扩张第2周及固定第1、2周时成骨细胞VEGF染色强阳性,表明VEGF参与了快速扩张力作用下腭中缝组织的成骨调控活动。
实验组腭中缝组织中VEGF呈高水平表达,除定位于血管内皮细胞,还定位于增殖活跃的间充质细胞、成骨细胞。VEGF的分布广泛,表明其可能更多地参与和调节牵张成骨各个时期的细胞生物学行为。本研究组织学观察显示成骨细胞和血管床的内皮细胞紧密相邻,实验组腭中缝组织成骨细胞和血管内皮细胞VEGF染色强阳性,说明成骨和血管化是不可分割的。成骨细胞在缺氧的条件下分泌VEGF,VEGF有促进内皮细胞增殖和保护内皮细胞的作用,而内皮细胞又能合成分泌一系列可溶性调节因子,这些因子具有控制成骨细胞募集、增殖及分化等作用。成骨细胞和内皮细胞相互作用,促进血管化,带来养分和新的成骨细胞,完成骨组织的修复重建工作。
本研究结果提示VEGF在上颌快速扩张机械-生物信号传递以及细胞应答过程中扮演重要的角色。VEGF功能与新骨形成密切相关。也许可在施加扩张力后的腭中缝组织中,通过组织工程学技术局部施加外源性VEGF,或者通过基因技术使腭中缝组织的成骨细胞持续、稳定表达VEGF,以此来增强腭中缝组织的血管生成作用及骨缝改建中的成骨活动,促进大量新骨形成,提高矫治疗效的稳定性。
Funding Statement
[基金项目] 江苏省自然科学基金资助项目(BK20141440);江苏高校优势学科建设工程基金资助项目(2014-37)
References
- 1.Sawada M, Shimizu N. Stimulation of bone formation in the expanding mid-palatal suture by transforming growth factor-beta 1 in the rat[J] Eur J Orthod. 1996;18(2):169–179. doi: 10.1093/ejo/18.2.169. [DOI] [PubMed] [Google Scholar]
- 2.Pacicca DM, Patel N, Lee C, et al. Expression of angiogenic factors during distraction osteogenesis[J] Bone. 2003;33(6):889–898. doi: 10.1016/j.bone.2003.06.002. [DOI] [PubMed] [Google Scholar]
- 3.Portal-Núñez S, Lozano D, Esbrit P. Role of angiogenesis on bone formation[J] Histol Histopathol. 2012;27(5):559–566. doi: 10.14670/HH-27.559. [DOI] [PubMed] [Google Scholar]
- 4.张 卫兵, 马 俊青, 王 林. 上颌快速扩大兔腭中缝组织改建的连续组织学研究[J] 现代口腔医学杂志. 2006;20(6):628–631. [Google Scholar]
- 5.李 甘地. 组织病理技术[M] 北京: 人民卫生出版社; 2002. pp. 56–79. [Google Scholar]
- 6.席 越. 骨组织病理解剖学技术[M] 北京: 人民卫生出版社; 1997. pp. 77–120. [Google Scholar]
- 7.Eshkar-Oren I, Viukov SV, Salameh S, et al. The forming limb skeleton serves as a signaling center for limb vasculature patterning via regulation of Vegf[J] Development. 2009;136(8):1263–1272. doi: 10.1242/dev.034199. [DOI] [PubMed] [Google Scholar]
- 8.Brandi ML, Collin-Osdoby P. Vascular biology and the skeleton[J] J Bone Miner Res. 2006;21(2):183–192. doi: 10.1359/JBMR.050917. [DOI] [PubMed] [Google Scholar]
- 9.Clarkin CE, Gerstenfeld LC. VEGF and bone cell signalling: an essential vessel for communication[J] Cell Biochem Funct. 2013;31(1):1–11. doi: 10.1002/cbf.2911. [DOI] [PubMed] [Google Scholar]
- 10.Mao JJ, Nah HD. Growth and development: hereditary and mechanical modulations[J] Am J Orthod Dentofacial Orthop. 2004;125(6):676–689. doi: 10.1016/j.ajodo.2003.08.024. [DOI] [PubMed] [Google Scholar]
- 11.Kanczler JM, Oreffo RO. Osteogenesis and angiogenesis: the potential for engineering bone[J] Eur Cell Mater. 2008;15:100–114. doi: 10.22203/ecm.v015a08. [DOI] [PubMed] [Google Scholar]
- 12.Holmes SB, Lloyd T, Coghlan KM, et al. Distraction osteogenesis of the mandible in the previously irradiated patient[J] J Oral Maxillofac Surg. 2002;60(3):305–309. doi: 10.1053/joms.2002.30581. [DOI] [PubMed] [Google Scholar]
- 13.Nakagawa M, Kaneda T, Arakawa T, et al. Vascular endothelial growth factor (VEGF) directly enhances osteoclastic bone resorption and survival of mature osteoclasts[J] FEBS Lett. 2000;473(2):161–164. doi: 10.1016/s0014-5793(00)01520-9. [DOI] [PubMed] [Google Scholar]
- 14.Mayr-Wohlfart U, Waltenberger J, Hausser H, et al. Vascular endothelial growth factor stimulates chemotactic migration of primary human osteoblasts[J] Bone. 2002;30(3):472–477. doi: 10.1016/s8756-3282(01)00690-1. [DOI] [PubMed] [Google Scholar]
- 15.Deckers MM, Karperien M, van der Bent C, et al. Expression of vascular endothelial growth factors and their receptors during osteoblast differentiation[J] Endocrinology. 2000;141(5):1667–1674. doi: 10.1210/endo.141.5.7458. [DOI] [PubMed] [Google Scholar]