Abstract
目的
研究过量氟对体外培养大鼠成釉细胞内钙超载及细胞凋亡的影响。
方法
取大鼠成釉细胞系HAT-7细胞,分别加入不同浓度(0、0.4、0.8、1.6、3.2、6.4 mmol·L−1)的氟化钠培养液,培养48 h后,采用Cell Counting Kit 8(CCK-8)试剂盒检测各组细胞的活性,流式细胞术分析氟对细胞凋亡的影响,激光扫描共聚焦显微镜、Western blot试验和实时荧光定量聚合酶链反应技术检测过量氟诱导大鼠成釉细胞内Ca2+浓度和钙网蛋白表达的变化。
结果
氟化钠浓度高于1.6 mmol·L−1时,可抑制成釉细胞的活性,成釉细胞内Ca2+浓度升高,钙网蛋白表达上调,细胞早期凋亡数量增加,并且随着浓度的增加,细胞凋亡的数量也随之增加。
结论
过量氟可引起成釉细胞内钙超载,诱导成釉细胞凋亡。
Keywords: 氟, 成釉细胞, 钙超载, 钙网蛋白, 细胞凋亡
Abstract
Objective
To study the effect of excessive fluoride on calcium overload and apoptosis in cultured rat ameloblasts in vitro.
Methods
Logarithmic-phase ameloblasts (HAT-7) were treated with 0, 0.4, 0.8, 1.6, 3.2, and 6.4 mmol·L−1 sodium fluoride (NaF) solution. Cell activities were detected by using a Cell Counting Kit 8 (CCK-8) assay after 48 h of treatment. The effect of fluoride on cell apoptosis was analyzed by using flow cytometry. Excessive fluoride-induced calcium concentration and calreticulin expression changes in ameloblasts were detected by using laser scanning confocal microscopy, Western blot analysis, and real-time quantitative polymerase chain reaction.
Results
NaF inhibited ameloblast activity at 1.6, 3.2, and 6.4 mmol·L−1 (dose-dependent) after 48 h of induction. The Ca2+ fluorescence intensity of HAT-7 cells incubated with 1.6 and 3.2 mmol·L−1 NaF was higher than that in the control group. The fluoride-induced early-stage apoptosis of ameloblasts after 48 h of induction and the early-stage apoptosis rate was positively correlated with fluoride concentration. Calreticulin mRNA expression in HAT-7 cells was higher than that in the control group after 48 h of incubation with 0.8, 1.2, and 1.6 mmol·L−1 NaF.
Conclusion
Excessive fluoride-induced calcium overload in ameloblasts and further caused endoplasmic reticulum stress-mediated apoptosis.
Keywords: fluoride, ameloblasts, calcium overload, calreticulin, apoptosis
氟是一种具有防龋功能的微量元素,但在牙齿的发育矿化时期,若机体摄入过量的氟会引起一种特殊的釉质发育不全,称为氟牙症。氟牙症的发病机制还未完全明确。有学者认为,地方性慢性氟中毒性疾病属于“钙矛盾”疾病[1],即整个机体缺钙,但细胞内Ca2+增多。Ca2+参与和调控多种细胞和组织的生理活动,包括肌肉收缩、新陈代谢以及细胞分裂等[2]–[3]。但是,若细胞内Ca2+浓度过高,可引起细胞凋亡,导致一些疾病的发生[4]–[5]。成釉细胞是釉质形成的关键,过量氟摄入机体,是否会导致成釉细胞Ca2+内流增加,产生钙超载,诱导成釉细胞凋亡,目前还少有研究。本实验应用不同浓度的氟化钠作用于体外培养的成釉细胞系HAT-7细胞,观察氟化钠对成釉细胞内Ca2+的影响,检测细胞凋亡的变化,为进一步研究氟牙症的发病机制提供依据。
1. 材料和方法
1.1. 实验材料及主要仪器
大鼠成釉细胞系HAT-7(日本岩手大学赠送);DMEM/F12培养液(Thermo scientific公司,美国)。Annexin Ⅴ-FITC/PI凋亡检测试剂盒(eBioscience公司,美国);Fluo-3/AM Ca2+荧光探针(Dojindo公司,日本);Trizol试剂(Invitrogen公司,美国);GoTaq®1-Step RT-qPCR System(Promega公司,美国);正向和反向引物(TaKaRa公司,日本);Marker(Thermo公司,美国);兔抗钙网蛋白(calreticulin,CRT)单克隆抗体(1∶1 000,Abcam公司,英国);兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体(1∶1 000,Proteintech Group公司,美国)。
自动酶联检测仪(Tecan公司,奥地利);Cell Counting Kit 8(CCK-8)试剂盒(Dojindo公司,日本);流式细胞仪(BD Facscalibur公司,美国);激光扫描共聚焦显微镜(confocal laser scanning microscope,CLSM)(Olympus公司,日本);十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)仪(BioRad公司, 美国)。
1.2. 实验方法
1.2.1. 细胞培养
HAT-7细胞用含10%胎牛血清、50 U·mL−1青霉素和50 µg·mL−1链霉素的高糖DMEM/F12培养液,在37 °C、5%CO2条件下培养。培养48 h后,用光学显微镜观察细胞形态。
1.2.2. 氟对细胞活性的影响
将HAT-7细胞以每孔3×103个细胞的密度接种在 96 孔板中,于37 °C、5%CO2条件下培养24 h后,分别加入终浓度为0、0.4、0.8、1.6、3.2和 6.4 mmol·L−1的氟化钠,培养 48 h后,每孔加入10 µL CCK-8溶液,继续培养2 h,利用自动酶联检测仪在450 nm 波长下测定各孔的光密度(optical density,OD)值,并绘制细胞生长曲线。所有实验重复3次。
1.2.3. CLSM观察细胞内Ca2+荧光强度
将HAT-7细胞以每孔3×103个细胞的密度接种于共聚焦培养皿中,于37 °C、5%CO2条件下培养24 h后,分别加入终浓度为0、1.6和3.2 mmol·L−1的氟化钠,培养48 h后,PBS漂洗细胞2次,加入浓度为5 µmol·L−1的Fluo-3/AM Ca2+荧光探针孵育60 min,PBS冲洗2次后用PBS孵育细胞30 min,置于CLSM下观察,激发波长为488 nm,发射波长为525 nm。通过计算机系统自动记录HAT-7细胞内Ca2+的荧光强度。
1.2.4. 流式细胞术检测成釉细胞的凋亡
采用终浓度为0、1.6、3.2 mmol·L−1的氟化钠孵育成釉细胞48 h以后,消化细胞,1 000 r·min−1离心5 min,重悬于100 µL Buffer缓冲液中。加入5 µL Annexin Ⅴ异硫氰酸荧光素(fluorescein isothiocyanate,FITC)混匀后,加入5 µL碘化丙啶(propidium iodide,PI)进行染色,室温下避光反应30 min后,通过流式细胞仪检测细胞凋亡率。每组均设2个复孔,实验步骤重复3次。
1.2.5. Western blot检测HAT-7细胞中CRT蛋白的表达
取对数期生长的HAT-7细胞,加入终浓度为0、0.8、1.2、1.6 mmol·L−1的氟化钠培养液,培养48 h后收集细胞,加入RIPA Lysis Buffer,冰上裂解、离心、收集上清,用BCA法检测蛋白质浓度,具体步骤为:取细胞总蛋白50 µg,上样量20 µL,Marker 5 µL,制备10%的分离胶进行SDS-PAGE,转膜;用含有5%脱脂奶粉的PBS溶液室温封闭1 h,然后用PBST溶液洗涤3次,分别加入兔抗CRT单克隆抗体和兔抗GAPDH抗体,冰上摇床孵育1 h后,将膜洗涤3次后封闭在近红外标记的二抗中,避光条件下冰上孵育1 h;然后用PBST冲洗,置于双色红外激光成像系统成像后使用Image Studio Ver 3.1软件进行分析。
1.2.6. 实时荧光定量聚合酶链反应(real-time quantitative polymerase chain reaction,real-time qPCR)技术检测HAT-7细胞中CRT mRNA的表达
用终浓度为0、0.8、1.2、1.6 mmol·L−1的氟化钠孵育HAT-7细胞48 h,采用Trizol试剂提取总RNA,通过酶标仪测定吸光度比值A260/A280以检测RNA浓度和纯度。使用GoTaq®1-Step RT-qPCR System进行real-time qPCR,终体积为20 µL,含10 µL GoTaq® qPCR Master Mix、正向和反向引物各2 µL、GoScript™ 0.4 µL、RNA 4 µL。首先42 °C反转录15 min,95 °C 10 min,然后进行变性步骤,95 °C 10 s,40个循环,退火温度30 s,72 °C 30 s,40个循环。解离条件:95 °C 15 s,60 °C 15 s,95 °C 15 s,60 °C 15 s。引物序列和退火温度见表1。以β-actin作为内参。实验结果采用ΔΔCT法表述。以上所有实验重复3次。
表 1. 引物序列和退火温度.
Tab 1 Primer sequences and annealing temperatures
| 引物名称 | 引物序列(5′—3′) | 退火温度/°C |
| CRT | F:GGACATGCATGGAGACTCAGAATA | 57 |
| R:CAGCACGTTCTTGCCCTTGTA | ||
| β-actin | F:GGAGATTACTGCCCTGGCTCCTA | 60 |
| R:GACTCATCGTACTCCTGCTTGCTG |
1.3. 统计学处理
采用SPSS 13.0软件完成统计学处理,统计方法采用单因素方差分析(ANOVA),检验水准为双侧α=0.05。采用GraphPad Prism 5软件作图。
2. 结果
2.1. HAT-7细胞的形态学观察
显微镜下可见成釉细胞呈多角形,呈铺路石样生长,细胞间连接紧密,细胞核明显(图1)。
图 1. HAT-7细胞的形态 光学显微镜 × 20.
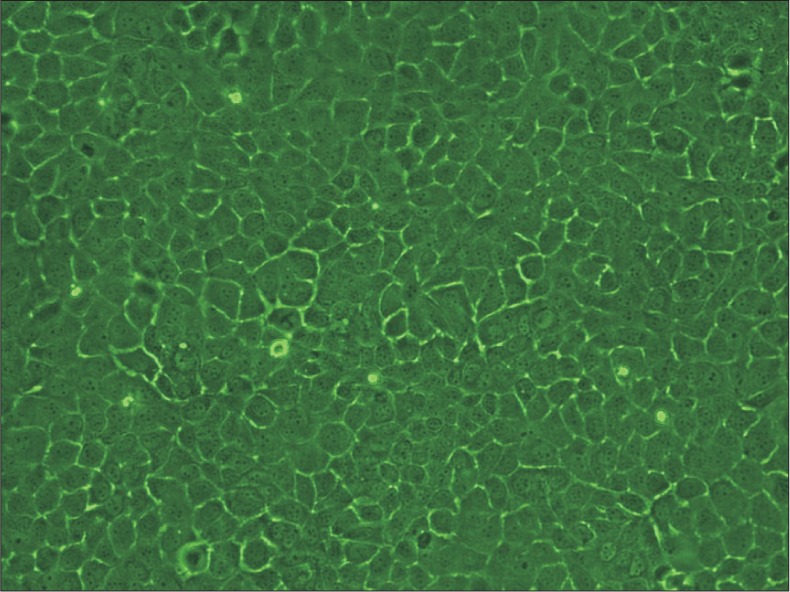
Fig 1 Morphology of HAT-7 cells light microscope × 20
2.2. 氟对HAT-7细胞活性的影响
不同浓度的氟化钠孵育HAT-7细胞48 h后,细胞生长曲线见图2:浓度为0.4、0.8 mmol·L−1的氟化钠对HAT-7细胞的增殖有促进作用(P<0.05);而氟化钠浓度为1.6、3.2和6.4 mmol·L−1时,对HAT-7细胞的增殖有抑制作用(P<0.05)。
图 2. 不同浓度的氟化钠作用48 h后HAT-7细胞的OD值.
Fig 2 OD values of HAT-7 cells incubated with different concentrations of NaF
2.3. 氟对HAT-7细胞内的Ca2+荧光强度的影响
不同浓度的氟诱导HAT-7细胞48 h后的CLSM观察结果见图3:HAT-7细胞经1.6、3.2 mmol·L−1氟化钠孵育后,细胞内绿色荧光明显多于对照组。对照组和1.6、3.2 mmol·L−1氟化钠组的平均荧光强度分别为10.5、18.2、35.6,经统计学分析,氟化钠诱导组细胞的平均荧光强度明显高于对照组(P<0.05),且氟化钠浓度越高,Ca2+绿色荧光的强度也越高。
图 3. HAT-7细胞经不同浓度氟化钠作用后的Ca2+荧光观察 CLSM × 20.
Fig 3 Ca2+ fluorescence observation of HAT-7 cells incubated with different concentrations of NaF CLSM × 20
A:对照组;B:1.6 mmol·L−1氟化钠组;C:3.2 mmol·L−1氟化钠组;绿色荧光为Ca2+。
2.4. 氟对HAT-7细胞凋亡的影响
流式细胞仪检测结果见图4:对照组细胞的凋亡率为3.37%;当氟化钠浓度为1.6 mmol·L−1时,可诱导细胞产生早期凋亡,凋亡率为8.82%;当氟化钠浓度增加到3.2 mmol·L−1时,细胞的早期凋亡率增加到12.21%。这提示氟作用成釉细胞48 h后可诱导成釉细胞的早期凋亡,并且细胞早期凋亡率与氟浓度呈正相关。
图 4. 流式细胞术检测不同浓度的氟化钠引起的HAT-7细胞凋亡.
Fig 4 HAT-7 cell apoptosis induced by different concentrations of NaF was detected using flow cytometry
左:对照组;中:1.6 mmol·L−1氟化钠组;右:3.2 mmol·L−1氟化钠组。左上象限为破碎或损伤细胞,左下象限为活细胞,右上象限为晚期凋亡细胞,右下象限为早期凋亡细胞。横坐标为Annexin-Ⅴ FITC荧光强度,纵坐标为PI荧光强度。
2.5. 氟对HAT-7细胞中CRT蛋白表达的影响
HAT-7细胞在含有不同浓度氟化钠(0、0.8、1.2、1.6 mmol·L−1)的培养液中培养48 h后,CRT蛋白的Western blot检测结果见图5。图5上显示:不同浓度氟作用HAT-7细胞后,CRT蛋白的表达量发生改变;图5下显示:氟浓度为0.8 mmol·L−1时,CRT蛋白的相对表达量与对照组无明显差异;氟浓度达到1.2 mmol·L−1时,CRT蛋白表达量升高;氟浓度为1.6 mmol·L−1时的表达量最高。
图 5. HAT-7细胞经不同浓度氟化钠作用后CRT蛋白的表达量.
Fig 5 The effect of different concentrations of fluoride on protein expession of CRT
上:Western blot检测,图中A、B、C、D分别为0、0.8、1.2、1.6 mmol·L−1氟化钠组;下:CRT蛋白相对表达量。
2.6. 氟对HAT-7细胞中CRT mRNA表达的影响
real-time qPCR检测表明,HAT-7细胞经0.8、1.2、1.6 mmol·L−1 氟化钠作用48 h后,CRT mRNA的表达量分别为1.3、5.7、2.2,均高于对照组(1.0),其差异均有统计学意义(P<0.05)。
3. 讨论
釉质的发育过程是复杂并受到精确调节的动态过程[6]。成釉细胞负责调控釉质有机基质的合成、分泌和移除,同时也与钙盐的活跃转运有关。在本实验中,高浓度的氟化钠(1.6、3.2、6.4 mmol·L−1)培养HAT-7细胞48 h,成釉细胞开始凋亡,显著降低了细胞的活性。有研究[7]表明,氟化钠(100 ng·mL−1)可促进细胞膜Ca2+通道在短时间内(20 s)迅速开放,使人成骨细胞内Ca2+浓度迅速增高。在本实验中,经不同浓度氟化钠作用48 h后,HAT-7细胞内Ca2+浓度明显增加,并且Ca2+浓度增加与氟化钠浓度呈正相关。Ca2+是细胞内的主要信使之一,在维持细胞的正常结构和功能方面起重要作用[8]。当一些有害因素引起钙平衡系统功能失调时,Ca2+分布紊乱,细胞内Ca2+浓度异常性升高,即为钙超载,此时可引起细胞凋亡[9]–[10]。本研究结果提示,过量的氟可以引起HAT-7细胞发生钙超载,从而诱导细胞发生凋亡。
CRT是一种类凝集素蛋白,也是主要的Ca2+结合蛋白,可以通过调节自身Ca2+结合能力和肌浆网Ca2+泵的活性而调节Ca2+稳态[11]。目前对CRT在细胞凋亡中的作用尚存在争议。有学者[12]认为,过度表达的CRT引起细胞质内Ca2+反应性增强,诱导Ca2+依赖性蛋白磷酸酶(protein phosphatase 2A,PP2A)的表达和活性均上调,使蛋白激酶B(protein kinase B,PKB)去磷酸化,抑制PKB信号转导途径,使细胞对凋亡刺激的敏感性增加。有学者[13]–[14]应用大鼠心肌细胞进行研究,证明CRT过表达可促进内质网Ca2+释放及细胞外Ca2+内流,从而加重细胞质Ca2+超载,增加细胞对应激致凋亡的敏感性。与上述研究结论相反,Hung等[15]发现CRT过表达可以减轻H2O2对肾小管上皮细胞的损伤。本研究发现,0.8 mmol·L−1氟化钠培养HAT-7细胞48 h后,可促进细胞的增殖,CRT mRNA表达量升高;当氟化钠浓度为1.2 mmol·L−1时,CRT mRNA表达量最高;氟化钠浓度为1.6 mmol·L−1时,细胞发生早期凋亡。通过CRT的作用机制,笔者猜想,当CRT少量过表达时,可增加内质网Ca2+的缓冲能力和/或抑制过多Ca2+对细胞的毒性作用,发挥保护细胞的作用;但当CRT过表达时间过长或过多时,其保护细胞的作用将消失,转而诱导细胞的凋亡。同时本研究通过Western blot试验也发现,当氟化钠浓度为1.2、1.6 mmol·L−1时,CRT表达量增高,但氟化钠浓度为0.8 mmol·L−1时,CRT表达量与对照组没有明显差异,分析原因可能是由于在mRNA转录、修饰蛋白质的过程中,细胞内也发生其他蛋白质的调控,导致蛋白质合成的量与mRNA固有的量不相匹配。
综上所述,氟对成釉细胞的影响与氟浓度有关,过量的氟可通过诱导细胞发生Ca2+超载介导细胞凋亡。在Ca2+超载早期,CRT起到保护细胞的作用;当Ca2+超载过于严重或持续时间过长,CRT则会诱导细胞凋亡。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81072245);辽宁省自然科学基金资助项目(20102278)
References
- 1.Fujita T, Palmieri GM. Calcium paradox disease: calcium deficiency prompting secondary hyperparathyroidism and cellular calcium overload[J] J Bone Miner Metab. 2000;18(3):109–125. doi: 10.1007/s007740050101. [DOI] [PubMed] [Google Scholar]
- 2.Chang DC, Meng C. A localized elevation of cytosolic free calcium is associated with cytokinesis in the zebrafish embryo[J] J Cell Biol. 1995;131(6 Pt 1):1539–1545. doi: 10.1083/jcb.131.6.1539. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Xu N, Luo KQ, Chang DC. Ca2+ signal blockers can inhibit M/A transition in mammalian cells by interfering with the spindle checkpoint[J] Biochem Biophys Res Commun. 2003;306(3):737–745. doi: 10.1016/s0006-291x(03)01061-1. [DOI] [PubMed] [Google Scholar]
- 4.Thibault O, Gant JC, Landfield PW. Expansion of the calcium hypothesis of brain aging and Alzheimer's disease: minding the store[J] Aging Cell. 2007;6(3):307–317. doi: 10.1111/j.1474-9726.2007.00295.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Gerasimenko JV, Gerasimenko OV, Petersen OH. The role of Ca2+ in the pathophysiology of pancreatitis[J] J Physiol:Lond. 2014;592(Pt 2):269–280. doi: 10.1113/jphysiol.2013.261784. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Stephanopoulos G, Garefalaki ME, Lyroudia K. Genes and related proteins involved in amelogenesis imperfecta[J] J Dent Res. 2005;84(12):1117–1126. doi: 10.1177/154405910508401206. [DOI] [PubMed] [Google Scholar]
- 7.Barry EL. Expression of mRNAs for the alpha 1 subunit of voltage-gated calcium channels in human osteoblast-like cell lines and in normal human osteoblasts[J] Calcif Tissue Int. 2000;66(2):145–150. doi: 10.1007/s002230010029. [DOI] [PubMed] [Google Scholar]
- 8.Szabó C, Salzman AL. Inhibition of terminal calcium overload protects against peroxynitrite-induced cellular injury in macrophages[J] Immunol Lett. 1996;51(3):163–167. doi: 10.1016/0165-2478(96)02568-0. [DOI] [PubMed] [Google Scholar]
- 9.Arnaudeau S, Frieden M, Nakamura K, et al. Calreticulin differentially modulates calcium uptake and release in the endoplasmic reticulum and mitochondria[J] J Biol Chem. 2002;277(48):46696–46705. doi: 10.1074/jbc.M202395200. [DOI] [PubMed] [Google Scholar]
- 10.Bernard-Marissal N, Moumen A, Sunyach C, et al. Reduced calreticulin levels link endoplasmic reticulum stress and Fastriggered cell death in motoneurons vulnerable to ALS[J] J Neurosci. 2012;32(14):4901–4912. doi: 10.1523/JNEUROSCI.5431-11.2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Arnaudeau S, Frieden M, Nakamura K, et al. Calreticulin differentially modulates calcium uptake and release in the endoplasmic reticulum and mitochondria[J] J Biol Chem. 2002;277(48):46696–46705. doi: 10.1074/jbc.M202395200. [DOI] [PubMed] [Google Scholar]
- 12.Kageyama K, Ihara Y, Goto S, et al. Overexpression of calreticulin modulates protein kinase B/Akt signaling to promote apoptosis during cardiac differentiation of cardiomyoblast H9c2 cells[J] J Biol Chem. 2002;277(22):19255–19264. doi: 10.1074/jbc.M112377200. [DOI] [PubMed] [Google Scholar]
- 13.马 林, 张 颖, 张 凯强, et al. 内质网应激诱导细胞凋亡的机制及其在氟斑牙形成中的作用[J] 中国实用口腔科杂志. 2013;6(6):379–382. [Google Scholar]
- 14.Ihara Y, Kageyama K, Kondo T. Overexpression of calreticulin sensitizes SERCA2a to oxidative stress[J] Biochem Biophys Res Commun. 2005;329(4):1343–1349. doi: 10.1016/j.bbrc.2005.02.112. [DOI] [PubMed] [Google Scholar]
- 15.Hung CC, Ichimura T, Stevens JL, et al. Protection of renal epithelial cells against oxidative injury by endoplasmic reticulum stress preconditioning is mediated by ERK1/2 activation[J] J Biol Chem. 2003;278(31):29317–29326. doi: 10.1074/jbc.M302368200. [DOI] [PubMed] [Google Scholar]






