Abstract
目的
通过腺病毒法建立稳定表达外源性人端粒酶反转录酶(hTERT)基因的牙周膜细胞系,以构建腺病毒介导的高效、稳定的hTERT牙周膜细胞系。
方法
聚合酶链反应(PCR)法扩增hTERT基因编码序列,构建同源重组腺病毒质粒pAd-pshuttle-cmv-hTERT,收集腺病毒颗粒后感染人牙周膜细胞,实时荧光定量PCR检测hTERT及成骨相关基因碱性磷酸酶、核心结合因子2、骨涎蛋白、骨钙素、骨桥素、Ⅰ型胶原蛋白mRNA的表达水平,茜素红染色观察成骨分化能力,CCK-8检测细胞增殖能力。
结果
成功构建了含hTERT基因的腺病毒颗粒并感染牙周膜细胞,感染细胞与正常牙周膜细胞形态相似;实时荧光定量PCR结果显示hTERT及成骨相关基因在感染细胞中高表达;茜素红染色显示牙周膜细胞系成骨能力强;CCK-8结果示牙周膜细胞系增殖能力强。
结论
通过腺病毒法成功建立了过表达hTERT的人牙周膜细胞系,其具有较强的成骨分化能力,这为研究牙周膜再生机制提供了一个理想的细胞系。
Keywords: 牙周膜细胞, 人端粒酶反转录酶, 腺病毒, 稳定表达, 成骨分化
Abstract
Objective
This study aims to establish an effective and stable periodontal ligament cell line stably expressing human telomerase reverse transcriptase (hTERT) gene by using the adenovirus method.
Methods
Polymerase chain reaction (PCR) was used to amplify the full length of hTERT gene to construct recombinant adenovirus plasmid pAd-pshuttle-cmv-hTERT. Packaged adenovirus particles were used for infection of human periodontal ligament cells. The expression levels of hTERT and osteogenic genes, such as alkaline phosphatase, Runt-related transcription factor 2, bone sialoprotein, osteocalcin, osteopontin, and collagen Ⅰ mRNA, were detected by quantitative real-time PCR (qRT-PCR). The ability of osteogenic differentiation was observed by alizarin red staining, and the cell proliferation was determined by CCK-8.
Results
Adenovirus particles containing the hTERT gene were successfully constructed and infected with periodontal ligament cells. The infected cells were similar to normal periodontal ligament cells. The qRT-PCR results showed that hTERT and osteogenesis-associated genes were highly expressed in the periodontal ligament cell lines constructed by adenoviruses. Alizarin red staining showed that the periodontal ligament cell line had strong osteogenic differentiation capability. CCK-8 showed that the periodontal ligament cell line had strong proliferation capability.
Conclusion
The human periodontal ligament cell line with high efficiency and stable expression of hTERT was established by the adenovirus method, thereby providing an ideal cell line for studying the mechanism of periodontal regeneration.
Keywords: periodontal ligament cells, human telomerase reverse transcriptase, adenovirus, stable expression, osteogenesis
牙周膜是连接牙骨质和牙槽骨的结缔组织,牙周膜细胞(periodontal ligament cells,PDLCs)中有多种细胞群体,主要有成纤维细胞、成牙骨质细胞、造骨细胞、内皮细胞、Malaseez上皮细胞、破骨细胞等。近年来的研究[1]–[2]发现,PDLCs中有类似间充质干细胞(mesenchymal stem cells,MSCs)功能的细胞,能在体外分化为成骨细胞、脂肪细胞及神经样细胞,使牙周组织的再生成为可能,遗憾的是牙周膜的再生机制尚不明晰。牙周膜的再生研究方面,主要受限于原代PDLCs的传代培养会降低细胞的分化潜能,并失去原代特性,比如不同代数牙周膜的成骨分化能力差异非常大[3]。所以建立与原代PDLCs表型和生长特性相同、并能稳定传代的PDLCs细胞系,为牙周膜再生机制的研究提供细胞平台,具有着重大的意义。
构建保留原代细胞特征的稳定的人PDLCs细胞系存在诸多难点。Kamata等[4]通过共转染人端粒酶反转录酶(human telomerase reverse transcriptase,hTERT)和人乳头状瘤细胞病毒16成功构建了人PDLCs系,但这些细胞失去了钙化潜能。本课题组在前期研究中发现,通过导入各种抑癌基因以期构建稳定的细胞系时,细胞的形态、生长状态都可能发生改变。hTERT是细胞内的正常基因,诱导端粒长度伸长并延伸体细胞的复制寿命,相对于传统的永生化基因,端粒酶转染建立的细胞系是正常细胞而非转化细胞,具有正常的核型和生长速度[5]。
研究[6]表明,通过慢病毒过表达hTERT可以构建PDLCs细胞系,但hTERT基因片段大,重组病毒的滴度不高,表达hTERT效率低,效果不理想。重组腺病毒是比较高效和可靠的重组病毒表达系统之一,其病毒滴度高,可以更有效地介导hTERT的表达。因此,本研究目的是通过腺病毒介导过表达hTERT建立稳定的PDLCs细胞系,探索构建与原代PDLCs相同的PDLCs细胞系的高效、简便的方法,为牙周膜再生机制的研究提供细胞平台,同时也为牙周病的治疗奠定一定的研究基础。
1. 材料和方法
1.1. 主要试剂
Rochel反转录试剂盒(Rochel公司,美国),Platinum Pfx DNA Polymerase高保真DNA聚合酶(Invitrogen公司,美国),限制性内切酶(New England Biolab公司,美国),GeneJet聚合酶链反应(polymerase chain reaction,PCR)纯化、胶回收试剂盒(Thermo Scientific™公司,美国),质粒小量提取试剂盒(OMEGA公司,美国),RNeasy Mini Kit试剂盒(Qiagen公司,德国),FuGENE6 Transfection Reagen转染试剂盒(Promega公司,美国),α-MEM、胎牛血清(fetal bovine serum)(Gibco公司,美国),BJ5183感受态(北京华越洋生物科技有限公司),质粒pAd-Easy-1和质粒pshuttlecmv(Agilent Technologies,美国),上下游引物合成及DNA测序由北京华大基因公司完成,CCK-8试剂(东仁化学科技上海有限公司)。
1.2. 人正常PDLCs的分离和培养
本研究由兰州大学伦理委员会审批。在患者知情同意下,选取兰州大学口腔医院正畸减数拔牙患者上颌第一前磨牙,PBS冲洗5遍,刮取根中1/3牙周膜,Ⅱ型胶原酶及dispase酶混合液于37 °C温箱中消化30 min,每10 min震荡1次。800 r·min-1离心5 min,弃上清,PBS吹打冲洗3遍,α-MEM培养液培养,7 d后见细胞贴壁。
1.3. 腺病毒颗粒获得
1.3.1. pshuttle-cmv-hTERT穿梭质粒的构建
根据NCBI(NM_198253.2)hTERT基因cDNA序列设计引物,上游引物:5′-CTAGGGTACCATGCCGCGCGCTCCCCGCT-3′;下游引物:5′-CTAGAAGCTTTCAGTCCAGGATGGTCTTGAAGTCT-3′。其中在上游引物添加了HindⅢ酶切位点及保护碱基,在下游引物添加了KpnⅠ酶切位点及保护碱基。参照高保真DNA聚合酶Platinum Pfx DNA Polymerase说明书,PCR特异性扩增hTERT基因编码序列。1%琼脂糖凝胶电泳分析结果,得到大小约为3.3 kb条带。限制性内切酶HindⅢ及KpnⅠ双酶切hTERT和质粒pshuttle-cmv,酶切产物胶回收,T4连接酶连接,连接产物转化Trans-T1感受态细胞,使用质粒小量提取试剂盒说明书抽提质粒,用PmeⅠ酶切鉴定,将鉴定为阳性的质粒送北京华大基因公司测序。
1.3.2. BJ5183/p超级感受态的制备
热激法将质粒pAd-Easy-1转化BJ5183感受态,涂氨苄霉素琼脂板,12 h后挑取单克隆,采用Inoue方法制备含pAd-Easy-1的BJ5183超级感受态,命名为BJ5183/p。
1.3.3. 同源重组腺病毒质粒pAd-pshuttle-cmv-hTERT的构建
用PmeⅠ酶切pshuttle-cmv-hTERT质粒使其线性化,热激法转化超级感受态BJ5183/p,涂氨苄抗性琼脂板,12 h后挑取10个菌落较小的单克隆,扩大培养,使用质粒小量提取试剂盒说明书抽提质粒,PacⅠ酶切鉴定,将重组成功质粒命名为pAd-pshuttle-cmv-hTERT,扩增。
1.3.4. 腺病毒颗粒收集
将生长状态好的293细胞按1︰3传代,第2天细胞生长达50%时按照FuGENE6 Transfection Reagen转染试剂盒说明书将重组质粒转染293细胞,7 d后将细胞及上清反复冻融3次后离心,收集上清,再感染293细胞,7 d后收集细胞上清,0.22 µm滤器过滤,分装冻存于-80 °C冰箱。
1.4. 腺病毒颗粒感染PDLCs
PDLCs传至第6代时,用腺病毒颗粒感染细胞。稳定传代后命名为PDL-PAD细胞。
1.5. 实时荧光定量PCR(quantitative real-time PCR,qRT-PCR)检测hTERT的表达
分别提取第6代PDLCs细胞、第15代PDL-PAD细胞及第35代PDL-PAD细胞RNA,按反转录试剂盒说明书反转录为cDNA。基因引物设计如下。hTERT:上游引物5′-TCTGGGATGCGAACGGGC-3′,下游引物5′-TCCGGCTCAGGGGCAGC-3′;GAPDH:上游引物5′-GGAGTCCACTGGCGTCTTC-3′;下游引物5′-GCTGATGATCTTGAGGCTGTTG-3′。按照Thermo Scientific DyNAmo Flash SYBR Green qPCR Kit试剂盒说明书进行qPCR扩增,以第6代PDLCs细胞组为对照组,每个基因4个重复,其相对表达量均以GAPDH的量作为内参照,基因相对定量采用2-ΔΔCt法计算。
1.6. qRT-PCR检测成骨相关基因的表达
分别提取第6代PDLCs细胞、第35代PDL-PAD细胞RNA,按反转录试剂盒说明书反转录为cDNA。成骨相关基因碱性磷酸酶(alkaline phosphatase,ALP)、核心结合因子2(Runt-related transcription factor 2,Runx2)、骨涎蛋白(bone sialoprotein,BSP)、骨钙素(osteocalcin,OC)、骨桥素(osteopontin,OPN)、Ⅰ型胶原蛋白(collagenⅠ,COLⅠ)的引物设计见表1。按照Thermo Scientific DyNAmo Flash SYBR Green qPCR Kit 试剂盒说明书进行qPCR扩增,以第6代PDLCs细胞组为对照组。每个基因4个重复,其相对表达量均以GAPDH 的量作为内参照,基因相对定量采用2-ΔΔCt法计算。
表 1. 成骨相关基因qRT-PCR的引物序列.
Tab 1 Primer sequences of qRT-PCR for osteogenic related gene
| 基因名称 | 引物序列 |
| ALP | 上游:5′-TCTGGGATGCGAACGGGC-3′ |
| 下游:5′-TCCGGCTCAGGGGCAGC-3′ | |
| Runx2 | 上游:5′- CACTATCCAGCCACCTTTAC-3′ |
| 下游:5′-ATCAGCGTCAACATC-3′ | |
| BSP | 上游:5′-CATAGCCATCGTATCCTTGTCCT-3′ |
| 下游:5′-CTATGGAGAGGACGCCACGCCTGG-3′ | |
| OC | 上游:5′-GCAGAGTCCAGCAAAGGGTG-3′ |
| 下游:5′-GTCAGCAACTCGTCACAG-3′ | |
| OPN | 上游:5′-CCAAGTAAGTCCAACGAAAG-3′ |
| 下游:5′-GGTGATGTCCTCGTCTGTA-3′ | |
| COLⅠ | 上游:5′-AGGGCTCCAACGAGATCGAGATCCG-3′ |
| 下游:5′-TACAGGAAGCAGACAGGGCCAACGTCG-3′ |
1.7. 茜素红染色观察成骨分化能力
先配置含10 mmol·L-1 β-甘油磷酸钠、50 µmol·L-1抗坏血酸二磷酸盐,100 ηmol·L-1地塞米松的α-MEM成骨诱导液。将第6代PDLCs细胞、第35代PDL-PAD细胞接种于6孔板中,每个样本3个重复。用成骨诱导液培养,每3 d换液,培养21 d。弃培养液,PBS洗3次后,用无水乙醇固定15 min,pH为4.1的茜素红染液染色10 min。
1.8. CCK-8检测细胞增殖能力
分别将第7代PDLCs细胞、第35代PDL-PAD细胞以每孔1×104个的密度接种200 µL于96孔板,每种细胞3个重复组,分别于接种24、36、48 h时取一板细胞,各孔均加入20 µL CCK-8的培养液,在细胞培养箱孵育2 h,酶标仪在450 nm测定各孔吸光度(A)值。
2. 结果
2.1. hTERT重组质粒双酶切鉴定及测序
重组质粒pshuttle-cmv-hTERT经KpnⅠ和HindⅢ双酶切鉴定后,可在3 kb处得到一条亮带(图1),将测序结果与NCBI数据库hTERT(NM_198253.2)cDNA序列进行对比分析,与目的序列一致。这表明重组腺病毒载体质粒pshuttle-cmv-hTERT构建成功。
图 1. pshuttle-cmv-hTERT双酶切鉴定.
Fig 1 Identification of pshuttle-cmv-hTERT by enzyme digestion
M:Marker;1、2:KpnⅠ和Hind Ⅲ双酶切质粒。
2.2. 同源重组腺病毒质粒酶切鉴定
pAd-pshuttle-cmv-hTERT同源重组质粒经PacⅠ酶切后在4.5 kb可见一条亮带(图2),证明腺病毒质粒同源重组成功。
图 2. pAd-pshuttle-cmv-hTERT同源重组质粒PacⅠ酶切.
Fig 2 Identification of recombinant pAd-pshuttle-cmv-hTERT plasmids by enzyme digestion
M:Marker;1、2:同源重组质粒PacⅠ酶切;3、4:同源重组腺病毒质粒;5:pshuttle-cmv-hTERT质粒PacⅠ酶切。
2.3. 转染后细胞形态及表型
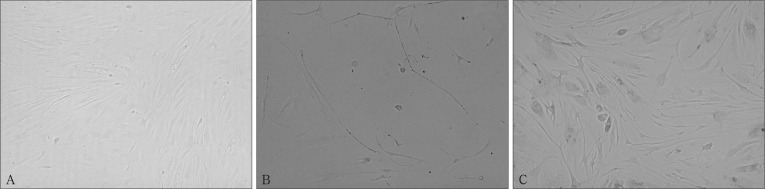
倒置相差显微镜下观察,转染hTERT后的PDLCs与正常PDLCs形态相似,为长梭形,呈典型的纤维细胞特征。未转染细胞和转染空载体后的细胞传15~16代后生长缓慢,逐渐死亡,而转染hTERT后的PDLCs生长迅速,增殖稳定(图3)。
图 3. 转染前后细胞形态 倒置相差显微镜 × 100.
Fig 3 Morphological characteristics of cells before and after transfection inverted phase contrast microscope × 100
A:正常PDLCs;B:传代至第16代PDLCs;C:转染hTERT后第35代PDLCs。
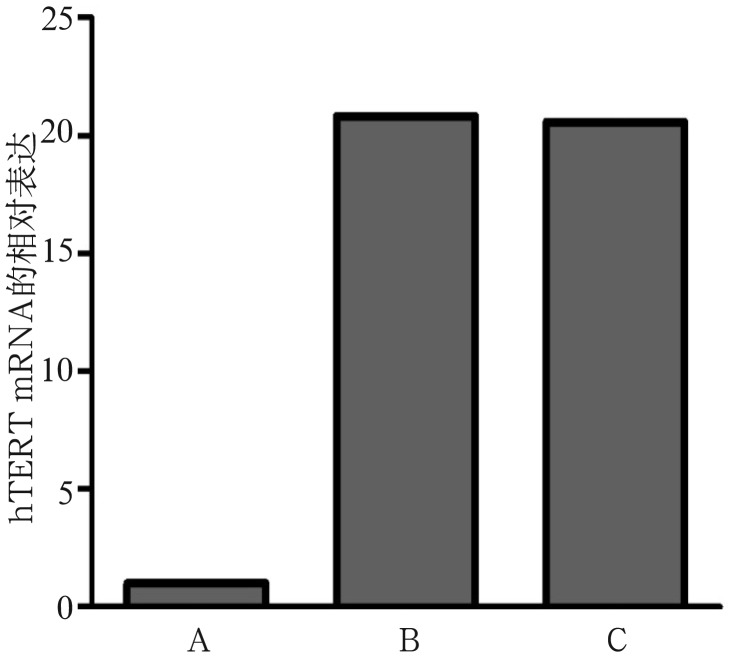
2.4. qRT-PCR检测转染后PDLCs中hTERT的相对表达
qRT-PCR结果显示,hTERTmRNA在PDL-PAD中高表达,其表达水平是PDLCS的15~20倍(图4)。
图 4. qRT-PCR检测转染后PDLCs中hTERT的相对表达.
Fig 4 The relative expression of hTERT in infected cells measured by qRT-PCR
A:第6代PDLCs;B:第15代PDL-PAD;C:第35代PDL-PAD。
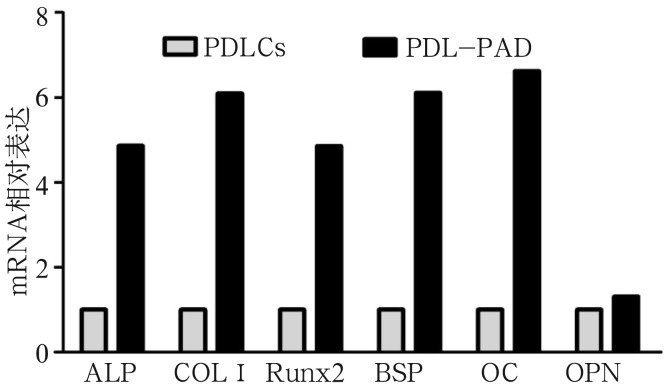
2.5. qRT-PCR检测转染后PDLCs中成骨相关基因的相对表达
qRT-PCR结果显示,ALP、Runx2、BSP、OC、COLⅠmRNA在PDL-PAD中的表达水平为PDLCs的4~7倍,而OPN mRNA的表达水平二者相似(图5)。
图 5. qRT-PCR检测转染后PDLCs中成骨相关基因的相对表达.
Fig 5 The relative expression of bone-related genes in infected cells measured by qRT-PCR
2.6. 茜素红染色观察成骨分化能力
茜素红染色结果显示,PDL-PAD较PDLCs形成更多矿化结节,有较强成骨能力(图6)。
图 6. 成骨分化 茜素红染色 × 100.
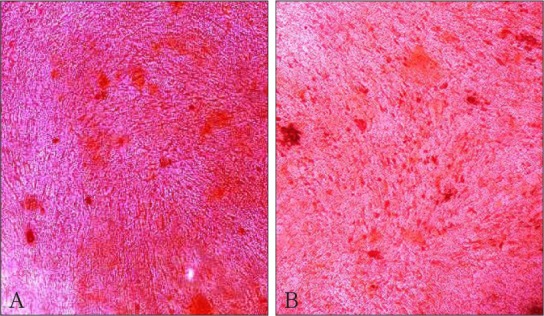
Fig 6 Osteogenesis differentiation alizarin red staining × 100
A:第7代PDLCs;B:第35代PDL-PAD。
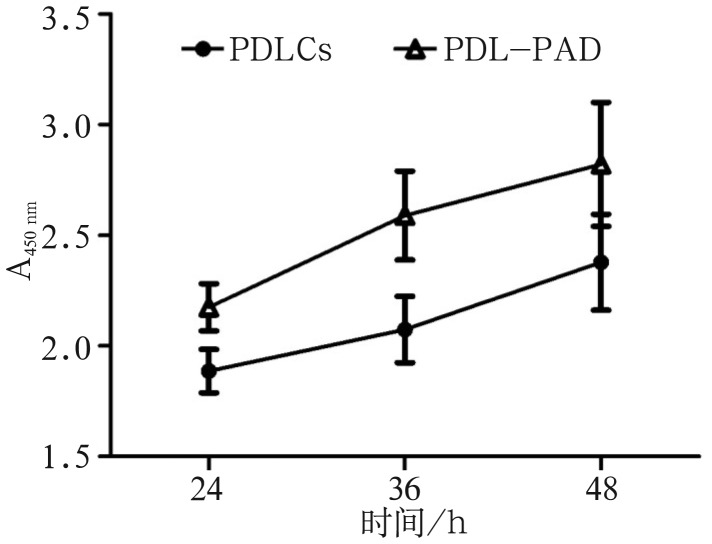
2.7. CCK-8检测细胞增殖能力
CCK-8检测结果显示,PDL-PAD较PDLCs有更强的增殖能力(图7)。
图 7. CCK-8检测细胞增殖能力.
Fig 7 The cell proliferation detected by CCK-8
3. 讨论
牙周病是口腔疾病中危害最大、发病率最高的疾病之一,其与糖尿病、心血管疾病等多种全身性疾病的发生发展有正相关关系。牙周病治疗的目标是阻止疾病的发展并使受损组织再生。在牙周病的治疗中,除了基础治疗技术外,牙周膜再生治疗逐渐成为研究的热点。常规治疗如根面平整术、翻瓣术虽可控制牙周病的发展,然而不能实现完整的牙周再生。目前牙周再生的方法包括引导组织再生、骨移植、应用生长因子和宿主调节因子等,但生物安全性、长期效果和稳定性尚需改进[7]。因此,利用替代治疗实现可预测的牙周再生是非常迫切的。
PDLCs的再生能力为牙周再生提供了可能性,但PDLCs的再生机制尚不明晰。原代细胞由于生长受代数限制,不能系统地进行持续研究,因此建立与原代细胞具有相同或者相似生长性能、再生潜能的PDLCs细胞系,可为牙周病的治疗提供一定的实验基础。
本研究通过腺病毒过表达hTERT成功构建了PDLCs细胞系,qRT-PCR结果说明hTERT在细胞系中高表达,与正常细胞有显著性差异。正常PDLCs在传代至第16代时出现明显细胞衰老迹象,而过表达hTERT的PDLCs仍可以快速生长,连续传代,表明过表达hTERT的PDLCs系构建成功。这些细胞保留了原代PDLCs的特征,其形态学外观、基因表达和钙化沉积物的产生与原代细胞类似,因此能作为阐明牙周膜生物学再生机制的有力工具。
hTERT能使MSCs逃脱衰老,在离体增殖期间能增加MSCs的寿命。研究[8]表明,hTERT可以显著增强MSCs的增殖能力,且可增强其体外成骨能力。本研究构建的PDL-PAD中成骨基因ALP、Runx2、BSP、OC、COLⅠmRNA的表达明显增高,证实了hTERT可以上调某些成骨相关基因而加强细胞的成骨分化能力。
ALP是骨形成、代谢、再生等过程中的重要矿化酶,是成骨细胞早期分化的标志,可作为评价细胞骨分化的一项特征性指标[9]。 OC主要在矿化形成期出现,是成骨细胞成熟的标志;ALP及OC的表达程度可以反映骨的形成进程[10]。Runx2是成骨细胞开始分化的标志,诱导MSCs发育为成骨细胞或软骨细胞,是骨形成过程中最早和最具特异性的标志基因[11]。COLⅠ含量的高低与细胞骨形成能力的强弱相辅相成,可以作为成骨细胞分化能力的一个重要检测指标。BSP在成骨细胞的矿化过程中具有很重要的调节作用,可促进成骨细胞黏附,是成骨细胞诱导成功并具有矿化功能的重要指标[12]。OPN作为成骨细胞分化的早期标志,在骨基质矿化开始以后,成骨细胞中的OPN mRNA水平开始升高,OPN可以诱导成骨细胞分化,促进矿化组织重建[13]。
PDL-PAD中5个成骨标志基因ALP、RUNX2、BSP、OC、COLⅠmRNA的表达较正常PDLCs有明显增高,相对应的茜素红染色中PDL-PAD较正常PDLCs形成更多的矿化结节,所以这种细胞系有较强的成骨分化能力,这为研究牙周膜再生机制提供了一个更理想的细胞系。
本研究中,PDL-PAD细胞成骨标记基因OPN mRNA的表达与正常PDLCs接近,而并未像其他5个标记基因一样明显增大,这可能是由于OPN信号通路与其他基因信号通路不同,具体原因有待进一步研究。
综上,本研究组成功构建了腺病毒过表达hTERT基因的PDLCs系,这种细胞具有与原代细胞相似的性状,增殖能力更强,更重要的是这种细胞有更强的成骨分化能力,在应用于牙周膜再生机制的研究中有其独特的优势,为牙周膜再生治疗的研究提供了一种有力的工具。
Funding Statement
[基金项目] 甘肃省自然科学基金(17JR5RA217)
Supported by: The Natural Science Foundation of Gansu Province (17JR5RA217).
References
- 1.Liu J, Wang LY, Liu WJ, et al. Dental follicle cells rescue the regenerative capacity of periodontal ligament stem cells in an inflammatory microenvironment[J] PLoS One. 2014;9(9):e108752. doi: 10.1371/journal.pone.0108752. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.甄 蕾, 刘 宏伟. 人牙周膜干细胞体外诱导分化为神经元样细胞的实验研究[J] 华西口腔医学杂志. 2009;27(1):71–74. [PubMed] [Google Scholar]; Zhen L, Liu HW. Differentiation of human periodontal ligament stem cells into neuron-like cells in vitro[J] West Chin J Stomatol. 2009;27(1):71–74. [PubMed] [Google Scholar]
- 3.刘 娟, 赵 红宇, 轩 东英, et al. 人牙周膜细胞群多向分化潜能的实验研究[J] 华西口腔医学杂志. 2010;28(2):185–189. [PubMed] [Google Scholar]; Liu J, Zhao HY, Xuan DY, et al. Differentiation characteristics of human periodontal ligament cell population in vitro[J] West Chin J Stomatol. 2010;28(2):185–189. [PubMed] [Google Scholar]
- 4.Kamata N, Fujimoto R, Tomonari M, et al. Immortalization of human dental papilla, dental pulp, periodontal ligament cells and gingival fibroblasts by telomerase reverse transcriptase[J] J Oral Pathol Med. 2004;33(7):417–423. doi: 10.1111/j.1600-0714.2004.00228.x. [DOI] [PubMed] [Google Scholar]
- 5.Moffatt-Jauregui CE, Robinson B, de Moya AV, et al. Establishment and characterization of a telomerase immortalized human gingival epithelial cell line[J] J Periodont Res. 2013;48(6):713–721. doi: 10.1111/jre.12059. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Fujii S, Maeda H, Wada N, et al. Establishing and characterizing human periodontal ligament fibroblasts immortalized by SV40T-antigen and hTERT gene transfer[J] Cell Tissue Res. 2006;324(1):117–125. doi: 10.1007/s00441-005-0101-4. [DOI] [PubMed] [Google Scholar]
- 7.Salvi GE, Mischler DC, Schmidlin K, et al. Risk factors associated with the longevity of multi-rooted teeth. Long-term outcomes after active and supportive periodontal therapy[J] J Clin Periodontol. 2014;41(7):701–707. doi: 10.1111/jcpe.12266. [DOI] [PubMed] [Google Scholar]
- 8.Gronthos S, Chen SQ, Wang CY, et al. Telomerase accelerates osteogenesis of bone marrow stromal stem cells by upregulation of CBFA1, osterix, and osteocalcin[J] J Bone Miner Res. 2003;18(4):716–722. doi: 10.1359/jbmr.2003.18.4.716. [DOI] [PubMed] [Google Scholar]
- 9.Wescott DC, Pinkerton MN, Gaffey BJ, et al. Osteogenic gene expression by human periodontal ligament cells under cyclic tension[J] J Dent Res. 2007;86(12):1212–1216. doi: 10.1177/154405910708601214. [DOI] [PubMed] [Google Scholar]
- 10.Fujisawa R, Tamura M. Acidic bone matrix proteins and their roles in calcification[J] Front Biosci (Landmark Ed) 2012;17:1891–1903. doi: 10.2741/4026. [DOI] [PubMed] [Google Scholar]
- 11.Bruderer M, Richards RG, Alini M, et al. Role and regulation of RUNX2 in osteogenesis[J] Eur Cell Mater. 2014;28:269–286. doi: 10.22203/ecm.v028a19. [DOI] [PubMed] [Google Scholar]
- 12.Mi HW, Lee MC, Fu E, et al. Highly efficient multipotent differentiation of human periodontal ligament fibroblasts induced by combined BMP4 and hTERT gene transfer[J] Gene Therapy. 2011;18(5):452–461. doi: 10.1038/gt.2010.158. [DOI] [PubMed] [Google Scholar]
- 13.Sodek J, Ganss B, McKee MD. Osteopontin[J] Crit Rev Oral Biol Med. 2000;11(3):279–303. doi: 10.1177/10454411000110030101. [DOI] [PubMed] [Google Scholar]