Abstract
目的
研究降钙素基因相关肽(CGRP)作用下相关炎症体和信号因子的表达变化,探讨CGRP对成骨细胞分化的作用机制。
方法
将不同浓度的CGRP(0、10、30、100 ng·mL−1)加入到成骨细胞中,采用实时聚合酶链反应技术检测细胞内Nod样受体蛋白3(NLRP3)及白细胞介素-1β(IL-1β)mRNA的表达水平,蛋白质印迹法检测NLRP3的蛋白表达,酶联免疫吸附测定检测IL-1β的蛋白表达,流式细胞仪检测细胞内活性氧(ROS)含量,茜素红染色显示成骨细胞分化情况。
结果
随着CGRP浓度的增加,NLRP3和IL-1β的蛋白表达及mRNA表达均呈降低趋势(P<0.05),而且细胞内ROS浓度逐渐下降(P<0.05)。100 ng·mL−1CGRP实验组较0 ng·mL−1CGRP对照组显著促进成骨细胞分化。
结论
CGRP在一定条件下,可通过抑制细胞内炎症因子的表达促进成骨细胞分化。
Keywords: 降钙素基因相关肽, Nod样受体蛋白3, 白介素1-β, 活性氧, 成骨细胞
Abstract
Objective
This study aims to investigate the regulatory effects of calcitonin gene-related peptide (CGRP) on Nod-like receptor protein 3 (NLRP3) and interleukin-1β (IL-1β) to promote osteoblast differentiation.
Methods
Different concentrations of CGRP (0, 10, 30, 100 ng·mL−1) were added to mouse osteoblasts in vitro. The mRNA and protein expression levels of both NLRP3 and IL-1β were examined using Real-time polymerase chain reaction and Western blot, respectively. Moreover, the concentrations of IL-1β protein and intracellular reactive oxygen species (ROS) were detected using enzyme-linked immunosorbent assay and flow cytometry, respectively. The osteogenic differentiation of mouse osteoblasts was identified through alizarin red staining.
Results
The protein and mRNA expression levels of both NLRP3 and IL-1β significantly decreased (P<0.05) with increasing CGRP concentration. Moreover, the contents of intracellular ROS gradually decreased (P<0.05). The osteogenic differentiation of the osteoblasts was more enhanced in the group treated with 100 ng·mL−1 CGRP than in the empty group (0 ng·mL−1CGRP).
Conclusion
CGRP promotes osteoblast differentiation by inhibiting the expression of inflammatory factors.
Keywords: calcitonin gene-related peptide, Nod-like receptor protein 3, interleukin-1β, reactive oxygen species, osteoblast
骨折愈合过程中炎症细胞分泌的大量细胞因子刺激成纤维细胞增殖分化、胶原蛋白及血管生成[1]。如果白细胞介素-1β(interleukin-1β,IL-1β)等促炎因子未能得到抑制而过度表达,则会使炎症期延长,从而影响骨折愈合[2]。通过调控IL-1β的表达,降低炎症反应,可达到调控骨愈合的速度。
降钙素基因相关肽(calcitonin gene-related peptide,CGRP)作为一种肽类神经递质,可以调节颌骨的生长、发育、修复及改建过程[3]。CGRP主要由感觉神经纤维分泌,成骨细胞自身也能分泌少量的CGRP[4]。研究[5]–[6]证实,CGRP可调控机体炎症反应及IL-1β的表达,其相关机制为CGRP直接作用于巨噬细胞和树突细胞,抑制这些细胞产生炎性细胞因子和抗原呈递细胞。在免疫细胞中,Nod样受体蛋白3(Nod-like receptor protein 3,NLRP3)的活化能激活中游分子半胱氨酸天冬氨酸蛋白酶(caspase)-1,继而诱导下游分子IL-1β的加工与释放[7]。成熟的IL-1β既可活化T细胞,又可激活核转录因子(nuclear factor kappa B,NF-κB)和促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路,启动先天性免疫应答清除病原体。细胞内活性氧(reactive oxygen species,ROS)是NLRP3活化的一个关键因子[8]。CGRP是否可以通过抑制成骨细胞内ROS的水平,从而抑制NLRP3的表达和减少IL-1β的释放,达到促进成骨分化的作用呢?本研究以NLRP3、ROS、IL-1β为研究对象,通过观察CGRP作用下相关炎症体和信号因子的表达变化,探讨CGRP对成骨细胞分化的作用和可能的调控机制,为骨创伤修复重建提供新的研究思路和途径。
1. 材料和方法
1.1. 主要试剂与仪器
DMEM高糖培养基、0.1%Ⅱ型胶原酶、青链霉素混合液、胎牛血清(Gibco公司,美国),0.25%胰蛋白酶(Hyclone公司,美国),CGRP(Sigma公司,美国),RNAiso Plus、实时聚合酶链反应(Real-time polymerase chain reaction,Real-time PCR)试剂盒[宝生物工程(大连)有限公司],BCA蛋白浓度测定试剂盒、辣根酶标记山羊抗兔IgG抗体、ROS检测试剂盒(上海碧云天生物技术有限公司),兔抗鼠NLRP3 IgG抗体(Santa Cruz公司,美国),小鼠IL-1β酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(eBioscience公司,美国),SW-CJ-2FD洁净工作台(苏州苏洁净化设备有限公司),3111水套式CO2培养箱、NanoDrop2000超微量分光光度计、Varioskan F酶标仪(Thermo公司,美国),ViiA7DX高产率荧光定量PCR仪(ABI公司,新加坡),Image quant Las 4000数字成像系统(GE公司,美国),MoFlo XDF流式细胞仪(Beckman公司,美国)。
1.2. 小鼠原代成骨细胞培养与鉴定
取新生BABL/c小鼠10只(第三军医大学附属新桥医院实验动物中心),拉尾处死后,无菌条件下取其颅骨,刮除骨膜及周围结缔组织,PBS液冲洗2次后将骨片剪成1 mm×1 mm大小,用0.25%胰蛋白酶消化20 min,0.1%Ⅱ型胶原酶于37 °C CO2孵箱消化60 min,离心后去除上清液,加入细胞培养液(90 mL DMEM高糖培养基+10 mL胎牛血清+2 mL青链霉素混合液)吹打成细胞悬液后,将细胞悬液连同骨块移入50 mL细胞培养瓶中,在5%CO2、37 °C培养箱中培养, 24 h后换液1次,之后每2 d换液1次,镜下观察其生长至80%时传代,并用差数贴壁法提纯细胞。取提纯后的第3代细胞行下一步实验并行碱性磷酸酶(alkaline phosphatase,ALP)与茜素红染色鉴定。
1.3. 细胞分组
将细胞按每孔5×105个的密度接种于6孔板中,分为4组,24 h后分别加入不同浓度的CGRP,A组(对照组)0 ng·mL1、B组10 ng·mL−1、C组30 ng·mL−1、D组100 ng·mL−1。3 d后提取RNA、蛋白以及取细胞培养液行下一步实验。
1.4. IL-1β、NLRP3 mRNA的检测
利用Real-time PCR法检测细胞内IL-1β、NLRP3 mRNA的表达水平。将各组细胞去除培养基后,PBS清洗3次,加入RNAiso Plus提取细胞内总RNA,经NanoDrop2000超微量分光光度计测得各组RNA浓度(A260/A280为1.8~2.0)。按照反转录试剂盒说明,将2 µg RNA反转录cDNA,于−80 °C冰箱保存,备用。 根据GenBank数据库,用Primer 5.0设计GAPDH (内参照)、IL-1β、NLRP3的引物,引物由生工生物工程(上海)股份有限公司合成。 各引物的具体序列如下。GAPDH扩增产物序列,正向:5′-ATGGCCTTCCGTGTTCCTAC-3′,反向:5′-CACCTTCTTGATGTCATCATACTTG-3′。IL-1β扩增产物序列,正向:5′-TGTGAGAAGCAGGTTCTACTCT-3′,反向:5′-GGATGCTCCTTGACCAGTTGG-3′。NLRP3扩增产物序列,正向:5′-CTCACAAGCAGAGCACAAGC-3′,反向:5′-CAGTCCAGCCCATACTTTAGG-3′。PCR反应体系(总体积25 µL)包括:2×SYBR Premix ExTaq™Ⅱ12.5 µL,10 µmol·L上、下游引物各1 µL,cDNA 2 µL,双蒸水8.5 µL。PCR反应条件:95 °C预变性30 s;95 °C变性5 s,60 °C退火延伸34 s,共40个循环。每一样品做3个复孔,取其平均值。反应结束后,根据溶解曲线判断扩增产物的特异性;以 GAPDH为内参基因,采用相对定量法(2−ΔΔCt)计算GAPDH、IL-1β、NLRP3的表达情况,实验重复3次。
1.5. 蛋白质印迹法(Western blot)检测NLRP3的蛋白表达
提取各组细胞内蛋白,BCA法测定蛋白浓度,十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electropheresis,SDS-PAGE)电泳,将蛋白转移至PVDF膜上,用含6%脱脂奶粉的1×TBST溶液封闭。加入兔抗小鼠NLRP3(一抗),洗涤后加入辣根酶标记山羊抗兔IgG抗体(二抗)。用电化学发光法(electrochemiluminescence,ECL)检测目的条带,显影、定影,Image quant Las4000数字成像系统采集影像,以β-肌动蛋白(β-actin)为内参进行分析。
1.6. ELISA检测IL-1β的蛋白表达
取各组细胞培养液放置于1.5 mL离心管中,立即检测或−20 °C冷冻保存。严格按照小鼠IL-1β ELISA检测试剂盒说明书操作,每个样品均设3个复孔。反应终止后用酶标仪检测450 nm处的吸光度(A450)。根据标准品浓度和A值做标准曲线,计算各组样本A值对应的浓度值。
1.7. 流式细胞仪检测ROS含量
取各组细胞并新增一组空白细胞,去除培养基后,PBS清洗3遍,胰蛋白酶消化后加入培养基移入10 mL离心管中,离心处理后按ROS检测试剂盒说明书操作,其中空白细胞组不加入检测试剂。流式细胞仪检测各组细胞内2′,7′-二氯二氢荧光素二乙酯(2′,7′-dichlorofluorescin,DCF)的荧光量从而得出ROS水平。
1.8. 茜素红染色检测成骨细胞分化
将第3代成骨细胞计数后接种到96孔板(细胞数为每孔5 000个),分为2组,每组20孔。其中对照组只加入成骨诱导液,实验组除加入成骨诱导液外,还加入100 ng·mL CGRP,每3天换液一次。处理14 d后行茜素红染色,倒置显微镜下观察矿化结节,评估成骨细胞分化情况。
1.9. 统计学分析
采用SPSS 17.0软件进行统计分析,对数据进行one-way ANOVA检验和配对t检验。
2. 结果
2.1. 原代成骨细胞的培养和鉴定
取小鼠颅骨经二次酶消化后常规培养2周,ALP染色阳性(图1左),茜素红染色可见矿化结节形成(图1右)。
图 1. 成骨细胞的鉴定.

Fig 1 The identification of osteoblast
左:ALP染色,× 100;右:茜素红染色,箭头示红色矿化结节,× 40。
2.2. NLRP3、IL-1β mRNA的表达
NLRP3、IL-1β mRNA的表达见表1。1)与A组比较,随着CGRP加入浓度的增加,NLRP3 mRNA相对表达量逐渐降低,各组与A组的差异均有统计学意义(P<0.05);与B组相比,C组和D组的表达下降明显,具有统计学差异(P<0.05);D组的表达明显低于C组,具有统计学差异(P<0.05)。2)IL-1β mRNA的表达随着CGRP加入浓度的增加,也呈逐渐降低的趋势。C组和D组降低明显,与A组有统计学差异(P<0.05),B组与A组相比无统计学差异(P>0.05);与B组相比,C组和D组的表达下降明显,具有统计学差异(P<0.05);D组的表达明显低于C组,具有统计学差异(P<0.05)。
表 1. NLRP3、IL-1β mRNA的表达.
Tab 1 The mRNA expressions of NLRP3 and IL-1β
| 组别 | NLRP3 mRNA | IL-1β mRNA |
| A | 1 | 1 |
| B | 0.71±0.36* | 0.88±0.56 |
| C | 0.44±0.40*# | 0.43±0.46*# |
| D | 0.23±0.03*#§ | 0.26±0.40*#§ |
注:*与A组相比,P<0.05;#与B组相比,P<0.05;§与C组相比,P<0.05。
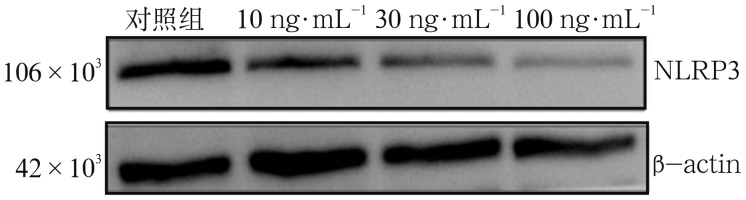
2.3. NLRP3的蛋白表达
各组成骨细胞中NLRP3的蛋白表达见图2。随着CGRP加入浓度的增加,NLRP3的蛋白表达降低,在100 ng·mL−1时其降低最为明显。
图 2. 各组成骨细胞中NLRP3的蛋白表达.
Fig 2 The protein expression of NLRP3 in osteoblasts of each group
2.4. IL-1β的蛋白表达
ELISA检测A、B、C、D组IL-1β的蛋白表达分别为(629.36±11.20)、(381.90±7.12)、(287.22±6.38)、(187.41±9.37)pg·mL−1。与A组相比,随着CGRP加入浓度的增加,IL-1 β蛋白表达呈降低趋势,差异具有统计学意义(P<0.01);B、C、D组之间的IL-1 β蛋白表达差异亦有统计学意义(P<0.01)。
2.5. 细胞内ROS的水平
A、B、C、D组的荧光强度分别为33.47±2.58、20.67±0.47、18.13±0.60、14.83±1.89。B、C、D组与A组比较,荧光强度明显降低,具有统计学差异(P<0.05);D组与B、C组比较,荧光强度均明显降低,具有统计学差异(P<0.05)。说明随着CGRP加入浓度增加,细胞内ROS浓度呈下降趋势。
2.6. 成骨细胞的分化
与对照组相比,实验组成骨细胞经诱导后,其矿化结节明显增多(图3)。说明实验组较对照组显著促进了成骨细胞分化。
图 3. 成骨细胞的矿化诱导 茜素红染色 × 40.

Fig 3 The mineralization induction of osteoblasts alizarin red stain × 40
左:对照组;右:实验组。箭头示矿化结节。
3. 讨论
骨折的愈合是一个复杂的病理和生理过程,包括局部炎症反应、细胞迁移、血管生成和骨痂改建等。在骨折发生时,骨髓中的间充质干细胞迁移至损伤部位,并在细胞外基质和各种细胞因子的刺激下发育分化成为成骨细胞,继而分化成熟形成骨细胞。在血肿形成36 h后,IL-10、转化生长因子β(transforming growth factor-β,TGF-β)等抗炎细胞因子起主导作用,控制和消除组织炎性反应,并促进炎性反应期向细胞增殖期的转变[9]。如果此时期内IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等促炎性细胞因子过表达或者促炎性细胞因子/抗炎性细胞因子表达失衡,将导致炎性反应期延长,最终导致骨折愈合延迟甚至骨不连[10]。与无骨折人群相比,骨折后患者24 h血浆内CGRP水平明显升高,提示外伤后CGRP参与了骨折早期的炎症过程[11]。研究表明,CGRP与IL-1β之间存在密切联系,作为先天性免疫的负调节因子,CGRP可以抑制单核吞噬细胞和树突细胞产生TNF-α和IL-1β[12]。本实验通过测定CGRP作用下IL-1β、NLRP3基因与蛋白的表达,来确定CGRP对于成骨细胞是否具有抑制其分泌IL-1β的作用。
炎性复合体参与IL-1β的生成。NLRP3是一个感官病原体和危险信号的多蛋白复合物,其为一种存在于细胞内相对分子质量约为700 000的多蛋白复合体,主要由接头蛋白(凋亡相关点样蛋白)、caspase-1、NAIP3和Cardinal蛋白构成。NLRP3是目前研究最广泛的NLR家族成员,其被过度激活时,可通过活化的caspase-1持续地将pro-IL-1β和pro-IL-18剪切为成熟的IL-1β和IL-18,进而激活下游信号转导通路,产生大量炎性介质,引起机体发生严重的炎症反应。ROS作为NLRP3的关键活化因子,可促进Ca2+的流动,并上调IL-1β[13]。线粒体可以通过自噬来下调ROS浓度,而Ca2+的流动又是线粒体功能失调和NLRP3活性下降的原因[14]–[15]。
在NLRP3与肿瘤发生的研究中发现,NLRP3可操纵细胞自主水平来消除恶性前体细胞,实现肿瘤细胞程序性死亡,NLRP3被激活后引起炎症级联反应,IL-1β、IL-18、IL-22和TNF-α等细胞因子大量释放,激活下游的NF-κB信号通路,促进肿瘤细胞生长和红细胞营养物质生成,导致组织损伤及肿瘤发生[16]。此研究结果启示,对同样处于创伤早期的炎性环境中的成骨细胞,NLRP3的激活和抑制对成骨细胞的分化将会有什么样的影响?是否可通过调控NLRP3的表达从而有利于骨创伤的愈合呢?笔者按此思路设计了本实验,结果表明成骨细胞中NLRP3表达受到抑制后其分化能力是增强的。严重的骨丢失和骨折延迟愈合被认为与局部环境中长期分泌IL-1β有关。IL-1β能显著减少成骨细胞向趋化因子血小板源性生长因子-BB和胰岛素样生长因子1的定向与非定向迁移。IL-1β的存在可能会影响骨折愈合早期阶段招募成骨细胞[17]。本研究结果表明,在CGRP作用下,成骨细胞内ROS水平降低,NLRP3和IL-1β的表达减少,而成骨细胞分化增强。这表明CGRP可能是通过抑制细胞内炎症因子的表达进而促进成骨细胞的分化。
本实验表明,CGRP在成骨细胞分化为骨细胞中具有抑制炎症因子表达的作用,为今后进一步研究该神经递质在骨创伤中的作用开辟了新的思路,但尚需要研究CGRP通过NLRP3调控其他炎症因子以及成骨细胞分化的机制。
Funding Statement
[基金项目] 国家自然科学基金(81277098)
Supported by: The National Natural Science Foundation of China (81277098).
References
- 1.Nakao J, Fujii Y, Kusuyama J, et al. Low-intensity pulsed ultrasound (LIPUS) inhibits LPS-induced inflammatory responses of osteoblasts through TLR4-MyD88 dissociation[J] Bone. 2014;58:17–25. doi: 10.1016/j.bone.2013.09.018. [DOI] [PubMed] [Google Scholar]
- 2.McCall SH, Sahraei M, Young AB, et al. Osteoblasts express NLRP3, a nucleotide-binding domain and leucine-rich repeat region containing receptor implicated in bacterially induced cell death[J] J Bone Miner Res. 2008;23(1):30–40. doi: 10.1359/JBMR.071002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Sample SJ, Hao Z, Wilson AP, et al. Role of calcitonin gene-related peptide in bone repair after cyclic fatigue loading[J] PLoS ONE. 2011;6(6):e20386. doi: 10.1371/journal.pone.0020386. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Antje H, Johannes K, Philip CL, et al. The role of calcitonin and α-calcitonin gene-related peptide in bone formation[J] Arch Biochem Biophy. 2008;473(2):210–217. doi: 10.1016/j.abb.2008.02.013. [DOI] [PubMed] [Google Scholar]
- 5.Mizushina Y, Shirasuna K, Usui F, et al. NLRP3 protein deficiency exacerbates hyperoxia-induced lethality through Stat3 protein signaling independent of interleukin-1β[J] J Biol Chem. 2015;290(8):5065–5077. doi: 10.1074/jbc.M114.603217. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Holzmann B. Antiinflammatory activities of CGRP modulating innate immune responses in health and disease[J] Curr Protein Pept Sci. 2013;14(4):268–274. doi: 10.2174/13892037113149990046. [DOI] [PubMed] [Google Scholar]
- 7.Schroder K, Tschopp J. The inflammasomes[J] Cell. 2010;140(6):821–832. doi: 10.1016/j.cell.2010.01.040. [DOI] [PubMed] [Google Scholar]
- 8.Zheng Q, Ren Y, Reinach PS, et al. Reactive oxygen species activated NLRP3 inflammasomes initiate inflammation in hyperosmolarity stressed human corneal epithelial cells and environment-induced dry eye patients[J] Exp Eye Res. 2015;134:133–140. doi: 10.1016/j.exer.2015.02.013. [DOI] [PubMed] [Google Scholar]
- 9.Dimitriou R, Tsiridis E, Giannoudis PV. Current concepts of molecular aspects of bone healing[J] Injury. 2005;36(12):1392–1404. doi: 10.1016/j.injury.2005.07.019. [DOI] [PubMed] [Google Scholar]
- 10.Chen YC, Lin YH, Wang SH, et al. Monitoring tissue inflammation and responses to drug treatments in early stages of mice bone fracture using 50 MHz ultrasound[J] Ultrasonics. 2014;54(1):177–186. doi: 10.1016/j.ultras.2013.06.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Onuoha GN. Circulating sensory peptide levels within 24 h of human bone fracture[J] Peptides. 2001;22(7):1107–1110. doi: 10.1016/s0196-9781(01)00434-x. [DOI] [PubMed] [Google Scholar]
- 12.Holzmann B. Antiinflammatory activities of CGRP modulating innate immune responses in health and disease[J] Curr Protein Pept Sci. 2013;14(4):268–274. doi: 10.2174/13892037113149990046. [DOI] [PubMed] [Google Scholar]
- 13.Heid ME, Keyel PA, Kamga C, et al. Mitochondrial reactive oxygen species induces NLRP3-dependent lysosomal damage and inflammasome activation[J] J Immunol. 2013;191(10):5230–5238. doi: 10.4049/jimmunol.1301490. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lawlor KE, Vince JE. Ambiguities in NLRP3 inflammasome regulation: is there a role for mitochondria[J] Biochim Biophys Acta. 2014;1840(4):1433–1440. doi: 10.1016/j.bbagen.2013.08.014. [DOI] [PubMed] [Google Scholar]
- 15.Zhong Z, Zhai Y, Liang S, et al. TRPM2 links oxidative stress to NLRP3 inflammasome activation[J] Nat Commun. 2013;4:1611. doi: 10.1038/ncomms2608. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Huber S, Gagliani N, Zenewicz LA, et al. IL-22BP is regulated by the inflammasome and modulates tumorigenesis in the intestine[J] Nature. 2012;491(7423):259–263. doi: 10.1038/nature11535. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Hengartner NE, Fiedler J, Ignatius A, et al. IL-1β inhibits human osteoblast migration[J] Mol Med. 2013;19:36–42. doi: 10.2119/molmed.2012.00058. [DOI] [PMC free article] [PubMed] [Google Scholar]