Abstract
目的
探讨饮酒和细胞外超氧化物岐化酶(EC-SOD)、乙醛脱氢酶2(ALDH2)基因多态性与口腔鳞状细胞癌患病之间的关系。
方法
采用病例对照研究的方法,以750例口腔鳞状细胞癌患者(病例组)及750例非癌对照者(对照组)的外周血白细胞为样本,采用聚合酶链反应(PCR)技术分析EC-SOD和ALDH2基因的多态性,并分析该基因多态性与口腔鳞状细胞癌患病的关系。
结果
病例组EC-SOD(C/G)和ALDH2变异基因型频率分别为38.27%、69.47%,对照组则为21.07%、44.40%,二者差异有统计学意义(P<0.01)。EC-SOD(C/G)患口腔鳞状细胞癌的风险显著增加(OR=2.32),ALDH2变异基因型的患病风险也显著增加(OR=2.85)。基因突变的协同分析发现,EC-SOD(C/G)/ALDH2变异基因型在病例组和对照组中的分布频率分别为30.67%和6.80%,二者差异有统计学意义(P<0.01)。EC-SOD(C/G)/ALDH2变异基因型患口腔鳞状细胞癌的风险显著增加(OR=8.13)。病例组的饮酒率明显高于对照组(OR=2.70),EC-SOD(C/G)及ALDH2变异基因型与饮酒有协同作用(OR=25.00)。
结论
EC-SOD及ALDH2变异基因型和饮酒是口腔鳞状细胞癌的易患因素,三者联合在口腔鳞状细胞癌的发生中有协同作用。
Keywords: 口腔鳞状细胞癌, 细胞外超氧化物岐化酶, 乙醛脱氢酶2, 多态现象, 饮酒行为
Abstract
Objective
To investigate the correlation between drinking behavior and polymorphism combination of extracellular superoxide dismutase (EC-SOD) and aldehyde dehydrogenase 2 (ALDH2) genes and oral squamous cell carcinoma.
Methods
The genetic polymorphisms of EC-SOD and ALDH2 were analyzed by polymorphism-polymerase chain reaction technique in peripheral blood leukocytes of 750 oral squamous cell carcinoma cases and 750 non-cancer controls.
Results
The frequencies of EC-SOD (C/G) and ALDH2 variant genotypes were 38.27% and 69.47% in oral squamous cell carcinoma cases and 21.07% and 44.40% in healthy controls, respectively. Statistical tests showed significant difference in the frequencies between the two groups (P<0.01). The risk of oral squamous cell carcinoma with EC-SOD (C/G) was significantly higher than that of controls (OR=2.32). Individuals carrying ALDH2 variant genotypes had high risk of oral squamous cell carcinoma (OR=2.85). Combined analysis of the polymorphisms showed that percentages of EC-SOD (C/G)/ALDH2 variant genotypes in oral squamous cell carcinoma and control groups were 30.67% and 6.80%, respectively (P<0.01). Individuals carrying EC-SOD (C/G)/ALDH2 variant genotypes had high risk of oral squamous cell carcinoma (OR=8.13). The drinking rate of the case group was significantly higher than that in the control group (OR=2.70). Statistical analysis suggested an interaction between drinking and EC-SOD (C/G) and ALDH2 variant genotypes, which increase risk of oral squamous cell carcinoma (OR=25.00).
Conclusion
EC-SOD (C/G) and ALDH2 variant genotypes and drinking are the risk factors in oral squamous cell carcinoma, which could carry out a coordinated attack of oral squamous cell carcinoma.
Keywords: oral squamous cell carcinoma, extracellular superoxide dismutase, aldehyde dehydrogenase 2, polymorphism, drinking
饮酒与癌症之间存在非常明显的关联性,长期饮酒导致人体内过量的氧自由基反应和乙醛聚集被认为是其致癌的重要机制,因此,抗氧化酶和乙醛代谢酶在清除致癌物中的作用非常重要。这两种酶的基因均具有多态性,即有多个等位基因,不同的等位基因编码的抗氧化酶或代谢酶的活性有所差异。两种酶的基因多态性可使机体清除外源性致癌物的能力有所不同,导致基因的稳定性和细胞的癌变率有所改变,这是决定机体肿瘤易患性的重要因素。抗氧化酶或乙醛代谢酶基因多态性与饮酒相关性肿瘤(如食管癌、胃癌)的关系是近年来国内外研究的热点之一[1]–[2],但关于口腔癌与两种酶基因多态性的相关性研究国内尚少见报道。本文拟通过研究750例口腔癌患者饮酒和细胞外超氧化物岐化酶(extracellular superoxide dismutase,EC-SOD)、乙醛脱氢酶2(aldehyde dehydrogenase 2,ALDH2)基因多态性的关系,探讨饮酒和EC-SOD、ALDH2基因多态性与口腔癌的相关性,为口腔癌的病因和遗传易患性研究提供依据。
1. 材料和方法
1.1. 研究对象及相关资料
选择2009年6月—2012年5月在新乡医学院第一附属医院收治的口腔癌患者750例为病例组,另外选择750例健康人为对照组。病例组研究对象均经病理学确诊为原发性口腔鳞状细胞癌;对照组来自健康体检人群,体检显示无肿瘤以及遗传性疾病。两组在年龄、性别、民族、籍贯上的差异均无统计学意义(P>0.05),且无血缘关系。由专人调查研究对象的人口学资料、吸烟史、职业史和家族肿瘤史。饮酒状况由饮酒指数(drinking index,DI)来估计,DI=d·y,其中d为研究对象的每日饮酒量(单位:g),y为饮酒时间(单位:年)。两组的性别、年龄、饮酒状况见表1。
表 1. 病例组和对照组的一般资料.
Tab 1 The general characteristics between oral squamous cell carcinoma group and control group
| 临床特征 | 病例组(n=750) | 对照组(n=750) | P值 | |
| 年龄(岁,x±s) | 55.69±4.82 | 55.71±4.62 | >0.05 | |
| 性别(n/%) | 男 | 512/68.27 | 510/68.00 | >0.05 |
| 女 | 238/31.73 | 240/32.00 | ||
| 饮酒状况(n/%) | - | 266/35.57 | 448/59.73 | <0.01 |
| + | 484/64.53 | 302 /40.27 | ||
| DI(n/%) | ≤3 000 | 119/15.87 | 202 /26.93 | <0.01 |
| >3 000 | 365/48.67 | 100/13.33 | ||
1.2. 基因型测定
每个研究对象各抽取静脉血2~3 mL,置乙二胺四乙酸钠抗凝管中分离白细胞层。用QIAampDNA提取试剂盒(QIAgen公司,德国)提取白细胞DNA,置于-30 °C低温冰箱中保存备用。
1.2.1. EC-SOD多态性分析
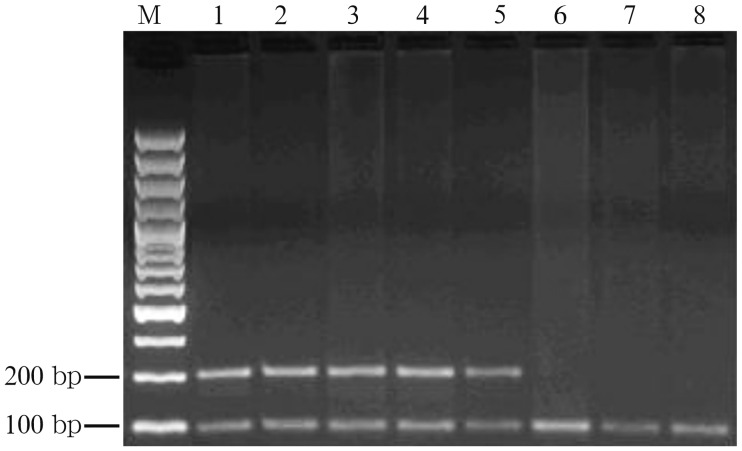
引物序列:顺式5′-GCAACCAGGCCAGCGTGGAGAACGGGAA-3′,反式5′-CCAGAGGAGAAGCTCAAAGGCAGA-3′;引物由上海生工生物工程技术服务有限公司合成。聚合酶链反应(polymerase chain reaction,PCR)体系总量50 µL,包括10×buffer 5 µL,dNTP 4.0 µL,上下游引物各20 pmol,Taq DNA聚合酶0.25 µL,模板DNA 100 ng,灭菌水加至50 µL。PCR扩增参数:94 °C预变性4 min,94 °C变性30 s,60 °C退火40 s,72 °C延伸30 s,于PE480型PCR仪(PE公司,美国)中循环35次后,72 °C延伸10 min。酶切反应体系总量20 µL,包括PCR产物1 ng,10×NEB反应缓冲液2 µL,内切酶0.5 µL;于60 °C下反应14 h。酶切后产物点样于3.0%琼脂糖凝胶中,100 V电压下电泳1 h,溴化乙锭染色30 min,分析结果。酶切后分为2种基因型(图1):EC-SOD(C/C)基因型,为111、109 bp;EC-SOD(C/G)基因型,为220、111、109 bp;两种基因型中,111、109 bp两条条带基本重合;两组中均未检测到纯合突变型(G/G)。
图 1. EC-SOD基因PCR产物检测结果.
Fig 1 The electrophoretogram of PCR products of EC-SOD gene
M:Marker;1、2、3、4、5:C/G基因型;6、7、8:C/C基因型。
1.2.2. ALDH2多态性分析
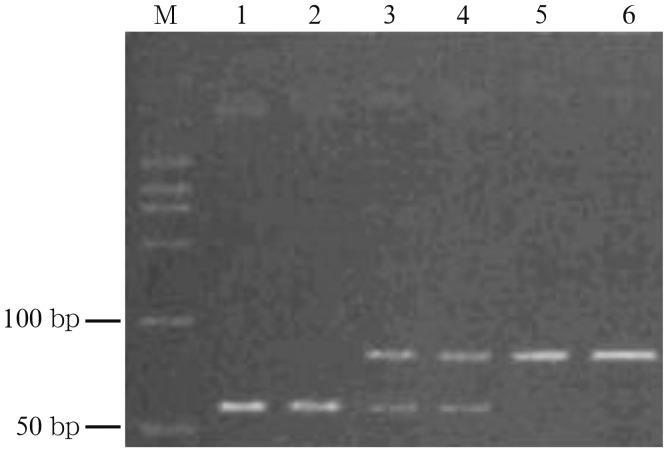
根据参考文献[3],选择PCR-限制性片段长度多态性(PCR-restriction fragment length polymorphism,PCR-RFLP)引物序列:Y3为5′-CCCTTTGGTGGCTAGAAGATG-3′,Y4为5′-CCACACTCACAGTTTTCTCTT-3′。扩增片段为91 bp。PCR扩增体系为25 µL,内含1 µL DNA,1 µmol·L−1引物,0.25 mmol·L−1 4×dNTP,0.25 mmol·L−1 MgCl2,1 U Taq酶(大连宝生物工程有限公司),以及2.5 µL 10×buffer。扩增条件为:95 °C预变性10 min,然后进行35个循环(95 °C 1 min,58 °C 2 min,72 °C1 min),最后72 °C延伸5 min。扩增后取PCR产物3 µL,加入5 U MboⅡ限制性内切酶及与内切酶配套使用的10×buffer,总量为10 µL,37 °C消化2.5 h。酶切后取酶切产物8 µL,作15%聚丙烯酰胺凝胶电泳,溴化乙锭染色,紫外灯照射,观察结果。酶切后分为3种基因型(图2):谷氨酸纯合型ALDH2(G/G),为55 bp;谷氨酸赖氨酸杂合型ALDH2(G/L),为65、55 bp两条带;赖氨酸纯合型ALDH2(L/L),为65 bp。为便于统计,将ALDH2(G/L)和ALDH2(L/L)合并记为ALDH2(non-G/G)共同分析。
图 2. ALDH2基因PCR产物检测结果.
Fig 2 The electrophoretogram of PCR products of ALDH2 gene
M:Marker;1、2:G/G基因型;3、4:G/L基因型;5、6:L/L基因型。
1.3. 统计方法
分别计算病例组和对照组EC-SOD和ALDH2基因型的分布,两组间的差异采用四格表χ2检验,各基因型口腔鳞状细胞癌风险的调整OR值及其95%可信区间(confidence interval,CI)通过非条件Logistic回归模型进行分析,EC-SOD和ALDH2之间的联合作用以及两者与饮酒的联合作用通过Logistic回归模型计算。采用SPSS 11.0统计软件包进行统计学分析。
2. 结果
2.1. EC-SOD、ALDH2基因型分布情况及两者与口腔鳞状细胞癌易患性的协同分析
两组EC-SOD、ALDH2基因型分布情况见表2:病例组与对照组EC-SOD(C/G)基因型各占38.27%和21.07%,ALDH2(non-G/G)各占69.47%和44.40%,二者差异均有统计学意义(P<0.01)。EC-SOD(C/G)者患口腔鳞状细胞癌的风险显著增加(OR=2.32,P<0.01),ALDH2变异基因型ALDH2(non-G/G)患口腔鳞状细胞癌的风险也显著增加(OR=2.85,P<0.01)。对两个基因的协同分析结果见表2:基因组合EC-SOD(C/G)/ALDH2(non-G/G)在病例组占30.67%,而对照组仅占6.80%,基因组合EC-SOD(C/G)/ALDH2(non-G/G)的口腔鳞状细胞癌患病风险是EC-SOD(C/C)/ALDH2(G/G)的8.13倍,两个基因型之间存在协同作用。
表 2. 病例组与对照组EC-SOD、ALDH2基因多态性分布及二者的协同作用分析.
Tab 2 Distribution of polymorphisms of EC-SOD and ALDH2 genotypes in oral squamous cell carcinoma and control groups and combined analysis of the two genotypes in relation to oral squamous cell carcinoma susceptibility
| 基因型 | 病例组(n/%) | 对照组(n/%) | OR值 | 95%CI | P值 | |
| 基因型 | EC-SOD(C/C) | 463/61.73 | 592/78.93 | 1.00 | ||
| EC-SOD(C/G) | 287/38.27 | 158/21.07 | 2.32 | 1.75~4.28 | <0.01 | |
| ALDH2(G/G) | 229/30.53 | 417/55.60 | 1.00 | |||
| ALDH2(non-G/G) | 521/69.47 | 333/44.40 | 2.85 | 1.89~4.64 | <0.01 | |
| 联合基因型 | EC-SOD(C/C)/ALDH2(G/G) | 172/22.93 | 310/41.33 | 1.00 | ||
| EC-SOD(C/C)/ALDH2(non-G/G) | 291/38.80 | 282/37.60 | 1.86 | 0.91~3.02 | >0.05 | |
| EC-SOD(C/G)/ALDH2(G/G) | 57/7.60 | 107/14.27 | 0.96 | 0.58~1.35 | >0.05 | |
| EC-SOD(C/G)/ALDH2(non-G/G) | 230/30.67 | 51/6.80 | 8.13 | 3.54~11.82 | <0.01 | |
2.2. 口腔鳞状细胞癌易患性与饮酒的相关分析
将对照组的饮酒人数和不饮酒人数与病例组的饮酒人数和不饮酒人数进行χ2检验,结果表明:口腔鳞状细胞癌的发生与饮酒有关,饮酒者更易患此疾病(OR=2.70,95% CI为1.28~4.47,P<0.01);将口腔鳞状细胞癌易患性与饮酒指数进行分析,结果显示:高饮酒组(DI>3 000)较低饮酒组(DI≤3 000)更易患口腔鳞状细胞癌(OR=6.20,95%CI为3.65~7.54,P<0.01)(表3)。
表 3. 口腔鳞状细胞癌易患性与饮酒状况的相关分析.
Tab 3 Related analysis of oral squamous cell carcinoma susceptibility and drinking status
| 饮酒状况 | 病例组(n/%) | 对照组(n/%) | OR值 | 95%CI | P值 |
| - | 266/35.47 | 448/59.73 | 1.00 | ||
| + | 484/64.53 | 302/40.27 | 2.70 | 1.28~4.47 | <0.01 |
| DI≤3 000 | 119/15.87 | 202/26.93 | 1.00 | ||
| DI>3 000 | 365/48.67 | 100/13.33 | 6.20 | 3.65~7.54 | <0.01 |
2.3. EC-SOD和ALDH2基因型和饮酒与口腔鳞状细胞癌易患性的协同分析
病例组中携带EC-SOD(C/G)/ALDH2(non-G/G)和饮酒者明显较对照组多,EC-SOD(C/G)/ ALDH2(non-G/G)饮酒者占病例组的29.33%,而在对照组中仅2.67%,二者差异有统计学意义(P<0.01);饮酒指数与EC-SOD/ALDH2以及口腔鳞状细胞癌易患性的协同分析显示,EC-SOD(C/G)/ ALDH2(non-G/G)/DI>3 000组合的患病风险是EC-SOD(C/C)/ALDH2(G/G)/DI≤3 000组合的230. 04倍(表4)。
表 4. EC-SOD/ALDH2基因型和饮酒状况与口腔鳞状细胞癌易患性的协同分析.
Tab 4 Combined analysis of genotypes of EC-SOD/ALDH2 and drinking status on oral squamous cell carcinoma susceptibility
| 联合基因型 |
饮酒状况 | 病例组 | 对照组 | OR值 | 95%CI | P值 | |
| EC-SOD | ALDH2 | (n/%) | (n/%) | ||||
| C/C | G/G | - | 55/7.33 | 125/16.67 | 1.00 | ||
| C/C | G/G | + | 117/15.60 | 185/24.67 | 1.44 | 0.82~2.58 | >0.05 |
| C/C | non-G/G | - | 191/25.47 | 272/36.27 | 1.60 | 1.27~2.97 | >0.05 |
| C/C | non-G/G | + | 100/13.33 | 10/1.33 | 22.73 | 11.41~32.83 | < 0.01 |
| C/G | G/G | - | 10/1.33 | 20/2.67 | 1.14 | 0.87~1.75 | >0.05 |
| C/G | G/G | + | 47/6.27 | 87/11.60 | 1.23 | 0.72~2.46 | >0.05 |
| C/G | non-G/G | - | 10/1.33 | 31/4.13 | 0.73 | 0.52~1.29 | >0.05 |
| C/G | non-G/G | + | 220/29.33 | 20/2.67 | 25.00 | 11.62~34.94 | < 0.01 |
| C/C | G/G | DI≤3 000 | 25/3.33 | 135/18.00 | 1.00 | ||
| C/C | G/G | DI>3 000 | 92/12.27 | 50/6.67 | 9.94 | 5.95~12.40 | < 0.01 |
| C/C | non-G/G | DI≤3 000 | 65/8.67 | 7/0.93 | 50.14 | 28.03~68.92 | < 0.01 |
| C/C | non-G/G | DI>3 000 | 35/4.67 | 3/0.40 | 63.00 | 58.36~117.26 | < 0.01 |
| C/G | G/G | DI≤3 000 | 22/2.93 | 45/6.00 | 2.64 | 1.94~4.59 | >0.05 |
| C/G | G/G | DI>3 000 | 25/3.33 | 42/5.60 | 3.21 | 2.43~7.51 | >0.05 |
| C/G | non-G/G | DI≤3 000 | 7/0.93 | 15/2.00 | 2.52 | 2.18~4.92 | >0.05 |
| C/G | non-G/G | DI>3 000 | 213/28.40 | 5/0.67 | 230.04 | 159.07~326.48 | < 0.01 |
3. 讨论
口腔癌是头颈部常见的恶性肿瘤,约占全身恶性肿瘤的3%。目前口腔癌的发病率在世界范围内呈上升趋势,尤其是在年轻女性,估计全球每年新发病例27.4万。虽然癌症治疗已经取得了许多重要进展,但自20世纪60年代至今,口腔癌的死亡率基本保持不变,5年生存率仍低于40%[4]。口腔癌的危险因素多种多样,包括化学致癌因素、物理致癌因素、生物致癌因素、遗传、机体易患性和种族等等,其确切病因尚不清楚。到目前为止,饮酒被认为是口腔癌的重要危险因素。饮酒者口腔癌的患病率随饮酒量、饮酒频率、持续时间的增加而上升[5]–[6]。通常情况下,生物体内的活细胞均可产生氧自由基,因存在着包括超氧化物歧化酶(superoxide dismutase,SOD)在内的自由基清除系统,可以及时地清除体内过剩的自由基,维持自由基的动态平衡;而长期饮酒的人,其肝脏、前列腺等实质脏器氧化应激增加[7],氧自由基产生过多,过量氧自由基通过血液进入口腔黏膜细胞,不仅可激活核转录因子-κB,而且可使口腔黏膜细胞发生脂质过氧化并启动新的自由基反应。过多的氧自由基可与细胞中的靶分子作用使靶细胞受损,通过损伤生物大分子,干扰细胞的氧化还原电势,并攻击核酸和DNA,使其发生断链和碱基修饰等,造成癌基因显露、DNA复制和转录出错,细胞周期发生改变及突变,从而导致细胞分化及增殖速度急剧加快,最终造成癌变[8]。此外,由于癌变部位及其周围组织的炎症改变,多形核嗜中性白细胞和其他吞噬细胞吞噬异物过程中发生呼吸爆发等所产生的大量氧自由基O2和H2O2活性物质,可以直接破坏抗氧化酶SOD、谷胱甘肽过氧化物酶(glutathione peroxidase,GST-Px)的-5H结构,损伤DNA,从而削弱机体加快合成SOD、GST-Px的功能,导致自由基清除能力减弱,过剩的O2和H2O2相互作用产生HO−,后者使细胞膜不饱和脂肪酸过氧化,脂质过氧化产物增加。脂质过氧化产物可通过氧化碱基,降低酶活性,损伤生物膜结构等作用引起代谢失调,加重组织损伤,导致机体免疫机能低下,有利于肿瘤的发生发展;此外,脂质过氧化产物对细胞增殖有强烈的抑制作用,导致机体免疫抑制促进肿瘤生长;另有研究[9]发现,脂质过氧化物有类似染色体畸变因子的作用;这些研究都表明,脂质过氧化物可能与肿瘤形成有关,是活性氧自由基诱发肿瘤形成的中间机制之一[10]。SOD是体内存在的一种抗氧化酶,能将氧自由基歧化为H2O2,H2O2进一步在过氧化氢酶(catalase,CAT)、GST-Px的催化下被清除,从而保护细胞免受损伤。SOD包括CuZnSOD、MnSOD和EC-SOD共3种,对机体的氧化与抗氧化平衡起重要的作用。CuZnSOD、MnSOD主要存在于真核细胞的细胞质、细胞核等部位,担负着这些部位清除超氧化物的作用。EC-SOD是细胞外液中最主要的SOD,其作用是清除超氧阴离子生成的H2O2,使之在CAT或者过氧化物酶和还原剂的作用下生成H2O,从而保护细胞免受损伤[11]。相关研究[12]表明,CuZnSOD、MnSOD基因多态性引起相应酶活性和体内自由基变化与肿瘤的易患性有密切关系;本研究也发现,EC-SOD(C/G)与口腔鳞状细胞癌的发生有关,口腔鳞状细胞癌组与对照组比较差异有统计学意义(P<0.01),携带EC-SOD(C/G)基因者患口腔鳞状细胞癌的风险高于携带EC-SOD(C/C)的个体(OR=2.32,95%CI为1.75~4.28)。研究[13]发现,EC-SOD基因定位于染色体4pter-q21,包含3个外显子,编码区位于外显子3,又称肝素结合区。EC-SOD基因变异位于碱基637位C→G,使得第213位氨基酸Arg变为Gly。通过减低EC-SOD酶与卵磷脂的亲和力,从而使EC-SOD酶的抗氧化活性降低,体内自由基增多,从而使个体患口腔癌的危险性增加。
动物学研究发现,乙醇不是一种致癌剂,而乙醇的代谢产物——乙醛却具有明显的致癌作用,与人类肿瘤的发生存在着一定的关系[14]–[15]。肝中的乙醇脱氢酶负责将乙醇氧化为乙醛,生成的乙醛作为底物进一步在乙醛脱氢酶(aldehyde dehydrogenase,ALDH)催化下转变为无害的乙酸。负责人体内乙醛转化的酶主要是肝中ALDH,ALDH1与ALDH2在催化速率上有明显的差异,ALDH2对乙醛的Km(Km即反应速度为最大反应速度一半时的底物浓度)低于ALDH1,约为后者的1/10,是主要负责乙醛转化的同工酶。ALDH2基因位于人类第12号染色体,由于ALDH2基因存在G1510A 多态性,导致氨基酸序列第487位上的谷氨酸被赖氨酸替换(Glu487Lys),其中具有催化活性的野生型称为G等位基因,催化能力失活的变异型称为L等位基因。由于遗传,人群中该酶基因型会出现3种情况,具有正常催化活性纯合子型ALDH2(G/G),催化活性下降的杂合子型ALDH2(G/L),催化活性失去的纯合子型ALDH2(L/L)。后两种基因型可引起相应的乙醛脱氢酶2活性降低或表达缺失,导致机体乙醛的集聚,从而增加特定肿瘤的患病率。已有研究[16]–[17]证明,ALDH2基因多态性与多种肿瘤风险相关。本研究发现,ALDH2(non-G/G)与口腔鳞状细胞癌的发生有关,与对照组比较差异有统计学意义(P<0.01),携带ALDH2(non-G/G)基因者患口腔鳞状细胞癌的风险高于携带ALDH2(G/G)的个体(OR=2.85,95%CI为1.89~4.64),与其他肿瘤的相关研究结论一致。
本研究结果显示,ALDH2(non-G/G)与EC-SOD(C/G)对口腔鳞状细胞癌的发生有显著的协同作用,兼有ALDH2(non-G/G)与EC-SOD(C/G)型者口腔鳞状细胞癌患病风险是兼有ALDH2(G/G)和EC-SOD(C/C)型的8.13倍。此外,本研究还发现,饮酒与口腔鳞状细胞癌的易患性有关(OR=2.70,95%CI为1.28~4.47,P<0.01)。对EC-SOD和ALDH2基因型与饮酒关系的协同分析发现,在口腔鳞状细胞癌患者中携带EC-SOD(C/G)型基因且饮酒,ALDH2(non-G/G)基因型且饮酒者较对照组多,差异有统计学意义(P<0.01);EC-SOD(C/G)/ALDH2(non-G/G)型饮酒者发生口腔鳞状细胞癌的危险显著增加(OR=25.00,95%CI为11.62~34.94);通过对饮酒状况的分析,发现大量饮酒者(DI>3 000)且具有ALDH2(non-G/G)与EC-SOD(C/G)基因型者口腔鳞状细胞癌的相对危险度更大(OR=230.04,95%CI为159.07~326.48);而DI≤3 000且ALDH2(non-G/G)/EC-SOD(C/G)基因型者患口腔鳞状细胞癌的风险(OR值)为2.52。由此可以看出,饮酒量越大,时间越长,口腔鳞状细胞癌患病风险越大。
环境致癌物代谢是涉及多种代谢酶的复杂过程,口腔鳞状细胞癌的发生也是涉及环境因子和多种基因相互作用的复杂过程。本研究提示,携带EC-SOD和ALDH2突变基因型的个体属口腔鳞状细胞癌高危险人群,在肿瘤防治中应加以重视。目前虽然尚不能通过改变人群的肿瘤易患基因型来防治肿瘤,但可以根据其与环境病因相互作用的特点,采取相应的控制环境病因的措施如戒酒或基因调控以达到有效预防肿瘤的目的。
References
- 1.Wang Y, Ji R, Wei X, et al. Esophageal squamous cell carcinoma and ALDH2 and ADH1B polymorphisms in Chinese females[J] Asian Pac J Cancer Prev. 2011;12(8):2065–2068. [PubMed] [Google Scholar]
- 2.Yi JF, Li YM, Liu T, et al. Mn-SOD and CuZn-SOD polymorphisms and interactions with risk factors in gastric cancer[J] World J Gastroenterol. 2010;16(37):4738–4746. doi: 10.3748/wjg.v16.i37.4738. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Ishibashi T, Taguchi A, Yamamoto Y, et al. Evaluation of the use of self-reported facial flushing and ethanol patch test for ALDH2 genotypes[J] Nihon Arukoru Yakubutsu Igakkai Zasshi. 2010;45(5):464–476. [PubMed] [Google Scholar]
- 4.Jayaprakash V, Sullivan M, Merzianu M, et al. Autofluore-scence-guided surveillance for oral cancer[J] Cancer Prev Res: Phila. 2009;2(11):966–974. doi: 10.1158/1940-6207.CAPR-09-0062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Testino G. The burden of cancer attributable to alcohol consumption[J] Maedica: Buchar. 2011;6(4):313–320. [PMC free article] [PubMed] [Google Scholar]
- 6.Wang JB, Jiang Y, Liang H, et al. Attributable causes of cancer in China[J] Ann Oncol. 2012;23(11):2983–2989. doi: 10.1093/annonc/mds139. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tabrez S, Ahmad M. Some enzymatic/nonenzymatic antioxidants as potential stress biomarkers of trichloroethylene, heavy metal mixture, and ethyl alcohol in rat tissues[J] Environ Toxicol. 2011;26(2):207–216. doi: 10.1002/tox.20548. [DOI] [PubMed] [Google Scholar]
- 8.Thounaojam MC, Jadeja RN, Valodkar M, et al. Oxidative stress induced apoptosis of human lung carcinoma (A549) cells by a novel copper nanorod formulation[J] Food Chem Toxicol. 2011;49(11):2990–2996. doi: 10.1016/j.fct.2011.07.055. [DOI] [PubMed] [Google Scholar]
- 9.La Maestra S, Kisby GE, Micale RT, et al. Cigarette smoke induces DNA damage and alters base-excision repair and tau levels in the brain of neonatal mice[J] Toxicol Sci. 2011;123(2):471–479. doi: 10.1093/toxsci/kfr187. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Sverko A, Sobočanec S, Kušić B, et al. Superoxide dismutase and cytochrome P450 isoenzymes might be associated with higher risk of renal cell carcinoma in male patients[J] Int Immunopharmacol. 2011;11(6):639–645. doi: 10.1016/j.intimp.2010.12.023. [DOI] [PubMed] [Google Scholar]
- 11.Kliment CR, Suliman HB, Tobolewski JM, et al. Extracellular superoxide dismutase regulates cardiac function and fibrosis[J] J Mol Cell Cardiol. 2009;47(5):730–742. doi: 10.1016/j.yjmcc.2009.08.010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Weydert CJ, Zhang Y, Sun W, et al. Increased oxidative stress created by adenoviral MnSOD or CuZnSOD plus BCNU (1,3-bis(2-chloroethyl)-1-nitrosourea) inhibits breast cancer cell growth[J] Free Radic Biol Med. 2008;44(5):856–867. doi: 10.1016/j.freeradbiomed.2007.11.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Samoila OC, Carter AM, Futers ST, et al. Polymorphic variants of extracellular superoxide dismutase gene in a Romanian population with atheroma[J] Biochem Genet. 2008;46(9/10):634–643. doi: 10.1007/s10528-008-9177-3. [DOI] [PubMed] [Google Scholar]
- 14.Salaspuro M. Acetaldehyde and gastric cancer[J] J Dig Dis. 2011;12(2):51–59. doi: 10.1111/j.1751-2980.2011.00480.x. [DOI] [PubMed] [Google Scholar]
- 15.Yokoyama A, Omori T, Yokoyama T, et al. Alcohol and aldehyde dehydrogenase polymorphisms and a new strategy for prevention and screening for cancer in the upper aerodigestive tract in East Asians[J] Keio J Med. 2010;59(4):115–130. doi: 10.2302/kjm.59.115. [DOI] [PubMed] [Google Scholar]
- 16.Oze I, Matsuo K, Hosono S, et al. Comparison between self-reported facial flushing after alcohol consumption and ALDH2 Glu504Lys polymorphism for risk of upper aerodigestive tract cancer in a Japanese population[J] Cancer Sci. 2010;101(8):1875–1880. doi: 10.1111/j.1349-7006.2010.01599.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Druesne-Pecollo N, Tehard B, Mallet Y, et al. Alcohol and genetic polymorphisms: effect on risk of alcohol-related cancer[J] Lancet Oncol. 2009;10(2):173–180. doi: 10.1016/S1470-2045(09)70019-1. [DOI] [PubMed] [Google Scholar]