Abstract
目的
观察乳铁蛋白(LF)对经脂多糖(LPS)刺激的人牙周膜细胞(hPDLCs)表达Toll样受体4(TLR4)的影响。
方法
采用组织块酶消化法培养hPDLCs,鉴定后取第4代细胞,分成空白对照组、LPS组、LPS+LF组。空白对照组不加任何刺激,LPS组加入0.1 µg·mL−1 LPS;LPS+LF组在加入0.1 µg·mL−1 LPS 2 h后,加入10 µg·mL−1 LF。以加入LF时开始计算时间,4 h后采用实时定量聚合酶链反应(RT-PCR)法检测hPDLCs中TLR4 mRNA的表达,24 h后采用细胞免疫荧光染色法观察TLR4蛋白的表达。
结果
RT-PCR检测显示:LPS+LF组TLR4 mRNA表达较LPS组明显降低(P<0.05),与空白对照组无明显差异(P>0.05)。细胞免疫荧光染色法显示:LPS+LF组TLR4蛋白的表达强度较LPS组减弱(P<0.05),与空白对照组无明显差别(P>0.05)。
结论
LF可以下调LPS激发的hPDLCs中TLR4的表达,在牙周炎症TLR4信号通路的调控过程中有一定的作用。
Keywords: 乳铁蛋白, 脂多糖, 人牙周膜细胞, Toll样受体4
Abstract
Objective
To examine the role of lactoferrin (LF) on Toll like receptor 4 (TLR4) stimulated by lipopolysaccharide (LPS) in human periodontal ligament cells (hPDLCs).
Methods
Primary hPDLCs were cultured by tissue block enzymolytic method. Cells obtained from four passages were identified and used in this experiment. Cells without stimulation served as the controls and cells treated with LPS (0.1 µg·mL−1) comprised the LPS group. The LPS+LF group was pretreated with LPS (0.1 µg·mL−1) for 2 h, and then treated with LF (10 µg·mL−1). Four hours after LF stimulation, the mRNA expression levels of TLR4 were examined by real-time quantitative polymerase chain reaction (RT-PCR). The protein expression of TLR4 was observed by cell immunofluorescence staining after LF stimulation of 24 hours.
Results
TLR4 mRNA expression in the LPS+LF group was significantly more decreased than that in the LPS group (P<0.05), but exhibited no difference with that in the control group (P>0.05). Cell immunofluorescence staining showed that the protein expression of TLR4 in the LPS+LF group was significantly more decreased than that in the LPS group (P<0.05), but exhibited no difference with that in the control group (P>0.05).
Conclusion
LF can decrease the expression of TLR4 stimulated by LPS in hPDLCs, thus presenting potential application for controlling the TLR4 immune pathway of periodontitis.
Keywords: lactoferrin, lipopolysaccharide, human periodontal ligament cells, Toll like receptor 4
Toll样受体家族(Toll like receptors,TLRs)是一种重要的模式识别受体,可识别保守的病原体相关的分子位点激活先天性免疫系统产生炎症细胞因子,进而启动后天性免疫系统。Toll样受体4(Toll like receptor 4,TLR4)是第一个被发现的哺乳动物的Toll样受体,可以通过经典的病原相关分子模式(pathogen association molecular pattern,PAMP)识别细菌脂多糖(lipopolysaccharide,LPS),启动细胞内信号传导,诱发细胞炎症因子分泌,启动炎症免疫反应[1]–[2]。牙周炎是以革兰阴性厌氧菌为主的混合感染性疾病,这些细菌能分泌大量的LPS,LPS在相关分子的协同下引发TLR4炎症信号通路,是细菌破坏牙周组织的关键途径。
乳铁蛋白(lactoferrin,LF)是一种存在于人体多种组织中的糖蛋白,具有抗细菌、真菌及病毒等特性,参与构成非特异性免疫系统,也是口腔唾液防御系统的重要组成部分[3]–[5]。LF可以通过干扰LPS引发的TLR4免疫反应来抑制内毒素毒性,进而抑制炎症发展。抑制LPS激发的TLR4反应从而调控相关的炎症反应,是近年来研究炎症治疗方法的热点。本研究采用实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT-PCR)和细胞免疫荧光染色法,检测LF对LPS引发的牙周膜细胞TLR4表达的影响,以期了解LF在牙周炎免疫治疗方面的作用。
1. 材料和方法
1.1. 主要材料和设备
大肠杆菌LPS、Ⅰ型胶原酶、乳铁蛋白(Sigma公司,美国),胎牛血清、高糖DMEM细胞培养液(Hyclone公司,美国);RNAiso Plus(总RNA提取试剂),反转录试剂盒、RT-PCR试剂盒(Takara公司,日本);抗荧光衰减封片剂、山羊血清封闭液、4,6-联脒-2-苯基吲哚 (4′,6-diamidino-2-phenylindole,DAPI)染色液(武汉博士德生物工程有限公司);鼠抗人TLR4一抗(Abcam公司,英国),山羊抗小鼠二抗(Santa Cruz公司,美国);流式抗体CD29、CD90、CD105、CD44(eBioscience公司,美国);流式细胞仪(BD公司,美国);Real-time RQ RT-PCR仪(Applied Biosystems公司,美国);生物安全柜、离心机(Thermo Electron公司,美国);显微镜及照片获取系统(Olympus公司,日本)。
1.2. 人牙周膜细胞(human periodontal ligament cells,hPDLCs)分离培养和鉴定
1.2.1. hPDLCs分离和培养
取南方医科大学南方医院口腔科15~25岁因正畸减数拔除的志愿者牙周组织健康的前磨牙,牙齿拔出后立即置于含双抗的DMEM培养液中,低温转移至实验室,用含双抗的PBS冲洗3遍,无菌湿润条件下刮取根中1/3的牙周膜组织,剪成1 mm3大小的组织块,PBS冲洗并离心后加入200 µLⅠ型胶原酶,37 °C培养箱内消化10 min,终止消化并离心后将组织块平整置于六孔板中,上盖无菌盖玻片,每孔加入2 mL含10%体积分数胎牛血清的DMEM培养液,37 °C、5%CO2孵箱中培养。次日换液,以后每3 d换液,待细胞从组织块中爬出并铺满瓶底达80%时进行首次传代。
1.2.2. hPDLCs鉴定
1)Ⅰ、Ⅳ型胶原的PCR检测。取第3代生长良好的细胞,以1×106个·mL−1的密度接种于6孔板,常规培养24 h至细胞贴壁后,TRIzol法提取总RNA,并以此作为模板合成cDNA,以磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)为内参,引物序列见表1。半定量PCR条件:95 °C 5 min, 95 °C变性30 s,58 °C退火30 s,68 °C延伸45 s,共35个循环;68 °C 5 min,4 °C结束。取PCR产物2 µL用1.2%琼脂糖进行凝胶电泳(100 V,30 min),凝胶成像分析系统进行分析并拍照。2)流式细胞术检测细胞分子表型。取第3代hPDLCs,PBS洗2次,制成密度为1×106个·mL−1的单细胞悬液,分别加入小鼠抗人CD105、CD29、CD44、CD90单抗,室温孵育1 h;再次洗涤后分别加入羊抗鼠Ig-FITC,室温避光45 min;PBS洗涤3次,弃上清,PBS重悬,流式细胞仪检测细胞表面分子。
表 1. 引物和序列.
Tab 1 Primers and sequences
| 引物 | 序列(5′—3′) | 片段大小/bp |
| β-actin | F: GCGCGGCTACAGCTTCA | 59 |
| R: TCTCCTTAATGTCACGCACGAT | ||
| TLR4 | F: TGAGGACCGACACACCAATG | 147 |
| R: TGCAATGGATCAAGGACCAG | ||
| Ⅰ型胶原 | F: GGAGGGAATCACTGGTGCTA | 381 |
| R: AGGGGGAAAAACTGCTTTGT | ||
| Ⅳ型胶原 | F: GGATCCTTCTGTTGATCACGGCTTC | 700 |
| R: CTCGAGTGTTCTTCTCATACAGAC | ||
| GAPDH | F:GACAGTCAGCCGCATCTTCT | 395 |
| R:AAATGAGCCCCAGCCTTCTC |
1.3. RT-PCR检测TLR4 mRNA的表达
取第4代生长良好的hPDLCs,以1×106个·mL−1接种于6孔板中,37 °C、5%CO2、饱和湿度条件下培养24 h至贴壁后,弃原培养液,加入含1%双抗、10%胎牛血清的DMEM,随机分成空白对照组、LPS组、LPS+LF组。空白对照组不加任何刺激,且于0 h用TRIzol法提取总RNA,−80 °C冻存备用;LPS组加入0.1 µg·mL−1 LPS;LPS+LF组在加入0.1 µg·mL−1 LPS 2 h后,加入10 µg·mL−1 LF。以加入LF时开始计算时间,4 h后用TRIzol 法提取总RNA。以各组总RNA为模板,用Takara逆转录试剂盒分别合成cDNA,引物由英潍捷基(上海)贸易有限公司合成,以β-actin为内参(引物序列见表1),然后进行RT-PCR。每组各取2 µL cDNA作为模板,按表1所列引物在ABI Prism 7500 Real-Time PCR System(Applied Biosystems公司,美国)检测系统中进行扩增,分别检测各组细胞中的TLR4 mRNA,以β-actin作为内参同时进行检测。 RT-PCR反应体系为:SYBR Premix Ex Taq(2×)10.0 µL,引物(10 mol·L−1)各0.8 µL,模板cDNA 2.0 µL,dH2O补足总体积至 20 µL;其中DNA聚合酶、PCR buffer、dNTP以及SYBR GreenⅠ均已事先混合于商品化的SYBR Premix Ex Taq中。PCR优化反应条件为95 °C 30 s,95 °C 5 s,60 °C 34 s,95 °C延伸15 s,循环40次。最后利用ABI Prism 7500 Real-Time PCR System联机软件进行Ct值相对定量分析。
1.4. 细胞免疫荧光化学染色法检测TLR4蛋白的表达
将生长良好的第4代hPDLCs以5×104个·mL−1密度接种于每孔底部放有盖玻片的24孔培养板,加入适量DMEM培养液,37 °C、5% CO2、饱和湿度条件下培养至贴壁并基本铺满盖玻片后,弃原培养液,分别加入800 µL含1%双抗、10%胎牛血清的DMEM,随机分成空白对照组、LPS组、LPS+LF组。空白对照组不加任何刺激;LPS组加入0.1 µg·mL−1 LPS;LPS+LF组加入0.1 µg·mL−1 LPS 2 h后,加入10 µg·mL−1 LF。以加入LF时开始计算时间,24 h后收集各组细胞爬片,按下列步骤操作:4%多聚甲醛固定10 min,PBS漂洗5 min,0.5%triton穿孔15 min,PBS漂洗2次各5 min,1%牛血清白蛋白封闭30 min,加一抗4 °C孵育过夜(各组分别取一张爬片以PBS代替一抗为阴性对照),PBS漂洗2次各5 min,加二抗37 °C孵育1 h,PBS漂洗2次各5 min,5 µg·mL−1 DAPI染色2 min,甘油封片后用光学显微镜观察。利用多功能真彩色细胞图像分析管理系统对染色标本进行图像分析,每张爬片随机选择5个高倍视野(×400),用免疫组织化学十三点评分方法进行免疫评分[6],分别计算TLR4在各组的阳性细胞数分值与荧光强度分值乘积。
1.5. 统计学分析
使用SPSS 13.0软件对所得数据进行单因素方差分析,RT-PCR结果两两比较用Dunnett T3检验,免疫荧光计分的比较用LSD检验,检验水准α=0.05。
2. 结果
2.1. hPDLCs的培养和鉴定
组织块酶消化法分离培养hPDLCs游出时间为5 d左右,且游出率和成活率较高。形态学观察:游出细胞多为梭形和星形,体积较小,核卵圆形且位于细胞质中央,为成纤维细胞样细胞(图1)。流式细胞仪分子表型检测显示:CD44、CD29、CD90和CD105标志的阳性细胞率分别为99.13%、98.17%、100%和78.21%,说明培养细胞为间充质来源。半定量PCR产物电泳结果见图2:Ⅰ型胶原阳性,Ⅳ型胶原阴性,此为牙周膜细胞特异性标记,证实培养细胞为牙周膜细胞。
图 1. hPDLCs原代培养第7天 倒置相差显微镜 × 100.

Fig 1 Primary culture of hPDLCs at 7 days inverted phase contrast microscope × 100
图 2. Ⅰ、Ⅳ型胶原的电泳结果.
Fig 2 Expression of collagen Ⅰand Ⅳ
2.2. LF对LPS激发的hPDLCs TLR4 mRNA表达的影响
RT-PCR检测结果显示:空白对照组、LPS组、LPS+LF组mRNA相对表达量分别为1.444±0.439、4.558±1.580、1.704±0.481。LPS刺激后hPDLCs的TLR4 mRNA表达增高;加入LF后,TLR4 mRNA表达下降;LF作用后TLR4 mRNA的表达与空白对照组无明显差异(P>0.05),但明显低于LPS刺激组(P<0.05)。
2.3. LF对LPS激发的hPDLCs TLR4蛋白表达的影响
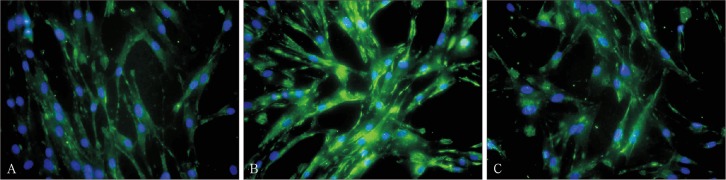
hPDLCs爬片的免疫荧光染色结果显示:TLR4主要表达于细胞膜和细胞质中,阳性表达为绿色荧光,细胞核呈蓝色(图3);以PBS代替一抗的阴性对照组染色均为阴性,无任何刺激的空白对照组TLR4呈弱阳性表达(图3A),LPS刺激24 h后TLR4表达明显增强(图3B),加入LF后TLR4表达减弱(图3C)。免疫评分结果:空白对照组、LPS组、LPS+LF组的评分分别为8.000±0.000、11.500±1.256、9.056±0.816;LPS+LF组与空白对照组相比无明显差异(P>0.05),与LPS组相比差异具有统计学意义(P<0.05)。
图 3. 3组细胞TLR4蛋白的表达 免疫荧光染色 × 400.
Fig 3 Expression of TLR4 protein in three groups immunofluorescence stain × 400
A:空白对照组;B:LPS组;C:LPS+LF组。
3. 讨论
Toll样受体信号通路是重要的炎症通路之一,其下游炎症信号的级联式反应往往会使疾病朝不良的方向发展。TLR4介导的炎症反应与牙周炎的发生发展有极为紧密的联系[7]–[8]。牙周炎的主要感染细菌为革兰阴性厌氧菌,LPS作为该类细菌的主要毒力因子,是炎症侵袭牙周组织的关键因素。TLR4通过PAMP识别LPS后,启动细胞内信号传导,诱发细胞炎症因子分泌[1]–[2],启动牙周炎症免疫反应,从而造成牙周组织破坏。
LF是口腔唾液防御系统中的重要组成部分。研究[9]–[10]证实:LF可减少口腔细菌如牙龈卟啉单胞菌、中间普氏菌等在牙周的吸附,阻止细菌破坏牙周组织。Drago-Serrano等[11]研究发现,LF与LPS的结合限制了LPS与细胞表面配体复合物的形成,可干扰Toll样受体通路的激活,起到免疫防御的作用。LF通过干扰LPS引发的TLR4免疫反应,可以抑制内毒素毒性,限制TLR4下游信号传导通路中核转录因子(nuclear transcription factor kappa B,NF-κB)、肿瘤坏死因子受体相关因子6(tumor necrosis-factor receptor-associated factor-6,TRAF6)、核因子-κB 抑制蛋白(inhibitor of NF-κB-α,IκBα)和IκB激酶β(inhibitor kappa B kinase β,IKKβ)等因子的活性,从而抑制LPS引发的炎症损害[12]–[13]。这些研究结果均表明,LF对LPS引发的炎症有一定的抑制作用。
本研究结果显示:LPS刺激后,hPDLCs的TLR4表达明显升高,表明LPS激发了细胞的TLR4反应。这一结果与其他学者[14]–[15]的研究结果类似。本研究在LPS刺激2 h后加入LF,TLR4表达较LPS刺激组明显下降,说明LF对LPS激发的TLR4反应有抑制作用,提示LF在调控TLR4信号传导通路进行炎症治疗方面有一定的作用。Drago-Serrano等[11]证明,LF可以限制LPS引发的细胞TLR4通路反应,从而起到免疫防御作用;Inubushi等[13]则直接证明LF可通过干扰LPS引发的TLR4免疫反应抑制内毒素毒性,从而减少LPS引起的骨吸收。这些研究结果预示LF可用于治疗牙周炎、关节炎等伴有骨缺损的炎症性疾病。本研究还发现,LF作用后hPDLCs的TLR4表达与空白对照组无明显差别,这意味着LF对TLR4的抑制作用并不会影响正常牙周膜细胞的TLR4表达。在正常牙周膜细胞中,TLR4的表达与牙周自身免疫防御功能有关,为达到炎症治疗的目的过度抑制TLR4表达会影响牙周膜细胞自身的免疫防御功能[16]。
通过调控TLR4炎症免疫通路来抑制LPS引发的炎症反应,是近年来炎症免疫治疗的研究热点。已有研究[17]–[18]证明,通过受体阻断剂或RNA干扰等方法可以抑制TLR4的表达和信号传导,在某些程度上可以控制LPS引发的炎症反应;然而,调控TLR4介导的炎症免疫传导通路可能会干扰细胞自身的免疫防御功能,引发新的问题。本研究结果证实,LF可以下调LPS引发的牙周膜细胞TLR4表达至正常水平,这对其在炎症治疗中的应用无疑有着积极的意义;但LF对牙周组织其他免疫防御功能是否有影响,还需进一步研究和探讨。此外,因为LPS引发的牙周炎症免疫通路及其信号转导较为复杂,各通路间存在一定的影响,因此LF对多通路共同作用下牙周炎症的调控作用还需进行大量的深入研究。
Funding Statement
[基金项目] 广东省科技计划基金资助项目(2010B060900053)
References
- 1.Tang L, Zhou XD, Wang Q, et al. Expression of TRAF6 and pro-inflammatory cytokines through activation of TLR2, TLR4, NOD1, and NOD2 in human periodontal ligament fibroblasts[J] Arch Oral Biol. 2011;56(10):1064–1072. doi: 10.1016/j.archoralbio.2011.02.020. [DOI] [PubMed] [Google Scholar]
- 2.Luo W, Wang CY, Jin L, et al. Baicalin downregulates Porphyromonas gingivalis lipopolysaccharide-upregulated IL-6 and IL-8 expression in human oral keratinocytes by negative regulation of TLR signaling[J] PLoS One. 2012;7(12):e51008. doi: 10.1371/journal.pone.0051008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Pecorini C, Sassera D, Rebucci R, et al. Evaluation of the protective effect of bovine lactoferrin against lipopolysaccharides in a bovine mammary epithelial cell line[J] Vet Res Commun. 2010;34(3):267–276. doi: 10.1007/s11259-010-9351-z. [DOI] [PubMed] [Google Scholar]
- 4.Dashper SG, Pan Y, Veith PD, et al. Lactoferrin inhibits Porphyromonas gingivalis proteinases and has sustained biofilm inhibitory activity[J] Antimicrob Agents Chemother. 2012;56(3):1548–1556. doi: 10.1128/AAC.05100-11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Embleton ND, Berrington JE, McGuire W, et al. Lactoferrin: antimicrobial activity and therapeutic potential[J] Semin Fetal Neonatal Med. 2013:pii: S1744-165X(13)00009-7. doi: 10.1016/j.siny.2013.02.001. [DOI] [PubMed] [Google Scholar]
- 6.何 华. 如何正确地对免疫组化结果进行半定量评分[J] 中外健康文摘: 临床医师. 2008;5(7):162. [Google Scholar]
- 7.Sun Y, Shu R, Zhang MZ, et al. Toll-like receptor 4 signaling plays a role in triggering periodontal infection[J] FEMS Immunol Med Microbiol. 2008;52(3):362–369. doi: 10.1111/j.1574-695X.2008.00386.x. [DOI] [PubMed] [Google Scholar]
- 8.Swaminathan V, Prakasam S, Puri V, et al. Role of salivary epithelial toll-like receptors 2 and 4 in modulating innate immune responses in chronic periodontitis[J] J Periodontal Res. 2013 doi: 10.1111/jre.12066. [DOI] [PubMed] [Google Scholar]
- 9.Arslan SY, Leung KP, Wu CD, et al. The effect of lactoferrin on oral bacterial attachment[J] Oral Microbiol Immunol. 2009;24(5):411–416. doi: 10.1111/j.1399-302X.2009.00537.x. [DOI] [PubMed] [Google Scholar]
- 10.Wakabayashi H, Yamauchi K, Kobayashi T, et al. Inhibitory effects of lactoferrin on growth and biofilm formation of Porphyromonas gingivalis and Prevotella intermedia[J] Antimicrob Agents Chemother. 2009;53(8):3308–3316. doi: 10.1128/AAC.01688-08. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Drago-Serrano ME, de la Garza-Amaya M, Luna JS, et al. Lactoferrin-lipopolysaccharide (LPS) binding as key to antibacterial and antiendotoxic effects[J] Int Immunopharmacol. 2012;12(1):1–9. doi: 10.1016/j.intimp.2011.11.002. [DOI] [PubMed] [Google Scholar]
- 12.Ando K, Hasegawa K, Shindo K, et al. Human lactoferrin activates NF-kappaB through the Toll-like receptor 4 pathway while it interferes with the lipopolysaccharide-stimulated TLR4 signaling[J] FEBS J. 2010;277(9):2051–2066. doi: 10.1111/j.1742-4658.2010.07620.x. [DOI] [PubMed] [Google Scholar]
- 13.Inubushi T, Kawazoe A, Miyauchi M, et al. Molecular mechanisms of the inhibitory effects of bovine lactoferrin on lipopolysaccharide-mediated osteoclastogenesis[J] J Biol Chem. 2012;287(28):23527–23536. doi: 10.1074/jbc.M111.324673. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.段 立立, 许 丽华, 王 洁, et al. 内毒素对人牙周膜细胞Toll样受体2和Toll样受体4表达的影响[J] 牙体牙髓牙周病学杂志. 2012;22(2):70–73. [Google Scholar]
- 15.Honda H, Nagai Y, Matsunaga T, et al. Glycyrrhizin and isoliquiritigenin suppress the LPS sensor toll-like receptor 4/MD-2 complex signaling in a different manner[J] J Leukoc Biol. 2012;91(6):967–976. doi: 10.1189/jlb.0112038. [DOI] [PubMed] [Google Scholar]
- 16.Eiró N, González L, González LO, et al. Study of the expression of toll-like receptors in different histological types of colorectal polyps and their relationship with colorectal cancer[J] J Clin Immunol. 2012;32(4):848–854. doi: 10.1007/s10875-012-9666-3. [DOI] [PubMed] [Google Scholar]
- 17.Hua D, Liu MY, Cheng ZD, et al. Small interfering RNA-directed targeting of Toll-like receptor 4 inhibits human prostate cancer cell invasion, survival, and tumorigenicity[J] Mol Immunol. 2009;46(15):2876–2884. doi: 10.1016/j.molimm.2009.06.016. [DOI] [PubMed] [Google Scholar]
- 18.Qin Q, Niu J, Wang Z, et al. Astragalus membranaceus inhibits inflammation via phospho-P38 mitogen-activated protein kinase (MAPK) and nuclear factor (NF)-κB pathways in advanced glycation end product-stimulated macrophages[J] Int J Mol Sci. 2012;13(7):8379–8387. doi: 10.3390/ijms13078379. [DOI] [PMC free article] [PubMed] [Google Scholar]