Abstract
目的
研究种植体周围炎条件下炎性微环境对颌骨成骨细胞生物学功能的影响。
方法
原代分离培养和纯化种植体周围炎来源和正常组织来源的人颌骨成骨细胞,取第3代细胞进行鉴定和检测,MTT法检测成骨细胞的增殖能力,实时定量聚合酶链反应法检测成骨细胞相关基因骨钙素(OCN)、Runx2、Ⅰ型胶原(Col Ⅰ)的表达,Western blot法检测成骨细胞相关蛋白OCN的表达。
结果
从培养第4天起,种植体周围炎来源的成骨细胞的增殖活力明显低于正常组织来源的成骨细胞(P<0.05)。培养7 d时,与正常组织来源的成骨细胞相比,种植体周围炎来源的成骨细胞相关基因OCN、Runx2、Col Ⅰ的表达均显著降低(P<0.05),相关蛋白OCN的表达也显著降低(P<0.05)。
结论
种植体周围炎的炎性微环境降低了颌骨成骨细胞的增殖及分化能力。
Keywords: 种植体周围炎, 成骨细胞, 生物学功能
Abstract
Objective
To study the effect of peri-implantitis inflammatory microenvironment on the biological function of jaw bone osteoblasts.
Methods
Primary mandible osteoblasts from peri-implantitis and normal tissue were isolated and cultured. Third-generation purified osteoblasts were identified and detected. The proliferative activity of osteoblasts was evaluated through MTT assay. Osteocalcin (OCN), Runx2, and collagen Ⅰ (Col Ⅰ) mRNA levels were examined by real-time quantitative polymerase chain reaction. OCN protein levels were determined by Western blot.
Results
After 4 d of culture, the proliferative activity of osteoblasts from peri-implantitis became lower than that of normal tissue (P<0.05). After 7 d of culture, OCN, Runx2, and Col Ⅰ mRNA expression decreased (P<0.05). The OCN protein levels also decreased (P<0.05).
Conclusion
Peri-implantitis inflammatory microenvironment can decrease the proliferation and differentiation activity of mandible osteoblasts.
Keywords: peri-implantitis, osteoblast, biological function
种植体周围炎是导致种植体松动失败的主要原因之一,可以使种植体周围支撑骨组织功能丧失。成骨细胞是骨形成的主要功能细胞,其生物学功能与种植体骨性结合紧密相关。种植体周围炎前期研究主要集中在炎性细胞因子和相关致病菌对成骨细胞生物学功能的影响,目前已经证实种植体周围炎龈沟液中的炎性细胞因子和致病菌的独立因子对鼠成骨细胞的生物学功能有不同程度的影响[1]–[2]。
本研究从种植体周围炎患者脱落种植体周围骨组织中获取成骨细胞,通过对炎症与正常组织来源的成骨细胞进行对比,探讨种植体周围炎对成骨细胞生物学行为的影响,为种植修复提供理论基础。
1. 材料和方法
1.1. 临床样本收集
种植体周围炎的骨组织样本来自中国人民解放军总医院种植科,选取患者年龄小于等于60岁、种植体植入年限小于等于3年、种植体位于磨牙区且因种植体周围炎出现种植体脱落的患者4例,刮取种植体附着以及种植窝中的骨组织。正常组织来源的样本来自中国人民解放军总医院口腔外科,选取4例身体健康的相同年龄段的第三磨牙拔除术患者,夹取舌侧骨板。所有患者均排除牙周炎,且近期没有急性感染、糖尿病、家族遗传病和骨质疏松症等全身系统性疾病。本研究已经中国人民解放军总医院伦理委员会批准,且每例患者均签署了知情同意书。
1.2. 成骨细胞的分离培养与纯化
PBS反复冲洗5次组织块,将较大的组织块剪为1 mm3大小,转移至离心管中,加入含有13.7 g·L−1 Ⅳ型胶原酶(北京索莱宝科技有限公司)和5 g·L−1胰蛋白酶(Amresco公司,美国)的消化液,37 °C震荡消化45 min。1 000 r·min−1离心8 min,去上清,加入H-DMEM培养液(GIBCO公司,美国)和10%胎牛血清(Invitrogen公司,美国),吸管反复吹打成细胞悬液,接种培养皿中,置于37 °C、5%CO2孵箱内培养。24 h后观察细胞贴壁及生长情况,待铺皿80%进行传代。采用反复贴壁法[3]对细胞进行纯化。
1.3. 碱性磷酸酶鉴定染色
将第3代分离纯化后的成骨细胞以每孔1×104个的密度接种于24孔板,细胞达70%时,用4%多聚甲醛在4 °C固定30 min。PBS反复冲洗后,使用碱性磷酸酶试剂盒(Sigma公司,美国)染色1 h。PBS反复冲洗后,在倒置相差显微镜下进行常规观察及照相。
1.4. MTT法检测成骨细胞的增殖能力
取对数生长期第3代细胞,经胰蛋白酶消化后离心加入DMEM(10%胎牛血清)终止成细胞混悬液,调整密度为2×104个·mL−1接种于96孔板,每孔0.2 mL。贴壁后隔天换液,连续培养8 d。每隔24 h取3孔,每孔加入20 µL 5 g·L−1 MTT溶液,37 °C、5%CO2孵箱中孵育4 h,加入二甲基亚砜200 µL。采用酶联免疫检测仪490 nm波长下检测吸光度值,实验重复3次。
1.5. 实时定量聚合酶链反应(real-time quantitative polymerase chain reaction,RT- PCR)检测成骨细胞相关基因骨钙素(osteocalcin,OCN)、Runx2、Ⅰ型胶原(collagen Ⅰ,Col Ⅰ)的表达
取第3代细胞接种,培养7 d后,将细胞进行常规消化离心,用0.01 mol·L−1 PBS冲洗,根据TRIZOL试剂盒说明书提取细胞总RNA。用紫外分光光度计测定A260/A280值,保证其比值为1.6~2.0,并计算RNA浓度。取2 µg RNA进行反转录,按照实际说明书进行。PCR体系:cDNA 2 µL,上下游引物各0.4 µL,dH2O 6.8 µL,ROX Reference Dye(50×)0.4 µL,SYBR Premix Ex Taq(Tli RNaseH Plus)10 µL,总计20 µL。PCR反应条件:95 °C预变性30 s 1个循环,95 °C(变性)5 s和60 °C(退火和延伸)34 s 40个循环。上下游引物(来自中国科学院理化技术研究所)的序列见表1。
表 1. 引物序列.
Tab 1 Primer sequences
| 基因 | 引物序列(5′—3′) | 产物大小/bp |
| Runx2 | 上游:TGAAATAGGCATCAGACAAA | 176 |
| 下游:CAGTAGCAAACCGAAACACT | ||
| Col Ⅰ | 上游:AGTGGTTTGGATGGTGCCAA | 170 |
| 下游:GCACCATCATTTCCACGAGC | ||
| OCN | 上游:ATGAGAGCCCTCACACTCCT | 117 |
| 下游:CTTGGACACAAAGGCTGCAC |
1.6. Western blot法检测成骨细胞相关蛋白OCN的表达
取第3代细胞进行接种,培养7 d后,将细胞用0.01 mol·L−1 PBS反复冲洗3遍,裂解细胞提取蛋白。取等量蛋白经8%十二烷基硫酸钠聚丙烯酰胺凝胶电泳后,将凝胶转移到聚偏二氟乙烯膜上,脱脂奶粉封闭过夜。加入鼠抗人OCN(Abcam公司,英国)(1︰1 000稀释)和β-actin(1︰2 000稀释),37 °C孵育2 h,洗膜后,经辣根过氧化物酶标记的羊抗鼠IgG2a(Abcam公司,英国)(1︰4 000稀释)孵育50 min,化学发光法显示抗原抗体复合物,X线片显影并定影,所有杂交信号经成像分析仪系统测定条带密度进行定量分析,以目的蛋白灰度值与内参β-actin的比值表示蛋白的表达水平。
1.7. 统计学分析
采用SPSS 13.0软件进行统计分析,独立样本t检验进行两组间比较,P<0.05为有统计学差异。
2. 结果
2.1. 成骨细胞的分离培养及纯化
种植体周围炎来源的成骨细胞与正常组织来源的成骨细胞在培养过程中状态基本相同,10~14 d时从组织块中爬出,形状多为不规则形和三角形(图1)。反复贴壁法纯化成骨细胞贴壁后,2种来源的细胞在形态学上无明显差异,细胞均呈长梭形和多边形,胞核可见多核仁,呈圆形或椭圆形(图2)。
图 1. 培养10 d后可见有细胞从组织块中爬出 倒置相差显微镜 × 200.

Fig 1 The primary neonatal osteoblasts crawling from bone pieces explants at 10 d of culture inverted phase contrast microscope × 200
左:种植体周围炎来源;右:正常组织来源。
图 2. 第3代纯化后的成骨细胞 倒置相差显微镜 × 100.

Fig 2 The third generation purified osteoblasts inverted phase contrast microscope × 100
左:种植体周围炎来源;右:正常组织来源。
2.2. 碱性磷酸酶鉴定染色
细胞固定后按碱性磷酸酶活性检测试剂盒要求进行检测,可见蓝黑色颗粒沉积在胞浆碱性磷酸酶活性部位(图3)。2种来源细胞都表现出了碱性磷酸酶阳性,但正常组织来源的成骨细胞比种植体周围炎来源成骨细胞内可见更多染色颗粒。
图 3. 成骨细胞碱性磷酸酶染色 倒置相差显微镜 × 200.
Fig 3 Osteoblasts of alkaline phosphatase staining inverted phase contrast microscope × 200
左:种植体周围炎来源;右:正常组织来源。
2.3. 2种来源的成骨细胞增殖能力的比较
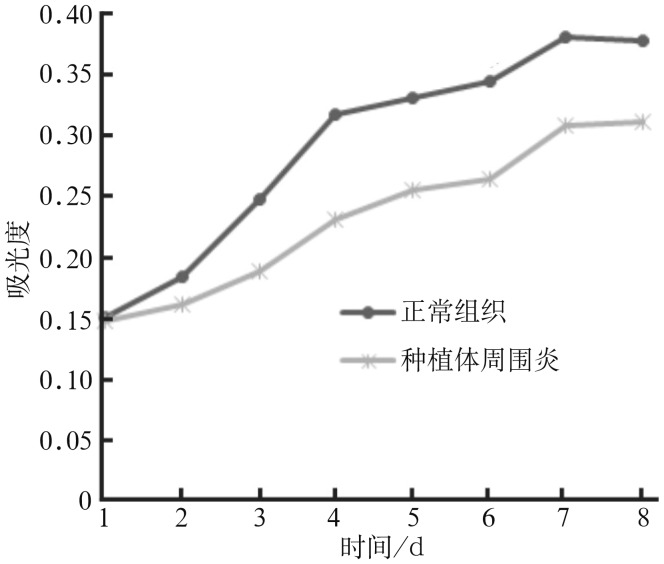
MTT检测结果(图4)表明,正常组织来源与种植体周围炎来源的成骨细胞都表现出了一定的体外扩增能力,从第4天起2种来源细胞的增殖能力出现统计学差异(P<0.05),种植体周围炎来源的成骨细胞的增殖活力明显低于正常组织来源的成骨细胞。
图 4. 2种来源的成骨细胞的生长曲线.
Fig 4 The growth curve of osteoblasts from two kinds of sources
2.4. 2种来源的成骨细胞相关基因表达的比较
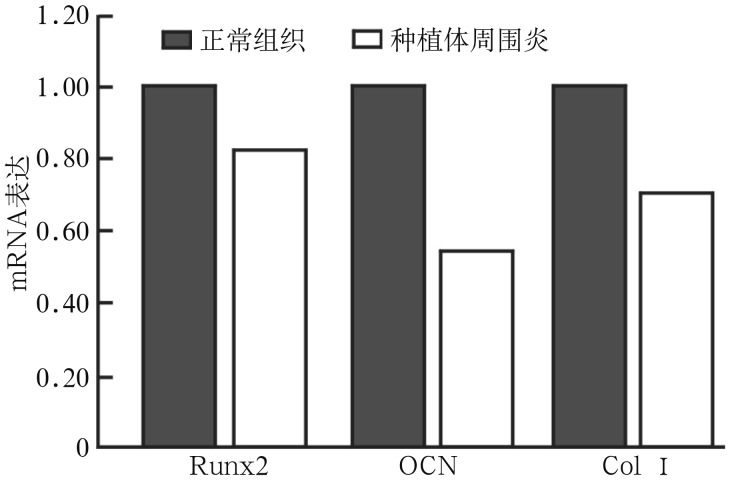
实时定量PCR检测结果表明,培养7 d时,与正常组织来源的成骨细胞相比,种植体周围炎来源的成骨细胞的Runx2表达降低了18%(P<0.05)(图5),OCN降低了45%(P<0.05),Col Ⅰ表达降低了28%(P<0.05)。
图 5. 2种来源的成骨细胞培养7 d时Runx2、OCN、Col Ⅰ的表达.
Fig 5 The expression of Runx2, OCN, Col Ⅰ from two kinds of sources at 7 d of culture
2.5. 2种来源的成骨细胞相关蛋白的比较
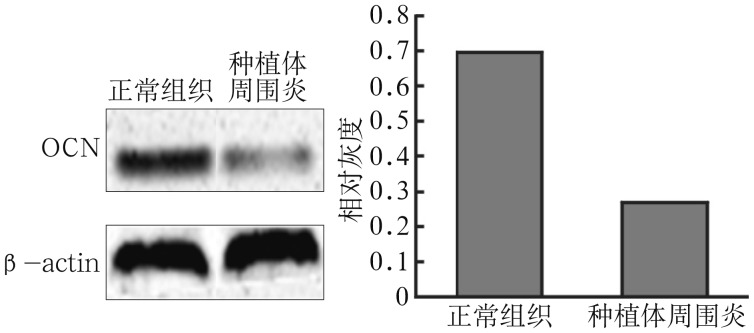
Western blot检测结果表明,培养7 d时,与正常组织来源的成骨细胞相比,种植体周围炎来源的成骨细胞OCN的表达降低,相对灰度值分析表明种植体周围炎来源的成骨细胞OCN的表达水平约为正常组织来源的1/3(P<0.05)(图6)。
图 6. 2种来源的成骨细胞培养7 d时OCN的表达(左)及相对灰度分析(右).
Fig 6 OCN expression (left) and relative gray analysis (right) in osteo blasts from two kinds of sources at 7 d of culture
3. 讨论
骨结合是牙种植手术的基础。种植体与颌骨骨性结合面的形成与种植区的骨密度密切相关,骨密度越高,种植体与骨的结合率就越高[4]。种植体周围炎正是在炎性微环境下,破坏了种植体与颌骨的骨结合,从而使种植体周围支撑骨组织的功能丧失。成骨细胞在骨组织的修复和改建中起到重要作用,是维持骨组织新陈代谢的主要细胞;因此,研究炎症组织来源的成骨细胞很有意义。
本研究从种植体周围炎种植体脱落患者的颌骨骨组织中分离培养获得了炎症组织来源的成骨细胞,通过比较炎症组织来源的成骨细胞和正常组织来源的成骨细胞的增殖能力以及相关骨组织修复基因的表达等生物学功能变化,探讨炎性微环境对成骨细胞生物学功能的影响。
本实验选用的成骨细胞均为第4代以内的细胞,结果表明,炎症组织来源的细胞在体外培养后仍然具有一定的炎症组织来源特异性。炎性细胞因子和种植体周围炎致病菌的毒力因子会导致成骨细胞的增殖能力显著下降。本研究结果显示,种植体周围炎来源的成骨细胞虽然在形态学上并没有表现出和正常组织来源的成骨细胞有明显差异,但是在细胞增殖活力方面表现出了不同,种植体周围炎来源的成骨细胞的增殖活力整体低于正常组织来源的成骨细胞。笔者认为这是由于种植体周围炎的炎性微环境抑制了成骨细胞的增殖能力。
Runx2和Col Ⅰ是反应成骨细胞分化能力的重要指标,Runx2是成骨细胞分化的关键转录因子,在骨组织的形成与重建过程中具有重要的作用[5]。炎性因子会影响Runx2的表达从而抑制成骨细胞的分化能力[6]–[7]。Col Ⅰ是成骨细胞分化成骨的重要基质。研究[8]表明,种植体周围炎的龈沟液中Col Ⅰ水平下降。本研究结果显示,种植体周围炎来源的成骨细胞的Runx2和Col Ⅰ表达水平相比正常组织来源显著下降,表明炎性微环境可影响成骨细胞的成骨分化能力,抑制Runx2和Col Ⅰ的正常表达,这与Liu等[9]对干细胞的研究结果一致。
OCN与成骨细胞的矿化紧密相关,在一定程度上反应了成骨细胞矿化的能力。学者[10]研究证实炎性微环境会降低OCN的表达。本研究中,种植体周围炎来源的成骨细胞由于在炎性微环境下降低了OCN mRNA的表达,从而导致OCN蛋白水平也明显降低。可见炎性微环境抑制了成骨细胞矿化的能力。
炎性微环境下成骨细胞的生物学功能受多方面调控,通过对比种植体周围炎来源的成骨细胞和正常组织来源的成骨细胞的生物学功能变化,可以确定炎性微环境下成骨细胞的生物学功能受到影响,成骨分化及矿化能力显著降低,这是种植体周围骨组织吸收的重要原因。其具体机制尚需进一步的深入研究。
Funding Statement
[基金项目] 国家自然科学基金资助项目(81271180)
References
- 1.宋 祥晨, 张 福萍, 李 希庭, et al. 牙龈卟啉单胞菌W83牙龈蛋白酶的提取、鉴定及对人成骨细胞增殖、凋亡的影响[J] 中华口腔医学研究杂志: 电子版. 2013;7(4):305–311. [Google Scholar]
- 2.薛 立伟, 张 君, 王 旭霞, et al. 肿瘤坏死因子-α对大鼠成骨细胞生长影响的实验研究[J] 华西口腔医学杂志. 2009;27(4):378–380. [PubMed] [Google Scholar]
- 3.鄂 玲玲, 刘 洪臣, 王 东胜. 贴壁组织块反复消化法培养新生大鼠下颌骨成骨细胞及鉴定[J] 华西口腔医学杂志. 2009;27(2):130–134. [PubMed] [Google Scholar]
- 4.Dvorak G, Reich KM, Tangl S, et al. Cortical porosity of the mandible in an osteoporotic sheep model[J] Clin Oral Implants Res. 2011;22(5):500–505. doi: 10.1111/j.1600-0501.2010.02031.x. [DOI] [PubMed] [Google Scholar]
- 5.Greenblatt MB, Shim JH, Glimcher LH, et al. Mitogen-activated protein kinase pathways in osteoblasts[J] Annu Rev Cell Dev Biol. 2013;29:63–79. doi: 10.1146/annurev-cellbio-101512-122347. [DOI] [PubMed] [Google Scholar]
- 6.Lee HL, Yi T, Woo KM, et al. Msx2 mediates the inhibitory action of TNF-alpha on osteoblast differentiation[J] Exp Mol Med. 2010;42(6):437–445. doi: 10.3858/emm.2010.42.6.045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Gilbert LC, Chen H, Lu X, et al. Chronic low dose tumor necrosis factor-α (TNF) suppresses early bone accrual in young mice by inhibiting osteoblasts without affecting osteoclasts[J] Bone. 2013;56(1):174–183. doi: 10.1016/j.bone.2013.06.002. [DOI] [PubMed] [Google Scholar]
- 8.Tümer C, Aksoy Y, Güncü GN, et al. Possible impact of inflammatory status on C-telopeptide pyridinoline cross-links of type Ⅰ collagen and osteocalcin levels around oral implants with peri-implantitis: a controlled clinical trial[J] J Oral Rehabil. 2008;35(12):934–939. doi: 10.1111/j.1365-2842.2008.01879.x. [DOI] [PubMed] [Google Scholar]
- 9.Liu N, Shi S, Deng M, et al. High levels of β-catenin signaling reduce osteogenic differentiation of stem cells in inflammatory microenvironments through inhibition of the noncanonical Wnt pathway[J] J Bone Miner Res. 2011;26(9):2082–2095. doi: 10.1002/jbmr.440. [DOI] [PubMed] [Google Scholar]
- 10.Pacios S, Andriankaja O, Kang J, et al. Bacterial infection increases periodontal bone loss in diabetic rats through enhanced apoptosis[J] Am J Pathol. 2013;183(6):1928–1935. doi: 10.1016/j.ajpath.2013.08.017. [DOI] [PMC free article] [PubMed] [Google Scholar]