Abstract
目的
前期研究发现降钙素基因相关肽(CGRP)能够促进成骨细胞的生物学活性,为了进一步揭示CGRP在骨修复中的作用,检测CGRP对小鼠骨髓间充质干细胞(BMSCs)成骨分化的影响,并对Hippo通路在这个过程中的作用进行了初步探讨。
方法
在体外诱导培养的BMSCs中加入不同浓度的CGRP,处理48 h后测试碱性磷酸酶(ALP)活性,以筛选的优势浓度;处理7 d后进行茜素红染色,分别检测细胞的分化情况。应用Western blot检测CGRP作用于BMSCs后,Hippo通路核心分子Mst1/2蛋白磷酸化的表达水平;利用Hippo通路抑制剂维替泊芬(Verteporfin)阻断下游Yap信号,逆转录聚合酶链反应检测其对成骨相关因子Ⅰ型胶原蛋白(ColⅠ)、Runt相关转录因子2(Runx2)mRNA的表达影响。
结果
ALP活性检测结果显示,与空白对照组相比,10−9、10−8、10−7 mol·L−1浓度范围的CGRP都能显著促进小鼠ALP活性的增加(P<0.05),以10−8 mol·L−1浓度的CGRP为最佳刺激浓度。用10−8 mol·L−1浓度的CGRP处理后,茜素红染色显示钙化结节明显增多。CGRP能够显著上调p-Mst1/2蛋白的表达(P<0.05);当运用了抑制剂Verteporfin时,显著降低了CGRP诱导的Runx2、ColⅠ mRNA的表达(P<0.05)。
结论
CGRP能够促进小鼠BMSCs的成骨分化,且Hippo信号通路介导了CGRP作用于小鼠BMSCs成骨分化的过程。
Keywords: 降钙素基因相关肽, 骨髓间充质干细胞, Hippo信号通路
Abstract
Objective
Previous studies have clarified that calcitonin gene-related peptide (CGRP) can promote the biological activity of osteoblasts. To further reveal the role of CGRP in bone repair, we studied its influence on osteogenic differentiation of mouse bone marrow stromal cells (BMSCs) and initially explored the effect of the Hippo signaling pathway with this process.
Methods
BMSCs were induced to osteogenic differentiate osteoblasts by different concentrations of CGRP for a screening of the optimal concentration. CGRP was added in BMSCs, then the activity of alkaline phosphatase (ALP) and the number of mineralized nodules were examined by specific ALP kits after 48 hours and alizarin red staining fluid after 7 days, respectively. The protein expression of p-Mst1/2 was measured by Western blot. Verteporfin was used to block the downstream Yap signaling. The mRNA expression of collagen typeⅠ(ColⅠ) and runt-related transcription factor 2 (Runx2) were detected by reverse transcription-polymerase chain reaction.
Results
Compared to the blank group, different concentrations of CGRP (10−9, 10−8, 10−7 mol·L−1), especially 10−8 mol·L−1, significantly increased the ALP activity of BMSCs (P<0.05). Alizarin red staining also showed more mineralized nodules in 10−8 mol·L−1 group. The expression of p-Mst1/2 increased in the CGRP group (P<0.05). Verteporfin treatment effectively decreased the mRNA expression of Runx2 and ColⅠ(P<0.05).
Conclusion
The Hippo signaling pathway plays a role in CGRP-induced osteogenic differentiation in mouse BMSCs.
Keywords: calcitonin gene-related peptide, bone marrow stromal cells, Hippo signaling pathway
降钙素基因相关肽(calcitonin gene-related peptide,CGRP)在骨发育、骨代谢、骨修复以及种植体周围的骨重建中都具有重要的病理生理学意义。本课题组在前期的实验中发现,CGRP能显著促进体外培养的人MG-63成骨细胞样细胞和鼠成骨细胞的增殖和分化,并且探究了MG-63细胞蛋白质组在CGRP参与的骨创伤修复过程中的变化[1]–[2],这些结果更加明确了CGRP在骨修复中具有的重要意义。最近,一条在果蝇细胞内发现的新通路——Hippo信号通路,因其能够级联网络控制细胞的周期进程、凋亡以及分化,是许多生理和病理过程的基础调节器而备受关注[3]–[5]。骨修复本身是一个复杂的生理过程,是多种细胞、细胞因子以及信号之间的协同参与的紧密调控过程;在CGRP调控骨修复的过程中,Hippo信号通路是否涉及其中,尚未见相关报道。众所周知,骨髓间充质干细胞(bone marrow stromal cells,BMSCs)因具有取材方便、可塑性高、抗感染能力强等特点,在骨组织损伤修复中应用前景十分广阔[6]–[7]。为了进一步揭示CGRP在骨修复中的作用,本研究检测了CGRP对小鼠BMSCs成骨分化的影响,并初步探讨了Hippo通路在CGRP的调控过程中所具有的作用。
1. 材料和方法
1.1. 材料
小鼠BMSCs细胞系C3H10T1/2购于中国科学院上海生命科学研究院细胞库。CGRP、β-甘油磷酸钠、抗坏血酸、地塞米松(Sigma公司,美国),p-Mst1/2抗体(CST公司,美国),Hippo通路抑制剂维替泊芬(Verteporfin)(Selleckchem公司,美国),胎牛血清、DMEM/F12培养基、0.25%胰蛋白酶(Hyclone公司,美国),茜素红染液、青链霉素混合液(北京索莱宝科技有限公司),碱性磷酸酶(alkaline phosphatase,ALP)试剂盒(南京建成生物工程研究所),总RNA提取试剂(RNAiso Plus)、反转录反应试剂盒、实时定量荧光PCR试剂盒(Takara公司,日本),全波长多功能酶标仪(Thermo公司,美国)。
1.2. 方法
1.2.1. 细胞培养
C3H10T1/2细胞常规用含10%胎牛血清、1%青链霉素混合液的DMEM/F12培养基,在37 °C、5%CO2的饱和湿度培养箱中培养,隔天更换1次培养基,待细胞融合达80%左右时用0.25%胰蛋白酶消化传代。
1.2.2. 细胞内ALP活性检测
C3H10T1/2细胞以每孔1×105个的密度接种于6孔板中,待细胞贴壁生长至对数生长期,分别加入0(空白对照组)、10−10、10−9、10−8、10−7 mol·L−1的CGRP进行处理,48 h后收集细胞裂解液,按试剂盒说明书进行ALP活性测定。每组设置3个复孔。
1.2.3. 茜素红染色
C3H10T1/2细胞以每孔1×105个的密度接种于6孔板中,待细胞贴壁后随机分为空白对照组和实验组。空白对照组不加CGRP,实验组加入等量含10−8 mol·L−1 CGRP的培养基,每孔2 mL,每3 d换液一次。7 d后弃掉培养基,PBS冲洗3次,95%无水乙醇固定10 min,0.1%茜素红-Tris-Hcl(pH=8.3)溶液37 °C染色30 min,蒸馏水冲洗3次,干燥,封片,镜下观察钙化结节形态、数目。
1.2.4. Western
blot检测p-Mst1/2蛋白表达 为了明确CGRP诱导的C3H10T1/2细胞成骨分化过程中是否涉及到Hippo信号通路,采用Western blot检测Hippo通路核心分子Mst1/2磷酸化水平的变化。细胞以每孔1×106个的密度接种于6孔板中,24 h后细胞贴壁,在培养基中加入CGRP作用24、48 h后提取细胞总蛋白并采用BCA法测样品蛋白含量。倍比稀释样品,每孔上样量为20 µL。聚丙烯酰胺凝胶电泳(10%分离胶、5%浓缩胶),转膜2 h,5%牛血清白蛋白(albumin from bovine serum,BSA)封闭。一抗4 °C孵育过夜,TBST漂洗4次,每次10 min。加入相应二抗,37 °C孵育1 h,TBST漂洗4次,每次10 min。按照电化学发光(electrochemiluminescence,ECL)超敏试剂说明书显影,图像分析。
1.2.5. 总RNA提取和荧光定量PCR检测
为了进一步明确Hippo信号参与CGRP调控C3H10T1/2细胞成骨分化的方式,采用Hippo信号通路抑制剂Verteporfin对C3H10T1/2细胞进行预处理,并观察抑制Hippo信号后,对CGRP作用于C3H10T1/2细胞Ⅰ型胶原蛋白(collagen typeⅠ,ColⅠ)、Runt相关转录因子2(runt-related transcription factor 2,Runx2)mRNA表达所产生的影响。将C3H10T1/2细胞以每孔1×105个的密度接种于6孔板中,并随机分为空白对照组和实验组。待细胞融合度达80%时,空白对照组和实验组均加入成骨诱导培养基(含10 mmol·L−1 β-甘油磷酸钠、50 mg·L−1抗坏血酸、1×10−8 mol·L−1地塞米松、10%胎牛血清、1%青链霉素混合液)。实验组加或不加Hippo通路抑制剂Verteporfin,提前0.5 h对细胞行预处理。且实验组中还加入10−8 mol·L−1 CGRP作用24 h和48 h,后收集细胞并用RNAiso Plus提取总RNA,按试剂盒说明书取1 µg RNA合成cDNA,再以cDNA为模板进行荧光定量PCR反应。反应条件为:95 °C 30 s预变性后95 °C 5 s,60 °C 34 s,40个循环。所用引物由上海生工生物工程公司设计并合成。引物序列如下。ColⅠ上游引物序列:5′-TAAGGGTCCCCAATGGTGAGA-3′,下游引物序列:5′-GGGTCCCTCGACTCCTACAT-3′;Runx2上游引物序列:5′-GCCGGGAATGATGAGAACTA-3′,下游引物序列:5′-GGTGAAACTCTTGCCTCGTC-3′;磷酸甘油醛脱氢酶(glyceraldehyde phos-phate dehydrogenase,GAPDH)上游引物序列:5′-GGTGAAGGTCGGTGTGAACG-3′,下游引物序列:5′-CTCGCTCCTGGAAGATGGTG-3′。反应结束后PCR仪自动生成荧光循环阈值(cycle threshold,CT),用各组mRNA与内参基因GAPDH的CT值差值(ΔCT)表示各组mRNA相对表达量。
1.3. 统计学分析
采用SPSS 17.0统计软件对实验数据进行处理,以上实验均重复3次,采用单因素方差分析进行差异显著性分析,以P<0.05为差异有统计学意义。采用GraphPad Prism 5软件作图。
2. 结果
2.1. CGRP促进C3H10T1/2细胞分化的检测结果
不同浓度CGRP作用C3H10T1/2细胞48 h后,0、10−10、10−9、10−8、10−7 mol·L−1组ALP活性测量值分别为(190.342±7.406)、(223.475±9.911)、(407.289±11.069)、(835.770±38.464)、(436.674±28.521) U·g prot−1。与空白对照组相比较,除了10−10 mol·L−1组外,其余各组均能显著促进细胞的ALP活性(P<0.05),并呈浓度依赖性,且10−8 mol·L−1为最佳刺激浓度,这与本课题组前期筛选的浓度是一致的[8]。茜素红染色的结果提示,与空白对照组相比,10−8 mol·L−1 CGRP处理后的C3H10T1/2细胞分泌形成钙化结节的数目明显增多(图1)。
图 1. 成骨分化能力检测 茜素红染色 × 100.
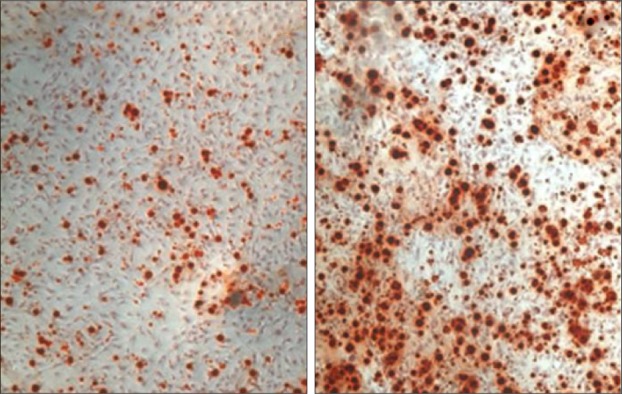
Fig 1 Ability of osteogenesis differentiation alizarin red staining × 100
左:空白对照组;右:实验组。
2.2. CGRP促进C3H10T1/2细胞成骨分化中p-Mst1/2的表达变化
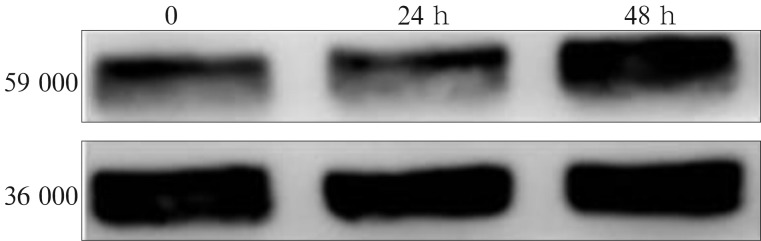
采用Western blot检测Hippo通路核心分子Mst1/2磷酸化水平的变化结果见图2。在10−8 mol·L−1的CGRP作用下,p-Mst1/2的表达相对于对照组都是明显增高的(P<0.05)。这说明在CGRP的作用下,Hippo信号产生了活化,这与前面的假设也是一致的。
图 2. CGRP对C3H10T1/2细胞p-Mst1/2表达的影响.
Fig 2 Effect of CGRP on p-Mst1/2 protein expression in C3H10T1/2 cells
上:p-Mst1/2;下:GAPDH。
2.3. Verteporfin作用下CGRP诱导的ColⅠ、Runx2 mRNA表达的改变
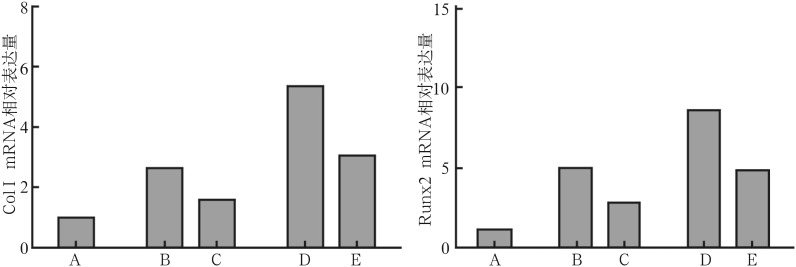
运用Verteporfin后,无论是24 h还是48 h,都能显著降低CGRP诱导的ColⅠ、Runx2的表达(P<0.01)(图3)。提示Hippo信号在CGRP调节BMSCs成骨分化中起一种正向调控作用。
图 3. Verteporfin对CGRP作用下ColⅠ和Runx2 mRNA表达的影响.
Fig 3 Influence of Verteporfin on CGRP-induced ColⅠand Runx2 mRNA expression
左:ColⅠmRNA;右:Runx2 mRNA;A:空白对照组;B:加CGRP、不加Verteporfin处理24 h;C:加CGRP、加Verteporfin处理24 h;D:加CGRP、不加Verteporfin处理48 h;E:加CGRP、加Verteporfin处理48 h。
3. 讨论
BMSCs是中胚层来源的一种具有自我更新和多向分化能力的成体干细胞,具有强烈的成骨潜能,一直被认为是骨组织工程的理想种子细胞[9]–[10]。将BMSCs与支架材料结合后移植到创伤部位是现今最好的局部骨缺损修复方法之一[11]。在骨折的自然愈合过程中,BMSCs能直接迁移至损伤部位增殖、分化成骨[12]。动物骨折的模型中,与正常野生型小鼠相比,糖尿病小鼠骨折愈合延迟,骨痂内BMSCs数目显著减少[13]。如何有效地募集BMSCs至修复区并促进其增殖与分化,一直是骨修复中存在的难点。CGRP是一种主要由感觉神经分泌的小分子神经递质,因在临床上颅脑损伤的骨折患者迅速的骨愈合现象中被重视。骨折发生时,在骨折局部以及患者血浆中CGRP含量均明显升高[14]–[15];提示这个小分子肽很可能参与了骨折修复的过程。体内实验证实,CGRP基因敲除的小鼠与野生型小鼠相比,会表现出更严重的骨缺失[16]。体外试验也明确了CGRP能够诱导成骨细胞的增殖和分化[17]。作为骨修复最佳的种子细胞BMSCs,是否也能够被CGRP作用并刺激其生物学活性?实际上有学者[18]通过激光共聚焦发现小鼠BMSCs表面存在着CGRP受体复合物:降钙素受体样受体(calcitonin receptor like receptor,CRLR)和受体活性修饰蛋白(receptor activity modifying protein,RAMP)。在本实验中观察了CGRP对BMSCs成骨分化的影响,结果显示CGRP不仅能够刺激成骨细胞的分化,也能够促进BMSCs的分化,且浓度为10−8 mol·L−1时为最佳刺激浓度。最初关注到Hippo信号通路时,是因为其与肿瘤的发生发展具有密切联系。近年来,该通路在骨组织生长、代谢尤其是干细胞干性维持方面的作用越来越引起研究人员的注意[19]–[20]。在CGRP调控的成骨分化过程中,Hippo通路是否涉及其中,还不甚清楚。通过对Mstl/2磷酸化的检测,能够证实在CGRP作用于BMSCs过程中能够上调p-Mstl/2的表达;更进一步的检测发现通过抑制剂Verteporfin的应用,能够明显抑制CGRP诱导的ColⅠ、Runx2 mRNA的表达,说明CGRP通过Hippo信号作用于BMSCs细胞。这一结果对深入了解CGRP在成骨修复的过程中所具有的作用做了有力的补充。
目前关于Hippo通路的研究日趋丰富。已知的Hippo信号核心分子包括Mst1/2、Sav1、Lats1/2和Mob1,效应分子包括Yap和Taz。其中,激酶Mstl/2在人体组织中分布广泛,并且可通过磷酸化调控其余的3种核心蛋白,实际上Mstl/2的磷酸化可以被认为是该通路激活的重要指标[21],这也是在本实验中着重检测p-Mstl/2的原因。Hippo通路的激活方式有2种,一种是刺激信号磷酸化活化Mst1/2,并经过一系列的级联磷酸化反应后最终磷酸化Yap,使其产生一个14-3-3蛋白结合位点,与14-3-3蛋白的结合促使Yap滞留在细胞质而失去转录激活功能。另一种是非磷酸化依赖途径,即Yap自身特异性WW结构域识别并结合Mst1/2、Lats1/2等上游信号分子的PPXY模序,进而抑制Yap的转录调节活性。
目前为止,Hippo通路在调控BMSCs分化中的研究仅限于Yap/Taz,该通路中其他信号分子的作用尚未见报道。本研究从Hippo通路的核心分子Mstl/2着眼,发现在CGRP促进小鼠BMSCs成骨分化的过程中,激酶Mstl/2的磷酸化水平上升,证实了该通路的激活。
本研究主要从功能上揭示了Hippo信号通路参与了CGRP促进BMSCs向成骨方向分化。但对于Hippo通路与CGRP通过何种分子机制实现此调控还需深入研究。更进一步的研究还在继续,以期为CGRP的转化应用奠定基础。
Funding Statement
[基金项目] 国家自然科学基金(81371110,81300873)
Supported by: The National Natural Science Foundation of China (81371110, 81300873).
References
- 1.赵 智亮. 受体活性修饰蛋白1过表达对降钙素基因相关肽促MG-63增殖和分化作用的影响研究[D] 重庆: 第三军医大学; 2013. pp. 14–48. [Google Scholar]; Zhao ZL. The influence of receptor activity modifying protein 1 overexpression on CGRP-induced osteogenic proliferation and differentiation in MG-63 cells in vitro: an experimental study[D] Chongqing: Third Military Medical University; 2013. pp. 14–48. [Google Scholar]
- 2.李 焰, 张 纲, 郑 加军, et al. 下齿槽神经缺失对下颌骨骨折愈合影响的实验研究[J] 西南军医. 2008;10(1):11–14. [Google Scholar]; Li Y, Zhang G, Zheng JJ, et al. Affection of IAN absence on the healing of mandibular fracture[J] J Military Surgeon Southwest China. 2008;10(1):11–14. [Google Scholar]
- 3.He C, Mao D, Hua G, et al. The Hippo/YAP pathway interacts with EGFR signaling and HPV oncoproteins to regulate cervical cancer progression[J] EMBO Mol Med. 2015;7(11):1426–1449. doi: 10.15252/emmm.201404976. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Gailite I, Aerne BL, Tapon N. Differential control of Yorkie activity by LKB1/AMPK and the Hippo/Warts cascade in the central nervous system[J] Proc Natl Acad Sci USA. 2015;112(37):E5169–E5178. doi: 10.1073/pnas.1505512112. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Verghese S, Bedi S, Kango-Singh M. Hippo signalling controls Dronc activity to regulate organ size in Drosophila[J] Cell Death Differ. 2012;19(10):1664–1676. doi: 10.1038/cdd.2012.48. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Shi C, Jia T, Mendez-Ferrer S, et al. Bone marrow mesenchymal stem and progenitor cells induce monocyte emigration in response to circulating toll-like receptor ligands[J] Immunity. 2011;34(4):590–601. doi: 10.1016/j.immuni.2011.02.016. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Tolar J, Villeneuve P, Keating A. Mesenchymal stromal cells for graft-versus-host disease[J] Hum Gene Ther. 2011;22(3):257–262. doi: 10.1089/hum.2011.1104. [DOI] [PubMed] [Google Scholar]
- 8.Tian G, Zhang G, Tan YH. Calcitonin gene-related peptide stimulates BMP-2 expression and the differentiation of human osteoblast-like cells in vitro[J] Acta Pharmacol Sin. 2013;34(11):1467–1474. doi: 10.1038/aps.2013.41. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Phinney DG. Biochemical heterogeneity of mesenchymal stem cell populations: clues to their therapeutic efficacy[J] Cell Cycle. 2007;6(23):2884–2889. doi: 10.4161/cc.6.23.5095. [DOI] [PubMed] [Google Scholar]
- 10.Wang ZX, Chen C, Zhou Q, et al. The treatment efficacy of bone tissue engineering strategy for repairing segmental bone defects under osteoporotic conditions[J] Tissue Eng Part A. 2015;21(17/18):2346–2355. doi: 10.1089/ten.TEA.2015.0071. [DOI] [PubMed] [Google Scholar]
- 11.Kneser U, Schaefer DJ, Polykandriotis E, et al. Tissue engineering of bone: the reconstructive surgeon's point of view[J] J Cell Mol Med. 2006;10(1):7–19. doi: 10.1111/j.1582-4934.2006.tb00287.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Chan JK, Götherström C. Prenatal transplantation of mesenchymal stem cells to treat osteogenesis imperfecta[J] Front Pharmacol. 2014;5:223. doi: 10.3389/fphar.2014.00223. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Ko KI, Coimbra LS, Tian C, et al. Diabetes reduces mesenchymal stem cells in fracture healing through a TNFα-mediated mechanism[J] Diabetologia. 2015;58(3):633–642. doi: 10.1007/s00125-014-3470-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Li J, Kreicbergs A, Bergström J, et al. Site-specific CGRP innervation coincides with bone formation during fracture healing and modeling: a study in rat angulated tibia[J] J Orthop Res. 2007;25(9):1204–1212. doi: 10.1002/jor.20406. [DOI] [PubMed] [Google Scholar]
- 15.Onuoha GN. Circulating sensory peptide levels within 24 h of human bone fracture[J] Peptides. 2001;22(7):1107–1110. doi: 10.1016/s0196-9781(01)00434-x. [DOI] [PubMed] [Google Scholar]
- 16.Huebner AK, Schinke T, Priemel M, et al. Calcitonin deficiency in mice progressively results in high bone turnover[J] J Bone Miner Res. 2006;21(12):1924–1934. doi: 10.1359/jbmr.060820. [DOI] [PubMed] [Google Scholar]
- 17.蒋 章, 张 慧宇, 张 纲, et al. RAMP1-siRNA对CGRP促MG-63细胞增殖作用影响的实验研究[J] 实用口腔医学杂志. 2015;31(3):339–342. [Google Scholar]; Jiang Z, Zhang HY, Zhang G, et al. Experimental study on the effect of RAMP1-siRNA on CGRP-induced proliferation of MG-63 cells[J] J Pract Stomatol. 2015;31(3):339–342. [Google Scholar]
- 18.Wang L, Shi X, Zhao R, et al. Calcitonin-gene-related peptide stimulates stromal cell osteogenic differentiation and inhibits RANKL induced NF-kappaB activation, osteoclastogenesis and bone resorption[J] Bone. 2010;46(5):1369–1379. doi: 10.1016/j.bone.2009.11.029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Maroni P, Matteucci E, Drago L, et al. Hypoxia induced E-cadherin involving regulators of Hippo pathway due to HIF-1α stabilization/nuclear translocation in bone metastasis from breast carcinoma[J] Exp Cell Res. 2015;330(2):287–299. doi: 10.1016/j.yexcr.2014.10.004. [DOI] [PubMed] [Google Scholar]
- 20.Lian I, Kim J, Okazawa H, et al. The role of YAP transcription coactivator in regulating stem cell self-renewal and differentiation[J] Genes Dev. 2010;24(11):1106–1118. doi: 10.1101/gad.1903310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Zhao B, Lei QY, Guan KL. The Hippo-YAP pathway: new connections between regulation of organ size and cancer[J] Curr Opin Cell Biol. 2008;20(6):638–646. doi: 10.1016/j.ceb.2008.10.001. [DOI] [PMC free article] [PubMed] [Google Scholar]