Abstract
目的
研究不同功率的水冷Nd: YAG激光照射治疗对牙根面结构及变异链球菌黏附的影响。
方法
将因重度慢性牙周炎拔除的离体牙分为4组,均进行手工刮治和根面平整,制备牙根片,激光1、2、3组分别用功率为4、6、8 W的水冷Nd: YAG激光照射处理60 s,对照组不作处理。用扫描电子显微镜(SEM)观察各组根片的表面结构。将变异链球菌接种于各组牙根片表面并进行培养,计数各组根片表面细菌的黏附量(CFU·mL−1);同时用SEM观察对照组及激光2组根面的细菌黏附情况。
结果
SEM观察根片表面结构,激光组较对照组牙根表面的玷污层、碎屑及菌斑样物质附着减少,但裂隙增多。3个激光组牙根表面的细菌黏附量均少于对照组(P<0.05),而不同功率的激光组之间的差异无统计学意义(P>0.05)。SEM观察细菌黏附情况,激光2组表面的细菌黏附量明显少于对照组。
结论
与单纯刮治相比,刮治后进行水冷Nd: YAG激光治疗能清除牙根表面的玷污层、碎屑及菌斑样物质,并能减少变异链球菌的黏附,但激光会导致牙根表面出现裂隙。本实验中,6 W为激光最佳功率,既能较好地去除牙根表面的玷污层和碎屑等,又能较好地控制激光对根面的热损害程度。
Keywords: Nd: YAG激光, 变异链球菌, 根面
Abstract
Objective
This study aimed to evaluate the effects of treatment with different powers of Nd: YAG laser irradiation on root surfaces and Streptococcus mutans (S. mutans) adhesion.
Methods
Extracted teeth because of severe periodontal disease were divided into the following four groups: control group, laser group 1, laser group 2, and laser group 3. After scaling and root planning, laser group 1, laser group 2, and laser group 3 were separately treated with Nd: YAG laser irradiation (4/6/8 W, 60 s); however, the control group did not receive the treatment. Scanning electron microscopy (SEM) was used to determine the morphology. S. mutans were cultured with root slices from each group. Colony forming unit per mL (CFU·mL−1) was used to count and compare the amounts of bacteria adhesion among groups. SEM was used to observe the difference of bacteria adhesion to root surfaces between control group (scaling) and laser group 2 (6 W, 60 s), thereby indicating the different bacteria adhesions because of different treatments.
Results
Morphology alterations indicated that root surfaces in control group contain obvious smear layer, debris, and biofilm; whereas the root surfaces in laser group contain more cracks with less smear layer and debris. The bacteria counting indicated that S. mutans adhesion to laser group was weaker than that of control group (P<0.05). No statistical significance among the laser groups (P>0.05) was observed. Morphology alterations also verified that S. mutans adhesion to laser group 2 (6 W, 60 s) was weaker than that of control group (scaling).
Conclusion
This study demonstrated that Nd: YAG laser irradiation treatment after scaling can reduce smear layer, debris, and biofilm on the root surfaces as compared with conventional scaling. The laser treatment reduces the adhesion of S. mutans as well. However, Nd: YAG laser irradiation can cause cracks on the root surfaces. In this experiment, the optimum laser power of 6 W can thoroughly remove the smear layer and debris, as well as relatively improve the control of thermal damagee.
Keywords: Nd: YAG laser, Streptococcus mutans, root surfaces
牙周炎和龋病是人口腔内常见的慢性感染性疾病,慢性牙周炎由于牙槽骨吸收、牙周袋形成、牙龈萎缩常导致牙根表面暴露。研究[1]发现,不同口腔环境中牙周致病菌与变异链球菌在数量上通常呈负相关。牙周基础治疗后,牙周生态环境改变,变异链球菌等致龋菌数量增加,根面龋的易患性增加,牙根面细菌由牙周致病菌转变为以变异链球菌为代表的致龋菌。致龋菌发挥致病作用主要是以牙菌斑生物膜的形式,而变异链球菌作为公认的主要致龋菌之一,其对牙面的黏附是口腔菌斑成熟与向致龋性菌斑转化的标志,是牙菌斑形成的前提,也是其致龋的重要基础。口腔内菌斑形成的首要阶段是获得性膜形成和细菌的初期聚集,变异链球菌在牙面的初始黏附实际上是细菌在唾液获得性膜上的黏附,变异链球菌的初始黏附对之后菌斑内细菌的迅速生长增殖聚集起着重要作用[2]。Nd: YAG激光作为一种非手术治疗手段,因其具有杀菌、缓解牙本质敏感等作用[3]–[4],目前正广泛应用于口腔疾病的辅助治疗当中。目前关于激光作为辅助治疗手段与单独刮治治疗牙周病相比,细菌对牙面黏附的差异以及激光治疗时参数的选择等还有待进一步研究。本实验通过对不同功率的激光照射组与单纯刮治组进行比较,探讨激光对牙根面结构及变异链球菌黏附的影响。
1. 材料和方法
1.1. 样本制备
1.1.1. 样本选择
收集因重度牙周炎拔除的磨牙和前磨牙,用生理盐水冲洗后备用。纳入标准:1)Ⅲ度松动的严重患牙,邻面牙周袋及附着丧失大于5 mm,无保留价值,存在龈下牙石;2)近半年内未进行过牙周治疗,未服用抗生素。排除标准:1)患牙根面有龋坏或缺损;2)患有全身系统性疾病。
1.1.2. 分组处理和牙根片制备
离体牙分别在牙根标记处理范围后,用刮治器对所有牙齿的根面进行刮治处理,使根面无残留软组织及牙石附着,用尖锐探针探查及肉眼观察根面平整光滑。在邻面釉牙骨质界下约1 mm处向根方做出3 mm×3 mm的标记。
将处理后的患牙随机分为4组,即对照组、激光1组、激光2组、激光3组。对照组不作其他处理,为单纯刮治组;激光1、2、3组用波长为1 064 nm,输出功率分别为4 W(每次脉冲80 mJ)、6 W(每次脉冲120 mJ)、8 W(每次脉冲160 mJ)的水冷Nd:YAG激光(Genius公司,丹麦)连续照射60 s。照射时激光光纤与根面轻触且成小于30°照射角度,在牙面冠根方上下快速扫描式移动,覆盖整个标记区域。各组其他参数的设置均一致:水和气均采取激光机的第“8”档,频率每秒50次,使用的光纤头直径为600 µm[5]–[10]。
取上述处理完成后的所有牙齿,分别在水冷却下从邻面釉牙骨质界下约1 mm处向根方切取3 mm×3 mm×l mm的根片,每张根片除牙根表面之外的其余各面均用细砂纸打磨光滑平整,分别从每组中选取较为平整的根片,其中对照组(单纯刮治)14片,激光1组(4 W)12片,激光2组(6 W)14片,激光3组(8 W)12片,过氧化氢等离子灭菌后备用。
1.2. 各组根片表面结构观察
从每组样本中分别随机抽取2张根片,生理盐水冲洗干净,干燥、喷金,扫描电子显微镜(scanning electron microscopy,SEM)下观察根片的表面形态。
1.3. 细菌黏附实验
1.3.1. 菌株、材料与仪器
变异链球菌参考株UA159(四川大学口腔疾病研究国家重点实验室提供);脑心浸液(brain-heart infusion,BHI)培养基(Oxoid公司,英国),唾液,生理盐水。0.22 µm孔径滤器(Millipore公司,美国),细菌培养箱(义乌冷冻机总厂),分光光度计(Shimadzu公司,日本),漩涡振荡器(IKA公司,德国)。
1.3.2. 唾液与牙根片的准备
选择1名健康成人志愿者,进食2 h后用清水漱口,不加任何刺激物收集唾液20 mL,置于离心管中,4 °C下10 000 r·min−1离心10 min,取上清液,以0.22 µm的微孔滤膜过滤除菌后备用[11]。将根片浸泡在唾液中24 h,形成人工获得性膜,制成唾液包被牙根片。
1.3.3. 细菌培养及菌液制备
将变异链球菌冻干菌株接种于BHI固体培养基,37 °C、混合气(体积分数氮气为75%、氢气为10%、二氧化碳为15%)条件下培养48 h,挑取单个菌落接种于 BHI 液体培养基,继续于上述条件下培养18 h,经涂片检查为纯培养后采用分光光度计测量细菌悬液的密度,用BHI液体培养基调整细菌悬液的密度,用菌落形成单位(colony forming unit,CFU)表示,调整至1×108 CFU·mL−1,备用。
1.3.4. 细菌接种于根片
将处理过的剩余根片表面朝上置于48孔板底部,将细菌接种于含根片的48孔板中,每孔100 µL,再加入BHI液体培养基900 µL,于37 °C、混合气条件下培养24 h,进行细菌计数及SEM观察。
1.3.5. 细菌计数
培养结束后,各组选取10个标本,用灭菌生理盐水清洗10次,去除表面没有黏附的菌落,放入盛有5 mL灭菌生理盐水的试管中备用。漩涡振荡器上振荡30 s。将标本原液用10倍系列稀释法稀释,选择稀释倍数为10、100、1 000的菌液,分别取稀释液0.1 mL接种于BHI固体培养基,每个稀释度接种3个培养基,培养48 h后,选择菌落计数为20~200个之间的稀释度进行计数,乘以稀释倍数后即得到黏附量,单位为CFU·mL−1。
1.3.6. SEM观察细菌黏附情况
分别将对照组及激光2组(6 W)剩余的2张根片取出,用无菌生理盐水将根片冲洗干净,放入2.5%戊二醛液4 °C下固定24 h后备用。将固定后的标本行乙醇梯度脱水,每次10 min,空气中干燥,真空纯金镀膜,SEM下观察牙根面情况并拍摄图像。
1.4. 统计学方法
对各组数据进行正态性及方差齐性检验,若服从正态分布,且各个样本方差齐,则组间比较采用方差分析(F检验),若不服从,则进行数据转换或非参数统计,检验水准为双侧α=0.05。
2. 结果
2.1. 牙根面形态的SEM观察
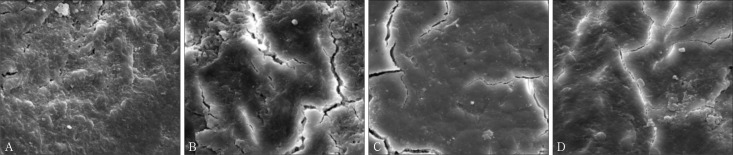
SEM观察结果见图1。对照组(单纯刮治):单纯刮治未经激光照射,可见明显玷污层,有碎屑及菌斑样物质附着,牙根表面不平整,未见明显裂隙、凹陷(图1A)。激光1组(4 W):根面出现明显裂隙、凹陷,根面玷污层、碎屑及菌斑样物质减少(图1B)。激光2组(6W):根面有明显裂隙,但无裂隙处较为平整,几乎无玷污层,有极少量碎屑及菌斑样物质(图1C)。激光3组(8 W):根面可见明显裂隙,有熔融、碎裂等热伤害现象,有少量碎屑,几乎未见玷污层及菌斑样物质(图1D)。
图 1. 不同处理组根面形态 SEM × 5 000.
Fig 1 Root surfaces morphology in control and laser groups SEM × 5 000
A:对照组;B:激光1组;C:激光2组;D:激光3组。
2.2. 变异链球菌黏附的比较
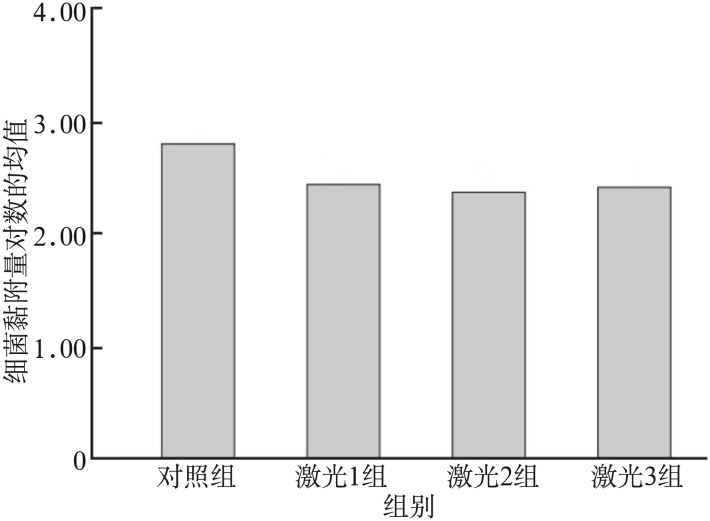
各组数据进行对数转换后进行正态性及方差齐性检验,数据服从正态分布且各样本方差齐,因此各组的组间比较采用方差分析。不同处理组变异链球菌的黏附量见图2。
图 2. 不同处理组变异链球菌黏附量的比较.
Fig 2 Comparison of Streptococcus mutans adhesion among control and laser groups
激光1、2、3组与对照组比较,差异均具有统计学意义(P<0.05),可以认为各激光组变异链球菌的黏附量较对照组少;而不同功率激光组间的差异无统计学意义(P>0.05)。
2.3. 变异链球菌黏附的SEM观察
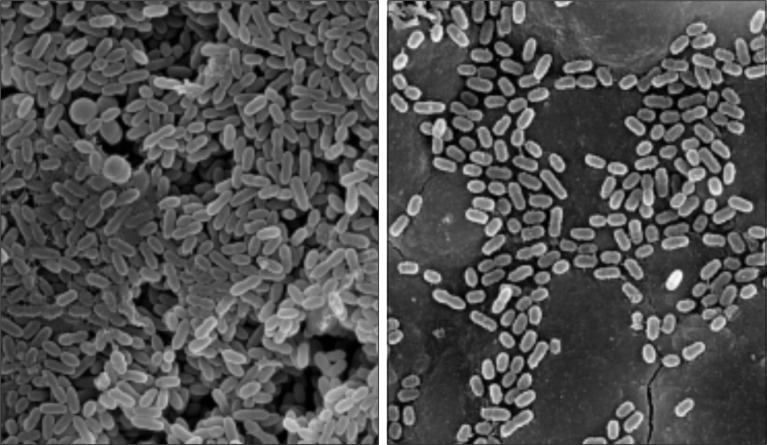
选择激光2组(6 W)作为激光组代表,进行细菌黏附的SEM观察,结果见图3。
图 3. 不同处理后的细菌黏附情况 SEM × 20 000.
Fig 3 Bacteria adhesion in different treatments SEM × 20 000
左:对照组;右:激光2组。
对照组可见有大量细菌黏附于牙根表面(图3左);激光2组可见有一定数量的细菌黏附于牙根表面,主要黏附于裂隙处,而其他相对较平整的牙根表面少见细菌黏附,黏附的细菌数量明显少于对照组(图3右)。
3. 讨论
牙周病治疗的主要目的是去除菌斑、牙石,平整根面,促进牙周再附着的形成。手用器械刮治作为目前常用的基础治疗手段尚存在一些缺点:费时费力,对操作敏感性高,根分叉处器械无法到达,患者在接受治疗时会产生不适感,术后有牙齿敏感等症状[12];此外,单纯刮治还会在牙根表面形成划痕、玷污层等[11]。相比于传统治疗手段,Nd: YAG激光操作简单方便,在杀菌、去除玷污层、气化牙结石、缓解牙本质敏感等方面具有独特的功能[3]–[4],但有关激光在使用时具体的参数设置及安全性等问题仍有待进一步研究。Slot等[5]用4 W的输出功率探入牙周袋内照射 60 s,测得细菌较治疗前显著减少;Qadri等[6]发现,手工刮治后辅助使用功率为4 W的激光照射治疗牙周病,效果优于单独刮治治疗;Kranendonk等[7]研究证明,牙周致病菌在功率为6 W的Nd: YAG激光照射15 s后显著减少,照射30 s和45 s后无细菌生长;Gašpirc等[13]采用Nd: YAG激光照射根面,牙根表面出现了裂缝、火山口及熔融碎裂等现象。激光的参数设置决定了激光的能量,从而影响激光的治疗效果。当生物物质一定时,激光与生物物质相互作用的效应取决于光斑大小(照射距离及角度)、激光功率和照射时间[14]。本实验选择易于控制及调节的激光功率作为实验变量进行研究,研究Nd: YAG激光对根面结构及细菌黏附的影响。
本实验将单纯刮治的对照组及经过不同功率设置的激光处理后的牙根面进行SEM观察,可以发现激光处理后的牙根面玷污层、碎屑及菌斑样物质附着明显少于单纯刮治组,但激光组表面有明显的裂隙、凹陷以及熔融碎裂等现象。该结果与国内外许多学者的研究基本一致,原因主要在于激光去除玷污层的同时会对牙面造成热伤害[13]。本实验采用的是水冷Nd: YAG激光,可在一定程度上降低激光对根面的热伤害,也可能是由于激光的热效应使表面附着的玷污层气化,进而使器械造成的根面划痕、裂隙等更明显地暴露出来所致[15]。此外,激光组中输出功率为6 W的组较4 W及8 W组的根面形态相对更为平整,与4 W组相比,玷污层、碎屑及菌斑样物质减少,而8 W组有更为明显的裂隙,甚至表面还出现了明显的熔融、碎裂等牙骨质损伤现象。由这些结果可得出本实验的初步结论:牙根表面进行单纯刮治治疗后,用波长为1 064 nm,输出功率分别为4、6、8 W的水冷Nd: YAG激光照射60 s,6 W组既能够较好地去除牙根表面的玷污层和碎屑等物质,又能较好地控制激光对根面的热损害程度;但仍需要进一步研究减少根面损伤程度的激光参数设置,如照射时间、距离、角度等。此外还需注意的是,口腔内存在再矿化等因素,根面的表面结构改变或许并不如实验中明显。
变异链球菌作为口腔主要的致龋菌,对唾液获得性膜的黏附是其致龋的重要基础。牙体表面细菌的黏附受多种因素的影响,黏附机制十分复杂。研究表明[16]–[18],细菌对牙面的黏附取决于牙面的粗糙度、表面自由能、电荷性及疏水性等因素的共同作用。变异链球菌的初始黏附是非蔗糖依赖性黏附,可能也包括黏附素-受体作用、静电作用、疏水作用和氢键作用等[2],但其具体机制至今尚不完全清楚。如何有效减少牙周病治疗后变异链球菌对牙根表面的黏附,从而减少牙周病的复发及根面龋的发生对临床治疗具有重要意义。目前关于激光对牙根表面的作用及影响细菌在牙面的初始黏附还少有研究。
本实验结果表明:经过激光处理后的牙面变异链球菌的黏附量较单纯刮治组明显减少,从SEM中可以看出,变异链球菌主要黏附于裂隙处,而其他相对较平整的牙根表面较少见。一方面可能是由于细菌的黏附量是由多种因素共同决定的,激光处理会使牙根表面自由能、表面疏水性等其他特征参数也发生变化,这些因素协同作用使细菌的黏附量减少。研究[13],[19]–[21]证实,激光能够改变牙面的电荷分布、晶体结构、氢键键能、电磁效应,使组织结构发生化学变化。另一方面,口腔硬组织以及口腔修复材料的表面粗糙度对细菌的最初黏附与滞留有着重要的作用,但其黏附量与粗糙度并非完全呈正相关。Quirynen等[16]发现,菌斑的黏附与表面自由能没有明显关联,而表面粗糙度对龈下菌斑的黏附也没有明显影响,龈沟的环境对细菌黏附的影响可能更为重要。此外,细菌的黏附情况还与细菌种类有关,Yamauchi等[22]的实验表明,变异链球菌在粗糙表面比光滑表面的黏附量要少,而其他一些细菌如中间普氏菌在粗糙面的黏附量更多。Eick等[23]的研究则表明,变异链球菌的菌落数量与材料表面的粗糙度无明显关系,其黏附量取决于细菌活力。
本实验结果提示,虽然激光造成了牙根表面裂隙增多,但激光处理的综合效应可使细菌在牙根表面的黏附量明显减少。值得注意的是,本实验仅针对变异链球菌,尚未考虑口腔内其他细菌及复杂环境的影响,而有关激光对牙周袋内环境、龈下菌斑的构成以及炎症因子的改变等尚需深入研究。
References
- 1.Quirynen M, Gizani S, Mongardini C, et al. The effect of periodontal therapy on the number of cariogenic bacteria in different intra-oral niches[J] J Clin Periodontol. 1999;26(5):322–327. doi: 10.1034/j.1600-051x.1999.260511.x. [DOI] [PubMed] [Google Scholar]
- 2.樊 明文, 周 学东. 牙体牙髓病学[M] 4版. 北京: 人民卫生出版社; 2012. pp. 15–22. [Google Scholar]; Fan MW, Zhou XD. Endodontics[M] 4th ed. Beijing: People's Medical Publishing House; 2012. pp. 15–22. [Google Scholar]
- 3.Bader J, Balevi B, Farsai P, et al. Lasers may reduce pain arising from dentin hypersensitivity[J] J Am Dent Assoc. 2014;145(4):e1–e2. doi: 10.14219/jada.2013.56. [DOI] [PubMed] [Google Scholar]
- 4.Arthur RA, Martins VB, de Oliveira CL, et al. Effect of over-the-counter fluoridated products regimens on root caries inhibition[J] Arch Oral Biol. 2015;60(10):1588–1594. doi: 10.1016/j.archoralbio.2015.07.018. [DOI] [PubMed] [Google Scholar]
- 5.Slot DE, Timmerman MF, Versteeg PA, et al. Adjunctive clinical effect of a water-cooled Nd: YAG laser in a periodontal maintenance care programme: a randomized controlled trial[J] J Clin Periodontol. 2012;39(12):1159–1165. doi: 10.1111/jcpe.12007. [DOI] [PubMed] [Google Scholar]
- 6.Qadri T, Tunér J, Gustafsson A. Significance of scaling and root planing with and without adjunctive use of a water-cooled pulsed Nd: YAG laser for the treatment of periodontal inflammation[J] Lasers Med Sci. 2015;30(2):797–800. doi: 10.1007/s10103-013-1432-0. [DOI] [PubMed] [Google Scholar]
- 7.Kranendonk AA, Wa VDR, Van Winkelhoff AJ, et al. The bactericidal effect of a Genius Nd:YAG laser[J] Int J Dent Hyg. 2010;8(1):63–67. doi: 10.1111/j.1601-5037.2009.00375.x. [DOI] [PubMed] [Google Scholar]
- 8.Qadri T, Javed F, Poddani P, et al. Long-term effects of a single application of a water-cooled pulsed Nd: YAG laser in supplement to scaling and root planing in patients with periodontal inflammation[J] Lasers Med Sci. 2011;26(6):763–766. doi: 10.1007/s10103-010-0807-8. [DOI] [PubMed] [Google Scholar]
- 9.Jensen J, Lulic M, Heitz-Mayfield LJA, et al. Nd: YAG (1 064 nm) laser for the treatment of chronic periodontitis: a pilot study[J] J Investig Clin Dent. 2010;1(1):16–22. doi: 10.1111/j.2041-1626.2010.00009.x. [DOI] [PubMed] [Google Scholar]
- 10.Qadri T, Poddani P, Javed F, et al. A short-term evaluation of Nd: YAG laser as an adjunct to scaling and root planing in the treatment of periodontal inflammation[J] J Periodontol. 2010;81(8):1161–1166. doi: 10.1902/jop.2010.090700. [DOI] [PubMed] [Google Scholar]
- 11.Kawashima H, Sato S, Kishida M, et al. A comparison of root surface instrumentation using two piezoelectric ultrasonic scalers and a hand scaler in vivo[J] J Periodontal Res. 2007;42(1):90–95. doi: 10.1111/j.1600-0765.2006.00924.x. [DOI] [PubMed] [Google Scholar]
- 12.Solís Moreno C, Santos A, Nart J, et al. Evaluation of root surface microtopography following the use of four instrumentation systems by confocal microscopy and scanning electron microscopy: an in vitro study[J] J Periodontal Res. 2012;47(5):608–615. doi: 10.1111/j.1600-0765.2012.01473.x. [DOI] [PubMed] [Google Scholar]
- 13.Gašpirc B, Skalerič U. Morphology, chemical structure and diffusion processes of root surface after Er: YAG and Nd: YAG laser irradiation[J] J Clin Periodontol. 2001;28(6):508–516. doi: 10.1034/j.1600-051x.2001.028006508.x. [DOI] [PubMed] [Google Scholar]
- 14.Kivanç BH, Ulusoy ÖİA, Görgül G. Effects of Er: YAG laser and Nd: YAG laser treatment on the root canal dentin of human teeth: a SEM study[J] Lasers Med Sci. 2008;23(3):247–252. doi: 10.1007/s10103-007-0474-6. [DOI] [PubMed] [Google Scholar]
- 15.王 萌, 叶 菁, 李 晶, et al. 不同牙周治疗手段对根面结构及牙周膜细胞生长的影响[J] 牙体牙髓牙周病学杂志. 2014;24(4):208–212. [Google Scholar]; Wang M, Ye J, Li J, et al. Proliferation of human periodental ligment cells on root surface treated by different methods[J] Chin J Conserv Dent. 2014;24(4):208–212. [Google Scholar]
- 16.Quirynen M, Marechal M, Busscher HJ, et al. The influence of surface free-energy on planimetric plaque growth in man[J] J Dent Res. 1989;68(5):796–799. doi: 10.1177/00220345890680050801. [DOI] [PubMed] [Google Scholar]
- 17.John G, Becker J, Schwarz F. Modified implant surface with slower and less initial biofilm formation[J] Clin Implant Dent Relat Res. 2015;17(3):461. doi: 10.1111/cid.12140. [DOI] [PubMed] [Google Scholar]
- 18.Flausino JS, Soares PBF, Carvalho VF, et al. Biofilm formation on different materials for tooth restoration: analysis of surface characteristics[J] J Mater Sci. 2014;49(19):6820–6829. [Google Scholar]
- 19.Watanabe T, Fukuda M, Mitani A, et al. Nd: YAG laser irradiation of the tooth root surface inhibits demineralization and root surface softening caused by minocycline application[J] Photomed Laser Surg. 2013;31(12):571–577. doi: 10.1089/pho.2013.3561. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.De-Melo MAS, Passos VF, Alves JJ, et al. The effect of diode laser irradiation on dentin as a preventive measure against dental erosion: an in vitro study[J] Lasers Med Sci. 2011;26(5):615–621. doi: 10.1007/s10103-010-0865-y. [DOI] [PubMed] [Google Scholar]
- 21.Malkoç MA, Sevimay M. Evaluation of mineral content of dentin treated with desensitizing agents and neodymium yttrium-aluminium-garnet (Nd: YAG) laser[J] Lasers Med Sci. 2012;27(4):743–748. doi: 10.1007/s10103-011-0954-6. [DOI] [PubMed] [Google Scholar]
- 22.Yamauchi M, Yamamoto K, Wakabayashi M, et al. In vitro adherence of microorganisms to denture base resin with different surface texture[J] Dent Mater J. 1990;9(1):19–24. doi: 10.4012/dmj.9.19. [DOI] [PubMed] [Google Scholar]
- 23.Eick S, Glockmann E, Brandl B, et al. Adherence of Streptococcus mutans to various restorative materials in a continuous flow system[J] J Oral Rehabil. 2004;31(3):278–285. doi: 10.1046/j.0305-182X.2003.01233.x. [DOI] [PubMed] [Google Scholar]