Abstract
目的
研究不同浓度Ca2+对人成骨细胞迁移与成骨分化的影响,探讨促进迁移与成骨合适的Ca2+浓度及相关机制。
方法
设置Ca2+浓度,Transwell检测成骨细胞迁移;CCK-8法评估成骨细胞增殖;逆转录聚合酶链反应(RT-PCR)检测细胞成骨分化相关基因的表达;茜素红染色检测成骨分化生成的矿化结节。钙敏感受体(CaSR)拮抗剂拮抗后,观察Ca2+对人成骨细胞迁移与成骨分化的影响。
结果
在迁移实验中,2、4、6 mmol·L−1的Ca2+在3个时间点(8、16、24 h)都能明显地促进人成骨细胞的迁移,10 mmol·L−1的Ca2+在8 h时明显抑制迁移。2~10 mmol·L−1 Ca2+能促进人成骨细胞的增殖、成骨分化与矿化,8、10 mmol·L−1的Ca2+诱导的矿化作用更明显。CaSR拮抗降低Ca2+诱导的人成骨细胞迁移与成骨分化作用。
结论
低浓度Ca2+有利于人成骨细胞迁移,高浓度Ca2+有利于人成骨细胞分化,4、6 mmol·L−1的Ca2+能较明显地同时诱导人成骨细胞迁移与成骨分化,Ca2+-CaSR通路参与相应的信号传导。
Keywords: 钙离子, 人成骨细胞, 迁移, 钙敏感受体, 骨替代材料
Abstract
Objective
This study aimed to investigate the effect of calcium ion (Ca2+) on the migration and osteogenic differentiation of human osteoblasts and explore the proper concentration and correlation mechanism.
Methods
A series of Ca2+ solutions with different concentrations was prepared. Osteoblast migration was assessed by Transwell assay, and proliferation was studied via the CCK-8 colorimetric assay. The mRNA expression of osteogenic genes was examined via reverse transcription-polymerase chain reaction (RT-PCR), and the mineralized nodule was examined by alizarin red-S method. After calcium sensitive receptor (CaSR) antagonism, Ca2+-induced migration and osteogenic differentiation were analyzed.
Results
In the migration experiment, 2, 4, and 6 mmol·L−1 Ca2+ could promoted osteoblast migration at three timepoints (8, 16, and 24 h), whereas 10 mmol·L−1 Ca2+ considerably inhibited migration at 8 h. The Ca2+ concentration range of 2–10 mmol·L−1 could promote proliferation, osteogenic differentiation, and mineralization of human osteoblasts. Moreover, mineralization was predominantly induced by 8 and 10 mmol·L−1 Ca2+. CaSR antagonism could reduce Ca2+-induced migration and osteogenic differentiation of human osteoblasts.
Conclusion
Low Ca2+ concentration favored osteoblast migration, whereas high Ca2+ concentration favored osteogenic differentiation. The Ca2+ concentrations of 4 and 6 mmol·L−1 could substantially induce osteoblast migration and osteogenic differentiation, and the Ca2+-CaSR pathway participated in signal transduction.
Keywords: calcium ion, human osteoblast, migration, calcium sensitive receptor, bone substitute
简单的自体骨移植或异体骨移植由于各种并发症及骨量有限等问题已不能满足人们对骨缺损后种植修复的需求。骨组织工程可以通过种子细胞、支架材料以及一些生物活性物质构建生物相容性好、填补骨组织缺损的组织工程骨,是近年来解决骨组织缺损及功能障碍的一种新方法。了解材料组成成分对骨形成细胞生物学行为与功能的影响,探讨其作用机制对优化骨组织工程的构建有一定指导意义。
钙离子(calcium ion,Ca2+)是细胞内重要的信号传导离子,可以调控众多表型基因和转录因子的转录,控制细胞生物功能,是骨组织的重要组成成分,也是目前商用骨替代材料、支架、涂层的重要组成成分[1]–[3]。在前期研究中,发现在二维和三维两种不同空间培养情况下,4 mmol·L−1 Ca2+同样可以诱导人骨髓间充质干细胞定向分化成骨。Barradas等[4]研究发现,磷酸三钙和羟磷灰石都能诱导间充质干细胞高表达成骨分化标志性基因,但磷酸三钙促成骨分化标志性基因的表达水平明显高于羟磷灰石,究其原因,可能是磷酸三钙溶解度高于羟磷灰石,致使培养基中Ca2+诱导基因的表达。
以往的研究多关注新型材料对成骨细胞(osteoblast,OB)的影响,材料的结构与组成复杂,影响因素较多,所以,本研究旨在探讨不同浓度Ca2+对人成骨细胞(human osteoblast,hOB)迁移、增殖、成骨分化的影响,探讨Ca2+影响细胞相关功能时的作用机制,为含钙骨替代材料的设计优化和临床应用提供一定的理论基础。
1. 材料和方法
1.1. 主要试剂
hOB、生长培养基(ScienCell公司,美国),氯化钙(Sigma公司,美国),NPS2143(ABcam公司,英国),CCK-8试剂盒(北京泰泽瑞达科技有限公司),引物(上海生工生物工程有限公司),荧光定量聚合酶链反应(polymerase chain reaction,PCR)试剂盒(Roche公司,瑞士)。
1.2. 主要仪器
高速冷冻离心机(Hitachi公司,日本),梯度PCR热循环仪(Applied Biosystems公司,美国),LightCycler480定量PCR仪(Roche公司,瑞士),荧光倒置显微镜(Zeiss公司,德国)。
1.3. 方法
1.3.1. 实验分组
以生长培养基培养的hOB组为对照组(GM),以含不同Ca2+(2、4、6、8、10 mmol·L−1)的生长培养基观察沉淀组为空白对照组(2C、4C、6C、8C、10C),以含不同Ca2+(2、4、6、8、10 mmol·L−1)的生长培养基培养的hOB组为实验组a[2C(−)、4C(−)、6C(−)、8C(−)、10C(−)],以加入钙敏感受体(calcium sensitive receptor,CaSR)拮抗剂NPS2143的培养基培养的hOB组为实验组b[2C(+)、4C(+)、6C(+)、8C(+)、10C(+)]。
1.3.2. Transwell细胞迁移实验
向24孔板内加入不同组相应的培养基600 µL,Corning Transwell小室置入。hOB用胰蛋白酶消化2 min,轻轻吹打成细胞悬浊液,4 °C时1 000 r·min−1离心5 min。调整细胞浓度至每毫升1×104,充分混匀,取200 µL细胞悬液于上室内(PTFE膜,8 µm)。于37 °C、5%CO2培养箱内分别培养8、16、24 h,取出小室,10%中性甲醛固定15 min,棉签依次擦掉室内未迁移的细胞,DAPI避光染色5 min,PBS漂洗,静置干燥,荧光倒置显微镜(400倍)观察,IPP 6.0软件计数,每孔10个视野,每个实验组3个重复,得出迁移细胞数。
1.3.3. 增殖的测定
将hOB以1×104个·cm−2接种于96孔板,24 h贴壁后弃原培养基,更换相应培养基培养1、4、7、10 d,在相应时间点,向每个测试孔内加入CCK-8溶液10 µL,将培养板在37 °C培养箱内继续孵育3 h显色,于450 nm处测量光密度(optical density,OD)值,每个实验组重复3次。
1.3.4. 定量逆转录聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)检测
将hOB以1×104个·cm−2接种于6孔板,24 h贴壁后弃原培养基,更换相应培养基培养4、7、10 d,在相应时间点,提取总RNA,Nano Drop 2000超微量分光光度计检测RNA的浓度和纯度。按照Takara RR047A逆转录试剂盒说明书进行操作,完成cDNA反转录。用Nano Drop 2000检测反转录的cDNA浓度及纯度,用焦炭酸二已酯(diethylpyrocarbonate,DEPC)水稀释cDNA至30 ng·mL−1用于扩增。引物序列如下。磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)上游引物序列:5’-GGTTGTCTCCTGCGACTTCA-3’,下游引物序列:5’-TGGTCCAGGGTTTCTTACTCC-3’;碱性磷酸酶(alkaline phosphatase,ALP)上游引物序列:5’-AACATCAGGGACATTGACGTG-3’,下游引物序列:5’-GTATCTCGGTTTGAAGCTCT 3’;Ⅰ型胶原蛋白(collagen typeⅠ,COLⅠ)上游引物序列:5’-AGACATCCCACCAATCACCTG-3’,下游引物序列:5’-CGTCATCGCACAACACCTT-3’;骨钙素(osteocalcin,OC)上游引物序列:5’-CAGGCGCTACCTGTATCAATG-3’,下游引物序列:5’-GATGTGGTCAGCCAACTCGT-3’。按照引物合成说明书,使用DEPC水溶解引物粉末、稀释、分装待用。将cDNA用DEPC水稀释至30 ng·mL−1,按照荧光定量PCR试剂盒说明书操作。完成上述步骤后,把加好样品的孔板放在LightCycler480 Software Setup(Roche 罗氏)中进行反应,按PCR循环条件进行扩增,并绘制熔解曲线。根据公式:−ΔΔCT=(对照组目标基因CT值-对照组内参基因CT值)−(待测样品CT值-待测样品内参基因CT值),RQ=2−ΔΔCT计算基因相对表达量,重复3次。
1.3.5. 茜素红矿化结节染色
将hOB以1×104个·cm−2接种于96孔板,24 h贴壁后弃原培养基,更换相应培养基培养10 d,弃培养基,1 mL PBS清洗3次,95%乙醇固定15 min,PBS清洗3次,现配并过滤pH 4.5的茜素红染色剂,染色10 min后立即吸出茜素红,去离子水清洗,于避光下自然干燥,并立刻于荧光倒置显微镜下观察矿化结节形成情况。
1.4. 统计学分析
采用SPSS 16.0统计软件对实验数据进行分析,方差齐时通过单因素方差分析,方差不齐时通过秩和检验分析,P<0.05时为差异有统计学意义。
2. 结果
2.1. Transwell细胞迁移实验
hOB的迁移情况见图1。
图 1. hOB的迁移情况 荧光倒置显微镜 × 400.
Fig 1 The observation on the migration of hOB fluorescence inverted microscope × 400
第一、二行:8 h;第三、四行:16 h;第五、六行:24 h。
在培养8、16、24 h时,2、4、6 mmol·L−1的Ca2+都能有效地促进hOB的迁移;而在8 h时,8 mmol·L−1的Ca2+对hOB的迁移促进作用开始下降,10 mmol·L−1的Ca2+已经明显抑制了hOB的迁移;到16、24 h时,8 mmol·L−1与10 mmol·L−1的Ca2+对hOB的迁移无明显影响。CaSR受体拮抗剂拮抗后,培养8、16、24 h时,2、4、6 mmol·L−1 Ca2+诱导的hOB迁移数目明显减少,而GM(+)组中hOB的迁移数目没有受到明显影响(图1、表1)。
表 1. 不同实验组中hOB的迁移.
Tab 1 The migration of hOB in different experimental groups
| 组别 | GM | 2C | 4C | 6C | 8C | 10C |
| 8 h(−) | 19±1 | 30±2* | 44±4* | 64±3* | 39±4* | 10±2* |
| 8 h(+) | 17±2 | 16±1# | 20±2# | 41±3# | 35±4 | 38±2# |
| 16 h(−) | 45±3 | 157±11* | 177±8* | 143±14* | 50±5 | 33±3 |
| 16 h(+) | 46±3 | 48±3# | 56±5# | 57±7# | 47±2 | 44±2# |
| 24 h(−) | 116±9 | 201±17* | 222±15* | 253±11* | 122±7 | 135±13 |
| 24 h(+) | 102±7 | 137±16# | 162±7# | 186±15# | 197±14# | 204±9# |
注:(−)表示实验组a,(+)表示实验组b。采用单因素方差分析,*相对于GM组,P<0.05;#相对于实验组a,P<0.05。
2.2. CCK-8细胞增殖实验
CCK-8细胞增殖实验结果见表2。
表 2. 不同实验组中hOB的增殖.
Tab 2 The proliferation of hOB in different experimental groups
| 组别 | GM | 2C | 4C | 6C | 8C | 10C |
| 1 d(−) | 0.146±0.01 | 0.147±0.013 | 0.145±0.007 | 0.156±0.014 | 0.150±0.017 | 0.147±0.009 |
| 1 d(+) | 0.144±0.009 | 0.128±0.015 | 0.127±0.022 | 0.124±0.025 | 0.133±0.014 | 0.131±0.016 |
| 4 d(−) | 0.201±0.011 | 0.211±0.035 | 0.237±0.032 | 0.245±0.031 | 0.316±0.049* | 0.314±0.022* |
| 4 d(+) | 0.191±0.017 | 0.209±0.020 | 0.190±0.015 | 0.182±0.021# | 0.247±0.017 | 0.253±0.026# |
| 7 d(−) | 0.422±0.024 | 0.571±0.053* | 0.725±0.085* | 0.734±0.041* | 0.692±0.073* | 0.636±0.102* |
| 7 d(+) | 0.412±0.021 | 0.416±0.015# | 0.496±0.044# | 0.464±0.057# | 0.447±0.051# | 0.505±0.036 |
| 10 d(−) | 0.429±0.022 | 0.445±0.039 | 0.450±0.028 | 0.404±0.014 | 0.342±0.049* | 0.308±0.045* |
| 10 d(+) | 0.420±0.016 | 0.428±0.023 | 0.453±0.042 | 0.415±0.032 | 0.452±0.037# | 0.432±0.034# |
注:(−)表示实验组a,(+)表示实验组b。采用单因素方差分析,*相对于GM组,P<0.05;#相对于实验组a,P<0.05。
由表2可见,培养1 d时,不同实验组中hOB的增殖无明显差异;4 d时,8C(−)、10C(−)组中hOB的增殖明显高于其他组(P<0.05),2C(−)、4C(−)、6C(−)组中hOB的增殖与GM组差异无统计学意义;7 d时,2C(−)、4C(−)、6C(−)、8C(−)、10C(−)组中hOB增殖明显高于GM组(P<0.05);10 d时,8C(−)、10C(−)组中hOB的增殖明显低于GM组(P<0.05),2C(−)、4C(−)、6C(−)组中hOB的增殖与GM组无明显差异。
CaSR拮抗剂NPS2143拮抗后,1 d时,各实验组hOB的增殖无明显差异;7 d时,2C(+)、4C(+)、6C(+)、8C(+)组中hOB增殖明显受到抑制(P<0.05);10 d时,8C(+)、10C(+)组中hOB的增殖明显高于8C(−)、10C(−)组。
2.3. RT-PCR检测成骨分化标志基因COLⅠ、ALP和OC的表达
Ca2+能刺激hOB上调COLⅠ、ALP、OC基因的表达,COLⅠ、ALP、OC基因表达的上调有浓度依赖性和时间依赖性。在CaSR受体拮抗剂拮抗后,COLⅠ、ALP、OC基因的表达上调明显受到抑制(图2~4)。
图 2. 不同实验组中COLⅠ基因的表达.
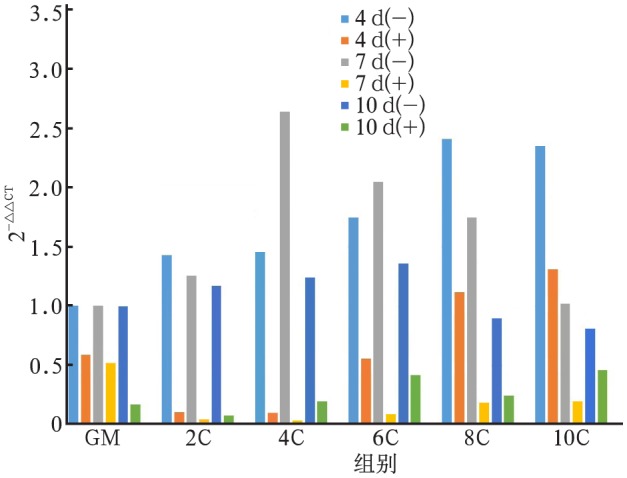
Fig 2 The gene expression of COLⅠ in different experimental groups
图 4. 不同实验组中OC基因的表达.
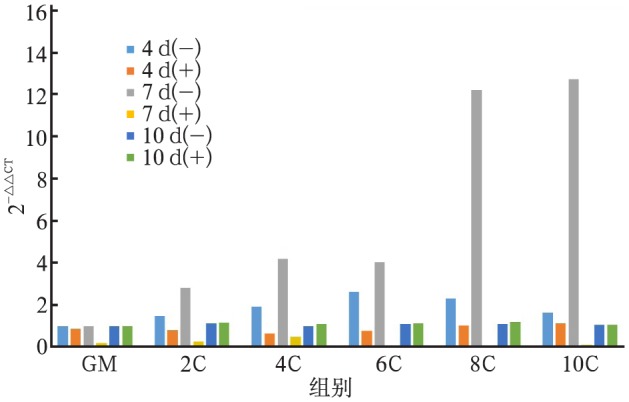
Fig 4 The gene expression of OC in different experimental groups
图 3. 不同实验组中ALP基因的表达.
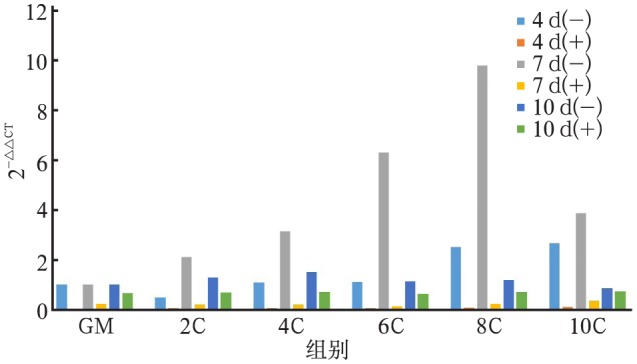
Fig 3 The gene expression of ALP in different experimental groups
2.4. 茜素红矿化结节染色
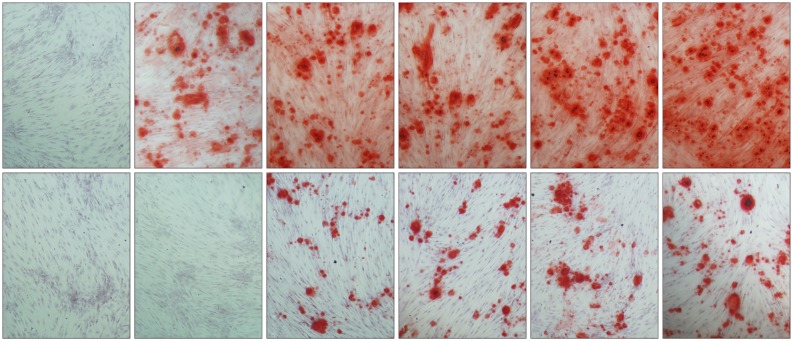
培养10 d后,采用茜素红染色,肉眼观察可见,在2C、4C、6C、8C、10C没加入hOB的空白对照组中,没有明显红染的矿化结节沉积;加入hOB的实验组中,GM组无矿化结节生成,2C(−)、4C(−)、6C(−)、8C(−)、10C(−)组可见明显红染矿化结节生成。倒置显微镜下观察同样显示,2C(−)、4C(−)、6C(−)、8C(−)、10C(−)组中有明显矿化结节生成。加入CaSR拮抗剂后,4C(+)、6C(+)、8C(+)、10C(+)组中矿化结节生成明显减少,但仍有一定的矿化结节生成(图5)。
图 5. 矿化结节的茜素红染色 倒置显微镜 × 100.
Fig 5 Alizarin red staining of mineralized nodules inverted microscope × 100
上:依次为GM(−)、2C(−)、4C(−)、6C(−)、8C(−)、10C(−)组;下:依次为GM(+)、2C(+)、4C(+)、6C(+)、8C(+)、10C(+)组。
3. 讨论
hOB是形成骨组织的主要功能细胞,在骨损伤修复时,hOB被招募迁移至骨损伤区域,合成分泌骨基质蛋白、COLⅠ、OC、骨桥蛋白等,促进其矿化。因此,hOB的迁移、增殖、分化对增加和维持骨量起至关重要的作用。钙是许多商用骨替代材料和支架材料的重要组成部分,是重要的第二信使,调控表型基因和转录因子的转录,控制细胞生物过程及功能[5]。骨替代材料在改建过程中会引起局部离子浓度的变化,影响骨组织改建[6]–[7],探讨不同浓度Ca2+对hOB的影响,对骨替代材料的构建有一定的指导意义。
在迁移实验中,观察到Ca2+对hOB的迁移影响存在明显的浓度与时间依赖性。2、4、6 mmol·L−1 的Ca2+在3个时间点(8、16、24 h)都能够明显地促进hOB的迁移,8 mmol·L−1 的Ca2+在8 h时还能够促进hOB的迁移,后期对细胞的影响不明显,而10 mmol·L−1的Ca2+在8 h时明显抑制hOB的迁移,说明低浓度的Ca2+(≤8 mmol·L−1)能促进hOB的迁移。在24 h时,不同浓度的Ca2+对hOB的增殖没有明显影响,说明Ca2+在前期引起的跨膜细胞的增加与细胞增殖没有关系,而是细胞的迁移引起的。到4 d时,8、10 mmol·L−1的Ca2+开始促进hOB的增殖;7 d时,2~10 mmol·L−1的Ca2+都能明显促进hOB的增殖;10 d时,8、10 mmol·L−1组中hOB的数量明显低于对照组,其他Ca2+组中hOB的数量与对照组无明显差异。此时,茜素红染色实验显示,在无添加hOB的空白对照组中,没有出现Ca2+沉积,无红染矿化结节,说明在此浓度范围内,Ca2+不会发生自发性沉积,而Ca2+组中出现不同数量的红染矿化结节。同时,成骨分化标志基因COLⅠ、ALP、OC的表达在观察期内有不同程度的高表达,说明Ca2+后期能诱导hOB的分化与矿化,且随着浓度的增加Ca2+诱导hOB的矿化作用更明显。
Lim等[8]通过浸没方式将不同数量的Ca2+加载在壳聚糖-二氧化钛纳米管支架上,观察OB的生物学行为,发现加载了Ca2+的纳米管支架能明显促进OB的黏附、复制与分化。Sun等[9]也认为流体剪切力引起的OB增殖和分化与Ca2+的细胞内流有关,短暂的Ca2+细胞内流促进OB的增殖,持续的Ca2+细胞内流促进OB的分化。Yasukawa等[10]在研究三氧化矿物凝聚体(mineral trioxide aggregate,MTA)对小鼠MC3T3-E1细胞的影响时发现,MTA能诱导MC3T3-E1高表达Runt相关转录因子2(Runt-related transcription factor 2,Runx2)、COLⅠ,这些OB分化标志基因的高表达与MTA溶解引起的Ca2+浓度增加,Ca2+-CaSR信号传导密切相关。
CaSR是由1 078个氨基酸组成的巨大的螺旋型7次跨膜糖蛋白,包含N-端信号肽、胞外结合域、富含半胱氨酸域、7次跨膜域、胞内结合域,属于G蛋白偶联受体家族中的代谢型谷氨酸受体亚类,与其他家族成员具有高度的同源性,存在于身体的多个器官,感受周围环境中盐度、酸碱度、Ca2+浓度、氨基酸浓度、聚胺类浓度等变化,与配体相互作用,调节相应的生理功能[11]–[14]。研究[15]表明,不同种族间CaSR胞内结合域存在着明显不同,引导不同的信号传导。CaSR胞外区上可能存在多达5个Ca2+结合位点,能感觉环境中Ca2+的细微变化,当胞外区配体结合位点与Ca2+结合后引起跨膜区构想改变而被激活,启动下游的信号传导[16]。研究[17]–[18]表明,活化的OB有CaSR的高表达,且CaSR信号通路的激活对OB的活化、骨形成与矿化起着重要作用。
Tharmalingam等[19]发现细胞外Ca2+浓度的升高能激活CaSR,增加细胞外信号调节蛋白激酶2与蛋白激酶B的磷酸化,进而促进细胞膜上整合素β1的高表达,整合素β1的增加能稳定细胞与细胞外基质蛋白的黏附,诱导细胞的迁移,这与低浓度的实验结果一致。在本研究中,CaSR的拮抗明显影响了Ca2+诱导的hOB迁移、增殖与成骨分化,但没能完全阻止这些作用。
综上所述,本研究结果表明,Ca2+能诱导hOB的迁移、增殖与成骨分化,且Ca2+-CaSR引导的信号通路参与了Ca2+诱导的hOB迁移、增殖与成骨分化,但这条通路不是唯一的在其中发挥作用的信号传导通路。低浓度Ca2+有利于人成骨细胞迁移,高浓度Ca2+有利于人成骨细胞分化,4、6 mmol·L−1的Ca2+能较明显地诱导人成骨细胞迁移与成骨分化,Ca2+-CaSR引导的通路参与相应的信号传导。
Funding Statement
[基金项目] 国家科技支撑计划(2012BAI17B03-6);福建省卫计委青年基金(2015-1-66);福建省口腔医院博士科研基金(2015-KQ-YY-BS-6)
Supported by: National Science and Technology Support Program(2012BAI17B03-6); Youth Found of Fujian Provincial Health and Family Planning Commission(2015-1-66); Doctoral Research Fund from Stomatological Hospital of Fujian Medical University(2015-KQYY-BS-6)
References
- 1.Bayat M, Shojaei S, Bahrami N, et al. Protein engineering of recombinant human bone morphogenetic protein 2 with higher interaction with Ca phosphate based scaffold used for osteogenesis[J] J Biomed Mater Res A. 2017;105(10):2799–2805. doi: 10.1002/jbm.a.36143. [DOI] [PubMed] [Google Scholar]
- 2.Cheng D, Liu D, Tang T, et al. Effects of Ca/P molar ratios on regulating biological functions of hybridized carbon nanofibers containing bioactive glass nanoparticles[J] Biomed Mater. 2017;12(2):025019. doi: 10.1088/1748-605X/aa6521. [DOI] [PubMed] [Google Scholar]
- 3.Rau JV, Antoniac I, Fosca M, et al. Glass-ceramic coated Mg-Ca alloys for biomedical implant applications[J] Mater Sci Eng C Mater Biol Appl. 2016;64:362–369. doi: 10.1016/j.msec.2016.03.100. [DOI] [PubMed] [Google Scholar]
- 4.Barradas AM, Monticone V, Hulsman M, et al. Molecular mechanism of biomaterial-driven osteogenic differentiation in human mesenchymal stromal cells[J] Integr Biol (Camb) 2013;5(7):920–931. doi: 10.1039/c3ib40027a. [DOI] [PubMed] [Google Scholar]
- 5.Capiod T. Extracellular calcium has multiple targets to control cell proliferation[J] Adv Exp Med Biol. 2016;898:133–156. doi: 10.1007/978-3-319-26974-0_7. [DOI] [PubMed] [Google Scholar]
- 6.Berglund IS, Dirr EW, Ramaswamy V, et al. The effect of Mg-Ca-Sr alloy degradation products on human mesenchymal stem cells[J] J Biomed Mater Res B Appl Biomater. 2018;106(2):697–704. doi: 10.1002/jbm.b.33869. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kim HK, Han HS, Lee KS, et al. Comprehensive study on the roles of released ions from biodegradable Mg-5wt% Ca-1wt% Zn alloy in bone regeneration[J] J Tissue Eng Regen Med. 2017;11(10):2710–2724. doi: 10.1002/term.2166. [DOI] [PubMed] [Google Scholar]
- 8.Lim SS, Chai CY, Loh HS. In vitro evaluation of osteoblast adhesion, proliferation and differentiation on chitosan-TiO2 nanotubes scaffolds with Ca2+ ions[J] Mater Sci Eng C Mater Biol Appl. 2017;76:144–152. doi: 10.1016/j.msec.2017.03.075. [DOI] [PubMed] [Google Scholar]
- 9.Sun J, Xie W, Shi L, et al. Simulation of intracellular Ca2+ transients in osteoblasts induced by fluid shear stress and its application[J] Biomech Model Mechanobiol. 2017;16(2):509–520. doi: 10.1007/s10237-016-0833-y. [DOI] [PubMed] [Google Scholar]
- 10.Yasukawa T, Hayashi M, Tanabe N, et al. Involvement of the calcium-sensing receptor in mineral trioxide aggregate-induced osteogenic gene expression in murine MC3T3-E1 cells[J] Dent Mater J. 2017;36(4):469–475. doi: 10.4012/dmj.2016-313. [DOI] [PubMed] [Google Scholar]
- 11.Alfadda TI, Saleh AM, Houillier P, et al. Calcium-sensing receptor 20 years later[J] Am J Physiol Cell Physiol. 2014;307(3):C221–C231. doi: 10.1152/ajpcell.00139.2014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Geng Y, Mosyak L, Kurinov I, et al. Structural mechanism of ligand activation in human calcium-sensing receptor[J] Elife. 2016;5.pii:e13662. doi: 10.7554/eLife.13662. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Rosado JA. Calcium entry pathways in non-excitable cells [J] Adv Exp Med Biol. 2016;898:vii–viii. [PubMed] [Google Scholar]
- 14.Colella M, Gerbino A, Hofer AM, et al. Recent advances in understanding the extracellular calcium-sensing receptor[J] F1000Res. 2016;5. pii:F1000 Faculty Rev-2535. doi: 10.12688/f1000research.8963.1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Zhang C, Miller CL, Gorkhali R, et al. Molecular basis of the extracellular ligands mediated signaling by the calcium sensing receptor[J] Front Physiol. 2016;7:441. doi: 10.3389/fphys.2016.00441. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Zhang C, Zhuo Y, Moniz HA, et al. Direct determination of multiple ligand interactions with the extracellular domain of the calcium-sensing receptor[J] J Biol Chem. 2014;289(48):33529–33542. doi: 10.1074/jbc.M114.604652. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Dvorak-Ewell MM, Chen TH, Liang N, et al. Osteoblast extracellular Ca2+-sensing receptor regulates bone development, mineralization, and turnover[J] J Bone Miner Res. 2011;26(12):2935–2947. doi: 10.1002/jbmr.520. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.A1-Dujaili SA, Koh AJ, Dang M, et al. Calcium sensing receptor function supports osteoblast survival and acts as a Co-factor in PTH anabolic action in bone[J] J Cell Biochem. 2016;117(7):1556–1567. doi: 10.1002/jcb.25447. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Tharmalingam S, Wu C, Hampson DR. The calcium-sensing receptor and integrins modulate cerebellar granule cell precursor differentiation and migration[J] Dev Neurobiol. 2016;76(4):375–389. doi: 10.1002/dneu.22321. [DOI] [PubMed] [Google Scholar]