Abstract
目的
对普萘洛尔治疗增殖期婴幼儿血管瘤的临床疗效和治疗过程中血清及尿液血管内皮生长因子-A(VEGF-A)和表皮生长因子样结构域7(EGFL7)表达水平进行检测分析。
方法
选择30例婴幼儿增殖期血管瘤患者为研究对象,口服普萘洛尔治疗4~8个月,口服剂量为每天0.5~2 mg·kg−1。采用B超测量治疗前后瘤体的半径,采用Achauer疗效评定法进行临床疗效评估。采用酶联免疫吸附法(ELISA)检测治疗前、治疗后4周、治疗后12周血清及尿液中VEGF-A和EGFL7水平。
结果
治疗效果评价:2例优,11例好,14例中等,3例差。治疗前血清VEGF-A水平最高(335.692 pg·mL−1±136.146 pg·mL−1),治疗后4周(264.853 pg·mL−1±122.120 pg·mL−1)和治疗后12周(211.345 pg·mL−1±104.035 pg·mL−1)呈逐渐下降趋势,治疗后4、12周血清VEGF-A水平低于治疗前(P<0.05)。治疗前尿液VEGF-A水平最高(76.234 pg·mL−1±24.169 pg·mL−1),治疗后4周(56.454 pg·mL−1±16.111 pg·mL−1)和治疗后12周(34.728 pg·mL−1±12.656 pg·mL−1)呈逐渐下降趋势,治疗后4、12周尿液VEGF-A水平低于治疗前(P<0.05)。血清和尿液中EGFL7的表达趋势与VEGF-A一致。
结论
普萘洛尔能够安全有效地治疗增殖期婴幼儿血管瘤。普萘洛尔能降低增殖期婴幼儿血管瘤患者外周血清和尿液中VEGF-A和EGFL7水平。
Keywords: 普萘洛尔, 增殖期婴幼儿血管瘤, 血管内皮生长因子-A, 表皮生长因子样结构域7
Abstract
Objective
This study aims to investigate the expression levels of serum and urinary vascular endothelial growth factor-A (VEGF-A) and epidermal growth factor-like domain 7 (EGFL7) in proliferating infantile hemangioma patients under propranolol treatment.
Methods
Propranolol (0.5–2 mg·kg−1) was orally administered to 30 infants every day for 4–8 months. The Achauer method was used to measure the tumor radius and thus evaluate the clinical curative effects of the treatment. Enzyme-linked immunosorbent assay was used to measure the serum and urinary concentrations of VEGF-A and EGFL7 at 0, 4, and 12 weeks after the treatment.
Results
The treatment response was excellent in 2 patients, good in 11, moderate in 14, and poor in 3. Serum VEGF-A (335.692 pg·mL−1±136.146 pg·mL−1) was high before the treatment and then significantly decreased after 4 weeks (264.853 pg·mL−1±122.120 pg·mL−1) and 12 weeks (211.345 pg·mL−1±104.035 pg·mL−1) of treatment (P<0.05). Urinary VEGF-A (76.234 pg·mL−1±24.169 pg·mL−1) was high before the treatment and then significantly decreased after four weeks (56.454 pg·mL−1±16.111 pg·mL−1) and twelve weeks (34.728 pg·mL−1±12.656 pg·mL−1) of treatment (P<0.05). Serum and urinary EGFL7 also decreased after the treatment, showing a positive relationship with VEGF-A.
Conclusion
Propranolol can be safely and effectively used to treat proliferating infantile hemangiomas. This treatment can reduce the peripheral serum and urinary concentrations of VEGF-A and EGFL7 in affected children.
Keywords: propranolol, proliferating infantile haemangioma, vascular endothelial growth factor-A, epidermal growth factor-like domain 7
婴幼儿血管瘤(infantile hemangioma)是胚胎期血管形成过程中出现的一种先天性发育不良,多见于出生时或出生后不久,是婴幼儿时期最常见的良性肿瘤[1],发病率为5%~10%,在早产儿中可高达30%[2]。Léauté-Labrèze等[3]于2008年首次报道了使用普萘洛尔治疗多例婴幼儿血管瘤取得了显著的疗效,然而其治疗机制至今尚不完全明确。
表皮生长因子样结构域(epidermal growth factor- like domain,EGFL)7由Soncin在2003年发现,是定位于人类9号染色体上的一个内皮特异性基因,在胚胎发育过程的内皮细胞及内皮祖细胞中表达[4]。EGFL7是血管管腔发育过程中的一个关键基因,其表达降低可直接引起血管管腔的发育障碍[5]。增殖期血管瘤中血管内皮生长因子(vascular endothelial-growth factor,VEGF)及其他促血管生成因子刺激内皮细胞大量增殖,EGFL7通过调节内皮细胞的黏附,引导内皮细胞迁徙,维持了血管正常的空间结构,同时内皮细胞上表达的EGFL7阻止平滑肌细胞的迁出,保证了肿瘤血管的稳定性,在其共同作用下,血管瘤得以快速增殖。本研究旨在对临床应用普萘洛尔治疗婴幼儿增殖期血管瘤患者VEGF-A、EGFL7的变化进行检测,探讨其可能的治疗机制及对治疗的影响。
1. 材料和方法
1.1. 研究对象
以2005年中华医学会发布的《口腔颌面部血管瘤及脉管畸形的诊断和治疗指南(草案)》[6]作为诊断标准,收集2010年8月—2013年2月新疆医科大学第一附属医院颌面肿瘤外科收治的30例婴幼儿增殖期血管瘤患者为研究对象。30例患者中,男性10例,女性20例;年龄2~11个月,平均8个月;汉族17例,维吾尔族8例,回族3例,蒙古族2例;颌面部27例,躯干2例,四肢1例。研究中纳入的婴幼儿血管瘤瘤体直径至少大于1 cm。参与研究的患者在采集血样本之前均未接受过任何治疗。
本研究经新疆医科大学第一附属医院伦理委员会批准,在治疗与实验前所有患者的监护人均知情同意,并签署知情同意书。
1.2. 治疗方法
患儿入院后完善血常规、肝肾功能、甲状腺功能、心电图、血压、血糖检查。对于各项检查符合要求的患儿口服普萘洛尔(天津力生制药厂生产,批号H12020151)。口服药物的治疗方案基于前期临床研究[7]进行了优化:小于3个月的患者口服剂量为每天0.5 mg·kg−1;3~6个月大小的患者口服剂量为每天1 mg·kg−1;大于6个月的患者口服剂量为每天2 mg·kg−1。每次服药前、服药后0.5、1、2、3 h监测心率、血压。
当患者出现以下情况时不能服药:急性炎症(如急性上呼吸道感染、气管炎、肺炎等)、血小板功能异常、哮喘、窦性心动过缓、房室传导阻滞、严重或急性充血性心力衰竭、心源性休克或肝、肾功能异常等疾病;血糖、甲状腺功能有异常者;接受手术和激光治疗者;年龄大于12月者;药物过敏史合并其他先天性疾病者;资料不完整者、不配合治疗者和不签署知情同意书者。
药物在需进食时服用。开始口服普萘洛尔后所有患儿入院观察3~5 d。患儿出院后,在父母或监护人指导下给予口服普萘洛尔。疗程持续4~8个月,如果患儿血管瘤完全消退或整个疗程达到8个月则停止服用药物。
所有患儿在出院后定期随访。随访时患儿给药剂量根据患儿体重的变化进行调整。
1.3. 临床疗效评价
治疗前和治疗后12周通过B超测量瘤体的层次、大小、血运、边界。根据B超得出的瘤体大小,采用国际上公认的Achauer疗效评定法[8]进行临床疗效评估。Ⅰ级(差):瘤体缩小<25%;Ⅱ级(中等):瘤体缩小 26%~50%;Ⅲ级(好):瘤体缩小 51%~75%;Ⅳ级(优):瘤体缩小>75%。
1.4. 治疗前后血清及尿液中VEGF-A和EGFL7表达的测定
分别抽取每例患者服用普萘洛尔前、服药后4周和12周外周静脉血2 mL、尿液5 mL。血液样本放置于无菌离心管中室温下静置60 min,采用转速为2 000 g·min−1离心机离心10 min分离血清。离心后的血清样本冻存于−80 °C,避免反复冻存和融化。采用相同方法处理尿液标本。所有样本在室温下解冻,VEGF-A试剂盒由eBioscience公司提供,EGFL7试剂盒由CUSABIO(CSB-E15864h)公司提供。采用酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)测定血清和尿液中VEGF-A、EGFL7的含量,具体步骤参照说明书进行。
1.5. 统计学分析
选用Excel软件进行数据录入,SPSS 17.0软件进行统计分析。组间比较采用两因素方差分析(检验水准α=0.05,P<0.05表示有统计学差异),两两比较采用LSD法比较。治疗效果采用Ridit方法分析,将有序等级资料转化成连续型资料(R值),转化后采用单因素方差分析F检验。在F值有意义的情况下,再进行多组间两两比较的LSD检验。对VEGF-A与EGFL7,VEGF-A、EGFL7与给药时程的关系进行BIVARIATE相关性分析。
2. 结果
2.1. 临床疗效
整个治疗过程中均未出现明显副作用,无1例患者退出治疗。首次治疗24 h后多数血管瘤瘤体颜色变浅并且质地变软,其中1例患者服用普萘洛尔3个月后瘤体完全消退。
治疗效果评价: 2例(17%)优, 11例(46%)好,14例(29%)中等,3例(9%)差。总有效率为90%(27/30)。
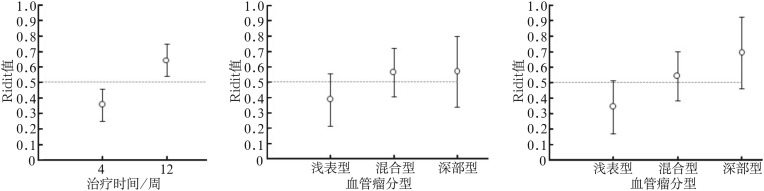
不同性别、民族、部位的血管瘤患者间的治疗效果均无统计学差异(P>0.05)。治疗后4周与治疗后12周的治疗效果有统计学差异(P<0.05),治疗后12周治疗效果优于治疗后4周,说明随着治疗时间的延长,治疗效果越来越显著。治疗后4周不同血管瘤分型(浅表型、混合型、深部型)的治疗效果无统计学差异(P>0.05);治疗后12周不同血管瘤分型(浅表型、混合型、深部型)的治疗效果有统计学差异(P<0.05)(图1),随着治疗时间的延长,深部或混合型血管瘤的治疗效果优于浅表型血管瘤。
图 1. 不同治疗时间、血管瘤分型的治疗效果的Ridit分析.
Fig 1 Ridit analysis of therapeutic effect of different treatment time and type of hemangioma
左:治疗后4、12周的治疗效果分析;中:治疗后4周不同血管瘤分型的治疗效果分析;右:治疗后12周不同血管瘤分型的治疗效果分析。
2.2. 治疗前后血清及尿液中VEGF-A的表达
治疗前后血清及尿液中VEGF-A的表达见表1。治疗前血清VEGF-A水平最高(335.692 pg·mL−1±136.146 pg·mL−1),治疗后4周(264.853 pg·mL−1±122.120 pg·mL−1)和治疗后12周(211.345 pg·mL−1±104.035 pg·mL−1)呈现逐渐下降的趋势,治疗后4、12周的血清VEGF-A水平低于治疗前(P<0.05)。治疗前尿液VEGF-A水平最高(76.234 pg·mL−1±24.169 pg·mL−1),治疗后4周(56.454 pg·mL−1±16.111 pg·mL−1)和治疗后12周(34.728 pg·mL−1±12.656 pg·mL−1)呈逐渐下降趋势,治疗后4、12周,尿中液VEGF的表达水平较治疗前明显降低,其差异有统计学意义(P<0.05)。
表 1. 治疗前后血清及尿液中VEGF-A和EGFL7的表达.
Tab 1 The expression of VEGF-A and EGFL7 in serum and urinary before and after treatment
| 标本 | 指标 | 治疗前 | 治疗后4周 | 治疗后12周 | P值 |
| 血清 | VEGF-A | 335.692±136.146 | 264.853±122.120 | 211.345±104.035 | 0.000 |
| EGFL7 | 20.62±12.011 | 13.488±9.826 | 3.811±2.154 | 0.000 | |
| 尿液 | VEGF-A | 76.234±24.169 | 56.454±16.111 | 34.728±12.656 | 0.000 |
| EGFL7 | 13.373±0.621 | 9.584±0.659 | 2.358±0.597 | 0.000 |
pg·mL−1
2.3. 治疗前后血清及尿液中EGFL7的表达
治疗前后血清及尿液中EGFL7的表达见表1。治疗前血清EGFL7水平最高,治疗后4周和12周EGFL7水平呈逐渐下降趋势,低于治疗前(P<0.05)。治疗前尿液EGFL7水平最高,治疗后4周和12周EGFL7水平呈逐渐下降趋势,低于治疗前(P<0.05)。血清和尿液中EGFL7的表达趋势与VEGF-A一致。VEGF-A和EGFL7水平两两比较,具有统计学差异(P<0.05)。
2.4. VEGF-A与EGFL7的相关性分析
相关性分析表明,血清VEGF-A与EGFL7不相关(r=−0.082,P>0.05),尿液VEGF-A与EGFL7呈正相关(r=0.657,P<0.05)。
2.5. VEGF-A、EGFL7与给药时程的相关性分析。
血清及尿液中的VEGF-A、EGFL7含量与给药时程均呈负相关关系,随着给药时间的延长,血清及尿液中的VEGF-A和EGFL7含量逐渐减少(P<0.05)(表2)。
表 2. VEGF-A、EGFL7与给药时程的相关性分析.
Tab 2 Correlation analysis between VEGF-A, EGFL7 and administration time
| 标本 | 检测指标 | R值 | P值 |
| 尿液 | EGFL-7 | −0.992 | 0.000 |
| VEGF-A | −0.689 | 0.000 | |
| 血液 | EGFL-7 | −0.623 | 0.000 |
| VEGF-A | −0.390 | 0.033 |
3. 讨论
本研究对治疗效果分析发现,患者的性别、民族、治疗部位与患者的治疗效果无关;治疗时间越长,治疗效果越好;血管瘤的分型与治疗效果密切相关,随着治疗时间的延长,深部型或混合型血管瘤的治疗效果优于浅表型血管瘤。特别值得注意的是,普萘洛尔对腮腺区较大的深部血管瘤具有明显疗效,此类病变治疗后明显缩小,而相对于表浅的侵犯皮肤的血管瘤,其治疗效果欠佳。治疗过程中无1例患者退出治疗。大多数血管瘤在首次治疗后24 h瘤体颜色变浅并且质地变软。治疗过程中均无明显副作用。患者家长对治疗效果满意。其中1例患者服用普萘洛尔3个月后瘤体完全消退。然而,有些瘤体在患儿突然停药后复发,通过继续服用药物治疗能有效地控制增殖,因此停药时需告知家长缓慢停药。
VEGF是最重要的一种血管生成调节因子,能有效地促进血管内皮细胞的增殖。在内皮细胞系统中,VEGF可以特异性地作用于VEGF受体,刺激内皮细胞增殖,增加血管的通透性,促进肿瘤血管的生长。
EGFL7基因是由Soncin等[4]的实验室首先发现的一个在血管内皮特异性表达的基因,EGFL7属于分泌型蛋白,包含两个生长因子类似的结构域。EGFL7存在于细胞的内质网和高尔基体,通过分泌至内皮细胞附近,可能与细胞间基质有关[9]。Parker等[5]在研究中发现,EGFL7涉及血管形成过程中成管这一关键性的步骤,在生理性和病理性血管的管腔形成、功能完善上发挥着重要作用,其表达改变将影响血管的新生。另有研究[10]表明,在血管增生过程中,EGFL7通过促进内皮细胞的迁移和黏附,使内皮细胞与细胞间质的结合及局部迁移受到协调控制,通过进一步调节血管生成组织或内皮细胞的逐渐分离和恰当的空间排列,导致血管管腔形成。EGFL7在促进血管内皮迁徙、调节内皮细胞黏附以及抑制血管平滑肌迁徙等构建血管床结构和保持血管稳定中起着重要作用,但是EGFL7并不能刺激内皮细胞的增殖[9]–[11]。
Campagnolo等[12]研究认为,EGFL7可作为一个化学趋化性物质刺激、增强细胞的运动迁移能力。化学趋化物介导细胞定向趋化运动的同时,也可通过G蛋白偶联受体激活下游信号传导通路,调节细胞的形态学改变。RAS/MAPK通路的激活等可增强细胞运动迁移能力[13]–[14],最终可导致血管内皮迁移活跃,血管新生增加。
血管形成是一个复杂但有序的严格调节的过程,分子间发生了复杂的相互作用,涉及多种可溶性因子及其受体。血管内皮细胞、血管壁细胞与细胞基质的接触也参与血管生成过程[15]–[16];因此,形成一个局部稳定和有功能的血管结构,最终取决于这些复杂的相互反应。EGFL7是血管管腔形成所必需的,高水平的EGFL7表达与血管增生和重塑有关[5]。EGFL7基因是血管管腔发育过程中的关键基因,与VEGF在血管形成中的作用明显不同,前者表达降低可以直接引起血管管腔的发育障碍,而后者则使内皮细胞的增生性能明显降低,间接地影响了血管的发育。
VEGF基因的转录受到多种细胞因子如碱性成纤维细胞生长因子、胰岛素样生长因子、表皮生长因子、肿瘤坏死因子、转化生长因子等的调节。这是因为VEGF基因启动子序列中相对于转录起始位点的50~96 bp区域为G-C丰富区[17],此启动子区域包含转录因子SP-1/SP-3、早期生长反应因子1及AP-2结合位点。推测EGFL7亦可能通过与特定的转录子SP-1、SP-3或与VEGF启动子结合,从而调控VEGF基因表达。
蒋卫东等[18]研究显示,EGFL7亦可能与其他的血管生长因子通过相同的信号通路相互影响,这与内皮细胞的活性有关。他们发现人脐静脉内皮细胞株的EGFL7基因被有效沉默后,三磷酸腺苷和乳酸脱氢酶等的检测结果均显示人脐静脉内皮细胞株的存活率受到了一定程度的影响,EGFL7可能是一种内皮细胞存活或活性维持的重要基因,一旦其基因沉默,内皮细胞活性降低,VEGF等生长因子表达水平降低。
本研究中也发现,在服用普萘洛尔治疗4周及12周后,患者血清及尿液的VEGF及EGFL7表达量明显减低,两者呈同步下降的趋势,符合正调控关系。出现这种现象可以认为普萘洛尔治疗婴幼儿血管瘤起效,其可能的机制是通过降低EGFL7的表达,使EGFL7对VEGF基因转录的调控作用减弱,导致VEGF转录水平受到抑制,VEGF表达减少,从而使血管新生活力下降,通过间接作用于血管内皮细胞使得血管瘤瘤体变小。这些细胞因子之间可能还存在一些其他的通路或相关因子的调控作用,这尚需进行进一步的实验来明确普萘洛尔成功治疗血管瘤的机制。
Funding Statement
[基金项目] 新疆维吾尔自治区自然科学基金面上资助项目(2013211A080)
References
- 1.陆 阳, 张 文杰, 李 伟. 婴幼儿血管瘤发病机制的研究进展[J] 中国美容医学. 2009;18(6):874–876. [Google Scholar]
- 2.Mulliken JB, Fishman SJ, Burrows PE. Vascular anomalies[J] Curr Probl Surg. 2000;37(8):517–584. doi: 10.1016/s0011-3840(00)80013-1. [DOI] [PubMed] [Google Scholar]
- 3.Léauté-Labrèze C, Dumas de la Roque E, Hubiche T, et al. Propranolol for severe hemangiomas of infancy[J] N Engl J Med. 2008;358(24):2649–2651. doi: 10.1056/NEJMc0708819. [DOI] [PubMed] [Google Scholar]
- 4.Soncin F, Mattot V, Lionneton F, et al. VE-statin, an endothelial repressor of smooth muscle cell migration[J] EMBO J. 2003;22(21):5700–5711. doi: 10.1093/emboj/cdg549. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Parker LH, Schmidt M, Jin SW, et al. The endothelial-cell-derived secreted factor Egfl7 regulates vascular tube formation[J] Nature. 2004;428(6984):754–758. doi: 10.1038/nature02416. [DOI] [PubMed] [Google Scholar]
- 6.中华口腔医学会口腔颌面外科专业委员会脉管性疾病学组. 口腔颌面部血管瘤及脉管畸形的诊断和治疗指南 (草案)[J] 中华口腔医学杂志. 2005;40(3):185–186. [Google Scholar]
- 7.龚 忠诚, 凌 彬, 克 热木, et al. 普萘洛尔治疗 24 例婴幼儿血管瘤的临床观察[J] 实用口腔医学杂志. 2013;29(4):594–597. [Google Scholar]
- 8.Achauer BM, Vander Kam VM. Vascular lesions[J] Clin Plast Surg. 1993;20(1):43–51. [PubMed] [Google Scholar]
- 9.Fitch MJ, Campagnolo L, Kuhnert F, et al. Egfl7, a novel epidermal growth factor-domain gene expressed in endothelial cells[J] Dev Dyn. 2004;230(2):316–324. doi: 10.1002/dvdy.20063. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Schmidt M, Paes K, De Mazière A, et al. EGFL7 regulates the collective migration of endothelial cells by restricting their spatial distribution[J] Development. 2007;134(16):2913–2923. doi: 10.1242/dev.002576. [DOI] [PubMed] [Google Scholar]
- 11.Rossant J, Hirashima M. Vascular development and patterning: making the right choices[J] Curr Opin Genet Dev. 2003;13(4):408–412. doi: 10.1016/s0959-437x(03)00080-7. [DOI] [PubMed] [Google Scholar]
- 12.Campagnolo L, Leahy A, Chitnis S, et al. EGFL7 is a chemoattractant for endothelial cells and is up-regulated in angiogenesis and arterial injury[J] Am J Pathol. 2005;167(1):275–284. doi: 10.1016/S0002-9440(10)62972-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Vicente-Manzanares M, Sánchez-Madrid F. Role of the cytoskeleton during leukocyte responses[J] Nat Rev Immunol. 2004;4(2):110–122. doi: 10.1038/nri1268. [DOI] [PubMed] [Google Scholar]
- 14.Rossi D, Zlotnik A. The biology of chemokines and their receptors[J] Annu Rev Immunol. 2000;18:217–242. doi: 10.1146/annurev.immunol.18.1.217. [DOI] [PubMed] [Google Scholar]
- 15.Levéen P, Pekny M, Gebre-Medhin S, et al. Mice deficient for PDGF B show renal, cardiovascular, and hematological abnormalities[J] Genes Dev. 1994;8(16):1875–1887. doi: 10.1101/gad.8.16.1875. [DOI] [PubMed] [Google Scholar]
- 16.Witzenbichler B, Maisonpierre PC, Jones P, et al. Chemotactic properties of angiopoietin-1 and -2, ligands for the endothelial-specific receptor tyrosine kinase Tie2[J] J Biol Chem. 1998;273(29):18514–18521. doi: 10.1074/jbc.273.29.18514. [DOI] [PubMed] [Google Scholar]
- 17.陈 治, 张 莉. VEGF 基因表达调控机制的研究进展[J] 国外医学: 生理病理科学与临床分册. 2000;20(3):190–192. [Google Scholar]
- 18.蒋 卫东, 曾 季平, 刘 玉胜, et al. 类表皮生长因子域7与动脉粥样硬化斑块内血管生成关系[J] 中华老年医学杂志. 2012;31(1):39–43. [Google Scholar]