Abstract
目的
探讨丝/苏氨酸蛋白激酶(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)/p70 S6K信号通路在口腔鳞癌组织中的表达情况,为口腔鳞癌的早期诊断和治疗提供参考。
方法
收集口腔鳞癌标本51例,癌旁黏膜组织10例,正常口腔黏膜10例。采用免疫组织化学SP法检测口腔鳞癌、癌旁黏膜组织及正常口腔黏膜中p-Akt、p-mTOR及p70 S6K的表达情况,分析三者相互之间表达的相关性。
结果
p-Akt、p-mTOR及p70 S6K在口腔鳞癌组中的表达显著高于正常口腔黏膜组和癌旁黏膜组的表达。p-Akt、p-mTOR及p70 S6K在口腔鳞癌的表达与患者的年龄、性别及临床分期无相关性,但与口腔鳞癌的分化程度及有无淋巴结转移有相关性。p-Akt、p-mTOR及p70 S6K在口腔鳞癌的表达相互之间具有较强的正相关关系。
结论
Akt/mTOR/p70 S6K信号通路分子在口腔鳞癌中表达活跃,提示可能与口腔鳞癌的发生发展具有重要的相关性。
Keywords: 丝/苏氨酸蛋白激酶, 哺乳动物雷帕霉素靶蛋白, p70 S6K, 口腔鳞癌, 免疫组织化学
Abstract
Objective
To investigate the expressions of serine-threonine kinase (Akt)/ mammalian target of rapamycin(mTOR)/p70 S6K in oral squamous cell carcinoma (OSCC) and provide references for early diagnosis and prognosis evaluation of OSCC.
Methods
A total of 51 cases of OSCC, 10 cases of paracancerous mucosa, and 10 cases of normal oral mucosa were collected. The expressions of Akt/mTOR/p70 S6K in these cases were detected using the SP method of immunohistochemistry. The correlation between their expressions in OSCC was also analyzed.
Results
The positive expressions of p-Akt, p-mTOR, and p70 S6K in OSCC were significantly higher than those in normal oral mucosa and paracancerous mucosa. The expressions of p-Akt, p-mTOR, and p70 S6K in OSCC were not correlated with age, gender, and clinical stage; by comparison, these expressions were correlated with lymph node metastasis and pathological grade. Strong positive correlations were also observed between the expressions of p-Akt, p-mTOR, and p70 S6K in OSCC.
Conclusion
Akt/mTOR/p70 S6K signaling molecules exhibit active expressions in OSCC and may be implicated in the occurrence and development of OSCC.
Keywords: serine-threonine kinase, mammalian target of rapamycin, p70 S6K, oral squamous cell carcinoma, immunohistochemistry
口腔鳞癌(oral squamous cell carcinoma,OSCC)是口腔颌面部最常见的恶性肿瘤,其发生和发展涉及多种基因表达的改变,致使信号传导通路异常,细胞异常增殖、分化、迁移,最终形成癌[1]–[3]。研究[4]表明:丝/苏氨酸蛋白激酶(serine-threonine kinase,Akt)的异常活化与多种肿瘤相关,包括卵巢癌、乳腺癌、甲状腺癌等,暗示Akt的活化在肿瘤的发生中有着重要作用。活化的Akt可以激活哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR),被激活的mTOR及其下游分子p70 S6K可以参与氨基酸、生长因子等所激发的信号通路,借以调控蛋白质翻译物合成、抑制不依赖p53的细胞凋亡、促进细胞周期加速[5]–[7]。但目前关于Akt/mTOR/p70 S6K信号转导通路在口腔鳞癌发生发展中的作用及这几种因子之间的相互关系的研究较少见。本研究采用免疫组织化学法检测正常口腔黏膜、鳞癌癌旁黏膜和口腔鳞癌组织中p-Akt、p-mTOR及p70 S6K的表达情况,并分析这几种蛋白质在口腔鳞癌中表达的相互关系,研究其作为口腔鳞癌的标志物或者预测因子的可能性,为临床上对口腔鳞癌进行早期诊断和治疗提供参考。
1. 材料和方法
1.1. 标本来源
收集2009—2011年四川大学华西口腔医院头颈肿瘤外科手术切除并经临床及病理确诊为口腔鳞癌的病例51例(口腔同时伴发其他黏膜疾病者不列入本实验,且所有病例术前均未行放疗及化疗)。其中男37例,女14例,年龄27~80岁,平均56.94岁。按组织学分化程度分为:鳞癌一级26例,二级16例,三级9例;临床分期:Ⅰ期10例,Ⅱ期14例,Ⅲ期9例,Ⅳ期18例。其中18例有淋巴结转移,33例无淋巴结转移。同时随机选取其中10例,取癌旁黏膜组织标本(肿瘤边缘约1 cm的口腔黏膜组织),作为对照组A。设置10例正常口腔黏膜组织为对照组B,其中男6例,女4例,年龄36~71岁,平均52.37岁。两组资料的性别及年龄差异均无统计学意义。所有标本在离体后常规甲醛固定,取材,逐级脱水,石蜡包埋。
1.2. 主要试剂
鼠抗人p-Akt(T308)单克隆抗体、鼠抗人p-mTOR(S2448)单克隆抗体以及鼠抗人p70 S6K(F415)单克隆抗体(南京巴傲得生物科技有限公司),免疫组化染色试剂盒(SP-9000通用型)及浓缩型DAB试剂盒(ZLI-9031)(北京中杉金桥生物技术有限公司)。
1.3. 实验方法
1.3.1. 标本切片
所收集的病理标本蜡块为供体蜡块,常规切片,每个标本切4 µm厚连续切片,切6张,1张行苏木精-伊红(hematoxylin-eosin,HE)染色复查,取材不好的标本弃用。1张用0.01 mol·L−1PBS液代替一抗作为阴性对照。
1.3.2. SP法染色
经预实验明确p-Akt抗体的最佳稀释度是1︰100,p-mTOR抗体的最佳稀释度是1︰150,p70 S6K抗体最佳稀释度为1︰200。主要步骤为烤片;脱蜡;梯度乙醇脱水;用3%H2O2溶液阻断灭活内源性过氧化物酶;抗原修复;正常山羊血清封闭;滴加一抗孵育(用PBS液代替一抗作阴性对照),PBS液洗3次;滴加生物素化标记二抗孵育,PBS液洗3次;滴加辣根过氧化物酶标记的链霉素卵白素工作液,PBS液洗3次;DAB显色液染色,水洗;苏木素复染,水洗;1%盐酸乙醇分色,水洗;氨水返蓝,水洗;最后常规脱水、透明、干燥、封片。
1.4. 结果观察
在10×40倍的光学显微镜下观察切片的显色反应。细胞质或细胞核呈棕黄色和棕褐色颗粒状物质的为p-Akt、p-mTOR、p70 S6K阳性细胞。采用Fromowitz等[8]的综合计分法,每张切片随机选取5个高倍视野(×400)计数,阳性细胞表达率=(阳性细胞数/记数细胞总数)×100%。无阳性细胞计0分,阳性细胞表达率≤25%计1分,26%~50%计2分,51%~75%计3分,>75%计4分。着色强度以多数阳性细胞呈现的染色特性记分,若无着色的计0分,呈淡黄色计1分,呈棕黄色计2分,呈棕褐色计3分。两者之和,0~1分为阴性(-),2~3分为弱阳性(+),4~5分为中度阳性(++);6~7分为强阳性(+++)。所有切片均采用双盲法阅片,进行相关性分析时,“-”、“+”归为弱表达,“++”、“ +++”均归为强表达。
1.5. 统计学处理
采用SPSS 17.0统计软件包进行统计分析。各组标本p-Akt、p-mTOR、p70 S6K表达阳性率比较采用χ2检验和Fisher 确切概率,p-Akt、p-mTOR、p70 S6K表达相关性采用Spearman秩相关分析。以α=0.05作为检验标准,P<0.05为差异有统计学意义。表达强度比较用等级资料的秩和检验,再进行两两比较时检验标准调整为α′=0.017。
2. 结果
2.1. p-Akt、p-mTOR、p70 S6K在正常口腔黏膜、癌旁黏膜组织、口腔鳞癌组织中的表达情况
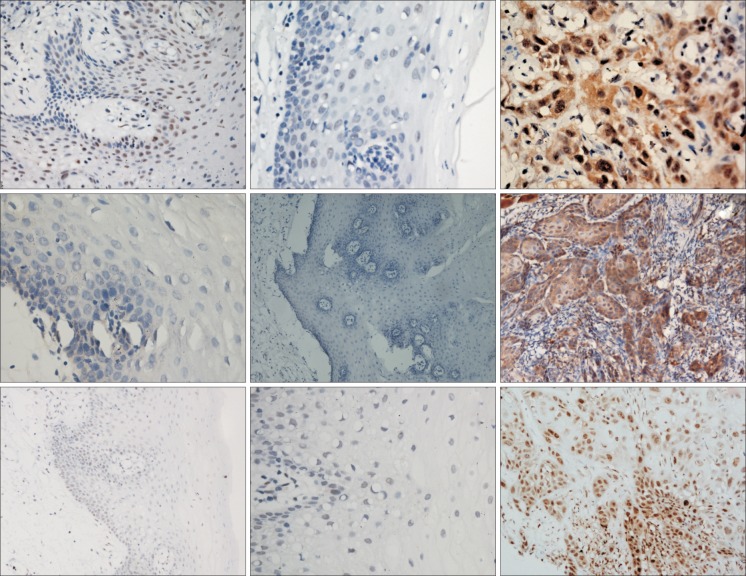
p-Akt、p-mTOR、p70 S6K在正常口腔黏膜、癌旁黏膜组织、口腔鳞癌组织中的表达情况见图1。p-Akt在口腔鳞癌组织中的阳性表达主要为癌细胞胞浆内棕黄色染色,少数亦位于细胞核棕黄色染色;p-mTOR阳性表达为细胞质内棕黄色染色;p70 S6K阳性表达为细胞质和胞核棕黄色染色。p-Akt、p-mTOR及p70 S6K在正常口腔黏膜和癌旁黏膜组织中的上皮层中均为阴性或弱阳性表达。在正常口腔黏膜中p-Akt、p-mTOR和p70 S6K分别只有40%、20%及40%的弱阳性表达。在癌旁黏膜组织中p-Akt、p-mTOR和p70 S6K分别只有40%、60%及40%的弱阳性表达。p-Akt、p-mTOR及p70 S6K在正常口腔黏膜组和癌旁黏膜组的表达强度差异均无统计学意义。在口腔鳞癌组中p-Akt、p-mTOR和p70 S6K阳性表达率均为98.04%,均以呈强阳性表达为主。经过统计分析,p-Akt、p-mTOR和p70 S6K在口腔鳞癌组的表达强度与正常口腔黏膜组和癌旁黏膜组的表达强度的差异有统计学意义(表1)。
图 1. p-Akt、p-mTOR和p70 S6K在正常口腔黏膜、癌旁黏膜组织、口腔鳞癌中的表达 SP × 400.
Fig 1 Expression of p-Akt, p-mTOR and p70 S6K in normal oral mucosa, paracancerous mucosa and OSCC SP × 400
上:p-Akt;中:p-mTOR;下:p70 S6K;从左至右依次为在正常口腔黏膜、癌旁黏膜、口腔鳞癌组织中的表达。
表 1. 正常口腔黏膜、癌旁黏膜组织、口腔鳞癌组织中p-Akt、p-mTOR、p70 S6K的表达.
Tab 1 Expression of p-Akt, p-mTOR and p70 S6K in normal oral mucosa, paracancerous mucosa and OSCC
| 表达等级 | p-Akta |
p-mTORb |
p70 S6Kc |
||||||
| 正常口腔黏膜d | 癌旁黏膜e | 口腔鳞癌f | 正常口腔黏膜g | 癌旁黏膜h | 口腔鳞癌i | 正常口腔黏膜j | 癌旁黏膜k | 口腔鳞癌l | |
| - | 6 | 6 | 1 | 8 | 4 | 1 | 6 | 6 | 1 |
| + | 4 | 4 | 9 | 2 | 6 | 12 | 4 | 4 | 13 |
| ++ | 0 | 0 | 28 | 0 | 0 | 27 | 0 | 0 | 26 |
| +++ | 0 | 0 | 13 | 0 | 0 | 11 | 0 | 0 | 11 |
| 合计 | 10 | 10 | 51 | 10 | 10 | 51 | 10 | 10 | 51 |
注:a 3组总体比较P=0.000,a=0.05;d vse:P=1.000,a′=0.017;dvsf:P=0.000,a′=0.017;evsf:P=0.000,a′=0.017;b3组总体比较P=0.000,a=0.05;gvsh:P=0.075,a′=0.017; gvsi:P=0.000,a′=0.017;hvsi:P=0.000,a′=0.017;c3组总体比较P=0.000,a=0.05;jvsk:P=1.000,a′=0.017;jvsl:P=0.000,a′=0.017;kvsl:P=0.000,a′=0.017。
2.2. 口腔鳞癌标本内p-Akt、p-mTOR和p70 S6K的表达与患者临床病理参数之间的关系
p-Akt、p-mTOR和p70 S6K在口腔鳞癌的强表达情况与口腔鳞癌患者的性别、年龄、病理分化程度、临床分期及淋巴结转移的关系见表2。p-Akt、p-mTOR、p70 S6K的表达与患者年龄、性别和临床分期无明显关系(P>0.05)。p-Akt、p-mTOR、p70 S6K在口腔鳞癌一级、二级和三级组织中,强表达率均逐渐升高,且差异均有统计学意义(P<0.05)。p-Akt、p-mTOR、p70 S6K的表达与是否有淋巴结转移有显著相关性,差异均有统计学意义(P<0.05)。
表 2. p-Akt、p-mTOR及p70 S6K的表达与患者临床病理参数的关系.
Tab 2 Relationship between expressions of p-Akt, p-TOR and p70 S6K in OSCC and clinic opathological parameters
| 指标 | 例数 | p-Akt |
p-mTOR |
p70 S6K |
|||
| 强表达(n/%) | P值 | 强表达(n/%) | P值 | 强表达(n/%) | P值 | ||
| 性别 | |||||||
| 男 | 37 | 29/78.38 | 0.846 | 27/72.97 | 0.961 | 26/70.27 | 0.809 |
| 女 | 14 | 12/85.71 | 11/78.57 | 11/78.57 | |||
| 年龄/岁 | |||||||
| ≥60 | 40 | 34/85.00 | 0.249 | 31/77.50 | 0.587 | 31/77.50 | 0.259 |
| <60 | 11 | 7/63.64 | 7/63.64 | 6/54.55 | |||
| 分化程度 | |||||||
| 一级 | 26 | 17/65.38 | 0.009 | 15/68.18 | 0.005 | 14/53.85 | 0.003 |
| 二级 | 16 | 15/93.75 | 14/87.50 | 14/87.50 | |||
| 三级 | 9 | 9/100.00 | 9/100.00 | 9/100.00 | |||
| 临床分期 | |||||||
| Ⅰ期、Ⅱ期 | 24 | 20/83.33 | 0.884 | 16/66.67 | 0.226 | 16/66.67 | 0.375 |
| Ⅲ期、Ⅳ期 | 27 | 21/77.78 | 22/81.48 | 21/77.78 | |||
| 淋巴转移 | |||||||
| 有 | 18 | 18/100.00 | 0.009 | 18/100.00 | 0.002 | 18/100.00 | 0.001 |
| 无 | 33 | 23/69.70 | 20/60.61 | 19/57.58 | |||
2.3. 口腔鳞癌中p-Akt、p-mTOR、p70 S6K表达的相关性分析
经过Spearman相关性分析,p-Akt和p-mTOR表达具有较强的正相关关系(rs=0.618,P<0.001);p-Akt和p70 S6K表达有较强的正相关关系(rs=0.629,P<0.001);p-mTOR和p70 S6K表达有较强的正相关关系(rs=0.648,P<0.001)。
3. 讨论
恶性肿瘤的发生是一个多因素、多步骤、多阶段的复杂过程,其调控过程是通过相当复杂而巨大的信号转导通路网络来完成的。近年来研究认为Akt/mTOR/p70 S6K通路在调控细胞生长、生存、繁殖、凋亡,参与细胞迁移和侵袭,促进血管生成等方面起着重要作用,其异常活化可能在肿瘤的发生发展过程以及抵抗放化疗中癌细胞的凋亡过程中起着非常重要的作用[9]–[10]。
Akt是细胞内反转录病毒v-Akt的同源物所编码的一种蛋白激酶,处于Akt/mTOR/p70 S6K信号转导通路的核心地位[11],活化的Akt通过磷酸化抑癌基因结节性脑硬化复合物蛋白2(tuberous sclerosis 2,TSC2),解除抑癌基因结节性脑硬化复合物TSC1-TSC2对脑中富集的Ras同源物(Rheb)的抑制,激活mTOR[12]–[13]。也有研究[14]发现Akt可以不依赖TSC2途径而直接影响mTOR活性。本实验显示出 p-Akt在正常口腔黏膜和癌旁黏膜组织中的表达很弱,而在口腔鳞癌组中主要呈现强阳性表达。p-Akt在口腔鳞癌组中的表达显著高于另外两组,且p-Akt的表达与口腔鳞癌的组织学分化程度和有无淋巴结转移显著相关。这些提示在口腔鳞癌组组织中存在Akt的活化,其异常活化在口腔鳞癌的发生发展中可能发挥重要作用。
mTOR具有蛋白激酶的活性,属于丝/苏氨酸蛋白激酶。研究认为mTOR被激活后,可磷酸化它的两个下游分子,即翻译启始因子4E结合蛋白1(eIF-4E binding protein 1,4E-BP1)和核糖体蛋白p70 S6K[5]。活化的mTOR磷酸化4E-BP1后,解除eIF-4E/4E-BP1的结合,从而激活蛋白质翻译[15]–[16]。而p70 S6K磷酸化后被激活,促进核糖体蛋白和翻译调节蛋白的合成,进而对蛋白合成调节。这些变化提高了mRNA的翻译起始效率,加速蛋白质的合成,利于胞内蛋白的积累,从而促进细胞生长[17]–[18]。本实验显示出p-mTOR和p70 S6K在正常口腔黏膜和癌旁黏膜组织中的表达很弱,而在口腔鳞癌组中主要呈现强阳性表达。p-mTOR和p70 S6K在口腔鳞癌组中的表达显著高于另外两组,且p-mTOR和p70 S6K的表达与口腔鳞癌的组织学分化程度和有无淋巴结转移均有显著相关。这些提示在口腔鳞癌组织中存在着mTOR/p70 S6K的活化,mTOR/p70 S6K的活化可能与口腔鳞癌的发生发展有关。本文的研究结果与其他学者在乳腺癌、肺癌上的研究有相类似的结果[19]–[20]。胡江辉等[19]报道p-Akt和p-p70 S6K在乳腺导管内癌、浸润性导管癌中的表达皆高于癌旁正常组织,差异均具有统计学意义。岳文涛等[20]研究发现与癌旁组织相比较,在非小细胞肺癌组织中Akt、mTOR的基因表达水平明显上调。这些研究均提示Akt/mTOR/p70 S6K信号通路可能与一些恶性肿瘤的发生发展有相关性。
另外还分析了p-Akt、p-mTOR和p70 S6K表达之间的相关性,结果发现其两两之间的表达均具有较强的正相关关系(P<0.001),进一步验证了Akt/mTOR/p70 S6K信号通路在口腔鳞癌中的存在。
综上所述,本研究显示Akt/mTOR/p70 S6K信号通路分子在口腔鳞癌中表达活跃,提示该信号通路可能在口腔鳞癌的发生、发展中起重要的作用,对该通路的表达进行检测有可能对口腔鳞癌的早期诊断和判断预后提供帮助。但要阐明Akt/mTOR/p70 S6K信号通路与口腔鳞癌发生发展的关系及其在此过程的具体作用机制,目前的研究还远远不够,只有从分子水平深入研究该信号传导通路,才有可能为头颈部鳞癌的基因治疗、新的抗肿瘤药物的开发提供新的靶点。
Funding Statement
[基金项目] 四川省科技支撑计划基金资助项目(2011SZ0156)
References
- 1.Kademani D, Bell RB, Schmidt BL, et al. Oral and maxillofacial surgeons treating oral cancer: a preliminary report from the American Association of Oral and Maxillofacial Surgeons Task Force on Oral Cancer[J] J Oral Maxillofac Surg. 2008;66(10):2151–2157. doi: 10.1016/j.joms.2008.06.030. [DOI] [PubMed] [Google Scholar]
- 2.Sathyan KM, Nalinakumari KR, Kannan S. H-Ras mutation modulates the expression of major cell cycle regulatory proteins and disease prognosis in oral carcinoma[J] Mod Pathol. 2007;20(11):1141–1148. doi: 10.1038/modpathol.3800948. [DOI] [PubMed] [Google Scholar]
- 3.Murugan AK, Hong NT, Cuc TT, et al. Detection of two novel mutations and relatively high incidence of H-RAS mutations in Vietnamese oral cancer[J] Oral Oncol. 2009;45(10):e161–e166. doi: 10.1016/j.oraloncology.2009.05.638. [DOI] [PubMed] [Google Scholar]
- 4.Testa JR, Bellacosa A. AKT plays a central role in tumorigenesis[J] Proc Natl Acad Sci USA. 2001;98(20):10983–10985. doi: 10.1073/pnas.211430998. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Zhou X, Tan M, Stone Hawthorne V, et al. Activation of the Akt/mammalian target of rapamycin/4E-BP1 pathway by ErbB2 overexpression predicts tumor progression in breast cancers[J] Clin Cancer Res. 2004;10(20):6779–6788. doi: 10.1158/1078-0432.CCR-04-0112. [DOI] [PubMed] [Google Scholar]
- 6.Wendel HG, De Stanchina E, Fridman JS, et al. Survival signalling by Akt and eIF4E in oncogenesis and cancer therapy[J] Nature. 2004;428(6980):332–337. doi: 10.1038/nature02369. [DOI] [PubMed] [Google Scholar]
- 7.Gao N, Flynn DC, Zhang Z, et al. G1 cell cycle progression and the expression of G1 cyclins are regulated by PI3K/AKT/mTOR/p70S6K1 signaling in human ovarian cancer cells[J] Am J Physiol, Cell Physiol. 2004;287(2):C281–C291. doi: 10.1152/ajpcell.00422.2003. [DOI] [PubMed] [Google Scholar]
- 8.Fromowitz FB, Viola MV, Chao S, et al. ras p21 expression in the progression of breast cancer[J] Hum Pathol. 1987;18(12):1268–1275. doi: 10.1016/s0046-8177(87)80412-4. [DOI] [PubMed] [Google Scholar]
- 9.Xu G, Zhang W, Bertram P, et al. Pharmacogenomic profiling of the PI3K/PTEN-AKT-mTOR pathway in common human tumors[J] Int J Oncol. 2004;24(4):893–900. [PubMed] [Google Scholar]
- 10.Shiojima I, Walsh K. Role of Akt signaling in vascular homeostasis and angiogenesis[J] Circ Res. 2002;90(12):1243–1250. doi: 10.1161/01.res.0000022200.71892.9f. [DOI] [PubMed] [Google Scholar]
- 11.Hay N. The Akt-mTOR tango and its relevance to cancer[J] Cancer Cell. 2005;8(3):179–183. doi: 10.1016/j.ccr.2005.08.008. [DOI] [PubMed] [Google Scholar]
- 12.Urano J, Sato T, Matsuo T, et al. Point mutations in TOR confer Rheb-independent growth in fission yeast and nutrient-independent mammalian TOR signaling in mammalian cells[J] Proc Natl Acad Sci USA. 2007;104(9):3514–3519. doi: 10.1073/pnas.0608510104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Huang S, Houghton PJ. Targeting mTOR signaling for cancer therapy[J] Curr Opin Pharmacol. 2003;3(4):371–377. doi: 10.1016/s1471-4892(03)00071-7. [DOI] [PubMed] [Google Scholar]
- 14.Peng XD, Xu PZ, Chen ML, et al. Dwarfism, impaired skin development, skeletal muscle atrophy, delayed bone development, and impeded adipogenesis in mice lacking Akt1 and Akt2[J] Genes Dev. 2003;17(11):1352–1365. doi: 10.1101/gad.1089403. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Hay N, Sonenberg N. Upstream and downstream of mTOR[J] Genes Dev. 2004;18(16):1926–1945. doi: 10.1101/gad.1212704. [DOI] [PubMed] [Google Scholar]
- 16.Schalm SS, Fingar DC, Sabatini DM, et al. TOS motifmediated raptor binding regulates 4E-BP1 multisite phosphorylation and function[J] Curr Biol. 2003;13(10):797–806. doi: 10.1016/s0960-9822(03)00329-4. [DOI] [PubMed] [Google Scholar]
- 17.Yang Q, Guan KL. Expanding mTOR signaling[J] Cell Res. 2007;17(8):666–681. doi: 10.1038/cr.2007.64. [DOI] [PubMed] [Google Scholar]
- 18.Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream[J] Cell. 2007;129(7):1261–1274. doi: 10.1016/j.cell.2007.06.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.胡 江辉, 李 代强. 乳腺癌组织中p-Tyr、p-Akt和p-p70S6K的表达及其临床意义[J] 临床与实验病理学杂志. 2009;25(3):260–263. [Google Scholar]
- 20.岳 文涛, 王 小敏, 王 玥. PI3K/Akt/mTOR信号转导途径与非小细胞肺癌的关系[J] 中国肺癌杂志. 2009;12(4):312–315. [Google Scholar]