Abstract
目的
研究龈下刮治和根面平整术(SRP)联合Nd: YAG激光治疗对慢性牙周炎患者的疗效。
方法
选择口内有4颗及以上牙齿,探诊深度为4~8 mm的慢性牙周炎患者,研究位点为分布在口内4个不同象限的互不毗邻的单根牙。随机分成4组:对照组(不治疗)、SRP组(单纯SRP)、SRP+L组(SRP后行激光治疗)、L+SRP组(激光治疗后行SRP)。观测时间点为基线(临床处理前)和临床处理后1周、1个月、3个月,比较不同组在不同观测点牙周临床指标和龈下菌群中红色复合体(包括牙龈卟啉单胞菌、福赛斯坦纳菌、齿垢密螺旋体)的组成变化。
结果
牙周临床指标:SRP、SRP+L、L+SRP组的各项临床指标变化均优于对照组;3个治疗组组间比较,探诊出血、探诊深度和临床附着丧失量之间无明显差异(P>0.05),但在3个月时,L+SRP和SRP+L组的菌斑指数百分比下降较SRP组明显(P<0.05)。微生物检测结果:SRP、SRP+L、L+SRP组龈下菌斑中牙龈卟啉单胞菌、福赛斯坦纳菌、齿垢密螺旋体百分比均较基线下降,3个治疗组间也存在一定差异(P<0.05),但在不同观测时间点的差异不完全相同。
结论
慢性牙周炎治疗中,Nd: YAG激光联合SRP治疗较单纯SRP治疗未见明显优势,且Nd: YAG激光和SRP的治疗先后对临床效果也无明显影响;但激光联合SRP治疗可能较单纯SRP更有利于局部菌斑的控制。
Keywords: 慢性牙周炎, 龈下刮治和根面平整术, Nd: YAG激光, 龈下菌斑, 红色复合体
Abstract
Objective
Our research aimed to detect the efficacy of non-surgical periodontal treatment with Nd: YAG laser and scaling and root planning (SRP) for chronic periodontitis.
Methods
We recruited chronic periodontitis patients who have more than four teeth with clinical pocket depth of 4–8 mm. These teeth were distributed in four different zones within the oral cavity. Moreover, the teeth were single root teeth and not adjacent to each other. The subordinated teeth were randomized into four groups, as follows: no treatment (C group), simple SRP (SRP group), Nd: YAG laser after SRP treatment (SRP+L group), and SRP after Nd: YAG laser treatment (L+SRP group). The four experimental observation points were as follows: before treatment (baseline) and 1 week, 1 month, and 3 months after treatment. We measured clinical indicators and collected subgingival deposits in the four time points to analyze changes of red complex in periodontitis.
Results
The clinical indicators were better in all treatment groups than in the control group. Comparison among treatment groups indicated that the value of bleeding on probing, periodontal probing depth, and clinical attachment loss showed no difference. However, the value of plaque index in SRP+L and L+SRP presented a significant reduction at 3 months after treatment. The percentages of Porphyromonas gingivalis, Tannerella forsythia, and Treponema denticola in all treatment groups decreased after clinical treatment, and differences were observed among the treatment groups at different time points.
Conclusion
Non-surgical periodontal treatment with SRP and Nd: YAG laser is not more effective than SRP monotherapy. The sequence of laser treatment and SRP has no significant effect on the treatment. However, SRP with Nd: YAG laser was beneficial for plaque control. Non-surgical periodontal treatment with Nd: YAG laser may be used as an alternative to reduce and control the proliferation of microorganisms in persistent periodontitis, but it still needs further verification.
Keywords: chronic periodontitis, scaling and root planning, Nd: YAG laser, subgingival plaque, red complex
龈下刮治和根面平整(scaling and root planning,SRP)术是目前慢性牙周炎的首选治疗方式。波长为1.064 µm的Nd: YAG激光属于近红外激光,可由光导纤维传输,以脉冲式间断发射,是临床上治疗慢性牙周炎的辅助手段;但目前对其作为慢性牙周炎辅助治疗手段的疗效评价仍不统一。Qadri等[1]–[3]认为:SRP联合激光治疗组较单纯SRP组的疗效更为明显;而Slot等[4]–[5]则认为,SRP联合激光治疗组与单纯SRP的治疗效果无明显差异。此外,应用脉冲型Nd: YAG激光辅助SRP的治疗顺序也尚无定论。曾雄群等[6]认为,Nd: YAG激光会对根面形态造成一定的影响,需要再次进行根面平整来改善根面光滑度;Gaspirc等[7]则认为,Nd: YAG激光通过改变根面形态和根面组织的化学组成而促使附着增加。相关研究未达成明确的结论,其对临床治疗的指导价值仍有限。基于此,本研究拟采用随机平行对照试验,通过检测牙周临床指标及龈下微生物红色复合体的组成变化,评估SRP联合脉冲型Nd:YAG激光治疗慢性牙周炎患者的效果,以期为激光在牙周炎中的治疗应用提供参考依据。
1. 材料和方法
1.1. 研究对象
选择2013年3月—2014年10月在四川大学华西口腔医院就诊的15例慢性牙周炎患者,其中男性6例,女性9例,年龄20~58岁,平均年龄(36.23±10.36)岁。每例患者要求有4颗及以上符合选择标准的患牙,分布在口内4个不同象限。患者的选择标准如下:1)符合慢性牙周炎的诊断标准,本研究采用Armitage(1999年)的诊断标准[8];2)近3个月内未进行牙周治疗;3)近3个月内无抗生素、非激素类抗炎药物及免疫抑制剂服用史;4)无影响牙周治疗的全身性疾病,女性非妊娠期及哺乳期;5)无吸烟史;6)无糖尿病、冠心病等与牙周密切相关的全身疾病;7)对将要进行的试验研究知情同意并且依从性良好。患牙选择标准:1)牙周探诊深度(periodontal probing depth,PPD)为4~8 mm,临床附着丧失(clinical attachment loss,CAL)≥2 mm,探诊出血(bleeding on probing,BOP)阳性 ;2)牙颈部无充填体;3)无咬合创伤;4)无根折或根裂;5)发育良好;6)同一患者的4颗患牙需分布在不同象限;7)均为单根牙,互不毗邻。本研究为临床试验,获得四川大学华西口腔医院医学伦理委员会的批准(批准号WCHSIRB-D-2013-134-R1),所有受试者均签署知情同意书。
1.2. 试验分组及临床处理
在对患者进行口腔卫生宣教、龈上洁治及牙面抛光后,将纳入患牙随机分组,并进行以下临床处理:1)对照组(C组),不作任何治疗;2)SRP组:单纯行SRP;3)SRP+L组:先进行SRP,再进行Nd:YAG激光治疗;4)L+SRP组:先进行Nd:YAG激光治疗,再进行SRP。
采用压电陶瓷式超声洁牙机(mimiPiezon型,EMS公司,瑞士)进行治疗。洁牙机参数设置:治疗功率为5 W,水成喷雾状。患牙用PS尖行超声龈下刮治,每个牙面约5 min;再用Gracey刮治器进行手工根面平整术,每一次刮除与前一次动作有部分重叠连续不间断,至探针探查根面光滑无结石。所有受试者均由同一位经过严格培训的医师完成。
脉冲型Nd:YAG激光治疗采用GENIUS激光治疗仪(GeniusPeriodotal牙医疗器械公司,丹麦)进行,参照Slot等[4]的研究设置照射量和照射时间,具体设置为:功率6.0 W,时间每位点55 s。激光照射前不需麻醉,光纤探头长度以袋深为准,治疗方式为探头沿袋内壁移至袋底,再沿牙根面移至龈缘,避免同一部位停留过久。所有受试者均由同一位经过严格培训的医师完成。
研究时间点的选择:1)基线,单纯龈上洁治及牙面抛光后、临床试验处理前;2)临床试验处理后1周;3)临床试验处理后1个月;4)临床试验处理后3个月。
1.3. 牙周临床指标的检测
由同一位经过严格培训的医师对患者受试牙待测位点的临床指标进行检测,保证结果的一致性。临床指标包括:菌斑指数(plaque index,PI)、BOP、PPD、CAL。检测顺序为先测定PI,再测量PPD并计算CAL,每颗牙均需要测定6个位点,BOP在探诊后10~15 s记录。PI的记分标准参照Silness和Loe[9]在1964年提出的方法,分数记为0、1、2、3,其中0和1表示无菌斑,2和3表示有菌斑;PI(%)=(有菌斑牙面数/测试牙面数×100%)[10]。BOP记录为阳性(+)或阴性(−)。PPD、CAL记录检测数值,单位为mm。测量BOP、PPD、CAL时需使用标准化牙周探针严格按照探诊的力度和方法进行测量。
1.4. 微生物指标的检测
1.4.1. 样本的收集及DNA提取
基线时,在纳入患牙牙周袋最深的位点采集龈下菌斑;在以后的3个观测点,重新采集相同位点的龈下菌斑样本。利用细菌DNA提取试剂盒提取样本DNA,紫外分光光度仪测定DNA纯度,−80 °C保存,备用。
1.4.2. 聚合酶链式反应(polymerase chain reaction,PCR)法定性验证所提取的DNA
参考Premix Taq R001AM试剂盒(TaKaRa Biotech公司,日本)说明,参照文献[11]设置的循环参数,将提取的DNA样本进行PCR扩增反应。取PCR扩增产物进行2%琼脂糖凝胶电泳,电泳30 min,然后采用全自动凝胶成像分析系统观察电泳产物并记录,100 bp Marker确定扩增产物的相对分子质量大小。
1.4.3. 实时荧光定量PCR反应
菌种特异性实时荧光定量PCR引物序列如表1所示。分别将实验菌株的DNA分装成4份(每份6 µL),行4个菌种的实时荧光定量PCR扩增,得到各个样本中每个菌种的Ct值,然后通过与细菌通用引物Ct值比较,计算出各细菌占样本总细菌量的百分比。每个样本每次进行PCR扩增时设置3个副孔,求平均值。
表 1. 实时荧光定量PCR引物序列.
Tab 1 Primer sequences of real-time fluorescence quantitative PCR
| 实验菌株 | 目的基因 | 引物序列 |
| 细菌通用引物 | 16S rRNA | 正向:5′-CGCAGAAGGTGAAAGTCCTGTAT-3′ |
| 反向:5′-TGTGACGGGCGGTGTGTA-3′ | ||
| 福赛斯坦纳菌 | 16S rRNA | 正向:5′-ATCCTGGCTCAGGATGAACG-3′ |
| 反向:5′-TACGCATACCCATCCGCAA-3′ | ||
| 牙龈卟啉单胞菌 | 16S rRNA | 正向:5′-TACCCATCGTCGCCTTGGT-3′ |
| 反向:5′-CGGACTAAAACCGCATACACTTG-3′ | ||
| 齿垢密螺旋体 | 16S rRNA | 正向:5′-AGAGCAAGCTCTCCCTTACCGT-3′ |
| 反向:5′-TAAGGGCGGCTTGAAATAATGA-3′ |
1.5. 统计分析
应用统计分析软件包SPSS 17.0进行数据处理。PPD、CAL采用均数±标准差表示,BOP、PI采用率来表示;应用方差分析比较PPD与CAL值的变化,卡方检验比较BOP与PI的变化;采用组内配对t检验和组间成组t检验,或方差分析和秩和检验进行微生物数据的统计分析。检验水准为双侧α=0.05。
2. 结果
2.1. 临床指标结果
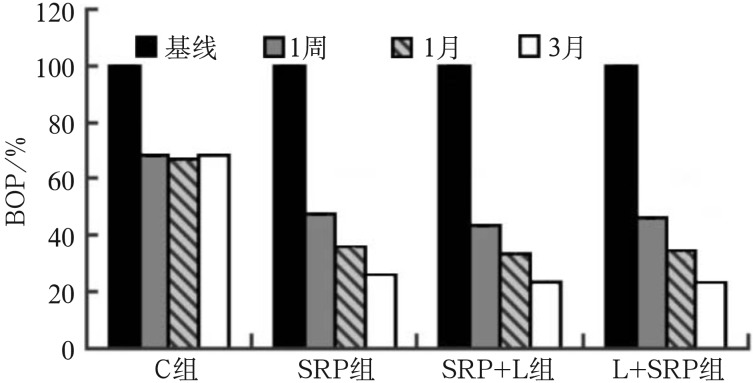
BOP检测结果见图1。为更直观地比较BOP的变化趋势,参考Lopes等[12]将各组基线时的BOP记为100%。组内比较显示:与基线时相比,C组与各治疗组在1周、1个月及3个月的BOP均有下降趋势,其中C组在1周时下降至68.57%(P<0.05),1、3个月时分别为67.13%和68.57%,与1周时比较差异无统计学意义(P>0.05);SRP组、SRP+L组、L+SRP组在1周与基线,1个月与基线及1周,3个月与基线、1周及1个月的BOP差异均有统计学意义(P<0.05)。组间比较:3个治疗组在1周、1个月及3个月时,BOP与C组相比差异均有统计学意义(P<0.05),但3个治疗组间的差异无统计学意义(P>0.05)。由此可见,治疗后各组的BOP表现出更明显的下降趋势,且呈持续下降状态,提示SRP、SRP+L、L+SRP组的治疗方法均可有效改善BOP症状,但3种治疗方法的改善程度无明显差别。
图 1. 各组在基线及治疗后1周、1个月及3个月的BOP阳性位点百分比分布图.
Fig 1 Percentage distribution of BOP positive loci at baseline and at 1 week, 1 and 3 months after treatment in each group
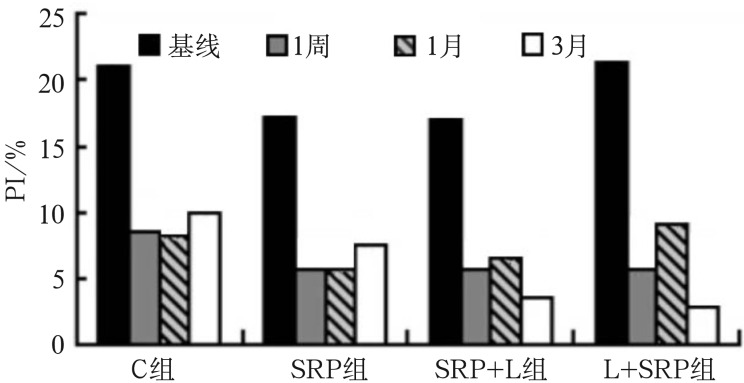
PI检测结果见图2。整个观察期内,PI均维持在21.4%以下;4组基线时与1周、1个月、3个月相比均显著下降(P<0.01),提示有效的牙周基础治疗有助于患者进行更好的口腔卫生维护。组间比较显示:3个月时,L+SRP组下降最明显,与其余3组的差异均有统计学意义(P<0.05);其次为SRP+L组,与C组和SRP组比较有统计学差异(P<0.05)。该结果提示,激光联合SRP治疗较单纯SRP可能更有利于维持菌斑控制的效果。
图 2. 各组在基线及治疗后1周、1个月及3个月的PI检测结果.
Fig 2 Results of PI test at baseline and at 1 weeks, 1 months and 3 months after treatment in each group
表 2. 各组在基线及治疗后1周、1个月及3个月的PPD指标比较.
Tab 2 The PPD indexes of baseline and 1 weeks, 1 months and 3 months after treatment in each group
| 测量项目 | 观测时间 | SRP组(n=122) | SRP+L组(n=124) | L+SRP组(n=136) | C组(n=123) |
| 测量值 | 基线 | 4.91±1.10 | 4.80±0.93 | 5.04±1.18 | 5.07±0.99 |
| 1周 | 4.06±1.311) | 4.06±1.191) | 4.32±1.201) | 5.00±1.00 | |
| 1个月 | 3.47±1.131) | 3.19±1.061) | 3.51±1.181) | 4.76±1.16 | |
| 3个月 | 3.26±1.271) | 3.03±1.071) | 3.26±1.261) | 4.85±1.11 | |
| 与基线差值 | 1周 | 0.85±0.862) | 0.75±0.812) | 0.71±1.202) | 0.07±0.56 |
| 1个月 | 1.44±0.912)3) | 1.61±1.292)3) | 1.53±1.272)3) | 0.31±0.78 | |
| 3个月 | 1.64±0.972)4) | 1.77±1.272)4) | 1.77±1.302)4) | 0.22±0.73 |
注:1)同一组内PPD值与基线相比,P<0.01;2)同一时间点PPD差值与C组比较,P<0.01;3)同一组内1个月与1周的平均差值相比,P<0.01;4)同一组内3个月与1周的平均差值相比,P<0.01。
表 3. 各组在基线及治疗后1周、1个月及3个月的CAL指标比较.
Tab 3 The CAL indexes of baseline and 1 weeks, 1 months and 3 months after treatment in each group
| 测量项目 | 观测时间 | SRP组(n=122) | SRP+L组(n=124) | L+SRP组(n=136) | C组(n=123) |
| 测量值 | 基线 | 5.45±1.45 | 5.36±1.35 | 5.61±1.26 | 5.37±0.99 |
| 1周 | 4.82±1.741) | 5.01±1.571) | 5.24±1.481) | 5.30±0.99 | |
| 1个月 | 4.50±1.611) | 4.41±1.641) | 4.76±1.601) | 5.06±1.16 | |
| 3个月 | 4.38±1.791) | 4.53±1.551) | 4.66±1.711) | 5.15±1.11 | |
| 与基线差值 | 1周 | 0.63±0.892)5) | 0.35±0.822) | 0.36±0.842) | 0.07±0.56 |
| 1个月 | 0.94±1.082)3) | 0.94±1.562)3) | 0.84±1.162)3) | 0.31±0.78 | |
| 3个月 | 1.07±1.152)4) | 0.82±1.572)4) | 0.94±1.142)4) | 0.22±0.73 |
注:1)同一组内CAL值与基线相比,P<0.01;2)同一时间点CAL再获得与C组比较,P<0.05;3)同一组内1个月与1周的CAL再获得相比较,P<0.05;4)同一组内3个月与1周的CAL再获得相比较,P<0.05;5)1周时,SRP组CAL再获得与L+SRP组和SRP+L组比较,P<0.05。
组内比较:SRP组、SRP+L组、L+SRP组的PPD及CAL均值在1周、1个月、3个月时均小于基线(P<0.01),而C组与基线时相比无明显改变(P>0.05),提示SRP组、SRP+L组、L+SRP组的治疗方法均可有效改善牙周病患者的牙周袋深度及附着丧失水平。组内比较PPD、CAL的平均差值显示:1个月和3个月时,各治疗组的差值变化与1周时比较均有统计学差异(P<0.01);但3个月与1个月时相比较,差值的变化尚无统计学意义(P>0.05)。组间比较显示:在1周、1个月和3个月时,与C组相比,3个治疗组的PPD、CAL平均差值变化均有统计学意义(P<0.01);同一时间点内各治疗组之间PPD差值的比较显示,尽管3个月时PPD的差值变化在SRP+L组(1.77 mm)和L+SRP组(1.77 mm)中均较SRP组(1.64 mm)明显,但3组的比较差异无统计学意义(P>0.05);1周时,CAL的差值变化在SRP组(0.63 mm)较L+SRP组(0.36 mm)和SRP+L组(0.35 mm)大(P=0.045),但1个月和3个月时3个治疗组间的差异无统计学意义(P>0.05)。该结果提示,各组治疗方法在改善牙周袋深度方面无明显差异,1个月和3个月时牙周附着丧失的改善也无明显差异。
2.2. 微生物指标测量结果
2.2.1. 细菌DNA的定性验证
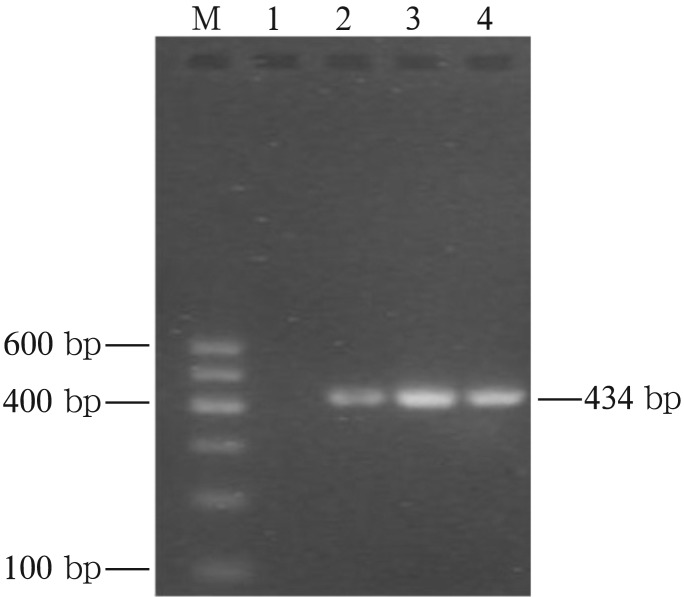
细菌16S rDNA通用引物的PCR扩增产物电泳图见图3,扩增产物大小为434 bp。1泳道是应用无菌双蒸水作为阴性对照组,未见阳性条带。2泳道是应用纯培养的牙龈卟啉单胞菌ATCC33277作为阳性对照组,可见阳性条带。3、4泳道是临床样本经通用引物扩增后,可见434 bp的阳性条带,说明本研究采用的菌斑采集方法和DNA提取方法能有效获得检测样本,扩增反应成功。
图 3. 细菌16S rDNA通用引物的PCR扩增产物电泳图.
Fig 3 PCR amplified product electrophoresis map of bacterial 16S rDNA universal primers
M:DNA Marker;1:阴性对照组;2:阳性对照组;3、4:临床采集样本。
2.2.2. 样本采集位点PPD的分析结果
分组后,选取基线时4组中牙周袋最深的位点作为采集龈下菌斑的试验位点,对4组龈下菌斑样本来源牙周袋的PPD进行分析,C组(5.69±0.75)mm、SRP组(5.69±1.32)mm、SRP+L组(5.62±1.20)mm及L+SRP组(5.92±1.12)mm,4组PPD值组间差异无统计学意义(P>0.05)。
2.2.3. 实时荧光定量PCR结果
目的基因16S rRNA、牙龈卟啉单胞菌、福赛斯坦纳菌、齿垢密螺旋体的实时荧光定量PCR扩增结果显示,PCR产物均达到有效扩增,说明目的基因引物设计合理,结果可靠。本研究共纳入15例患者,每例患者共收集16份龈下菌斑样本,共计240份样本,均为有效样本。每份样本均使用16S rRNA、牙龈卟啉单胞菌、福赛斯坦纳菌、齿垢密螺旋体4种引物进行扩增,产生4组Ct值。通过样本中细菌16S rRNA的拷贝数来标准化转换样本中牙周致病菌基因的拷贝数,即通过ΔCt值进行转换,计算出各样本中牙龈卟啉单胞菌、福赛斯坦纳菌、齿垢密螺旋体在所有菌群总数中所占的百分比[13]–[14],从而反映龈下菌斑组成的变化。
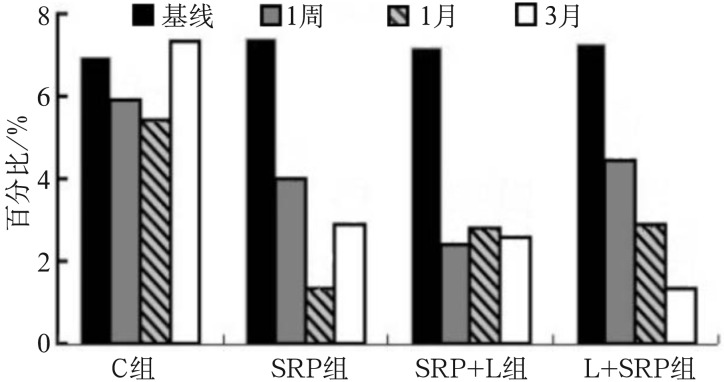
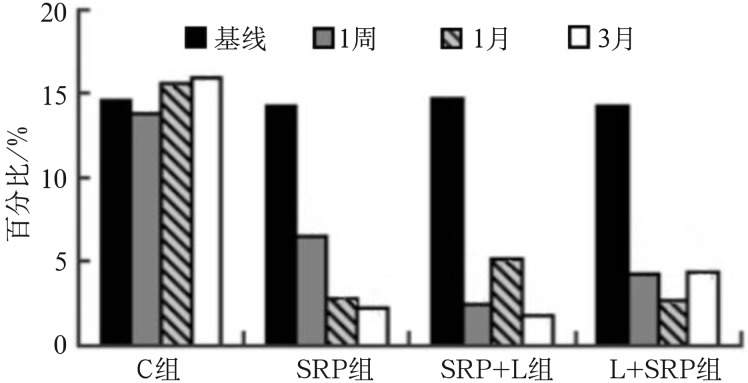
4组在基线、1周、1个月及3个月的龈下菌斑样本中牙龈卟啉单胞菌、福赛斯坦纳菌、齿垢密螺旋体组成百分比的分布情况图4~6。如图4所示,C组牙龈卟啉单胞菌百分比在临床处理后1周和1个月均较基线降低(P<0.05),3个月时与基线的差异无统计学意义(P>0.05),提示相邻区域的牙周治疗可在短期内改善未治疗位点的龈下菌斑中牙龈卟啉单胞菌组成的百分比。组内比较:SRP组、SRP+L组、L+SRP组的牙龈卟啉单胞菌百分比在处理后1周、1个月、3个月较基线均显著降低(P<0.01);组间比较:SRP组、SRP+L组、L+SRP组均较C组下降明显(P<0.01),提示3组的治疗方法均可有效改善龈下菌斑中牙龈卟啉单胞菌的组成。3个治疗组内进行比较(图4):1周时,SRP+L组牙龈卟啉单胞菌百分比的改善较L+SRP组和SRP组更明显(P<0.01);1个月时,SRP组较SRP+L组和L+SRP组下降明显(P<0.01);3个月时,L+SRP组较SRP组和SRP+L组下降明显(P<0.01);该结果提示,3种治疗方法在发挥改善龈下菌斑总牙龈卟啉单胞菌组成百分比的有效作用时间存在差异。
图 4. 各组龈下菌斑在不同观测时间牙龈卟啉单胞菌的百分比.
Fig 4 The percentage of each subgingival plaque in different observation time of Porphyromonas gingivalis
图 6. 各组龈下菌斑在不同观测时间齿垢密螺旋体的百分比.
Fig 6 The percentage of each subgingival plaque in different observation time of Treponema denticola
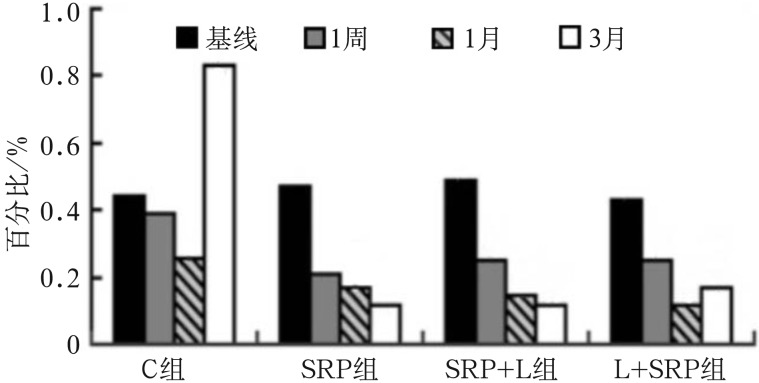
如图5所示,C组的福赛斯坦纳菌百分比在处理后1周与基线相比无明显差异(P>0.05),1个月时较基线明显降低(P<0.05),3个月时反而明显升高(P<0.01),提示相邻牙的牙周治疗可在1个月内改善未治疗位点的龈下菌斑中福赛斯坦纳菌百分比的组成,随着时间增加,未治疗组福赛斯坦纳菌百分比则会明显增加。组内比较:SRP组、SRP+L组、L+SRP组的福赛斯坦纳菌在治疗后1周、1个月、3个月时较基线均明显降低(P<0.05);组间比较:SRP组、SRP+L组、L+SRP组均较C组下降明显(P<0.05),提示3种治疗方法均可有效改善龈下菌斑中福赛斯坦纳菌的组成;3个月时,SRP、SRP+L组的福赛斯坦纳菌百分比较L+SRP组下降更明显(P<0.05),提示SRP组和SRP+L组可以更好地发挥改善龈下菌斑中福赛斯坦纳菌组成的作用。
图 5. 各组龈下菌斑在不同观测时间福赛斯坦纳菌的百分比.
Fig 5 The percentage of each subgingival plaque in different observation time of Tannerella forsythia
如图6所示,组内比较SRP组、SRP+L组、L+SRP组的齿垢密螺旋体百分比在治疗后的1周、1个月、3个月较基线均显著降低(P<0.01),且均较C组下降明显,提示3种治疗方法均可有效改善龈下菌斑中齿垢密螺旋体百分比的组成;组间比较,1周时SRP+L组齿垢密螺旋体百分比较SRP、L+SRP组下降明显(P<0.05),而L+SRP组较SRP组下降明显(P<0.05);1个月时,SRP、L+SRP组较SRP+L组下降明显(P<0.05);3个月时SRP+L、SRP组较L+SRP组下降明显(P<0.05);该结果提示,3种治疗方法在改善龈下菌斑中齿垢密螺旋体百分比组成作用方面存在时间差异。
3. 讨论
目前激光在牙周炎治疗方面的研究结果存在较多争议。本研究采用随机平行对照试验设计,将全口不同象限分为对照、SRP、SRP+L、L+SRP共4个组,探讨激光联合SRP的疗效,以及激光和SRP的治疗顺序对牙周临床指标改善及龈下菌斑红色复合体组成的影响。
PI作为检测指标,受患者本身口腔卫生维护状况的影响较大,虽然可在一定程度上反映牙周治疗效果,但并不存在绝对的相关性[15]。本研究中由于患者本身的口腔维护意识强烈及研究期间不断强调的口腔卫生宣教,减小了对研究效果的影响,从而得出激光联合SRP治疗疗效可能较单纯SRP更有利于维持菌斑控制效果的结果。本试验中,各治疗组的BOP、PPD、CAL值在1周、1个月、3个月时均较基线值减少,且有统计学意义(P<0.05),与C组相比,治疗组在各个时间点PPD、CAL的平均差值、BOP与基线的变化均更为明显,证明SRP和SRP联合Nd: YAG激光治疗对BOP、PPD、CAL的改善均是有效的,这与其他研究[16]结果一致。
本研究结果发现,同一时间点内各治疗组间的PPD和CAL值的比较差异无统计学意义,这与Eltas等[17]的研究结果一致,即组间PPD改变不存在差异性;但与Qadri等[2]的研究结果存在着差异,该研究认为SRP联合Nd: YAG激光对CAL的改善显著优于SRP。Sgolastra等[18]对Nd: YAG激光联合SRP治疗慢性牙周炎的效果进行Meta分析,结果显示,二者联合可以更有效地降低PPD,但对CAL获得的改善不明显。由此可见,Nd: YAG激光辅助SRP治疗对慢性牙周炎患者的临床疗效还有待于进一步验证。
本研究显示,各治疗组在各时间点的牙龈卟啉单胞菌、福赛斯坦纳菌、齿垢密螺旋体百分比与基线相比均显著下降,表明经过3种不同的治疗方法均达到了有效减少龈下菌斑中红色复合体比例的疗效,这与临床指标的改善相匹配,也与以往较多研究[12],[19]的结果一致。但也有研究[20]显示,当牙周炎处于活动期时,尽管进行了牙周治疗,仍可检测到高水平的龈下致病微生物。本研究中,治疗组的牙龈卟啉单胞菌和福赛斯坦纳菌百分比的下降存在组间差异,且在不同的时间点差异不同。Lopes等[12]对临床处理后12 d的龈下菌斑进行检测,发现SRP+L组牙龈卟啉单胞菌的检出率较SRP组低。Tomasi等[19]对临床处理后2 d的龈下菌斑进行检测,SRP+L组牙龈卟啉单胞菌的检出率较SRP组低,但处理后1个月时两组检出率无显著差异。本研究中,治疗组龈下红色复合体的组成变化趋势无明显规律,造成这种差异的原因可能与临床样本量较小有关,这提示还需加大样本量进行微生物学变化分析。
在临床治疗过程中,本研究共有2次激光光纤折断的情况,且均在L+SRP组,这提示一定要严格掌握激光的使用方法。在使用激光治疗时,需先用激光将牙周袋“袖口”部位打开,避免阻力过大导致的光纤折断。另外,这也提示临床治疗时,大块龈下牙石未清除的状态下先使用激光操作具有一定的风险性,这是值得探讨的问题。
综上所述:单纯SRP及激光联合SRP均可以达到有效治疗慢性牙周炎的效果,但Nd: YAG激光联合SRP治疗不一定较单纯SRP对慢性牙周炎的疗效更明显,且Nd: YAG激光和SRP治疗先后对临床治疗效果影响不大。激光辅助SRP治疗可对龈下菌斑的组成产生一定影响,Nd: YAG激光联合SRP治疗可以作为一种辅助手段改善龈下菌斑中致病微生物的组成,当然该结论仍需要采用大样本和更长观测周期的临床研究来验证。
Funding Statement
[基金项目] 国家卫生和计划生育委员会牙周病科国家临床重点专科建设项目(2010);教育部留学回国人员科研启动项目(2013-693-11-11)
Supported by: The National Key Clinical Practice Foundation of the Department of Periodontal Diseases of the Health Commission of China (2010); The Project for Launching Scientific Research for Returned Students from Ministry of Education (2013-693-11-11).
References
- 1.Qadri T, Miranda L, Tunér J, et al. The short-term effects of low-level lasers as adjunct therapy in the treatment of periodontal inflammation[J] J Clin Periodontol. 2005;32(7):714–719. doi: 10.1111/j.1600-051X.2005.00749.x. [DOI] [PubMed] [Google Scholar]
- 2.Qadri T, Poddani P, Javed F, et al. A short-term evaluation of Nd:YAG laser as an adjunct to scaling and root planing in the treatment of periodontal inflammation[J] J Periodontol. 2010;81(8):1161–1166. doi: 10.1902/jop.2010.090700. [DOI] [PubMed] [Google Scholar]
- 3.Qadri T, Javed F, Poddani P, et al. Long-term effects of a single application of a water-cooled pulsed Nd:YAG laser in supplement to scaling and root planing in patients with periodontal inflammation[J] Lasers Med Sci. 2011;26(6):763–766. doi: 10.1007/s10103-010-0807-8. [DOI] [PubMed] [Google Scholar]
- 4.Slot DE, Kranendonk AA, Van der Reijden WA, et al. Adjunctive effect of a water-cooled Nd:YAG laser in the treatment of chronic periodontitis[J] J Clin Periodontol. 2011;38(5):470–478. doi: 10.1111/j.1600-051X.2010.01695.x. [DOI] [PubMed] [Google Scholar]
- 5.Slot DE, Timmerman MF, Versteeg PA, et al. Adjunctive clinical effect of a water-cooled Nd:YAG laser in a periodontal maintenance care programme: a randomized controlled trial[J] J Clin Periodontol. 2012;39(12):1159–1165. doi: 10.1111/jcpe.12007. [DOI] [PubMed] [Google Scholar]
- 6.曾 雄群, 李 梅, 谭 澍良, et al. Nd: YAG激光照射对牙周病患牙根面的影响[J] 口腔医学纵横. 2001;17(2):132–134. [Google Scholar]; Zeng XQ, Li M, Tan SL, et al. Effect of Nd: YAG laser on periodontally involved root surfaces in vivo[J] J Comprehens Stomatol. 2001;17(2):132–134. [Google Scholar]
- 7.Gaspirc B, Skaleric U. Morphology, chemical structure and diffusion processes of root surface after Er:YAG and Nd:YAG laser irradiation[J] J Clin Periodontol. 2001;28(6):508–516. doi: 10.1034/j.1600-051x.2001.028006508.x. [DOI] [PubMed] [Google Scholar]
- 8.Armitage GC. Development of a classification system for periodontal diseases and conditions[J] Ann Periodontol. 1999;4(1):1–6. doi: 10.1902/annals.1999.4.1.1. [DOI] [PubMed] [Google Scholar]
- 9.Silness J, Loe H. Periodontal disease in pregnancy. Ⅱ. Correlation between oral hygiene and periodontal condtion[J] Acta Odontol Scand. 1964;22:121–135. doi: 10.3109/00016356408993968. [DOI] [PubMed] [Google Scholar]
- 10.O'Leary TJ, Drake RB, Naylor JE. The plaque control record[J] J Periodontol. 1972;43(1):38. doi: 10.1902/jop.1972.43.1.38. [DOI] [PubMed] [Google Scholar]
- 11.Siqueira JF, Jr, Rôças IN. Simultaneous detection of Dialister pneumosintes and Filifactor alocis in endodontic infections by 16S rDNA-directed multiplex PCR[J] J Endod. 2004;30(12):851–854. doi: 10.1097/01.don.0000132300.13023.5d. [DOI] [PubMed] [Google Scholar]
- 12.Lopes BM, Theodoro LH, Melo RF, et al. Clinical and microbiologic follow-up evaluations after non-surgical periodontal treatment with erbium:YAG laser and scaling and root planing[J] J Periodontol. 2010;81(5):682–691. doi: 10.1902/jop.2010.090300. [DOI] [PubMed] [Google Scholar]
- 13.Yoshida A, Suzuki N, Nakano Y, et al. Development of a 5' fluorogenic nuclease-based real-time PCR assay for quantitative detection of Actinobacillus actinomycetemcomitans and Porphyromonas gingivalis[J] J Clin Microbiol. 2003;41(2):863–866. doi: 10.1128/JCM.41.2.863-866.2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Kato H, Yoshida A, Awano S, et al. Quantitative detection of volatile sulfur compound- producing microorganisms in oral specimens using real-time PCR[J] Oral Dis. 2005;11(Suppl 1):67–71. doi: 10.1111/j.1601-0825.2005.01096.x. [DOI] [PubMed] [Google Scholar]
- 15.Kelbauskiene S, Baseviciene N, Goharkhay K, et al. One-year clinical results of Er,Cr:YSGG laser application in addition to scaling and root planing in patients with early to moderate periodontitis[J] Lasers Med Sci. 2011;26(4):445–452. doi: 10.1007/s10103-010-0799-4. [DOI] [PubMed] [Google Scholar]
- 16.Schwarz F, Sculean A, Berakdar M, et al. Periodontal treatment with an Er:YAG laser or scaling and root planing. A 2-year follow-up split-mouth study[J] J Periodontol. 2003;74(5):590–596. doi: 10.1902/jop.2003.74.5.590. [DOI] [PubMed] [Google Scholar]
- 17.Eltas A, Orbak R. Clinical effects of Nd:YAG laser applications during non-surgical periodontal treatment in smoking and nonsmoking patients with chronic periodontitis[J] Photomed Laser Surg. 2012;30:360–366. doi: 10.1089/pho.2011.3184. [DOI] [PubMed] [Google Scholar]
- 18.Sgolastra F, Severino M, Petrucci A, et al. Nd:YAG laser as an adjunctive treatment to nonsurgical periodontal therapy: a meta-analysis[J] Lasers Med Sci. 2014;29(3):887–895. doi: 10.1007/s10103-013-1293-6. [DOI] [PubMed] [Google Scholar]
- 19.Tomasi C, Schander K, Dahlén G, et al. Short-term clinical and microbiologic effects of pocket debridement with an Er:YAG laser during periodontal maintenance[J] J Periodontol. 2006;77(1):111–118. doi: 10.1902/jop.2006.77.1.111. [DOI] [PubMed] [Google Scholar]
- 20.Haffajee AD, Cugini MA, Dibart S, et al. The effect of SRP on the clinical and microbiological parameters of periodontal diseases[J] J Clin Periodontol. 1997;24(5):324–334. doi: 10.1111/j.1600-051x.1997.tb00765.x. [DOI] [PubMed] [Google Scholar]