Abstract
目的
从基因和蛋白水平研究增殖细胞核抗原(PCNA)和P53在萎缩性腮腺再生过程中的表达及意义。
方法
将102只Wistar大鼠分为实验组和对照组,结扎实验组大鼠腮腺主导管,分别于结扎7 d(A组)、14 d(B组)后实现腮腺导管再通,并于再通后第0、3、5、7、10、14、21、28天处死大鼠获取新鲜腮腺组织标本。采用苏木精-伊红(HE)染色法观察腮腺组织形态学变化,实时荧光定量聚合酶链式反应和Western blot法检测两组腮腺组织中PCNA和P53的表达。
结果
两实验组在腮腺导管结扎第7、14天,腺泡凋亡,导管细胞增殖,同组P53相对表达量高于PCNA;随着再通时间延长,腺泡细胞逐渐增多,A组在导管再通后第3天、B组在导管再通后第5天,PCNA和P53相对表达量达到峰值,与对照组比较,差异有统计学意义(P<0.01);其后PCNA和P53相对表达量逐渐减少,A组于再通后第21天、B组于再通后第28天接近对照组。
结论
腮腺导管结扎后,P53相对表达量增多,诱导腮腺腺泡凋亡;导管再通后,PCNA相对表达量逐渐增多,达峰值后减少,可促进腺泡增殖。
Keywords: 腮腺, 萎缩, 再生, 增殖细胞核抗原, P53
Abstract
Objective
This research aims to further explore the expression and significance of proliferating cell nuclear antigen (PCNA) and P53 in regenerating rat atrophy parotid gland from the gene and protein levels.
Methods
One hundred and two Wistar rats were randomly divided into experimental and control groups; the former group's duct was ligated and then released respectively in 7 (Group A) and 14 days (Group B). Fresh parotid specimens were obtained at 0, 3, 5, 7, 10, 14, 21, and 28 days after being released. Hematoxylin-eosin staining method was used to observe the morphological changes of the parotid gland. The significance of P53 and PCNA in two groups was resolved by real-time fluorescence quantitative polymerase china reaction and Western blot.
Results
Acinar cells aoptosis and duct cells proliferation occurred when the occlusion of the parotid duct was reversed on days 7 and 14. The expression of P53 was higher than that of PCNA, and they reached the peak at the third and fifth days after groups A and B regenerated, respectively. This finding was significantly different compared with the control (P<0.01). P53 and PCNA contents decreased gradually; acinar and duct gradually returned to normal morphology; PCNA and P53 contents gradually close to the normal control group.
Conclusion
After ligating the parotid duct, P53 was highly expressed, and induced parotid gland atrophy. Meanwhile, PCNA was highly expressed, which then decreased inducing gland recovery.
Keywords: parotid gland, atrophy, regeneration, proliferating cell nuclear antigen, P53
唾液腺导管结石是口腔颌面外科的常见病和多发病,如果治疗不及时,会导致患者唾液腺分泌功能受累。唾液腺功能障碍大多是实质细胞凋亡损失以及不同程度的炎症及纤维化造成的。虽然多数导管上皮细胞保持原形态,但是迟发性反应会进一步损害周围环境。由于唾液对消化、免疫、微环境具有调控等特殊功能,唾液缺乏可能会导致猛性龋、黏膜炎、口腔真菌感染、吞咽困难等,严重影响患者的口腔和全身健康[1]。如何诱导萎缩的腺体再生是治疗阻塞性唾液腺疾病的研究热点之一。本实验采用结扎大鼠腮腺主导管后实现再通以诱导萎缩的腮腺组织再生,并从分子机制出发,探索增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)和P53在萎缩性腮腺组织再生过程中的意义,为临床治疗腮腺萎缩提供基础。
1. 材料和方法
1.1. 主要试剂和仪器
聚合酶链式反应(polymerase chain reaction,PCR)扩增仪(Eppendorf公司,德国);实时荧光定量PCR仪(CFX96型,Bio-Rad公司,美国);逆转录试剂盒(RR047A)和SYBR Premix Ex Taq(RR420A)购自宝生物工程(大连)有限公司;兔抗鼠PCNA多克隆抗体(Catalog No:10205-2-AP)购于美国ProteinTech公司;兔抗鼠P53多克隆抗体(ab131442)购于美国Abcam公司;苏木精-伊红(hematoxylineosin,HE)染色试剂盒购于上海诺伦生物医药技术有限公司。实验用引物由生工生物工程(上海)股份有限公司合成。
1.2. 建立动物模型
清洁级Wistar大鼠102只,4周龄,体重(180±20) g,购于济南朋悦实验动物繁育有限公司。102只大鼠分为实验组(96只)和对照组(N组,6只)。结扎实验组大鼠腮腺导管,于结扎第7天(A组)、第14天(B组)实现腮腺导管再通,并分别于再通后第0、3、5、7、10、14、21、28天处死大鼠(根据处死时间,分别设为A0、A3、A5、A7、A10、A14、A21、A28及B0、B3、B5、B7、B10、B14、B21、B28组),每组6只,获取新鲜腮腺组织标本。一部分标本立即投入液氮中,10 s后保存于-80 °C冰箱,以行实时荧光定量PCR和Western blot检测;另一部分标本采用4%多聚甲醛溶液固定,以备行病理切片观察。N组只解剖分离出腮腺主导管,然后关闭创口。
1.3. HE染色
4%多聚甲醛溶液固定标本后,经冲洗、梯度乙醇脱水、二甲苯透明、浸蜡后包埋,制成4 µm厚石蜡切片,按照HE染色说明书步骤进行HE染色,最后置于显微镜下观察、拍照。
1.4. 总RNA提取和cDNA合成
称取适量组织,按照RNAiso Plus说明书要求提取腮腺组织总RNA,将提取的RNA沉淀溶解于适量DEPC处理水,按照逆转录试剂盒的要求,先去除基因组DNA,反应体系如下:DNA Eraser Buffer 2 µL,gDNA Eraser 1 µL,总RNA 1 µg,不含RNA酶dH2O补足至10 µL,42 °C 2 min;然后进行逆转录反应(20 µL体系):继续加入PrimeScript RT Enzyme Mix I 1 µL,RT Primer Mix 1 µL,5×PrimeScript Buf-fer 2液4 µL,不含RNA酶dH2O 4 µL,扩增条件:37 °C 15 min,85 °C 5 s。
1.5. 实时荧光定量PCR
在避光条件下配制25 µL反应体系:SYBR Premix Ex Taq(Tli RNaseH Plus)(2×)12.5 µL,PCR正向引物(10 µmol·L−1)0.5 µL,PCR反向引物(10 µmol·L−1)0.5 µL,DNA 模板(<100 ng)2 µL,灭菌蒸馏水dH2O 9.5 µL;反应条件:预变性 95 °C 30 s,PCR反应95 °C 5 s,60 °C 30 s,重复39个循环,每个样本均做3个复孔,以磷酸甘油醛脱氢酶(glyceraldehyde-phosphate dehydrogenase,GAPDH)为内参照,PCNA、P53以及GAPDH的引物序列见表1。
表 1. 实时荧光定量PCR的引物序列.
Tab 1 Primer sequence for real-time fluorescence quantitative PCR
| 基因名称 | 引物序列 |
| PCNA | 正向:5′-AGGACGGGGTGAAGTTTTCT-3′ |
| 反向:5′-CAGTGGAGTGGCTTTTGTGA-3′ | |
| P53 | 正向:5′-GGACGACAGGCAGACTTTTC-3′ |
| 反向:5′-CAGCGTGATGATGGTAAGGA-3′ | |
| GAPDH | 正向:5′-GACATGCCGCCTGGAGAAAG-3′ |
| 反向:5′-AGCCCAGGATGCCCTTTAGT-3′ |
1.6. 蛋白提取及Western blot
称取适量组织,加入含有苯甲基磺酰氟化物(phenylmethyl sulfonylfluoride,PMSF)的RIPA裂解液充分裂解,提取的蛋白质采用BCA蛋白浓度测定试剂盒(增强型)测定各组质量浓度后,按照每5 µL蛋白样品加入1 µL蛋白上样缓冲液(6×)的比例混合蛋白样品和蛋白上样缓冲液。配制10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分离胶和5%浓缩胶,每孔上样总蛋白30 µg。电泳条件:恒压80 V 50 min,跑出浓缩胶后恒压100 V 55 min,电泳完成后4 °C恒流250 mA 90 min,将蛋白转移至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜,洗膜后5%脱脂牛奶在室温下摇床孵育1.5 h,PCNA、P53抗体稀释到适量比例与蛋白样品在4 °C过夜反应,洗膜,室温下结合二抗1 h,洗膜,避光条件下与超敏ECL化学发光夜反应,压片、曝光、拍照。以GAPDH为内参照。
1.7. 统计学处理
所有数据采用均数±标准差表示,数据应用统计软件SPSS 13.0进行处理,两组之间差异的比较采用两独立样本t检验,组内比较采用单因素方差分析,检验水准为双侧α=0.05。
2. 结果
2.1. 组织学观察结果
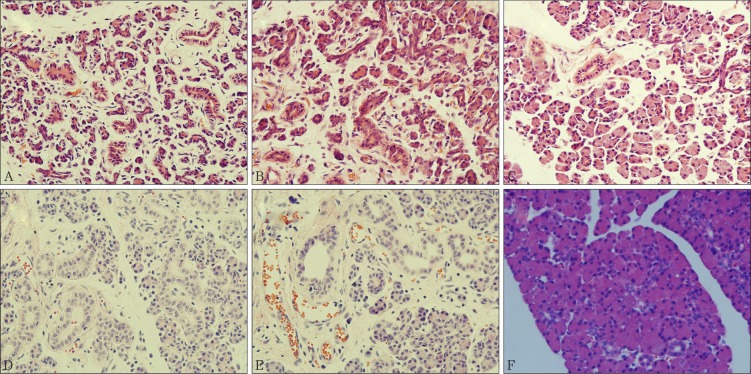
各组的组织学观察结果见图1。大鼠腮腺导管结扎第7天,腺体体积较N组减少,颜色较深,腺体之间连接较疏松,腺泡细胞减少,导管扩张,再通后,腺体体积逐渐增大,颜色变浅,腺泡细胞逐渐增多,扩张导管减少,A10、A14组腺体体积基本恢复,颜色转为淡红色,腺泡与导管细胞比例与N组无明显差异;导管结扎第14天,腺体体积较N组和A0组明显减小,腺体较疏松,连接不紧密,质地较韧,与周围组织分界逐渐模糊,腺泡细胞明显减少,大量扩张的导管占据大部分视野,随着再通时间延长,腺体逐渐红润、充盈,光泽亮丽,腺泡细胞大量增殖,至B21组腺体体积、颜色、质地与N组无明显差异,腺小叶结构完整,比例协调。
图 1. 组织学观察 HE × 400.
Fig 1 Histological results HE ×400
A:A0组,导管扩张增殖,腺泡细胞减少,腺体之间连接疏松;B:A3组,腺泡细胞逐渐增多,未成熟腺泡细胞逐渐成熟;C:A14组腺泡与导管比例接近N组;D:B0组,导管扩张较A0组严重,且腺泡细胞明显减少,腺小叶间由大量间质连接;E:B5组未成熟腺泡及成熟腺泡细胞逐渐增多,扩张导管减少;F:B21组腺体组织结构接近N组。
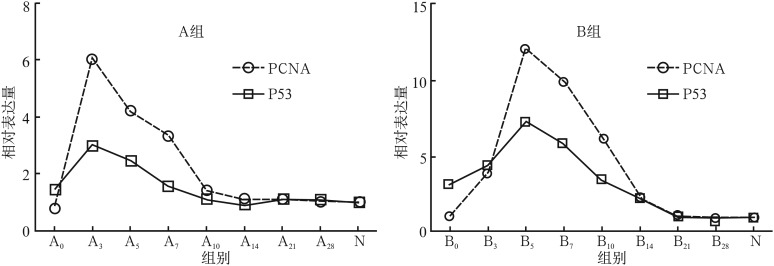
2.2. 实时荧光定量PCR结果
各组实时荧光定量PCR测定结果见图2。PCNA和P53 mRNA在N组大鼠腮腺中相对表达量较少(P<0.01)。导管结扎第7、14天,同组P53 mRNA相对表达量高于PCNA mRNA,两组P53 mRNA相比,B0>A0。随着再通时间延长,A、B组相对表达量逐渐增多,PCNA mRNA增多速率较P53 mRNA更快。两者相对表达量分别于A3和B5组达到峰值(A3组:PCNA为6.02±0.82,P53为2.98±0.07;B5组:PCNA为11.97±0.29,P53为7.36±0.07;N组:PCNA和P53均为1);此后随着时间延长,PCNA mRNA、P53 mRNA在两实验组相对表达量逐渐降低,分别于A14、B21组恢复正常水平,与N组相比无明显差异(P>0.05)。
图 2. 实时荧光定量PCR测定结果.
Fig 2 Results of real-time fluorescence quantitative PCR
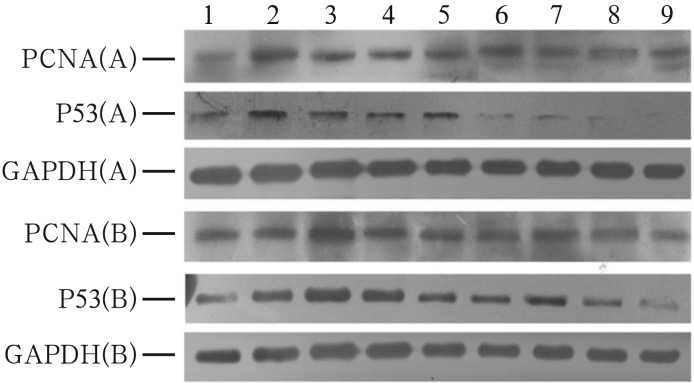
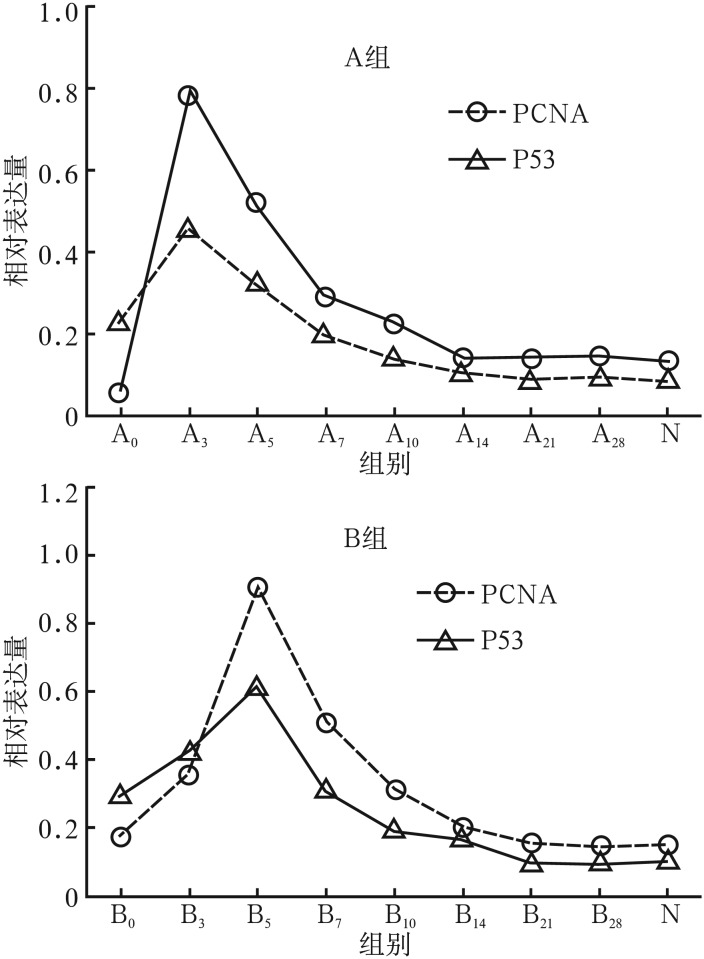
2.3. Western blot结果
Western blot结果见图3、4。PCNA和P53蛋白在N组相对表达量较少(PCNA为0.15±0.02,P53为0.10±0.02);导管结扎后第7、14天,同组PCNA蛋白相对表达量低于P53蛋白,A0组与B0组相比,B0组P53蛋白相对表达量明显高于A0组。导管再通后,PCNA蛋白和P53蛋白相对表达量逐渐增多,两组分别于A3组、B5组达到峰值,与N组的差异有统计学意义(P<0.01),其后两蛋白相对表达量逐渐减少至接近N组水平(P>0.05)。导管再通过程中,P53蛋白的相对表达量整体低于PCNA蛋白,差异有统计学意义(P<0.01)。
图 3. PCNA和P53蛋白测定的Western blot电泳图.
Fig 3 Electrophoretograms of PCNA and P53 with Western blot
1~8分别代表导管再通后0、3、5、7、10、14、21、28 d,9表示N组。
图 4. PCNA和P53蛋白相对表达量.
Fig 4 Relative expression of PCNA and P53
3. 讨论
PCNA是一种位于细胞核中可调控细胞增殖的基因,在多种唾液腺肿瘤中高表达。P53[2]参与细胞周期调控和细胞凋亡,主要位于细胞质中,是一种常见的抑癌基因,可以消除机体受损的细胞,若受损机体细胞中无P53基因表达,则DNA损伤被复制,从而导致恶性肿瘤出现,另外,与Bcl-2蛋白上调有关的P53功能丧失会给细胞带来增殖并影响肿瘤行为的不利因素。有研究[3]指出,唾液腺导管细胞P53和P21蛋白共定位可以提供预留DNA修复时间,防止细胞凋亡。
本实验通过结扎腮腺导管后再通来建立腮腺萎缩后再生的模型,结果发现,结扎导管7、14 d后,腺泡凋亡,腺体萎缩,导管扩张增殖,此点与刘多文等[4]研究结果相似,证明实验模型建造成功。导管再通后,萎缩的腮腺组织可恢复正常,PCNA、P53表达量增多和减少与腮腺的萎缩和再生的表现基本一致。在A3至A14、B5至B21阶段,同组同时期PCNA相对表达量基本多于P53相对表达量,说明腺体组织基本处于增殖修复过程中。再通第0天,B组P53相对表达量多于A组,说明结扎导管时间越长,对腮腺组织造成的损伤越大,腮腺萎缩越严重,因此,临床上腮腺全叶切除术后通常加压包扎两周。两实验组PCNA达到峰值的时间不同,B组比A组时间延后,且B组PCNA峰值高于A组,表明腮腺组织受到不同程度的损伤后,损伤严重者诱导腮腺再生需要的PCNA含量相对越多,且恢复需要的时间也相应延长。导管结扎7、14 d后,两组腮腺分别于再通后第14、21天恢复正常,随着导管损伤时间的延长,腮腺腺泡恢复到正常状态所需的时间也越长。通过PCR与Western blot检测结果发现,在基因和蛋白水平上,PCNA和P53相对表达量的变化大体一致,但是在腮腺组织恢复正常后,PCNA仍然高于P53,腺体却没有增殖的表现,是因为腮腺的萎缩及再生过程并不是单一因素调控,还有许多其他因子和途径,比如上皮调节蛋白[5],FAS/FASL途径[6]等,另外基因转录及翻译过程也受多种机制共同调节。
Yi等[7]从唾液腺分泌单位提取到干细胞,并将其植入经放射线损伤的萎缩唾液腺小鼠模型,结果发现可促进腺体分泌功能恢复。在颌下腺组织萎缩过程中,Nagai等[5]发现,导管上皮细胞增殖形成导管状结构,这些增生的细胞具有分化形成腺泡细胞的潜力。这些研究说明导管上皮细胞增殖在颌下腺再生启动中占重要因素。本研究发现,导管再通早期,导管管腔扩张,数量较多,腺泡细胞减少,随着再通时间延长,导管管腔逐渐缩小,数量减少,腺泡数量增多,可能是由于导管阻力解除,大量具有分化潜力的、增殖的导管细胞分化形成腺泡细胞导致。由此看来,导管再通后早期阶段对腺泡细胞再生至关重要。虽然造成唾液腺萎缩的因素不同,但是研究结果揭示萎缩的腺体有转归的可能,具体机制有待探讨。临床治疗中,有时需要做腺体部分切除术,术后患者没有观察到腺体明显再生,有可能是由于受损的腺体未经过萎缩过程[8]。
综上所述,腮腺导管结扎可诱导腺体组织萎缩,导管再通后,具有分化潜力的导管细胞可分化形成新的腺泡,促进腺体再生。这为治疗腮腺萎缩性疾病提供了研究基础,有可能成为再生组织工程的研究热点。
Funding Statement
[基金项目] 山东省医药卫生科技发展计划(2011HW004,2015WS0487)
Supported by: Shandong Medicine and Health Science and Technology Development Plan (2011HW004, 2015WS0487).
References
- 1.Lombaert I, Movahednia MM, Adine C, et al. Concise review: salivary gland regeneration: therapeutic approaches from stem cells to tissue organoids[J] Stem Cells. 2017;35(1):97–105. doi: 10.1002/stem.2455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.Ferreira JC, Morais MO, Elias MR, et al. Pleomorphic adenoma of oral minor salivary glands: an investigation of its neoplastic potential based on apoptosis, mucosecretory activity and cellular proliferation[J] Arch Oral Biol. 2014;59(6):578–585. doi: 10.1016/j.archoralbio.2014.03.002. [DOI] [PubMed] [Google Scholar]
- 3.Dickinson D, Yu H, Ohno S, et al. Epigallocatechin-3-gallate prevents autoimmune-associated down-regulation of p21 in salivary gland cells through a p53-independent pathway[J] Inflamm Allergy Drug Targets. 2014;13(1):15–24. doi: 10.2174/1871528112666131211102500. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.刘 多文, 左 金华, 毛 玉龙, et al. 免疫组化双染技术观察大鼠萎缩腮腺中肌上皮细胞的增殖变化[J] 实用口腔医学杂志. 2014;30(3):331–335. [Google Scholar]; Liu DW, Zuo JH, Mao YL, et al. Proliferation of myoepithelial cells in rat atrophic parotid gland observed by double sequential immunohistochemical staining[J] J Pract Stomatol. 2014;30(3):331–335. [Google Scholar]
- 5.Nagai K, Arai H, Okudera M, et al. Epiregulin is critical for the acinar cell regeneration of the submandibular gland in a mouse duct ligation model[J] J Oral Pathol Med. 2014;43(5):378–387. doi: 10.1111/jop.12145. [DOI] [PubMed] [Google Scholar]
- 6.Nakamura H, Kawakami A, Izumi M, et al. Detection of the soluble form of Fas ligand (sFasL) and sFas in the saliva from patients with Sjögren's syndrome[J] Clin Exp Rheumatol. 2005;23(6):915. [PubMed] [Google Scholar]
- 7.Yi T, Lee S, Choi N, et al. Single cell clones purified from human parotid glands display features of multipotent epitheliomesenchymal stem cells[J] Sci Rep. 2016;6:36303. doi: 10.1038/srep36303. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Proctor GB, Carpenter GH. Salivary secretion: mechanism and neural regulation[J] Monogr Oral Sci. 2014;24:14–29. doi: 10.1159/000358781. [DOI] [PubMed] [Google Scholar]