Abstract
Introduction The clinical presentation of endometriosis is extremely varied. Because endometriosis symptoms may overlap with symptoms caused by gastroenterological disorders, this can lead to misdiagnosis and a considerable delay in arriving at the correct diagnosis. The aim was to evaluate the type and duration of endometriosis-related symptoms and to identify predictors for patterns of involvement depending on symptoms.
Material and Method The data of 266 consecutive patients who were operated on in the Endometriosis Center between 1/2016 and 12/2017 after receiving a histologically verified diagnosis of endometriosis were recorded. In addition to recording the clinical parameters, a questionnaire was distributed to the patients, who were asked about their medical history. Infertile patients were grouped together as Group 1 and compared to non-infertile patients (Group 2).
Results The response rate for returned questionnaires was 79.47% (182/229). 41.8% of patients reported that they were infertile and 91.8% reported pelvic pain. In more than ⅓ of cases in both groups, more than 10 years passed between the initial symptoms and the final diagnosis (39.4 vs. 37.5%). On average, patients consulted 2.72 (± 1.58) resp. 3.08 (± 1.72) doctors before they presented to a hospital or were referred for laparoscopic diagnostic workup (p = 0.162). Cycle-related diarrhea (odds ratio 2.707; 95% CI: 1.063 – 6.895, p = 0.037) and dysmenorrhea (odds ratio 2.278; 95% CI: 1.193 – 4.348, p = 0.013) were associated with involvement of the pelvic peritoneum, cycle-related dyschezia was associated with rectal involvement by a factor of 4.6 in binary regression analysis (odds ratio 4.659; 95% CI: 1.132 – 19.186; p = 0.033).
Conclusion Cycle-related diarrhea and dysmenorrhea increase the risk probability of peritoneal endometriosis. Dyschezia increases the risk probability of rectal endometriosis.
Key words: endometriosis, dysmenorrhea, dyschezia
Introduction
Endometriosis is one of the most common, benign, gynecological disorders, affecting around 15% of all women of reproductive age, 60% of all women with chronic pelvic pain and 50% of all infertile women 1 , 2 , 3 . The incidence in Germany is 40 000 new cases per year; around 80 million women are affected worldwide 4 , 5 , 6 . The exact prevalence in the female population in the reproductive years is unknown as final confirmation is only possible with diagnostic laparoscopy. The most common sites of endometriosis include the pelvic peritoneum, the ovaries and the rectovaginal septum 7 .
Endometriosis is a chronic disease which is associated with regular symptoms, repeated surgical interventions and lifelong hormone treatment. Long-term effects include chronic pain and infertility 7 . The clinical presentation of the disease is quite varied. Endometriosis may be asymptomatic and may only be detected as an incidental finding during abdominal surgery. As the symptoms are unspecific and they often overlap with the symptoms of other gynecological and gastroenterological disorders, misdiagnoses are common and can include irritable bowel syndrome or pelvic infection 8 . Symptoms typical for endometriosis include dysmenorrhea, pelvic pain, dyspareunia, dysuria and dyschezia as well as infertility 1 , 9 . The heterogeneity of these symptoms makes it difficult to arrive at the correct diagnosis, which is often delayed. Despite the high incidence of endometriosis, on average 10.4 years elapsed between the initial symptoms and the final diagnosis. During this period, patients were given at least one incorrect diagnosis 10 . An international comparison showed similar figures for the interval between initial symptoms and correct diagnosis; in the USA, an average of 11.7 years elapsed and in Great Britain, the average was 8.0 years until the correct diagnosis was obtained 6 , 9 , 11 , 12 .
How much the patient is aware of the disease depends on the symptoms, when the correct diagnosis was made, and the patientʼs individual situation 13 . Receiving a diagnosis of endometriosis significantly affects the patientʼs health-related quality of life. The resilience of patients with endometriosis is reduced; on average, patients are off work 7.41 hours per week 14 . In the USA. the cost associated with treating endometriosis including the loss of working hours amounted to 69 billion dollars in 2009 15 , 16 .
National and international consensus statements have been developed for the diagnosis and treatment of endometriosis. Non-invasive methods for a diagnostic workup include imaging procedures, the determination of serum biomarkers, and systematic questioning of patients about their symptoms 17 , 18 . Out of a cohort of 1200 women who underwent laparoscopy for sterilization, infertility, pelvic pain or hysterectomy, patients in whom endometriosis was confirmed intraoperatively were significantly more often likely to have reported dysmenorrhea preoperatively 19 . Symptoms such as dyschezia and dyspareunia can be predictors for deep-infiltrating endometriosis 20 . An insufficient correlation between the extent of symptoms and the extensively used revised American Society of Reproductive Medicine (rASRM) classification of 1996 is being discussed internationally 21 .
In this study, the aim was to evaluate the type and duration of endometriosis symptoms, the process of obtaining a diagnosis, and the relationship between the pattern of involvement and the symptoms based on a patient cohort from a well-established certified endometriosis center in Germany. The investigation looked at the clues provided by symptoms with the aim of improving sensitivity in future when taking patientsʼ medical history and actively asking patients about their symptoms. When the individual areas were looked at, the subgroup of infertile patients were examined separately to determine possible differences in obtaining a diagnosis and the impact on the stage and subsequent course of disease.
Material and Methods
Study design and patient recruitment
The data of all patients who presented to the Clinic and Polyclinic for Gynecology and Reproductive Medicine at Jena University Hospital 1/2016 to 12/2017 to undergo surgery for endometriosis and its symptoms were retrospectively collected (n = 266). Patients were contacted by telephone and asked to complete and return a questionnaire. Patients with no histological confirmation of endometriosis were excluded from the study (n = 5).
Parameters such as age, prior pregnancies and attempts to have children, endometriosis stage using the rASRM and the ENZIAN classifications and the location of the endometriosis lesions were obtained from the electronic patient files. Preoperatively, patients underwent a gynecological examination with transvaginal ultrasound; if there was a suspicion of deep-infiltrating endometriosis, patients had additional examinations such as pelvic MRI, rectal endosonography and rectoscopy, cystoscopy, etc. Following surgery, endometriosis findings were staged ex post using the rASRM and the ENZIAN classification systems and the patterns of involvement detected intraoperatively. Surgical care included surgical steps such as cyst extirpation, excision and coagulation of endometriosis, adhesiolysis, ureterolysis with partial peritonectomy as well as bladder and bowel procedures, with the goal of completely removing all endometriosis lesions.
Research ethics approval and patient information and consent
Before starting the study, an application was sent to the ethics committee of Friedrich Schiller University Jena which approved the study (no. 5237-08/17). All patients gave their consent to the use of their clinical, anonymized data.
Questionnaire
To collect the data, a questionnaire was developed together with the Institute for Medical Statistics, Information Technology and Data Science. The questionnaire was designed to specifically obtain the following parameters: type and duration of symptoms before surgery, number of doctors consulted until the diagnosis was made, use of painkillers, how often patients were unable to work because of symptoms. The questionnaire was developed as part of a doctoral dissertation and was completed by the patients; their responses recorded in a database.
Statistical analysis
Statistical analysis was carried out using SPSS Version 25 (SPSS Inc., Chicago, IL, USA). Mean values and standard deviations or frequencies were calculated for continuous and categorical variables. Differences between mean values of metric variables were determined using Studentʼs t-test and for categorical variables using Mann-Whitney U-test or Fisherʼs exact test. The patient population was divided into a group of patients with infertility (hereinafter referred to as Group 1; n = 76, 41.8%) and a group of patients without infertility (Group 2; n = 106, 58.2%). Multivariate, linear and binary regression analysis was used to investigate possible risk factors for the endometriosis stage or involvement based on preoperative symptoms.
A p-value of ≤ 0.05 was defined as statistically significant.
Results
Descriptive characteristics of the study population
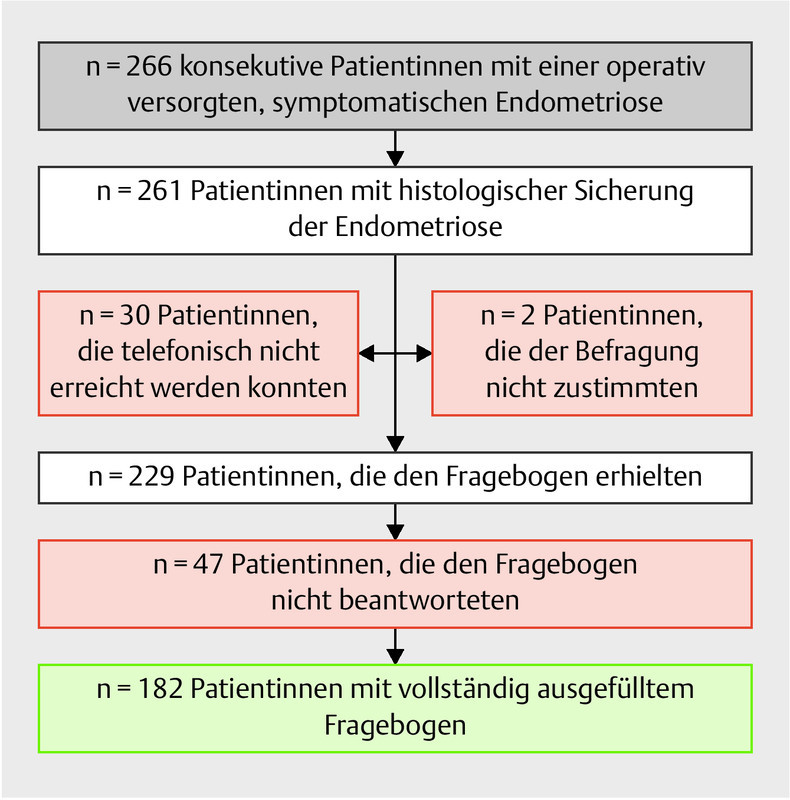
The response rate for entirely completed questionnaires was 79.5% (182/229) ( Fig. 1 ). A total of 182 patients were treated for histologically confirmed endometriosis at the Clinic and Polyclinic for Gynecological and Reproductive Medicine of Jena University Hospital during the observation period and were available for questionnaire-based evaluation.
Fig. 1.

Recruitment of the study population (recruited and contacted patients, n = 266) as a function of histological confirmation, return of the completed questionnaire (n = 229), and completeness of study data (n = 182).
41.8% (n = 76) of these patients reported a medical history of infertility. The percentage of primary diagnoses (71.1 vs. 69.8%, p = 0.871) und diagnoses of recurrence (28.9 vs. 29.2%, p = 1.0) was similarly distributed for both groups. Both patients with infertility and patients without infertility were diagnosed with endometriosis incidentally during other abdominal surgical procedures (5.3 vs. 5.7%; p = 1.0). On average, patients with infertility were significantly younger (32.84 ± 6.18 years) compared to patients without infertility (35.28 ± 9.75 years) (p = 0.041).
Symptom-related parameters
Patients reported chronic pelvic pain as the most common symptom with 91.8%. In decreasing order, other reported symptoms were dyspareunia (53.3%), dysmenorrhea (47.3%), dyschezia (46.7%) and dysuria (24.7%). A group-specific examination of symptoms, summarized in Table 1 , shows that patients without infertility reported dyschezia significantly more often compared to patients with infertility (53.8 vs. 36.8%, p = 0.035).
Table 1 Endometriosis-specific symptoms reported by the study population; results are presented as absolute values and percentages.
| Symptom-related parameters | Group 1: endometriosis patients with infertility n = 76 |
Group 2: endometriosis patients without infertility n = 106 |
p-value |
|---|---|---|---|
| Dysmenorrhea | 35 (46.1%) | 51 (48.1%) | 0.08 |
| Pelvic pain | 68 (89.5%) | 99 (93.4%) | 0.42 |
| Dyspareunia | 35 (46.1%) | 62 (58.5%) | 0.10 |
| Dysuria | 16 (27.4%) | 29 (21.1%) | 0.39 |
| Dyschezia | 28 (36.8%) | 57 (53.8%) | 0.03 |
In addition to dyschezia, patients were asked about the frequency of unspecific, cycle-related abdominal complaints. Patients in Group 2 reported a feeling of abdominal pressure (12.3 vs. 1.3%, p = 0.009), diarrhea (31.1 vs. 13.2%, p = 0.005) and constipation (21.7 vs. 9.2%, p = 0.027) significantly more often than patients in Group 1. No group-specific distribution was found for hematochezia (14.2 vs. 9.2%, p = 0.36) and flatulence (13.2 vs. 9.2%, p = 0.485).
Another aspect recorded in the questionnaire was the frequency of symptoms. Patients in Group 2 reported that symptoms occurred regularly significantly more often compared to patients with infertility (90.6 vs. 77.6%, p = 0.02), with symptoms usually occurring at monthly intervals (69.8 vs. 65.8%). Both groups of patients reported having to take time off work because of symptoms, usually in monthly intervals (10.5 vs. 17.9%; p = 0.159). Table 2 summarizes the distribution of symptom-related parameters.
Table 2 Symptom-related parameters of the study population such as frequency of symptoms, regular use of painkillers and frequency of having to take time off work; results are presented as absolute values and percentages.
| Symptom-related parameters | Group 1: endometriosis patients with infertility n = 76 |
Group 2: endometriosis patients without infertility n = 106 |
p-value |
|---|---|---|---|
| Frequency of symptoms | 59 (77.6%) | 96 (90.6%) | 0.020 |
|
5 (6.6%) | 16 (15.1%) | |
|
3 (3.9%) | 6 (5.7%) | |
|
50 (65.8%) | 74 (69.8%) | |
| Regular use of painkillers | 50 (65.8%) | 84 (79.2%) | 0.060 |
|
3 (3.9%) | 8 (7.5%) | |
|
4 (5.3%) | 8 (7.5%) | |
|
43 (56.6%) | 68 (64.2%) | |
| Frequency of having to take time off work | 0.203 | ||
|
0 (0%) | 1 (0.9%) | |
|
6 (7.9%) | 17 (16.0%) | |
|
2 (2.6%) | 1 (0.9%) |
Diagnosis-related parameters
In ⅓ of cases in both groups, more than 10 years elapsed between the first emergence of symptoms and the diagnosis of endometriosis (39.4 vs. 37.5%). Patients who were also infertile (Group 1) consulted 2.72 (± 1.58) doctors on average until the diagnosis of endometriosis was made, patients without infertility (Group 2) consulted an average of 3.08 (± 1.72) different doctors (p = 0.162). Patients in both groups reported a positive familial history of endometriosis (13.2 vs. 18.9%, p = 0.418). Table 3 summarizes the diagnosis-related parameters.
Table 3 Diagnosis-related parameters of the study population such as time to diagnosis, type of diagnosis, familial history and number of doctors consulted until the diagnosis of endometriosis was made; results are presented as absolute values and percentages.
| Diagnosis-related parameters | Group 1: endometriosis patients with infertility n = 76 |
Group 2: endometriosis patients without infertility n = 106 | p-value |
|---|---|---|---|
| Time to diagnosis | 0,69 | ||
|
12 (16.9%) | 14 (13.5%) | |
|
22 (31.0%) | 31 (29.8%) | |
|
9 (12.7%) | 20 (19.2%) | |
|
28 (39.4%) | 39 (37.5%) | |
| Primary diagnosis | 54 (71.1%) | 74 (69.8%) | 0.87 |
| Diagnosis of recurrence | 22 (28.9%) | 31 (29.2%) | 1.00 |
| Incidental diagnosis | 4 (5.3%) | 6 (5.7%) | 1.00 |
| Positive familial history | 10 (13.2%) | 20 (18.9%) | 0.42 |
| Number of doctors consulted until the diagnosis was made | 2.72 ± 1.58 | 3.08 ± 1.72 | 0.16 |
|
13 (17.1%) | 11 (10.4%) | 0.24 |
|
31 (40.8%) | 43 (40.6%) | |
|
15 (19.7%) | 20 (18.9%) | |
|
8 (10.5%) | 12 (11.3%) | |
|
5 (6.6%) | 9 (8.5%) | |
|
2 (2.6%) | 13 (13.0%) |
Endometriosis-related parameters:
There were no group-specific differences in rASRM stage distribution. Of the patients in Group 1, 26.4% (n = 19) were classified as rASRM stage I, 25% (n = 18) as rASRM stage II, 19.4% (n = 14) as rASRM stage III and, the most common finding, 29.2% (n = 21) were classified as rASRM stage IV. The most common classification of patients in Group 2 was rASRM stage I (28.3%, n = 28), followed by rASRM stage II in 22.2% of cases (n = 22), rASRM stage III in 23.2% (n = 23) and rASRM stage IV in 26.3% (n = 26). In both groups, the most common classification of patients with deep infiltrating endometriosis was ENZIAN B (31 vs. 47, p = 0.53). The distribution of stages is shown below in Table 4 .
Table 4 Stage-related parameters of endometriosis involvement in the study population using the ENZIAN and the rASRM (classification of the American Society for Reproductive Medicine) classification systems; results are presented as absolute values and percentages.
| Endometriosis-related parameters | Group 1: endometriosis patients with infertility n = 76 |
Group 2: endometriosis patients without infertility n = 106 |
p-value |
|---|---|---|---|
| rASRM score | 0.90 | ||
|
19 (26.4%) | 28 (26.4%) | |
|
18 (25%) | 22 (20.6%) | |
|
14 (19.4%) | 23 (21.7%) | |
|
21 (29.2%) | 26 (24.5%) | |
| ENZIAN classification | |||
| A compartment | 11 (14.5%) | 11 (10.3%) | 1.00 |
|
3 (3.9%) | 3 (2.8%) | |
|
4 (5.3%) | 4 (3.8%) | |
|
4 (5.3%) | 4 (3.8% | |
| B compartment | 31 (40.8%) | 47 (44.3%) | 0.53 |
|
5 (6.6%) | 13 (12.3%) | |
|
18 (23.7%) | 24 (22.6%) | |
|
8 (10.5%) | 10 (9.4%) | |
| C compartment | 14 (18.4%) | 16 (15.1%) | 0.52 |
|
6 (7.9%) | 7 (6.6%) | |
|
5 (6.6%) | 3 (2.8%) | |
|
3 (3.9%) | 6 (5.6%) | |
|
1 (1.3%) | 1 (0.9%) | 1.0 |
|
2 (2.6%) | 2 (1.8%) | 1.0 |
|
4 (5.3%) | 5 (4.7%) | 1.0 |
|
2 (2.6%) | 6 (5.6%) | 0.47 |
In our patient population, linear multivariate regression analysis showed no significant increase in the probable risk of higher grade rASRM scores as a function of typical symptoms such as “dysmenorrhea”, “pelvic pain”, “dyspareunia”, “dysuria”, “dyschezia” and “infertility”. The results are summarized in Table 5 . When the pattern of involvement was evaluated, the most common location in both groups of patients was the pelvic peritoneum (43 vs. 60, p = 1.0). Binary regression analysis showed a significant increase in the probable risk of involvement of the pelvic peritoneum as a function of the symptoms; according to this analysis, dysmenorrhea increased the risk 2.3-fold (p = 0.013). The occurrence of dyspareunia decreased the risk of pelvic peritoneum involvement (odds ratio 0.475, p = 0.037). The results are summarized in Table 6 . No significant increases in probable risk based on the symptoms “dysmenorrhea”, “pelvic pain”, “dyspareunia”, “dysuria”, “dyschezia” and “infertility” were detected for compartments A, B and C of the ENZIAN classification.
Table 5 Results of linear multivariate regression analysis to evaluate risk factors for rASRM stages of endometriosis involvement as a function of specific symptoms reported by the study population.
| Symptom | Regression coefficient B | SE | p-value | Lower CI | Upper CI |
|---|---|---|---|---|---|
| CI = confidence interval, B is the calculated regression coefficient, SE is the standard error of the regression coefficient. | |||||
| Dysmenorrhea | 0.054 | 0.180 | 0.766 | − 0.302 | 0.409 |
| Pelvic pain | 0.445 | 0.324 | 0.172 | − 0.196 | 1.086 |
| Dyspareunia | − 0.331 | 0.196 | 0.094 | − 0.719 | 0.057 |
| Dysuria | − 0.163 | 0.222 | 0.464 | − 0.600 | 0.275 |
| Dyschezia | 0.294 | 0.201 | 0.145 | − 0.103 | 0.691 |
| infertility | 0.051 | 0.184 | 0.782 | − 0.312 | 0.414 |
Table 6 Results of binary regression analysis to evaluate risk factors for endometriosis involvement of the pelvic peritoneum as a function of specific symptoms reported by the study population.
| Symptom | Regression coefficient B | SE | p-value | Odds ratio | Lower CI | Upper CI |
|---|---|---|---|---|---|---|
| CI = confidence interval, B is the calculated regression coefficient, SE is the standard error of the regression coefficient. | ||||||
| Dysmenorrhea | 0.823 | 0.33 | 0.013 | 2.278 | 1.193 | 4.348 |
| Pelvic pain | 0.249 | 0.586 | 0.670 | 1.283 | 0.407 | 4.043 |
| Dyspareunia | − 0.745 | 0.356 | 0.037 | 0.475 | 0.236 | 0.954 |
| Dysuria | 0.671 | 0.411 | 0.103 | 1.956 | 0.874 | 4.376 |
| Dyschezia | − 0.353 | 0.357 | 0.322 | 0.702 | 0.349 | 1.414 |
| Infertility | − 0.083 | 0.331 | 0.801 | 0.920 | 0.481 | 1.760 |
In binary regression analysis, the risk probability for involvement of the pelvic peritoneum for unspecific but cycle-related gastrointestinal symptoms such as dyschezia, hematochezia, feeling of abdominal pressure, diarrhea, constipation, bloating and pelvic pain was significantly higher, with a 2.7-fold increase if patients reported a history of cycle-related diarrhea (odds ratio: 2.707, 95% CI: 1.063 – 6.895, p = 0.037). Moreover, analysis of these unspecific cycle-related gastrointestinal complaints found a significant 4.6-fold increase in the risk probability for rectal involvement if patients reported cycle-related dyschezia (odds ratio: 4.659, 95% CI: 1.132 – 19.186, p = 0,033).
Fertility-related parameters
There was a high percentage of nulligravida in the group with infertility (53.9%) compared to Group 2 (46.2%) (p = 0.046). Patients with infertility reported significantly lower numbers of spontaneous conceptions in previous pregnancies (34.2 vs. 49.1%, p = 0.05) and a significantly higher number had used ART (31.6 vs. 6.6%, p = 0.001).
Therapy-related parameters
Following surgical excision, the percentage of patients who returned to work was similar in both groups. The majority of patients had fully returned to work at two months postoperatively (94.7 vs. 93.4%, p = 0.413). The reported severity of pain measured using the visual analog pain scale decreased significantly in both groups postoperatively (from 7.05 to 2.57 vs. 7.37 to 2.28).
The majority of patients in both groups felt that endometriosis impaired their quality of life (64.5 vs. 78.3%); this was even more pronounced in Group 2 (p = 0.045).
Discussion
This study aimed to evaluate the type and duration of endometriosis complaints in a patient population which presented to a clinical-scientific endometriosis center. The study also investigated the effect of the pattern of endometriosis involvement on specific complaints.
The mean age of the investigated patient population was 34.26 years, and infertility was reported by 41.8% of cases. Pelvic pain was the most commonly reported symptom (91.8%). Peterson et al. investigated risk factors for the presence of endometriosis in 473 patients prior to laparoscopy; the risk probability of detecting endometriosis intraoperatively increased 3.6-fold if patients reported pelvic pain (OR 3.67, 95% CI: 2.44 – 5.50) and 2.4-fold if they reported dysmenorrhea (OR 2.46; 95% CI: 1.28 – 4.72). In addition to specific symptoms such as pelvic pain, dysmenorrhea, dyspareunia, dyschezia and dysuria, patients with endometriosis also reported unspecific gastrointestinal complaints 8 . A group-specific examination of symptoms showed that patients without infertility were particularly likely to report dyschezia (p = 0.035) and unspecific, cycle-related gastrointestinal symptoms such as a feeling of abdominal pressure (p = 0.009), diarrhea (p = 0.005) and constipation (p = 0.027). The overlap of endometriosis symptoms with symptoms of gastroenterological disorders made obtaining the correct diagnosis more difficult, not least because of misdiagnoses, particularly among patients without infertility. In a study by Seaman et al. which examined 5540 patients with endometriosis, patients with endometriosis received a diagnosis of irritable bowel syndrome 3.5 times more often (OR 3.5; 95% CI: 3.1 – 3.9) compared to patients without endometriosis. The issue of bowel involvement in endometriosis is controversially discussed in the literature. The majority of endometriosis lesions are in the area of the pelvic peritoneum in the immediate vicinity of terminal sections of the large intestine. The inflammation-related irritation and release of prostaglandins could explain the reported disorders of bowel function 22 . Binary regression analysis showed a 2.7-fold increase in the risk probability of involvement of the pelvic peritoneum as a function of these unspecific cycle-related gastrointestinal complaints (dyschezia, hematochezia, feeling of abdominal pressure, diarrhea, constipation, bloating and pelvic pain) if patients had previously reported cycle-related diarrhea (p = 0.037, odds ratio 2.707, 95% CI: 1.063 – 6.895).
Hudelist et al. showed that patients with endometriosis had a history of at least one misdiagnosis. In addition to misdiagnoses which can be a consequence of symptoms which overlap with those of gastroenterological disorders, unspecific complaints also lead to a delay in obtaining the correct diagnosis 10 . Ballard et al. found that in addition to patients being misdiagnosed, symptoms were played down and/or suppressed by taking oral, hormone-based contraceptives and that diagnostic tests with a low sensitivity and specificity were often used 23 . In almost 40% of cases of the total patient population, more than 10 years passed (39.4 vs. 37.5%) between experiencing the initial symptoms and obtaining the correct diagnosis; no differences were found between patients with infertility and patients without infertility (p = 0.699). Overall, however, the percentage of diagnoses obtained within the space of less than one year was somewhat higher in the group of patients with infertility (16.9 vs. 13.5%). With regard to the time to diagnosis, patients with infertility appear to benefit from the surgical diagnostic workup for infertility. Hudelist et al. reported a delay of 10.4 years in Germany and Austria in obtaining the correct diagnosis for 171 patients 10 . An international comparison of the time to diagnosis showed that figures ranged from 11.7 years (USA) to 6.7 years (Norway) 8 . Patients regularly report that symptoms have been present for 180 months and that the time to diagnosis was delayed by 102 months 23 . In our patient population, patients consulted 2.93 ± 1.672 doctors on average until they obtained the final diagnosis. There was no significant difference between groups of women with and without infertility (2.72 ± 1.58 vs. 3.08 ± 1.72, p = 0.162).
As regards the distribution of rASRM stages, stages I – IV were evenly distributed (25.8%, 22.0%, 20.3%, 25.8%). However, because of the retrospective study design, it was not possible to differentiate between endometriosis lesions and endometriosis-related adhesions. No significant differences in the distribution of rASRM stages were found between the two groups (p = 0.9). As regards the typical symptoms of dysmenorrhea, pelvic pain, dyspareunia, dysuria, dyschezia and infertility, linear multivariate regression analysis found no significant increase in risk probability for higher rASRM scores. Other studies have already demonstrated a lack of correlation between rASRM scores and the severity of patientsʼ complaints 21 . The strength of the rASRM classification system is the international prevalence and acceptance of the system and its ease of use 24 . It should be noted that this classification system does not take deep infiltrating endometriosis into account.
Deep infiltration is found in 48% of all endometriosis cases; these findings are associated with more pronounced symptoms than superficial endometriosis 25 . In the patient population studied here, a total of 152 lesions were classified as deep infiltrating endometriosis using the ENZIAN classification. An ENZIAN B score was the most common ENZIAN classification in both groups (31 vs. 47, p = 0.53). The low incidence of uterine adenomyosis in our patient population was due to the difficulty of histologically confirming uterine adenomyosis without uterine resection and the low rate of hysterectomies performed in our patient population. Haas et al. studied 194 cases and found that, in contrast to the rASRM score, the ENZIAN classification showed a correlation with clinical symptoms. Findings in compartment A showed a strong association with pelvic pain (p = 0.012), findings in compartment C were associated with gastrointestinal complaints (p = 0.011) 26 . In our study, binary regression analysis of cycle-related gastrointestinal complaints such as dyschezia, hematochezia, feeling of abdominal pressure, diarrhea, constipation, bloating and pelvic pain showed a significant 4.6-fold increase in the risk probability for compartment C involvement if patients reported dyschezia (p = 0.033, odds ratio 4.659, 95% CI: 1.132 – 19.186).
Another strength of the ENZIAN classification system is the attribution to a specific organ or compartment. The most common pattern of involvement for both groups of patients was the pelvic peritoneum (43 vs. 60, p = 1.0) and the ovaries (34 vs. 45, p = 0.87). Binary regression analysis showed a significantly increased risk for involvement of the pelvic peritoneum based on reported symptoms; according to this analysis, dysmenorrhea increased the risk of pelvic peritoneum involvement 2.3-fold (p = 0.013). The occurrence of dyspareunia decreased the risk of pelvic peritoneum involvement (odds ratio 0.475, p = 0.037). Some studies have suggested that deep dyspareunia may be associated with deep infiltrating endometriosis 27 .
The heterogeneity of endometriosis symptoms delays the diagnosis and makes obtaining a correct diagnosis more difficult 28 . rASRM scores are not correlated with patientsʼ symptoms. In addition to typical symptoms such as dysmenorrhea, symptoms such as unspecific cycle-related gastrointestinal complaints such as diarrhea can be indications pointing to a diagnosis of peritoneal endometriosis. Such symptoms can be investigated safely and with few complications early on, using minimally invasive surgery, which could prevent misdiagnoses such as irritable bowel syndrome. Symptoms such as dyschezia can be an indication of deep infiltrating endometriosis with involvement of the rectum. Patients with endometriosis and infertility have a higher percentage of diagnoses made within the space of less than one year and need to consult fewer doctors on average until they obtain the correct diagnosis; overall, however there were no differences between the two patient cohorts which could be useful in clinical practice to improve the diagnostic workup.
Conclusion
In almost 40% of our total patient population, more than 10 years passed between experiencing the first symptoms to obtaining the correct diagnosis. To reduce the delay in obtaining a correct diagnosis, physicians should actively ask about typical endometriosis symptoms and be aware that unspecific cycle-related gastrointestinal complaints in young women of reproductive age can be indications for endometriosis. Unspecific, cycle-related gastrointestinal complaints such as diarrhea and dysmenorrhea increase the risk probability for peritoneal endometriosis. Cycle-related dyschezia increases the risk probability for rectal endometriosis. The use of diagnostic laparoscopy as a minimally-invasive diagnostic procedure can reduce the delay in obtaining the correct diagnosis, particularly if used in combination with targeted taking of the patientʼs history and careful questioning about symptoms.
Footnotes
Conflict of Interest/Interessenkonflikt The authors declare that they have no conflict of interest./Die Autorinnen/Autoren geben an, dass kein Interessenkonflikt besteht.
References/Literatur
- 1.Schweppe K W. Differentialdiagnose und Behandlungsstrategien bei Endometriose: Was tun – wann? Journal für Fertilität und Reproduktion. 2003;13:8–12. [Google Scholar]
- 2.Goldstein D P, deCholnoky C, Emans S J. Laparoscopy in the diagnosis and management of pelvic pain in adolescents. J Reprod Med. 1980;24:251–256. [PubMed] [Google Scholar]
- 3.Eskenazi B, Warner M L. Epidemiology of endometriosis. Obstet Gynecol Clin North Am. 1997;24:235–258. doi: 10.1016/s0889-8545(05)70302-8. [DOI] [PubMed] [Google Scholar]
- 4.Schweppe K W. [Endometriosis–a disease that has no lobby] Zentralbl Gynakol. 2003;125:233. doi: 10.1055/s-2003-42275. [DOI] [PubMed] [Google Scholar]
- 5.Child T J, Tan S L. Endometriosis: aetiology, pathogenesis and treatment. Drugs. 2001;61:1735–1750. doi: 10.2165/00003495-200161120-00005. [DOI] [PubMed] [Google Scholar]
- 6.Viganò P, Parazzini F, Somigliana E. Endometriosis: epidemiology and aetiological factors. Best Pract Res Clin Obstet Gynaecol. 2004;18:177–200. doi: 10.1016/j.bpobgyn.2004.01.007. [DOI] [PubMed] [Google Scholar]
- 7.Giudice L C. Clinical Practice. Endometriosis. N Engl J Med. 2010;362:2389–2398. doi: 10.1056/NEJMcp1000274. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Ballard K, Seaman H E, deVries C S. Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study – Part 1. BJOG. 2008;115:1382–1391. doi: 10.1111/j.1471-0528.2008.01878.x. [DOI] [PubMed] [Google Scholar]
- 9.Mathias S D, Kuppermann M, Liberman R F. Chronic pelvic pain: prevalence, health-related quality of life, and economic correlates. Obstet Gynecol. 1996;87:321–327. doi: 10.1016/0029-7844(95)00458-0. [DOI] [PubMed] [Google Scholar]
- 10.Hudelist A, Fritzer N, Thomas A. Diagnostic delay for endometriosis in Austria and Germany: causes and possible consequences. Hum Reprod. 2012;27:3412–3416. doi: 10.1093/humrep/des316. [DOI] [PubMed] [Google Scholar]
- 11.Zondervan K T, Yudkin P L, Vessey M P. The community prevalence of chronic pelvic pain in women and associated illness behaviour. Br J Gen Pract. 2001;51:541–547. [PMC free article] [PubMed] [Google Scholar]
- 12.Grace V M, Zondervan K T. Chronic pelvic pain in New Zealand: prevalence, pain severity, diagnoses and use of the health services. Aust N Z J Pub Health. 2004;28:369–375. doi: 10.1111/j.1467-842x.2004.tb00446.x. [DOI] [PubMed] [Google Scholar]
- 13.Wimberger P, Grübling N, Riehn A. Endometriosis – A Chameleon: Patientsʼ Perception of Clinical Symptoms, Treatment Strategies and Their Impact on Symptoms. Geburtsh Frauenheilk. 2014;74:940–946. doi: 10.1055/s-0034-1383168. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Fourquet J, Báez L, Figueroa M. Quantification of the impact of endometriosis symptoms on health-related quality of life and work productivity. Fertil Steril. 2011;96:107–112. doi: 10.1016/j.fertnstert.2011.04.095. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Simoens S, Hummelshoj L, DʼHooghe T. Endometriosis: cost estimates and methodological perpective. Hum Reprod Update. 2007;13:395–404. doi: 10.1093/humupd/dmm010. [DOI] [PubMed] [Google Scholar]
- 16.Simoens S, Dunselman G, Dirksen C. The burden of endometriosis: costs and quality of life of women with endometriosis and treated in referral centers. Hum Reprod. 2012;27:1292–1299. doi: 10.1093/humrep/des073. [DOI] [PubMed] [Google Scholar]
- 17.Ulrich U, Buchweitz O, Greb R. Interdisciplinary S2k guidelines for the diagnosis and treatment of endometriosis: short version – AWMF Registry No. 015-045. Geburtsh Frauenheilk. 2013;73:890–898. doi: 10.1055/s-0033-1350810. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.World Endometriosis Society Montpellier Consortium . Johnson N P, Hummelshoj L. Consensus on current management of endometriosis. Hum Reprod. 2013;28:1552–1568. doi: 10.1093/humrep/det050. [DOI] [PubMed] [Google Scholar]
- 19.Mahmood T A, Templeton A A, Thomson L. Menstrual symptoms in women with pelvic endometriosis. Br J Obstet Gynecol. 1991;98:558–563. doi: 10.1111/j.1471-0528.1991.tb10370.x. [DOI] [PubMed] [Google Scholar]
- 20.Fauconnier A, Chapron C, Dubuisson J B. Relation between pain symptoms and the anatomic location of deep infiltrating endometriosis. Fertil Steril. 2002;78:719–726. doi: 10.1016/s0015-0282(02)03331-9. [DOI] [PubMed] [Google Scholar]
- 21.Andres M P, Borrelli G M, Abrão M S. Endometriosis classification according to pain symptoms: can the ASRM classification be improved? Best Pract Res Clin Obstet Gynaecol. 2018;51:111–118. doi: 10.1016/j.bpobgyn.2018.06.003. [DOI] [PubMed] [Google Scholar]
- 22.Ferrero S, Petrera P, Colombo B M. Asthma in women with endometriosis. Hum Reprod. 2005;20:3514–3517. doi: 10.1093/humrep/dei263. [DOI] [PubMed] [Google Scholar]
- 23.Ballard K, Lowton K, Wright J. Whatʼs the delay? A qualitative study of Womenʼs experiences of reaching a diagnosis of endometriosis. Fertil Steril. 2006;86:1296–1301. doi: 10.1016/j.fertnstert.2006.04.054. [DOI] [PubMed] [Google Scholar]
- 24.Haas D, Shel O, Shamiyeh A. The rASRM Score and the Enzian classification for endometriosis: their strengths and weaknesses. Acta Obstet Gynecol Scand. 2013;92:3–7. doi: 10.1111/aogs.12026. [DOI] [PubMed] [Google Scholar]
- 25.Abrão M S, Petraglia F, Falcone T. Deep endometriosis infiltrating the recto-sigmoid: critical factors to consider before management. Hum Reprod Update. 2015;21:329–339. doi: 10.1093/humupd/dmv003. [DOI] [PubMed] [Google Scholar]
- 26.Haas D, Oppelt P, Shebl O. Enzian classification: does it correlate with clinical symptoms and the rASRM score? Acta Obstet Gynecol Scand. 2013;92:562–566. doi: 10.1111/aogs.12118. [DOI] [PubMed] [Google Scholar]
- 27.Lafay Pillet M C, Huchon C, Santulli P. A clinical score can predict associated deep infiltrating endometriosis before surgery for an endometrioma. Hum Reprod. 2014;29:1666–1676. doi: 10.1093/humrep/deu128. [DOI] [PubMed] [Google Scholar]
- 28.Burghaus S, Hildebrandt T, Fahlbusch C. Standards used by a clinical and scientific endometriosis center for the diagnosis and therapy of patients with endometriosis. Geburtsh Frauenheilk. 2019;79:487–497. doi: 10.1055/a-0813-4411. [DOI] [PMC free article] [PubMed] [Google Scholar]