Zusammenfassung
Ätherische Öle aus unterschiedlichen Heilpflanzen sind hoch wirksam gegen einige Virusinfektionen, z. B. gegen Herpes-simplex-Virus vom Typ 1, den Erreger des Lippenherpes. Melissenöl, Teebaumöl und Pfefferminzöl sind in vitro deutlich antiherpetisch wirksam. Dies beruht vor allem auf einer direkten Interaktion des Öls mit Viruspartikeln. Die genannten ätherischen Öle sind auch gegen aciclovirresistente Herpesstämme wirksam. In klinischen Studien wurde für Teebaumöl eine infektionshemmende Eigenschaft nachgewiesen. Letztere führt zur schnelleren Abheilung des Lippenherpes. Darüber hinaus wirken ätherische Öle bei topischer Anwendung auch schmerzlindernd und entzündungshemmend. Eine 3- bis 4-malige topische Applikation verdünnter ätherischer Öle wird zur Therapie bei herpetischen Infektionen empfohlen. Einige Pflanzenprodukte, z. B. aus der Melisse, sind bereits im Handel zur Behandlung von herpetischen Infektionen erhältlich.
Schlüsselwörter: Ätherische Öle, Infektion, Herpes simplex, Antivirale Aktivität, Antivirale Substanzen
Abstract
Essential oils from various aromatic medicinal plants are highly active against some viral infections, e.g. labial herpes caused by herpes simplex virus type 1. Balm oil, tea tree oil and peppermint oil demonstrate in vitro a significant antiherpetic activity, mainly related to a direct drug-virus particle interaction, some essential oils also act directly virucidal. Interestingly, these essential oils are also highly active against acyclovir-resistant herpes simplex virus strains. In clinical studies, tea tree oil has been shown to possess antiherpetic, anti-inflammatory and pain-relieving properties, as well as to accelerate the healing process of herpes labialis. Applying diluted essential oils three to four times daily for the antiherpetic treatment of affected areas is recommended. Some companies have marketed plant products, e.g. from Melissa, for the treatment of recurrent herpetic infections.
Keywords: Essential oils, Infection, Herpes simplex, Antiviral activity, Antiviral agents
Der rezidivierende Herpes labialis ist die häufigste Erkrankung, die durch einen Vertreter aus der Familie der Herpesviren verursacht wird. Lippenbläschen werden durch das Herpes-simplex-Virus ausgelöst, insbesondere Typ 1 (HSV-1), in seltenen Fällen auch durch Typ 2 (HSV-2). Die therapeutischen Maßnahmen reichen von alten Hausmitteln über pflanzliche Extrakte, ätherische Öle bis zu den modernen Virustatika. Im Mittelpunkt des vorliegenden Artikels stehen Untersuchungen zur Wirksamkeit von Pflanzenprodukten gegen Herpes-simplex-Virus Typ 1 (HSV-1), den Erreger des Lippenherpes [3, 9, 35, 49, 56, 58].
Ätherische Öle
Pflanzenprodukte werden schon lange in der traditionellen Medizin zur Behandlung von respiratorischen Infekten, Asthma, Dermatitis und gastrointestinalen Infekten eingesetzt [40]. Ätherische Öle aus verschiedenen Pflanzen spielen hierbei eine sehr große Rolle, antibakterielle und antifungale Eigenschaften ätherischer Öle wurden gegen einige grampositive und gramnegative Bakterien und verschiedene Pilze nachgewiesen [46, 48, 49]. Darüber hinaus wurde sowohl für ätherische Öle als auch für einzelne Bestandteile dieser Öle aus aromatischen Pflanzen gezeigt, dass diese Substanzen eine antivirale Wirkung gegen verschiedene behüllte DNA- und RNA-Viren besitzen. Die Behandlung von Lippenherpes und Genitalherpes mit Präparaten, die ätherische Öle enthalten, ist in der traditionellen Medizin seit Langem beschrieben. Viele In-vitro-Untersuchungen wurden vorangetrieben, um die wissenschaftlichen Grundlagen für die antivirale Wirkung, insbesondere die Aufklärung des genauen Wirkmechanismus, zu erforschen.
Manche Pflanzen produzieren ätherische Öle in Blüten, Blättern, Früchten und Wurzeln
Ätherische Öle sind komplexe, aromatisch duftende Gemische aus verschiedenen Komponenten mit niedrigem Molekulargewicht und unterschiedlichster chemischer Struktur. Überwiegend handelt es sich bei den Einzelsubstanzen um Monoterpene, Sesquiterpene, und Phenylpropane. Pflanzen aus verschiedenen Familien, z. B. Alliaceae, Apiaceae, Asteraceae, Brassicaceae, Lamiaceae, Myrtaceae, and Rutaceae, produzieren ätherische Öle in Blüten, Blättern, Früchten und Wurzeln. Durch Destillation können diese Pflanzenprodukte zum medizinischen und kommerziellen Gebrauch aufgereinigt werden. Neben antimikrobiellen Eigenschaften zeichnen sich diese Öle auch durch antiinflammatorische, antirheumatische, immunmodulatorische und sedative Effekte aus [49]. Die Applikation ist abhängig von der Pathophysiologie der Erkrankung, Atemwegsinfekte werden durch Inhalation behandelt, bei Hauterkrankungen steht die topische Anwendung im Vordergrund. Bei der topischen Anwendung können allerdings Hautirritationen auftreten. Solche Effekte können in einem hühnereibasierten Test überprüft und abgeschätzt werden. Es ist daher allgemein empfohlen, ätherische Öle nur in verdünnter Form topisch anzuwenden [40, 48, 53].
Herpesviren
Aufbau
Herpesviren gehören zu den größten und komplexesten Viren. Wie alle Vertreter dieser Familie besteht das Herpes-simplex-Virus (HSV), das man nach seinen antigenen Eigenschaften in die beiden Typen HSV-1 und HSV-2 unterteilt, aus den Strukturkomponenten Core, Kapsid, Tegument und einer Hüllmembran (Virushülle, „envelope“). Der akute lytische Replikationszyklus der Herpes-simplex-Viren während der Primärinfektion oder eines Rezidivs beginnt mit der Adsorption des Virus an die epithelialen Zellen. Durch Fusion der Virushülle mit der Zellmembran wird das Viruskapsid in das Zytoplasma eingeschleust (Penetration). Klinisch äußert sich die Zellzerstörung durch die typischen Bläschen, die schließlich aufbrechen und ihren infektiösen Inhalt freisetzen.
Verbreitung
Das Herpes-simplex-Virus ist weltweit verbreitet, mehr als 85% der Weltbevölkerung sind seropositiv für HSV-1. Die Inzidenz hängt von der Altersgruppe, dem Sozialstatus und der geographischen Region ab. Nach Ansteckung durch engen körperlichen Kontakt beträgt die HSV-1-Infektionsrate bei den 12-Jährigen in den Industriestaaten etwa 40%. HSV-1 führt meist zu Läsionen im Bereich von Mund und Lippe [26]. Die HSV-2-Infektionsrate ist deutlich geringer als die von HSV-1 und liegt bei 10–20%. HSV-2 ist der vorherrschende Auslöser von Herpes genitalis und wird meistens erst durch Sexualkontakte übertragen. Es induziert schmerzhafte Läsionen im Genitalbereich [22]. Jedoch kann auch HSV-1 genitale Herpesinfektionen auslösen. Umgekehrt infiziert HSV-2 bei oralem Kontakt auch die Mundschleimhaut und kommt in seltenen Fällen als Ursache für die Lippenherpesrezidive in Frage. Zwar verursachen Herpesviren zumeist banale, teilweise schmerzhafte Infekte, sie können aber auch in seltenen Fällen lebensbedrohliche Erkrankungen auslösen, z. B. eine Herpesenzephalitis [14, 50, 61]. Bei immunsupprimierten Patienten kommt es häufig zu Infektionen mit dem Zytomegalievirus, einem weiteren Vertreter der Familie der Herpesviren.
Infektionsverlauf
Bei der Primärinfektion werden vorwiegend Epithelien ohne Stratum corneum infiziert, bei HSV-1 in erster Linie die Mundschleimhaut. Die Inkubationszeit beträgt 2–12 Tage. Die Primärinfektion verläuft meist asymptomatisch oder als unspezifische Gingivitis oder Pharyngitis mit dem typischen Ausschlag, der ohne Narbenbildung abheilt. Der viel seltenere spezifische symptomatische Verlauf einer HSV-1-Primärinfektion ist charakterisiert durch Läsionen in der bukkalen und gingivalen Mukosa über 2–3 Wochen und Fieber. Intraorale Ulzerationen deuten auf die Primärinfektion hin, während äußerliche Läsionen an den Lippen bereits eine rezidivierende Infektion darstellen. Während der meist harmlosen primären HSV-1-Infektion ist der Speichel bis zu 3 Wochen lang infektiös.
Nach der Primärinfektion werden Herpesviren entlang der Axone zu den sensorischen Ganglien transportiert. HSV-1 gelangt nach der oralen Infektion in das Trigeminalganglion, HSV-2 in die Lumbal- und Sakralganglien. Ganz unterschiedliche Ursachen können Rezidive auslösen. Die Viren vermehren sich und steigen über die sensorische Nervenachse wieder zum peripheren Epithel im Innervationsbereich des Ganglions auf. In der Basalzellschicht werden zahlreiche Infektionsherde gesetzt, die sich nach wenigen Replikationszyklen vergrößern. Die rezidivierende HSV-1-Infektion manifestiert sich i. d. R. an den Lippen als Herpes labialis, seltener an anderen Gesichtsbereichen wie Nase, Kinn und Wangen oder Mundhöhle.
Phasen des Lippenherpes
Die typische Herpes-labialis-Episode verläuft in Phasen. Die Virusreplikation findet hauptsächlich in den ersten 48 h statt. Die höchsten Virustiter bestehen während des Bläschenstadiums, sie nehmen mit der Verkrustung ab. Nach etwa 5 Tagen können keine Viren mehr aus den Läsionen isoliert werden.
In der Prodromalphase treten oft Symptome wie Schmerzen, Kribbeln, Brennen, Spannungsgefühl und Jucken auf. Diese Empfindungen korrelieren nach histologischen Untersuchungen zeitlich mit den frühen Phasen der Virusreplikation in der Haut. Patienten mit Prodromalsymptomen haben meist schwerere Verläufe als Patienten ohne diese Anzeichen.
In der Papelphase rötet sich zunächst die Haut, nach und nach erscheinen mehr oder weniger dicke gerötete schmerzhafte Papeln am Lippenrand.
In der Vesikelphase werden immer mehr Zellen der Epidermis zerstört. Die Papeln entwickeln sich zu flüssigkeitsgefüllten Bläschen (Vesikel) mit einem Durchmesser zwischen 2–5 mm.
In der Ulzerationsphase brechen die Vesikel auf und verschmelzen, sie bilden schmerzhafte nässende Wunden. Die austretende Flüssigkeit enthält Millionen von Viren und ist hoch infektiös.
Zum Ende der Infektion folgen noch die Verkrustungs- und Abheilungsphase.
Entscheidend bei allen Infektionen mit Herpesviren ist die Tatsache, dass diese Viren lebenslang im Organismus persistieren und immer wieder reaktiviert werden können. Aus der lytischen Primärinfektion der Schleimhaut entsteht eine latente Infektion in Nervenzellen, die sich durch bestimmte Stimuli reaktivieren und zu Rezidiven führen kann [17].
Studien zur antiherpetischen Wirksamkeit von ätherischen Ölen
Ein Screening zur antiviralen Wirksamkeit erfolgt meist im Zellkultursystem, unter Verwendung von aus humanen Tumoren abgeleiteten Zelllinien wie HeLa-Zellen oder Zellen aus Affennieren, z. B. Vero-Zellen oder RC-37-Zellen. Ein etwaiger zytotoxischer Effekt muss zunächst überprüft oder ausgeschlossen werden, damit die antivirale Wirkung und damit die Hemmung der Virusvermehrung eindeutig der verwendeten Droge und nicht einem etwaigen Zellschaden zugeordnet werden kann. Hierzu steht der Neutralrottest zur Verfügung, in dem die Anzahl der vitalen Zellen nach Exposition mit verschiedenen Verdünnungsstufen des Öls bestimmt werden kann, indem die Aufnahme an Neutralrot durch die Zellen in Kultur quantifiziert wird [56]. Mit dieser Methode kann die halbtoxische (TC50) und maximale nichtzytotoxische Konzentration der Drogen bestimmt werden. Das Verhältnis von TC50 und der inhibitorischen Konzentration des Öls, bei der die Virusvermehrung um 50% gehemmt wird (IC50), wird als Selektivitätsindex bezeichnet. Der Selektivitätsindex ist ein wichtiges Maß für die therapeutische Anwendung von natürlichen und synthetischen Produkten. Eine geringe Toxizität bei gleichzeitiger hoher Wirksamkeit eines Produkts führt zu einem hohen Selektivitätsindex, der eine potenzielle klinische Applikation in Aussicht stellt.
Eine geringe Toxizität bei gleichzeitiger hoher Wirksamkeit eines Produkts führt zu einem hohen Selektivitätsindex
Zur Behandlung von herpetischen Infektionen sind verschiedene Virostatika zugelassen, z. B. Aciclovir und andere Nukleosidanaloga, die die Neusynthese von viraler DNA hemmen und somit die Virusvermehrung inhibieren [6]. Jedoch wurden in den letzten Jahren vermehrt aciclovirresistente Herpesviren isoliert, insbesondere von immundefizienten oder immunsupprimierten Patienten, z. B. HIV-Patienten oder Patienten nach Chemotherapie und Knochenmarktransplantation, die über längere Zeit mit Aciclovir behandelt wurden [5, 62]. Das Auftreten von resistenten Herpesviren verlangt nach der Suche und Entwicklung von alternativen Therapeutika, die einen anderen Wirkmechanismus besitzen und gegen aciclovirresistente Stämme wirksam sind. Im Idealfall induzieren die alternativen Produkte nur in geringem Maße gewisse Resistenzmechanismen.
Medizinalpflanzen stellen hier ein fast unerschöpfliches Reservoir an Naturprodukten dar, die möglicherweise auch antimikrobiell wirken [32, 35]. Daher ist die Identifizierung und Entwicklung neuer antiviraler Produkte, die sich von den bisherigen synthetischen Produkten und deren Wirkmechanismus unterscheiden, dringend notwendig. Diese neuen Drogen können die Virusvermehrung zu verschiedenen Zeitpunkten der Infektion hemmen, z. B. während des Anheftens der Viren an die Zellen (Attachment), während des Eindringens der Viren in die Zellen (Penetration), während der intrazellulären Replikation oder bei der Freisetzung der Viren aus infizierten Zellen [18]. Eine mögliche viruzide Eigenschaft von verschiedenen Pflanzenprodukten sollte ebenfalls untersucht werden, da vielen Medizinalpflanzen eine antimikrobielle Eigenschaft zugeschrieben wird [10, 11, 12, 15, 16, 23, 27, 63]. Naturprodukte bieten als Reinsubstanzen oder als standardisierte Extrakte sehr vielfältige Möglichkeiten für antivirale Drogen, da die chemische Vielfalt dieser Naturprodukte mit einfachen und sehr komplexen Strukturen fast unerschöpflich scheint. Momentan stehen nur wenige Virostatika zur Behandlung von Infekten zur Verfügung.
Zum Screenen von Naturprodukten gegen Herpesviren kommen verschiedene In-vitro-Methoden in Betracht, z. B. die Inhibition eines zytopathischen Effekts, die Inhibition oder Reduktion einer Plaquebildung und die Hemmung virusspezifischer Enzyme. Bei einigen sekundären Metaboliten im Stoffwechsel der Pflanzen wurden bereits antivirale Eigenschaften nachgewiesen, z. B. bei Flavonoiden, Anthrachinonen und Phenolen [42, 45], die antiherpetische Wirkung verschiedener pflanzlicher ätherischen Öle ist in Tab. 1 dargestellt. Beispiele einheimischer Pflanzen, deren Effekt gegen HSV nachgewiesen wurde, sind in Abb. 1 dargestellt: Melisse, Pfefferminze, Braunelle, Rosmarin, Salbei und Thymian.
| Pflanze | Name | Virus | Inhibitorische Konzentration IC50 (μg/ml) |
Literatur |
|---|---|---|---|---|
| Silberwermut | Artemisia arborescens | HSV-1/HSV-2 | 2400/4100 | Saddi et al. 2007, [51] |
| Amerikanisches Moxakraut | Artemisia douglasiana | HSV-1 | 83 | Garcia et al. 2003, [24] |
| Libanonzeder | Cedrus libani | HSV-1 | 440 | Loizzo et al. 2008, [41] |
| Echter Zimt | Cinnamonum verum | HSV-1 | 80 | Bourne et al. 1999, [9] |
| Zitrone | Citrus limon | HSV-1/HSV-2 | 15/15 | Koch et al. 2008, [38] |
| Zitronengras | Cymbopogon citratus | HSV-1 | 1000 | Minami et al. 2003, [44] |
| Blauer Eukalyptus | Eucalyptus globulus | HSV-1/HSV-2 | 90/80 | Schnitzler et al. 2001, [56] |
| Ysop | Hyssopus officinalis | HSV-1/HSV-2 | 1/6 | Schnitzler et al. 2007, [54] |
| Sternanis | Illicium verum | HSV-1/HSV-2 | 40/30 | Koch et al. 2008, [36] |
| Wacholder | Juniperus oxycedrus | HSV-1 | 200 | Loizzo et al. 2008, [41] |
| Großer Speik | Lavandula latifolia | HSV-1 | 10.000 | Garcia et al. 2003, [24] |
| Südseemyrte | Leptospermum scoparium | HSV-1/HSV-2 | 1/0,6 | Reichling et al. 2005, [47] |
| Kamille | Matricaria recutita | HSV-1/HSV-2 | 0,3/1,5 | Koch et al. 2008, [36] |
| Teebaum | Melaleuca alternifolia | HSV-1/HSV-2 | 9/8 | Schnitzler et al. 2001, [56] |
| Melisse | Melissa officinalis | HSV-1/HSV-2 | 4/0,8 | Schnitzler et al. 2008, [57] |
| Pfefferminze | Mentha piperita | HSV-1/HSV-2 | 20/8 | Schumacher et al. 2003, [58] |
| Majoran | Origanum majorana | HSV-1 | 10.000 | Garcia et al. 2003, [24] |
| Bergkiefer | Pinus mugo | HSV-1/HSV-2 | 7/7 | Koch et al. 2008, [36, 38] |
| Rosmarin | Rosmarinus officinalis | HSV-1 | 10.000 | Minami et al. 2003, [44] |
| Weißes Sandelholz | Santalum album | HSV-1/HSV-2 | 2/5 | Schnitzler et al. 2007, [54] |
| Heiligenkraut | Santolina insularis | HSV-1/HSV-2 | 1/1 | De Logu et al. 2000, [19] |
| Thymian | Thymus vulgaris | HSV-1/HSV-2 | 10/7 | Schnitzler et al. 2007, [54] |
| Ingwer | Zingiber officinale | HSV-1/HSV-2 | 2/1 | Schnitzler et al. 2007, [54] |
IC 50 50% inhibitorische Konzentration.

Der potenzielle antivirale Effekt ätherischer Öle gegen HSV wurde in vitro mit Plaquereduktionstests bestimmt. Serielle Verdünnungsreihen dieser Öle wurden hierbei eingesetzt, die infizierten Zellen anschließend mit Methylzellulose überschichtet und für 3 Tage bei 37°C inkubiert. Diejenige Konzentration des Pflanzenprodukts, die die Infektion um 50% reduzierte (IC50), wurde aus diesen Verdünnungsreihen bestimmt. Eine klare dosisabhängige Wirkung konnte eindeutig nachgewiesen werden. Bei Melissenöl konnte eine IC50 von 0,0004% für HSV-1 und 0,00008% für HSV-2 analysiert werden. Melissenöl inhibierte die Plaquebildung von Herpesviren bei einer Konzentration von 0,002% um 98,8% für HSV-1 und um 97,2% für HSV-2. Bei höheren Konzentrationen dieses Öls war die Virusvermehrung nahezu vollständig gehemmt.
Ätherische Öle von Melisse, Pfefferminze, und Thymian waren nicht nur gegen aciclovirsensitive HSV-1-Stämme wirksam, sondern zeigten eine gleich starke Aktivität gegen aciclovirresistente Herpesstämme, die von Patienten nach langer Aciclovirtherapie isoliert wurden (Abb. 2). Aciclovir zeigt nur noch Wirkung gegen empfindliche HSV-Stämme. Diese besondere Eigenschaft und Überlegenheit über synthetische hergestellte Medikamente der Pflanzenprodukte erscheint für die Behandlung von resistenten Herpesviren sehr vielversprechend [36, 37, 38, 47, 55].
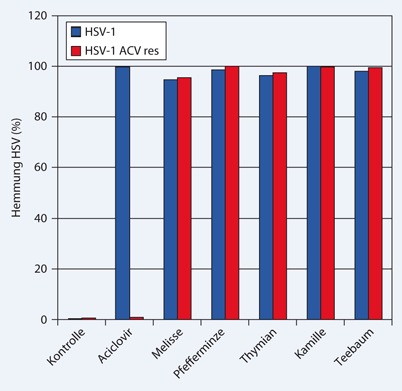
Ein wichtiger Gesichtspunkt bei der Untersuchung von Pflanzenprodukten mit antiherpetischem Effekt ist deren Wirkmechanismus. Das klassische Virostatikum Aciclovir ist ein Nukleosidanalogon, das in herpesinfizierten Zellen bei der Neusynthese von HSV-DNA eingebaut wird und zum Kettenabbruch der HSV-DNA führt. Zur Aufklärung des Wirkmechanismus von Melissenöl wurde dieses Pflanzenprodukt mit Zellen vor der Virusinfektion inkubiert, Viren wurden mit Melissenöl inkubiert und anschließend empfängliche Zellen infiziert, Zellen wurden gleichzeitig mit Herpesviren und Melissenöl inkubiert oder bereits infizierte Zellen wurden erst während der intrazellulären Replikation mit Melissenöl behandelt. Dieses Verfahren erlaubt Rückschlüsse darauf, welcher Teilschritt der Virusvermehrung gehemmt wird.
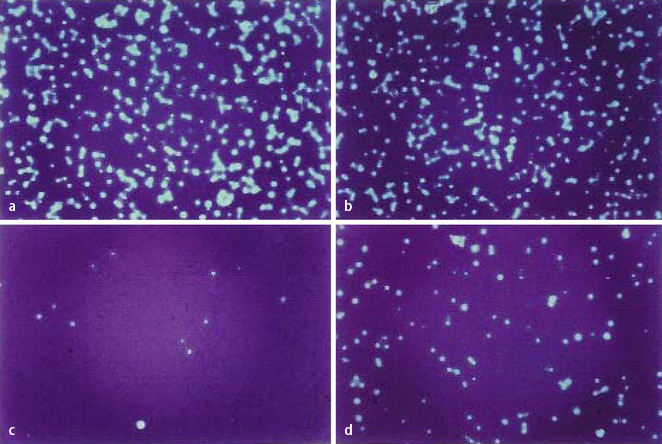
Wie in Abb. 3 dargestellt, ist ein deutlicher antiviraler Effekt zu verzeichnen, wenn Herpesviren gemeinsam mit Melissenöl inkubiert werden. Infizierte Zellen sterben ab, nach Färbung des Zellrasens werden dann helle Plaques sichtbar. Die Zugabe von Melissenöl erfolgte zu verschiedenen Zeitpunkten im viralen Replikationszyklus. Bei Inkubation von Herpesviren mit Melissenöl vor dem Eindringen in die Zellen ist die Virusvermehrung um über 98% gehemmt, was sich durch eine geringe Anzahl an Plaques im Zellrasen widerspiegelt (Abb. 3 c). Melissenöl, andere ätherische Öle sowie wässrige und ethanolische Pflanzenprodukte entfalten ihre maximale antivirale Wirkung durch eine direkte Interaktion mit Viruspartikeln und verhindern somit das Attachment der Viren an die Zellen und/oder unterbinden das Eindringen der Viren in die Zellen. Dieser Wirkmechanismus unterscheidet sich grundlegend von der Wirkung synthetischer Produkte, die erst zu einem späteren Zeitpunkt der Infektion wirksam sind.
Elektronenmikroskopisch wurde die viruzide Eigenschaft des ätherischen Öls aus Oregano direkt nachgewiesen
Ein Teil der genannten Pflanzenprodukte besitzt darüber hinaus viruzide Eigenschaften. In einer elektronenmikroskopischen Untersuchung wurde die viruzide Eigenschaft des ätherischen Öls aus Oregano direkt nachgewiesen [60]. Dieses ätherische Öl zerstört die Lipidhülle von Herpesviren, somit können diese Viren nicht mehr an Zellen binden und verlieren dadurch ihre Infektiosität. Erfreulicherweise sind diese antiviralen Effekte bei sehr geringen Konzentrationen der Pflanzenprodukte nachweisbar. Und ein hoher Wirkungsgrad bei niedriger Konzentration des Pflanzenprodukts und niedriger Toxizität ist eine wichtige Voraussetzung für die klinische Anwendung [46, 55]. Viele Studien zu ätherischen Ölen zur Wirksamkeit gegen andere Viren zeigen ähnliche Ergebnisse [21, 24, 29, 43, 60]. Darüber hinaus blockieren ätherische Öle auch die Ausbreitung der Viren von Zelle zu Zelle [19, 51].
Antiherpetische Wirkung von isolierten Pflanzenmetaboliten
Ätherische Öle bestehen aus mehr als 50 flüchtigen Einzelsubstanzen. Zur antiherpetischen Wirkung tragen unterschiedliche Substanzen mit unterschiedlichen Strukturen bei [3, 9, 35]. Die meisten Substanzen in ätherischen Ölen zählen zu den Monoterpenen, Sesquiterpenen und Phenylpropanen. Eine Auswahl wichtiger Monoterpene ist in Abb. 4 dargestellt. Ähnlich wie bei ätherischen Ölen wurde eine starke Interaktion dieser Substanzen mit Herpesviren nachgewiesen, die zur Hemmung der Infektionen mit HSV-1 und HSV-2 führt [3, 4]. Die antiherpetische Wirkung einiger Substanzen wurden in zahlreichen Untersuchungen belegt [1, 9, 32, 33, 35, 44, 64].

Die Wirksamkeit von Monoterpenen gegen HSV-1 ist in Abb. 5 dargestellt. Im Gegensatz zu ätherischen Ölen besitzen eine Vielzahl isolierter Monoterpene eine mittlere bis hohe Toxizität, sodass der therapeutische Einsatz einiger Einzelsubstanzen eher fraglich erscheint. In einer neueren Studie [7] wurde gezeigt, dass Eugenol aus Nelkenöl viruzid gegen HSV wirkt, ebenfalls konnte ein synergistischer Effekt mit Aciclovir festgestellt werden [64]. Eugenol verzögerte eine herpesbedingte Keratitis bei Mäusen [7]. Die Applikation von 1,8-Cineol und Eugenol schützte Mäuse vor Genitalherpes [9]. Der Wirkmechanismus von ätherischen Ölen Monoterpenen und Sesquiterpenen ist in Abb. 6 schematisch dargestellt.


Die Wirksamkeit von ätherischen Ölen wurde auch bei einem breiten Spektrum anderer Viren getestet. Das ätherische Öl von Houttuynia cordata, einer Heilpflanze aus Japan und China, ist viruzid gegen Herpes-simplex-Virus, Influenzavirus und HIV, jedoch nicht gegen unbehüllte Polioviren [28, 29]. Für die viruzide Aktivität waren v. a. die Komponenten Methyl-n-nonyl-Keton, Laurylaldehyd und Caprylaldehyd verantwortlich. Kürzlich wurden auch die ätherischen Öle von Ridolfia segetum und Oenanthe crocata auf ihre Aktivität gegen das Schlüsselenzym reverse Transkriptase von HIV untersucht, beide Öle sind hoch wirksam gegen dieses Enzym [8]. Wässrige Extrakte aus Pfefferminze und Melisse zeigen ebenfalls Anti-HIV-Aktivität in vitro [25]. In einer Übersichtsarbeit wurden kürzlich Naturprodukte beschrieben, die auch gegen resistente HIV wirken [30]. Das Influenzavirus wird durch das ätherische Öl von Cynanchum stauntonii inhibiert, die IC50 liegt bei 64 µg/ml. Bei mit Influenza infizierten Mäusen konnte ebenfalls eine dosisabhängige Wirkung dieses ätherischen Öls nachgewiesen werden.
Garcia et al. [24] untersuchten ätherische Öle von 8 verschiedenen Pflanzen aus Argentinien auf viruzide Effekte. Ätherische Öle aus Lippia junelliana und Lippia turbinata sind hoch wirksam gegen das Junin-Virus, zeigten aber keine Wirkung gegen HSV. Die Plaquebildung durch das Dengue-Virus wurde durch das ätherische Öl von Artemisia douglasiana und Eupatorium patens signifikant reduziert. Das Öl von Laurus nobilis wird in der traditionellen Medizin bei Rheuma eingesetzt. Loizzo et al. [41] ist es gelungen, eine antivirale Aktivität gegen das SARS-Coronavirus (SARS: schweres akutes respiratorisches Syndrom) nachzuweisen, jedoch ist der Selektivitätsindex eher niedrig.
Klinische Studien
Bereits vor über 10 Jahren wurde in einer Studie die antibakterielle Wirksamkeit von Teebaumöl bei Patienten nachgewiesen, die mit multiresistenten Staphylokokken (MRSA) infiziert waren [12]. Mehrere klinische Studien zur Behandlung von Lippenherpes mit Pflanzenprodukten wurden bereits durchgeführt [42, 52]. Jedoch gibt es nur wenige klinische Studien zur antiherpetischen Wirksamkeit von ätherischen Ölen. Eine randomisierte placebokontrollierte Studie wurde mit einem Gel zur Behandlung von Lippenherpes durchgeführt, das 6% Teebaumöl enthielt [10]. Die mittlere Zeit bis zur Reepitheliasierung nach Behandlung mit Teebaumöl betrug 9 Tage, bei Verwendung von Placebo waren dies 12,5 Tage. Dies spricht für einen Nutzen für die Patienten bei der Verwendung von Teebaumöl zur Behandlung des Lippenherpes. Teebaumöl stellt eine preisgünstigere Alternative zu gängigen synthetischen Produkten dar, die Gefahr von resistenten Virusstämmen erscheint deutlich niedriger. Darüber hinaus berichten sehr viele Patienten über einen schmerzlindernden Effekt bei der Anwendung von ätherischen Ölen, der bei schmerzhaftem Lippenherpes nicht unterschätzt werden sollte.
Teebaumöl stellt eine günstigere Alternative zu gängigen synthetischen Produkten dar
Eukalyptusöl wird traditionell zur Behandlung von Pharyngitis, Bronchitis und Sinusitis angewendet. In einer weiteren Studie wurden bei Patienten mit respiratorischen Infekten Adenoviren und Mumpsviren nachgewiesen; Eukalyptusöl war bei diesen Patienten zwar wirksam gegen die behüllten Mumpsviren, aber wenig wirksam gegen die unbehüllten Adenoviren [13]. Nicht nur bei ätherischen Ölen, sondern auch bei anderen Pflanzenprodukten gelang der Nachweis antiviraler Potenz; bei zahlreichen klinischen Studien wurden ebenfalls gute therapeutische Erfolge verzeichnet [42].
Viele klinische Studien mit Pflanzenprodukten gegen Genitalherpes wurden zwischen 1970 und 1980, also vor Einführung von Aciclovir durchgeführt. CYSTUS052, ein Pflanzenextraxt aus Cistus incanus, der reich an Polyphenolen ist, wirkt ausgezeichnet bei mit Influenza infizierten Mäusen und lindert die Symptomatik bei Patienten mit einem Infekt der oberen Atemwege [20, 34]. In einer randomisierten Studie wurden 66 Patienten, die im Jahr mindestens 4 Episoden von Lippenherpes aufwiesen, mit einem standardisierten Melissenblattextrakt (Lomaherpan®) behandelt. Die Melissencreme wurde 4-mal täglich für 5 Tage auf die befallenen Areale aufgetragen. Ein therapeutischer Effekt gegen Lippenherpes wurde in dieser Studie mit Melissencreme festgestellt, zytotoxische oder hautreizende Nebenwirkungen sind nicht aufgetreten [39]. In einer weiteren klinischen Studie konnten mit einem Extrakt aus Salbei und Rhabarber ebenfalls gute Erfolge bei Patienten mit Lippenherpes erzielt werden [52]. Jedoch sind weitere kontrollierte Studien mit größeren Fallzahlen notwendig, um die Wirksamkeit bei Lippenherpes genauer zu untersuchen.
Fazit für die Praxis
Verschiedene Pflanzenprodukte sind wirksam bei bakteriellen, fungalen oder viralen Infekten, z. B. gegen Herpes-simplex-Virus Typ 1.
Durch Destillationsverfahren können aus aromatischen Heilpflanzen ätherische Öle isoliert werden, die aus einer Vielzahl von Monoterpenen, Sesquiterpenen und Phenylpropanen bestehen.
Teilweise besitzen diese Öle auch eine viruzide Aktivität.
Monoterpene und Sesquiterpene aus diesen ätherischen Ölen sind zwar ebenfalls wirksam gegen Herpesviren, kommen aber aufgrund ihrer Toxizität weniger für eine klinische Applikation in Frage.
Melissenöl, Teebaumöl und Pfefferminzöl zeigen in vitro eine deutliche antiherpetische Wirksamkeit.
Auch gegen aciclovirresistente Herpesstämme sind diese Öle wirksam, da das Wirkprinzip der natürlichen Substanzen sich grundlegend vom Wirkmechanismus der synthetischen Produkte unterscheidet.
In klinischen Studien konnte für Teebaumöl eine infektionshemmende Eigenschaft nachgewiesen werden.
Zur Therapie herpetischer Infektionen wird die 3- bis 4-malige topische Applikation verdünnter ätherischer Öle empfohlen.
Acknowledgments
Interessenkonflikt
Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Allahverdiyev Phytomedicine. 2004;11:657. doi: 10.1016/j.phymed.2003.07.014. [DOI] [PubMed] [Google Scholar]
- 2.Armaka Antiviral Res. 1999;43:79. doi: 10.1016/S0166-3542(99)00036-4. [DOI] [PubMed] [Google Scholar]
- 3.Astani Phytother Res. 2010;24:673. doi: 10.1002/ptr.2955. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Astani A, Reichling J, Schnitzler P (2009) Screening for antiviral activities of isolated compounds from essential oils. Evid Based Compl Altern Med Article ID nep187, 8 pages, DOI:10.1155/2009/nep187 [DOI] [PMC free article] [PubMed]
- 5.Bacon Clin Microbiol Rev. 2003;16:114. doi: 10.1128/CMR.16.1.114-128.2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Balfour N Engl J Med. 1999;340:1255. doi: 10.1056/NEJM199904223401608. [DOI] [PubMed] [Google Scholar]
- 7.Benencia Phytother Res. 2000;14:495. doi: 10.1002/1099-1573(200011)14:7<495::AID-PTR650>3.0.CO;2-8. [DOI] [PubMed] [Google Scholar]
- 8.Bicchi Planta Med. 2009;75:1331. doi: 10.1055/s-0029-1185546. [DOI] [PubMed] [Google Scholar]
- 9.Bourne Antiviral Res. 1999;42:219. doi: 10.1016/S0166-3542(99)00020-0. [DOI] [PubMed] [Google Scholar]
- 10.Carson J Antimicrob Chemother. 2001;48:450. doi: 10.1093/jac/48.3.450. [DOI] [PubMed] [Google Scholar]
- 11.Carson Clin Microbiol Rev. 2006;19:50. doi: 10.1128/CMR.19.1.50-62.2006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Caelli J Hosp Infect. 2000;46:236. doi: 10.1053/jhin.2000.0830. [DOI] [PubMed] [Google Scholar]
- 13.Cermelli Curr Microbiol. 2008;56:89. doi: 10.1007/s00284-007-9045-0. [DOI] [PubMed] [Google Scholar]
- 14.Corey N Engl J Med. 1986;314:686. doi: 10.1056/NEJM198603133141105. [DOI] [PubMed] [Google Scholar]
- 15.Cos J Ethnopharmacol. 2006;106:290. doi: 10.1016/j.jep.2006.04.003. [DOI] [PubMed] [Google Scholar]
- 16.Cowan Clin Microbiol Rev. 1999;12:564. doi: 10.1128/cmr.12.4.564. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Cunningham J Inf Dis. 2006;194:S11. doi: 10.1086/505359. [DOI] [PubMed] [Google Scholar]
- 18.De Nature Rev. 2002;1:13. doi: 10.1038/nrd703. [DOI] [Google Scholar]
- 19.De Antiviral Res. 2000;48:177. doi: 10.1016/S0166-3542(00)00127-3. [DOI] [PubMed] [Google Scholar]
- 20.Droebner Antiviral Res. 2007;76:1. doi: 10.1016/j.antiviral.2007.04.001. [DOI] [PubMed] [Google Scholar]
- 21.Duschatzky Antivir Chem Chemother. 2005;16:247. doi: 10.1177/095632020501600404. [DOI] [PubMed] [Google Scholar]
- 22.Freeman EE, Weiss HA, Glynn JR et al (2006) Herpes simplex virus 2 infection increases HIV acquisition in men and women: systematic review and meta-analysis of longitudinal studies. AIDS 73–83 [DOI] [PubMed]
- 23.Furneri J Antimicrob Chemother. 2006;58:706. doi: 10.1093/jac/dkl269. [DOI] [PubMed] [Google Scholar]
- 24.Garcia Phytother Res. 2003;17:1073. doi: 10.1002/ptr.1305. [DOI] [PubMed] [Google Scholar]
- 25.Geuenich Retrovirology. 2008;5:27. doi: 10.1186/1742-4690-5-27. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Gilbert Herpes. 2007;14:56. [PubMed] [Google Scholar]
- 27.Hammer J Appl Microbiol. 1999;86:985. doi: 10.1046/j.1365-2672.1999.00780.x. [DOI] [PubMed] [Google Scholar]
- 28.Hayashi J Antimicrob Chemother. 1996;37:759. doi: 10.1093/jac/37.4.759. [DOI] [PubMed] [Google Scholar]
- 29.Hayashi Planta Med. 1995;61:237. doi: 10.1055/s-2006-958063. [DOI] [PubMed] [Google Scholar]
- 30.Hupfeld In vivo. 2009;23:1. [PubMed] [Google Scholar]
- 31.Inouye J Antimicrob Chemother. 2001;47:565. doi: 10.1093/jac/47.5.565. [DOI] [PubMed] [Google Scholar]
- 32.Jassim J Appl Microbiol. 2003;95:412. doi: 10.1046/j.1365-2672.2003.02026.x. [DOI] [PubMed] [Google Scholar]
- 33.Kalemba Curr Med Chem. 2003;10:813. doi: 10.2174/0929867033457719. [DOI] [PubMed] [Google Scholar]
- 34.Kalus Phytother Res. 2010;24:96. doi: 10.1002/ptr.2876. [DOI] [PubMed] [Google Scholar]
- 35.Khan MT, Ather A, Thompson KD, Gambari R (2005) Extracts and molecules from medicinal plants against herpes simplex viruses. Antiviral Res 107–119 [DOI] [PubMed]
- 36.Koch J Pharm Pharmacol. 2008;60:1545. doi: 10.1211/jpp.60.11.0017. [DOI] [PubMed] [Google Scholar]
- 37.Koch Phytomedicine. 2008;15:71. doi: 10.1016/j.phymed.2007.09.003. [DOI] [PubMed] [Google Scholar]
- 38.Koch C, Reichling J, Schnitzler P (2008) Essential oils inhibit the replication of herpes simplex virus type 1 (HSV-1) and type 2 (HSV-2). In: Preedy VR, Watson RR (Hrsg) Botanical medicine in clinical practice. CAB International, Wallingford, United Kingdom, S 192–197
- 39.Koytchev Phytomedicine. 1999;6:225. doi: 10.1016/S0944-7113(99)80013-0. [DOI] [PubMed] [Google Scholar]
- 40.Lis-Balchin (2006) Aromatherapy science – a guide for healthcare professionals. Pharmaceutical Press, London Chicago
- 41.Loizzo Chem Biodivers. 2008;5:461. doi: 10.1002/cbdv.200890045. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Martin Antiviral Ther. 2003;8:77. [Google Scholar]
- 43.Meneses Ann Clin Microbiol Antimicrob. 2009;8:8. doi: 10.1186/1476-0711-8-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Minami Microbiol Immunol. 2003;47:681. doi: 10.1111/j.1348-0421.2003.tb03431.x. [DOI] [PubMed] [Google Scholar]
- 45.Mukhtar Virus Res. 2008;131:111. doi: 10.1016/j.virusres.2007.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Reichling J (2007) Experimentelle Belege zur antimikrobiellen Wirkung von ausgewählten ätherischen Ölen. In: Steflitsch M, Steflitsch W (Hrsg) Aromatherapie – Wissenschaft – Klinik – Praxis. Springer Wien, New York, S 181–189
- 47.Reichling Planta Med. 2005;71:1123. doi: 10.1055/s-2005-873175. [DOI] [PubMed] [Google Scholar]
- 48.Reichling Nat Prod Commun. 2006;1:1003. [Google Scholar]
- 49.Reichling Forsch Komplementmed. 2009;16:79. doi: 10.1159/000207196. [DOI] [PubMed] [Google Scholar]
- 50.Reusser J Hosp Infect. 1996;3:235. doi: 10.1016/S0195-6701(96)90010-9. [DOI] [PubMed] [Google Scholar]
- 51.Saddi Ann Clin Microbiol Antimicrob. 2007;6:1. doi: 10.1186/1476-0711-6-10. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Saller Forsch Komplementmed Klass Naturheilkd. 2001;8:373. doi: 10.1159/000057255. [DOI] [Google Scholar]
- 53.Schäfer UF, Schneele J, Schmitt S, Reichling J (2008) Efficacy, absorption, and safety of essential oils. In: Walters HA, Roberts MS (Hrsg) Dermatologic, cosmeceutic, and cosmetic development – therapeutic and novel approaches. Informa Healthcare, New York London, S 401–418
- 54.Schnitzler Antimicrob Agents Chemother. 2007;51:1859. doi: 10.1128/AAC.00426-06. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 55.Schnitzler Phytomedicine. 2007;15:62. doi: 10.1016/j.phymed.2007.11.013. [DOI] [Google Scholar]
- 56.Schnitzler Pharmazie. 2001;56:343. [Google Scholar]
- 57.Schnitzler Phytomedicine. 2008;15:734. doi: 10.1016/j.phymed.2008.04.018. [DOI] [PubMed] [Google Scholar]
- 58.Schuhmacher Phytomedicine. 2003;10:504. doi: 10.1078/094471103322331467. [DOI] [PubMed] [Google Scholar]
- 59.Serkedjieva Basic Life Sci. 1992;59:705. doi: 10.1007/978-1-4615-3476-1_42. [DOI] [PubMed] [Google Scholar]
- 60.Siddiqui Med Sci Res. 1996;24:185. [Google Scholar]
- 61.Smith J Inf Dis. 2002;186:S3. doi: 10.1086/343739. [DOI] [PubMed] [Google Scholar]
- 62.Stranska J Clin Virol. 2005;32:7. doi: 10.1016/j.jcv.2004.04.002. [DOI] [PubMed] [Google Scholar]
- 63.Tolo J Ethnopharmacol. 2006;104:92. doi: 10.1016/j.jep.2005.08.053. [DOI] [PubMed] [Google Scholar]
- 64.Tragoolpua Phytother Res. 2007;21:1153. doi: 10.1002/ptr.2226. [DOI] [PubMed] [Google Scholar]


