Zusammenfassung
Infektionen spielen bei Organtransplantierten eine große Rolle als mögliche Komplikationen. Hierbei sind Infektionen mit Viren, Bakterien, Pilzen und Parasiten möglich. Die Häufigkeit einzelner Erkrankungen ist auch vom transplantierten Organ abhängig. Die Morphologie der Entzündungsreaktion ist meist durch das schädigende Agens vorgegeben, wobei jedoch häufig verschiedene Reaktionsformen auf den gleichen Erreger möglich sind und verschiedene Erreger die gleiche Reaktionsform bedingen können. Die Histologie gestattet daher nur in wenigen Fällen eine konkrete Bestimmung des Erregers, sodass eine zusätzliche mikrobiologische Erregerdiagnostik erforderlich ist. Das Ergebnis dieser Diagnostik sollte dem Pathologen mitgeteilt werden, damit eine Abgrenzung von infektionsbedingten Veränderungen gegenüber einer Abstoßungsreaktion möglich wird.
Schlüsselwörter: Infektionskrankheiten, Virusinfektionen, Transplantatabstoßung, Pathologie, Mikrobiologie
Abstract
Infections play a crucial role in organ transplantations as possible complications. Viruses, bacteria, fungi and parasites are potential agents. The relevance of individual diseases depends on the organ transplanted. Morphology of the inflammatory reaction is given by the agent involved, but often several reactions can be caused by the same agent and different agents can also lead to the same reaction. Histology therefore provides concrete identification of the causal agent only in some cases, such that additional microbiological diagnostics are necessary. Results from these investigations should be transferred to the pathologist to distinguish between infection-associated changes and transplant rejection.
Keywords: Infectious diseases, Virus infection, Transplant rejection, Pathology, Microbiology
Neben den perioperativen Komplikationen, der akuten und chronischen Abstoßungsreaktion und den im weiteren Verlauf gehäuft auftretenden Tumorerkrankungen stellen Infektionskrankheiten eine besondere Gefährdung von Organtransplantierten dar (Übersichten: [1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11]). Insbesondere seit der Einführung potenterer Immunsuppressiva ist das Risiko für Infektionen gestiegen und erfordert ein entsprechendes Screening sowohl des Spenders als auch des Empfängers sowie eine Prophylaxe gegen opportunistische Infektionen nach einer Transplantation [12]. Darüber hinaus müssen aufgrund des Organmangels zunehmend auch „marginale“ Organe z. B. mit präexistenten Infektionen akzeptiert werden, was das Risiko für entsprechende infektiologische Komplikationen im Einzelfall erhöht.
Die möglichen Erreger schließen das gesamte Spektrum von Viren, Bakterien, Pilzen und Parasiten ein, wobei jedoch aufgrund der Immunsuppression auch opportunistische Erreger eine große Bedeutung besitzen. Nicht selten kommen auch Mehrfachinfektionen mit unterschiedlichen Erregergruppen vor [13].
Infektionsdiagnostik
Das histologische Bild der Entzündung ist zumeist wegweisend für den einzelnen Erreger, jedoch sind häufig verschiedene Formen der Reaktion möglich [14]. Nur in einem Teil der Fälle kann der Erreger mikroskopisch sicher identifiziert werden. Die Immunhistochemie erlaubt häufig eine genusspezifische, aber keine speziesspezifische Einordnung. Die notwendige mikrobiologische Erregerdiagnostik kann daher nicht ersetzt werden, da eine Resistenztestung auf Antibiotika ebenfalls erforderlich ist. Ein Problem sind häufig auch adäquate Positiv- und Negativkontrollen für die Immunhistochemie, meist ergibt sich ein breites Feld mit Kreuzreaktionen, z. B. bei Treponemen und Brachyspiren (eigene Beobachtung bei HIV-Patienten). Gut geeignet für Kontrollen ist in der Regel experimentell infiziertes Material aus Organkulturen [15]. Die Immunfluoreszenzmikroskopie erlaubt über den Einsatz von Mehrfachmarkierungen eine exakte zelltyp- und organellenspezische Erregerlokalisation [16].
Zur Diagnostik kann auch am Gewebe die In-situ-Hybridisierung eingesetzt werden, die jedoch in der Handhabung einer entsprechenden Expertise mit dem Einsatz von geprüften Erregerstämmen als Kontrollen bedarf [17, 18]. Jedoch kann hier mit der Benutzung von eubakteriellen, genus- und speziesspezifischen Sonden ein hohes Maß an Präzision erreicht werden. Die molekularbiologische Untersuchung des histologischen Materials mit PCR- (Polymerase-Ketten-Reaktions-)Verfahren ist häufig möglich, jedoch schwierig [19]. In der Pathologie sind in der Regel nur wenige PCR-Anwendungen zur Bestimmung von Erregerspezies verfügbar. Falls jedoch nur Gewebematerial zur Verfügung steht, sollten der örtliche Mikrobiologe bzw. das zuständige Nationale Referenzzentrum konsultiert werden [20]. Vorraussetzung ist jedoch eine konkrete Vermutung zumindest hinsichtlich des Erregergenus. Weiterhin besteht die Möglichkeit der elektronenmikroskopischen Erregerdiagnostik auch am umgebetteten Formaldehyd-fixierten Material.
Primär unbekannte Erreger sollten immer mit einer Kombination von Verfahren abgeklärt werden [21]. Bei vermutetem Infektionsgeschehen, aber fehlendem Hinweis auf den verursachenden Erreger sollte immer auch Nativmaterial des entnommenen Gewebes für eventuelle weitere Untersuchungen asserviert werden.
Infektionsserologische Untersuchungsverfahren (Antigen- und Antikörpernachweise) besitzen innerhalb der Transplantationsmedizin zumindest in der Prätransplantationsdiagnostik einen hohen Stellenwert, da sie im Gegensatz zu histologischen Verfahren nicht organspezifisch begrenzt sind [3]. Ergänzt werden sie durch valide molekulargenetische Techniken. Schon im Vorfeld der Transplantation versucht man mithilfe der Labordiagnostik, Infektionsrisiken von Spender und Empfänger zu erkennen und nach Möglichkeit zu minimieren [z. B. Zytomegalievirus (CMV), humanes Immundefizienzvirus (HIV), Virushepatitiden, Lues, Toxoplasmose; [1, 2, 3]].
Weitere wichtige Indikationen sind:
Überwachungsuntersuchungen nach Transplantation,
frühzeitiges Erkennen von Reaktivierungen und von neuen Infektionen,
Abschätzen des antiinfektiven Therapieerfolgs.
Die Interpretation der Daten ist häufig sehr schwierig, da die Testsysteme verschiedener Hersteller nicht selten zu unterschiedlichen Aussagen führen. Klinik, Titerdynamik, Immunstatus und klinisch-chemische Parameter müssen in die Interpretation einfließen. Eine erregerspezifische Darstellung und Interpretation der sich hierbei ergebenden – z. T. sehr komplexen – Befundkonstellationen geht über den Rahmen dieser Darstellung weit hinaus.
Die Übertragung von Erregern kann von unterschiedlichen Quellen ausgehen (Tab. 1, [22, 23]). Hier sind zu nennen:
das Spenderorgan (z. B. CMV [24], Toxoplasmose [25, 26, 27]),
das Krankenhaus [nosokomiale Infektionen [22] mit typischen Erregern wie z. B. Methicillin-resistenten Staphylokokken (MRSA), Clostridium difficile [28]],
außerhalb der Klinik erworbene Infektionen (z. B. respiratorische Viren [29, 30]),
die Reaktivierung latenter endogener Erreger (z. B. Herpesviren [6], Mycobacterium tuberculosis [10]).
| Infektionsrisiko bei der Organtransplantation | ||
|---|---|---|
| Wahrscheinlicher Ursprung der Infektion | ||
| Nosokomial, technisch (Spender oder Empfänger) | Reaktivierte, rekurrierende, opportunistische Infektion | Nichtnosokomiale Infektion |
| Häufige Infektionen bei Organtransplantierten | ||
| Unter 1 Monat nach Transplantation | 1–6 Monate nach Transplantation | Über 6 Monate nach Transplantation |
|
Infektion mit resistenten Spezies: MRSA, VRE, Sprosspilze (Candida spp., nicht Candida albicans) Aspiration Katheterinfektion Wundinfektion Anastomosenleck und Ischämie Clostridium-difficile-Kolitis Spenderabhängige Infektion (selten): HSV, LCMV, Tollwut, West-Nil-Virus, HIV, Trypanosoma cruzi Empfängerabhängige Infektion (Kolonisation): Schimmelpilze (Aspergillen), Pseudomonas spp. |
Mit PCP- und antiviraler (CMV, HBV) Prophylaxe: Polyoma- (BK-)Infektion, -Nephropathie Clostridium-difficile-Colitis, HCV-, Adenovirus-, Influenzainfektion, Kryptokokkose (Cryptococcus neoformans), Mykobakteriosen (Tuberkulose) Anastomosenkomplikationen Ohne Prophylaxe: Pneumocystis; Herpesviren: VZV, CMV, EBV; HBV Infektionen mit Listeria, Nocardia, Toxoplasma gondii, Strongyloides stercoralis, Leishmania, Trypanosoma cruzi |
„Community-acquired pneumonia“, Harnwegsinfektionen Infektionen mit Aspergillus, seltenen Schimmelpilzen, Rhodococcus Späte Virusinfektionen: CMV-Infektion (Kolitis, Retinitis), Hepatitis (HBV, HCV), HSV-Enzephalitis, „community-acquired“ (SARS, West-Nil-Virus) JC-Polyomavirus Hautkrebs, Lymphome (PTLD) |
MRSA Methicillin-resistente Staphylokokken, VRE Vancomycin-resistente Enterokokken, HSVHerpes-simplex-Virus, LCMV lymphozytäres Choriomeningitisvirus, HIV humanes Immundefizienzvirus, PCPPneumocystis-jirovecii-Pneumonie, CMV Zytomegalievirus, HBV Hepatitis-B-Virus, HCV Hepatitis-C-Virus, VZV Varicella-zoster-Virus, EBV Epstein-Barr-Virus, SARS „sudden acute respiratiory syndrome“, PTLD „post transplant lymphoproliferative disorders“.
Die Infektionen beschränken sich nicht nur auf das übertragene Organ, sondern können z. B. in Form von septischen Krankheitsbildern jedes andere Organ in Mitleidenschaft ziehen [4]. Im ersten Monat nach Organtransplantation stehen nosokomiale Infektionen bei typischen chirurgischen, technischen und intensivmedizinischen Problemen – ähnlich wie bei anderen großen Eingriffen – im Vordergrund (Tab. 1). Danach dominieren – abhängig von der Immunitätslage – opportunistische Infektionen (mit z. B. Pneumocystis jirovecii [10, 31], Toxoplasma gondii [25, 27], Schimmelpilzen [32, 33, 13]).
Bei komplikationslosem Verlauf bestehen nach etwa einem halben Jahr erhöhte Risiken für nichtnosokomiale (z. B. respiratorische Viren, Pneumokokken) und chronische Infektionen. Bei Organtransplantierten besteht ebenfalls ein erhöhtes Risiko für Zoonosen [34]. Ferner ist zu beachten, dass jedes transplantierte Organ zusätzlich spezifische infektiologische Risiken (z. B. Mediastinitis bei Herztransplantationen, Harnwegsinfektionen bei Nierentransplantationen) aufweist [7, 8, 9].
Atemwegsinfektionen sind insbesondere bei Lungentransplantierten von Bedeutung, da sie eine Abstoßungsreaktion triggern können. Sie treten aber allgemein unter Immunsuppression gehäuft auf [10, 11]. Generell muss die Prävention oberste Priorität haben [2, 23].
Virusinfektionen
Zytomegalievirus
Das CMV infiziert in entwickelten Ländern etwa 60% der Erwachsenen und kann als intrauterine, perinatale und Kontaktinfektion erworben werden. Auch eine Übertragung durch Bluttransfusionen oder Transplantationen ist möglich. Bei jedem Individuum mit CMV-IgG-Antikörpern kann eine latente Virusinfektion reaktiviert werden. Bei seropositiven Personen ist eine Infektion mit einem anderen Stamm möglich. CMV führt bei Transplantierten zu einer Reihe von Erkrankungen. Die CMV-Pneumonie ist ein Hauptproblem nach Knochenmarktransplantationen, während sie bei anderen Organtransplantationen nicht im Vordergrund steht. Sind Symptome und Zeichen des betroffenen Organs mit dem Nachweis des Erregers in der Biopsie verknüpft, wird dies als CMV-Endorganerkrankung bezeichnet.
Risikofaktoren für eine Erkrankung sind eine Primärinfektion des Organempfängers und der Nachweis einer Virämie sowie eine hohe Viruslast nach der Transplantation. Die Virusreplikation an einem Ort kann die lokale Immunantwort durchbrechen und zu einer Virämie mit Aussaat in andere Organe führen [6, 7, 24].
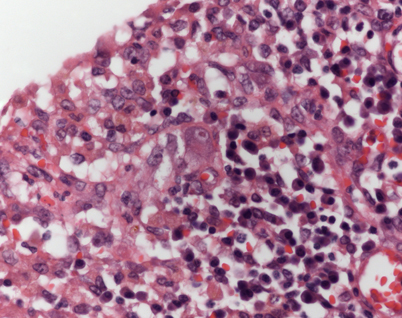
Histologisch findet sich hier in der Regel eine unterschiedlich ausgeprägte Entzündungsreaktion mit so genannten Eulenaugenzellen (Abb. 1), die immunhistochemisch unter Verwendung von Antikörpern gegen Virusantigene verifiziert werden kann. Dieses hat sich nach unserer Einschätzung als ausreichend erwiesen. Ein Einsatz der PCR am Paraffinmaterial ist möglich [24]. Aus klinischer Sicht sollte ergänzend eine Bestimmung der Viruslast erfolgen; bei hoher Viruslast wird in der Regel die Indikation zur Therapie gestellt.
Respiratorische Viren
Die respiratorischen Viren [humanes Metapneumovirus (hMPV), „respiratory syncytial virus“ (RSV), Parainfluenzaviren, Influenzaviren, Rhinoviren] werden auch bei Lungentransplantierten gefunden, hierbei sind die beiden erst genannten (hMPV, RSV) häufiger mit einem Bronchiolitis-obliterans-Syndrom (BOS) assoziiert [29, 30].
Mikroskopisch können eine akute Tracheobronchitis und Bronchiolitis sowie ein akuter Alveolarschaden gefunden werden [14]. In der Regel wird der Nachweis im Rahmen eines PCR- oder antigenbasierten Screenings durchgeführt. Antikörper gegen verschiedene Viren sind prinzipiell verfügbar [15, 16].
Polyomavirus
Die erste Polyomavirusinfektion eines Nierentransplantierten wurde 1971 nachgewiesen. Ungefähr 1–5% der Nierentransplantierten sind davon betroffen, wobei ein irreversibler Schaden in etwa 45% der Patienten resultiert [35, 36]. Mit der Einführung neuer Immunsuppressiva (Tacrolimus, Mycophenolatmofetil) wurde diese Infektion verstärkt vorwiegend bei Nierentransplantierten und Empfängern allogener hämatopoetischer Stammzellen beobachtet. Eine Reduktion der Immunsuppression ist hierbei die notwendige Maßnahme.
In der Urinzytologie und der Stanzbiopsie sind neben einer Entzündung charakteristische Einschlusskörper zu finden, die immunhistochemisch bestätigt werden können [36].
Andere Viren
In Einzelfällen können auch andere Viren bei Transplantierten relevant sein. So wurde über eine Parvovirus-B19-Infektion mit Anämie bei einer lungentransplantierten Patientin mit zystischer Fibrose und über eine West-Nil-Virus-induzierte Enzephalitis bei Nieren- und Pankreastransplantierten berichtet. Eine Parvovirus-B19-Infektion kann insbesondere auch zu einem Hämophagozytosesyndrom (HPS) führen. Weiterhin von großer Bedeutung sind Hepatitisviren, Herpes-simplex-Viren, Varicella-Zoster-Virus und HIV [6]. Die Übertragung von Tollwutviren gehört sicher zu den Raritäten [37].
Eine besondere Rolle nimmt noch das Epstein-Barr-Virus (EBV) ein, da eine Infektion mit EBV zu verschiedenen lymphoproliferativen Erkrankungen („post transplant lymphoproliferative disorders“, PTLD) führen kann [38]. EBV kann mit Erfolg immunhistochemisch nachgewiesen werden.
Bakterielle Infektionen
Während der postoperativen Phase spielt vor allem die patienteneigene Besiedelung von Haut und Schleimhäuten eine herausragende Rolle, insbesondere nach Lungentransplantation bei Mukoviszidosepatienten [11]. Überwinden diese Keime ihre natürlichen Schranken (unspezifische Abwehr), kann es zu Organ- und Wundinfektionen oder sogar zu einer Sepsis kommen [4]. Verschärft wird das Infektionsgeschehen durch nosokomial erworbene Erreger, die sich oftmals durch antibiotische Multiresistenz auszeichnen und dadurch die therapeutischen Möglichkeiten stark begrenzen [3, 5, 13, 22]. Beispiele sind multiresistente gramnegative Stäbchen (z. B. Enterobacter sp., Stenotrophomonas sp., Pseudomonas sp.) und grampositive Kokken [Vancomycin-resistente Enterokokken (VRE), MRSA-Stämme].
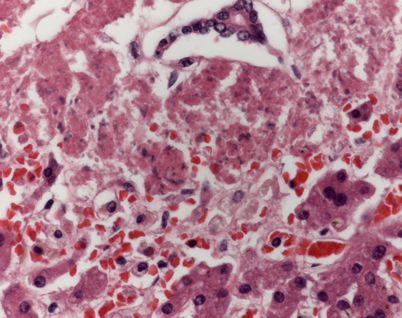
Zu den opportunistischen Erregern, die bei Immunkompetenten selten zu Infektionen führen, zählen z. B. atypische Mykobakterien (Abb. 2) wie Mycobacterium abscessus. Infektionen werden meist bei Lungentransplantierten beobachtet; aber auch bei Nieren-, Herz- und Multiorgantransplantierten, insbesondere bei einer zusätzlich bestehenden Lungenerkrankung wie einer chronisch obstruktiven Atemwegserkrankung (COPD) wurden diese gesehen [39]. Die pleuropulmonale Manifestation ist die häufigste, danach rangieren das kutane und das disseminierte Vorkommen.
Weiterhin müssen an dieser Stelle Infektionen mit Listerien [40], Nocardien [41], Legionellen [42] und die klinisch bedeutungsvolle Diarrhö durch Clostridium difficile [28] genannt werden. Auch über Infektionen mit Leuconostoc pseudomesenteroides [43], Rhodococcus equi [44], Leptospiren [45] und Pasteurella multocida [46] wurde bei Organtransplantierten berichtet.
Das histologische Bild entspricht dem Typ der jeweiligen Infektion mit akzeleriertem Verlauf. Bei Nocardiosen findet sich in der Ziehl-Neelsen-Färbung eine charakteristische geflechtartige Anordnung der Erreger [47]. Immunhistochemische Verfahren spielen in der Routinediagnostik bakterieller Infektionen keine Rolle. Mit der In-situ-Hybridisierung ist häufig eine weitergehende Einordnung möglich [17, 18]. Der Schwerpunkt liegt bei der Erregerkultur, wobei jedoch die unterschiedlichen Anforderungen der Keime hinsichtlich der Anzuchtbedingungen zu berücksichtigen sind.
Pilz- und Algeninfektionen
Ein erhöhtes Risiko für systemische Pilzinfektionen wird generell bei immunsupprimierten Patienten beobachtet [32, 33]. Der dominierende Erregertyp hängt hierbei vom transplantierten Organ ab. Bei Lebertransplantierten überwiegen Kandidosen, während Aspergillosen eher bei Lungentransplantierten vorkommen.
Aspergillosen
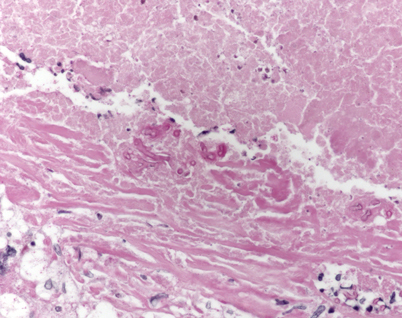
Während Aspergillosen im Obduktionsgut allgemein im einstelligen Prozentbereich vorkommen, wurden bei Immunsupprimierten (einschließlich der Organtransplantierten) in über 12% tödlich verlaufende invasive Aspergillus-Infektionen gesehen (Abb. 3). Diese werden nur zu 25% klinisch diagnostiziert [48]. Nach einer anderen Studie mit im Zentralnervensystem manifestierten Aspergillosen bei Transplantierten erfolgte die richtige Diagnose prämortal in 50%, ein zusätzlicher Diabetes mellitus bestand in 59%, und in 86% lagen zusätzlich bakterielle oder andere schwere Infektionen vor [49]. In einem Fall wurde die Übertragung einer invasiven Aspergillose von einem subklinisch infizierten Donor auf drei verschiedene Organempfänger (Herz und Nieren) berichtet [50].
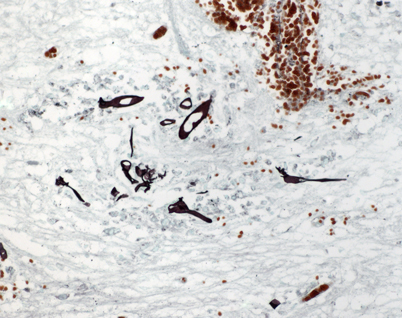
Hinsichtlich invasiver Kandidosen bei Herz- und Lungentransplantierten ist ein allgemeiner Rückgang der Erkrankungen feststellbar [51]. Weiter von Bedeutung sind Zygomykosen (Abb. 4, [52]), Kryptokokkosen [53] und Pneumozystosen (Abb. 5, [31]). Auch wurde über Koinfektionen von Nocardien und Aspergillen nach Nierentransplantation berichtet [54]. Weiterhin kommen Infektionen durch weniger bekannte opportunistische Pilze wie z. B. Scedosporium apiospermum vor [55].
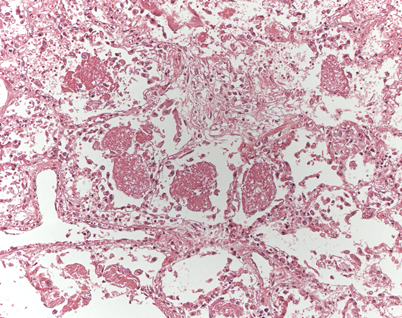
In Einzelfällen werden auch Algeninfektionen bei Transplantierten beobachtet [56]. Hierbei kann es zu lokalisierten oder systemischen Infektionen kommen. Meist bestehen zusätzliche Risikofaktoren; die Prognose ist ungünstig.
Histologisch werden bei Pilzinfektionen Abszesse oder chronische bzw. granulomatöse Infektionen gefunden [14]. Eine Kryptokokkose kann aufgrund der typischen Erregerstruktur in der Regel in der Hämatoxylin-Eosin- (HE-)Färbung hinreichend sicher diagnostiziert werden. Sehr hilfreich ist die Verwendung der Periodic-acid-Schiff- (PAS-)Reaktion und der Grocott-Färbung (Abb. 3, Abb. 4). Diese gestatten meist bereits die Unterscheidung von Kandidosen, Aspergillosen und Zygomykosen [57]. Zur Bestätigung einer Pneumocystis-Infektion kann die Immunhistochemie eingesetzt werden [58]. Eine immunhistochemische Differenzierung von Spross- und Schimmelpilzen ist möglich, wird jedoch nur von einigen Zentren praktiziert. Die PCR kann auch am Paraffinmaterial erfolgreich eingesetzt werden [59].
Parasitäre Infektionen
Toxoplasmose
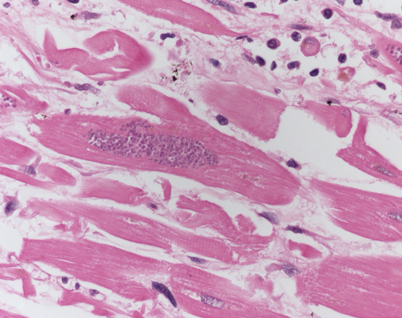
Toxoplasmosen treten regelmäßig bei Transplantierten auf. Insgesamt liegt eine hohe Durchseuchung mit Toxoplasma gondii vor. Bei manifesten Erkrankungen handelt es sich um vom Spender erworbene oder reaktivierte latente Infektionen [25, 35]. Prädilektionsorte sind insbesondere das Herz [9] und das Gehirn. Endomyokardbiopsien können hierbei mit einer gegenüber der Histologie gesteigerten Sensitivität auch für die PCR-Diagnostik eingesetzt werden [26]. Auch bei Nierentransplantierten kommen Toxoplasmosen vor. Häufig liegen ein Abstand zur Operation von 3 Monaten, allgemeine Zeichen einer Infektion und eine Übertragung vom Donor vor [27].
Histologisch entscheidend ist der Nachweis von Trophozoiten mit einer Entzündungsreaktion (Abb. 6). Die Immunhistochemie kann zur Bestätigung eingesetzt werden.
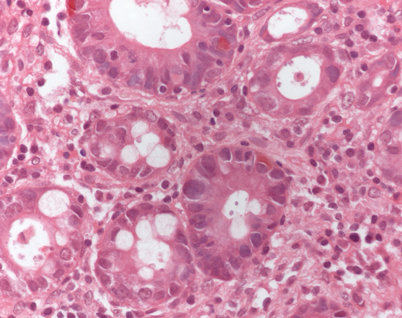
Auch Infektionen mit anderen Protozoen kommen vor. Hierbei sind die Amoebidae zu nennen, wobei Akanthamöben noch am häufigsten auftreten [50]. Mikroskopisch sind die Trophozoiten hierbei in einer Nekrose nachweisbar. Zu denken ist auch an Kryptosporidien (Abb. 7), die Malaria und weitere außereuropäische Protozoen sowie Wurminfektionen, wie z. B. Strongyloides stercoralis [4].
Fazit für die Praxis
Bei Organtransplantierten stellen Infektionen eine häufige Komplikation dar, die auch zu Lebzeiten nur in einem Teil der Fälle erkannt wird.
Differenzialdiagnostisch ist die Abgrenzung von einer Abstoßungsreaktion insbesondere klinisch relevant.
Wichtig sind die Prävention, eine adäquate histologische und Erregerdiagnostik sowie eine effektive sofortige Therapie, um einen Organverlust oder sogar einen fatalen Verlauf zu verhindern.
Acknowledgments
Interessenkonflikt
Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Fishman N Engl J Med. 2007;357:2601. doi: 10.1056/NEJMra064928. [DOI] [PubMed] [Google Scholar]
- 2.Fishman Infect Dis Clin North Am. 2010;24:273. doi: 10.1016/j.idc.2010.01.005. [DOI] [PubMed] [Google Scholar]
- 3.Mandell GL, Bennett JE, Dolin R (2005) Mandell, Douglas and Bennett’s principles and practice of infectious diseases. 6. Aufl. Elsevier Churchill Livingstone, Philadelphia
- 4.Kalil Curr Drug Targets. 2007;8:533. doi: 10.2174/138945007780362746. [DOI] [PubMed] [Google Scholar]
- 5.Lease Semin Respir Crit Care Med. 2010;31:234. doi: 10.1055/s-0030-1249119. [DOI] [PubMed] [Google Scholar]
- 6.Razonable Minerva Med. 2009;100:479. [PubMed] [Google Scholar]
- 7.Garbino Swiss Med Wkly. 2005;135:587. doi: 10.4414/smw.2005.10399. [DOI] [PubMed] [Google Scholar]
- 8.Sweny Saudi J Kidney Dis Transpl. 2006;17:189. [PubMed] [Google Scholar]
- 9.Stewart J Clin Pathol. 1991;44:803. doi: 10.1136/jcp.44.10.803. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Stewart Arch Pathol Lab Med. 2007;131:1219. doi: 10.5858/2007-131-1219-PIITP. [DOI] [PubMed] [Google Scholar]
- 11.Remund Proc Am Thorac Soc. 2009;6:94. doi: 10.1513/pats.200809-113GO. [DOI] [PubMed] [Google Scholar]
- 12.Mueller Transpl Infect Dis. 2008;10:379. doi: 10.1111/j.1399-3062.2008.00346.x. [DOI] [PubMed] [Google Scholar]
- 13.Tolkoff-Rubin J Am Soc Nephrol. 1992;2:S264. doi: 10.1681/ASN.V212s264. [DOI] [PubMed] [Google Scholar]
- 14.Connor DH, Chandler FW, Schwartz DA et al (1997) Pathology of infectious diseases. Appleton & Lange, Stamford
- 15.Ebsen Pathol Res Pract. 2002;198:747. doi: 10.1078/0344-0338-00331. [DOI] [PubMed] [Google Scholar]
- 16.Ebsen Virchows Arch. 2002;440:512. doi: 10.1007/s004280100534. [DOI] [PubMed] [Google Scholar]
- 17.Moter J Microbiol Methods. 2000;41:85. doi: 10.1016/S0167-7012(00)00152-4. [DOI] [PubMed] [Google Scholar]
- 18.Lefmann J Clin Microbiol. 2006;44:3760. doi: 10.1128/JCM.01435-06. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Schewe Pathologe. 2000;21:218. doi: 10.1007/s002920050391. [DOI] [PubMed] [Google Scholar]
- 20.Robert Koch-Institut: Nationale Referenzzentren. http://www.rki.de/cln_178/nn_205772/DE/Content/Infekt/NRZ/nrz__node.html?__nnn=true (Zugriff: 30.11.2010)
- 21.Theegarten Eur Respir J. 2002;19:192. doi: 10.1183/09031936.02.00682001. [DOI] [PubMed] [Google Scholar]
- 22.Sola Braz J Infect Dis. 2007;11:567. doi: 10.1590/S1413-86702007000600008. [DOI] [PubMed] [Google Scholar]
- 23.Angelis Liver Transpl. 2003;9:451. doi: 10.1053/jlts.2003.50094. [DOI] [PubMed] [Google Scholar]
- 24.Colina J Clin Pathol. 1995;48:351. doi: 10.1136/jcp.48.4.351. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Wreghitt J Clin Pathol. 1989;43:194. doi: 10.1136/jcp.42.2.194. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Holliman J Clin Pathol. 1992;45:931. doi: 10.1136/jcp.45.10.931. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Renoult Clin Infect Dis. 1997;24:625. doi: 10.1093/clind/24.4.625. [DOI] [PubMed] [Google Scholar]
- 28.Riddle Curr Opin Organ Transplant. 2008;13:592. doi: 10.1097/MOT.0b013e3283186b51. [DOI] [PubMed] [Google Scholar]
- 29.Milstone Eur Respir J. 2006;28:131. doi: 10.1183/09031936.06.00105505. [DOI] [PubMed] [Google Scholar]
- 30.Hopkins Am J Respir Crit Care Med. 2008;178:876. doi: 10.1164/rccm.200711-1657OC. [DOI] [PubMed] [Google Scholar]
- 31.Haidinger Transpl Infect Dis. 2009;11:171. doi: 10.1111/j.1399-3062.2009.00366.x. [DOI] [PubMed] [Google Scholar]
- 32.Richardson J Antimicrob Chemother. 2005;56:i5. doi: 10.1093/jac/dki218. [DOI] [PubMed] [Google Scholar]
- 33.Silveira Med Mycol. 2007;45:305. doi: 10.1080/13693780701200372. [DOI] [PubMed] [Google Scholar]
- 34.Kotton Clin Infect Dis. 2007;44:857. doi: 10.1086/511859. [DOI] [PubMed] [Google Scholar]
- 35.Gardner J Clin Pathol. 1984;37:578. doi: 10.1136/jcp.37.5.578. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Bonvoisin Transplantation. 2008;85:S42. doi: 10.1097/TP.0b013e318169c794. [DOI] [PubMed] [Google Scholar]
- 37.Maier Clin Infect Dis. 2010;50:1112. doi: 10.1086/651267. [DOI] [PubMed] [Google Scholar]
- 38.Carbone Oncologist. 2008;13:577. doi: 10.1634/theoncologist.2008-0036. [DOI] [PubMed] [Google Scholar]
- 39.Garrison Transpl Infect Dis. 2009;11:541. doi: 10.1111/j.1399-3062.2009.00434.x. [DOI] [PubMed] [Google Scholar]
- 40.Rettally Transplant Proc. 2003;35:1485. doi: 10.1016/S0041-1345(03)00510-4. [DOI] [PubMed] [Google Scholar]
- 41.Niehues Dtsch Med Wochenschr. 1996;121:1390. doi: 10.1055/s-2008-1043158. [DOI] [PubMed] [Google Scholar]
- 42.Lück J Med Microbiol. 2008;57:240. doi: 10.1099/jmm.0.47382-0. [DOI] [PubMed] [Google Scholar]
- 43.Tholpady Ann Transplant. 2010;15:61. [PubMed] [Google Scholar]
- 44.Rahamat-Langendoen Diagn Microbiol Infect Dis. 2009;65:427. doi: 10.1016/j.diagmicrobio.2009.08.004. [DOI] [PubMed] [Google Scholar]
- 45.Gerasymchuk Transpl Infect Dis. 2009;11:454. doi: 10.1111/j.1399-3062.2009.00415.x. [DOI] [PubMed] [Google Scholar]
- 46.Al-Sabah Transpl Infect Dis. 2007;9:233. doi: 10.1111/j.1399-3062.2006.00192.x. [DOI] [PubMed] [Google Scholar]
- 47.Borchers Dtsch Med Wochenschr. 2006;131:1085. doi: 10.1055/s-2006-941724. [DOI] [PubMed] [Google Scholar]
- 48.Boon J Clin Pathol. 1991;44:452. doi: 10.1136/jcp.44.6.452. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Torre-Cisneros J Neurol Neurosurg Psychiatry. 1993;56:188. doi: 10.1136/jnnp.56.2.188. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Keating Chest. 1995;109:1119. doi: 10.1378/chest.109.4.1119. [DOI] [PubMed] [Google Scholar]
- 51.Schaenman Transpl Infect Dis. 2009;11:112. doi: 10.1111/j.1399-3062.2009.00364.x. [DOI] [PubMed] [Google Scholar]
- 52.Harada Hawaii Med J. 2007;66:68. [PubMed] [Google Scholar]
- 53.Pasqualotto Nephrol Dial Transplant. 2005;20:2997. doi: 10.1093/ndt/gfh801. [DOI] [PubMed] [Google Scholar]
- 54.Carter J Natl Med Assoc. 1990;82:527. [PMC free article] [PubMed] [Google Scholar]
- 55.Sahi J Heart Lung Transplant. 2007;26:350. doi: 10.1016/j.healun.2007.01.011. [DOI] [PubMed] [Google Scholar]
- 56.Narita Liver Transpl. 2008;14:1211. doi: 10.1002/lt.21565. [DOI] [PubMed] [Google Scholar]
- 57.Sudhoff HNO. 2003;51:908. doi: 10.1007/s00106-003-0815-0. [DOI] [PubMed] [Google Scholar]
- 58.Theegarten Pneumologie. 1994;48:837. [PubMed] [Google Scholar]
- 59.Theegarten Pneumologie. 2010;64:S194. doi: 10.1055/s-0029-1243964. [DOI] [Google Scholar]
- 60.Vernon Transpl Infect Dis. 2005;7:154. doi: 10.1111/j.1399-3062.2005.00113.x. [DOI] [PubMed] [Google Scholar]
- 61.Barsoum Exp Clin Transplant. 2004;2:258. [PubMed] [Google Scholar]


