Zusammenfassung
Als Internist muss man damit rechnen, Erstbehandler eines Patienten mit selten importierter hochkontagiöser, lebensbedrohlicher Erkrankung zu sein. Dies kommt sicherlich nur äußerst selten vor, hat aber enorme Konsequenzen. Man sollte daher grundsätzlich die viralen hämorrhagischen Fieber kennen: Filoviren verursachen das Ebola- und Marburg-Fieber, Arenaviren das Lassa-Fieber und südamerikanische hämorrhagische Fieber, die Bunya-Viren u. a. das hämorrhagische Krim-Kongo-Fieber. Weiterhin sollte man einige hochkontagiöse respiratorische Infektionen wie das „hantavirus pulmonary syndrome“, die Lungenpest und das „Middle East respiratory syndrome“ kennen.
Schüsselwörter: Neu auftretende Infektionserkrankungen, Ausbruch, Zoonosen, Virale hämorrhagische Fieber, Atemwegsinfektionen
Abstract
Internists should expect to be the first contact for patients with rare, but highly contagious, life-threatening illnesses. Although certainly not encountered often, it is associated with significant consequences. Thus, physicians should be familiar with viral hemorrhagic fevers: filoviruses cause Ebola and Marburg fever, arenaviruses cause Lassa fever and South American hemorrhagic fevers, and the bunyaviruses cause among others Crimean–Congo hemorrhagic fever. Furthermore, physicians should be familiar with highly contagious respiratory infections, such as hantavirus pulmonary syndrome, pneumonic plague, and Middle East respiratory syndrome (MERS).
Keywords: Communicable diseases, emerging; Disease outbreaks; Zoonoses; Hemorrhagic fevers, viral; Respiratory tract infections
Lernziele
Nachdem Sie diese Lerneinheit absolviert haben,
wissen Sie, bei welchen Symptomen an ein virales hämorrhagisches Fieber zu denken ist.
welche anamnestischen Befunde bei Patienten mit respiratorischen Symptomen auf eine hochkontagiöse Erkrankung hindeuten.
kennen Sie seltene Erreger, die bei unklaren Symptomen nach Aufenthalten in abgelegenen tropischen Regionen und nach Tierkontakten differenzialdiagnostisch infrage kommen.
Hintergrund
Ende 2013 brach in mehreren westafrikanischen Ländern eine Ebola-Epidemie aus. Ende September 2014 wurde in den USA erstmals ein Fall von Ebola außerhalb Afrikas nachgewiesen, am 6. Oktober folgte die erste bestätigte Infektion in Spanien, am 29. Dezember 2014 der erste Fall im Vereinigten Königreich. 2015 hat sich die Lage entspannt, es werden aber weiterhin Fälle gemeldet.
Selbstverständlich kann es uns in Deutschland nicht gleichgültig sein, ob sich auf anderen Kontinenten derartige Epidemien abspielen – insbesondere aus humanitären Gründen. Wie man solche Ausbrüche, die teilweise auf eine mangelnde medizinische Infrastruktur zurückzuführen sind, in Zukunft verhindert oder rasch eindämmt, ist eine Frage der internationalen Politik. Es ergeben sich aber auch ganz praktische Konsequenzen für den klinisch tätigen Arzt in Deutschland. Die Ebola-Epidemie hat bewusst gemacht, dass
Importierte Infektionskrankheiten können lebensbedrohlich verlaufen und hochkontagiös sein
es Krankheiten gibt, die zwar bei uns sehr selten vorkommen, aber aus zwei Gründen sehr gefährlich sind:
Sie können lebensbedrohlich verlaufen, teils weil sie mit Hämorrhagien einhergehen oder weil sie schwere respiratorische Symptome verursachen.
Sie können hochkontagiös sein und damit eine Bedrohung für das behandelnde medizinische Personal darstellen, eventuell auch für die weitere Umgebung.
Solche Krankheiten können bei bekannten Epidemien aus den Tropen eingeschleppt werden. Dann werden sie relativ leicht erkannt. Es können aber auch einzelne Fälle bei Migranten oder Reiserückkehrern auftreten und hier erstmalig manifest werden – mit möglicherweise enormen Konsequenzen, wenn die Krankheiten zu spät diagnostiziert werden. Und schließlich muss bedacht werden, dass
Auch bisher unbekannte Erreger können auftreten
auch bisher unbekannte Erreger auftreten könnten.
Krankheiten zu erkennen, die man wahrscheinlich im Leben noch nie gesehen hat, oder Krankheiten aufzudecken, die sogar gänzlich neu sind, ist nicht einfach – zumal die Symptome zu Beginn meist unspezifisch sind. Aber genau dies muss man heutzutage von Internisten fordern, die Migranten oder Reisende betreuen. Daher werden in diesem Beitrag die seltenen, aber lebensbedrohlichen und hochansteckenden Erkrankungen vorgestellt. Abschließend soll diskutiert werden, womit wir möglicherweise in Zukunft rechnen müssen.
Ebola- und Marburg-Fieber
Die Marburg-Viren wurden 1967 entdeckt, als in Marburg und in Jugoslawien mehrere Laborarbeiter an einem akuten Fieber erkrankten. Auslöser der Epidemie waren infizierte Affen, die aus Uganda nach Europa importiert worden waren. Einzelfälle wurden dann in Rhodesien, dem heutigen Simbabwe, beobachtet, ein erster Ausbruch 1998 in der Nähe von Durba in der Demokratischen Republik Kongo. 2004 kam es zu einer Epidemie in der Uige-Provinz in Angola.
Das Ebola-Virus wurde erstmals 1976 als Verursacher zweier großer Epidemien in Zaire und dem Sudan beobachtet
Das Ebola-Virus wurde erstmals 1976 als Verursacher zweier großer Epidemien in Zaire, der heutigen DR Kongo, und dem Sudan beobachtet. Das Virus ist nach dem Fluss Ebola in der Nähe des Epizentrums der Epidemie in Zaire benannt. In der Folge kam es zu einer Reihe von kleineren Ausbrüchen in Zentralafrika [1].
Epidemiologie
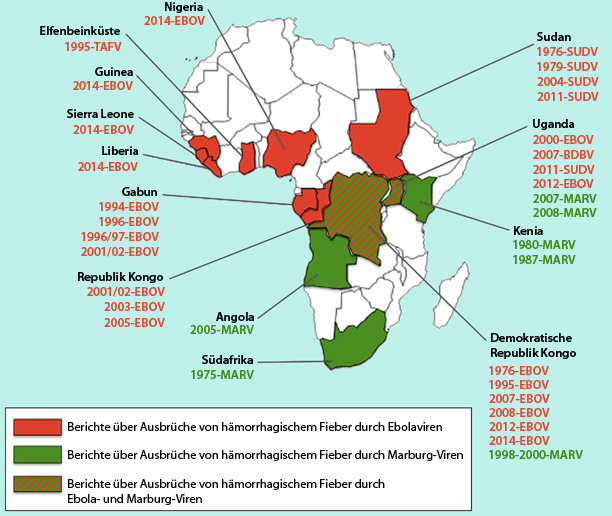
Mit Infektionen durch beide Viren muss in weiten Teilen Zentral- und Westafrikas gerechnet werden (Abb. 1).
Bei entsprechend guter Gesundheitsversorung wären Ausbrüche von Ebola- und Marburg-Viren leicht eindämmbar
Grundsätzlich wären Ausbrüche leicht einzudämmen; die Ausbrüche in Afrika hängen mit mangelhaften Gesundheitssystemen, der – z. T. daraus resultierenden – Nichtinanspruchnahme der Krankenhäuser sowie kulturellen Besonderheiten zusammen.
Erreger und Übertragung
Ebola- und Marburg-Viren sind Filoviren .
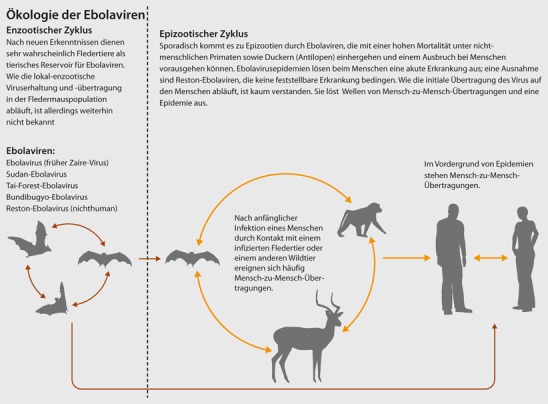
Das natürliche Reservoir der Ebola- und Marburg-Viren sind wahrscheinlich bestimmte Flughundarten
Das natürliche Reservoir sind wahrscheinlich bestimmte Flughundarten. Die Viren wurden allerdings noch nie aus den Tieren angezüchtet und man weiß nicht, wie sie sich in einer Flughundpopulation verbreiten. Die Marburg-Virusinfektionen bei Minenarbeitern und Reisenden, die sich in Fledermaushöhlen aufgehalten hatten, sind vermutlich durch direkten Kontakt mit den Tieren oder mit deren infektiösen Ausscheidungen verursacht worden [2]. Andererseits wird das Ebola-Virus – vermutlich von Flughunden – auf andere Säugetiere wie Menschenaffen und Antilopen übertragen, die an der Infektion erkranken bzw. versterben.
Die Übertragung auf den Menschen erfolgt durch Kontakt zu erkrankten oder verstorbenen Tieren
Die Übertragung auf den Menschen erfolgt durch Kontakt zu erkrankten oder verstorbenen Tieren (Abb. 2). Oft bleibt das initiale Übertragungsereignis im Dunkeln. Im Genus Ebola-Virus werden 5 Spezies differenziert (Tab. 1), die sich in der Virulenz unterscheiden.
Filoviren
| Spezies | Land | Wirt | Menschliche Fälle | Letalität (%) |
|---|---|---|---|---|
| Tai-Forest-Ebola-Virus (TAFV) | Elfenbeinküste | Mensch | 1 | 100 |
| Reston-Ebola-Virus (RESTV) | Philippinen | NHP, Fledermäuse, Schweine | 141 | 0 |
| Sudan-Ebola-Virus (SUDV) | Sudan, Uganda | Mensch, NHP | 761 | 42–65 |
| Zaire-Ebola-Virus (EBOV) | Zentralafrika, Uganda, Guinea, Liberia, Sierra Leone | Mensch, NHP, Fledermäuse | 26.000 | 40–90 |
| Bundibugyo-Ebola-Virus (BDBV) | Uganda | Mensch, NHP | 149 | 25 |
NHP Nichthumane Primaten.
Nosokomiale Übertragung
Infektionen mit Ebola- und Marburg-Viren nach Nadelstichverletzungen sind bei Ausbrüchen in Afrika häufig. Offenbar ist eine Infektion schon bei sehr geringen Inokula möglich. Filoviren können aber auch durch Kontakt mit Schleimhäuten übertragen werden. Da man bei Patienten eine große Zahl an Ebola-Viruspartikeln auf der Haut und in den Ausführungsgängen der Schweißdrüsen findet,
Bereits die Berührung infizierter Patienten kann zur Infektion führen
kann bereits die Berührung infizierter Patienten zur Infektion führen – ein derartiger Übertragungsweg wird bei Erkrankten vermutet, die während Ebola-Epidemien Angehörige gepflegt oder Verstorbene gewaschen hatten.
Nadelstichverletzungen
Infektionen bei Reisenden und Migranten
Importierte Infektionen sind sehr selten [4]. In Tab. 2 sind Risikofaktoren aufgeführt, bei deren Vorhandensein man an Filovirusinfektionen denken sollte.
| Patient hatte in Zentralafrika oder Westafrika mit toten Menschenaffen Kontakt oder hat Affenfleisch gegessen |
| Patient war in Höhlen oder Behausungen, in denen Fledermäuse nisten |
| Patient hat in Zentralafrika oder Westafrika „bushmeat“ gegessen |
| Patient hatte Kontakt mit möglichen Ebola-/Marburg-Patienten (also insbesondere medizinisches Personal aus Krankenhäusern in Zentralafrika) |
Klinik
Die Inkubationszeit beträgt 2–21 Tage [5]. Daher kann es sich bei einer
Eine mehr als 3 Wochen nach Verlassen des Endemiegebiets einsetzende Symptomatik deutet nicht auf ein virales hämorrhagisches Fieber hin
Symptomatik nicht um ein virales hämorrhagisches Fieber handeln, wenn sie mehr als 3 Wochen nach Verlassen des Endemiegebiets einsetzt. Die Krankheit beginnt mit plötzlichem Fieber, es entwickeln sich schwere Kopf-, Gelenk-, Muskel-, Brust- und Bauchschmerzen sowie Anorexie [6, 7, 8]. Gastrointestinale Symptome treten häufig auf, wobei die Durchfälle bei fatalem Verlauf blutig werden. Am fünften bis siebten Krankheitstag kann zu einer allgemeinen Blutungsneigung kommen. Neurologische Symptome wie Halbseitenlähmungen oder Psychosen sind häufig, eine Rhabdomyolyse oder eine Anurie kann auftreten. Der Tod tritt im Mittel um den neunten Krankheitstag ein.
Pathophysiologisch stehen eine Gerinnungsaktivierung, ein Zytokinsturm und ein Endothelschaden im Vordergrund. Wird die Krankheit überlebt, können Allgemeinsymptome, Kopfschmerzen, Amenorrhö, Myalgien und Arthralgien, aber auch Sehstörungen und ein Hörverlust persistieren [9]. Bei den Angaben zur Letalität in Tab. 1 ist zu beachten, dass diese sich meist auf Fälle im Krankenhaus beziehen – wie häufig leichtere oder auch asymptomatische Verläufe vorkommen, wird man jetzt genauer untersuchen.
Differenzialdiagnose
Die Symptome sind zunächst unspezifisch. Umso wichtiger sind die anamnestischen Hinweise (Tab. 2). Wichtige Differenzialdiagnosen sind
Malaria,
eine fulminante Virushepatitis,
Leptospirose,
Meningokokkensepsis (Waterhouse-Friderichsen-Syndrom) und
Intoxikationen.
Natürlich kommen selten auch andere (nichtkontagiöse) virale hämorrhagische Fieber in Betracht, z. B. Gelbfieber, Rift-Valley-Fieber oder hämorrhagische Verläufe eines Denguefiebers. Alkhumra-Viren werden von Zecken übertragen, kommen in Saudi-Arabien vor und können ein hämorrhagisches Fieber auslösen.
Wichtigste
Wichtigste Differenzialdiagnose ist die bedeutend häufiger importierte Malaria
Differenzialdiagnose ist die Malaria, die bedeutend häufiger importiert wird. Bei der Malaria tropica tritt typischerweise eine Thrombozytopenie auf, eine Verbrauchskoagulopathie mit manifesten Blutungen ist allerdings selten.
Lassa-Fieber
Das Lassa-Fieber ist nach einer Stadt im Nordosten Nigerias benannt, wo 1969 die Erkrankung beschrieben und das Virus erstmals isoliert wurde.
Epidemiologie
Das Lassa-Fieber kommt endemisch in Westafrika vor. Schätzungen zufolge
In Westafrika gibt es jedes Jahr etwa 100.000–300.000 Lassa-Fieber-Fälle
gibt es in dieser Region jedes Jahr etwa 100.000–300.000 Fälle, etwa 70 % verlaufen subklinisch.
Erreger und Übertragung
Lassa-Viren sind Arenaviren . Reservoirwirt sind Ratten (Mastomys natalensis), die das Virus über den Urin ausscheiden.
Die Übertragung der Lassa-Viren auf den Menschen erfolgt vermutlich indirekt durch Kontamination von Lebensmitteln oder Alltagsgegenständen
Die Übertragung auf den Menschen erfolgt vermutlich indirekt durch Kontamination von ungeschützt gelagerten Lebensmitteln, die den Tieren als Nahrung dienen, oder von Gegenständen des täglichen Bedarfs.
Arenaviren
Ratten
Nosokomiale Übertragung
Ähnlich wie bei Filoviren besteht eine Ansteckungsgefahr insbesondere durch Kontakt mit infiziertem Blut oder Sekreten [10]. Es wird vermutet, dass auch eine aerogene Transmission möglich ist, tierexperimentell wurde diese auch nachgewiesen. Während eines Lassa-Ausbruchs in einem Krankenhaus in Nigeria kam es zu Sekundärfällen, die auf derselben Station wie der Indexfall gelegen hatten. Dieser hatte ein Lassa-Fieber mit schwerer pulmonaler Beteiligung [11]. Bei anderen Lassa-Fällen traten keine Sekundärfälle auf, obwohl vor Diagnosesicherung keine Isolierungsmaßnahmen durchgeführt worden waren.
Nosokomiale Lassa-Infektionen bei Krankenhauspersonal sind beschrieben
Es wurden nosokomiale Infektionen bei Krankenhauspersonal beschrieben.
Infektionen bei Reisenden und Migranten
Bis Mitte 2015 wurden insgesamt 57 Lassa-Fieber-Fälle bei Reisenden dokumentiert [12]. In Tab. 3 sind Risikofaktoren aufgelistet, bei denen man an ein Lassa-Fieber denken sollte.
| Patient hat in Westafrika gewohnt oder gearbeitet, in Behausungen, zu denen Ratten Zugang hatten |
| Patient hat Lebensmittel gegessen, die möglicherweise durch Rattenkot oder -urin kontaminiert waren |
| Patient hatte Kontakt mit möglichen Lassa-Virus-Patienten (also insbesondere medizinisches Personal aus Krankenhäusern in Westafrika) |
Klinik
Die Symptome des Lassa-Fiebers sind häufig unspezifisch.
Aufgrund der häufig unspezifischen Symptome sind Fragen nach anamnestischen Risikofaktoren sehr wichtig
Sehr wichtig ist daher die Frage nach anamnestischen Risikofaktoren. Die Inkubationszeit beträgt 3–21 Tage. Zunächst treten Fieber und unspezifische grippeähnliche oder gastrointestinale Symptome auf. Als Vorzeichen für einen schweren Verlauf gelten ab der zweiten Krankheitswoche Ödeme der Augenlider und des Gesichts, Zeichen einer allgemeinen Blutungsneigung (Schleimhautblutungen), Pleura- und Perikardergüsse sowie neurologische Symptome. Es bestehen Bradykardie und Hypotonie. Der Tod tritt im Durchschnitt 12 Tage nach Krankheitsbeginn im irreversiblen Schockzustand mit Organversagen, Hypovolämie und Anurie ein. Das Zentralnervensystem kann mit einer Enzephalopathie beteiligt sein, die sich mit Krämpfen oder Somnolenz bis hin zum Koma manifestiert.
Prognostisch ungünstig sind u. a. Blutungen und eine exsudative Pharyngitis mit Ödem
Blutungen, eine exsudative Pharyngitis mit Ödem (Erstickungsgefahr) sowie die Kombination aus erhöhter Glutamat-Oxalacetat-Transaminase ( 150 U/l) und hoher Virämie sind prognostisch ungünstig.
Südamerikanische hämorrhagische Fieber
Epidemiologie
Das argentinische hämorrhagische Fieber wurde zunächst im Nordwesten der Provinz Buenos Aires festgestellt, das Verbreitungsgebiet hat sich dann aber in die Provinzen Córdoba, La Pampa, Entre Rios und Santa Fé ausgedehnt. Bei seroepidemiologischen Untersuchungen wurden Seroprävalenzen von 3 % in der ländlichen Bevölkerung gefunden,
Beim argentinischen hämorrhagischen Fieber geht man von 30–50 Erkrankungsfällen pro Jahr in Argentinien aus
man geht von 30–50 Erkrankungsfällen pro Jahr aus. Das bolivianische hämorrhagische Fieber tritt im Departamento Beni und in der Gegend um die Ortschaft San Joaquín an der östlichen Landesgrenze auf, 1971 gab es eine Epidemie in Cochabamba. Das venezolanische hämorrhagische Fieber ist in drei epidemischen Ausbrüchen aufgetreten, vorwiegend in ländlichen Gebieten im Süden von Portuguesa, einige Fälle gab es auch in den benachbarten Bundesstaaten Barinas und Guárico. Das Sabiá-Virus wurde bisher nur einmalig bei einem Patienten isoliert (Tab. 4). Das Chapare-Virus wurde einmalig im Serum eines Patienten nachgewiesen, der während eines kleinen Ausbruchs eines hämorrhagischen Fiebers von Dezember 2003 bis Januar 2004 in der bolivianischen Provinz Chapare verstorben war [13].
| Virus | Krankheit | Englische Bezeichnung | Spanische Bezeichnung |
|---|---|---|---|
| Junín-Virus | Argentinisches hämorrhagisches Fieber | Argentine hemorrhagic fever | Fiebre hemorrágica argentina (FHA) |
| Machupo-Virus | Bolivianisches hämorrhagisches Fieber | Bolivian hemorrhagic fever | Fiebre hemorrágica boliviana (FHB) |
| Guanarito-Virus | Venezolanisches hämorrhagisches Fieber | Venezuelan hemorrhagic fever | Fiebre hemorrágica venezolana (FHV) |
| Sabiá-Virus | Brasilianisches hämorrhagisches Fieber | Brazilian hemorrhagic fever | Fiebre hemorrágica brasileña = fiebre hemorrágica de São Paulo |
Erreger und Übertragung
Die Erreger sind Arenaviren. Als Reservoir dienen wildlebende kleine Nagetiere sowie Hausmäuse, bei denen die Infektion latent mit einer wahrscheinlich lebenslangen Viruspersistenz und Ausscheidung des Erregers mit Urin und Speichel verläuft. Fälle treten möglicherweise besonders dort auf, wo durch Abholzen neue Kontakte mit den sylvatischen Reservoirtieren auftreten. Ein Beispiel: Mähdrescherfahrer sind gefährdet, weil sie aerolisiertes Blut von Nagern einatmen können.
Sylvatische Reservoirtiere
Nosokomiale Übertragung
Die mögliche Infektion über Aerosole ist belegt [14] und wurde auch tierexperimentell nachgewiesen [15]. Beim argentinischen hämorrhagischen Fieber wurde auch – ähnlich wie beim Lassa-Fieber – die Möglichkeit einer sexuellen Übertragung nachgewiesen.
Infektionen bei Reisenden und Migranten
Südamerikanische hämorrhagische Fieber wurden bisher nicht nach Europa importiert –
Trotz bislang fehlender Fälle ist der Import eines südamerikanischen hämorrhagischen Fiebers nach Europa denkbar
die Möglichkeit besteht aber.
Klinik
Die Klinik ist ähnlich wie bei anderen hämorrhagischen Fiebern. Schwere Verläufe werden insbesondere bei Schwangeren beschrieben.
Lujo-Virusinfektion
Auch das Lujo-Virus gehört zu den Arenaviren. Bisher wurde es nur bei einer Patientin aus Lusaka, Sambia, nachgewiesen. Allerdings übertrug sie es auf das Gesundheitspersonal, das sie in Johannesburg betreute.
Das Lujo-Virus trat bislang nur bei einem Ausbruch mit 5 Fällen in Erscheinung
Insgesamt kam es zu 5 Fällen, von denen 4 tödlich verliefen [16].
Hämorrhagisches Krim-Kongo-Fieber
Im Jahr 1944 erkrankten auf der Krim sowjetische Soldaten an einem hämorrhagischen Fieber. Erst 1967 wurde das Virus durch intrazerebrale Inokulation von neugeborenen Mäusen isoliert. Es zeigte sich, dass das „Krim-Virus“ identisch zum „Kongo-Virus“ war, das wenige Jahre zuvor aus einem Patienten aus Belgisch-Kongo, der heutigen DR Kongo, isoliert worden war. Diese Erkenntnis fand dann in der Namensgebung Berücksichtigung.
Epidemiologie
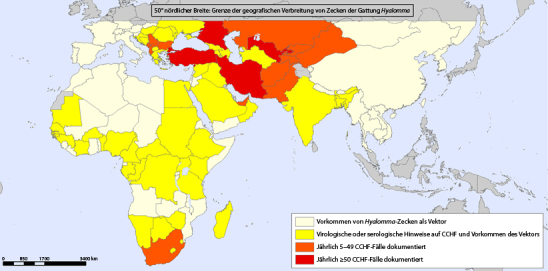
Endemisch ist das hämorrhagische Krim-Kongo-Fieber [“Crimean–Congo hemorrhagic fever“ (CCHF)]
Das CCHF hat ein großes Verbreitungsgebiet in Asien, Afrika und Südosteuropa
in Afrika und Asien, aber auch in Südosteuropa. Ausbrüche waren z. B. im Kosovo, in Albanien, in der Türkei, in Kasachstan, Pakistan und Südafrika zu verzeichnen [17]. In einigen Ländern, wie Ägypten, Portugal, Ungarn, Frankreich und Benin konnten die Viren in Zecken nachgewiesen werden, manifeste Erkrankungen hat es dort bislang aber nicht gegeben (Abb. 3).
Erreger und Übertragung
Das CCHF-Virus gehört zur Familie der Bunyaviridae. Es zirkuliert zwischen Zecke und Vertebratenwirt. Die Übertragung auf den Menschen erfolgt entweder durch Zeckenstich oder Kontakt zu infizierten Tieren. Ein hohes Risiko für eine Zeckenstichübertragung haben Personen, die sich in endemischen Gebieten überwiegend im Freien aufhalten, u. a. Bauern und Militärpersonal. Von der Übertragung über inapparent infizierte Tiere sind Nutztierhalter, Tierärzte und Schlachter betroffen. Die wahrscheinliche Infektionsquelle ist das virämische Blut der Tiere. Das CCHF-Virus kann auch von Mensch zu Mensch übertragen werden [19].
Nosokomiale Übertragung
Die Übertragung erfolgt durch direkten Kontakt mit infiziertem Blut. Das Virus kann auch in Speichel und Urin nachgewiesen werden; die Bedeutung ist unklar.
Mehrere nosokomiale CCHF-Ausbrüche mit hoher Letalität sind dokumentiert
Mehrere nosokomiale Ausbrüche mit hoher Letalität sind dokumentiert.
Infektionen bei Reisenden und Migranten
Importierte Fälle sind selten [20, 21]. In Tab. 5 ist angegeben, wann man an ein CCHF denken sollte.
| Kontakt mit Zecken im Endemiegebiet (Südosteuropa, Afrika, Mittlerer Osten, Zentralasien) |
| Teilnahme an Tierschlachtungen im Endemiegebiet |
| Kontakt zu möglichen CCHF-Patienten im Endemiegebiet |
Klinik
Auch
Auch beim CCHF sind die Symptome zunächst unspezifisch
beim CCHF sind die Symptome zunächst unspezifisch. Plötzliches Fieber, Schüttelfrost, Kopf-, Muskel- und Rückenschmerzen, auch Gesichtsröte, Konjunktivitis, Nackensteifigkeit und Fotophobie sind Zeichen des akuten Krankheitsbeginns. Übelkeit und Erbrechen können früh hinzutreten, manchmal mit Durchfall und Bauchschmerzen. Über die nächsten Tage können die Patienten verwirrt oder aggressiv werden. Nach 2–4 Tagen werden sie zunehmend schläfrig. Bei mehr als 25 % der Fälle kommt es am dritten bis fünften Krankheitstag zu petechialen Blutungen der Haut bzw. dann zu profusen Blutungen mit Kreislaufkollaps. Als prognostisch ungünstig gelten zentralnervöse Störungen als Folge zerebraler Blutungen. Die Patienten können ein hepatorenales Syndrom entwickeln, meist tritt es in der zweiten Krankheitswoche auf.
Petechiale Blutungen
Hepatorenales Syndrom
„Hantavirus pulmonary syndrome“
Im Jahr 1993 traten im Südwesten der USA in der von den angrenzenden Bundesstaaten Arizona, Colorado, New Mexico und Utah gebildeten Four-Corners-Region gehäuft Fälle eines akuten Atemnotsyndroms [“acute respiratory distress syndrome“ (ARDS)] bei jungen, vorher gesunden Personen auf. Serologische und molekulargenetische Analysen führten dann zur Identifikation eines neuartigen Hantavirus , des Sin-Nombre-Virus, das von der Hirschmaus (Peromyscus maniculatus) übertragen wird. In der Folgezeit wurden weitere Neuwelt-Hantaviren entdeckt, so in Südamerika das Andes-Virus. Dieses kann von Mensch zu Mensch übertragen werden [22]. Über mehrere nach Europa importierte Infektionen mit einem südamerikanischen Hantavirus wurde berichtet [23, 24].
Hantavirus
Hantaviren der Neuen Welt können also ein ARDS hervorrufen.
Bei Pneumonie nach Kontakt mit Nagetieren sollte eine Infektion mit Hantaviren bedacht werden
Bei Pneumonie nach Kontakt mit Nagetieren sollte diese mögliche Ursache bedacht werden.
„Middle East respiratory syndrome“
Das „Middle East respiratory syndrome coronavirus“ (MERS-CoV) ist ein im Jahr 2012 erstmals identifiziertes Virus aus der Familie der Coronaviren . Die ersten Fälle traten auf der Arabischen Halbinsel auf. Als wahrscheinlichster Reservoirwirt wurden Dromedare identifiziert. Von Mai bis Juli 2015 kam es in Südkorea zu einem größeren Ausbruch.
Coronaviren
Klinisch
Klinisch beginnt das MERS wie eine Grippe
beginnt die Erkrankung wie eine Grippe. Bei schweren Verläufen ist die Entwicklung einer Pneumonie möglich, die in ein ARDS übergehen kann. Durchfall ist ein häufiges Begleitsymptom. Bei schweren Verläufen kann ein Nierenversagen auftreten.
Eine Mensch-zu-Mensch-Übertragung ist durch epidemiologische Daten belegt. Genomische Untersuchungen sprechen für eine Mensch-zu-Mensch-Ausbreitung mit periodischer Reintroduktion des Virus in die menschlichen Populationen.
Die größeren MERS-Ausbrüche sind bisher krankenhausassoziiert
Die größeren Ausbrüche sind bisher krankenhausassoziiert [25]. Importierte Fälle wurden auch in Deutschland beobachtet.
Lungenpest
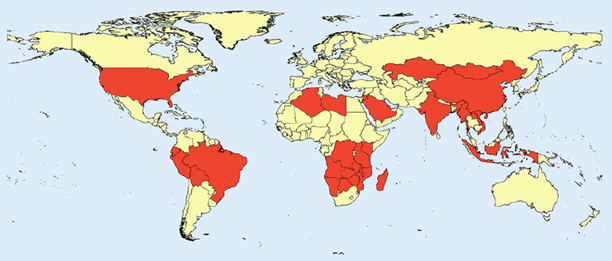
Der Pesterreger, Yersinia pestis, ist ein gramnegatives Stäbchenbakterium aus der Familie der Enterobacteriaceae. Menschen werden über verschiedene Übertragungsmechanismen mit Pest infiziert: Flohbisse, Kontakt mit infizierten Tierkadavern, Kratzer und Bisse durch infizierte Katzen, Exposition gegenüber Aerosolen, Essen infizierter Tiere (z. B. Meerschweinchen in Peru und Ecuador oder Ziegen und Kamele in Libyen), Kontakt mit lungenpestinfizierten Personen.
In Asien, Südafrika, Kenia und Tansania, Madagaskar, im nördlichen Afrika, den Vereinigten Staaten und Südamerika kommt es immer wieder zu Übertragungen auf den Menschen. In den letzten Jahren wurden immer etwa 1000–5000 Fälle und 100–200 Todesfälle pro Jahr gemeldet, die meisten in Afrika (Abb. 4).
Die
Die Bubonenpest ist die häufigste Manifestation
Bubonenpest ist die häufigste Manifestation. Ohne Therapie kann sie in eine disseminierte septische Erkrankung übergehen. Die Lungenpest tritt häufig sekundär bei septikämischer oder Bubonenpest auf. Lungenpest kann aber auch primär nach Inhalation von Y.-pestis-Bakterien auftreten, die von anderen Erkrankten oder Tieren mit Lungenpest ausgeatmet wurden [27]. Diese primäre Lungenpest hat eine sehr kurze Inkubationszeit von wenigen Stunden bis Tagen. Die Betroffenen sind plötzlich dyspnoisch, haben hohes Fieber und leiden unter Brustschmerzen. Der Husten ist oft von blutigem Auswurf begleitet. Unbehandelt versterben die Patienten sehr rasch. Bei Lungenbefall kann also, wenn die Bakterien in die Alveolen übertreten, eine sehr große Erregerzahl aerogen übertragen werden [28].
Bei Patienten mit Lungenpest kann nur die sofortige Einleitung von Isolationsmaßnahmen eine Epidemie verhindern
Bei Patienten mit Lungenpest kann nur die sofortige Einleitung von Isolationsmaßnahmen eine Epidemie verhindern.
Differenzialdiagnostisch kommen fulminante Pneumonien anderer Ursache infrage. Bei Lungenmilzbrand findet sich ebenfalls ein schweres septisches Krankheitsbild mit Dyspnoe, Fieber und Hypotonie, Ursache ist vorwiegend eine hämorrhagische Mediastinitis, es besteht keine Kontagiosität.
Pestfälle bei Reisenden wurden beschrieben [29, 30]. In Tab. 6 ist angegeben, bei welchen Patienten mit einer Pneumonie eventuell an hochkontagiöse Erreger zu denken ist.
| Pneumonie nach engem Kontakt mit Vögeln |
| Pneumonie nach Kontakt mit Nagern in Südamerika (z. B. Veterinäre, Waldarbeiter) |
| Pneumonie nach Aufenthalt auf der Arabischen Halbinsel (Stand Ende Juli 2015) |
| Einreise aus einem Gebiet mit bekannter Pestepidemie |
„Severe fever with thrombocyopenia syndrome“
Das „severe fever with thrombocyopenia syndrome“ (SFTS) geht auf ein Phlebovirus aus der Familie der Bunyaviridae zurück. Die Erkrankung geht mit Fieber, Erbrechen, Diarrhö, multiplem Organversagen, erhöhten Transaminasen, Thrombo- und Leukopenie einher [31]. Sie kommt in Nordost- und Zentralchina sowie in Japan und Korea vor.
Das SFTS-Virus wird durch Zecken übertragen
Das SFTS-Virus wird durch Zecken übertragen. Nosokomiale Ausbrüche wurden beschrieben [32].
Bunyaviridae
Affenpocken
Die Affenpocken („monkey pox“) sind in Zentral- und Westafrika endemisch und kommen auch im Südsudan vor. Reservoirtiere sind Hörnchen, gambische Riesenratten und andere Nagetiere. Das Krankheitsbild der Affenpocken kann mit typischen Pockenpusteln im Gesicht, an Körper und Extremitäten dem Bild der echten Pocken sehr ähnlich sein. Im Unterschied zu Pocken sind bei Affenpocken Schwellungen der maxillären, axillären und inguinalen Lymphknoten typisch. Die Letalität liegt bei 1–10 % [33]. Im Gegensatz zu anderen Tierpocken ist eine Mensch-zu-Mensch-Übertragung möglich. Im Jahr 2003 gab es einige Fälle von Affenpocken in den USA, die nach Kontakt mit Präriehunden auftraten. Diese hatten sich wiederum an importierten Ratten aus Gambia angesteckt.
Bei Patienten aus West- und Zentralafrika mit Verdacht auf Windpocken sollte auch an Affenpocken gedacht werden
Bei Patienten aus West- und Zentralafrika mit Verdacht auf Windpocken sollte auch an Affenpocken gedacht werden.
Maßnahmen bei Verdacht auf hochkontagiöse Erkrankung
Bei einem entsprechenden Verdacht muss der Patient soweit möglich vor Ort isoliert und das zuständige Gesundheitsamt informiert werden.
Das Gesundheitsamt muss den strikt isolierten Transport des Patienten in ein Behandlungszentrum organisieren
Das Gesundheitsamt muss den strikt isolierten Transport des Patienten in ein Behandlungszentrum organisieren. In Deutschland sind mehrere derartige Behandlungszentren vorhanden. Diese sind Mitglieder des Ständigen Arbeitskreises der Kompetenz- und Behandlungszentren für hochkontagiöse und lebensbedrohliche Erkrankungen (STAKOB; http://www.rki.de/DE/Content/Kommissionen/Stakob/Stakob_node.html).
Ausblick
„Prognosen sind schwierig, besonders wenn sie die Zukunft betreffen“ (Niels Bohr). Trotzdem kann man versuchen, aus der Vergangenheit zu lernen und Trends in die Zukunft zu extrapolieren. Schließlich waren viele Infektionen einmal neu für den Menschen – wenn sie nicht schon von früheren Homininen mitgebracht wurden. Wie viele unbekannte Pandemiekeime noch auf ihren Auftritt warten, ist nicht bekannt [34].
Herkunft neuer Infektionen
Grundsätzlich bestehen die folgenden Möglichkeiten für das Auftreten neuer Infektionskrankheiten.
Neuidentifikation statt neues Auftreten
Viele Erreger sind nicht neu, sondern können durch neue Techniken erst jetzt detektiert werden. Molekularbiologische Techniken haben eine zuvor unvorstellbare genomische Diversität unter den Mikroben gezeigt, sodass viele Arten jetzt in neue Arten unterteilt werden.
Genomische Diversität
Horizontaler Gentransfer
Der
Der horizontale Gentransfer ist eine Übertragung von Genen außerhalb der geschlechtlichen Fortpflanzung
horizontale Gentransfer ist eine Übertragung von Genen außerhalb der geschlechtlichen Fortpflanzung. Er kann zu neuen Spezies führen. Ein Beispiel ist der Escherichia-coli-Stamm O104:H4, der 2011 die Epidemie eines hämolytisch-urämischen Syndroms ausgelöst hat. Man nimmt an, dass das Gen für die Shiga-Toxine durch Transduktion über einen horizontalen Gentransfer mittels Bakteriophagen in einen enteroaggregativen E. coli (EAEC) gelangte. Dadurch hat dieser Stamm die Eigenschaft erworben, Shiga-Toxine zu produzieren.
Überwindung der Speziesgrenzen
Die meisten neuen Infektionen sind wahrscheinlich darauf zurückzuführen, dass es
Die meisten neuen Infektionen basieren wahrscheinlich auf der Überwindung von Speziesgrenzen
Erregern gelingt, die Speziesgrenze zwischen Tier und Mensch zu überwinden [35]. Dies ist nicht einfach. Adaptive Eigenschaften der Organismen entstehen üblicherweise in kleinen Schritten, wobei in jedem Zwischenschritt die Lebensfähigkeit erhalten bleiben muss. Die neu entstehenden Erreger sollten darüber hinaus ihren Vorgängern überlegen sein, sonst können sie sie reproduktiv nicht überholen. Beim Sprung auf eine neue Spezies sind aber evtl. Zwischenschritte erforderlich, die die Fitness herabsetzen – das sollten nicht zu viele sein [36]. Die ersten wirklichen „new emerging infections“ sind wahrscheinlich beim Übergang von der nomadisierenden zur sesshaften Lebensweise in der neolithischen Revolution aufgetreten [37]. In Tab. 7 sind Beispiele für eine erfolgreiche Überwindung der Speziesgrenze aufgeführt.
| Von Affen | Malaria tropica |
| HIV | |
| Hepatitis B | |
| Dengue | |
| Von Haustieren | Diphtherie |
| Pertussis | |
| Pocken | |
| Tuberkulose | |
| Von Vögeln | Influenza A |
| Von Nagern | Pest |
| Hepatitis C | |
| Von Fledermäusen | Ebola |
| Marburg | |
| Nipah | |
| Schweres akutes respiratorisches Syndrom (SARS) | |
| Mumps |
Auf die Gensynthese im Labor und auf die Frage, ob Mikroben mit Meteoriten zu uns gelangen könnten, soll hier nicht eingegangen werden.
Die
Die meisten neuen Infektionen sind Zoonosen
meisten neuen Infektionen sind Zoonosen. Risikofaktoren für die Übertragung von Infektionserregern vom Tier auf den Menschen sind sicherlich eine hohe Populationsdichte, z. B. durch Superurbanisierung, der Handel mit Wildtieren und „bushmeat“ sowie eventuell auch Xenotransplantationen [38]. Sich ändernde Umweltbedingungen, z. B. der Klimawandel oder der Verlust der Biodiversität, können die Übertragung begünstigen [39]. Es liegt auf der Hand, dass die globale Mobilität Infektionserregern rasch neue Nischen erschließen kann. Beispiele hierfür sind
UN-Soldaten aus Bangladesh, die 2010 die Cholera in Haiti importierten,
ein Reisender aus Indien, der 2007 einen Chikungunya-Ausbruch in Italien verursachte, und
Pilger aus Mekka, die 1988 und 1989 Epidemien der Meningokokkenmeningitis in Westafrika auslösten.
Etablierung und Ausbreitung neuer Erreger
Einige Erreger werden von Tieren gelegentlich auf den Menschen übertragen. Es kommt aber zu keiner weiteren Übertragung von Mensch zu Mensch, so beispielsweise bei Tollwut oder Milzbrand. Bei anderen sind einige Zyklen sekundärer Infektionen möglich, die aber schnell zum Stillstand kommen (z. B. Affenpocken). Wenige Erreger haben ein natürliches Reservoir sowohl in Tieren als auch im Menschen etabliert. Ein Beispiel sind der sylvatische und urbane Zyklus beim Gelbfieber. Andere Erreger kommen nur noch beim Menschen vor. Die Gründe für diese unterschiedlichen Ausbreitungstendenzen liegen im Verhalten der Erreger und in ihren Virulenzfaktoren, eine Vorhersage ist im Einzelfall aber schwer [40].
Die
Die meisten in den letzten Jahren als „neu“ beschriebenen Erreger sind nicht hochkontagiös
meisten Erreger, die in den letzten Jahren als „neu“ beschrieben wurden, sind nicht hochkontagiös. Daher werden sie in diesem Beitrag nicht weiter erwähnt. Beispiele sind die aviären Influenzaviren und Nipah-Viren. Oft vergehen viele Jahre zwischen der Entdeckung eines Virus und seinem epidemischen Auftreten – ein Beispiel ist das Zika-Virus, das vor 70 Jahren bei Affen in Uganda beschrieben wurde und jetzt 12.000 km entfernt in Mikronesien zu einem Ausbruch geführt hat.
Maßnahmen zur Verhinderung von Ausbrüchen
Die Surveillance im Hinblick auf neue Erreger ist naturgemäß schwierig („the problem of knowing the unknown“). Am wahrscheinlichsten erscheint, dass Zoonosen als neue Erreger infrage kommen. Modellrechnungen helfen, das Risiko für Ausbrüche durch neue Erreger zu beschreiben und „hot spots“ zu lokalisieren [41]. Bisher kann man aus der Gensequenz von Viren bei Tieren nicht darauf rückschließen, ob eine Adaptation an den Menschen zu erwarten ist. Nur für aviäre Influenzaviren wird dieses Risiko als hoch eingeschätzt.
Wichtig
Wichtig ist eine weltweite epidemiologische Überwachung
sind selbstverständlich eine weltweite epidemiologische Überwachung und ein weltweites Netzwerk, um auf Ausbrüche reagieren zu können [42]. Dieses beinhaltet auch
eine veterinärmedizinische Surveillance,
die Entwicklung neuer diagnostischer Möglichkeiten,
eine Überwachung von Risikogruppen, z. B. von Jägern in Zentralafrika,
die Etablierung weltweiter Netzwerke, um etwa Reisende als „sentinels“ zu nutzen, sowie
ein Screening digitaler Netze („digital disease detection“; [43]).
Fazit für die Praxis
An seltene oder sogar an neue hochkontagiöse Erreger sollte man
bei Fieber und hämorrhagischer Diathese;
bei Patienten mit Fieber, die in den Tropen oder Subtropen im Krankenhaus gearbeitet haben;
vielleicht bei Patienten mit unklaren Symptomen nach Aufenthalt in abgelegenen tropischen und subtropischen Regionen;
bei Personen mit unklaren Symptomen, die engen Kontakt zu Tieren hatten (insbesondere zu Vögeln, Fledermäusen und nichthumanen Primaten);
bei Pneumonien nach Kontakt mit Nagern oder Vögeln und
vielleicht auch bei Ausbrüchen mit ungewöhnlich vielen schweren oder synchronisierten Krankheitsverläufen
denken.
CME-Fragebogen
Ein Patient, der vor 14 Tagen aus der Demokratischen Republik Kongo zurückgekehrt ist, wird mit starken abdominalen Schmerzen und Diarrhö vorstellig. Seit einer Woche bestünden grippeartige Symptome. Auffällig sind diffuse Einblutungen in die Haut, der Patient berichtet zudem über einen Rückgang der Urinausscheidung. Welches ist die am ehesten zutreffende Diagnose?
Lassa-Fieber
Ebola-Virusinfektion
MERS
CCHF
„Hantavirus pulmonary syndrome“
Ein Patient, der bis vor einer Woche im Urlaub in Saudi-Arabien war, wird mit starken grippeartigen Symptomen und röntgenologisch nachgewiesener Pneumonie aufgenommen. Im Verlauf entwickelt er ein ARDS, zudem treten Durchfall und ein akutes Nierenversagen auf. Welches ist die am ehesten zutreffende Diagnose?
Lassa-Fieber
Ebola-Virusinfektion
MERS
CCHF
„Hantavirus pulmonary syndrome“
Mit Ausbrüchen welches hämorrhagischen Fiebers muss in Südosteuropa am ehesten gerechnet werden?
Marburg-Virusinfektion
Chapare-Virusinfektion
Bolivianisches hämorrhagisches Fieber
Ebola
CCHF
Welche Aussage zur Epidemiologie der südamerikanischen hämorrhagischen Fieber ist richtig?
Mit dem brasilianischen hämorrhagischen Fieber ist neuerdings auch in Rio de Janeiro und São Paulo zu rechnen.
Mähdrescherfahrer in den Pampas von Argentinien sind gefährdet, da sie aerolisiertes Blut von Nagern einatmen können.
Man kann sich mit dem bolivianischen hämorrhagischen Fieber bei Kontakt zu Affen im Amazonasgebiet anstecken.
Beim Essen von Meerschweinchen in Ecuador kann man ein hämorrhagisches Fieber bekommen.
Nach Fledermauskontakt in Venezuela muss man sich auf ein venezolanisches hämorrhagisches Fieber untersuchen lassen und eine postexpositionelle Tollwutprophylaxe durchführen.
Bei welcher der folgenden Infektionskrankheiten erfolgt die Übertragung häufig durch Zecken?
Lassa-Fieber
Hantavirusinfektion
Argentinisches hämorrhagisches Fieber
Ebola
CCHF
Bei welcher der folgenden Krankheiten ist eine aerogene Übertragung von Mensch zu Mensch nicht möglich?
MERS
Lassa-Fieber
„Hantavirus pulmonary syndrome“
Lungenmilzbrand
Lungenpest
Welche Aussage zur Pest trifft nicht zu?
Yersinia pestis, der Erreger der Pest, kann durch Flohstiche übertragen werden.
Früher gab es Pestfälle in den USA – jetzt nicht mehr.
Die Beulenpest ist die häufigste Manifestation einer Pest.
Der Verzehr von rohem Fleisch infizierter Tiere kann zur Pest führen.
Unter den Krankheitsmanifestationen der Pest ist nur die Lungenpest hochkontagiös.
Bei welcher Klinik und bei welcher Anamnese muss man an Affenpocken denken?
Bei einem Primatenforscher aus Peru, der im Amazonasgebiet Kontakt mit Neuweltaffen hatte und jetzt Fieber hat
Bei einem Migranten aus Gabun, der vor einigen Tagen eingereist ist und jetzt unter der Verdachtsdiagnose Windpocken eingewiesen wird
Bei einem Reiserückkehrer, der auf Bali in einem Tempel von einem Affen gebissen wurde und jetzt zur Tollwutimpfung vorgestellt wird
Bei einem Tierpfleger in Deutschland, der von einem Affen im Zoo gebissen wurde und jetzt eine Enzephalitis hat
Bei einem Reiserückkehrer aus Kenia mit einem makulopapulösen Exanthem, der in Kenia einen Autounfall hatte und Bluttransfusionen bekommen hat
Bei welchen anamnestischen Angaben eines Patienten mit Fieber und hämorrhagischer Diathese müsste man nicht an ein CCHF denken?
Teilnahme an der rituellen Schlachtung eines Schafs im Iran
Multiple Zeckenstiche während eines Pakistanaufenthalts
Nadelstichverletzung während einer Tätigkeit in einem Krankenhaus im Kosovo
Kontakt zu Neuweltaffen auf einer Forschungsreise in Südamerika
Famulatur in einem Krankenhaus in Südafrika
Ein Patient, der vor 3 Wochen von einer Safari in Kenia zurückgekehrt ist, stellt sich mit seit 2 Tagen bestehendem Fieber in der Notambulanz vor. Laborchemisch findet sich eine schwere Thrombozytopenie, manifeste Blutungszeichen liegen aber nicht vor. Welches ist die am ehesten zutreffende Diagnose?
Lassa-Fieber
Malaria tropica
Marburg-Virusinfektion
Gelbfieber
CCHF
Acknowledgments
Einhaltung ethischer Richtlinien
Interessenkonflikt. G.D. Burchard gibt an, dass kein Interessenkonflikt besteht.
Dieser Beitrag beinhaltet keine Studien an Menschen oder Tieren.
Prof. Dr. G.D. Burchard

Literatur
- 1.Rougeron V, Feldmann H, Grard G et al (2015) Ebola and Marburg haemorrhagic fever. J Clin Virol 64:111–119 [DOI] [PMC free article] [PubMed]
- 2.Pigott Trans R Soc Trop Med Hyg. 2015;109:366. doi: 10.1093/trstmh/trv024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.http://www.bu.edu/today/files/2014/08/EBOLA_ecology_800px.jpg
- 4.Paassen Lancet Infect Dis. 2012;12:635. doi: 10.1016/S1473-3099(12)70018-X. [DOI] [PubMed] [Google Scholar]
- 5.Velásquez GE, Aibana O, Ling EJ et al (2015) Time from infection to disease and infectiousness for Ebola Virus disease, a systematic review. Clin Infect Dis (im Druck) [DOI] [PMC free article] [PubMed]
- 6.Bah EI, Lamah MC, Fletcher T et al (2015) Clinical presentation of patients with Ebola virus disease in Conakry, Guinea. N Engl J Med 372(1):40–47 [DOI] [PubMed]
- 7.Qin Clin Infect Dis. 2015;61:491. doi: 10.1093/cid/civ319. [DOI] [PubMed] [Google Scholar]
- 8.Lado M, Walker NF, Baker P et al (2015) Clinical features of patients isolated for suspected Ebola virus disease at Connaught Hospital, Freetown, Sierra Leone: a retrospective cohort study. Lancet Infect Dis (im Druck) [DOI] [PubMed]
- 9.Clark Lancet Infect Dis. 2015;15:905. doi: 10.1016/S1473-3099(15)70152-0. [DOI] [PubMed] [Google Scholar]
- 10.Idemyor V (2010) Lassa virus infection in Nigeria: clinical perspective overview. J Natl Med Assoc 102:1243–1246 [DOI] [PubMed]
- 11.Carey Trans R Soc Trop Med Hyg. 1972;66:402. doi: 10.1016/0035-9203(72)90271-4. [DOI] [PubMed] [Google Scholar]
- 12.Gideon. http://www.gideononline.com/2015/05/26/lassa-fever-and-travel/
- 13.Delgado PLoS Pathog. 2008;4:e1000047. doi: 10.1371/journal.ppat.1000047. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Peters Am J Epidemiol. 1974;99:425. doi: 10.1093/oxfordjournals.aje.a121631. [DOI] [PubMed] [Google Scholar]
- 15.Kenyon Intervirology. 1992;33:23. doi: 10.1159/000150227. [DOI] [PubMed] [Google Scholar]
- 16.Briese PLoS Pathog. 2009;5:e1000455. doi: 10.1371/journal.ppat.1000455. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Messina Trans R Soc Trop Med Hyg. 2015;109:503. doi: 10.1093/trstmh/trv050. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.http://www.who.int/csr/disease/crimean_congoHF/Global_CCHFRisk_20080918.png?ua=1
- 19.Wiemer Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2015;58:714. doi: 10.1007/s00103-015-2169-7. [DOI] [PubMed] [Google Scholar]
- 20.Tall Bull Soc Pathol Exot. 2009;102:159. [PubMed] [Google Scholar]
- 21.Lumley Euro Surveill. 2014;19:20864. [Google Scholar]
- 22.Martinez Emer Inf Dis. 2005;11:1848. doi: 10.3201/eid1112.050501. [DOI] [Google Scholar]
- 23.Murgue Emerg Infect Dis. 2002;8:106. doi: 10.3201/eid0801.010367. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Rovida New Microbiol. 2013;36:103. [PubMed] [Google Scholar]
- 25.Drosten Clin Infect Dis. 2015;60:369. doi: 10.1093/cid/ciu812. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Stenseth PLoS Med. 2008;5:e3. doi: 10.1371/journal.pmed.0050003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.CDC MMWR Morb Mortal Wkly Rep. 2015;64:429. [PMC free article] [PubMed] [Google Scholar]
- 28.Kool Clin Infect Dis. 2005;40:1166. doi: 10.1086/428617. [DOI] [PubMed] [Google Scholar]
- 29.Mann JAMA. 1982;247:47. doi: 10.1001/jama.1982.03320260031024. [DOI] [PubMed] [Google Scholar]
- 30.CDC MMWR Morb Mortal Wkly Rep. 1990;39:895. [Google Scholar]
- 31.Liu Lancet Infect Dis. 2014;14:763. doi: 10.1016/S1473-3099(14)70718-2. [DOI] [PubMed] [Google Scholar]
- 32.Kim Clin Infect Dis. 2015;60:1681. doi: 10.1093/cid/civ128. [DOI] [PubMed] [Google Scholar]
- 33.McCollum Clin Infect Dis. 2014;58:260. doi: 10.1093/cid/cit703. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Rosenberg Cell Mol Life Sci. 2015;72:1115. doi: 10.1007/s00018-014-1785-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Wolfe Nature. 2007;447:279. doi: 10.1038/nature05775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Parrish Microbiol Mol Biol Rev. 2008;72:457. doi: 10.1128/MMBR.00004-08. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Barrett R, Armelagos GJ (2013) An unnatural history of emerging infections. Oxford University Press, Oxford. ISBN 978-0-19-960829-4
- 38.Karesh Lancet. 2012;380:1936. doi: 10.1016/S0140-6736(12)61678-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Keesing Nature. 2010;468:647. doi: 10.1038/nature09575. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Anderson Philos Trans R Soc Lond B Biol Sci. 1986;314:533. doi: 10.1098/rstb.1986.0072. [DOI] [PubMed] [Google Scholar]
- 41.Jones Nature. 2008;451:990. doi: 10.1038/nature06536. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 42.Morse Lancet. 2012;380:1956. doi: 10.1016/S0140-6736(12)61684-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Hartley Clin Microbiol Infect. 2013;19:1006. doi: 10.1111/1469-0691.12273. [DOI] [PubMed] [Google Scholar]


