Resumen
Las epidemias causadas, entre otros, por los virus Ébola, Marburgo, Nipah, Lassa, coronavirus, virus del Nilo Occidental, virus de Saint Louis, virus de la inmunodeficiencia humana, dengue, fiebre amarilla y fiebre hemorrágica venezolana han puesto sobre el tapete el riesgo que estos agentes representan para la salud pública global.
Entre las nuevas amenazas destaca el virus chikungunya, que ha extendido rápidamente su área endémica desde regiones remotas de África hacia la cuenca del océano Índico y el Pacífico Oriental, causando importantes epidemias en África, Asia, islas del Índico y Europa Occidental, llegando a establecerse recientemente en islas del Caribe.
Debido a su comportamiento dual endémico y epidémico, a sus propiedades virológicas y a la presencia global de sus vectores, este virus entraña el riesgo de causar grandes epidemias e instalarse en el territorio continental de las Américas a partir de la introducción de casos importados y a la circulación local vista en la región caribeña.
Se revisan las principales características epidemiológicas y clínicas de la fiebre chikungunya y el riesgo de introducción de esta enfermedad en las Américas, enfatizando el rol de la vigilancia y la lucha contra los mosquitos en su prevención.
Palabras clave: Chikungunya, Medicina tropical, Infecciones emergentes
Abstract
The recent onset of epidemics caused by viruses such as Ebola, Marburg, Nipah, Lassa, coronavirus, West-Nile encephalitis, Saint Louis encephalitis, human immunodeficiency virus, dengue, yellow fever and Venezuelan hemorrhagic fever alerts about the risk these agents represent for the global health.
Chikungunya virus represents a new threat. Surged from remote African regions, this virus has become endemic in the Indic ocean basin, the Indian subcontinent and the southeast of Asia, causing serious epidemics in Africa, Indic Ocean Islands, Asia and Europe.
Due to their epidemiological and biological features and the global presence of their vectors, chikungunya represents a serious menace and could become endemic in the Americas. Although chikungunya infection has a low mortality rate, its high attack ratio may collapse the health system during epidemics affecting a sensitive population.
In this paper, we review the clinical and epidemiological features of chikungunya fever as well as the risk of its introduction into the Americas. We remark the importance of the epidemiological control and mosquitoes fighting in order to prevent this disease from being introduced into the Americas.
Keywords: Chikungunya, Tropical medicine, Emerging infections
Introducción
Chikungunya es una virosis emergente que se manifiesta como un síndrome febril con artralgias intensas y exantema, causada por un alfavirus transmitido por mosquitos, el virus chikungunya.
Esta enfermedad se ha diseminado globalmente en la última década, amenazando con hacerse pandémica y constituyendo una de las mayores virosis emergentes del siglo xxi.
El riesgo de epidemias de chikungunya a partir de casos importados resulta especialmente elevado en las Américas, donde los vectores se hallan presentes en número suficiente y la población no posee inmunidad contra el virus.
Epidemiología
Los primeros casos fueron originalmente descritos por Robinson en la excolonia británica de Tanganika (actual Tanzania)1 durante los años de la década de 1950.
Tras su descubrimiento, chikungunya se diseminó rápidamente. El primer brote urbano afectó Bangkok en 1960, seguido por pequeños brotes en India entre 1963 y 1973. En 2004 ocurrió la primera gran epidemia en Kenia2, 3, 4, y un año más tarde ocurrieron 250.000 casos en la Isla de La Reunión (océano Índico), a un ritmo de hasta 40.000 nuevos casos semanales5.
Desde la cuenca del Índico –importante destino turístico–, la enfermedad se introdujo en más de 18 países de Europa, América y Asia, estableciendo en algunos de ellos una circulación local endémica con numerosos casos autóctonos (fig. 1 ). En 2007 el virus chikungunya causó un brote local en Italia6.
Figura 1.
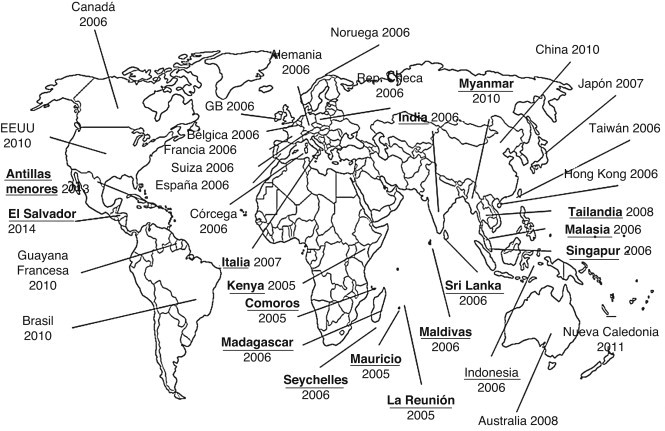
Países afectados y año de aparición de la fiebre chikungunya.
Subrayado-negrita: países donde la enfermedad se ha tornado endémica o donde han ocurrido brotes locales.
Desde entonces, la aparición de casos en Australia, Japón, Brasil, EE. UU., Canadá y el Caribe resalta la capacidad de este virus para ocupar nuevos nichos ecológicos y causar epidemias.
Algunos factores, como una elevada tasa de ataque7, una alta viremia (frecuentemente mayor a 15 log10 unidades formadoras de placas por mililitro de sangre) y la distribución global de los mosquitos vectores8, favorecen la rápida diseminación de este agente9.
El riesgo de epidemias y endemicidad en las Américas parece muy elevado debido a la existencia de una población sensible a la enfermedad, la ubicuidad de los mosquitos vectores y la introducción cada vez más frecuente de casos importados. En efecto, entre 2006 y 2010 se confirmaron 106 casos de chikungunya en viajeros retornados a EE. UU., frente a solo 3 casos ocurridos entre 1995 y 2005. Durante el mismo período ocurrieron 9 casos importados en los territorios franceses de las Américas, y a partir de 2013 se ha detectado la transmisión autóctona del virus en varias islas del Caribe, con 661 casos probables o confirmados en la isla de San Martín, 518 casos en Martinica, 175 casos en Guadalupe y 83 casos en San Bartolomé, además de casos detectados en las islas Vírgenes, Jost Van Dyke, Dominica, Anguila y Barbuda. Recientemente, han ocurrido mas de 1.000 casos autóctonos en la república de El Salvador.
Los magros resultados logrados en el control de otras virosis transmitidas por mosquitos, como el dengue, la encefalitis de Saint Louis y la encefalitis del Nilo Occidental, y la amplia distribución de vectores transmisores ensombrecen aún más este panorama.
El virus chikungunya exhibe un comportamiento dual, epidémico y endémico: cuando comienza a circular en una población desprovista de inmunidad, su elevada tasa de ataque permite la aparición de grandes epidemias, pudiendo afectar hasta al 40% de la población sensible10. Pero a medida que crece el número de personas con inmunidad específica, la enfermedad se torna endémica, limitándose a originar casos esporádicos entre las personas que aún carecen de inmunidad.
El agente
Chikungunya es un alfavirus perteneciente a la familia Togaviridae. El genus alfavirus consta de 29 especies distintas, 6 de las cuales afectan a seres humanos y causan enfermedades con compromiso articular: virus chikungunya (global); virus o’nyong-nyong (África Central); virus Ross River y virus Barmah Forest (Australia y el Pacífico); virus Sindbis (global) y virus Mayaro (Guayana francesa)11.
Como otros alfavirus, chikungunya consiste en una sola hebra positiva de ARN constituida por 12.000 nucleótidos que codifican genes regulatorios y un único gen estructural. Este gen estructural codifica una proteína precursora que, una vez fragmentada, da origen a la proteína de la cápside, a 2 glucoproteínas mayores de la superficie viral denominadas E1 y E2, y a dos pequeños péptidos llamados E3 y E612.
Vectores
Los principales vectores del virus chikungunya en Asia y el océano Índico son los mosquitos Aedes aegypti y Aedes albopictus, pero otras especies de Aedes (A. furcifer, A. vittatus, A. fulgens, A. luteocephalus, A. dalzieli, A. vigilax y A. camptorhynchites) pueden transmitir la infección. Otros mosquitos, como Culex annulirostris, Mansonia uniformis y Anopheles stephensi, han sido ocasionalmente implicados como vectores13, 14, 15, 16.
A. aegypti y A. albopictus son especies invasivas que habitan regiones tropicales y templadas del globo situadas entre los 35° N y los 35° S. Durante la estación cálida avanzan hasta latitudes extremas como los 45°, aunque no sobreviven al invierno en estas latitudes extremas. Su capacidad para criar en recipientes artificiales facilita su diseminación pasiva a través de las principales rutas de transporte17.
A. aegypti tiene hábitos domésticos y peridomésticos. Usualmente no ocupa territorios situados a más de 1.000 m de altitud, aunque ha sido hallado ocasionalmente hasta los 2.400 m.
A. albopictus tiene hábitos selváticos y prolifera en ambientes silvestres. Es una especie salvaje y rural, responsable de la transmisión del virus en zonas rurales o semiurbanas.
Los huevos de Aedes resisten la desecación y temperaturas extremas, manteniéndose viables durante 7 meses a un año. Esta propiedad constituye una ventaja evolutiva que dificulta notablemente la erradicación del vector.
Como sucede con otros mosquitos, solo pican las hembras Aedes. Estas son antropófilas y prefieren picar a personas antes que a animales.
Siendo también el vector de la fiebre amarilla y del dengue, Aedes ha sido duramente combatido y eliminado de América Central y del Sur a comienzos del siglo xx, pero tras suspenderse las campañas de erradicación a comienzos de la década de 1960 ha resurgido en las regiones de las que fuera erradicado, e incluso extendido su hábitat a sitios que no ocupaba antes de la campaña de erradicación.
Al compartir los mismos vectores, la epidemiología del dengue y la de la fiebre amarilla están estrechamente ligadas con el riesgo de introducción del virus chikungunya en las Américas. Debido a la amplia distribución de los Aedes en las Américas, toda la región es susceptible a la invasión y la diseminación de este virus, y la aparición reciente de epidemias urbanas de dengue en Sudamérica destaca el peligro potencial de fiebre chikungunya.
Transmisión
Durante los períodos epidémicos, los humanos son el principal reservorio del virus, que se mantiene en circulación alternando, al igual que el dengue, entre mosquitos y humanos. En los períodos interepidémicos, diversos vertebrados han sido implicados como reservorios, incluyendo primates no humanos, roedores, aves y algunos mamíferos pequeños. En África Centrooriental el virus circula en un ciclo selvático que involucra mosquitos Aedes y primates.
El virus chikungunya se transmite a los humanos mediante la picadura de mosquitos hembra infectados. Tras ingerir sangre de una persona virémica, el virus debe replicarse en el mosquito durante al menos 48 h (período de incubación extrínseco) antes de que este pueda transmitir la enfermedad al picar nuevamente18. Al igual que sucede en el dengue, los humanos infectados se mantienen virémicos varios días, aproximadamente el mismo tiempo que dura la fiebre (fig. 2 ).
Figura 2.
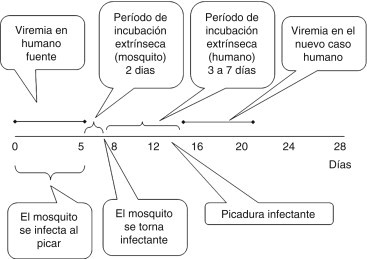
Ciclos de incubación extrínsecos (mosquito) e intrínsecos (humano) del virus chikungunya.
La transmisión vertical del virus chikungunya ha sido bien documentada. Aunque la tasa de transmisión vertical parece baja a lo largo de la gestación, cuando la infección ocurre durante el parto o poco antes, la tasa de transmisión aumenta y se aproxima al 50%19.
No se ha documentado transmisión mediante la lactancia, pero sí a través de la exposición a sangre infectada, mostrando la posibilidad de transmisión mediante transfusiones de sangre o hemoderivados20.
Características clínicas
El nombre «chikungunya» significa «el que se dobla» en idioma Makonde (lengua bantú de Tanzania), y hace referencia a las artralgias intensas, que obligan a los enfermos a replegarse en actitud antálgica.
La infección puede causar manifestaciones agudas, subagudas y crónicas.
Enfermedad aguda (fiebre chikungunya)
Un alto porcentaje de los infectados (72 a 97%) desarrollan síntomas tras un período de incubación que oscila entre 3 y 7 días (límites: 1 a 12), mientras que el resto permanece completamente asintomático21, 22.
La fiebre chikungunya remeda al dengue por su comienzo súbito con fiebre, que suele superar los 39 °C, exantema y cefaleas, pero la presencia de artralgias intensas lo diferencia de esa enfermedad. Típicamente, la fiebre persiste 48 h y cede abruptamente, aunque en algunos casos dura hasta una semana. Este cuadro febril suele acompañarse de síntomas inespecíficos, como cefaleas, inyección conjuntival y fotofobia.
Chikungunya no amenaza la vida, pero la recuperación puede ser prolongada y los dolores articulares pueden persistir durante meses23.
El compromiso articular múltiple afecta al 70-100% de los pacientes. Suele ser simétrico y afecta pequeñas articulaciones de manos y pies, aunque ocasionalmente ataca grandes articulaciones de los miembros. Puede limitarse a artralgias, o puede aparecer tumefacción articular, frecuentemente debida a tenosinovitis. La combinación de dolor, sensibilidad, inflamación y rigidez articular suele ser muy invalidante, e incapacita a muchos pacientes, que quedan confinados al lecho durante el período agudo.
Dos a 5 días después del inicio de la fiebre, el 50% de los pacientes desarrollan un exantema maculopapular, u ocasionalmente petequial, que afecta el tronco y, con menos frecuencia, las extremidades, pudiendo extenderse a palmas, plantas y rostro. El exantema tiende a ser fugaz, aunque persiste más de 2 días en un 10% de los casos. Ocasionalmente aparece como un eritema difuso que palidece con la presión. En los niños pequeños, el compromiso cutáneo consiste en lesiones vesiculares o ampollares.
Un 25% de los adultos sufren estomatitis, y el 15% desarrollan úlceras orales (tabla 1 ).
Tabla 1.
Manifestaciones habituales de la infección por virus chikungunya
| Característica clínica | Porcentaje de frecuencia |
|---|---|
| Fiebre | 76-100 |
| Poliartralgias | 71-100 |
| Poliartritis | 12-32 |
| Mialgias | 46-72 |
| Dorsalgia | 34-52 |
| Náuseas y vómitos | 50-70 |
| Exantema | 30-77 |
| Cefalea | 17-74 |
| Conjuntivitis | 3-56 |
Los síntomas duran de 5 a 7 días, y nunca más de 10. Sin embargo, las artralgias pueden persistir hasta 2 años, dependiendo de la edad del paciente (fig. 3 ).
Figura 3.
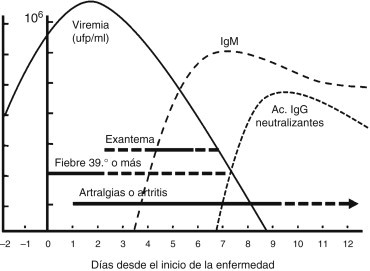
Gráfico clínico de la fiebre chikungunya.
ufp/ml: unidades formadoras de placas por mililitro de sangre.
Enfermedad subaguda
La mayoría de los pacientes mejora al cabo de 10 días de enfermedad. Sin embargo, algunos enfermos sufren una recidiva de los síntomas articulares 2 o 3 meses después de la recuperación inicial, desarrollando artralgias en las articulaciones y huesos previamente afectados, poliartritis distal y tenosinovitis hipertrófica subaguda en muñecas y tobillos. También pueden desarrollar síndrome de Raynaud, depresión, astenia y debilidad.
La infección subaguda por chikungunya no persiste más de 3 meses y afecta a un porcentaje variable de los pacientes, que oscila entre un 43 y un 70% de los casos.
Enfermedad crónica
Cuando los síntomas persisten durante más de 3 meses se considera enfermedad crónica. El porcentaje de pacientes que desarrolla manifestaciones crónicas es muy variable, oscilando entre un 12 y un 57%24, 25.
La enfermedad crónica tiende a resolverse con el tiempo: el 93% de los casos persiste sintomático al cabo de 3 meses de definida la enfermedad como crónica, pero este porcentaje se reduce a 57% al cabo de 15 meses, y a 47% 2 años más tarde26.
Se han documentado abortos espontáneos en embarazadas infectadas27. En los casos de transmisión vertical durante o inmediatamente antes del parto es habitual que el niño nazca asintomático y desarrolle síntomas al cabo de unos días28, 29.
Excepcionalmente pueden ocurrir formas graves de la enfermedad con manifestaciones atípicas, entre las que destacan miocarditis, meningoencefalitis y hemorragias leves30. También se han observado síndrome de Guillain-Barré, pérdida de la agudeza auditiva31, 32, 33, 34, uveítis y retinitis35, 36, 37 (tabla 2 ).
Tabla 2.
Manifestaciones poco frecuentes de la infección por virus chikungunya
| Sistema, aparato u órgano blanco | Manifestaciones |
|---|---|
| Sistema nervioso central | Meningitis, encefalopatía, paresia, parálisis, neuropatía, síndrome cerebeloso, síndrome de Guillain-Barré, convulsiones |
| Aparato cardiovascular | Miocarditis, pericarditis, arritmias, inestabilidad hemodinámica, insuficiencia cardíaca |
| Riñón | Nefritis, insuficiencia renal aguda |
| Ojo | Uveítis, epiescleritis, iridociclitis, neuritis óptica, retinitis |
| Piel | Nefritis, insuficiencia renal aguda |
| Aparato respiratorio | Neumonía, insuficiencia respiratoria |
| Sistema endocrino | Insuficiencia suprarrenal, síndrome de secreción inadecuada de vasopresina |
| Miscelánea | Hepatitis, pancreatitis, diátesis hemorrágica |
La fiebre chikungunya tiene una mortalidad muy baja. Sin embargo, el genio epidémico puede modificar las tasas de mortalidad, ya que las epidemias de la India e isla Mauricio mostraron un aumento significativo en la mortalidad38, 39.
Los ancianos son más propensos a sufrir episodios graves de fiebre chikungunya: en un estudio, los mayores de 65 años presentaron una mortalidad 50 veces mayor que los menores de 45 años40.
Diagnóstico diferencial
Las manifestaciones prominentes de la fiebre chikungunya, como fiebre, artralgias, exantema, mialgias y conjuntivitis, son frecuentes en otras enfermedades con las que puede confundirse o coexistir, como el dengue, lo que obliga a realizar un diagnóstico diferencial meticuloso.
Dengue: es la entidad más parecida a la fiebre chikungunya y la que plantea el diagnóstico diferencial más importante debido a la superposición de vectores, espacio geográfico y cuadro clínico, y a la posibilidad de que ambas enfermedades afecten simultáneamente a un mismo paciente. En el único estudio comparativo realizado, chikungunya muestra un comienzo más abrupto; la fiebre es de menor duración que en el dengue, y el exantema, la inyección conjuntival y las artralgias fueron más frecuentes que en el dengue41 (tabla 3 ).
Tabla 3.
Frecuencia de los síntomas presentes en el dengue y la fiebre chikungunya
| Características clínicas | Chikungunya, % | Dengue, % |
|---|---|---|
| Fiebre | 70-100 | 40-69 |
| Cefalea | 40-69 | 40-69 |
| Exantema | 40-69 | 10-39 |
| Artralgias o artritis | 70-100 | < 10 |
| Mialgias | 10-39 | 40-69 |
| Diátesis hemorrágica | < 10 | 40-69 |
| Shock | 0 | < 10 |
| Leucocitopenia | 40-69 | 70-100 |
| Linfopenia | 70-100 | 40-69 |
| Neutropenia | 10-39 | 70-100 |
| Trombocitopenia | 10-39 | 70-100 |
El hallazgo de diátesis hemorrágicas, petequias o púrpura, junto con dorsalgia intensa, evidencia el diagnóstico de dengue. Las pruebas de laboratorio ayudan a diferenciar entre ambas entidades, teniendo siempre presente que dengue y fiebre chikungunya pueden afectar simultáneamente al mismo paciente.
Leptospirosis: mialgias graves en los músculos de la pantorrilla, junto con hemorragia subconjuntival o congestión conjuntival, acompañadas o no de oliguria o ictericia en una persona que ha tomado contacto con agua, barro o roedores en una zona endémica ayudan a establecer el diagnóstico. La presencia de neutrofilia y títulos elevados de creatinfosfocinasa en sangre favorecen el diagnóstico de leptospirosis.
Paludismo: la periodicidad de la fiebre, así como la alteración en el nivel de conciencia y las convulsiones, favorecen el diagnóstico de paludismo. La periodicidad típica de la fiebre palúdica puede no aparecer en los primeros días de la enfermedad (fiebre de aclimatación).
Meningitis: la combinación de fiebre elevada con signos meníngeos o trastornos de conciencia evidencian el diagnóstico de meningitis. Sin embargo, durante una epidemia de chikungunya, todos los casos de meningoencefalitis deben sospecharse como debidos a esta infección.
Fiebre reumática: es más común en los niños y se presenta como una poliartritis migratoria que afecta predominantemente las grandes articulaciones. Los criterios de Jones deberían guiar el diagnóstico.
Hallazgos de laboratorio
El hemograma suele mostrar leucocitopenia. A diferencia del dengue, la trombocitopenia suele estar ausente o ser solo muy ligera (> 100.000 plaquetas/mm3). A diferencia de otras virosis, los marcadores de inflamación, como la velocidad de eritrosedimentación y la proteína C reactiva, suelen estar elevados. También aparece un discreto aumento de las transaminasas.
Diagnóstico
El diagnóstico puede realizarse por métodos directos o indirectos. Los métodos directos incluyen los procedimientos moleculares, como la retrotranscripción de la reacción en cadena de la polimerasa y el aislamiento del virus por cultivo, en tanto que los métodos indirectos se basan en la detección de anticuerpos específicos, ya sean estos de tipo IgM o, en el caso de las IgG, demostrando una elevación de al menos 3 veces los valores basales al cabo de 2 o 3 semanas.
Los anticuerpos de tipo IgM no alcanzan un título demostrable por enzimoinmunoanálisis (ELISA) antes de transcurridas 2 semanas desde la infección. Por este motivo no se recomienda realizar esta prueba durante la primera semana de la enfermedad. En algunos casos, la prueba ELISA se positiviza al cabo de 6 a 12 semanas (fig. 4 ).
Figura 4.
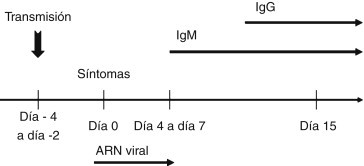
Cronología diagnóstica de la fiebre chikungunya. Momento evolutivo óptimo para realizar las diferentes pruebas diagnósticas.
Tratamiento y prevención
No se conoce ningún tratamiento antiviral efectivo para la fiebre chikungunya, lo que reduce las medidas terapéuticas a la administración de analgésicos no salicílicos y antiinflamatorios no esteroideos.
Aunque se ha demostrado un efecto sinérgico entre el interferón α y la ribavirina sobre el virus chikungunya, no existen pruebas clínicas que avalen el uso de esta combinación. La cloroquina no parece tener eficacia para el tratamiento de las artralgias.
Al no existir una vacuna eficaz, la prevención se basa en evitar las picaduras de mosquito. En las zonas endémicas estas medidas se complementan con la lucha contra los vectores mediante medidas de saneamiento y fumigación que tiendan a reducir el número de mosquitos.
Quienes viajen a zonas endémicas pueden aplicar insecticidas como permetrina directamente sobre la ropa. Este insecticida tiene un largo efecto residual, resistiendo de 4 a 5 lavados. También pueden emplearse repelentes de uso tópico que contengan N, N-dietil-m-toluamida en concentraciones entre 30 y 35%. Los repelentes deben aplicarse directamente sobre la piel expuesta, procurando evitar el contacto con la conjuntiva y otras mucosas debido a su toxicidad. En niños se recomienda utilizar concentraciones inferiores al 30%.
Los perfumes deben evitarse, puesto que atraen a los mosquitos. El aire acondicionado ayuda a controlar la circulación de mosquitos en el interior de las viviendas.
Conclusiones
En las Américas el control de los virus transmitidos por artrópodos no ha sido muy exitoso: el dengue continúa apareciendo en una región que se extiende desde los EE. UU. hasta la Patagonia, y en años recientes ha desarrollado brotes de una magnitud nunca antes vista; el virus del Nilo Occidental, un arbovirus recientemente introducido en las Américas, es ahora endémico en la región. Durante la última década, este virus ha expandido su área desde Canadá hasta Argentina. Recientemente, otro arbovirus relacionado, el virus de la encefalitis de Saint Louis, causó varios casos confirmados en Argentina.
La reciente aparición de casos con transmisión autóctona del chikungunya en la región caribeña aumenta significativamente el riesgo de introducción en el continente americano, especialmente en áreas tropicales y subtropicales donde A. aegypti está ampliamente distribuido, y la existencia de una población sensible a la infección crea las condiciones ideales para la introducción y diseminación del virus.
Considerando la elevada tasa de ataque vista durante las epidemias de chikungunya, los grandes brotes resultantes tienen el potencial de colapsar los sistemas de atención de salud existentes y la infraestructura de salud pública. Ante este escenario, tanto las autoridades sanitarias como los médicos de atención primaria deben estar advertidos del riesgo potencial y de la necesidad de controlar y combatir los insectos vectores.
Conflicto de intereses
El autor declara no tener ningún conflicto de intereses.
Bibliografía
- 1.Mason P.J., Haddow A.J. An epidemic of virus disease in Southern Province, Tanganyika Territory, in 1952-53. An additional note on Chikungunya virus isolations and serum antibodies. Trans R Soc Trop Med Hyg. 1957;51:238–240. doi: 10.1016/0035-9203(57)90022-6. [DOI] [PubMed] [Google Scholar]
- 2.Robinson M.C. An epidemic of virus disease in Southern Province, Tanganyika territory, in 1952-53. Trans R Soc Trop Med Hyg. 1955;49:28–32. doi: 10.1016/0035-9203(55)90080-8. [DOI] [PubMed] [Google Scholar]
- 3.Outbreak and spread of chikungunya. Wkly Epidemiol Rec. 2007;82:409–415. [PubMed] [Google Scholar]
- 4.Powers A.M., Logue C.H. Changing patterns of chikungunya virus: Reemergence of a zoonotic arbovirus. J Gen Virol. 2007;88:2363–2377. doi: 10.1099/vir.0.82858-0. [DOI] [PubMed] [Google Scholar]
- 5.Renault P., Solet J.L., Sissoko D., Balleydier E., Larrieu S., Filleul L. A major epidemic of chikungunya virus infection on Reunion Island, France, 2005-2006. Am J Trop Med Hyg. 2007;77:727–731. [PubMed] [Google Scholar]
- 6.Rezza G., Nicoletti L., Angelini R., Romi R., Finarelli A.C., Panning M. Infection with chikungunya virus in Italy: an outbreak in a temperate region. Lancet. 2007;370:1840–1846. doi: 10.1016/S0140-6736(07)61779-6. [DOI] [PubMed] [Google Scholar]
- 7.Sergon K., Njuguna C., Kalani R., Ofula V., Onyango C., Konongoi L.S. Seroprevalence of Chikungunya virus (CHIKV) infection on Lamu Island, Kenya, October 2004. Am J Trop Med Hyg. 2008;78:333–337. [PubMed] [Google Scholar]
- 8.Knudsen A.B. Global distribution and continuing spread of Aedes albopictus. Parassitologia. 1995;37:91–97. [PubMed] [Google Scholar]
- 9.Kariuki Njenga M., Nderitu L., Ledermann J.P., Ndirangu A., Logue C.H., Kelly C.H. Tracking epidemic chikungunya virus into the Indian Ocean from East Africa. J Gen Virol. 2008;89:2754–2760. doi: 10.1099/vir.0.2008/005413-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Padbidri V.S., Gnaneswar T.T. Epidemiological investigations of chikungunya epidemic at Barsi, Maharashtra state, India. J Hyg Epidemiol Microbiol Immunol. 1979;23:445–451. [PubMed] [Google Scholar]
- 11.Strauss J.H., Strauss E.G. The alphaviruses: Gene expression, replication, and evolution. Microbiol Rev. 1994;58:491–562. doi: 10.1128/mr.58.3.491-562.1994. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Powers A.M., Logue C.H. Changing patterns of chikungunya virus: Re-emergence of a zoonotic arbovirus. J Gen Virol. 2007;88:2363–2377. doi: 10.1099/vir.0.82858-0. [DOI] [PubMed] [Google Scholar]
- 13.Jupp P.G., McIntosh B.M. Aedes furcifer and other mosquitoes as vectors of chikungunya virus at Mica, northeastern Transvaal, South Africa. J Am Mosq Control Assoc. 1990;6:415–420. [PubMed] [Google Scholar]
- 14.Jupp P.G., McIntosh B.M., dos Santos I., DeMoor P. Laboratory vector studies on six mosquito and one tick species with chikungunya virus. Trans R Soc Trop Med Hyg. 1981;75:15–19. doi: 10.1016/0035-9203(81)90005-5. [DOI] [PubMed] [Google Scholar]
- 15.Pialoux G., Gaüzère B.A., Jauréguiberry S., Strobel M. Chikungunya, an epidemic arbovirosis. Lancet Infect Dis. 2007;7:319–327. doi: 10.1016/S1473-3099(07)70107-X. [DOI] [PubMed] [Google Scholar]
- 16.Staples J.E., Breiman R.F., Powers A.M. Chikungunya fever: An epidemiological review of a re-emerging infectious disease. Clin Infect Dis. 2009;49:942–948. doi: 10.1086/605496. [DOI] [PubMed] [Google Scholar]
- 17.Lounibos L.P. Invasions by insect vectors of human disease. Annu Rev Entomol. 2002;47:233–266. doi: 10.1146/annurev.ento.47.091201.145206. [DOI] [PubMed] [Google Scholar]
- 18.Dubrulle M., Mousson L., Moutailler S., Vazeille M., Failloux A.B. Chikungunya virus and Aedes mosquitoes: Saliva is infectious as soon as two days after oral infection. PLoS One. 2009;4:e5895. doi: 10.1371/journal.pone.0005895. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Gerardin P., Barau G., Michault A., Bintner M., Randrianaivo H., Choke G. Multidisciplinary prospective study of mother-to-child chikungunya virus infections on the island of La Reunion. PLoS Med. 2008;5:e60. doi: 10.1371/journal.pmed.0050060. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Cordel H., Quatresous I., Paquet C., Couturier E. Imported cases of chikungunya in metropolitan France, April 2005-February 2006. Euro Surveill. 2006;11:2944. doi: 10.2807/esw.11.16.02944-en. Disponible en: http://www.eurosurveillance.org/ViewArticle.aspx?ArticleIdp2944. [DOI] [PubMed] [Google Scholar]
- 21.Queyriaux B., Simon F., Grandadam M., Michel R., Tolou H., Boutin J.P. Clinical burden of chikungunya virus infection. Lancet Infect Dis. 2008;8:2–3. doi: 10.1016/S1473-3099(07)70294-3. [DOI] [PubMed] [Google Scholar]
- 22.Moro M.L., Cagliotti C., Silvi G., Angelini R., Sambri V., Rezza G. Chikungunya virus in North-Eastern Italy: A seroprevalence survey. Am J Trop Med Hyg. 2010;82:508–511. doi: 10.4269/ajtmh.2010.09-0322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Shah N., Pal U.S., Shirsat M.K., Shirsat V.M., Verma M., Joshi R. Advance review of chikungunya. AJPTR. 2011;1:60–71. [Google Scholar]
- 24.Fourie E.D., Morrison J.G. Rheumatoid arthritic syndrome after chikungunya fever. S Afr Med J. 1979;56:130–132. [PubMed] [Google Scholar]
- 25.Brighton S.W., Prozesky O.W., de la Harpe A.L. Chikungunya virus infection. A retrospective study of 107 cases. S Afr Med J. 1983;63:313–315. [PubMed] [Google Scholar]
- 26.Organización Panamericana de la Salud . OPS; Washington, D. C.: 2011. Preparación y respuesta ante la eventual introducción del virus chikungunya en las Américas. [Google Scholar]
- 27.Touret Y., Randrianaivo H., Michault A., Schuffenecker I., Kauffmann E., Lenglet Y. Early maternal-fetal transmission of the chikungunya virus. Presse Med. 2006;35:1656–1658. doi: 10.1016/S0755-4982(06)74874-6. [DOI] [PubMed] [Google Scholar]
- 28.Fritel X., Rollot O., Gerardin P., Gauzere B.A., Bideault J., Lagarde L., Chikungunya-Mere-Enfant Team Chikungunya virus infection during pregnancy, Reunion, France, 2006. Emerg Infect Dis. 2010;16:418–425. doi: 10.3201/eid1604.091403. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Robillard P.Y., Boumahni B., Gérardin P., Michault A., Fourmaintraux A., Schuffenecker I. Vertical maternal fetal transmission of the chikungunya virus. Ten cases among 84 pregnant women. Presse Med. 2006;35(5 Pt 1):785–788. doi: 10.1016/s0755-4982(06)74690-5. [DOI] [PubMed] [Google Scholar]
- 30.Obeyesekere I., Hermon Y. Myocarditis and cardiomyopathy after arbovirus infections (dengue and chikungunya fever) Br Heart J. 1972;34:821–827. doi: 10.1136/hrt.34.8.821. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Wielanek A.C., Monredon J.D., Amrani M.E., Roger J.C., Serveaux J.P. Guillain-Barré syndrome complicating a chikungunya virus infection. Neurology. 2007;69:2105–2107. doi: 10.1212/01.wnl.0000277267.07220.88. [DOI] [PubMed] [Google Scholar]
- 32.Rampal S.M., Meena H. Neurological complications in chikungunya fever. J Assoc Physicians India. 2007;55:765–769. [PubMed] [Google Scholar]
- 33.Singh S.S., Manimunda S.P., Sugunan A.P., Sahina, Vijayachari P. Four cases of acute flaccid paralysis associated with chikungunya virus infection. Epidemiol Infect. 2008;136:1277–1280. doi: 10.1017/S0950268807009739. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Bhavana K., Tyagi I., Kapila R.K. Chikungunya virus induced sudden sensorineural hearing loss. Int J Pediatr Otorhinolaryngol. 2008;72:257–259. doi: 10.1016/j.ijporl.2007.09.022. [DOI] [PubMed] [Google Scholar]
- 35.Mittal A., Mittal S., Bharathi J.M., Ramakrishnan R. Uveitis during outbreak of chikungunya fever. Ophthalmology. 2007;114:1798. doi: 10.1016/j.ophtha.2007.03.045. [DOI] [PubMed] [Google Scholar]
- 36.Lalitha P., Rathinam S., Banushree K., Maheshkumar S., Vijayakumar R., Sathe P. Ocular involvement associated with an epidemic outbreak of chikungunya virus infection. Am J Ophthalmol. 2007;144:552–556. doi: 10.1016/j.ajo.2007.06.002. [DOI] [PubMed] [Google Scholar]
- 37.Mahendradas P., Ranganna S.K., Shetty R., Balu R., Narayana K.M., Babu R.B. Ocular manifestations associated with chikungunya. Ophthalmology. 2008;115:287–291. doi: 10.1016/j.ophtha.2007.03.085. [DOI] [PubMed] [Google Scholar]
- 38.Mavalankar D., Shastri P., Bandyopadhyay T., Parmar J., Ramani K.V. Increased mortality rate associated with chikungunya epidemic, Ahmedabad, India. Emerg Infect Dis. 2008;14:412–415. doi: 10.3201/eid1403.070720. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Beesoon S., Funkhouser E., Kotea N., Spielman A., Robich R.M. Chikungunya fever, Mauritius, 2006. Emerg Infect Dis. 2008;14:337–338. doi: 10.3201/eid1402.071024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Economopoulou A., Dominguez M., Helynck B., Sissoko D., Wichmann O., Quenel P. Atypical chikungunya virus infections: Clinical manifestations, mortality and risk factors for severe disease during the 2005-2006 outbreak on Reunion. Epidemiol Infect. 2009;137:534–541. doi: 10.1017/S0950268808001167. [DOI] [PubMed] [Google Scholar]
- 41.Nimmannitya S., Halstead S.B., Cohen S.N., Margiotta M.R. Dengue and chikungunya virus infection in man in Thailand, 1962-1964. I. Observations on hospitalized patients with hemorrhagic fever. Am J Trop Med Hyg. 1969;18:954–971. doi: 10.4269/ajtmh.1969.18.954. [DOI] [PubMed] [Google Scholar]


