Zusammenfassung
Das akut-auf-chronische Leberversagen („acute-on-chronic liver failure“, ACLF) ist ein emergentes Krankheitssyndrom, das durch einen oder mehrere akute Trigger bei vorgeschädigter Leber ausgelöst wird und vom progressiven hepatalen und nichthepatalen Organversagen, einem gravierenden Risiko infektiöser Komplikationen sowie hoher kurzfristiger Letalität gekennzeichnet ist. Wenngleich pathophysiologisch noch weitgehend unverstanden erfordert das ACLF frühzeitige diagnostische und therapeutische Maßnahmen, die sich auf zugrunde liegende Ursachen sowie das Verhindern von Komplikationen richten, um die Prognose betroffener Patienten zu verbessern.
Schlüsselwörter: Leberversagen, Zirrhose, Infektion, Organversagen, Transplantation
Abstract
Acute-on-chronic liver failure (ACLF) is an emerging clinical syndrome in patients with underlying liver disease that is usually triggered by one or multiple insults and characterized by progressive hepatic and nonhepatic organ failure, a significant risk of infections, and high short-term mortality rates. Despite our incomplete understanding of the underlying pathophysiology, ACLF requires timely diagnostic and therapeutic measures aiming at the identification and elimination of causative factors as well as the prevention of complications to improve the prognosis of affected patients.
Keywords: Liver failure, Cirrhosis, Infection, Organ failure, Transplantation
Das Krankheitsbild ACLF
Das akut-auf-chronische Leberversagen (ACLF) wird im Zusammenschluss der European Association for the Study of the Liver (EASL) und der American Association for the Study of Liver Diseases (AASLD) als „akute Verschlechterung einer vorbestehenden chronischen Lebererkrankung, die üblicherweise im Zusammenhang mit einem auslösenden Ereignis steht und aufgrund eines Multiorganversagens mit erhöhter 3‑Monats-Letalität verbunden ist“ definiert [1]. Der Fokus der Definition liegt dabei eindeutig auf dem Organversagen, das zumeist extrahepatische Organe betrifft (Abb. 1) und die Prognose betroffener Patienten am stärksten beeinflusst [2, 3]. Zur Identifizierung, Risikostratifizierung sowie Definition in Abhängigkeit von klinisch relevanten Outcomeparametern wurden in 2 großen prospektiven multizentrischen Untersuchungen – davon eine in Europa (Chronic Liver Failure Consortium Acute on Chronic Liver Failure in Cirrhosis, CANONIC) und eine in Kanada/den USA (North American Consortium for the Study of End Stage Liver Disease, NACSELD) – Risikogruppen mit hoher kurzfristiger Mortalität identifiziert. Gleichzeitig wurde die prognostische Wertigkeit klinischer Scores für das ACLF evaluiert [4, 5]. Hierbei zeigte sich ein in der Tendenz erwarteter, in der tatsächlichen Ausprägung jedoch alarmierender Anstieg der Kurzzeitletalität bis hin zu über 70 % [5]. Klar abzugrenzen ist das ACLF daher vom akuten Leberversagen (ALV), das durch den Funktionsausfall einer zuvor gesunden Leber definiert ist und bei dem durch intensivmedizinische und supportive Maßnahmen in über 70 % der Fälle ein Überleben ohne Organtransplantation erreicht werden kann [6, 7].
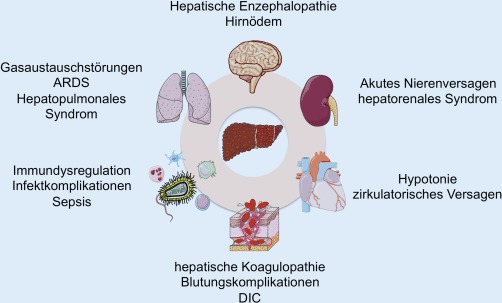
Ursachen des ACLF
Die Identifikation spezifischer Auslöser des ACLF ist für die Diagnosestellung nicht zwingend erforderlich (Tab. 1). Die häufigsten Auslöser des ACLF sind geographisch unterschiedlich verteilt und oft für den Krankheitsverlauf relevant [4). Die häufigsten Auslöser des ACLF sind geographisch unterschiedlich verteilt und oft für den Krankheitsverlauf relevant [4, 5]. Sie beinhalten lokale und generalisierte Infektionen, neue oder fortgesetzte Leberschädigung durch Alkohol und/oder andere hepatotoxische Substanzen, Operationen, Zirkulationsstörungen sowie seltenere Ursachen wie beispielsweise einen Schub einer autoimmunen Hepatitis (Tab. 2). Während die Varizenblutung traditionell eher als Dekompensation einer vorbestehenden Leberzirrhose gewertet und ihre Mortalität in den letzten Jahren durch moderne evidenzbasierte Behandlungsstrategien (einschließlich endoskopischer Blutstillung, medikamentöser und interventioneller Senkung des portosystemischen Druckgradienten und Vermeidung infektiöser Komplikationen) gesenkt werden konnte, können sowohl hämorrhagischer als auch septischer Schock nach einer Blutung ein ACLF auslösen. In bis zu 40 % der Fälle kann kein auslösendes Ereignis identifiziert werden. In diesen Fällen liegen möglicherweise subklinische Infektionen, passagere Störungen der intestinalen Barriere oder unerkannte hepatotoxische Effekte als mögliche Auslöser zugrunde [9].
| Kein ACLF | ACLF Grad 1 |
ACLF Grad 2 |
ACLF Grad 3 |
Dekompensierte Leberzirrhose | Akutes Leberversagen (ALF) |
|---|---|---|---|---|---|
| Kein Organversagen | Isoliertes Nierenversagen | 2-0rgan-Versagen | 3- oder Mehrorganversagen | Aszites, hepatorenales Syndrom, Varizenblutung HE und/oder synthetische Dysfunktion bei vorbekannter Leberzirrhose ohne Organversagen | Hepatische Koagulopathie (INR 2:1,5) und HE bei Patienten ohne Leberzirrhose Innerhalb von ≤26 Wochen nach Krankheitsbeginn |
| Einzelnes nichtrenales Organversagen (Leber Gerinnung, Zirkulation Respiration) mit Serumkreatinin <1,5 mg/dl und ohne HE |
Isoliertes Versagen von Leber, Gerinnung Kreislauf oder Respiration mit Serumkreatinin zwischen 1,5 und 1,9 mg/dl und/oder milde bis Moderate HE |
– | – | – | – |
| Isolierte HE mit Serumkreatinin <1,5 mg/dl | Isolierte HE und Serumkreatinin zwischen 1,5 und 1,9 mg/dl | – | – | – | – |
Definitionen von Organversagen (CANONIC): Leberversagen: Serumbilirubin ≥12,0 mg/dl, Nierenversagen: Serumkreatinin ≥2,0 mg/dl oder Einsatz von Nierenersatzverfahren, ZNS-Versagen: HE Grad 3 oder 4, koagulatorisches Versagen: INR >2,5 und/oder Thrombozyten ≤20.000/µI, zirkulatorisches Versagen: Einsatz von Katecholaminen oder Terlipressin, respiratorisches Versagen: paO2/FIO2 ≤ 200 oder SO2/FIO2 ≤ 200
HE hepatische Enzephalopathie, ZNS zentrales Nervensystem, F I O 2 inspiratorische Sauerstofffraktion, SO 2 pulsoxymetrische Sauerstoffsättigung, p a O 2 parterieller Sauerstoffpartialdruck
| ACLF-Auslöser (Häufigkeit) |
|---|
| Bakterielle Infektionen (39 %)/Sepsis |
| Aktiver Alkoholismus in den vergangenen 3 Monaten (23 %) |
| Gastrointestinale Blutungen (18 %) |
| Medikamente/alternative Heilmittel |
| Krankheitsschub bei AIH |
| Krankheitsschub bei Morbus Wilson |
| HAV-/HBV-(„flare“ oder Neuinfektion)/HCV-/HDV-/HEV-Infektion |
| TIPS-Anlage |
| Nichtbakterielle Infektionen |
| Parazentese ohne Albuminsubstitution |
| Operationen |
| Andere |
| >1 Auslöser (30 %) |
| Kein auslösender Faktor eruierbar (43 %) |
AIH Autoimmunhepatitis, HAV Hepatitis-A-Virus, HBV Hepatitis-B-Virus, HCV Hepatitis-C-Virus, HEV Hepatitis-E-Virus, TIPS transjugulärer intrahepatischer portosystemischer Stentshunt
Pathophysiologie des ACLF
Unabhängig davon, ob das ACLF durch direkte oder indirekte Schädigung der Leber ausgelöst wird, scheinen 2 Faktoren im Zentrum der Pathophysiologie der Erkrankung zu stehen: 1) hämodynamische Veränderungen und 2) systemische Inflammationsreaktionen („systemic inflammatory response syndrome“, SIRS; [9, 11]). Bei der fortgeschrittenen Zirrhose besteht eine hyperdyname Kreislaufsituation mit portaler Hypertension, was die pathophysiologische Grundlage für die kardinalen Dekompensationszeichen (Hypotonie, Aszites, hepatorenales Syndrom, gastrointestinale Blutungen) und gleichzeitig den Ansatzpunkt für lebensrettende Interventionen darstellt. In der komplexen Wechselwirkung aus Volumenhaushalt, kardialer Auswurfleistung und Aktivierung neurohumoraler Regelkreise scheint nach der gängigen Auffassung die effektive Hypovolämie durch periphere Vasodilatation im Splanchnikusgebiet eine Hauptrolle zu spielen. Diese Vasodilatation wiederum wird zunehmend als Resultat einer generalisierten Entzündungsantwort des Körpers aufgefasst, die durch verschiedenste Mediatoren ausgelöst und unterhalten werden kann. So wird angenommen, dass zugrundegehende Parenchymzellen in allen Geweben zelluläre Bestandteile („damage-associated molecular patterns“, DAMP) freisetzen, die umliegende Entzündungszellen aktivieren und im Sinne einer Immunpathologie durch sterile Entzündungsmechanismen zur verstärkten Organschädigung beitragen. Bei bakteriellen Infektionen hingegen gelten neben Toxinen und Virulenzfaktoren molekulare „Fremdsignaturen“ („pathogen-associated molecular patterns“, PAMP) als Stimulus für angeborene und adaptive Immuneffektoren, die der Pathogenabwehr dienen. Sie tragen jedoch ihrerseits lokal durch Unterdrückung der normalen Parenchymfunktionen und immunologische „Kollateralschädigung“ gesunder Gewebezellen zum Organausfall bei. Zirkulierende PAMP und DAMP und durch sie ausgelöste immunologische Effekte werden neben der Vasodilatation im Splanchnikusgebiet auch für die Ausbildung eines SIRS/einer Sepsis als klinische Syndrome einer generalisierten Entzündungsantwort des Körpers verantwortlich gemacht. Vieles deutet dabei darauf hin, dass eine überschießende Immunantwort bei Zirrhosepatienten zur Ausbildung eines ACLF beiträgt. So weisen Zirrhotiker sowohl in der Früh- als auch der Spätphase nach bakterieller Infektion signifikant höhere Level an proinflammatorischen Zytokinen (TNF-α, IL-6) auf als Patienten ohne Zirrhose [12]. Zudem wurden auch andere pro- und antiinflammatorische Zytokine (sTNF-α R1, IL-2, IL-8, IL-10, IFN-γ) in stark erhöhten plasmatischen Konzentrationen bei Patienten mit ACLF nachgewiesen [13]. Auch Routinelaborparameter, wie Leukozyten und CRP, sind bei Patienten mit ACLF erhöht und korrelieren in ihrer Höhe mit der Anzahl von Organausfällen und dem ACLF-Grad [5]. Bei Patienten, die eine erste Immunaktivierung im Rahmen des auslösenden Stimulus überleben, wird, ähnlich wie bei der Sepsis ohne Lebererkrankung, ein Übergang in einen immunsupprimierten bzw. immundysregulierten Zustand („immune paralysis“; [14]) beobachtet, der das Risiko für weitere Infektionen signifikant erhöht. Angesichts der hohen Letalität hospitalisierter Zirrhotiker bei Infektionen (etwa 15 %) bzw. bei schweren bakteriellen Infektionen mit septischem Schock (60–100 %; [15–17]) erscheint eine aggressive antiinfektive Präventions- und Therapiestrategie bei ACLF-Patienten von zentraler Bedeutung.
Klinische und prognostische Faktoren
Die CANONIC-Studie ging der Frage nach, welcher Anteil von – zunächst meist auf einer Normalstation – hospitalisierten Zirrhosepatienten ein ACLF aufweisen oder im Verlauf entwickeln und welche prognostischen Parameter sich in dieser Patientengruppe ausmachen lassen, um besonders gefährdete Subgruppen frühzeitig zu erkennen. Das ACLF wurde dabei als häufigste Indikation für eine Aufnahme von Zirrhosepatienten auf eine Intensivstation identifiziert. Die Anzahl und das jeweilige Ausmaß von Organversagen wurden mittels eines modifizierten Sequential-organ-failure-assessment(SOFA)-Scores erfasst, da sich dieses System in der Vergangenheit zuverlässiger in der Mortalitätsabschätzung von kritisch kranken Zirrhosepatienten erwiesen hatte als die MELD- oder Child-Pugh-Klassifikation. Der SOFA-Score wurde für die Studie modifiziert (Tab. 3) und schließlich in eine vereinfachte Form („CLIF consortium organ failure score“, CLIF-C-OFs) mit identischen Organparametern und ähnlichem prognostischem Wert modifiziert. Der Schweregrad des ACLF wurde anhand der Anzahl der Organausfälle (OF) stratifiziert: ACLF 1: 1 OF, ACLF 2: 2 OF, ACLF 3: 3–6 OF.
| Punkte Organ/System | 0 | 1 | 2 | 3 | 4 |
|---|---|---|---|---|---|
| Leber (Bilirubin, mg/dl) | <1,2 | ≥1,2 bis <2,0 | ≥2,0 bis <6,0 | ≥6,0 bis<12,0 | ≥12,0 |
| Niere (Kreatinin, mg/dl) | <1,2 | ≥1,2 bis <2,0 | ≥2,0 bis <3,5 oder Nierenersatzverfahren | ≥3,5 bis <5,0 oder Nierenersatzverfahren | ≥5,0 oder Nierenersatzverfahren |
| ZNS (HE-Grad) | Keine HE | I | II | III | IIII |
| Gerinnung (INR) | <1,1 | ≥1,1 bis <1,25 | ≥1,25 bis <1,5 | ≥1,5 bis <2,5 | ≥2,5 oder Thrombozyten ≤20.000/µI |
| Zirkulation (MAP, mm Hg) | ≥70 | <70 | Dopamin ≤5 µg/kg und Minute oder Einsatz von Dobutamin oder Terlipressin (jegliche Dosis) | Dopamin >5 µg/kg und Minute oder A ≤ 0,1 µg/kg und Minute oder NA ≤ 0,1 µg/kg und Minute | Dopamin >15 µg/kg und Minute oder A > 0,1 µg/kg und Minute oder NA > 0,1 µg/kg und Minute |
| Respiration | |||||
| paO2/FIO2 | >400 | >300 bis ≤400 | >200 bis ≤300 | >100 bis ≤200 | ≤100 |
| SpO2/FIO2 | >512 | >357 bis ≤512 | >214 bis ≤357 | >89 bis ≤214 | ≤89 |
CLIF „chronic liver failure“, HE hepatische Enzephalopathie, A Adrenalin, NA Noradrenalin, p a O 2 arterieller Sauerstoffpartialdruck, F I O 2 inspiratorische Sauerstofffraktion, S p O 2 pulsoxymetrische Sauerstoffsättigung, MAP mittlerer arterieller Blutdruck, ZNS zentrales Nervensystem
In der Auswertung der CANONIC-Studie zeigte sich eine Prävalenz des ACLF von 30 % (20 % bei Aufnahme, 10 % während der Hospitalisierung) bei nicht elektiv hospitalisierten Patienten mit Leberzirrhose. Die 28- bzw. 90-Tages-Mortalität war bei ACLF mit 33 % (Tag 28) bzw. 51 % (Tag 90), verglichen mit 1,9 % bzw. 10 % bei Patienten ohne ACLF, dramatisch erhöht. Die Mortalität der ACLF-Patienten korrelierte hierbei am deutlichsten mit dem ACLF-Grad, mit einer 28- bzw. 90-Tages-Mortalität von 22 % bzw. 41 % beim ACLF 1, 32 % bzw. 55 % beim ACLF 2 und 73 % bzw. 77 % beim ACLF 3. Alkoholismus (60 %), Hepatitis C (13 %) sowie deren Kombination (5 %) wurden als häufigste zugrunde liegende Lebererkrankungen identifiziert. Während des ACLF waren in der Analyse die Nieren das häufigste ausfallende Organsystem (56 % der Patienten), gefolgt von der Leber (44 %), Blutgerinnungssystem (28 %), ZNS (24 %), Kreislauf (17 %) und Lungen (9 %), wobei letztere nur bei ACLF 3 beobachtet wurden. Interessanterweise trat das ACLF in fast 50 % bei Patienten auf, die zuvor keine akute Dekompensation der Leber erlitten hatten, und nahm in diesen Patienten auch einen gravierenderen Verlauf als in Patienten mit zurückliegender Dekompensation (28-Tages-Mortalität 42 % vs. 29 %; [5]). Während bakterielle Infektionen und aktiver Alkoholismus als häufigste Auslöser des ACLF ausgemacht werden konnten, verblieb in vielen Fällen kein spezifischer Auslöser des ACLF eruierbar. Art und etwaige Erfassung (bzw. Nichterfassung) eines ACLF-Triggers waren indes ohne Auswirkung auf die Mortalität.
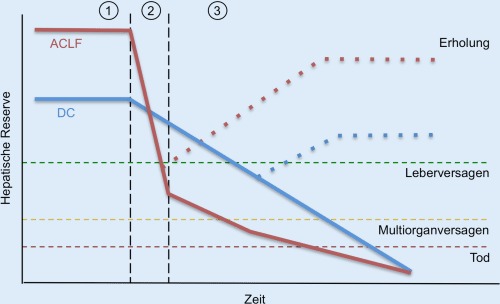
Die außerordentlich hohe Dynamik des Krankheitsbilds ACLF spiegelt sich auch in der Tatsache wider, dass während der Hospitalisierung in etwa 50 % eine Besserung und in 20 % eine Verschlechterung auftrat [18]. Die Heilungsrate sank mit dem ACLF-Grad von 55 % (ACLF 1) über 35 % (ACLF 2) bis auf 15 % (ACLF 3). Da sich der ACLF-Grad zumeist in den ersten beiden bis maximal 7 Tagen änderte, wird hier ein „goldenes Zeitfenster“ für therapeutische Interventionen vermutet (Abb. 1). Für eine Risikoabschätzung von Patienten mit akuter Dekompensation einer Leberzirrhose mit oder ohne ACLF wurden klinische und laborchemische Parameter identifiziert, die mit erhöhter Mortalität assoziiert waren. Hier wurden 1) die Anzahl von Organversagen (nach CLIF-Kriterien), 2) das Patientenalter sowie 3) die Konzentration zirkulierender Leukozyten als unabhängige Variablen identifiziert. Diese Resultate gingen wiederum in eine Erweiterung des CLIF-C-OFs ein („CLIF consortium ACLF score“, CLIF-C ACLFs), der einen Punktwert von 0–100 annehmen kann und eine deutlich bessere Vorhersagekraft hinsichtlich der 28-, 90-, 180- und 360-Tages-Mortalität besitzt als MELD-, MELD-Na- und Child-Pugh-Score [19]. Nachteilig ist hierbei, dass der Score (verglichen zum ursprünglichen SOFA- oder auch CLIF-SOFA-Score) nicht ohne eine komplexe Formel berechnet werden kann; die Kalkulation kann jedoch beispielsweise durch einen Onlinerechner des „CLIF consortium“ erfolgen [20]. In der weiteren Aufarbeitung der CANONIC-Kohorte zeigte sich eine 100 %ige Letalität von Patienten mit ≥4 Organversagen und/oder einem „CLIF-ACLFs score“ ≥64 nach 3–7 Tagen Therapie, sofern keine Lebertransplantation erfolgte [18]. Die Zahlen unterstreichen den Stellenwert eines frühen und raschen – insbesondere intensivmedizinischen – Therapiebeginns, um das Fortschreiten des Multiorganversagens zu durchbrechen. Ob eine frühzeitige Lebertransplantation bei Patienten mit ACLF zielführend ist, ist derzeit Thema kontroverser Debatten und wird erst durch zukünftige Studien geklärt werden können. Zusätzlich kann die wiederholte Risikostratifizierung mittels Scores bei Patienten mit ACLF in dem schwierigen Entscheidungsprozess hinsichtlich der Art des weiteren therapeutischen Vorgehens (kurativer oder palliativer Therapieansatz) helfen. Wir möchten jedoch betonen, dass derartige Entscheidungen definitiv ärztliche Entscheidungen sind, die niemals von einem Score übernommen werden dürfen. Im Rahmen dieses ärztlichen Entscheidungsprozesses müssen neben der unmittelbaren Schwere der Erkrankung beispielsweise auch der mutmaßliche Patientenwunsch, jeweilige lokale und nationale Überlebensraten, eine potenzielle Reversibilität der Organausfälle sowie die Komorbiditäten des Patienten berücksichtigt werden.
Management
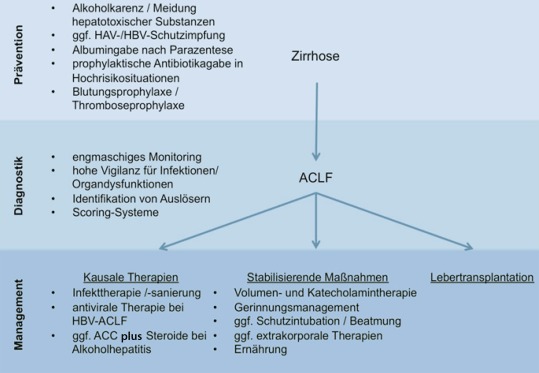
Die Grundlage für eine effektive Behandlung eines ACLF besteht in der frühzeitigen Diagnose der Erkrankung und, sofern möglich, Identifikation und Beseitigung seiner auslösenden Faktoren, um einen Progress des Organversagens zu verhindern (Abb. 2). Beim ACLF, das durch HBV-Erstinfektion oder Reaktivierung einer chronischen Virushepatitis B ausgelöst wird, sollte umgehend eine antivirale Therapie eingeleitet werden [21]. Bei der Alkoholhepatitis senkt Prednisolon zusammen mit N‑Acetylcystein bei hohem MELD- bzw. Maddrey-Score die 1‑Monats-Mortalität, ohne jedoch die Prognose nach 3 oder 6 Monaten zu verbessern [22, 23]. In den meisten Fällen stehen beim ACLF jedoch keine spezifischen Therapieoptionen zur Verfügung, sodass supportive Maßnahmen in den Vordergrund rücken. Im Allgemeinen erscheint es sinnvoll, hospitalisierte Zirrhotiker mit ACLF frühzeitig auf eine Intensiv- oder Überwachungsstation aufzunehmen und dort frühzeitig forcierte diagnostische und stabilisierende therapeutische Maßnahmen einzuleiten, die sich insbesondere auf beginnende Organdysfunktionen und infektiöse Komplikationen richten (Abb. 3; [24, 25]). Jegliche medikamentöse oder interventionelle Therapiemaßnahme sollte kritisch auf potenzielle Hepatotoxizität und anderweitige nachteilige Effekte (z. B. Immunsuppression, Veränderungen der Hämodynamik) überprüft werden. Ob geeignete Kandidaten frühzeitig in ein Transplantationszentrum verlegt werden sollen, ist in Anbetracht der limitierten prospektiven Erfahrungen mit Lebertransplantationen bei ACLF-Patienten strittig. Kleine retrospektive Studien haben mit einer 1‑Jahres-Überlebensrate nach Lebertransplantation von 80 % bei geeigneten ACLF-Patienten zwar ein vergleichbares Outcome mit Nicht-ACLF-Lebertransplantierten gezeigt [26, 27], allerdings erreichen bei weitem nicht alle ACLF-Patienten eine Listung zur Transplantation. Weitere Analysen des Stellenwerts der Lebertransplantation beim ACLF sind daher dringend erforderlich.
Infektionen
Die häufigsten mit einem ACLF assoziierten Infektionen sind die spontan-bakterielle Peritonitis (SBP), Pneumonien und Harnwegsinfekte, gefolgt von Haut- und Weichteilinfekten und Bakteriämien [4, 5]. Die schnelle Diagnosestellung und umgehende Einleitung einer Antibiotikatherapie sind von entscheidender Bedeutung für den Krankheitsverlauf. Auch für prophylaktische Antibiotikastrategien gibt es bei Hochrisikokonstellationen (obere gastrointestinale Blutung, fortgeschrittene Zirrhose mit niedrigem Aszitesproteingehalt, Sekundärprophylaxe nach stattgehabter SBP), wie sie häufig bei kritisch kranken Patienten bestehen, eine sehr starke Evidenz [29]. Bei klinischem Verdacht auf Vorliegen einer Infektion sollte niedrigschwellig eine frühzeitige, sich nach dem vermuteten Fokus, dem Schweregrad der Infektion und dem lokalen Resistenzmuster richtende breit kalkulierte Antibiotikatherapie eingeleitet werden, die nach Eingrenzung des Keimspektrums oder Nachweis des auslösenden Erregers und (sofern möglich) Sanierung des Infektherds konsequent antibiogrammgerecht (de-)eskaliert werden sollte. Bei entsprechendem klinischem Verdacht sowie bei Nichtansprechen einer kalkulierten Breitspektrumantibiose müssen auch Pilzinfektionen in Betracht gezogen werden.
Hämodynamik
Hämodynamisch weisen ACLF-Patienten wie Zirrhotiker allgemein meist eine hyperdyname Kreislaufsituation auf, bei der infolge der Vasodilatation im Splanchnikusgebiet eine effektive zentrale Hypovolämie vorherrscht, die sich mit Fortschreiten des ACLF meist noch aggraviert. In Ermangelung klinischer Daten erscheinen ein mittlerer arterieller Blutdruck von 60–65 mm Hg sowie als Transfusionstrigger ein unterer Hb-Wert von 7 g/dl bei Zirrhotikern als hämodynamische Zielvariablen sinnvoll; Hb-Werte über 9 g/dl nach Bluttransfusionen können das Risiko portalhypertensiver Blutungskomplikationen unnötig erhöhen und sollten daher vermieden werden [30, 31]. Bei der Volumentherapie zur Kreislaufstabilisierung sind Kristalloide die erste Wahl. Die zusätzliche Gabe von Humanalbumin zur Volumenexpansion verbessert im Rahmen der Antibiotikatherapie bei SBP, bei der Behandlung des Typ-1-hepatorenalen Syndroms und nach großvolumiger Parazentese das Überleben und ist hierbei von zentraler Bedeutung. Bei anderen Infektionen als der SBP verzögerte die Albumingabe in einer kleinen Studie zwar das Auftreten von renaler Dysfunktion, nicht aber das Überleben [32] und sollte dementsprechend zurückhaltend eingesetzt werden. Der Einsatz von kolloidalen Volumenersatzmitteln wie Hydroxyethylstärke wird aufgrund potenzieller Nephrotoxizität nicht empfohlen. Der Stellenwert von nichtselektiven β‑Blockern (NSBB), einer Hauptsäule in der Therapie des portalen Hypertonus zur Prophylaxe von Varizenblutungen, wird bei Patienten mit fortgeschrittener dekompensierter Leberzirrhose zunehmend kritisch diskutiert [33–35]. So zeigten einerseits retrospektive Untersuchungen eine erhöhte Mortalität bei Infektionen bei Leberzirrhotikern, die β‑Blocker erhielten [34], andererseits zeigte sich bei den ACLF-Patienten in der CANONIC-Studie retrospektiv ein günstiger Effekt einer (fortgesetzten) β‑Blockade auf SIRS und Überleben, sodass zumindest das unkritische Absetzen einer vorbestehenden Medikation mit NSBB bei Auftreten eines ACLF nicht gerechtfertigt erscheint [36]. Zur endgültigen Klärung dieses kontrovers diskutierten Themas sind jedoch weitere Studien vonnöten.
Niere und Dialyseverfahren
Die Nieren sind das beim ACLF in seiner Funktion am häufigsten gestörte Organsystem und renale Dysfunktion ist mit einer gravierenden Verschlechterung der Prognose betroffener Patienten assoziiert [37]. Grundsätzlich kann die Nierenfunktion im Rahmen von Infektionen/Sepsis (CANONIC-Kohorte: 39 % der ACLF-Patienten), Volumendepletion (Blutung, Diarrhö etc.; 21 %) sowie im Rahmen des Typ-1-hepatorenalen Syndroms (HRS, 12 %) sowie anderweitiger Nierenschädigung einschließlich Medikamentennebenwirkungen/-toxizität (etwa 30 %) eingeschränkt werden, wobei auch Mischbilder auftreten können [38, 39]. Hierbei ist zu beachten, dass eine statische Beurteilung des Serumkreatinins das tatsächliche Ausmaß der Dysfunktion nicht korrekt abbilden muss und eine Beurteilung der Dynamik des Kreatininwerts sowie des ausgeschiedenen Harnvolumens über die Zeit repäsentativer für die aktuelle Nierenfunktion ist [40]. Als Therapie beim HRS gilt derzeit 1) das Absetzen jeglicher potenziell nephrotoxischer Medikamente einschließlich Diuretika, 2) die Behebung von beeinträchtigenden Faktoren der renalen Perfusion, wie beispielsweise die Beseitigung einer intraabdominellen Hypertension durch Aszites (Parazentese), sowie schließlich 3) eine Volumenexpansion mit Albumin und ggf. der Einsatz von Vasopressoren (primär Terlipressin, alternativ Noradrenalin) als Maßnahmen der Wahl, um die Nierenfunktion zu verbessern. Bei gravierenden Störungen des Flüssigkeits-, Säure-Base- und/oder Elektrolythaushalts können extrakorporale Verfahren angewandt werden, wobei deren Einsatz insbesondere bei fehlender Möglichkeit einer Lebertransplantation unter Berücksichtigung der hohen Mortalität und des niedrigen Regenerationspotenzials bei derart weit fortgeschrittenen Lebererkrankungen mit Mehrorganversagen kontrovers ist. Der Einsatz sollte in Abhängigkeit von der möglichen Reversibilität, der Möglichkeit der Überbrückung zur Transplantation sowie der Anzahl und Schwere der Organversagen erfolgen. In der Regel wird einem kontinuierlichen extrakorporalen Ersatzverfahren aufgrund der besseren hämodynamischen Eigenschaften der Vorzug vor intermittierender Dialyse gegeben. Zitratbasierte extrakorporale Antikoagulationsverfahren können hierbei unter Berücksichtigung der Gefahr einer Akkumulation von Zitrat durch Beachtung entsprechender Vorsichts- und Überwachungsmaßnahmen zum Einsatz kommen und die Dauer und Effektivität der Behandlung verbessern. Erweiterte extrakorporale Dialyseverfahren (Leberunterstützungsverfahren) mit der Möglichkeit einer erweiterten Entgiftung (neben wasserlöslichen Substanzen können auch eiweißgebundene Substanzen eliminiert werden) sind die am besten untersuchten Dialyseverfahren bei Patienten mit ACLF. Die Albumindialyse mittels „molecular adsorbent recirculating system“ (MARS [Gambro/Baxter, Unterschleißheim, Deutschland]) hat sich als effektives Verfahren zur Elimination unterschiedlicher Substanzen, die als aktive Antreiber des ACLF vermutet werden (z. B. Prostaglandine, NO), erwiesen und konnte in einer kleinen randomisierten Studie einen Überlebensvorteil bei ACLF-Patienten erzielen [41]. Des Weiteren konnte in einer randomisierten kontrollierten multizentrischen Studie eine signifikante Verbesserung der fortgeschrittenen hepatischen Enzephalopathie durch den Einsatz des MARS-Verfahrens belegt werden [42]. In einer großen europäischen multizentrischen Studie an 189 ACLF-Patienten (RELIEF-Studie) wurden zwar Verbesserungen von Kreatinin-, Bilirubin und HE-Werten beobachtet, aber es konnte kein Überlebensvorteil in der MARS-Gruppe festgestellt werden [43]. Auch die fraktionierte Plasmaseparation und -adsorption (FPSA, Prometheus [Fresenius Medical. Care AG, Bad Homburg, Deutschland]), die als intermittierendes Verfahren albumin- und wasserlösliche Toxine effizienter als das MARS-System aus der Zirkulation entfernt [44], jedoch hämodynamisch nachteilig ist [45], blieb bei ACLF-Patienten im randomisierten Vergleich mit Standardtherapieverfahren in der HELIOS-Studie ohne Vorteil für das Überleben. In der Subgruppenanalyse zeigte sich allerdings ein signifikanter Überlebensvorteil bei ACLF-Patienten mit MELD-Score ≥30 sowie bei Patienten mit Typ-1-HRS unter Prometheus-Therapie im Vergleich mit Standardtherapieverfahren [46]. Obwohl eine rezente Publikation bei Patienten mit akutem Leberversagen durch den Einsatz eines hochvolumigen Plasmaaustausches („high volume plasma exchange“, HVP) einen Überlebensvorteil beobachten konnte, ist der Stellenwert des HVP beim ACLF gegenwärtig durch Studien nicht ausreichend untersucht [47]. Der Einsatz bioartifizieller Systeme, bei denen zusätzlich zur Dialyse die Lebersynthesefunktion durch kultivierte Hepatozyten unterstützt wird, sind in Ermangelung von in Studien nachgewiesenen Vorteilen nicht für die klinische Routineanwendung zugelassen [48].
Lunge
Pulmonale Komplikationen sind beim ACLF häufig und bis zu 9 % der ACLF-Patienten weisen eine ventilatorische Insuffizienz (paO2/FIO2 ≤ 200) auf. Ursächlich hierfür sind neben Pneumonien oft mechanische Einschränkungen bei ausgeprägtem Aszites und Pleuraergüssen. Bei respiratorischer Insuffizienz mit Aszites und Pleuraergüssen sollten zunächst eine therapeutische Parazentese und bei Beschwerdepersistenz Pleurapunktionen durchgeführt werden. Für pulmonalvaskuläre Ursachen, wie das hepatopulmonale Syndrom (HPS) und die portopulmonale Hypertension (PPH), existieren abgesehen von der Lebertransplantation andere therapeutische Optionen wie Langzeitsauerstofftherapie bei HPS oder verschiedene medikamentöse Therapieoptionen (PPH; [49–52]). Bei beatmeten Patienten sollten die konsequente Durchführung oraler Dekontaminationsstrategien (z. B. durch Chlorhexidin) und lungenprotektive Beatmungsschemata beachtet werden.
HE/ZNS
Eine engmaschige klinische und laborchemische (arterieller Ammoniak) Überwachung auf eine entstehende oder progressive hepatische Enzephalopathie sollte ggf. durch frühzeitige Einleitung therapeutischer Maßnahmen, wie Verabreichung von Laktulose und/oder Rifaximin, beantwortet werden, wenngleich diese Therapiemaßnahmen bei ACLF-Patienten durch Studien nicht gut belegt sind. Sedative Medikation sollte nach Möglichkeit vermieden werden. Ab drittgradiger hepatischer Enzephalopathie sollte die Schutzintubation zur Verhinderung einer Aspiration erwogen werden [53].
Blutungskomplikationen
PTT- und INR-Wert bilden bei Zirrhotikern das Blutungsrisiko aufgrund der meist gleichsam verminderten antikoagulatorischen Faktoren nicht adäquat ab. Die stärksten Prädiktoren für das Neuauftreten einer klinisch relevanten Blutung bei Patienten mit Zirrhose auf der Intensivstation sind Fibrinogen sowie Thrombozyten [54]. Vor Routineinterventionen, wie Anlage eines zentralvenösen Katheters, Parazentese, Gastroskopie oder Bronchoskopie, ist eine erweiterte Gerinnungsdiagnostik sowie eine routinemäßige Substitution von Gerinnungsprodukten nicht erforderlich. Lediglich bei aktiven Blutungen sollten bei hepatischer Koagulopathie entsprechende Gerinnungsprodukte verabreicht werden. Bei der Entscheidung über Art und Menge der Produkte könnte neben den im Rahmen der klinischen Routine erhobenen Parametern auch die ROTEM-Analyse beim Einsparen der Verabreichung von Gerinnungsprodukten helfen [55].
Ernährung
Die bei chronisch Lebererkrankten häufig vorbestehende und im Rahmen des ACLF noch exazerbierte Malnutrition erfordert eine sorgfältige Erhebung des Ernährungsstatus und eine adäquate, möglichst enterale Versorgung mit Nährstoffen. Mangels gezielter Studien an ACLF-Patienten erscheinen die aktuellen Empfehlungen für Patienten mit fortgeschrittenen Lebererkrankungen unter Berücksichtigung des durch Organversagen und (Infekt‑)Komplikationen dynamischen Bedarfs sowie der jeweiligen Auswirkungen der Nahrungsbestandteile auf Enzephalopathie und/oder Aszites am ehesten zielführend [56, 57]. Demnach sollte auf eine ausreichende Kalorienzufuhr geachtet werden, wobei die historische Praxis einer Proteinrestriktion obsolet ist und Zirrhotiker mit oder ohne HE ebenso wie Nichtzirrhotiker etwa 1,2–1,5 g/kgKG Protein täglich erhalten sollten [58]. Eine Glutaminsubstitution ist in diesem Zusammenhang aufgrund der ungünstigen Wirkungen auf den Ammoniakhaushalt kontraindiziert. Auf das Risiko einer Hypoglykämie muss insbesondere beim Leberversagen geachtet werden. Außerdem sollten niedrigschwellig Thiamin und andere Vitamine substituiert werden. Grundsätzlich ist die enterale Zufuhr der parenteralen Ernährung vorzuziehen. Diese kann per Magensonde auch bei Patienten mit bekannten Ösophagusvarizen ohne erhöhtes Risiko einer Varizenblutung durchgeführt werden [59].
Sonstige therapeutische Optionen
Ein weiterer Therapieansatz des ACLF besteht in der medikamentösen Stimulation des Knochenmarks durch G‑CSF zur Mobilisation CD34-positiver Immunzellen und zur Verbesserung der Funktion neutrophiler Granulozyten, durch die bei Patienten mit ACLF 1 und ACLF 2 niedrigere Raten von Nieren- und ZNS-Versagen und septischen Komplikationen sowie ein verlängertes Kurzzeitüberleben erzielt werden konnte [60]. Mit dem Fortschritt zell- und molekularbiologischer Verfahren rücken Zelltransplantationen von adulten Hepatozyten oder ihrer Vorläuferzellen in die Reichweite therapeutischer Applikationen. Zum gegenwärtigen Zeitpunkt haben diese Verfahren allerdings in der klinischen Routine noch keinen Stellenwert.
Resümee
Das ACLF stellt ein akut lebensbedrohliches hochkomplexes und nahezu alle Organsysteme des Körpers betreffendes Krankheitsbild bei Patienten mit vorgeschädigter Leber dar. Neben der frühzeitigen Identifikation und Beseitigung auslösender Faktoren steht die hohe Vigilanz für die mannigfaltigen Komplikationen der Erkrankung und deren Behandlung im Vordergrund der medizinischen Maßnahmen. Betroffene Patienten sollten frühzeitig intensivmedizinisch behandelt und gegebenenfalls bezüglich einer potenziellen Eignung als Lebertransplantationskandidaten evaluiert werden.
Fazit für die Praxis
Das ACLF ist eine akut lebensbedrohliche Komplikation bei Patienten mit vorbestehender Lebererkrankung.
Im Vordergrund des Geschehens stehen das Versagen insbesondere extrahepatischer Organsysteme sowie die hohe Gefahr von Infektionen, die zur hohen kurzfristigen Letalität des Krankheitsbilds beitragen.
ACLF-Patienten sollten frühzeitig im intensivmedizinischen Umfeld diagnostischen und stabilisierenden Maßnahmen zugeführt werden, um ein Fortschreiten des Organversagens zu verhindern.
Aufgrund der hohen Dynamik des ACLF ist eine regelmäßige Reevaluation des Therapieansprechens, z. B. unter Zuhilfenahme klinischer Scores, zur Festlegung des weiteren Prozederes unumgänglich.
Bei geeigneten Patienten sollte die Option einer Lebertransplantation evaluiert werden.
Einhaltung ethischer Richtlinien
Interessenkonflikt
P. Hübener und G. Braun geben an, dass kein Interessenkonflikt besteht. V. Fuhrmann: Vortragshonorare und Forschungsunterstützung von Baxter/Gambro und HepaWash außerhalb der eingereichten Arbeit.
Dieser Beitrag beinhaltet keine von den Autoren durchgeführten Studien an Menschen oder Tieren.
Footnotes
P. Hübener, G. Braun und V. Fuhrmann repräsentieren die Sektion Gastroenterologie der Deutsche Gesellschaft für internistische Intensivmedizin und Notfallmedizin (DGIIN).
Literatur
- 1.Jalan R, Gines P, Olson JC, Mookerjee RP, Moreau R, Garcia-Tsao G, et al. Acute-on chronic liver failure. J. Hepatol. 2012;57(6):1336–1348. doi: 10.1016/j.jhep.2012.06.026. [DOI] [PubMed] [Google Scholar]
- 2.Bernal W, Jalan R, Quaglia A, Simpson K, Wendon J, Burroughs A. Acute-on-chronic liver failure. Lancet. 2015;386(10003):1576–1587. doi: 10.1016/S0140-6736(15)00309-8. [DOI] [PubMed] [Google Scholar]
- 3.Jalan R, Yurdaydin C, Bajaj JS, Acharya SK, Arroyo V, Lin HC, et al. Toward an improved definition of acute-on-chronic liver failure. Gastroenterology. 2014;147(1):4–10. doi: 10.1053/j.gastro.2014.05.005. [DOI] [PubMed] [Google Scholar]
- 4.Bajaj JS, O’Leary JG, Reddy KR, Wong F, Biggins SW, Patton H, et al. Survival in infection-related acute-on-chronic liver failure is defined by extrahepatic organ failures. Hepatology. 2014;60(1):250–256. doi: 10.1002/hep.27077. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Moreau R, Jalan R, Gines P, Pavesi M, Angeli P, Cordoba J, et al. Acute-on-chronic liver failure is a distinct syndrome that develops in patients with acute decompensation of cirrhosis. Gastroenterology. 2013;144(7):1426–1437. doi: 10.1053/j.gastro.2013.02.042. [DOI] [PubMed] [Google Scholar]
- 6.Bernal W, Hyyrylainen A, Gera A, Audimoolam VK, McPhail MJ, Auzinger G, et al. Lessons from look-back in acute liver failure? A single centre experience of 3300 patients. J. Hepatol. 2013;59(1):74–80. doi: 10.1016/j.jhep.2013.02.010. [DOI] [PubMed] [Google Scholar]
- 7.Rutter K, Horvatits T, Drolz A, Roedl K, Siedler S, Kluge S, et al. Acute liver failure. Med Klin Intensivmed Notfmed. 2016 doi: 10.1007/s00063-016-0156-x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.http://www.servier.com/Powerpoint-image-bank
- 9.Moreau R. The pathogenesis of ACLF: The inflammatory response and immune function. Semin. Liver Dis. 2016;36(2):133–140. doi: 10.1055/s-0036-1583287. [DOI] [PubMed] [Google Scholar]
- 10.Arroyo V, Moreau R, Jalan R, Gines P. Study E‑CCC. Acute-on-chronic liver failure: A new syndrome that will re-classify cirrhosis. J. Hepatol. 2015;62(1 Suppl):131–143. doi: 10.1016/j.jhep.2014.11.045. [DOI] [PubMed] [Google Scholar]
- 11.Bernardi M, Moreau R, Angeli P, Schnabl B, Arroyo V. Mechanisms of decompensation and organ failure in cirrhosis: From peripheral arterial vasodilation to systemic inflammation hypothesis. J. Hepatol. 2015;63(5):1272–1284. doi: 10.1016/j.jhep.2015.07.004. [DOI] [PubMed] [Google Scholar]
- 12.Byl B, Roucloux I, Crusiaux A, Dupont E, Deviere J. Tumor necrosis factor alpha and interleukin 6 plasma levels in infected cirrhotic patients. Gastroenterology. 1993;104(5):1492–1497. doi: 10.1016/0016-5085(93)90361-F. [DOI] [PubMed] [Google Scholar]
- 13.Sen S, Davies NA, Mookerjee RP, Cheshire LM, Hodges SJ, Williams R, et al. Pathophysiological effects of albumin dialysis in acute-on-chronic liver failure: A randomized controlled study. Liver Transpl. 2004;10(9):1109–1119. doi: 10.1002/lt.20236. [DOI] [PubMed] [Google Scholar]
- 14.Wasmuth HE, Kunz D, Yagmur E, Timmer-Stranghoner A, Vidacek D, Siewert E, et al. Patients with acute on chronic liver failure display “sepsis-like” immune paralysis. J. Hepatol. 2005;42(2):195–201. doi: 10.1016/j.jhep.2004.10.019. [DOI] [PubMed] [Google Scholar]
- 15.Linderoth G, Jepsen P, Schonheyder HC, Johnsen SP, Sorensen HT. Short-term prognosis of community-acquired bacteremia in patients with liver cirrhosis or alcoholism: A population-based cohort study. Alcohol Clin Exp Res. 2006;30(4):636–641. doi: 10.1111/j.1530-0277.2006.00074.x. [DOI] [PubMed] [Google Scholar]
- 16.Borzio M, Salerno F, Piantoni L, Cazzaniga M, Angeli P, Bissoli F, et al. Bacterial infection in patients with advanced cirrhosis: a multicentre prospective study. Dig Liver Dis. 2001;33(1):41–48. doi: 10.1016/S1590-8658(01)80134-1. [DOI] [PubMed] [Google Scholar]
- 17.Arvaniti V, D’Amico G, Fede G, Manousou P, Tsochatzis E, Pleguezuelo M, et al. Infections in patients with cirrhosis increase mortality four-fold and should be used in determining prognosis. Gastroenterology. 2010;139(4):1246–1256. doi: 10.1053/j.gastro.2010.06.019. [DOI] [PubMed] [Google Scholar]
- 18.Gustot T, Fernandez J, Garcia E, Morando F, Caraceni P, Alessandria C, et al. Clinical Course of acute-on-chronic liver failure syndrome and effects on prognosis. Hepatology. 2015;62(1):243–252. doi: 10.1002/hep.27849. [DOI] [PubMed] [Google Scholar]
- 19.Jalan R, Saliba F, Pavesi M, Amoros A, Moreau R, Gines P, et al. Development and validation of a prognostic score to predict mortality in patients with acute-on-chronic liver failure. J. Hepatol. 2014;61(5):1038–1047. doi: 10.1016/j.jhep.2014.06.012. [DOI] [PubMed] [Google Scholar]
- 20.http://www.clifresearch.com/ToolsCalculators.aspx. Zugegriffen: 30.11.2016
- 21.Sarin SK, Kedarisetty CK, Abbas Z, Amarapurkar D, Bihari C, Chan AC, et al. Acute-on-chronic liver failure: Consensus recommendations of the Asian Pacific Association for the Study of the Liver (APASL) 2014. Hepatol Int. 2014;8(4):453–471. doi: 10.1007/s12072-014-9580-2. [DOI] [PubMed] [Google Scholar]
- 22.Nguyen-Khac E, Thevenot T, Piquet MA, Benferhat S, Goria O, Chatelain D, et al. Glucocorticoids plus N‑acetylcysteine in severe alcoholic hepatitis. N. Engl. J. Med. 2011;365(19):1781–1789. doi: 10.1056/NEJMoa1101214. [DOI] [PubMed] [Google Scholar]
- 23.Thursz MR, Forrest EH, Ryder S, Investigators S. Prednisolone or Pentoxifylline for Alcoholic Hepatitis. N. Engl. J. Med. 2015;373(3):282–283. doi: 10.1056/NEJMc1506342. [DOI] [PubMed] [Google Scholar]
- 24.Gines P, Fernandez J, Durand F, Saliba F. Management of critically-ill cirrhotic patients. J. Hepatol. 2012;56(Suppl 1):13–24. doi: 10.1016/S0168-8278(12)60003-8. [DOI] [PubMed] [Google Scholar]
- 25.Olson JC, Wendon JA, Kramer DJ, Arroyo V, Jalan R, Garcia-Tsao G, et al. Intensive care of the patient with cirrhosis. Hepatology. 2011;54(5):1864–1872. doi: 10.1002/hep.24622. [DOI] [PubMed] [Google Scholar]
- 26.Bahirwani R, Shaked O, Bewtra M, Forde K, Reddy KR. Acute-on-chronic liver failure before liver transplantation: Impact on posttransplant outcomes. Transplantation. 2011;92(8):952–957. doi: 10.1097/TP.0b013e31822e6eda. [DOI] [PubMed] [Google Scholar]
- 27.Finkenstedt A, Nachbaur K, Zoller H, Joannidis M, Pratschke J, Graziadei IW, et al. Acute-on-chronic liver failure: Excellent outcomes after liver transplantation but high mortality on the wait list. Liver Transpl. 2013;19(8):879–886. doi: 10.1002/lt.23678. [DOI] [PubMed] [Google Scholar]
- 28.Sarin SK, Choudhury A. Acute-on-chronic liver failure: Terminology, mechanisms and management. Nat Rev Gastroenterol Hepatol. 2016;13(3):131–149. doi: 10.1038/nrgastro.2015.219. [DOI] [PubMed] [Google Scholar]
- 29.Jalan R, Fernandez J, Wiest R, Schnabl B, Moreau R, Angeli P, et al. Bacterial infections in cirrhosis: A position statement based on the EASL Special Conference 2013. J. Hepatol. 2014;60(6):1310–1324. doi: 10.1016/j.jhep.2014.01.024. [DOI] [PubMed] [Google Scholar]
- 30.Durand F, Nadim MK. Management of acute-on-chronic liver failure. Semin. Liver Dis. 2016;36(2):141–152. doi: 10.1055/s-0036-1583198. [DOI] [PubMed] [Google Scholar]
- 31.Villanueva C, Colomo A, Bosch A, Concepcion M, Hernandez-Gea V, Aracil C, et al. Transfusion strategies for acute upper gastrointestinal bleeding. N. Engl. J. Med. 2013;368(1):11–21. doi: 10.1056/NEJMoa1211801. [DOI] [PubMed] [Google Scholar]
- 32.Guevara M, Terra C, Nazar A, Sola E, Fernandez J, Pavesi M, et al. Albumin for bacterial infections other than spontaneous bacterial peritonitis in cirrhosis. A randomized, controlled study. J. Hepatol. 2012;57(4):759–765. doi: 10.1016/j.jhep.2012.06.013. [DOI] [PubMed] [Google Scholar]
- 33.Serste T, Melot C, Francoz C, Durand F, Rautou PE, Valla D, et al. Deleterious effects of beta-blockers on survival in patients with cirrhosis and refractory ascites. Hepatology. 2010;52(3):1017–1022. doi: 10.1002/hep.23775. [DOI] [PubMed] [Google Scholar]
- 34.Mandorfer M, Bota S, Schwabl P, Bucsics T, Pfisterer N, Kruzik M, et al. Nonselective beta blockers increase risk for hepatorenal syndrome and death in patients with cirrhosis and spontaneous bacterial peritonitis. Gastroenterology. 2014;146(7):1680–1690. doi: 10.1053/j.gastro.2014.03.005. [DOI] [PubMed] [Google Scholar]
- 35.Thorhauge KH, Lindvig KP, Laleman W, Angeli P, Singh SP, Krag A. Lack of consensus for usage of beta-blockers in end-stage liver disease. Gut. 2016;65(6):1058–1060. doi: 10.1136/gutjnl-2016-311573. [DOI] [PubMed] [Google Scholar]
- 36.Mookerjee RP, Pavesi M, Thomsen KL, Mehta G, Macnaughtan J, Bendtsen F, et al. Treatment with non-selective beta blockers is associated with reduced severity of systemic inflammation and improved survival of patients with acute-on-chronic liver failure. J. Hepatol. 2016;64(3):574–582. doi: 10.1016/j.jhep.2015.10.018. [DOI] [PubMed] [Google Scholar]
- 37.Zimmerman JE, Wagner DP, Seneff MG, Becker RB, Sun X, Knaus WA. Intensive care unit admissions with cirrhosis: risk-stratifying patient groups and predicting individual survival. Hepatology. 1996;23(6):1393–1401. doi: 10.1002/hep.510230615. [DOI] [PubMed] [Google Scholar]
- 38.Martin-Llahi M, Guevara M, Torre A, Fagundes C, Restuccia T, Gilabert R, et al. Prognostic importance of the cause of renal failure in patients with cirrhosis. Gastroenterology. 2011;140(2):488–496. doi: 10.1053/j.gastro.2010.07.043. [DOI] [PubMed] [Google Scholar]
- 39.Angeli P, Rodriguez E, Piano S, Ariza X, Morando F, Sola E, et al. Acute kidney injury and acute-on-chronic liver failure classifications in prognosis assessment of patients with acute decompensation of cirrhosis. Gut. 2015;64(10):1616–1622. doi: 10.1136/gutjnl-2014-307526. [DOI] [PubMed] [Google Scholar]
- 40.Angeli P, Gines P, Wong F, Bernardi M, Boyer TD, Gerbes A, et al. Diagnosis and management of acute kidney injury in patients with cirrhosis: revised consensus recommendations of the International Club of Ascites. J. Hepatol. 2015;62(4):968–974. doi: 10.1016/j.jhep.2014.12.029. [DOI] [PubMed] [Google Scholar]
- 41.Heemann U, Treichel U, Loock J, Philipp T, Gerken G, Malago M, et al. Albumin dialysis in cirrhosis with superimposed acute liver injury: A prospective, controlled study. Hepatology. 2002;36(4 Pt 1):949–958. doi: 10.1053/jhep.2002.36130. [DOI] [PubMed] [Google Scholar]
- 42.Hassanein TI, Tofteng F, Brown RS, Jr., McGuire B, Lynch P, Mehta R, et al. Randomized controlled study of extracorporeal albumin dialysis for hepatic encephalopathy in advanced cirrhosis. Hepatology. 2007;46(6):1853–1862. doi: 10.1002/hep.21930. [DOI] [PubMed] [Google Scholar]
- 43.Banares R, Nevens F, Larsen FS, Jalan R, Albillos A, Dollinger M, et al. Extracorporeal albumin dialysis with the molecular adsorbent recirculating system in acute-on-chronic liver failure: The RELIEF trial. Hepatology. 2013;57(3):1153–1162. doi: 10.1002/hep.26185. [DOI] [PubMed] [Google Scholar]
- 44.Evenepoel P, Laleman W, Wilmer A, Claes K, Kuypers D, Bammens B, et al. Prometheus versus molecular adsorbents recirculating system: Comparison of efficiency in two different liver detoxification devices. Artif Organs. 2006;30(4):276–284. doi: 10.1111/j.1525-1594.2006.00215.x. [DOI] [PubMed] [Google Scholar]
- 45.Laleman W, Wilmer A, Evenepoel P, Elst IV, Zeegers M, Zaman Z, et al. Effect of the molecular adsorbent recirculating system and Prometheus devices on systemic haemodynamics and vasoactive agents in patients with acute-on-chronic alcoholic liver failure. Crit Care. 2006;10(4):R108. doi: 10.1186/cc4985. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Kribben A, Gerken G, Haag S, Herget-Rosenthal S, Treichel U, Betz C, et al. Effects of fractionated plasma separation and adsorption on survival in patients with acute-on-chronic liver failure. Gastroenterology. 2012;142(4):782–789. doi: 10.1053/j.gastro.2011.12.056. [DOI] [PubMed] [Google Scholar]
- 47.Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, Patel VC, et al. High-volume plasma exchange in patients with acute liver failure: An open randomised controlled trial. J. Hepatol. 2016;64(1):69–78. doi: 10.1016/j.jhep.2015.08.018. [DOI] [PubMed] [Google Scholar]
- 48.Li H, Chen HS, Nyberg SL. Extracorporeal liver support and liver transplant for patients with acute-on-chronic liver failure. Semin. Liver Dis. 2016;36(2):153–160. doi: 10.1055/s-0036-1583197. [DOI] [PubMed] [Google Scholar]
- 49.Krowka MJ, Fallon MB, Kawut SM, Fuhrmann V, Heimbach JK, Ramsay MA, et al. International liver transplant society practice guidelines: Diagnosis and management of Hepatopulmonary syndrome and Portopulmonary hypertension. Transplantation. 2016;100(7):1440–1452. doi: 10.1097/TP.0000000000001229. [DOI] [PubMed] [Google Scholar]
- 50.Horvatits T, Drolz A, Rutter K, Kluge S, Fuhrmann V. Pulmonary complications in liver diseases. Med Klin Intensivmed Notfmed. 2014;109(4):235–239. doi: 10.1007/s00063-013-0319-y. [DOI] [PubMed] [Google Scholar]
- 51.Horvatits T, Fuhrmann V. Therapeutic options in pulmonary hepatic vascular diseases. Expert Rev Clin Pharmacol. 2014;7(1):31–42. doi: 10.1586/17512433.2014.857598. [DOI] [PubMed] [Google Scholar]
- 52.Horvatits T, Drolz A, Rutter K, Roedl K, Kluge S, Fuhrmann V. Hepatocardiac disorders : Interactions between two organ systems. Med Klin Intensivmed Notfmed. 2016;111(5):447–452. doi: 10.1007/s00063-015-0043-x. [DOI] [PubMed] [Google Scholar]
- 53.Romero-Gomez M, Montagnese S, Jalan R. Hepatic encephalopathy in patients with acute decompensation of cirrhosis and acute-on-chronic liver failure. J. Hepatol. 2015;62(2):437–447. doi: 10.1016/j.jhep.2014.09.005. [DOI] [PubMed] [Google Scholar]
- 54.Drolz A, Horvatits T, Roedl K, Rutter K, Staufer K, Kneidinger N, et al. Coagulation parameters and major bleeding in critically ill patients with cirrhosis. Hepatology. 2016;64:556–568. doi: 10.1002/hep.28628. [DOI] [PubMed] [Google Scholar]
- 55.Bedreli S, Sowa JP, Gerken G, Saner FH, Canbay A. Management of acute-on-chronic liver failure: Rotational thromboelastometry may reduce substitution of coagulation factors in liver cirrhosis. Gut. 2016;65(2):357–358. doi: 10.1136/gutjnl-2015-309922. [DOI] [PubMed] [Google Scholar]
- 56.Sanchez AJ, Aranda-Michel J. Nutrition for the liver transplant patient. Liver Transpl. 2006;12(9):1310–1316. doi: 10.1002/lt.20894. [DOI] [PubMed] [Google Scholar]
- 57.Florez DA, Aranda-Michel J. Nutritional management of acute and chronic liver disease. Semin. Gastrointest. Dis. 2002;13(3):169–178. [PubMed] [Google Scholar]
- 58.Amodio P, Bemeur C, Butterworth R, Cordoba J, Kato A, Montagnese S, et al. The nutritional management of hepatic encephalopathy in patients with cirrhosis: International society for hepatic encephalopathy and nitrogen metabolism consensus. Hepatology. 2013;58(1):325–336. doi: 10.1002/hep.26370. [DOI] [PubMed] [Google Scholar]
- 59.Lopez-Torres A, Waye JD. The safety of intubation in patients with esophageal varices. Am J Dig Dis. 1973;18(12):1032–1034. doi: 10.1007/BF01076517. [DOI] [PubMed] [Google Scholar]
- 60.Garg V, Garg H, Khan A, Trehanpati N, Kumar A, Sharma BC, et al. Granulocyte colony-stimulating factor mobilizes CD34(+) cells and improves survival of patients with acute-on-chronic liver failure. Gastroenterology. 2012;142(3):505–512. doi: 10.1053/j.gastro.2011.11.027. [DOI] [PubMed] [Google Scholar]


