Einleitung
Auch im vergangenen Jahr ist wieder eine Vielzahl an Publikationen mit intensivmedizinischem Schwerpunkt erschienen, die es dem Einzelnen schwer machen, sich einen strukturierten Überblick über die neuesten Erkenntnisse zu verschaffen. Die Autoren möchten mit dieser subjektiven Auswahl aus ihrer Sicht relevanter Veröffentlichungen dazu beitragen, die neue Evidenz in kompakter Form einem breiten Anwenderfeld zugänglich zu machen und somit die Behandlungsqualität stetig zu verbessern (Tab. 1).
| Akronym | Bedeutung des Akronyms | Originaltitel der Studie | Ergebnis – kurz zusammengefasst |
|---|---|---|---|
| INSEP | Incidence of severe sepsis and septic shock in German intensive care units | Incidence of severe sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study | Sepsis und septischer Schock sind nach wie vor häufig auftretende Krankheitsbilder mit hoher Krankenhaussterblichkeit |
| SAPS | Stop Antibiotics on Procalcitonin guidance Study | Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients | Prokalzitoningesteuerte Therapie verringerte die Antibiotikabehandlungsdauer und -tagesdosen bei Patienten mit bakterieller Infektion auf der Intensivstation |
| LeoPARDS | Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis | Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis | Levosimendan konnte bei Patienten mit septischem Schock nicht die Schwere des Organversagens verringern oder die Mortalität reduzieren |
| HYPRESS | Hydrocortisone for Prevention of Septic Shock | Effect of Hydrocortisone on Development of Shock Among Patients With Severe Sepsis | Hydrokortison konnte bei Patienten mit schwerer Sepsis die Progression zum septischen Schock innerhalb von 14 Tagen nicht verhindern |
| LUNG SAFE | Large Observational Study to Understand the Global Impact of Severe Acute Respiratory Failure | Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries | ARDS wird weltweit zu spät und zu selten richtig diagnostiziert, zu oft falsch behandelt und hat eine hohe Mortalität |
| Oxygen-ICU | Normal Oxygenation Versus Hyperoxia in the Intensive Care Unit | Effect of Conservative vs. Conventional Oxygen Therapy on Mortality Among Patients in an Intensive Care Unit | Eine zurückhaltende Sauerstoffapplikation verringerte die Sterblichkeit kritisch kranker Patienten |
| OPTINIV | The HFNC combined with NIV for decreasing oxygen desaturation during intubation procedures in ICU hypoxaemic patients | Apnoeic oxygenation via high-flow nasal cannula oxygen combined with non-invasive ventilation preoxygenation for intubation in hypoxaemic patients in the intensive care unit | Die Präoxygenierung mit der High-Flow-Nasenkanüle zusätzlich zur nichtinvasiven Beatmung konnte Sättigungsabfälle während der Intubation hypoxischer, kritisch kranker, Patienten verringern |
| ELAIN | Early vs. Late Initiation of Renal Replacement Therapy in Critically Ill Patients With Acute Kidney Injury | Effect of Early vs. Delayed Initiation of Renal Replacement Therapy on Mortality in Critically Ill Patients With Acute Kidney Injury | Eine frühzeitig eingeleitete Nierenersatztherapie konnte die Sterblichkeit von Intensivpatienten mit akutem Nierenversagen verringern |
| AKIKI | Artificial Kidney Initiation in Kidney Injury | Initiation Strategies for Renal-Replacement Therapy in the Intensive Care Unit | Die Sterblichkeit kritisch kranker Patienten mit akutem Nierenversagen unterschied sich nach frühzeitiger, verglichen mit verzögerter Initiierung der Nierenersatztherapie, nicht |
| EMPET | European Multicenter Plasma Exchange Trial | High-volume plasma exchange in patients with acute liver failure: An open randomized controlled trial | Die Hochvolumenplasmaaustauschtherapie konnte das transplantatfreie Überleben von Patienten mit akutem Leberversagen verbessern |
| RESCUEicp | Randomised Evaluation of Surgery with Craniectomy for Uncontrollable Elevation of Intracranial Pressure | Trial of Decompressive Craniectomy for Traumatic Intracranial Hypertension | Die chirurgische Therapie zur Senkung des intrakraniellen Drucks bei Patienten mit schwerem Schädel-Hirn-Trauma konnte die Mortalität senken, jedoch hatten mehr Patienten ein schlechtes neurologisches Ergebnis |
| PATCH | Platelet Transfusion in Cerebral Haemorrhage | Platelet transfusion versus standard care after acute stroke due to spontaneous cerebral haemorrhage associated with antiplatelet therapy | Thrombozytenkonzentrate zur Behandlung der intrazerebralen Blutung unter Thrombozytenaggregationshemmern führten zu einem schlechteren Behandlungsergebnis |
| CLEAR III | Phase 3 Clot Lysis: Evaluating Accelerated Resolution of Intraventricular Haemorrhage trial | Thrombolytic removal of intraventricular haemorrhage in treatment of severe stroke | Die Anwendung von Alteplase zusätzlich zur externen Ventrikeldrainage führte bei Patienten mit intraventrikulärer Blutung zu keinem verbesserten neurologischen Ergebnis |
| INCH | International Normalized Ratio Normalization in Coumarin Associated Intracerebral Haemorrhage | Fresh frozen plasma versus prothrombin complex concentrate in patients with intracranial haemorrhage related to vitamin K antagonists | PPSB konnte die INR bei Patienten mit Vitamin-K-Antagonisten induzierter intrakranieller Blutung zuverlässiger normalisieren als FFP |
| ATACH-2 | Antihypertensive Treatment of Acute Cerebral Hemorrhage II | Intensive blood-pressure lowering in patients with acute cerebral hemorrhage | Eine intensivierte Blutdrucksenkung konnte das neurologische Ergebnis oder Überleben von Patienten mit akuter intrazerebraler Blutung nicht verbessern |
| HYBERNATUS | Hypothermia for Brain Enhancement Recovery by Neuroprotective and Anticonvulsant Action after Convulsive Status Epilepticus | Hypothermia for neuroprotection in convulsive status epilepticus | Hypothermie zeigte bei Patienten mit konvulsivem Status epilepticus keinen positiven Effekt auf das funktionelle Behandlungsergebnis nach 90 Tagen |
| SIESTA | Sedation vs Intubation for Endovascular Stroke Treatment | Effect of conscious sedation vs. general anesthesia on early neurological improvement among patients with ischemic stroke undergoing endovascular thrombectomy | Der primäre Verzicht auf eine Intubation während der mechanischen Thrombektomie bei Patienten mit ischämischem Hirninfarkt hatte gegenüber der Allgemeinanästhesie keinen Vorteil bezüglich des frühen, neurologischen Behandlungsergebnisses |
ARDS „acute respiratory distress syndrome“, FFP „fresh frozen plasma“, INR International Normalized Ratio, PPSB Prothrombinkomplexkonzentrat
Besonders geprägt wurde das vergangene Jahr durch die neue Definition der Sepsis (Sepsis-3) mit relevanter Bedeutung für die Notfall- und Intensivmedizin sowie durch die aktualisierte Leitlinie zur Sepsistherapie. Neben der Darstellung der Studiengrundlage für die neue Definition gehen wir auch orientierend auf die damit assoziierten Probleme ein. Weitere Themenfelder stellen die Sauerstofftherapie, nichtinvasive Beatmungsformen, die Behandlung des Acute Respiratory Distress Syndrome (ARDS) sowie verschiedene Formen der Organersatztherapie dar. Zudem werden die Frühmobilisation sowie einige neurochirurgische und neurologische Veröffentlichungen mit intensivmedizinischer Relevanz diskutiert.
Die neue Sepsisdefinition
Originalpublikationen
Shankar-Hari M, Phillips GS, Levy ML et al (2016) Developing a New Definition and Assessing New Clinical Criteria for Septic Shock: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315(8):775–787
Seymour CW, Liu VX, Iwashyna TJ et al (2016) Assessment of Clinical Criteria for Sepsis: For the Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315(8):762–774
Singer M, Deutschman CS, Seymour C et al (2016) The Third International Consensus Definitions for Sepsis and Septic Shock (Sepsis-3). JAMA 315(8):801–810
Im Jahr 2015 wurden die bis dato für die Diagnosestellung der Sepsis gültigen Kriterien des Systemic Inflammatory Response Syndrome (SIRS, [1]) in einer großen retrospektiven Untersuchung an über 100.000 Patienten mit einer schweren Sepsis, also einer Infektion mit Organversagen (Sepsis-related Organ Failure Assessment (SOFA)-Score ≥2), auf ihre Sensitivität sowie (Augenschein- und Konstrukt‑)Validität untersucht [2]. Es zeigte sich, dass etwa einer von 8 Patienten mit einer schweren Sepsis weniger als 2 von 4 SIRS-Kriterien erfüllte. Diese 12,1 % „SIRS-negative“ Sepsispatienten hatten im Vergleich zum Gesamtkollektiv zwar eine geringere, jedoch relevante Mortalität von 8,5 %. Des Weiteren erwies sich die dichotome Klassifizierung der SIRS-Kriterien (≥2 ≙ SIRS-positiv, <2 ≙ SIRS-negativ) als unzureichend, da ein linearer Anstieg der Mortalität mit jedem positiven SIRS-Kriterium festgestellt wurde und ein Cut-off-Wert nicht zu erkennen war [2]. In 3 simultan veröffentlichten Publikationen wurden daraufhin im Februar 2016 die Definition der Sepsis und des septischen Schocks revidiert (Sepsis-3) sowie deren wissenschaftliche Ausarbeitung dargestellt [3–5]. In einer umfangreichen, retrospektiven Kohortenstudie zeigte sich, dass im Vergleich zu den SIRS-Kriterien und dem neu eingeführten Quick-SOFA(qSOFA)-Score, der SOFA-Score bei intensivmedizinisch behandelten Patienten mit einer Infektion die beste Vorhersagekraft für die Mortalität dieser Patienten aufwies [4]. Das Logistic Organ Dysfunction System (LODS) hatte zwar eine dem SOFA-Score vergleichbare Vorhersagekraft, wenngleich für diesen umfangreichere (Labor‑)Untersuchungen notwendig sind, sodass letztendlich der SOFA-Score als Diagnosekriterium für die Sepsis gewählt wurde. Dieser muss sich bei Patienten mit einer vermuteten oder nachgewiesenen Infektion für die Diagnose Sepsis um mindestens 2 Punkte erhöhen, wobei im Regelfall davon ausgegangen werden soll, dass der „Baseline“-SOFA-Score bei 0 Punkten liegt [3].
Für Patienten wiederum, die sich außerhalb einer Intensivstation befinden (z. B. Notaufnahme, periphere Station), erweist sich der qSOFA-Score (neben dem LODS), als bestes Screeninginstrument, um die Mortalität vorherzusagen [4]. Der qSOFA-Score ist aufgrund seiner lediglich 3 zu erhebenden Variablen: Atemfrequenz >22/min, veränderter mentaler Status und systolischer Blutdruck <100 mm Hg gut praktikabel und jederzeit bettseitig zu erheben. Positiv ist dieser Test, wenn mindestens 2 der 3 oben genannten Kriterien erfüllt sind [4]. Betont werden sollte, dass der qSOFA-Score kein Bestandteil der Diagnose „Sepsis“ ist. Allerdings lassen sich hiermit Patienten identifizieren, die einer erweiterten Diagnostik sowie intensivmedizinischen Behandlung zugeführt werden sollen, um dann nach Erhebung des SOFA-Scores die formelle Diagnose „Sepsis“ stellen zu können. Dass der qSOFA-Score nicht zur Definition der Sepsis gehört, wurde auch in einem Kommentar von 3 Mitgliedern der Konsensuskonferenz zur Erstellung der neuen Sepsis-3-Definition sehr anschaulich dargestellt [6]. Sie wiesen noch einmal auf die unzulängliche Spezifität der SIRS-Kriterien hin, da beinahe jeder Patient auf der Intensivstation 2 oder mehr SIRS-Kriterien aufweist. Bei Sepsis-1 und Sepsis-2 war die Schnittmenge von Infektion und Sepsis also ziemlich groß. Durch Sepsis-3 hat sich zum einen die Menge der Patienten mit Sepsis verringert, da diese durch den SOFA-Score zwar spezifischer, möglicherweise aber später diagnostiziert werden. Des Weiteren weisen die Autoren noch einmal explizit darauf hin, dass der qSOFA-Score die SIRS-Kriterien nicht ersetzt, da es sowohl Patienten mit Sepsis, also einer Infektion und einem positiven SOFA-Score, aber weniger als 2 Punkten im qSOFA-Score gibt. Genauso kann ein „qSOFA-positiver“ Patient mit Infektion aber auch weniger als 2 Punkte im SOFA-Score aufweisen und somit keine Sepsis haben (Abb. 1).

Für die Diagnose „Sepsis“ ist nun also eine nachgewiesene oder vermutete Infektion sowie ein Anstieg des SOFA-Score um mindestens 2 Punkte gefordert. Bei der Sepsis handelt es sich somit um eine lebensbedrohliche Organdysfunktion aufgrund einer fehlregulierten Wirtsantwort auf dem Boden einer Infektion [3]. Als einen grundlegenden Unterschied der neuen Sepsis-3-Definition zu den SIRS-basierten Vorgängerversionen (Sepsis-1, Sepsis-2) lässt sich somit festhalten, dass der Begriff der schweren Sepsis abgeschafft wurde. Das Organversagen ist nun bereits Teil der Definition der Sepsis. Gemäß der Sepsis-3-Definition haben die SIRS-Kriterien keinen Stellenwert für die Diagnosestellung mehr, sind aus Sicht der Autoren aber gerade für den Kliniker nach wie vor von enormer Wichtigkeit zur Identifikation von Patienten mit einer vermuteten Infektion.
Ein septischer Schock liegt nun laut der neuen Definition vor, wenn trotz adäquater Volumengabe die Applikation von Vasopressoren nötig ist, um einen mittleren arteriellen Blutdruck (MAP) von mindestens 65 mm Hg zu halten und zugleich der Serum-Laktat-Wert 2 mmol/l (18 mg/dl) übersteigt [5]. Die Mortalität dieses Patientenkollektivs liegt dann bei über 40 % [5], gegenüber etwa 10 % bei Patienten mit einer alleinigen Sepsis ohne Schock [3]. Durch die Einbeziehung des Laktatwerts spielen nun bereits zelluläre und metabolische Beeinträchtigungen für die Definition des septischen Schocks eine Rolle. Wie auch bei der Sepsis wird sich durch diese spezifischere Definition die Krankheitsschwere der Patienten mit der Diagnose „septischer Schock“ erhöhen.
Originalpublikation
SepNet Critical Trials Group (2016) Incidence of severe sepsis and septic shock in German intensive care units: the prospective, multicentre INSEP study. Intensive Care Med 42(12):1980–1989
Eindrücklich dargestellt wurden die höhere Spezifität, geringere Sensitivität und damit verbundene höhere Krankheitsschwere der Patienten, die nach den neuen Sepsis-3-Kriterien diagnostiziert werden, in einer epidemiologischen Untersuchung des SepNet-Netzwerks [7]. In einer longitudinalen Observationsstudie unter Einschluss von 133 deutschen Intensivstationen wurden alle in einem Zeitraum von 4 Wochen behandelten Patienten eingeschlossen und auf das Vorliegen einer schweren Sepsis oder eines septischen Schocks untersucht. Von 11.883 untersuchten Patienten wiesen 1285 Patienten die nach der alten Definition [1] gültigen Kriterien des septischen Schocks auf, also eine Infektion mit Organversagen und einem systolischen Blutdruckwert <90 mm Hg oder einem MAP <70 mm Hg bzw. einen Vasopressorenbedarf, um diese Blutdruckwerte zu erreichen. Die Mortalität dieses Kollektivs betrug 37,3 % auf der Intensivstation und 43,3 % während des gesamten Krankenhausaufenthalts. Die Kriterien der neuen Sepsis-3-Definition, für die ein MAP von 65 mm Hg bei gleichzeitig pathologisch erhöhtem Serum-Laktat-Wert >2 mmol/l (18 mg/dl) gilt, erfüllten gerade einmal zwei Drittel (n = 848) dieser Patienten. Die Sterblichkeit dieses spezifischeren Kollektivs erhöhte sich folgerichtig auf 44,3 % auf der Intensivstation und 50,9 % im Krankenhaus (Abb. 2).

Es wird deutlich, dass die Ergebnisse zukünftiger Studien unter Verwendung der neuen Sepsis-3-Definition als Einschlusskriterium, nicht ohne Weiteres mit bisherigen Studienergebnissen zur Sepsis und zum septischen Schock vergleichbar sein werden, da vermutlich „kränkere“ Patienten untersucht werden. Es ist denkbar, dass diese unterschiedlichen Kollektive damit von Maßnahmen, welche sich bisher als wirkungslos erwiesen haben, profitieren. Möglicherweise zeigen aber auch etablierte Therapien bei Patienten mit Sepsis und septischem Schock nach alter Definition nun keinen Vorteil mehr oder schaden gar. Der gravierendere Effekt könnte sich allerdings im klinischen Behandlungsergebnis unserer Patienten zeigen, da es zu einer verzögerten Diagnosestellung der Sepsis und somit auch zu später eingeleiteten Therapiemaßnahmen kommen dürfte. Ein unmittelbarer Therapiebeginn ist jedoch nach wie vor eine der grundlegenden Behandlungsstrategien und wird von der Surviving Sepsis Campaign (SSC) (http://www.survivingsepsis.org/Guidelines/Pages/default.aspx) in den für 2016 aktualisierten internationalen Leitlinien [8] als zentrales Element zur Reduktion der Sterblichkeit festgehalten [9]. Als weitere Kritikpunkte sind zu nennen, dass die in Deutschland zwar ubiquitär verfügbare Laktatmessung in weniger entwickelten Umgebungen möglicherweise nicht oder in nicht ausreichendem Maß zur Verfügung steht. Die formale Diagnose „septischer Schock“ kann dann also nur verzögert oder nicht abschließend gestellt werden. Nichtsdestotrotz bringt die neue Definition aber auch auf unseren Intensivstationen Probleme in Bezug auf die Diagnosestellung mit sich. Gemäß Sepsis-3 verlangt die Diagnose „Sepsis“ für die DRG-Kodierung formell das Vorliegen eines manifesten Organversagens; weniger schwere oder frühzeitig adäquat behandelte Fälle würden somit möglicherweise gar nicht erfasst werden, da ein Organversagen frühzeitig verhindert werden konnte. Somit müssen wir wohl ab sofort ein Krankheitsbild behandeln, zu dessen Diagnosestellung wir möglicherweise gar nicht erst kommen.
Originalpublikation
Freund Y, Lemachatti N, Krastinova E et al (2017) Prognostic Accuracy of Sepsis-3 Criteria for In-Hospital Mortality Among Patients With Suspected Infection Presenting to the Emergency Department. JAMA 317(3):301–308
Die Sepsis-3-Definition ist auf Grundlage von Daten einer retrospektiven Kohortenstudie entstanden [4]. Die externe Validierung der Diagnosekriterien, insbesondere in einer prospektiven Untersuchung, stand zum Zeitpunkt der Veröffentlichung aus. Zudem wurde der qSOFA-Score an einem sehr heterogenen Patientenkollektiv in der Notaufnahme und auf peripheren Stationen untersucht. Bereits zeitnah nach Einführung von Sepsis-3 [3–5] erschienen deshalb einige Publikationen, welche die Wertigkeit der zur Diskussion stehenden Kriterien wie SIRS, SOFA-Score, LODS und qSOFA-Score aufarbeiteten [10–16].
Freund et al. [11] untersuchten erstmals prospektiv die Vorhersagekraft der Sterblichkeit durch den qSOFA-Score bei Patienten aus der Notaufnahme [11]. Sie untersuchten 879 Patienten an 20 Zentren mit vermuteter oder nachgewiesener Infektion in der Notaufnahme und verglichen die prognostische Aussagekraft des qSOFA- und SOFA-Scores sowie der SIRS-Kriterien in Bezug auf die Krankenhaussterblichkeit. Patienten mit einem qSOFA-Score <2 hatten eine Wahrscheinlichkeit von 3 %, im Krankenhaus zu versterben. Demgegenüber lag bei Patienten mit einem qSOFA-Score ≥2 die Sterblichkeit bei 24 %. Ein Patient mit vermuteter Infektion in der Notaufnahme mit einem positiven qSOFA-Score hat folglich ein 6,2-fach höheres Risiko zu versterben, als wenn <2 der 3 qSOFA-Kriterien erfüllt sind. Die prognostische Vorhersagekraft des qSOFA-Scores, ausgedrückt mittels der Area under the Receiver Operating Curve (AUROC = 0,80), war besser als die der SIRS-Kriterien (AUROC = 0,65) und des SOFA-Scores (AUROC = 0,65). Es bestätigte sich, dass die SIRS-Kriterien zwar eine gute Sensitivität (93 %), allerdings eine mäßige Spezifität (27 %) haben. Durch den qSOFA-Score wird die Diagnose zwar spezifischer (Spezifität: 79 %) gestellt, allerdings besteht die Gefahr, dass durch die gegenüber den SIRS-Kriterien geringere Sensitivität (70 %) Patienten erst deutlich später oder gar nicht erkannt werden. An dieser Stelle soll allerdings noch einmal betont werden, dass der qSOFA-Score nicht zur Diagnosestellung der Sepsis genutzt wird, sondern nur ein Frühwarnelement sein soll. Die formelle Diagnosestellung erfordert einen Anstieg des SOFA-Scores um ≥2 Punkte, welcher allerdings aufgrund der Notwendigkeit für die Bestimmung von vordefinierten Laborparametern (z. B. Bilirubin, Thrombozyten) nicht als schnelles Screeningtool geeignet ist [4]. Mittels des qSOFA-Scores können allerdings sehr zielgerichtet und mit einfachen Mitteln jene Patienten identifiziert werden, die aufgrund einer Infektion eine hohe Wahrscheinlichkeit haben zu versterben und einer Behandlung und weitergehenden Diagnostik auf der Intensivstation (inkl. der Erhebung des SOFA-Scores) zugeführt werden sollten. Eine weitere Erkenntnis der Untersuchung von Freund et al. [11] war, dass analog zu den Ergebnissen von Seymour et al. [4] der Laktatwert, wenn er zusätzlich zum qSOFA-Score erhoben wird, bei diesen Patienten keinen weiteren Vorteil bezüglich der Vorhersagekraft der Sterblichkeit mit sich brachte.
Originalpublikation
Raith EP, Udy AA, Bailey M et al (2017) Prognostic Accuracy of the SOFA Score, SIRS Criteria, and qSOFA Score for In-Hospital Mortality Among Adults With Suspected Infection Admitted to the Intensive Care Unit. JAMA 317(3):290–300
In einer zeitgleich mit der soeben vorgestellten Studie von Freund et al. [11] erschienenen Untersuchung wurden die Sepsisdiagnosekriterien auch im Setting der Intensivstation evaluiert. Raith et al. [10] analysierten alle Patienten aus der Datenbank der Australian and New Zealand Intensive Care Society (ANZICS) der Jahre 2000–2015. Über 180.000 Patienten aus 182 Intensivstationen mit vermuteter oder nachgewiesener Infektion wurden eingeschlossen, sodass die Kohorte über 11-mal so groß wie die der Sepsis-3-Publikation war [4]. Retrospektiv untersuchten die Autoren die Vorhersagekraft der Krankenhaussterblichkeit anhand des SOFA- und qSOFA-Scores sowie der SIRS-Kriterien. Wiederum konnten die Erkenntnisse der Sepsis-3-Definition bestätigt werden. Der SOFA-Score hatte die beste Vorhersagekraft für die Sterblichkeit bei Patienten mit Infektion auf der Intensivstation (AUROC = 0,75). Patienten mit einem SOFA-Score ≥2 hatten eine Sterblichkeit von 20,2 % gegenüber 4,4 %, wenn der SOFA-Score <2 Punkte betrug. Sowohl die SIRS-Kriterien (AUROC = 0,59) als auch der qSOFA-Score (AUROC = 0,61) hatten eine schlechtere Vorhersagekraft und sind somit für das Setting der Intensivstation nicht geeignet. Eine externe Validierung der Sepsis-3-Kohorte konnte durch den geografischen Unterschied der beiden Kollektive gewährleistet werden, denn die Kohorte der Sepsis-3-Defintion stammte aus den USA und Deutschland, während Raith et al. Patienten aus Australien und Neuseeland untersuchten [4, 10].
Zusammenfassung
Sepsis-3 definiert die Sepsis als eine lebensbedrohliche Organdysfunktion aufgrund einer fehlregulierten Wirtsantwort auf dem Boden einer Infektion. Zur Diagnosestellung werden eine Infektion sowie ein Anstieg ≥2 Punkte im SOFA-Score gefordert. Mögliche Gefahren dieser spezifischeren Definition stellen sowohl die spätere Diagnosestellung, einschließlich der verspäteten Einleitung von Therapiemaßnahmen, als auch ein hieraus resultierend schlechteres Behandlungsergebnis dar.
Therapie der Sepsis
Originalpublikation
Rhodes A et al (2017) Surviving Sepsis Campaign: International Guidelines for Management of Sepsis and Septic Shock: 2016. Crit Care Med Jan 18; Epub ahead of print
Die für 2016 aktualisierte Leitlinie zur Behandlung der Sepsis und des septischen Schocks der Surviving Sepsis Campaign (SSC), der Society of Critical Care Medicine (SCCM) und der European Society of Intensive Care Medicine (ESICM) erschien am 18. Januar 2017 [8]. Um diese möglichst vielen Anwendern zugänglich und verständlich zu machen, wurde in Form eines Users’ Guide [17] zeitgleich eine Art Praxisanleitung für die Leitlinie veröffentlicht, welche einen Überblick über die wichtigsten Neuerungen sowie einige, über die Empfehlungen der Leitlinie hinausgehende, Behandlungsvorschläge gibt. Auch eine am gleichen Tag veröffentlichte Synopsis [18] und ein Kommentar von de Backer und Dorman [19] fassen die wichtigsten Unterschiede zur vorherigen Version der Sepsisleitlinie von 2012 [20] zusammen.
In Bezug auf die Methodik ist zu vermerken, dass neben dem bereits bekannten starken und schwachen Empfehlungsgrad („strong“ und „weak recommendations“), mit dem Best Practice Statement (BPS) eine neue Form der Empfehlung hinzugekommen ist. Es handelt sich hierbei ebenso um starke Empfehlungen, die zwar keine Evidenzgrundlage besitzen, allerdings i. Allg. als sinnvoll und gut für den Patienten angesehen werden bzw. ein geringes Risikopotenzial mit sich bringen (ähnlich den General Practice Points (GPP) der deutschen S3-Leitlinien der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF)). Beispielsweise ist die sofortige Einleitung von Therapiemaßnahmen nach Diagnosestellung der Sepsis ein BPS, da die Alternative eines verzögerten Maßnahmenbeginns keinerlei plausible Vorteile mit sich bringen würde.
Im Anschluss an die ausgearbeitete Textform der Leitlinie mit Hintergrundinformationen zur Evidenz sind alle Empfehlungen tabellarisch zusammengefasst, nach Themengebieten sortiert und jenen der Vorgängerversion von 2012 gegenübergestellt. Die Kerninhalte der Leitlinie umfassen in der Akuttherapie der Sepsis die Abnahme von Blutkulturen und eine darauffolgende Applikation eines Breitspektrumantibiotikums innerhalb 1 h nach Diagnosestellung sowie in Form eines BPS das Anstreben einer umgehenden Fokussanierung. Eine empirische, antibiotische Kombinationstherapie ist – wenn überhaupt – nur im septischen Schock empfohlen, nicht jedoch in der Sepsis (auch nicht bei Patienten in der Neutropenie). Im weiteren Verlauf soll die Antibiotikatherapie täglich reevaluiert und wenn möglich auf Grundlage von mikrobiologischen Befunden oder im Fall der klinischen Verbesserung deeskaliert werden. Eine Behandlungsdauer von 7 bis 10 Tagen ist in der Regel ausreichend, sollte bei Bedarf allerdings angepasst werden. So wird eine Verlängerung der Behandlungsdauer bei verzögertem klinischen Ansprechen, nichtsanierbarem Fokus, bestehender Immundefizienz (inkl. Neutropenie) oder bestimmten Erregern (z. B. Staphylococcus aureus, bestimmte Pilze oder Viren) empfohlen. Tritt eine schnelle klinische Besserung nach einer guten Fokussanierung bei intraabdominellen oder urologischen Infektionen ein, kann die Behandlungsdauer allerdings auch auf unter 7 Tage verkürzt werden.
Innerhalb der ersten 3 h sollen zudem 30 ml/kgKG kristalloider Flüssigkeit infundiert werden und vor einer weiteren Flüssigkeitsapplikation dann die Volumenreagibilität anhand dynamischer Variablen, wie beispielsweise dem „passive leg raising test“ oder der Schlagvolumenvariation, evaluiert werden. Eine relevante Änderung zur vorherigen Version der Leitlinie [20] ist hierbei der Wegfall konkreter Zielwerte der zentralvenösen Sättigung (SzvO2) und des zentralen Venendrucks (ZVD), nachdem diese in den 3 groß angelegten, randomisierten und aufeinander abgestimmten Australasian Resuscitation in Sepsis Evaluation (ARISE)-, Protocolized Care for Early Septic Shock (PROCESS)- und Protocolised Management in Sepsis (PROMISE)-Untersuchungen zur Early Goal Directed Therapy (EGDT) gegenüber der Standardbehandlung keinen Vorteil im Behandlungsergebnis zeigen konnten [21–23].
Im septischen Schock sollte ein MAP von 65 mm Hg angestrebt werden. Das Katecholamin der Wahl stellt Noradrenalin dar. Ist hierdurch ein Erreichen des Ziel-MAP-Werts nicht möglich, sollen zusätzlich Vasopressin und erst danach Adrenalin zum Einsatz kommen.
Als weitere Behandlungsmaßnahme ist bei Patienten, die aufgrund der Sepsis ein ARDS entwickeln, eine lungenprotektive Beatmung mit einem Atemzugvolumen <6 ml/kgKG sowie einem Plateaudruck <30 cmH2O anzustreben.
Da Leitlinien immer nur Empfehlungen darstellen, die für den Großteil der Patienten den bestmöglichen Effekt auf Grundlage der aktuellen Evidenz mit sich bringen, muss in jedem Einzelfall geprüft werden, ob der entsprechende Patient auch von den jeweiligen Maßnahmen profitiert. In Bezug auf die Flüssigkeits- und Vasopressorenapplikation können die Algorithmen aus dem Users’ Guide von Dellinger et al. [17] dem Behandelnden konkrete Handlungspfade vorgeben, die über die generellen Empfehlungen der Leitlinie hinausgehen. Beispielsweise schlagen die Autoren im septischen Schock konkret vor, die Therapie mit Kortikosteroiden beim Einsatz von Vasopressin durchzuführen, sobald zusätzlich Adrenalin zur Blutdrucktherapie notwendig ist [17]. Noch in diesem Jahr sollen auf Grundlage der neuen Leitlinie zudem die Therapiebündel der SSC aktualisiert und für möglichst viele Behandelnde auf Intensivstationen zugänglich gemacht werden.
Zusammenfassung
Die neue Leitlinie zur Behandlung der Sepsis und des septischen Schocks gibt einen umfassenden Überblick über die aktuelle Evidenz zu diesem Thema und betont den nach wie vor hohen Stellenwert der zentralen Säulen der Sepsistherapie. Hierzu gehören die schnelle Antibiotikatherapie, frühestmögliche Maßnahmen zur Fokussanierung, die Volumentherapie sowie die lungenprotektive Beatmung.
Originalpublikation
Allegranzi B, Zayed B, Bischoff P et al (2016) New WHO recommendations on intraoperative and postoperative measures for surgical site infection prevention: an evidence-based global perspective. Lancet Infect Dis 16(12):e288–e303
Wichtiger noch als die bestmögliche Therapie einer Erkrankung ist deren Prävention. So hat die Weltgesundheitsorganisation (WHO) Ende des Jahres 2016 Empfehlungen zur Prävention der chirurgischen Wundinfektion herausgegeben und diese mit Handlungsanweisungen für das prä-, intra- und postoperative Management verknüpft [24, 25]. Neben Hinweisen zum chirurgischen Management und dem Umgang mit Antiinfektiva wird eine starke Empfehlung zur Applikation einer inspiratorischen Sauerstoffkonzentration (FIO2) von 80 % intraoperativ und in den ersten 2–6 h postoperativ ausgesprochen [25]. Hintergrund dieser Empfehlung ist die Annahme, dass eine Gewebshyperoxygenierung die Infektionswahrscheinlichkeit und das Auftreten postoperativer Wundinfektionen senkt. Nun muss an dieser Stelle allerdings angemerkt werden, dass dies in deutlichem Widerspruch zu einer bereits im Jahr 2014 erschienenen Handlungsempfehlung der Society for Healthcare Epidemiology of America (SHEA) und der Infectious Diseases Society of America (IDSA) [26] steht, die explizit darauf hinweist, dass eine perioperative FIO2 von 80 % die Sterblichkeit von onkologischen Patienten signifikant erhöht, im Vergleich zu onkologischen Patienten, bei denen die FIO2 nur 30 % beträgt. Dieser Hinweis fußte auf 2 Publikationen aus den Jahren 2004 [27] und 2009 [28], die zumindest keinen Hinweis für einen Benefit einer erhöhten Sauerstoffkonzentration nachweisen konnten. In einer Subgruppenanalyse [29] der PROXI-Studie von 2009 [28] zeigte sich zudem in einem onkologischen Kollektiv eine erhöhte Sterblichkeit unter Anwendung einer FIO2 von 80 %. In einem Editorial kommentierten Volk et al. [30] die für die WHO-Empfehlung durchgeführte Metaanalyse. Sie konnten in Ergänzung zu den in der Metaanalyse genannten Arbeiten nach eingehender Literaturrecherche 2 weitere Studien mit dem gleichen Behandlungsziel hinzufügen, woraufhin die Verringerung der Wundinfektionsrate durch eine erhöhte Sauerstoffkonzentration in dieser neuen Metaanalyse nicht mehr nachweisbar war. Die Autoren kommen deshalb zu dem Schluss, dass sich die Auswahl der perioperativen Sauerstoffkonzentration nach anderen Gesichtspunkten richten sollte als nur dem Auftreten postoperativer Wundinfektionen [30]. Da die WHO-Empfehlung, welche wohlbemerkt ohne die Mitarbeit anästhesiologischer Kollegen entstanden ist, letzten Endes auch juristische Konsequenzen bei Nichtbeachtung nach sich ziehen könnte, darf mit Spannung erwartet werden, welche Reaktionen diese nun noch hervorbringen wird.
Originalpublikation
Roberts JA, Abdul-Aziz MH, Davis JS et al (2016) Continuous versus Intermittent β‑Lactam Infusion in Severe Sepsis. A Meta-analysis of Individual Patient Data from Randomized Trials. Am J Respir Crit Care Med 194(6):681–691
Lässt sich eine Infektion und gar die Entwicklung einer Sepsis nicht vermeiden, so ist eine Antibiotikatherapie als kausale Therapieoption im Rahmen des 3‑h-Bündels der SSC notwendig [20]. Es stellt sich dann häufig die Frage nach der optimalen Applikationsform dieser Medikamente. In Bezug auf die β‑Lactam-Antibiotika wird z. B. ein möglicher Vorteil einer kontinuierlichen bzw. prolongierten Infusion gegenüber der nach einem initialen Bolus intermittierend weitergeführten Gabe diskutiert. Drei in jüngster Zeit erschienene, randomisierte Studien zu dieser Fragestellung konnten unabhängig voneinander, jeweils keinen signifikanten Überlebensvorteil für die kontinuierliche Infusion nachweisen [31–33]. In einer von Roberts et al. [34] durchgeführten Metaanalyse wurden die Ergebnisse dieser 3 Studien nun zusammengefasst und zeigten schließlich in der Gesamtauswertung eine signifikante Verschiebung des Behandlungsergebnisses hin zu einem Überlebensvorteil bei kontinuierlicher Gabe (Abb. 3). Dass die Datenlage allerdings unzureichend ist, um eine generelle Empfehlung zur kontinuierlichen Gabe der β‑Lactam-Antibiotika auszusprechen, wurde unter Mitarbeit der Autoren der oben genannten Studien und Metaanalyse auch in einer daraufhin erschienenen Übersichtsarbeit betont [35]. Gerade eine kontinuierliche Gabe ohne Wirkspiegelmessung ist obsolet, um ein kontinuierliches Unterschreiten der minimalen Hemmkonzentration (MHK) unter allen Umständen zu verhindern. Ebenso ist zur Aufsättigung des Gewebes ein initialer Bolus obligat, der möglicherweise in Kombination mit einer prolongierten Infusion über beispielsweise 3 h eine durchaus praktikable und sichere Applikationsform für β‑Lactam-Antibiotika im klinischen Alltag darstellen kann, auch wenn keine routinemäßigen Spiegelkontrollen verfügbar sind.

Originalpublikation
de Jong E, van Oers JA, Beishuizen A et al (2016) Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: a randomised, controlled, open-label trial. Lancet Infect Dis 16(7):819–827
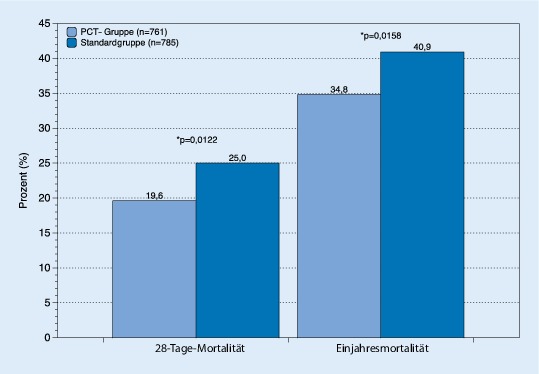
Zur Frage nach der optimalen Dauer einer antibiotischen Therapie haben de Jong et al. in einer prospektiven, randomisierten, allerdings unverblindeten Multizenterstudie in den Niederlanden untersucht, ob ein Prokalzitonin(PCT)-gesteuerter Algorithmus die Tagesdosen und Therapiedauer von Antibiotika verbessern kann [36]. Es wurden 1546 Patienten auf 15 niederländischen Intensivstationen eingeschlossen und die Dauer der Antibiotikatherapie entweder nach Standard oder anhand eines PCT-Algorithmus gesteuert. Dieser Algorithmus schlug bei einem PCT-Wert unter 20 % des gemessenen Spitzenwerts bzw. unterhalb eines Werts von 0,5 µg/l den Therapiestopp vor. Die Anwendung dieses Algorithmus führte tatsächlich zu einer Reduktion der Tagesdosen von 9,3 in der Standardgruppe auf 7,5 in der PCT-gesteuerten Gruppe (p < 0,0001). Ebenso konnte die Therapiedauer von 7 auf 5 Tage reduziert werden (p < 0,0001). Selbst für die Autoren war erstaunlich, dass sogar die 28-Tage- sowie die Einjahressterblichkeit in der Gruppe mit PCT-gesteuerter Therapie signifikant verringert war (Abb. 4). Mögliche Erklärungen hierfür sind zum einen die geringere Exposition gegenüber den Antibiotika und den damit verbundenen unerwünschten Arzneimittelwirkungen (UAW). Zudem ist denkbar, dass aufgrund des nichtverblindeten Studiendesigns die Patienten entlang des PCT-Algorithmus eine vielleicht sorgfältigere Behandlung erfahren haben und somit vom sog. Hawthorne-Effekt profitierten. Ob sich die positiven Effekte dieses Konzepts auch in der breiten Anwendung bestätigen lassen, ist daher zum gegenwärtigen Zeitpunkt noch unklar. Anzumerken ist, dass eine in diesem Zusammenhang ebenfalls 2016 erschienene Untersuchung zum Effekt einer PCT-gesteuerten Therapie wiederum keinen Vorteil feststellen konnte [37]. In den neuen Leitlinien zur Sepsistherapie wird jedenfalls eine regelmäßige PCT-Bestimmung zur Reduktion der Therapiedauer von Antibiotika mit einer schwachen Empfehlung vorgeschlagen [8].
Originalpublikation
Gordon AC, Perkins GD, Singer M et al (2016) Levosimendan for the Prevention of Acute Organ Dysfunction in Sepsis. N Engl J Med 375(17):1638–1648
Für die adjunktive Behandlung von Patienten im septischen Schock stehen diverse Therapieoptionen zur Verfügung, um ein Fortschreiten der Krankheitsschwere und das Behandlungsergebnis dieser Patienten zu verbessern. Patienten im septischen Schock mit septischer Kardiomyopathie könnten möglicherweise von der Applikation des Kalzium-Sensitizer Levosimendan profitieren [38]. Diesbezüglich untersuchten Gordon et al. in einer prospektiven, randomisierten, doppelblinden Multizenterstudie auf 34 britischen Intensivstationen, inwiefern Levosimendan zusätzlich zur Standardtherapie das Organversagen von Patienten mit septischem Schock verringern kann [39]. Sie schlossen hierfür 516 Patienten im septischen Schock ein, die trotz adäquater Volumentherapie seit mindestens 4 h mit Noradrenalin therapiert wurden. Diese erhielten dann entweder Levosimendan in einer Dosierung von 0,05–0,2 µg/kgKG und min oder Placebo über einen Zeitraum von 24 h. Den primären Endpunkt stellte der mittlere SOFA-Score innerhalb von 28 Tagen dar, welcher durch die Zusatzbehandlung mit Levosimendan nicht verändert wurde. Es zeigte sich sogar eher ein Trend zu einer schlechteren Organfunktion. In der Unterkategorie des kardiovaskulären SOFA-Scores war dieser Unterschied dann sogar signifikant. Die Sterblichkeit nach 28 Tagen konnte durch Levosimendan ebenfalls nicht signifikant verändert werden (34,5 % vs. 30,9 %; p = 0,43). Sollte jetzt also festgehalten werden, dass Levosimendan bei septischen Patienten einen negativen Effekt hat? Diesbezüglich muss darauf hingewiesen werden, dass das untersuchte Kollektiv möglicherweise nicht derjenigen Zielgruppe entsprochen hat, für die Levosimendan eine echte Therapieoption darstellt. So erhielten bei Einschluss in die Studie weniger als 10 % der Patienten in beiden Gruppen eine inotrope Medikation in Form von Dobutamin. Der Anteil an Patienten mit einem schlechten Herzindex und septischer Kardiomyopathie war also definitiv zu gering, um eine Aussage dazu tätigen zu können, ob sich das Behandlungsergebnis dieser Patienten durch eine Levosimendanapplikation verbessert hätte. Dieses spezifischere Kollektiv sollte folglich in Zukunft weitergehend untersucht werden. Von der generellen Anwendung von Levosimendan bei allen Patienten mit Sepsis oder septischem Schock muss auf Basis der Ergebnisse von Gordon et al. [39] allerdings dringend abgeraten werden.
Originalpublikation
Keh D, Trips E, Marx G et al (2016) Effect of Hydrocortisone on Development of Shock Among Patients With Severe Sepsis: The HYPRESS Randomized Clinical -Trial. JAMA 316(17):1775–1785
In den neuen Leitlinien zur Therapie der Sepsis und des septischen Schocks [8] hat Hydrokortison weiterhin einen Stellenwert, wenngleich es auf die Behandlung des therapierefraktären, septischen Schocks limitiert bleiben sollte (Dosisempfehlung: 200 mg/Tag). Inwiefern Hydrokortison bei Patienten mit schwerer Sepsis möglicherweise eine Progression hin zum septischen Schock zu verhindern vermag, wurde durch die von Keh et al. 2016 publizierte prospektive randomisierte und doppelblinde HYPRESS-Studie untersucht [40]. Sie verglichen 380 Patienten mit schwerer Sepsis auf 34 Überwachungsstationen, die entweder über 5 Tage mit 200 mg/Tag Hydrokortison (mit anschließendem Ausschleichschema) behandelt wurden oder Placebo erhielten. Untersucht wurde die Progression der schweren Sepsis zum septischen Schock innerhalb von 14 Tagen. Nachdem in der CORTICUS-Studie von 2008 [41] zwar der septische Schock durch Hydrokortison schneller aufgehoben werden konnte, sich aber kein Überlebensvorteil zeigte, war leider auch das Ergebnis der HYPRESS-Studie ernüchternd. Weder die Progression zum septischen Schock noch die 28-Tage-Sterblichkeit konnten signifikant verringert werden (Abb. 5). Ein sekundärer Endpunkt zeigte allerdings einen signifikanten Unterschied zwischen den beiden Gruppen: So entwickelten die mit Hydrokortison behandelten Patienten seltener ein Delir als diejenigen Patienten, die lediglich Placebo erhielten (8,5 % vs. 19,2 %; p = 0,01) – möglicherweise ein Hinweis auf einen Einfluss der Inflammation auf die Genese des Delirs bei Patienten auf der Intensivstation (Abb. 5).

Zusammenfassung
Es gibt Hinweise dafür, dass im Rahmen der Sepsistherapie eine prolongierte Infusion von β‑Lactam-Antibiotika der Bolusgabe überlegen ist und ein PCT-Algorithmus zur Steuerung der Antibiotikatherapie sinnvoll sein könnte. Levosimendan und Hydrokortison zeigten keine Behandlungsvorteile, wenn sie bei unselektierten Patientenkollektiven mit Sepsis zur Anwendung kamen.
ARDS
Originalpublikationen
Bellani G, Laffey JG, Pham T et al (2016) Epidemiology, Patterns of Care, and Mortality for Patients With Acute Respiratory Distress Syndrome in Intensive Care Units in 50 Countries. JAMA 315(8):788–800
Laffey JG, Bellani G, Pham T et al (2016) Potentially modifiable factors contributing to outcome from acute respiratory distress syndrome: the LUNG SAFE study. Intensive Care Med 42(12):1865–1876
Im Jahr des „50. Geburtstags“ der Erstbeschreibung des ARDS [42] erscheint die große, epidemiologische Untersuchung „LUNG SAFE“ [43] zur weltweiten Qualität der Diagnosestellung und Therapie dieses Krankheitsbildes als besonders erwähnenswert. Diese multizentrische, prospektive Kohortenstudie untersuchte innerhalb von 4 Wochen über 29.000 Patienten auf 459 Intensivstationen in 50 Ländern und stellte eine Inzidenz des ARDS von 10,4 % bei diesem Patientenkollektiv fest. Die Studie zeigte große Defizite in der frühzeitigen Erkennung des ARDS und der Umsetzung relativ einfacher Maßnahmen zur Reduktion der Sterblichkeit. Die richtige Diagnose erhielten zum Zeitpunkt der Erfüllung der Kriterien der Berlin-Definition [44] lediglich 34 % der betroffenen Patienten, während im gesamten Verlauf der Erkrankung nur in 60 % der Fälle die Diagnose ARDS gestellt wurde. Selbst einfach anwendbare und allseits anerkannte Therapieoptionen, wie z. B. die lungenprotektive Ventilation, wurden nur unzureichend umgesetzt. So erhielten weniger als zwei Drittel der Patienten ein Tidalvolumen (VT) <8 ml/kgKG; der Anteil an Patienten mit einem VT <6 ml/kgKG lag noch nicht einmal bei 20 %. Ebenso blieb der positiv-endexspiratorische Druck (PEEP) bei über 80 % der Patienten unter 12 cmH2O. Stattdessen wurde viel zu häufig versucht, die Oxygenierung der Patienten durch eine Änderung der FIO2 zu verbessern [43].
Eine Auswertung der beeinflussbaren Faktoren zur Verbesserung des Behandlungsergebnisses dieses Kollektivs ergab, dass bei den überlebenden Patienten ein höherer PEEP, ein niedrigerer Spitzendruck, eine Druckdifferenz zwischen PEEP und Plateaudruck („driving pressure“) unter 14 cmH2O sowie eine geringere Atemfrequenz als bei den nichtüberlebenden Patienten vorlagen [45]. Der Einfluss des VT auf das Überleben war unklar, da im gesamten Patientenkollektiv nur geringe Unterschiede festgestellt werden konnten (mittleres VT 7,6 ml/kgKG). Es konnte zudem ein Zusammenhang zwischen der Überlebenswahrscheinlichkeit und der Anzahl an Intensivbetten hergestellt werden. So war die Krankenhaussterblichkeit höher, je weniger Betten die jeweilige Intensivstation hatte, nicht jedoch die Sterblichkeit auf der Intensivstation. Dies könnte ein Hinweis darauf sein, dass es im Fall limitierter intensivmedizinischer Ressourcen zu einer möglicherweise zu frühen Verlegung der ARDS-Patienten in ein normalstationäres Umfeld kommt und die dortige Behandlung den Anforderungen dieser Patienten nicht gerecht werden kann.
In einer weiteren Substudie von LUNG SAFE stellten die Autoren um Bellani et al. [46] zudem fest, dass Patienten mit ARDS und einem Horowitz-Quotienten <150 mm Hg eine erhöhte Mortalität aufwiesen, wenn sie nichtinvasiv beatmet wurden. Die Intubation und invasive Ventilation haben in diesem Fall also die Überlebenswahrscheinlichkeit erhöht.
In einer lesenswerten Übersichtsarbeit fassten Bein et al. den aktuellen Wissensstand und die derzeit geltende Evidenz zu Diagnosekriterien, Therapieoptionen und adjuvanten Maßnahmen bei Patienten mit ARDS zusammen [47]. In einem Algorithmus erarbeiteten sie die grundlegenden diagnostischen und therapeutischen Schritte, welche bei korrekter Anwendung sicherlich dazu beitragen können, den Behandlungserfolg bei Patienten mit diesem komplexen Krankheitsbild zu verbessern (Abb. 6).

Sauerstofftherapie und nichtinvasive Beatmung
Originalpublikation
Girardis M, Busani S, Damiani E et al (2016) Effect of Conservative vs Conventional Oxygen Therapy on Mortality Among Patients in an Intensive Care Unit: The Oxygen-ICU Randomized Clinical Trial. JAMA 316(15):1583–1589
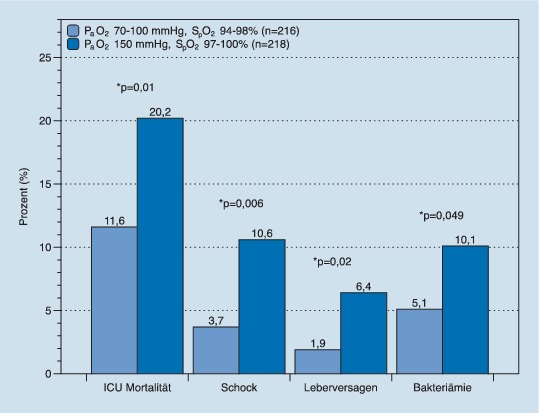
Patienten auf der Intensivstation benötigen auch in Abwesenheit eines ARDS häufig eine Sauerstoffapplikation, um einer Hypoxie vorzubeugen bzw. diese zu therapieren. Umgekehrt ist allerdings auch hinlänglich bekannt, dass eine Hyperoxie negative Folgen für die Patienten haben kann: So ist z. B. beim chirurgischen Management von Tumorpatienten beschrieben, dass eine höhere Sauerstoffkonzentration mit einer erhöhten Mortalität assoziiert ist [29]. Gleiches gilt auch für Patienten mit Myokardinfarkt, bei denen ein Sauerstoffüberangebot zu einer größeren Infarktausdehnung führt [48]. Dennoch ist bisher nicht geklärt, inwiefern eine restriktive Sauerstoffapplikation auf der Intensivstation das Behandlungsergebnis generell verbessern kann. Dieser Frage gingen Girardis et al. in der OXYGEN-ICU-Studie nach [49]. Sie untersuchten an 434 Patienten in einer monozentrischen Studie prospektiv und randomisiert den Einfluss einer konservativen Sauerstoffgabe auf die Sterblichkeit von Patienten auf der Intensivstation. Patienten mit einem ARDS und einem Horowitz-Quotienten <150 mm Hg wurden aus der Studie ausgeschlossen. Unter Berücksichtigung der paO2-Zielwerte in Höhe von 70–100 mm Hg vs. ≤150 mm Hg bzw. der SpO2-Zielwerte in Höhe von 94–98 % vs. 97–100 % konnten in der konservativ therapierten Gruppe signifikant geringere FIO2- (0,36) und paO2-Werte (87 mm Hg) erzielt werden als in der konventionell behandelten Gruppe (FIO2: 0,39; paO2: 102 mm Hg). In der Tat zeigte sich ein messbarer Einfluss der Sauerstoffapplikation auf die Sterblichkeit der Patienten, welcher in der Gruppe der konservativ mit Sauerstoff versorgten Patienten signifikant geringer war (11,6 % vs. 20,2 % [p = 0,01]). In gleicher Weise konnten auch einige sekundär untersuchte Endpunkte, wie z. B. das Auftreten eines Schocks, eines Leberversagens sowie einer Bakteriämie signifikant verringert werden (Abb. 7).
Allerdings muss man das Ergebnis dieser Studie dahingehend relativieren, als dass es sich um eine monozentrische Untersuchung handelt, was häufig zu einer Überschätzung des Therapieeffekts führt. Zudem war die Studie ursprünglich für eine Patientenzahl von 660 ausgelegt worden, wobei aufgrund eines Erdbebens im Jahr 2012 ein Teil der Intensivstation des Krankenhauses in Modena zerstört wurde, was die weitere planmäßige Rekrutierung von Patienten unmöglich machte. Auch eine geringere Fallzahl trägt möglicherweise dazu bei, den Effekt einer Methode zu überschätzen. Nichtsdestotrotz ist dies ein hoch interessanter Ansatz, der eine erneute Überprüfung in großen, multizentrisch durchgeführten Untersuchungen nach sich ziehen sollte.
Originalpublikation
Jaber S, Monnin M, Girard M et al (2016) Apnoeic oxygenation via high-flow nasal cannula oxygen combined with non-invasive ventilation preoxygenation for intubation in hypoxaemic patients in the intensive care unit: the single-centre, blinded, randomised controlled OPTINIV trial. Intensive Care Med 42(12):1877–1887
Nachdem die High-Flow-Nasenkanüle (High-Flow Nasal Cannula, HFNC) bereits im vergangenen Jahr mit den Arbeiten von Frat et al. [50] und Hernandez et al. [51] Erwähnung in unserer Zusammenfassung intensivmedizinischer Studien [52] gefunden hat, ist dieses Verfahren auch 2016 wieder in interessanten Publikationen untersucht wurden.
So wurde am Universitätsklinikum in Montpellier in einer monozentrischen Studie der Nutzen der HFNC bei der Präoxygenierung hypoxischer Patienten auf einer gemischt chirurgisch-internistischen Intensivstation gezeigt [53]. In dieser Machbarkeitsstudie konnte an gerade einmal 49 Patienten mit ARDS oder Pneumonie ein signifikant geringerer Abfall der SpO2 während der Intubation nachgewiesen werden, wenn zur 4‑minütigen Präoxygenierung die HFNC (Fluss: 60 l/min, FIO2: 100 %) zusätzlich zur nichtinvasiven Ventilation (NIV) (PEEP 5, Druckunterstützung 10 cmH2O, FIO2: 100 %) eingesetzt wurde. Die Kontrollgruppe wurde lediglich mit den gleichen NIV-Einstellungen präoxygeniert. Durch einen aufwendigen Versuchsaufbau konnte sogar eine Verblindung der Untersucher (nicht jedoch der intubierenden Ärzte) erreicht werden, welche die Sättigungswerte sowie Outcome-Daten registrierten und dokumentierten. Wahrscheinlich aufgrund der durch den kontinuierlichen Sauerstofffluss über die HFNC weiterhin stattfindenden Oxygenierung in der Apnoephase, lag der SpO2-Wert bei den 25 Patienten der Interventionsgruppe im Median bei 100 %, gegenüber 96 % bei den 24 Patienten der Kontrollgruppe. Anders ausgedrückt fiel bei Betrachtung der Per-Protocol-Analyse auf, aus der 2 Patienten der Interventionsgruppe ausgeschlossen werden mussten, dass keiner der Patienten in der HFNC-Gruppe während der Intubation mit der SpO2 unter 80 % fiel, dies aber bei 21 % der Patienten in der Kontrollgruppe der Fall war. Auch wenn es sich um eine monozentrische Studie mit einer geringen Patientenzahl handelte, so scheint sich ein klinisch relevanter Effekt durch eine prinzipiell einfache Maßnahme nachweisen zu lassen. Die bereits in der Veröffentlichung von den Autoren angekündigte Multizenterstudie wird nun zeigen müssen, inwiefern sich der Effekt auch in Zentren mit weniger HFNC-Erfahrung reproduzieren lässt.
Originalpublikation
Hernandez G, Vaquero C, Colinas L et al (2016) Effect of Postextubation High-Flow Nasal Cannula vs Noninvasive Ventilation on Reintubation and Postextubation Respiratory Failure in High-Risk Patients: A Randomized Clinical Trial. JAMA 316(15):1565–1574
Die Kollegen um Hernandez et al. [51] zeigten bereits Anfang des Jahres 2016, dass die HFNC gegenüber der konventionellen Sauerstofftherapie die Reintubationsrate bei Patienten, die ein geringes Risiko für eine Reintubation aufweisen, senken konnte. Die gleiche Arbeitsgruppe veröffentlichte daraufhin im Herbst desselben Jahres eine Untersuchung, die sich mit der Frage befasste, ob die HFNC auch gegenüber der NIV in Bezug auf die Vermeidung von Reintubationen und respiratorischem Versagen bei Patienten mit einem hohen Reintubationsrisiko nicht unterlegen ist [54]. Sie untersuchten auf 3 spanischen Intensivstationen intubierte Patienten, die aufgrund verschiedener Faktoren ein hohes Risiko hatten, nach der Extubation reintubiert werden zu müssen. Zu diesen Risikofaktoren zählten u. a. ein Alter >65 Jahre, ein APACHE II Score >12, ein BMI >30 kg/m2, ein schwieriges oder verlängertes Weaning, eine Beatmungsnotwendigkeit aufgrund einer kardialen Insuffizienz, eine moderate oder schwere COPD sowie ein schwieriger Atemweg. Insgesamt 604 Patienten wurden randomisiert und erhielten über eine Zeitdauer von 24 h nach der Extubation entweder Sauerstoff über die HFNC (Fluss titriert nach Toleranz des Patienten, im Median 50 l/min, FIO2 nach SpO2 >92 %) oder per NIV (PEEP und Druckunterstützung nach Zielwerten: Atemfrequenz: <25/min, SaO2 >92 %, pH-Wert ≥7,35). Eine sedierende Medikation zur besseren Toleranz der NIV-Maske durfte nicht verabreicht werden. Nach 24 h erhielten die Patienten dann bei Bedarf nur noch konventionell Sauerstoff über eine Gesichtsmaske. Die Reintubationsrate nach 72 h war in der Gruppe der mit der HFNC behandelten Patienten ähnlich wie in der NIV-Gruppe (22,8 vs. 19,1 %). In Bezug auf das respiratorische Versagen nach 72 h (definiert durch: respiratorische Acidose, SpO2 <90 % oder paO2 <60 mm Hg bei FIO2 >0,4, Atemfrequenz >35/min, Einsatz der Atemhilfsmuskulatur oder verminderter mentaler Status) zeigte sich sogar ein statistisch signifikanter Vorteil für die HFNC: 26,9 % vs. 39,8 % unter NIV. Im Hinblick auf den Patientenkomfort konnte gezeigt werden, dass bei keinem der Patienten mit HFNC ein Therapieabbruch vorgenommen werden musste, während dies jedoch bei 42,9 % der Patienten in der NIV-Gruppe der Fall war. Allerdings soll nochmals erwähnt werden, dass die Patienten zur besseren Toleranz der NIV-Maske im Rahmen der hier vorliegenden Studie nicht sediert werden durften. Diese Untersuchung zeigte also deutlich, dass die HFNC nicht nur zur Präoxygenierung, sondern auch zur Prävention einer Reintubation bei Hochrisikopatienten eine zumindest vergleichbare Effektivität wie die NIV aufweist. Zudem ist die HFNC insbesondere in Bezug auf den Patientenkomfort gegenüber der NIV-Maske deutlich bevorteilt.
Originalpublikation
Patel BK, Wolfe KS, Pohlman AS et al (2016) Effect of Noninvasive Ventilation Delivered by Helmet vs Face Mask on the Rate of Endotracheal Intubation in Patients With Acute Respiratory Distress Syndrome: A Randomized Clinical Trial. JAMA 315(22):2435–2441
Inwiefern nicht nur im Sinne der Patienten-Compliance, sondern auch in Bezug auf das Behandlungsergebnis die NIV-Maske durch ein alternatives Verfahren (wie z. B. den NIV-Helm) ersetzt werden kann, untersuchten im vergangenen Jahr Patel et al. [55] in einer monozentrischen Studie in den USA. Das Studienprotokoll sah den Einschluss von insgesamt 206 ARDS-Patienten auf einer internistischen Intensivstation in Chicago vor, die bereits 8 h per NIV-Maske therapiert wurden und dann entweder mit der NIV-Maske (Kontrollgruppe) oder mit dem NIV-Helm (Interventionsgruppe) weitertherapiert werden sollten. Als primärer Endpunkt diente die Intubationsrate. Aufgrund von Sicherheitsbedenken beendete das Data Safety Monitoring Board die Studie vorzeitig nach dem Einschluss von insgesamt 83 Patienten. Zu diesem Zeitpunkt mussten in der Kontrollgruppe 61,5 % der Patienten intubiert werden, während dies gerade einmal bei 18,2 % der Patienten in der Interventionsgruppe notwendig wurde (p < 0,001). Ebenso unterschieden sich die Anzahl der beatmungsfreien Tage (12,5 vs. 28,0; p < 0,001) sowie die 90-Tage-Sterblichkeit (56,4 % vs. 34,1 %; p = 0,02) bereits signifikant voneinander. Es handelt sich hier zwar um eine monozentrische Studie, im Rahmen derer Behandlungseffekte aufgrund der konsequenten Maßnahmenumsetzung sowie der hohen Kompetenz des Personals häufig überschätzt werden, sodass es noch einer Überprüfung in einer großen multizentrischen Studie bedarf, bevor die Studienergebnisse verallgemeinert werden können. Bis dahin ist es aber durchaus lohnenswert darüber nachzudenken, welches der beiden Verfahren der NIV wir bei dem individuellen Patienten zur Anwendung bringen.
Zusammenfassung
In Bezug auf die Diagnose und Therapie des ARDS gibt es weltweit gravierende Defizite. Was die Anwendung von Sauerstoff auf der Intensivstation anbelangt, könnte eine restriktive Applikation von Vorteil sein. Zur Vermeidung respiratorischer Komplikationen ist die HFNC der NIV-Maske möglicherweise überlegen; ebenso zeigte der NIV-Helm bessere Behandlungsergebnisse als die NIV-Maske.
Organersatztherapie
Originalpublikationen
Gaudry S, Hajage D, Schortgen F et al (2016) Initiation Strategies for Renal-Replacement Therapy in the Intensive Care Unit. N Engl J Med 375(2):122–133
Zarbock A, Kellum JA, Schmidt C et al (2016) Effect of Early vs Delayed Initiation of Renal Replacement Therapy on Mortality in Critically Ill Patients With Acute Kidney Injury: The ELAIN Randomized Clinical Trial. JAMA 315(20):2190–2199
Das akute Nierenversagen („acute kidney injury“, AKI) stellt eine häufige Komplikation bei Patienten auf Intensivstationen dar. Es ist mit einer schlechten Kurz- und Langzeitprognose in Form von hoher Mortalität und Entwicklung einer chronischen oder sogar terminalen Niereninsuffizienz assoziiert [56]. Es existieren verschiedene AKI-Klassifikationen [57, 58], wenngleich diejenige der Organisation Kidney Disease: Improving Global Outcomes (KDIGO) die derzeit gebräuchlichste und sensitivste darstellt [58]. Die KDIGO-Kriterien beinhalten Veränderungen des Serum-Kreatinin(SCr)-Werts sowie der Urinausscheidung über die Zeit und dienen zu Schweregradeinteilung und Abschätzung der Prognose (Tab. 2). Ein Problem bleibt jedoch weiterhin die zeitliche Latenz zwischen eigentlicher Nierenfunktionsstörung und SCr-Anstieg. Mittels der Urinausscheidung ist meist eine frühzeitigere AKI-Klassifikation möglich. Zu beachten ist allerdings eine große Variation der assoziierten Mortalität innerhalb des gleichen Stadiums zwischen SCr- und Urinausscheidungskriterien [59].
| KDIGO-Stadium | Serum-Kreatinin-Wert | Urinausscheidung |
|---|---|---|
| 1 |
1,5- bis 1,9-facher Anstieg oder Anstieg ≥0,3 mg/dl |
<0,5 ml/kgKG und h über 6–12 h |
| 2 | 2,0- bis 2,9-facher Anstieg | <0,5 ml/ kgKG und h ≥12 h |
| 3 |
3,0-facher Anstieg oder Serum-Kreatinin-Wert ≥4,0 mg/dl oder Beginn einer Nierenersatztherapie |
<0,3 ml/ kgKG und h ≥24 h oder Anurie ≥12 h |
Nach Khwaja [ 58 ]
KDIGO Kidney Disease: Improving Global Outcomes
Über den optimalen Zeitpunkt für die Initiierung einer Nierenersatztherapie herrscht allerdings abseits absoluter Indikationskriterien (z. B. therapierefraktäre Volumenüberladung, metabolische Acidose (pH-Wert <7,15), Serum-Kalium-Wert >6 mmol/l oder >5,8 mmol/l mit Herzrhythmusstörungen, klinisch manifeste Urämie) Uneinigkeit.
Zwei hochrangig publizierte Untersuchungen beschäftigten sich im vergangenen Jahr mit der Frage, ob die frühe, gegenüber der verspäteten Nierenersatztherapie, bei Patienten mit AKI einen Einfluss auf die Sterblichkeit hat [60, 61]. Zum einen wurden in einer prospektiven randomisierten monozentrischen Studie aus Deutschland 231 Patienten mit AKI eingeschlossen. Zarbock et al. [61] verglichen die frühe gegenüber der verzögerten Nierenersatztherapie und untersuchten den Einfluss auf die 90-Tage-Sterblichkeit (früh vs. spät: 39,3 % vs. 54,7 %, p = 0,03). Im Rahmen der zweiten relevanten Untersuchung schlossen Gaudry et al. [60] insgesamt 619 Patienten auf 31 französischen Intensivstationen prospektiv randomisiert in eine Multizenterstudie ein. Auch hier wurde die frühe mit der verzögerten Nierenersatztherapie verglichen und deren Einfluss auf die 60-Tage-Sterblichkeit untersucht (früh vs. spät: 48,5 vs. 49,7 %, p = 0,79).
Interessanterweise ergaben sich unterschiedliche Ergebnisse in den beiden genannten Publikationen. Zur Interpretation dieser Ergebnisse lohnt es sich, die Unterschiede der beiden Untersuchungen etwas genauer zu beleuchten. Beide Studien bedienten sich der oben beschriebenen KDIGO-Kriterien, sowohl für den Studieneinschluss als auch für die Initiierung einer frühen oder späten Nierenersatztherapie. Bei Zarbock et al. [61] wurden die Patienten in die Studie eingeschlossen, wenn sie trotz ausreichender Flüssigkeitsgabe Neutrophilengelatinase-assoziiertes-Lipocalin(NGAL)-Werte >150 ng/ml aufwiesen und die Kriterien des KDIGO-Stadiums 2 erfüllten, entsprechend einer Erhöhung des SCr-Werts auf mindestens das Zweifache des Ausgangswerts oder einer Urinausscheidung von weniger als 0,5 ml/kgKG und h über 6–12 h. Die frühe Nierenersatztherapie sollte dann innerhalb von 8 h nach Erreichen des KDIGO-Stadiums 2 initiiert werden. Die verzögerte Nierenersatztherapie sollte innerhalb von 12 h nach Erreichen des KDIGO-Stadiums 3, also bei einer SCr-Erhöhung auf das Dreifache des Ausgangswerts bzw. einer Urinausscheidung von weniger als 0,3 ml/kgKG und h über 24 h oder Anurie über 12 h erfolgen. Demgegenüber erfolgte der Einschluss bei den Kollegen um Gaudry et al. [60] generell erst bei Erreichen des KDIGO-Stadiums 3. Die frühe Gruppe sollte dann innerhalb von 6 h der Nierenersatztherapie zugeführt werden, während die späte Gruppe erst bei Erreichen absoluter Dialyseindikationen (Harnstoff-Stickstoff-Wert >112 mg/dl (40 mmol/l), Serum-Kalium-Wert >6 mmol/l, pH-Wert <7,15 oder Hypoxie aufgrund Flüssigkeitsüberladung trotz diuretischer Therapie) dialysiert wurde.
Betrachtet man nun den Anteil der Patienten, die letzten Endes auch tatsächlich eine Nierenersatztherapie erhielten, so fällt Folgendes auf: Aufgrund des „früheren“ Einschlusses der späten Gruppe bei Zarbock et al. [61] erhielten beinahe alle Patienten eine Dialyse (frühe Gruppe: 112 von 112 Patienten [100 %], späte Gruppe 108 von 119 Patienten [91 %]), während bei Gaudry et al. [60] bei 305 von 311 Patienten (98 %) der frühen Gruppe, jedoch nur bei 157 von 308 Patienten (51 %) der späten Gruppe überhaupt eine Nierenersatztherapie durchgeführt wurde. Es hatte hier also fast die Hälfte der Patienten die Möglichkeit, sich spontan bzw. mithilfe medikamentöser Therapieoptionen vom AKI zu erholen und somit der Nierenersatztherapie und deren potenziellen Nebenwirkungen zu entgehen. Die Autoren schlüsselten deshalb die Mortalität noch einmal genauer auf und zeigten, dass die Patienten, deren Nierenfunktion sich spontan erholte, die niedrigste Sterblichkeit aufwiesen (37,1 %). Im Gegensatz hierzu wiesen wiederum diejenigen Patienten die höchste Sterblichkeit auf (61,8 %), die erst spät oder möglicherweise zu spät dialysiert wurden. Mit einer Sterblichkeit von 48,5 % lagen die früh dialysierten Patienten etwa in der Mitte der beiden anderen Gruppen [60].
Möglicherweise ist es also viel entscheidender, jene Patienten zu identifizieren, deren Nierenfunktion sich spontan erholen wird und die somit nicht den Nebenwirkungen der Nierenersatztherapie ausgesetzt werden müssen, als eine pauschale Aussage darüber zu treffen, ob eine Dialyse bei Patienten auf der Intensivstation früh oder spät begonnen werden soll. Die derzeit verwendeten KDIGO-Kriterien sind für diese Differenzierung unzureichend, und es existieren bis dato auch keine vielversprechenden Biomarker als Entscheidungshilfe.
Eine generelle Empfehlung von SCr‑, Harnstoff- und Urinausscheidungsgrenzwerten zur Definition des optimalen Zeitpunkts der Nierenersatztherapie fern absoluter Indikationen ist weiterhin fragwürdig und wird seitens der KDIGO-Leitlinien nicht gegeben. Nach aktueller Datenlage erscheint jedoch zumindest ein abwartendes Verhalten hinsichtlich einer Nierenersatztherapie gerechtfertigt, solange bestimmte Grenzwerte nicht überschritten werden (Abb. 8; [60, 62]). Außerhalb dieser ist die Initiierung einer Nierenersatztherapie immer eine patientenindividuelle und interdisziplinäre Entscheidung, bei der nicht zuletzt die Erfahrung der behandelnden Mediziner einen hohen Stellenwert besitzt und eine ständige Reevaluation notwendig ist. Zu berücksichtigende Parameter sind hierbei: Art der Erkrankung, Veränderung des Sauerstoffbedarfs und der Beatmungsparameter, hämodynamische (In‑)Stabilität sowie volumenabhängige Veränderung der kardialen Pumpfunktion. Ob sich in ersten Untersuchungen vielversprechende Biomarker, wie z. B. die Zellzyklusarrestmarker TIMP-2 und IGFBP7 [63], zur Prognoseabschätzung bewähren, muss in größeren Untersuchungen bestätigt werden.

Originalpublikation
Larsen FS, Schmidt LE, Bernsmeier C et al (2016) High-volume plasma exchange in patients with acute liver failure: an open randomized controlled trial. J Hepatol 64(1):69–78
Organersatzverfahren der Leber konnten bei Patienten mit Leberversagen bislang keinen positiven Einfluss auf die Sterblichkeit zeigen. So blieben vielversprechende Ansätze, wie z. B. die „Albumindialyse“ mittels des Molecular Adsorbent Recirculating System (MARS) oder die fraktionierte Plasmaseparation und -adsorption durch das Prometheus-System, bei Patienten mit Akut-auf-chronischem-Leberversagen (AOCLV) ohne signifikanten Überlebensvorteil [64, 65].
Im Jahr 2016 wurde nun erstmals ein positiver Einfluss eines Organersatzverfahrens bei Patienten mit akutem Leberversagen (ALV) nachgewiesen [66]. Larsen et al. [66] untersuchten in 3 Zentren insgesamt 182 Patienten mit ALV und hepatischer Enzephalopathie im Stadium 2 der West-Haven-Klassifikation [67], die sich in Somnolenz, Apathie, Dysarthrie, verminderter zeitlicher und örtlicher Orientierung, Gedächtnisstörungen sowie beginnenden EEG-Veränderungen, manifestieren kann. Während 90 dieser Patienten die Standardtherapie erhielten, wurden 92 Patienten zusätzlich noch einer Hochvolumenplasmaaustausch(HVP)-Therapie unterzogen. Diese HVP bestand aus einer Plasmaextraktion von 15 % des idealen Körpergewichts (im Mittel etwa 9 l) pro Sitzung mit Substitution durch gefrorenes Frischplasma („fresh frozen plasma“, FFP) und wurde an 3 aufeinanderfolgenden Tagen durchgeführt. Durch diese Maßnahme unterschied sich das transplantatfreie Überleben bis zur Entlassung aus dem Krankenhaus signifikant (47,8 % bei Standardtherapie gegenüber 58,7 % bei HVP zusätzlich zur Standardtherapie; p = 0,0083). Besonders interessant ist hierbei, dass dieser Überlebensvorteil aber nur für jene Patienten zutreffend zu sein scheint, die im Verlauf keiner Lebertransplantation unterzogen werden können. Durch eine in einer Substudie an 31 Patienten durchgeführte Analyse zahlreicher immunmodulatorischer Biomarker konnte gezeigt werden, dass dieser Effekt aller Wahrscheinlichkeit nach auf einer Verringerung der proinflammatorischen Reize und der Limitierung der antiinflammatorischen Immunantwort von Neutrophilen und Monozyten beruht. Die Leber hat aufgrund dieser Mechanismen vermutlich die Möglichkeit, sich in diesem kritischen Zeitfenster in Bezug auf ihre Synthese- und Exkretionsleistung zu erholen.
Zusammenfassung
Für die Einleitung einer Nierenersatztherapie ist neben der Frage nach dem „Wann“, die Frage nach dem „Ob“ von großer Relevanz, und die Nierenersatztherapie sollte im Fall einer hohen Wahrscheinlichkeit frühzeitig durchgeführt werden. Mit der HVP-Therapie zeigte beim akuten Leberversagen erstmals ein Organersatzverfahren einen positiven Einfluss auf das Behandlungsergebnis.
Mobilisation
Originalpublikation
Schaller SJ, Anstey M, Blobner M et al (2016) Early, goal-directed mobilisation in the surgical intensive care unit: a randomised controlled trial. Lancet 388:1377–1388
Ein Großteil der Patienten auf der Intensivstation ist aufgrund verschiedener Indikationen immobil(isiert), wie dies beispielsweise im Fall der Notwendigkeit zur Durchführung einer (lungenprotektiven) Beatmung, einer Muskelrelaxierung, einer Neuroprotektion, einer Behandlung nach Frakturen oder bei polytraumatisierten Patienten notwendig sein kann. Natürlich bedeutet ein immobilisierter und ggf. sedierter Patient einen geringeren Aufwand für die Pflege und das Behandlungsteam. Abseits absoluter Kontraindikationen haben sich in einigen Untersuchungen jedoch positive Effekte einer frühzeitigen Mobilisierung, wie z. B. eine kürzere Verweildauer auf der Intensivstation und im Krankenhaus sowie ein besseres funktionelles Ergebnis bei Krankenhausentlassung, nachweisen lassen [68–70]. Basierend hierauf wird auch in der 2015 erschienenen Leitlinie zur Frühmobilisation diese zur Vermeidung pulmonaler Komplikationen empfohlen [71]. Schaller et al. [72] untersuchten nun auf 5 chirurgischen Intensivstationen in den USA, Deutschland und Österreich, inwiefern eine frühzeitige und protokollbasierte Mobilisierung beatmeter Patienten deren Behandlungsergebnis verbessern kann. Sie bedienten sich des von ihnen entwickelten [73] und validierten [74, 75] Surgical Intensive Care Unit Optimal Mobilisation Score (SOMS) (Tab. 3) zur Beurteilung der Mobilität während des Aufenthalts auf der Intensivstation (primärer Endpunkt) sowie zur Definition mobilitätsbezogener Tagesziele in der Interventionsgruppe.
| SOMS-Score | Grad der Mobilisation |
|---|---|
| 0 | Keine Aktivität/Immobilisation |
| 1 | Passive Bewegung |
| 2 | Sitzen |
| 3 | Stehen |
| 4 | Gehen |
Nach Schaller et al. [ 72 ]
Die Autoren randomisierten insgesamt 200 postoperative oder nach Trauma auf der Intensivstation behandelte Patienten, von denen 96 Patienten nach dem jeweiligen Mobilisierungsstandard der entsprechenden Einrichtung behandelt wurden (Kontrollgruppe). Die restlichen 104 Patienten erhielten aufgrund der klinischen Untersuchung in der Morgenvisite ein täglich neu definiertes Mobilisationsziel (Interventionsgruppe). Nachdem dieses am Bett des Patienten visualisiert wurde, konnten alle Mitglieder des Behandlungsteams (Pflegekräfte, Physiotherapeuten, Ärzte) Bedenken und Hindernisse im Hinblick auf die Erreichung des jeweiligen Therapieziels äußern. Ein Moderator leitete das definierte Ziel über den Schichtwechsel hinaus an die behandelnden Kollegen weiter und versuchte, die Umsetzung des Therapieziels zu unterstützen. Am Ende des Tages wurde dann das letztendlich erreichte Mobilitätsniveau dokumentiert und in die Datenanalyse einbezogen. Die weitere Behandlung der Patienten unterschied sich zwischen den beiden Gruppen nicht. Im Hinblick auf den primären Endpunkt zeigten die Patienten der Interventionsgruppe einen besseren medianen SOMS während ihres Intensivaufenthaltes (2,2 vs. 1,5; p < 0,0001) im Vergleich zur Kontrollgruppe. Auch die zuvor festgelegten [76] sekundären Endpunkte der Intensivverweildauer (7 vs. 10 Tage) sowie des Mini-Modified Functional Independence Measure Score (mmFIM), der eine Aussage über die funktionelle Mobilität bei der Krankenhausentlassung gibt (8 vs. 5) waren durch die Intervention positiv beeinflusst. Besonders eindrücklich ist, dass zum Zeitpunkt der Entlassung aus dem Krankenhaus, insgesamt 51 % der in der Interventionsgruppe behandelten Patienten im Vergleich zu lediglich 28 % der Patienten aus der Kontrollgruppe eine funktionelle Unabhängigkeit erreichen konnten. Diese Studie liefert uns also eindeutige Hinweise dafür, dass unsere Patienten im perioperativen Umfeld schnellstmöglich mobilisiert werden sollten und dass dieses Ziel sehr effektiv durch ein interprofessionelles Team, bestehend aus Ärzten, Pflegekräften und Physiotherapeuten, erreicht werden kann. Nichtsdestotrotz sollte aber auch erwähnt werden, dass in der Interventionsgruppe mehr unerwünschte Ereignisse als in der Kontrollgruppe beobachtet werden konnten, wenngleich es sich hierbei überwiegend um hypotensive Phasen handelte und keine gefährlichen Komplikationen zu verzeichnen waren.
Dekompressionstrepanation bei Schädel-Hirn-Trauma
Originalpublikation
Hutchinson PJ, Kolias AG, Timofeev IS et al (2016) Trial of Decompressive Craniectomy for Traumatic Intracranial Hypertension. N Engl J Med 375(12):1119–1130
Die Dekompressionstrepanation wird seit Jahrzehnten als chirurgische Ultima-Ratio-Maßnahme zur Behandlung der intrakraniellen Hypertension angewendet. Bei der Behandlung großer ischämischer zerebraler Infarkte hat die Dekompressionstrepanation einen festen Stellenwert, nachdem in Studien gezeigt wurde, dass hierdurch die Mortalität gesenkt und das Risiko für ein schlechtes neurologisches Behandlungsergebnis nicht erhöht wird [77]. Die Rolle dieses Eingriffs bei Patienten mit Schädel-Hirn-Trauma (SHT) ist derzeit unklar. In der vorliegenden, multizentrischen, randomisierten kontrollierten Studie wurden 408 SHT-Patienten mit therapierefraktärer Erhöhung des intrakraniellen Drucks (ICP) auf >25 mm Hg über einen Zeitraum von 1–12 h eingeschlossen [78]. Nach Randomisierung wurde entweder eine Dekompressionstrepanation (unilaterale Hemikraniektomie oder bifrontale Kraniektomie) durchgeführt oder die medikamentöse Therapie mit der Gabe von Barbituraten intensiviert. Nach 6 Monaten war die Mortalitätsrate bei chirurgisch behandelten Patienten signifikant niedriger als bei medikamentös behandelten Patienten (26,9 % vs. 48,9 %, [absolute Differenz: −22,1 %; 95 %-Konfidenzintervall (95 %-KI): −31,5 %–−12,7 %]). Keine statistisch signifikanten Unterschiede zeigten sich jedoch in Bezug auf Patienten mit einem günstigen neurologischen Behandlungsergebnis gemäß der Extended Glasgow Outcome Scale (chirurgisch vs. medikamentös: 42,8 % vs. 34,6 %; p = 0,12). In der chirurgischen Behandlungsgruppe war der Anteil der Patienten mit einem ungünstigen neurologischen Behandlungsergebnis höher als in der medikamentösen Behandlungsgruppe. Die Ergebnisse dieser Studie zeigen, dass die Dekompressionstrepanation die Mortalität bei therapierefraktärer ICP-Erhöhung zwar zu reduzieren vermag, dies jedoch auf Kosten eines erhöhten Risikos für ein ungünstiges neurologisches Behandlungsergebnis geht. Bei der Behandlung von SHT-Patienten bleibt die Dekompressionstrepanation in Anbetracht dieser Daten daher eine Einzelfallentscheidung. Eine frühere prospektive Studie hatte gezeigt, dass durch eine frühzeitige bifrontale Dekompressionstrepanation das neurologische Behandlungsergebnis sogar verschlechtert werden kann [79]. Die Daten der vorliegenden Studie sind dennoch wichtig und sollten in der klinischen Praxis auch im Angehörigengespräch bei der Ermittlung des mutmaßlichen Patientenwillens berücksichtigt werden.
Transfusion von Thrombozytenkonzentraten bei spontaner intrazerebraler Blutung
Originalpublikation
Baharoglu MI, Cordonnier C, Al-Shahi S et al (2016) Platelet transfusion versus standard care after acute stroke due to spontaneous cerebral haemorrhage associated with antiplatelet therapy (PATCH): a randomised, open-label, phase 3 trial. Lancet 387:2605–2613
Die Behandlung mit Thrombozytenaggregationshemmern kann einen Risikofaktor für das Auftreten einer spontanen intrazerebralen Blutung (ICB) darstellen [80]. Das Vorliegen einer Thrombozytenfunktionsstörung kann bei diesen Patienten auch zu einer Hämatomprogression mit Entwicklung eines ungünstigen neurologischen Behandlungsergebnisses oder einer erhöhten Mortalität führen [81]. Die Transfusion von Thrombozytenkonzentraten (TK) wird bei Patienten mit ICB unter Thrombozytenaggregationshemmern oftmals durchgeführt, um die Thrombozytenfunktion zu verbessern und somit – zumindest theoretisch – das Risiko einer Hämatomprogression zu reduzieren. Geführt von der Neurologischen Klinik der Universität Amsterdam wurde diesbezüglich eine prospektive und randomisierte Studie an insgesamt 60 Krankenhäusern durchgeführt (Niederlande, Großbritannien, Frankreich, [82]). Es wurden insgesamt 190 Patienten mit ICB unter Einnahme von Thrombozytenaggregationshemmern (Acetylsalicylsäure, Carbasalat-Calcium, Clopidogrel, Dipyridamol) eingeschlossen. Von diesen wurden 97 Patienten einer TK-Transfusion unterzogen. Es wurde deutlich, dass sich zwischen beiden Gruppen kein Unterschied in Bezug auf die Größenzunahme des intrazerebralen Hämatoms nach 24 h ergab. Das Risiko, nach 3 Monaten verstorben oder schwer pflegeabhängig zu sein, war in der mit TK behandelten Gruppe höher als in der Kontrollgruppe. Das neurologische Behandlungsergebnis gemäß der modifizierten Rankin-Skala (mRS) war in der Behandlungsgruppe schlechter als in der Kontrollgruppe. Ein „serious adverse event“ trat bei 42 % der mit TK behandelten Patienten und nur bei 29 % der Kontrollgruppe auf („odds ratio“: 1,79; 95 %-KI: 0,98–3,27). Die Ergebnisse der vorliegenden Studie zeigen auf, dass die Transfusion von TK bei diesem Patientenkollektiv ungünstige Effekte hat, und bestätigen die Ergebnisse einer Metaanalyse bei Patienten mit einer traumatischen ICB unter Thrombozytenaggregationshemmern [83]. Die routinemäßige Transfusion von TK kann bei diesen Patienten nach derzeitiger Datenlage nicht empfohlen werden. Inwieweit bei ausgeprägter Thrombozytenfunktionsstörung aufgrund der Einnahme entsprechender Medikamente die Transfusion von TK – z. B. im Rahmen operativer Eingriffe – angezeigt ist, muss auf Einzelfallbasis entschieden werden.
Intraventrikuläre Fibrinolyse bei intraventrikulärer Blutung
Originalpublikation
Hanley DF, Lane K, McBee N et al (2017) Thrombolytic removal of intraventricular haemorrhage in treatment of severe stroke: results of the randomised, multicentre, multiregion, placebo-controlled CLEAR III trial. Lancet 389:603–611
Intraventrikuläre Blutungen stellen einen Sonderfall des hämorrhagischen Schlaganfalls dar, meist auf dem Boden einer ICB mit Einbruch in das Ventrikelsystem, und sind mit einer hohen Mortalität (>50 %) und Morbidität vergesellschaftet [84]. Die intraventrikuläre Blutung kann in der Akutphase zu einem Verschlusshydrozephalus führen, der mittels externer Ventrikeldrainage (EVD) behandelt wird. Eine Standardtherapie (EVD-Anlage: generelle Indikationsstellung/Anzahl und Position der Katheter/intraventrikuläre Thrombolyse; mikrochirurgisches Absaugen des „clot“) gibt es bislang nicht. Basierend auf den ermutigenden Behandlungsergebnissen einer vorausgegangenen Phase-II-Studie [85] hat ein internationales Konsortium (73 Studienzentren in 8 Ländern) eine randomisierte kontrollierte doppelblinde Phase-III-Studie zur intraventrikulären Fibrinolyse durchgeführt [86]. Es wurden 500 Patienten mit intraventrikulärer Blutung und Obstruktion des III. oder IV. Ventrikels auf dem Boden einer kleinvolumigen (≤30 ml) spontanen ICB nach routinemäßiger Anlage einer EVD in 8‑stündlichen Abständen mit intraventrikulären Bolusgaben (maximal 12) entweder des Fibrinolytikums Alteplase (1 mg/Bolus) oder von isotonischer Kochsalzlösung behandelt. Primärer Endpunkt der Studie war das funktionelle Ergebnis nach 180 Tagen, gemessen an der mRS. Ein „gutes“ funktionelles Behandlungsergebnis (mRS ≤3) war zwischen Alteplase- (48 %) und Kontrollgruppe (45 %) vergleichbar (RR 1,06; 95 %-KI: 0,88–1,28; p = 0,554). Das Sicherheitsprofil war in der Alteplasegruppe besser (bakterielle Ventrikulitis: 7 % vs. 12 %; p = 0,048) bzw. vergleichbar mit der Kontrollgruppe (symptomatische Reblutung: jeweils 2 %; p = 0,771). Ebenso war die Anzahl der Patienten, die langfristig einen Liquor-Shunt benötigten (jeweils 18 %; p = 0,78), vergleichbar (gering). Am Ende der intraventrikulären Behandlung waren bei 33 % der Patienten in der Alteplasegruppe und bei 10 % in der Kontrollgruppe mindestens 80 % des Clot CT-morphologisch aufgelöst; dabei gab es eine signifikante Korrelation zwischen dem verbleibenden Clot-Volumen und dem funktionellen Behandlungsergebnis bzw. der Mortalität. Auch wenn die Thrombolyse intraventrikulärer Blutungen mit Bolusgaben von Alteplase sicher war und sich Hinweise fanden, dass eine Reduktion des intraventrikulären Blutvolumens zu einem verbesserten funktionellen Behandlungsergebnis und Überleben führt, kann diese Behandlung auf der Basis der vorliegenden Studienergebnisse nicht als Standardtherapie empfohlen werden. Interessanterweise ist die 180-Tage-Mortalität in beiden Studiengruppen deutlich geringer als bislang berichtet. Ein mögliches Selektions- und Behandlungsbias stellt die Tatsache dar, dass die Entscheidung, welcher Patient eine EVD erhält und wie viele Katheter an welchen Stellen positioniert werden, bereits vor Studieneinschluss getroffen wurde.
Zusammenfassung
Im Bereich der neurochirurgischen Intensivmedizin zeigte die Dekompressionstrepanation bei Patienten mit therapierefraktärer Erhöhung ICP auf >25 mm Hg im Vergleich zur konservativen Therapie des SHT ein verbessertes Überleben bei fraglichem neurologischen Behandlungsergebnis. Thrombozytenkonzentrate sollten bei spontaner intrazerebraler Blutung unter Thrombozytenaggregationshemmern nicht verabreicht werden, und auch eine intraventrikuläre Fibrinolyse hat bei Ventrikelblutung keinen Vorteil gezeigt.
Neurologische Intensivmedizin
Originalpublikation
Steiner T, Poli S, Griebe M et al (2016) Fresh frozen plasma versus prothrombin complex concentrate in patients with intracranial haemorrhage related to vitamin K antagonists (INCH): a randomised trial. Lancet Neurol 15: 566–573
Intrazerebrale Blutungen stellen eine gefürchtete Komplikation der Behandlung mit Vitamin-K-Antagonisten dar. Mit dem Ziel der Vermeidung eines Größenwachstums der Blutung wird eine Normalisierung der Gerinnungssituation in der Akutphase angestrebt. Unsicherheit bestand bislang hinsichtlich der Auswahl der zur Normalisierung der International Normalized Ratio (INR) beitragenden Gerinnungsfaktoren, wobei FFP und Prothrombinkomplexkonzentrat (PPSB) zur Verfügung stehen. In der kürzlich veröffentlichten multizentrischen prospektiven und randomisierten INCH-Studie untersuchten Steiner et al. [87] den Effekt einer FFP-Gabe (20 ml/kgKG) im Vergleich zur PPSB-Substitution (30 Einheiten/kgKG) bei Patienten mit Vitamin-K-assoziierten Hirnblutungen, die innerhalb von 12 h nach Symptombeginn die Klinik erreichten und eine INR von mehr als 2,0 aufwiesen. Im Zeitraum August 2009 bis Januar 2015 konnten 54 Patienten eingeschlossen werden. Für die Auswertung herangezogen wurden die Datensätze von 23 Patienten in der FFP-Gruppe und 27 Patienten in der PPSB-Gruppe. Die Studie wurde aus Sicherheitsgründen beendet, nachdem eine Zwischenauswertung die Überlegenheit der PPSB-Gabe zeigte. Im Detail erreichten lediglich 9 % der Patienten in der FFP-Gruppe den primären Endpunkt, definiert als eine Normalisierung der INR (≤1,2) innerhalb von 3 h, wohingegen dies in 67 % der Fälle in der PPSB-Gruppe gelang (p = 0,0003). Die Behandlung mit PPSB resultierte sowohl in der nach 3 als auch nach 24 h erfolgten zerebralen Bildgebung in einer signifikant geringeren Blutungsgröße als nach FFP-Gabe (p = 0,023, p = 0,018). Ein signifikanter Unterschied im funktionellen Behandlungsergebnis nach 3 Monaten konnte nicht gezeigt werden. Trotz der vergleichsweise geringen Fallzahl zeigt die Studie von Steiner et al. [87] die Effektivität der Anwendung von PPSB bei Vitamin-K-induzierten Hirnblutungen. Eine Überprüfung hinsichtlich des funktionellen Behandlungsergebnisses im Langzeitverlauf wäre wünschenswert, erscheint jedoch angesichts der aktuellen Datenlage allein aus ethischen Gesichtspunkten – zumindest im direkten Vergleich mit FFP – nicht realisierbar.
Originalpublikation
Qureshi AI, Palesch YY, Barsan WG et al (2016) Intensive blood-pressure lowering in patients with acute cerebral hemorrhage. N Engl J Med 375: 1033–1043
Neben der Normalisierung der Gerinnungssituation gehört die Behandlung hypertensiver Blutdruckwerte zu den Therapiestrategien in der Akutphase nach ICB. Eine Senkung des systolischen Blutdruckwerts <180 mm Hg gilt allgemein als Standard. Bisherige Untersuchungen lieferten zudem den Hinweis, dass mit einer noch stärkeren Senkung des Blutdrucks ein verbessertes funktionelles Ergebnis erzielt werden könnte [88, 89]. Das Ausmaß der Senkung bzw. der im kurzfristigen Verlauf angestrebte Zielbereich des Blutdrucks waren bislang jedoch nicht durch eine prospektive Studie charakterisiert. In der multizentrischen, prospektiven und randomisierten ATACH-2-Studie untersuchten Qureshi et al. [90] die Effektivität einer frühzeitigen (innerhalb von 4,5 h nach Symptombeginn) und aggressiven Blutdrucksenkung (systolischer Wert 110–139 mm Hg) im Vergleich zu einer nur moderaten Senkung (140–179 mm Hg) bei Patienten mit ICB, die ein Blutungsvolumen von 6×10-5m3 nicht überschritten. Im Zeitraum Mai 2011 bis September 2015 wurden 8532 Patienten gescreent und 1000 Patienten mit einer 1:1-Verteilung für die Behandlungsgruppen eingeschlossen. Für die Blutdrucksenkung und zur Einhaltung des Zielbereichs innerhalb der ersten 24 h nach Randomisierung kamen die i.v.-Gabe des Kalziumantagonisten Nicardipin sowie – im Fall eines Therapieversagens – Labetalol, Diltiazem und Urapidil zur Anwendung. Hinsichtlich des primären Endpunkts, der Rate an Patienten mit schwerer funktioneller Beeinträchtigung oder Tod (mRS 4–6), war die aggressive der nur moderaten Blutdrucksenkung nicht überlegen (38,7 vs. 37,7 %). Unter den sekundären Endpunkten zeigte sich ein Trend für ein geringeres Größenwachstum der Blutung innerhalb der ersten 24 h, jedoch auch eine höhere Anzahl an schwerwiegenden unerwünschten Ereignissen in der Behandlungsgruppe mit intensiver Blutdrucksenkung. Zusammenfassend gelang auch in der ATACH-2-Studie nicht der Nachweis, dass eine aggressive Blutdrucksenkung auf geringere systolische Werte als 140 mm Hg mit einem verbesserten Behandlungsergebnis einhergeht. Vor dem Hintergrund, dass innerhalb der ersten 2 h nach Randomisierung auch unter der Kontrollgruppe eine deutliche Blutdrucksenkung nachvollziehbar war (systolischer Wert 141,1 mm Hg), kann einschränkend jedoch formuliert werden, dass die Differenz zur Gruppe mit intensivierter Blutdrucksenkung (zum gleichen Zeitpunkt systolischer Wert 128,9 mm Hg) nicht ausreichend war, um einen signifikanten Unterschied im primären Endpunkt zu erzielen. Das optimale Blutdruckmanagement bei Patienten mit intrazerebralen Blutungen bleibt auch nach der ATTACH-2-Studie offen und wird sicher Gegenstand weiterführender Studien sein.
Originalpublikation
Beardsley J, Wolbers M, Kibengo FM et al (2016) Adjunctive dexamethasone in HIV-associated cryptococcal meningitis. N Engl J Med 374: 542–554
Der Einsatz von Dexamethason ist fester Bestandteil der Leitlinie zur Behandlung der bakteriellen Meningitis im Erwachsenenalter [91]. Gestützt wird dies durch klinische Studien mit positiven Effekten – v. a. hinsichtlich des Erregers Streptococcus pneumoniae – und eine im Jahr 2015 aktualisierte Metaanalyse [92]. Der potenzielle Nutzen einer adjuvanten Therapie mit Glukokortikoiden bei viralen Meningoenzephalitiden wurde in den vergangenen Jahren intensiv diskutiert und zumindest für das Herpes-simplex-Virus systematisch untersucht [93]. Eine ausreichende Datengrundlage für die Empfehlung zum routinemäßigen Einsatz zeichnete sich bislang jedoch nicht ab [94]. Offen ist zudem der Einsatz von Glukokortikoiden bei zerebralen Pilzinfektionen. In ihrer multizentrischen randomisierten placebokontrollierten und doppelblinden Studie untersuchten Beardsley et al. [95] nun den Effekt einer adjuvanten Therapie mit Dexamethason bei Patienten mit Humaner-Immundefizienz-Virus(HIV)-assoziierten Meningitis durch Cryptococcus neoformans. Zusätzlich zur erregerspezifischen Therapie mit Amphotericin B oder Fluconazol erhielten Patienten für eine Dauer von 6 Wochen Dexamethason mit einer Initialdosis von 0,3 mg/kgKG und Tag (i.v.) innerhalb der ersten Woche sowie nachfolgend absteigend bis 1 mg/Tag während der 6. Woche (p.o.). Im Zeitraum Februar 2013 bis August 2014 wurden 451 Patienten eingeschlossen, wobei die Studie aus Sicherheitsgründen gestoppt werden musste. Es zeichnete sich ein zu diesem Zeitpunkt noch nicht signifikanter Vorteil hinsichtlich des primären Endpunkts, zuvor definiert als Rate an überlebenden Patienten innerhalb der ersten 10 Wochen nach Randomisierung, für die Placebogruppe ab. Im Detail verstarben in der Dexamethasongruppe 106 der insgesamt 224 Patienten (47 %) und in der Placebogruppe lediglich 93 der insgesamt 227 Patienten (41 %). Darüber hinaus zeigten sich signifikant mehr unerwünschte Ereignisse und eine höhere Rate an Patienten mit körperlicher Beeinträchtigung infolge der Therapie mit Dexamethason. Eine genaue Ursachenzuschreibung dieses unerwarteten Ergebnisses gelang bislang nicht; diskutiert wird das per se mit der Glukokortikoidgabe assoziierte Risiko für andere Infektionen bis hin zu septischen Verläufen. Zusammenfassend kann der Einsatz von Dexamethason zum gegenwärtigen Zeitpunkt über die bakterielle Meningitis hinaus nicht empfohlen werden.
Originalpublikation
Legriel S, Lemiale V, Schenck M et al (2016) Hypothermia for neuroprotection in convulsive status epilepticus. N Engl J Med 375: 2457–2467
Der Nutzen der therapeutischen Hypothermie für das funktionelle Langzeitergebnis nach erlittenem Herzstillstand konnte in der Vergangenheit in mehreren klinischen Studien gezeigt werden [96] und wurde in Metaanalysen bestätigt [97]. Für den Bereich kritischer neurologischer Erkrankungen wurden ebenfalls Versuche unternommen, die für die Hypothermie diskutierten neuroprotektiven Effekte nutzbringend einzusetzen. Für den ischämischen Schlaganfall liegen bei hier noch unvollständiger Studienlage [98] keine ausreichenden Daten für eine abschließende Beurteilung vor, wohingegen die Anwendung der Hypothermie bei Patienten mit bakterieller Meningitis mit einer erhöhten Sterblichkeit einherging [99]. In der kürzlich veröffentlichten multizentrischen randomisierten und kontrollierten HYBERNATUS-Studie untersuchten Legriel et al. [100] den Effekt einer Hypothermie bei Patienten mit Status epilepticus, dessen Behandlung bislang auf ein medikamentöses Stufenkonzept begrenzt ist, das im Wesentlichen aus Benzodiazepinen, der spezifischen antiepileptischen Therapie und Narkotika besteht [101]. Im Zeitraum März 2011 bis Januar 2015 wurden 270 Patienten mit konvulsivem Status epilepticus und hierdurch bedingter invasiver Beatmung eingeschlossen. Für die Auswertung zur Verfügung standen 138 Patienten nach Hypothermie (24 h bei 32–34 °C) durch gekühlte Infusionen und äußerliche Maßnahmen sowie 130 Patienten der Kontrollgruppe mit Standardbehandlung. Den primären Endpunkt, definiert als Anteil der Patienten mit gutem funktionellen Behandlungsergebnis (Glasgow Outcome Scale 5) nach 90 Tagen, erreichten 67 Patienten (49 %) in der Hypothermiegruppe und 56 Patienten (43 %) in der Kontrollgruppe (p = 0,43). Somit ergaben sich hinsichtlich des primären Endpunkts keine relevanten Unterschiede zwischen den Behandlungsgruppen. Nach Hypothermie ging während der ersten 12 nach der Randomisierung ein geringerer Anteil der Patienten in einen – entsprechend elektroenzephalographischer Kriterien – andauernden Status epilepticus über (p = 0,009). In der Interventionsgruppe fanden sich jedoch mehr unerwünschte Ereignisse, v. a. eine höhere Rate an Aspirationspneumonien. Zusammenfassend liefert die HYBERNATUS-Studie keine ausreichende Evidenz, die eine Empfehlung zur Anwendung der Hypothermie beim konvulsiven Status epilepticus erlauben würde.
Originalpublikation
Schönenberger S, Uhlmann L, Hacke W et al (2016) Effect of conscious sedation vs. general anesthesia on early neurological improvement among patients with ischemic stroke undergoing endovascular thrombectomy: a randomized clinical trial. JAMA 316: 1986–1996
Nachdem der Nutzen der mechanischen Thrombektomie bei Hirninfarkten, die durch einen proximalen Gefäßverschluss bedingt sind, in mehreren klinischen Studien bestätigt werden konnte (Übersicht: Goyal et al. [102]), wurde diese in die Leitlinie zur Behandlung des ischämischen Schlaganfalls implementiert [103] und wird mittlerweile vielerorts mit hoher Frequenz umgesetzt. Retrospektive Untersuchungen lieferten im Nachgang den Hinweis, dass dem periprozeduralen Management eine entscheidende Bedeutung zukommt: Patienten mit Allgemeinnarkose erzielten dabei ein schlechteres funktionelles Langzeitergebnis als Patienten, bei denen die mechanische Thrombektomie in wachem bzw. leicht sediertem Zustand durchgeführt wurde [104]. Mit einem erstmals prospektiven Design untersuchten Schönenberger et al. [105] den Aspekt des periprozeduralen Managements in der kürzlich veröffentlichten unizentrischen (Heidelberg) randomisierten Parallelgruppenstudie SIESTA. Im Zeitraum April 2014 bis Februar 2015 konnten 150 Patienten mit ischämischem Schlaganfall und gegebener Indikation zur mechanischen Thrombektomie eingeschlossen werden. Randomisiert wurden die Patienten in eine Behandlungsgruppe mit Allgemeinnarkose, einschließlich Intubation, (n = 73) sowie eine Gruppe mit primärem Verzicht auf eine Intubation und erlaubter Nutzung von Sedativa (n = 77). Hinsichtlich des primären Endpunkts, definiert als frühes neurologisches Behandlungsergebnis, zeigten sich unter Betrachtung der Mittelwerte der National Institutes of Health Stroke Scale (NIHSS) bzw. deren Differenzen zwischen der stationären Aufnahme und einem 24 h-Zeitpunkt keine signifikanten Unterschiede zwischen den Behandlungsgruppen (p = 0,82). Im Detail wurde eine Verbesserung um 3,2 bzw. 3,6 Punkte beobachtet. Unter der Vielzahl an sekundären Endpunkten mit überwiegend homogener Verteilung zwischen den beiden Gruppen fanden sich signifikante Unterschiede hinsichtlich der Rate an Pneumonien und dem Vorliegen einer Hypothermie zugunsten der Allgemeinnarkose. Darüber hinaus war die Rate an Patienten mit geringer Funktionseinschränkung (mRS 0–2) nach 3 Monaten signifikant höher in der Gruppe mit durchgeführter Allgemeinnarkose. Die im Feld der neurologischen Intensivmedizin mit Spannung erwarteten Ergebnisse der SIESTA-Studie zeigen erstmals unter Nutzung eines prospektiven Designs, dass der primäre Verzicht auf eine Intubation als Teil der Allgemeinnarkose im Rahmen des periprozeduralen Managements der mechanischen Rekanalisation nicht mit einem verbesserten Outcome assoziiert ist. Die deutliche Diskrepanz zu früheren, retrospektiven Untersuchungen wird weitere Post-hoc-Analysen nach sich ziehen und unterstreicht zudem die Notwendigkeit der Ausarbeitung differenzierterer Konzepte zum periprozeduralen Management der mechanischen Thrombektomie.
Zusammenfassung
In der neurologischen Intensivmedizin zeigte sich bei Vitamin-K-Antagonisten assoziierten intrakraniellen Blutungen eine Überlegenheit von PPSB gegenüber FFP im Hinblick auf die Gerinnungsnormalisierung. Zur Therapie intrazerebraler Blutungen zeigt eine intensivierte Blutdrucksenkung keinen Vorteil; zudem scheint die Behandlung des Status epilepticus durch Hypothermie nicht verbessert zu werden. Des Weiteren hat sich bei der mittlerweile etablierten Rekanalisation mittels mechanischer Thrombektomie zur Therapie des Hirninfarkts kein Vorteil des Verzichts auf eine Allgemeinanästhesie gezeigt.
Interessenkonflikt
C. Beynon gibt an, dass folgende Interessenskonflikte bestehen: Advisory Board‑/Vortragshonorare von Boehringer Ingelheim; Vortragshonorare von Bayer, CSL Behring; Forschungsunterstützung von Roche Diagnostics. C.J. Reuß, M. Bernhard, A. Hecker, C. Jungk, D. Michalski, C. Nusshag, M.A. Weigand und T. Brenner geben an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Bone RC, Balk RA, Cerra FB, Dellinger RP, Fein AM, Knaus WA, Schein RM, Sibbald WJ. Definitions for sepsis and organ failure and guidelines for the use of innovative therapies in sepsis. The ACCP/SCCM Consensus Conference Committee. American College of Chest Physicians/Society of Critical Care Medicine. Chest. 1992;101:1644–1655. doi: 10.1378/chest.101.6.1644. [DOI] [PubMed] [Google Scholar]
- 2.Kaukonen KM, Bailey M, Pilcher D, Cooper DJ, Bellomo R. Systemic inflammatory response syndrome criteria in defining severe sepsis. N. Engl. J. Med. 2015;372:1629–1638. doi: 10.1056/NEJMoa1415236. [DOI] [PubMed] [Google Scholar]
- 3.Singer M, Deutschman CS, Seymour CW, Shankar-Hari M, Annane D, Bauer M, Bellomo R, Bernard GR, Chiche JD, Coopersmith CM, Hotchkiss RS, Levy MM, Marshall JC, Martin GS, Opal SM, Rubenfeld GD, van der Poll T, Vincent JL, Angus DC. The third international consensus definitions for sepsis and septic shock (sepsis-3) JAMA. 2016;315:801–810. doi: 10.1001/jama.2016.0287. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Seymour CW, Liu VX, Iwashyna TJ, Brunkhorst FM, Rea TD, Scherag A, Rubenfeld G, Kahn JM, Shankar-Hari M, Singer M, Deutschman CS, Escobar GJ, Angus DC. Assessment of clinical criteria for sepsis: for the third international consensus definitions for sepsis and septic shock (sepsis-3) JAMA. 2016;315:762–774. doi: 10.1001/jama.2016.0288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Shankar-Hari M, Phillips GS, Levy ML, Seymour CW, Liu VX, Deutschman CS, Angus DC, Rubenfeld GD, Singer M, Sepsis Definitions Task F Developing a new definition and assessing new clinical criteria for septic shock: For the third international consensus definitions for sepsis and septic shock (sepsis-3) JAMA. 2016;315:775–787. doi: 10.1001/jama.2016.0289. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Vincent JL, Martin GS, Levy MM. qSOFA does not replace SIRS in the definition of sepsis. Crit Care. 2016;20:210. doi: 10.1186/s13054-016-1389-z. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.SepNet Critical Care Trials G Incidence of severe sepsis and septic shock in German intensive care units: The prospective, multicentre INSEP study. Intensive Care Med. 2016;42:1980–1989. doi: 10.1007/s00134-016-4504-3. [DOI] [PubMed] [Google Scholar]
- 8.Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R, Kumar A, Sevransky JE, Sprung CL, Nunnally ME, Rochwerg B, Rubenfeld GD, Angus DC, Annane D, Beale RJ, Bellinghan GJ, Bernard GR, Chiche JD, Coopersmith C, De Backer DP, French CJ, Fujishima S, Gerlach H, Hidalgo JL, Hollenberg SM, Jones AE, Karnad DR, Kleinpell RM, Koh Y, Lisboa TC, Machado FR, Marini JJ, Marshall JC, Mazuski JE, McIntyre LA, McLean AS, Mehta S, Moreno RP, Myburgh J, Navalesi P, Nishida O, Osborn TM, Perner A, Plunkett CM, Ranieri M, Schorr CA, Seckel MA, Seymour CW, Shieh L, Shukri KA, Simpson SQ, Singer M, Thompson BT, Townsend SR, Van der Poll T, Vincent JL, Wiersinga WJ, Zimmerman JL, Dellinger RP. Surviving sepsis campaign: international guidelines for management of sepsis and septic shock: 2016. Crit. Care Med. 2017;45:486. doi: 10.1097/CCM.0000000000002255. [DOI] [PubMed] [Google Scholar]
- 9.Leisman D, Wie B, Doerfler M, Bianculli A, Ward MF, Akerman M, D’Angelo JK, Zemmel D’Amore JA. Association of fluid resuscitation initiation within 30 minutes of severe sepsis and septic shock recognition with reduced mortality and length of stay. Ann Emerg Med. 2016;68:298–311. doi: 10.1016/j.annemergmed.2016.02.044. [DOI] [PubMed] [Google Scholar]
- 10.Raith EP, Udy AA, Bailey M, McGloughlin S, MacIsaac C, Bellomo R, Pilcher DV, Australian, New Zealand Intensive Care Society Centre for O. Resource E Prognostic accuracy of the SOFA score, SIRS criteria, and qSOFA score for in-hospital mortality among adults with suspected infection admitted to the intensive care unit. JAMA. 2017;317:290–300. doi: 10.1001/jama.2016.20328. [DOI] [PubMed] [Google Scholar]
- 11.Freund Y, Lemachatti N, Krastinova E, Van Laer M, Claessens YE, Avondo A, Occelli C, Feral-Pierssens AL, Truchot J, Ortega M, Carneiro B, Pernet J, Claret PG, Dami F, Bloom B, Riou B, Beaune S, French Society of Emergency Medicine Collaborators G Prognostic accuracy of sepsis-3 criteria for in-hospital mortality among patients with suspected infection presenting to the emergency department. JAMA. 2017;317:301–308. doi: 10.1001/jama.2016.20329. [DOI] [PubMed] [Google Scholar]
- 12.Williams JM, Greenslade JH, McKenzie JV, Chu K, Brown AF, Lipman J. SIRS, qSOFA and organ dysfunction: insights from a prospective database of emergency department patients with infection. Chest. 2016;151:586. doi: 10.1016/j.chest.2016.10.057. [DOI] [PubMed] [Google Scholar]
- 13.Churpek MM, Snyder A, Han X, Sokol S, Pettit N, Howell MD, Edelson DP. qSOFA, SIRS, and early warning scores for detecting clinical deterioration in infected patients outside the ICU. Am. J. Respir. Crit. Care Med. 2016;195:906. doi: 10.1164/rccm.201604-0854OC. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Singer AJ, Ng J, Thode HC, Jr., Spiegel R, Weingart S. Quick SOFA scores predict mortality in adult emergency department patients with and without suspected infection. Ann Emerg Med. 2017;69:475. doi: 10.1016/j.annemergmed.2016.10.007. [DOI] [PubMed] [Google Scholar]
- 15.Giamarellos-Bourboulis EJ, Tsaganos T, Tsangaris I, Lada M, Routsi C, Sinapidis D, Koupetori M, Bristianou M, Adamis G, Mandragos K, Dalekos GN, Kritselis I, Giannikopoulos G, Koutelidakis I, Pavlaki M, Antoniadou E, Vlachogiannis G, Koulouras V, Prekates A, Dimopoulos G, Koutsoukou A, Pnevmatikos I, Ioakeimidou A, Kotanidou A, Orfanos SE, Armaganidis A, Gogos C, Hellenic Sepsis Study G. Validation of the new Sepsis-3 definitions: Proposal for improvement in early risk identification. Clin. Microbiol. Infect. 2017;23:104–109. doi: 10.1016/j.cmi.2016.11.003. [DOI] [PubMed] [Google Scholar]
- 16.Wang JY, Chen YX, Guo SB, Mei X, Yang P. Predictive performance of quick sepsis-related organ failure assessment for mortality and ICU admission in patients with infection at the ED. Am J Emerg Med. 2016;34:1788–1793. doi: 10.1016/j.ajem.2016.06.015. [DOI] [PubMed] [Google Scholar]
- 17.Dellinger RP, Schorr CA, Levy MM. A users’ guide to the 2016 surviving sepsis guidelines. Crit. Care Med. 2017;45:381. doi: 10.1097/CCM.0000000000002257. [DOI] [PubMed] [Google Scholar]
- 18.Howell MD, Davis AM. Management of Sepsis and Septic Shock. JAMA. 2017;317:847. doi: 10.1001/jama.2017.0131. [DOI] [PubMed] [Google Scholar]
- 19.De Backer D, Dorman T. Surviving sepsis guidelines: A continuous move toward better care of patients with sepsis. JAMA. 2017;317:807. doi: 10.1001/jama.2017.0059. [DOI] [PubMed] [Google Scholar]
- 20.Dellinger RP, Levy MM, Rhodes A, Annane D, Gerlach H, Opal SM, Sevransky JE, Sprung CL, Douglas IS, Jaeschke R, Osborn TM, Nunnally ME, Townsend SR, Reinhart K, Kleinpell RM, Angus DC, Deutschman CS, Machado FR, Rubenfeld GD, Webb SA, Beale RJ, Vincent JL, Moreno R, Surviving Sepsis Campaign Guidelines Committee including the Pediatric Surviving sepsis campaign: international guidelines for management of severe sepsis and septic shock: 2012. Crit. Care Med. 2013;41:580–637. doi: 10.1097/CCM.0b013e31827e83af. [DOI] [PubMed] [Google Scholar]
- 21.Mouncey PR, Osborn TM, Power GS, Harrison DA, Sadique MZ, Grieve RD, Jahan R, Harvey SE, Bell D, Bion JF, Coats TJ, Singer M, Young JD, Rowan KM, Pro MTI. Trial of early, goal-directed resuscitation for septic shock. N. Engl. J. Med. 2015;372:1301–1311. doi: 10.1056/NEJMoa1500896. [DOI] [PubMed] [Google Scholar]
- 22.Peake SL, Delaney A, Bailey M, Bellomo R, Cameron PA, Cooper DJ, Higgins AM, Holdgate A, Howe BD, Webb SA, Williams P. Goal-directed resuscitation for patients with early septic shock. N. Engl. J. Med. 2014;371:1496–1506. doi: 10.1056/NEJMoa1404380. [DOI] [PubMed] [Google Scholar]
- 23.Yealy DM, Kellum JA, Huang DT, Barnato AE, Weissfeld LA, Pike F, Terndrup T, Wang HE, Hou PC, LoVecchio F, Filbin MR, Shapiro NI, Angus DC. A randomized trial of protocol-based care for early septic shock. N. Engl. J. Med. 2014;370:1683–1693. doi: 10.1056/NEJMoa1401602. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Allegranzi B, Bischoff P, de Jonge S, Kubilay NZ, Zayed B, Gomes SM, Abbas M, Atema JJ, Gans S, van Rijen M, Boermeester MA, Egger M, Kluytmans J, Pittet D, Solomkin JS, Group WHOGD New WHO recommendations on preoperative measures for surgical site infection prevention: An evidence-based global perspective. Lancet Infect Dis. 2016;16:e276–e287. doi: 10.1016/S1473-3099(16)30398-X. [DOI] [PubMed] [Google Scholar]
- 25.Allegranzi B, Zayed B, Bischoff P, Kubilay NZ, de Jonge S, de Vries F, Gomes SM, Gans S, Wallert ED, Wu X, Abbas M, Boermeester MA, Dellinger EP, Egger M, Gastmeier P, Guirao X, Ren J, Pittet D, Solomkin JS, Group WHOGD New WHO recommendations on intraoperative and postoperative measures for surgical site infection prevention: An evidence-based global perspective. Lancet Infect Dis. 2016;16:e288–e303. doi: 10.1016/S1473-3099(16)30402-9. [DOI] [PubMed] [Google Scholar]
- 26.Anderson DJ, Podgorny K, Berrios-Torres SI, Bratzler DW, Dellinger EP, Greene L, Nyquist AC, Saiman L, Yokoe DS, Maragakis LL, Kaye KS. Strategies to prevent surgical site infections in acute care hospitals: 2014 update. Infect Control Hosp Epidemiol. 2014;35:605–627. doi: 10.1086/676022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Pryor KO, Fahey TJ, 3rd, Lien CA, Goldstein PA. Surgical site infection and the routine use of perioperative hyperoxia in a general surgical population: A randomized controlled trial. JAMA. 2004;291:79–87. doi: 10.1001/jama.291.1.79. [DOI] [PubMed] [Google Scholar]
- 28.Meyhoff CS, Wetterslev J, Jorgensen LN, Henneberg SW, Hogdall C, Lundvall L, Svendsen PE, Mollerup H, Lunn TH, Simonsen I, Martinsen KR, Pulawska T, Bundgaard L, Bugge L, Hansen EG, Riber C, Gocht-Jensen P, Walker LR, Bendtsen A, Johansson G, Skovgaard N, Helto K, Poukinski A, Korshin A, Walli A, Bulut M, Carlsson PS, Rodt SA, Lundbech LB, Rask H, Buch N, Perdawid SK, Reza J, Jensen KV, Carlsen CG, Jensen FS, Rasmussen LS, Group PT Effect of high perioperative oxygen fraction on surgical site infection and pulmonary complications after abdominal surgery: The PROXI randomized clinical trial. JAMA. 2009;302:1543–1550. doi: 10.1001/jama.2009.1452. [DOI] [PubMed] [Google Scholar]
- 29.Meyhoff CS, Jorgensen LN, Wetterslev J, Christensen KB, Rasmussen LS, Group PT Increased long-term mortality after a high perioperative inspiratory oxygen fraction during abdominal surgery: Follow-up of a randomized clinical trial. Anesth. Analg. 2012;115:849–854. doi: 10.1213/ANE.0b013e3182652a51. [DOI] [PubMed] [Google Scholar]
- 30.Volk T, Peters J, Sessler DI. The WHO recommendation for 80 % perioperative oxygen is poorly justified. Anaesthesist. 2017;66:227. doi: 10.1007/s00101-017-0286-4. [DOI] [PubMed] [Google Scholar]
- 31.Abdul-Aziz MH, Sulaiman H, Mat-Nor MB, Rai V, Wong KK, Hasan MS, Abd Rahman AN, Jamal JA, Wallis SC, Lipman J, Staatz CE, Roberts JA. Beta-Lactam Infusion in Severe Sepsis (BLISS): A prospective, two-centre, open-labelled randomised controlled trial of continuous versus intermittent beta-lactam infusion in critically ill patients with severe sepsis. Intensive Care Med. 2016;42:1535. doi: 10.1007/s00134-015-4188-0. [DOI] [PubMed] [Google Scholar]
- 32.Dulhunty JM, Roberts JA, Davis JS, Webb SA, Bellomo R, Gomersall C, Shirwadkar C, Eastwood GM, Myburgh J, Paterson DL, Starr T, Paul SK, Lipman J, BIIft ACT. A multicenter randomized trial of continuous versus intermittent beta-Lactam infusion in severe sepsis. Am. J. Respir. Crit. Care Med. 2015;192:1298–1305. doi: 10.1164/rccm.201505-0857OC. [DOI] [PubMed] [Google Scholar]
- 33.Falagas ME, Tansarli GS, Ikawa K, Vardakas KZ. Clinical outcomes with extended or continuous versus short-term intravenous infusion of carbapenems and piperacillin/tazobactam: A systematic review and meta-analysis. Clin. Infect. Dis. 2013;56:272–282. doi: 10.1093/cid/cis857. [DOI] [PubMed] [Google Scholar]
- 34.Roberts JA, Abdul-Aziz MH, Davis JS, Dulhunty JM, Cotta MO, Myburgh J, Bellomo R, Lipman J. Continuous versus intermittent beta-Lactam infusion in severe sepsis. A meta-analysis of individual patient data from randomized trials. Am. J. Respir. Crit. Care Med. 2016;194:681–691. doi: 10.1164/rccm.201601-0024OC. [DOI] [PubMed] [Google Scholar]
- 35.Osthoff M, Siegemund M, Balestra G, Abdul-Aziz MH, Roberts JA. Prolonged administration of beta-lactam antibiotics – a comprehensive review and critical appraisal. Swiss Med Wkly. 2016;146:w14368. doi: 10.4414/smw.2016.14368. [DOI] [PubMed] [Google Scholar]
- 36.de Jong E, van Oers JA, Beishuizen A, Vos P, Vermeijden WJ, Haas LE, Loef BG, Dormans T, van Melsen GC, Kluiters YC, Kemperman H, van den Elsen MJ, Schouten JA, Streefkerk JO, Krabbe HG, Kieft H, Kluge GH, van Dam VC, van Pelt J, Bormans L, Otten MB, Reidinga AC, Endeman H, Twisk JW, van de Garde EM, de Smet AM, Kesecioglu J, Girbes AR, Nijsten MW, de Lange DW. Efficacy and safety of procalcitonin guidance in reducing the duration of antibiotic treatment in critically ill patients: a randomised, controlled, open-label trial. Lancet Infect Dis. 2016;16:819. doi: 10.1016/S1473-3099(16)00053-0. [DOI] [PubMed] [Google Scholar]
- 37.Bloos F, Trips E, Nierhaus A, Briegel J, Heyland DK, Jaschinski U, Moerer O, Weyland A, Marx G, Grundling M, Kluge S, Kaufmann I, Ott K, Quintel M, Jelschen F, Meybohm P, Rademacher S, Meier-Hellmann A, Utzolino S, Kaisers UX, Putensen C, Elke G, Ragaller M, Gerlach H, Ludewig K, Kiehntopf M, Bogatsch H, Engel C, Brunkhorst FM, Loeffler M, Reinhart K, for SepNet Critical Care Trials G Effect of sodium selenite administration and Procalcitonin-guided therapy on mortality in patients with severe sepsis or septic shock: A randomized clinical trial. JAMA Intern Med. 2016;176:1266–1276. doi: 10.1001/jamainternmed.2016.2514. [DOI] [PubMed] [Google Scholar]
- 38.Zangrillo A, Putzu A, Monaco F, Oriani A, Frau G, De Luca M, Di Tomasso N, Bignami E, Lomivorotov V, Likhvantsev V, Landoni G. Levosimendan reduces mortality in patients with severe sepsis and septic shock: A meta-analysis of randomized trials. J Crit Care. 2015;30:908–913. doi: 10.1016/j.jcrc.2015.05.017. [DOI] [PubMed] [Google Scholar]
- 39.Gordon AC, Perkins GD, Singer M, McAuley DF, Orme RM, Santhakumaran S, Mason AJ, Cross M, Al-Beidh F, Best-Lane J, Brealey D, Nutt CL, McNamee JJ, Reschreiter H, Breen A, Liu KD, Ashby D. Levosimendan for the prevention of acute organ dysfunction in sepsis. N. Engl. J. Med. 2016;375:1638–1648. doi: 10.1056/NEJMoa1609409. [DOI] [PubMed] [Google Scholar]
- 40.Keh D, Trips E, Marx G, Wirtz SP, Abduljawwad E, Bercker S, Bogatsch H, Briegel J, Engel C, Gerlach H, Goldmann A, Kuhn SO, Huter L, Meier-Hellmann A, Nierhaus A, Kluge S, Lehmke J, Loeffler M, Oppert M, Resener K, Schadler D, Schuerholz T, Simon P, Weiler N, Weyland A, Reinhart K, Brunkhorst FM, SepNet-Critical Care Trials G Effect of Hydrocortisone on development of shock among patients with severe sepsis: The HYPRESS randomized clinical trial. JAMA. 2016;316:1775–1785. doi: 10.1001/jama.2016.14799. [DOI] [PubMed] [Google Scholar]
- 41.Sprung CL, Annane D, Keh D, Moreno R, Singer M, Freivogel K, Weiss YG, Benbenishty J, Kalenka A, Forst H, Laterre PF, Reinhart K, Cuthbertson BH, Payen D, Briegel J, Group CS Hydrocortisone therapy for patients with septic shock. N. Engl. J. Med. 2008;358:111–124. doi: 10.1056/NEJMoa071366. [DOI] [PubMed] [Google Scholar]
- 42.Ashbaugh DG, Bigelow DB, Petty TL, Levine BE. Acute respiratory distress in adults. Lancet. 1967;2:319–323. doi: 10.1016/S0140-6736(67)90168-7. [DOI] [PubMed] [Google Scholar]
- 43.Bellani G, Laffey JG, Pham T, Fan E, Brochard L, Esteban A, Gattinoni L, van Haren F, Larsson A, McAuley DF, Ranieri M, Rubenfeld G, Thompson BT, Wrigge H, Slutsky AS, Pesenti A, Investigators LS, Group ET Epidemiology, patterns of care, and mortality for patients with acute respiratory distress syndrome in intensive care units in 50 countries. JAMA. 2016;315:788–800. doi: 10.1001/jama.2016.0291. [DOI] [PubMed] [Google Scholar]
- 44.Ranieri VM, Rubenfeld GD, Thompson BT, Ferguson ND, Caldwell E, Fan E, Camporota L, Slutsky AS. Acute respiratory distress syndrome: The Berlin Definition. JAMA. 2012;307:2526–2533. doi: 10.1001/jama.2012.5669. [DOI] [PubMed] [Google Scholar]
- 45.Laffey JG, Bellani G, Pham T, Fan E, Madotto F, Bajwa EK, Brochard L, Clarkson K, Esteban A, Gattinoni L, van Haren F, Heunks LM, Kurahashi K, Laake JH, Larsson A, McAuley DF, McNamee L, Nin N, Qiu H, Ranieri M, Rubenfeld GD, Thompson BT, Wrigge H, Slutsky AS, Pesenti A, Investigators LS, the ETG. Potentially modifiable factors contributing to outcome from acute respiratory distress syndrome: the LUNG SAFE study. Intensive Care Med. 2016;42:1865–1876. doi: 10.1007/s00134-016-4571-5. [DOI] [PubMed] [Google Scholar]
- 46.Bellani G, Laffey JG, Pham T, Madotto F, Fan E, Brochard L, Esteban A, Gattinoni L, Bumbasirevic V, Piquilloud L, van Haren F, Larsson A, McAuley DF, Bauer PR, Arabi YM, Ranieri M, Antonelli M, Rubenfeld GD, Thompson BT, Wrigge H, Slutsky AS, Pesenti A, Investigators LS, Group ET Noninvasive ventilation of patients with acute respiratory distress syndrome. Insights from the LUNG SAFE study. Am. J. Respir. Crit. Care Med. 2017;195:67–77. doi: 10.1164/rccm.201606-1306OC. [DOI] [PubMed] [Google Scholar]
- 47.Bein T, Grasso S, Moerer O, Quintel M, Guerin C, Deja M, Brondani A, Mehta S. The standard of care of patients with ARDS: Ventilatory settings and rescue therapies for refractory hypoxemia. Intensive Care Med. 2016;42:699–711. doi: 10.1007/s00134-016-4325-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Stub D, Smith K, Bernard S, Nehme Z, Stephenson M, Bray JE, Cameron P, Barger B, Ellims AH, Taylor AJ, Meredith IT, Kaye DM, Investigators A. Air Versus Oxygen in ST-Segment-Elevation Myocardial Infarction. Circulation. 2015;131:2143–2150. doi: 10.1161/CIRCULATIONAHA.114.014494. [DOI] [PubMed] [Google Scholar]
- 49.Girardis M, Busani S, Damiani E, Donati A, Rinaldi L, Marudi A, Morelli A, Antonelli M, Singer M. Effect of conservative vs conventional oxygen therapy on mortality among patients in an intensive care unit: The oxygen-ICU randomized clinical trial. JAMA. 2016;316:1583–1589. doi: 10.1001/jama.2016.11993. [DOI] [PubMed] [Google Scholar]
- 50.Frat JP, Thille AW, Mercat A, Girault C, Ragot S, Perbet S, Prat G, Boulain T, Morawiec E, Cottereau A, Devaquet J, Nseir S, Razazi K, Mira JP, Argaud L, Chakarian JC, Ricard JD, Wittebole X, Chevalier S, Herbland A, Fartoukh M, Constantin JM, Tonnelier JM, Pierrot M, Mathonnet A, Beduneau G, Deletage-Metreau C, Richard JC, Brochard L, Robert R, Group FS. Network R. High-flow oxygen through nasal cannula in acute hypoxemic respiratory failure. N. Engl. J. Med. 2015;372:2185–2196. doi: 10.1056/NEJMoa1503326. [DOI] [PubMed] [Google Scholar]
- 51.Hernandez G, Vaquero C, Gonzalez P, Subira C, Frutos-Vivar F, Rialp G, Laborda C, Colinas L, Cuena R, Fernandez R. Effect of Postextubation high-flow nasal cannula vs conventional oxygen therapy on Reintubation in low-risk patients: A randomized clinical trial. JAMA. 2016;315:1354. doi: 10.1001/jama.2016.2711. [DOI] [PubMed] [Google Scholar]
- 52.Reuss CJ, Bernhard M, Beynon C, Hofer S, Jungk C, Michalski D, Weigand MA, Brenner T. Intensive care studies from 2015/2016. Anaesthesist. 2016;65:532–552. doi: 10.1007/s00101-016-0188-x. [DOI] [PubMed] [Google Scholar]
- 53.Jaber S, Monnin M, Girard M, Conseil M, Cisse M, Carr J, Mahul M, Delay JM, Belafia F, Chanques G, Molinari N, De Jong A. Apnoeic oxygenation via high-flow nasal cannula oxygen combined with non-invasive ventilation preoxygenation for intubation in hypoxaemic patients in the intensive care unit: the single-centre, blinded, randomised controlled OPTINIV trial. Intensive Care Med. 2016;42:1877–1887. doi: 10.1007/s00134-016-4588-9. [DOI] [PubMed] [Google Scholar]
- 54.Hernandez G, Vaquero C, Colinas L, Cuena R, Gonzalez P, Canabal A, Sanchez S, Rodriguez ML, Villasclaras A, Fernandez R. Effect of Postextubation high-flow nasal cannula vs Noninvasive ventilation on Reintubation and Postextubation respiratory failure in high-risk patients: A randomized clinical trial. JAMA. 2016;316:1565–1574. doi: 10.1001/jama.2016.14194. [DOI] [PubMed] [Google Scholar]
- 55.Patel BK, Wolfe KS, Pohlman AS, Hall JB, Kress JP. Effect of Noninvasive ventilation delivered by helmet vs face mask on the rate of Endotracheal Intubation in patients with acute respiratory distress syndrome: A randomized clinical trial. JAMA. 2016;315:2435–2441. doi: 10.1001/jama.2016.6338. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 56.Hoste EA, Bagshaw SM, Bellomo R, Cely CM, Colman R, Cruz DN, Edipidis K, Forni LG, Gomersall CD, Govil D, Honore PM, Joannes-Boyau O, Joannidis M, Korhonen AM, Lavrentieva A, Mehta RL, Palevsky P, Roessler E, Ronco C, Uchino S, Vazquez JA, Andrade VE, Webb S, Kellum JA. Epidemiology of acute kidney injury in critically ill patients: The multinational AKI-EPI study. Intensive Care Med. 2015;41:1411–1423. doi: 10.1007/s00134-015-3934-7. [DOI] [PubMed] [Google Scholar]
- 57.Bellomo R, Ronco C, Kellum JA, Mehta RL, Palevsky P, Acute Dialysis Quality Initiative w Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: The second international consensus conference of the acute dialysis quality initiative (ADQI) group. Crit Care. 2004;8:R204–212. doi: 10.1186/cc2872. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 58.Khwaja A. KDIGO clinical practice guidelines for acute kidney injury. Nephron Clin Pract. 2012;120:c179–c184. doi: 10.1159/000339789. [DOI] [PubMed] [Google Scholar]
- 59.Izawa J, Uchino S, Takinami M. A detailed evaluation of the new acute kidney injury criteria by KDIGO in critically ill patients. J Anesth. 2016;30:215–222. doi: 10.1007/s00540-015-2109-6. [DOI] [PubMed] [Google Scholar]
- 60.Gaudry S, Hajage D, Schortgen F, Martin-Lefevre L, Pons B, Boulet E, Boyer A, Chevrel G, Lerolle N, Carpentier D, de Prost N, Lautrette A, Bretagnol A, Mayaux J, Nseir S, Megarbane B, Thirion M, Forel JM, Maizel J, Yonis H, Markowicz P, Thiery G, Tubach F, Ricard JD, Dreyfuss D, Group AS Initiation strategies for renal-replacement therapy in the intensive care unit. N. Engl. J. Med. 2016;375:122–133. doi: 10.1056/NEJMoa1603017. [DOI] [PubMed] [Google Scholar]
- 61.Zarbock A, Kellum JA, Schmidt C, Van Aken H, Wempe C, Pavenstadt H, Boanta A, Gerss J, Meersch M. Effect of early vs delayed initiation of renal replacement therapy on mortality in critically ill patients with acute kidney injury: The ELAIN randomized clinical trial. JAMA. 2016;315:2190–2199. doi: 10.1001/jama.2016.5828. [DOI] [PubMed] [Google Scholar]
- 62.Zhang L, Chen Z, Diao Y, Yang Y, Fu P. Associations of fluid overload with mortality and kidney recovery in patients with acute kidney injury: A systematic review and meta-analysis. J Crit Care. 2015;30:e867–813. doi: 10.1016/j.jcrc.2015.03.025. [DOI] [PubMed] [Google Scholar]
- 63.Kimmel M, Shi J, Latus J, Wasser C, Kitterer D, Braun N, Alscher MD. Association of renal stress/damage and filtration Biomarkers with subsequent AKI during hospitalization among patients presenting to the emergency department. Clin J Am Soc Nephrol. 2016;11:938–946. doi: 10.2215/CJN.10551015. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 64.Banares R, Nevens F, Larsen FS, Jalan R, Albillos A, Dollinger M, Saliba F, Sauerbruch T, Klammt S, Ockenga J, Pares A, Wendon J, Brunnler T, Kramer L, Mathurin P, de la Mata M, Gasbarrini A, Mullhaupt B, Wilmer A, Laleman W, Eefsen M, Sen S, Zipprich A, Tenorio T, Pavesi M, Schmidt HH, Mitzner S, Williams R, Arroyo V, group Rs Extracorporeal albumin dialysis with the molecular adsorbent recirculating system in acute-on-chronic liver failure: The RELIEF trial. Hepatology. 2013;57:1153–1162. doi: 10.1002/hep.26185. [DOI] [PubMed] [Google Scholar]
- 65.Kribben A, Gerken G, Haag S, Herget-Rosenthal S, Treichel U, Betz C, Sarrazin C, Hoste E, Van Vlierberghe H, Escorsell A, Hafer C, Schreiner O, Galle PR, Mancini E, Caraceni P, Karvellas CJ, Salmhofer H, Knotek M, Gines P, Kozik-Jaromin J, Rifai K, Group HS Effects of fractionated plasma separation and adsorption on survival in patients with acute-on-chronic liver failure. Gastroenterology. 2012;142:782–789. doi: 10.1053/j.gastro.2011.12.056. [DOI] [PubMed] [Google Scholar]
- 66.Larsen FS, Schmidt LE, Bernsmeier C, Rasmussen A, Isoniemi H, Patel VC, Triantafyllou E, Bernal W, Auzinger G, Shawcross D, Eefsen M, Bjerring PN, Clemmesen JO, Hockerstedt K, Frederiksen HJ, Hansen BA, Antoniades CG, Wendon J. High-volume plasma exchange in patients with acute liver failure: An open randomised controlled trial. J. Hepatol. 2016;64:69–78. doi: 10.1016/j.jhep.2015.08.018. [DOI] [PubMed] [Google Scholar]
- 67.Ferenci P, Lockwood A, Mullen K, Tarter R, Weissenborn K, Blei AT. Hepatic encephalopathy – definition, nomenclature, diagnosis, and quantification: final report of the working party at the 11th World Congresses of Gastroenterology, Vienna, 1998. Hepatology. 2002;35:716–721. doi: 10.1053/jhep.2002.31250. [DOI] [PubMed] [Google Scholar]
- 68.Dalton JE, Kurz A, Turan A, Mascha EJ, Sessler DI, Saager L. Development and validation of a risk quantification index for 30-day postoperative mortality and morbidity in noncardiac surgical patients. Anesthesiology. 2011;114:1336–1344. doi: 10.1097/ALN.0b013e318219d5f9. [DOI] [PubMed] [Google Scholar]
- 69.Morris PE, Goad A, Thompson C, Taylor K, Harry B, Passmore L, Ross A, Anderson L, Baker S, Sanchez M, Penley L, Howard A, Dixon L, Leach S, Small R, Hite RD, Haponik E. Early intensive care unit mobility therapy in the treatment of acute respiratory failure. Crit. Care Med. 2008;36:2238–2243. doi: 10.1097/CCM.0b013e318180b90e. [DOI] [PubMed] [Google Scholar]
- 70.Needham DM, Korupolu R, Zanni JM, Pradhan P, Colantuoni E, Palmer JB, Brower RG, Fan E. Early physical medicine and rehabilitation for patients with acute respiratory failure: A quality improvement project. Arch Phys Med Rehabil. 2010;91:536–542. doi: 10.1016/j.apmr.2010.01.002. [DOI] [PubMed] [Google Scholar]
- 71.Bein T, Bischoff M, Bruckner U, Gebhardt K, Henzler D, Hermes C, Lewandowski K, Max M, Nothacker M, Staudinger T, Tryba M, Weber-Carstens S, Wrigge H. S2e guideline: positioning and early mobilisation in prophylaxis or therapy of pulmonary disorders : Revision 2015: S2e guideline of the German Society of Anaesthesiology and Intensive Care Medicine (DGAI) Anaesthesist. 2015;64(Suppl 1):1–26. doi: 10.1007/s00101-015-0071-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 72.Schaller SJ, Anstey M, Blobner M, Edrich T, Grabitz SD, Gradwohl-Matis I, Heim M, Houle T, Kurth T, Latronico N, Lee J, Meyer MJ, Peponis T, Talmor D, Velmahos GC, Waak K, Walz JM, Zafonte R, Eikermann M, International Early S‑gMRI Early, goal-directed mobilisation in the surgical intensive care unit: A randomised controlled trial. Lancet. 2016;388:1377–1388. doi: 10.1016/S0140-6736(16)31637-3. [DOI] [PubMed] [Google Scholar]
- 73.Kasotakis G, Schmidt U, Perry D, Grosse-Sundrup M, Benjamin J, Ryan C, Tully S, Hirschberg R, Waak K, Velmahos G, Bittner EA, Zafonte R, Cobb JP, Eikermann M. The surgical intensive care unit optimal mobility score predicts mortality and length of stay. Crit. Care Med. 2012;40:1122–1128. doi: 10.1097/CCM.0b013e3182376e6d. [DOI] [PubMed] [Google Scholar]
- 74.Piva S, Dora G, Minelli C, Michelini M, Turla F, Mazza S, D’Ottavi P, Moreno-Duarte I, Sottini C, Eikermann M, Latronico N. The surgical optimal mobility score predicts mortality and length of stay in an italian population of medical, surgical, and neurologic intensive care unit patients. J Crit Care. 2015;30:1251–1257. doi: 10.1016/j.jcrc.2015.08.002. [DOI] [PubMed] [Google Scholar]
- 75.Schaller SJ, Stauble CG, Suemasa M, Heim M, Duarte IM, Mensch O, Bogdanski R, Lewald H, Eikermann M, Blobner M. The German validation study of the surgical intensive care unit optimal mobility score. J Crit Care. 2016;32:201–206. doi: 10.1016/j.jcrc.2015.12.020. [DOI] [PubMed] [Google Scholar]
- 76.Meyer MJ, Stanislaus AB, Lee J, Waak K, Ryan C, Saxena R, Ball S, Schmidt U, Poon T, Piva S, Walz M, Talmor DS, Blobner M, Latronico N, Eikermann M. Surgical Intensive Care Unit Optimal Mobilisation Score (SOMS) trial: A protocol for an international, multicentre, randomised controlled trial focused on goal-directed early mobilisation of surgical ICU patients. BMJ Open. 2013;3:e003262. doi: 10.1136/bmjopen-2013-003262. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 77.Juttler E, Unterberg A, Woitzik J, Bosel J, Amiri H, Sakowitz OW, Gondan M, Schiller P, Limprecht R, Luntz S, Schneider H, Pinzer T, Hobohm C, Meixensberger J, Hacke W, Investigators DI. Hemicraniectomy in older patients with extensive middle-cerebral-artery stroke. N. Engl. J. Med. 2014;370:1091–1100. doi: 10.1056/NEJMoa1311367. [DOI] [PubMed] [Google Scholar]
- 78.Hutchinson PJ, Kolias AG, Timofeev IS, Corteen EA, Czosnyka M, Timothy J, Anderson I, Bulters DO, Belli A, Eynon CA, Wadley J, Mendelow AD, Mitchell PM, Wilson MH, Critchley G, Sahuquillo J, Unterberg A, Servadei F, Teasdale GM, Pickard JD, Menon DK, Murray GD, Kirkpatrick PJ, Collaborators RET. Trial of decompressive Craniectomy for traumatic Intracranial hypertension. N. Engl. J. Med. 2016;375:1119–1130. doi: 10.1056/NEJMoa1605215. [DOI] [PubMed] [Google Scholar]
- 79.Cooper DJ, Rosenfeld JV, Murray L, Arabi YM, Davies AR, D’Urso P, Kossmann T, Ponsford J, Seppelt I, Reilly P, Wolfe R, Investigators DT, Australian, New Zealand Intensive Care Society Clinical Trials G Decompressive craniectomy in diffuse traumatic brain injury. N. Engl. J. Med. 2011;364:1493–1502. doi: 10.1056/NEJMoa1102077. [DOI] [PubMed] [Google Scholar]
- 80.Antithrombotic Trialists C. Baigent C, Blackwell L, Collins R, Emberson J, Godwin J, Peto R, Buring J, Hennekens C, Kearney P, Meade T, Patrono C, Roncaglioni MC, Zanchetti A. Aspirin in the primary and secondary prevention of vascular disease: Collaborative meta-analysis of individual participant data from randomised trials. Lancet. 2009;373:1849–1860. doi: 10.1016/S0140-6736(09)60503-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 81.Naidech AM, Jovanovic B, Liebling S, Garg RK, Bassin SL, Bendok BR, Bernstein RA, Alberts MJ, Batjer HH. Reduced platelet activity is associated with early clot growth and worse 3‑month outcome after intracerebral hemorrhage. Stroke. 2009;40:2398–2401. doi: 10.1161/STROKEAHA.109.550939. [DOI] [PubMed] [Google Scholar]
- 82.Baharoglu MI, Cordonnier C, Al-Shahi Salman R, de Gans K, Koopman MM, Brand A, Majoie CB, Beenen LF, Marquering HA, Vermeulen M, Nederkoorn PJ, de Haan RJ, Roos YB, Investigators P. Platelet transfusion versus standard care after acute stroke due to spontaneous cerebral haemorrhage associated with antiplatelet therapy (PATCH): a randomised, open-label, phase 3 trial. Lancet. 2016;387:2605–2613. doi: 10.1016/S0140-6736(16)30392-0. [DOI] [PubMed] [Google Scholar]
- 83.Batchelor JS, Grayson A. A meta-analysis to determine the effect on survival of platelet transfusions in patients with either spontaneous or traumatic antiplatelet medication-associated intracranial haemorrhage. BMJ Open. 2012;2:e000588. doi: 10.1136/bmjopen-2011-000588. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 84.Hansen BM, Morgan TC, Betz JF, Sundgren PC, Norrving B, Hanley DF, Lindgren A. Intraventricular extension of supratentorial Intracerebral hemorrhage: The modified Graeb scale improves outcome prediction in Lund stroke register. Neuroepidemiology. 2016;46:43–50. doi: 10.1159/000442575. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 85.Naff N, Williams MA, Keyl PM, Tuhrim S, Bullock MR, Mayer SA, Coplin W, Narayan R, Haines S, Cruz-Flores S, Zuccarello M, Brock D, Awad I, Ziai WC, Marmarou A, Rhoney D, McBee N, Lane K, Hanley DF., Jr. Low-dose recombinant tissue-type plasminogen activator enhances clot resolution in brain hemorrhage: The intraventricular hemorrhage thrombolysis trial. Stroke. 2011;42:3009–3016. doi: 10.1161/STROKEAHA.110.610949. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 86.Hanley DF, Lane K, McBee N, Ziai W, Tuhrim S, Lees KR, Dawson J, Gandhi D, Ullman N, Mould WA, Mayo SW, Mendelow AD, Gregson B, Butcher K, Vespa P, Wright DW, Kase CS, Carhuapoma JR, Keyl PM, Diener-West M, Muschelli J, Betz JF, Thompson CB, Sugar EA, Yenokyan G, Janis S, John S, Harnof S, Lopez GA, Aldrich EF, Harrigan MR, Ansari S, Jallo J, Caron JL, LeDoux D, Adeoye O, Zuccarello M, Adams HP, Jr., Rosenblum M, Thompson RE, Awad IA, Investigators CI. Thrombolytic removal of intraventricular haemorrhage in treatment of severe stroke: Results of the randomised, multicentre, multiregion, placebo-controlled CLEAR III trial. Lancet. 2017;389:603–611. doi: 10.1016/S0140-6736(16)32410-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 87.Steiner T, Poli S, Griebe M, Husing J, Hajda J, Freiberger A, Bendszus M, Bosel J, Christensen H, Dohmen C, Hennerici M, Kollmer J, Stetefeld H, Wartenberg KE, Weimar C, Hacke W, Veltkamp R. Fresh frozen plasma versus prothrombin complex concentrate in patients with intracranial haemorrhage related to vitamin K antagonists (INCH): A randomised trial. Lancet Neurol. 2016;15:566–573. doi: 10.1016/S1474-4422(16)00110-1. [DOI] [PubMed] [Google Scholar]
- 88.Anderson CS, Heeley E, Huang Y, Wang J, Stapf C, Delcourt C, Lindley R, Robinson T, Lavados P, Neal B, Hata J, Arima H, Parsons M, Li Y, Wang J, Heritier S, Li Q, Woodward M, Simes RJ, Davis SM, Chalmers J, Investigators I. Rapid blood-pressure lowering in patients with acute intracerebral hemorrhage. N. Engl. J. Med. 2013;368:2355–2365. doi: 10.1056/NEJMoa1214609. [DOI] [PubMed] [Google Scholar]
- 89.Qureshi AI, Palesch YY, Martin R, Novitzke J, Cruz-Flores S, Ehtisham A, Ezzeddine MA, Goldstein JN, Hussein HM, Suri MF, Tariq N, Antihypertensive Treatment of Acute Cerebral Hemorrhage Study I Effect of systolic blood pressure reduction on hematoma expansion, perihematomal edema, and 3‑month outcome among patients with intracerebral hemorrhage: Results from the antihypertensive treatment of acute cerebral hemorrhage study. Arch. Neurol. 2010;67:570–576. doi: 10.1001/archneurol.2010.61. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 90.Qureshi AI, Palesch YY, Barsan WG, Hanley DF, Hsu CY, Martin RL, Moy CS, Silbergleit R, Steiner T, Suarez JI, Toyoda K, Wang Y, Yamamoto H, Yoon BW, Investigators A-T, the Neurological Emergency Treatment Trials N Intensive blood-pressure lowering in patients with acute cerebral hemorrhage. N. Engl. J. Med. 2016;375:1033–1043. doi: 10.1056/NEJMoa1603460. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 91.Pfister HW, Bühler R, Eiffert H, Grabein B, Klein M, Linn J, Nau R, Salzberger B, Tumani H, Weber JR. S2k-Leitlinie Ambulant erworbene bakterielle (eitrige) Meningoenzephalitis im Erwachsenenalter. Leitlinien für Diagnostik und Therapie in der Neurologie. 2015. [Google Scholar]
- 92.Brouwer MC, McIntyre P, Prasad K, van de Beek D. Corticosteroids for acute bacterial meningitis. Cochrane Database Syst Rev. 2015 doi: 10.1002/14651858.CD004405.pub5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 93.Martinez-Torres F, Menon S, Pritsch M, Victor N, Jenetzky E, Jensen K, Schielke E, Schmutzhard E, de Gans J, Chung CH, Luntz S, Hacke W, Meyding-Lamade U, Investigators G. Protocol for German trial of Acyclovir and corticosteroids in Herpes-simplex-virus-encephalitis (GACHE): a multicenter, multinational, randomized, double-blind, placebo-controlled German, Austrian and Dutch trial [ISRCTN45122933. BMC Neurol. 2008;8:40. doi: 10.1186/1471-2377-8-40. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 94.Ramos-Estebanez C, Lizarraga KJ, Merenda A. A systematic review on the role of adjunctive corticosteroids in herpes simplex virus encephalitis: Is timing critical for safety and efficacy? Antivir. Ther. (Lond.) 2014;19:133–139. doi: 10.3851/IMP2683. [DOI] [PubMed] [Google Scholar]
- 95.Beardsley J, Wolbers M, Kibengo FM, Ggayi AB, Kamali A, Cuc NT, Binh TQ, Chau NV, Farrar J, Merson L, Phuong L, Thwaites G, Van Kinh N, Thuy PT, Chierakul W, Siriboon S, Thiansukhon E, Onsanit S, Supphamongkholchaikul W, Chan AK, Heyderman R, Mwinjiwa E, van Oosterhout JJ, Imran D, Basri H, Mayxay M, Dance D, Phimmasone P, Rattanavong S, Lalloo DG, Day JN, CryptoDex I. Adjunctive Dexamethasone in HIV-associated Cryptococcal meningitis. N. Engl. J. Med. 2016;374:542–554. doi: 10.1056/NEJMoa1509024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 96.Bernard SA, Gray TW, Buist MD, Jones BM, Silvester W, Gutteridge G, Smith K. Treatment of comatose survivors of out-of-hospital cardiac arrest with induced hypothermia. N. Engl. J. Med. 2002;346:557–563. doi: 10.1056/NEJMoa003289. [DOI] [PubMed] [Google Scholar]
- 97.Arrich J, Holzer M, Havel C, Mullner M, Herkner H. Hypothermia for neuroprotection in adults after cardiopulmonary resuscitation. Cochrane Database Syst Rev. 2016;2:CD004128. doi: 10.1002/14651858.CD004128.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 98.van der Worp HB, Macleod MR, Bath PM, Demotes J, Durand-Zaleski I, Gebhardt B, Gluud C, Kollmar R, Krieger DW, Lees KR, Molina C, Montaner J, Roine RO, Petersson J, Staykov D, Szabo I, Wardlaw JM, Schwab S, Euro HYPi EuroHYP-1: European multicenter, randomized, phase III clinical trial of therapeutic hypothermia plus best medical treatment vs. best medical treatment alone for acute ischemic stroke. Int J Stroke. 2014;9:642–645. doi: 10.1111/ijs.12294. [DOI] [PubMed] [Google Scholar]
- 99.Mourvillier B, Tubach F, van de Beek D, Garot D, Pichon N, Georges H, Lefevre LM, Bollaert PE, Boulain T, Luis D, Cariou A, Girardie P, Chelha R, Megarbane B, Delahaye A, Chalumeau-Lemoine L, Legriel S, Beuret P, Brivet F, Bruel C, Camou F, Chatellier D, Chillet P, Clair B, Constantin JM, Duguet A, Galliot R, Bayle F, Hyvernat H, Ouchenir K, Plantefeve G, Quenot JP, Richecoeur J, Schwebel C, Sirodot M, Esposito-Farese M, Le Tulzo Y, Wolff M. Induced hypothermia in severe bacterial meningitis: a randomized clinical trial. JAMA. 2013;310:2174–2183. doi: 10.1001/jama.2013.280506. [DOI] [PubMed] [Google Scholar]
- 100.Legriel S, Lemiale V, Schenck M, Chelly J, Laurent V, Daviaud F, Srairi M, Hamdi A, Geri G, Rossignol T, Hilly-Ginoux J, Boisrame-Helms J, Louart B, Malissin I, Mongardon N, Planquette B, Thirion M, Merceron S, Canet E, Pico F, Tran-Dinh YR, Bedos JP, Azoulay E, Resche-Rigon M, Cariou A, Group HS Hypothermia for Neuroprotection in convulsive status Epilepticus. N. Engl. J. Med. 2016;375:2457–2467. doi: 10.1056/NEJMoa1608193. [DOI] [PubMed] [Google Scholar]
- 101.Rosenow F, Besser R, Hamer HM, Holtkamp M, Kluge S, Knake S, Rossetti A, Schneider D, Trinka E. S2k-Leitlinie Status epilepticus im Erwachsenenalter. Leitlinien für Diagnostik und Therapie in der Neurologie. 2012. [Google Scholar]
- 102.Goyal M, Menon BK, van Zwam WH, Dippel DW, Mitchell PJ, Demchuk AM, Davalos A, Majoie CB, van der Lugt A, de Miquel MA, Donnan GA, Roos YB, Bonafe A, Jahan R, Diener HC, van den Berg LA, Levy EI, Berkhemer OA, Pereira VM, Rempel J, Millan M, Davis SM, Roy D, Thornton J, Roman LS, Ribo M, Beumer D, Stouch B, Brown S, Campbell BC, van Oostenbrugge RJ, Saver JL, Hill MD, Jovin TG, collaborators H. Endovascular thrombectomy after large-vessel ischaemic stroke: A meta-analysis of individual patient data from five randomised trials. Lancet. 2016;387:1723–1731. doi: 10.1016/S0140-6736(16)00163-X. [DOI] [PubMed] [Google Scholar]
- 103.Ringleb PA, Veltkamp R, Hamann GF, Röther J, Jansen O, Groden C. S2k-Leitlinie Akuttherapie des ischämischen Schlaganfalls – Ergänzung 2015; Rekanalisierende Therapie. Leitlinien für Diagnostik und Therapie in der Neurologie. 2015. [Google Scholar]
- 104.van den Berg LA, Koelman DL, Berkhemer OA, Rozeman AD, Fransen PS, Beumer D, Dippel DW, van der Lugt A, van Oostenbrugge RJ, van Zwam WH, Brouwer PA, Jenniskens S, Boiten J, Lycklama ANGA, Vos JA, Schonewille WJ, Majoie CB, Roos YB, group MCps, Participating c Type of anesthesia and differences in clinical outcome after intra-arterial treatment for ischemic stroke. Stroke. 2015;46:1257–1262. doi: 10.1161/STROKEAHA.115.008699. [DOI] [PubMed] [Google Scholar]
- 105.Schonenberger S, Uhlmann L, Hacke W, Schieber S, Mundiyanapurath S, Purrucker JC, Nagel S, Klose C, Pfaff J, Bendszus M, Ringleb PA, Kieser M, Mohlenbruch MA, Bosel J. Effect of conscious sedation vs general anesthesia on early neurological improvement among patients with Ischemic stroke undergoing Endovascular Thrombectomy: A randomized clinical trial. JAMA. 2016;316:1986–1996. doi: 10.1001/jama.2016.16623. [DOI] [PubMed] [Google Scholar]


