Zusammenfassung
Milchglasinfiltrate sind definiert als Dichteanhebungen des Lungenparenchyms, durch die Gefäße und Bronchialwände noch abgrenzbar sind. Sie werden durch intraalveoläre oder interstitielle Prozesse hervorgerufen, bei denen die Luft nur partiell aus dem Lungenparenchym verdrängt wird. Ätiologisch kommen die verschiedensten Ursachen in Frage; von Ödem über alveoläre und interstitielle Pneumonien durch verschiedene Erreger, nichtinfektiöse Pneumonitiden bis zu Tumormanifestationen. Auch physiologische Prozesse wie lageabhängige Belüftungsstörungen und Exspirationseffekte stellen sich als Milchglasinfiltrate dar.
In dieser Übersicht werden die Physiologie und Pathophysiologie erläutert, die Milchglasinfiltraten zugrunde liegen, verschiedene Beispiele häufiger Entitäten vorgestellt, die mit Milchglasinfiltraten einhergehen, und es wird dargestellt, wie die bildgebende Darstellung von Milchglasinfiltraten diagnostisch und differenzialdiagnostisch genutzt werden kann.
Schlüsselwörter: Milchglastrübung, Milchglasinfiltrat, Lungenparenchym, Nichtsolide Rundherde, Alveolitis
Abstract
Ground glass opacity (GGO) is defined as diffuse pulmonary infiltration which does not obscure vessels and bronchial walls and is due to intra-alveolar or interstitial processes of pulmonary parenchyma which only partially replace air. The etiology is variable including edema, airspace and interstitial pneumonia due to different organisms, non-infectious pneumonitis as well as tumor manifestations. Physiological processes, such as poor ventilation of dependent lung areas and effects of expiration can also present as ground glass opacity.
This review describes the physiology and pathophysiology of GGO, illustrates different examples of common diseases presenting with GGO and reviews how GGO may be used for diagnosis and differential diagnosis of pulmonary disease.
Keywords: Ground glass opacity, Ground glass infiltrate, Lung parenchyma, Non-solid nodules, Alveolitis
Mini-Kurs HRCT der Lunge.
Diese Übersicht setzt die Fortbildungsartikel der Reihe „Mini-Kurs HRCT der Lunge“ fort und baut auf den vorangehenden Beiträgen auf:
Definition Milchglas
Unter Milchglastrübung („ground glass opacity“, GGO) versteht man Verdichtungen des Lungenparenchyms, die aufgrund ihrer im Vergleich zu Gefäßen oder Bronchialwänden geringeren Absorption von Röntgenstrahlen nicht zu deren Maskierung führen [2]. Demgegenüber werden dichtere Veränderungen, in denen Gefäße und Bronchuswände nicht mehr abgrenzbar sind, als Konsolidierungen („consolidation“) bezeichnet.
Milchglastrübung
Konsolidierungen
Der Begriff „Milchglasinfiltrat“ bezieht sich dabei auf diffuse Veränderungen, die oft entzündliche Prozesse widerspiegeln. Milchglasartige fokale Läsionen, deren Ätiologie meist im neoplastischen oder inflammatorischen Formenkreis liegt, werden dagegen als nichtsolide Rundherde oder Milchglasknoten („non-solid nodules“ oder „ground glass nodules“) bezeichnet. Sind fokale Läsionen teils milchglasartig und teils weichteildicht, werden sie als teilsolide Rundherde („part-solid nodules“) bezeichnet. Der Begriff „Milchglasinfiltrat“ ist für Befunde in der MRT unüblich.
„Milchglasinfiltrat“
Nichtsolide Rundherde
Milchglasknoten
Teilsolide Rundherde
Mikropathologie von Milchglasinfiltraten
Wird die Luft im Lungenparenchym komplett verdrängt, erscheint das betroffene Lungenareal weichteildicht
Wird die Luft im Lungenparenchym komplett verdrängt, entweder durch raumforderndes neoplastisches Wachstum (weichteildichter Rundherd, „solid nodule“) oder durch eine komplette Ausfüllung der Alveolen durch entzündliches Sekret (Pneumonie, Pneumonitis), Blut (Hämorrhagie), Tumorzellen (bronchioloalveoläres Karzinom) oder Transsudat (alveoläres Lungeödem), erscheint das betroffene Lungenareal weichteildicht. Allenfalls sind lufthaltige Bronchiallumina als so genanntes Luftbronchogramm (Synonyme: Pneumobronchogramm, Air-Bronchogramm; bei fokalen Herden: Zeichen des offenen Bronchus, „open bronchus sign“ oder „bubble lucencies“) innerhalb der Verdichtung abgrenzbar.
Wenn die Luft inkomplett verdrängt wird, trägt sie zur durchschnittlichen Dichte des betroffenen Areals bei
Wenn jedoch die Luft inkomplett verdrängt wird, trägt sie im Rahmen von Teilvolumeneffekten („partial volume effects“) zur durchschnittlichen Dichte des betroffenen Areals bei, das damit zwar dichter als normale Lunge erscheint, jedoch weniger dicht als die Weichteilstrukturen (Gefäße, Bronchuswände). Dabei ist auch unter Verwendung dünnster Schichtdicken (<1 mm) und hoch auflösender Rekonstruktionsalgorithmen
Die Ortsauflösung der CT ist nicht ausreichend, um Alveolarwände und Alveolarräume zu differenzieren
die Ortsauflösung der CT nicht ausreichend, um Alveolarwände und Alveolarräume zu differenzieren. Daher lässt sich aus dem Vorliegen von Milchglasinfiltraten auch nicht ableiten, ob die Pathologie intraalveolär oder interstitiell lokalisiert ist.
Luftbronchogramm
Abb. 1 zeigt schematisch die Mikromorphologie von Normalbefund und von durch intraalveoläre bzw. interstitielle Strukturvermehrung sowie durch partiellen Alveolarkollaps bedingten Milchglasinfiltraten (Abb. 1a,b,c,d).

Untersuchungstechnik
Milchglasartige Dichteänderungen sind in Projektionsaufnahmen des Thorax nur schwer erkennbar
Milchglasartige Dichteänderungen sind aufgrund von Überlagerungseffekten und Belichtungsunterschieden in Projektionsaufnahmen des Thorax (Röntgenthoraxübersichtsaufnahmen) nur schwer erkennbar. Am ehesten sind sie nachweisbar, wenn sie fokal auftreten und dadurch von der normalen Lunge abgrenzbar werden. In der CT sind sie bei geeigneter Fenstereinstellung (s. u.) empfindlich nachweisbar. Je nach Verteilung und Größe können sie in Dünnschicht-CT-Untersuchungen („high-resolution computed tomography“, HRCT) aufgrund der hier optimalen Ortsauflösung, aber auch bei ausreichender Größe in einer CT mit höheren Schichtdicken gut dargestellt werden.
In der MRT sind radiologisch milchglasartige Veränderungen dann gut detektierbar, wenn Flüssigkeit oder Zellen mit ihrem hohen Protonengehalt zur Bildgebung beitragen
In der MRT sind radiologisch milchglasartige Veränderungen dann gut detektierbar, wenn Flüssigkeit oder Zellen mit ihrem hohen Protonengehalt zur Bildgebung beitragen. Zell- und flüssigkeitsarme fibrotische Veränderungen können dagegen weniger deutlich nachweisbar sein.
Fenstereinstellungen im CT
Fensterweite
Die Fensterweite („window width“, WW; Abb. 2 a,b,c)
Die Fensterweite sollte für die Beurteilung von computertomographischen Untersuchungen immer identisch gewählt werden
sollte prinzipiell für die Beurteilung von Thorax-CTs wie auch bei der Befundung von anderen computertomographischen Untersuchungen immer identisch gewählt werden (s. u.). Üblich sind je nach Institution Werte von 1400 bis 1600 Hounsfield-Einheiten (HE).
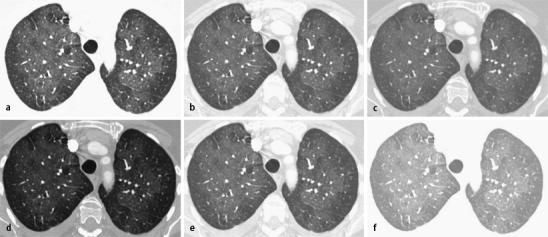
Da die Weichteilkontraste bei Vergrößerung der Fensterweite auf z. B. 1800 HE oder 2000 HE abnehmen und bei Verringerung auf z. B. 1000 oder 1200 HE zunehmen, kann es im Einzelfall sinnvoll sein, zusätzlich zur Standard-Fenstereinstellung eine engere Weite zu verwenden, um geringe Dichteunterschiede im Sinne von Milchglasinfiltraten zu erkennen.
Fensterlage
Die Fensterlage („window level“, WL; Abb. 2 d,e,f)
Die Fensterlage sollte grundsätzlich in dem Bereich gewählt werden, in dem die zu beurteilenden Veränderungen liegen
sollte grundsätzlich in dem Bereich gewählt werden, in dem die zu beurteilenden Veränderungen liegen. Da die Dichte des Lungenparenchyms zwischen etwa -950 (Emphysem) und der Dichte von Weichteilen (0 HE bis >300 HE; Konsolidierung, Tumoren bei Kontrastmitteluntersuchungen) liegt, empfiehlt sich eine Fensterlage von ca. -500 bis -600 HE. Niedrige Fensterlagen (z. B. -800 HE) sind wenig nützlich, positivere Fensterlagen (z. B. -300 HE) können in Verbindung mit weiten Fensterweiten (z. B. 2000 HE) zur Beurteilung der Pleura und des Subpleuralraums hilfreich sein, sind aber für die Beurteilung des Lungenparenchyms selten vorteilhaft.
Zur Befundung bei Verdacht auf Milchglasinfiltrate empfiehlt sich ein Standardfenster (z. B. 1500 HE, -600 HE), das ggf. durch engere Fensterweiten (z. B. 1000 HE) ergänzt wird
Zur Befundung bei Verdacht auf Milchglasinfiltrate empfiehlt sich somit ein Standardfenster (von z. B. 1500 HE, -600 HE), das ggf. durch zusätzliche engere Fensterweiten (z. B. 1000 HE) ergänzt wird.
Tipps
Nicht zuletzt zur zuverlässigen Erkennung von geringen Dichteunterschieden bei Milchglasinfiltraten, aber auch emphysematösen Veränderungen empfiehlt es sich, in der Befundung von Thorax-CTs im Lungenfenster grundsätzlich mit identischen Fenstereinstellungen zu arbeiten. Nur so kann sich ein Engramm bilden, welche Dichte des Lungenparenchyms normal ist.
Bei ganz diffusen Dichteanhebungen kann die Beachtung des Dichteunterschieds zu sicher ausschließlich lufthaltigen Strukturen wie Tracheal- oder Bronchuslumen hilfreich sein. Wenn das lufthaltige Lumen eine auffällig große Dichtedifferenz zum Lungenparenchym aufweist, also besonders schwarz wirkt („black bronchus sign“), kann dies als Indiz verwendet werden, dass die Dichte des Lungenparenchyms erhöht ist (Abb. 3 a, b).

Klinische Relevanz von Milchglasinfiltraten
Physiologische milchglasartige Veränderungen
Nicht jeder milchglasartigen Verdichtung des Lungenparenchyms liegt ein krankhafter Prozess zugrunde
Nicht jeder milchglasartigen Verdichtung des Lungenparenchyms liegt ein krankhafter Prozess zugrunde.
Exspiration
Die Lunge erscheint nur bei guter Entfaltung durch Aufnahmen in tiefer Inspiration in der CT gleichmäßig transparent
Die Lunge erscheint nur bei guter Entfaltung durch Aufnahmen in tiefer Inspiration in der CT gleichmäßig transparent. In Exspiration findet sich dagegen physiologischerweise ein Dichtegradient innerhalb jedes einzelnen Lungenlappens von normaler Transparenz ventral zu milchglasartigen Verdichtungen dorsal. Diese Verdichtungen dürfen nicht mit pathologischen Milchglasinfiltraten verwechselt werden.
Ein Hinweiszeichen auf eine Aufnahme in Exspiration kann die Form der Trachea sein
Ein Hinweiszeichen auf die Notwendigkeit der Anfertigung einer Aufnahme in Exspiration kann die Form der Trachea sein: Die Pars membranacea, die die Trachealhinterwand bildet, ist in Inspiration konvex vorgewölbt. In Exspiration begradigt sie sich dagegen oder wölbt sich als konkave Struktur in das Tracheallumen ein (Abb. 4b).

Belüftungsstörungen
Bereits nach wenigen Minuten führt die liegende Position des Patienten zu einem Volumenverlust des lufthaltigen Lungenparenchyms in den abhängigen Partien, der bei naturgemäß unverändertem Volumen von Alveolarwänden und intralobulärem Bindegewebe als Milchglasinfiltrat erscheint (Abb. 5 a,b). Aus diesem Grund soll
Insbesondere für den Nachweis von Milchglasinfiltraten in den dorsalen Lungenpartien sollte mit der Untersuchung unmittelbar nach Auflegen des Patienten auf den CT-Tisch begonnen werden
insbesondere bei Fragestellungen, für die der Nachweis von Milchglasinfiltraten in den dorsalen Lungenpartien von Relevanz ist, mit der Untersuchung unmittelbar nach Auflegen des Patienten auf den CT-Tisch begonnen werden.

Tipp
Ggf. sollte der Patient unmittelbar vor der Untersuchung aufgefordert werden, mehrfach zu husten, um durch Erhöhung des intraalveolären Drucks bereits kollabierte Alveolen wieder zu entfalten.
Lässt sich zwischen realen Verdichtungen und Belüftungsstörungen nicht unterscheiden, muss die Untersuchung ggf. in Bauchlage wiederholt werden.
Perfusionsumverteilung/Mosaikperfusion
Zur Absorption von Röntgenstrahlen in Übersichtsaufnahmen oder CTs des Lungenparenchyms trägt neben den Strukturen der Alveolarwände, des zentralen Interstitiums und der Lymphgefäße auch entscheidend das Blut in Arteriolen, Kapillaren und Venolen bei. Daher führt
Eine Zu- oder Abnahme der Lungenperfusion führt zu Änderungen der Dichte des Lungenparenchyms
eine Zunahme oder Abnahme der Lungenperfusion unweigerlich zu Änderungen der Dichte des Lungenparenchyms.
Bei einer diffusen Minderperfusion (kardialer Rechts-Links-Shunt, pulmonale Hypertension) äußert sich dies in einer ganz diffusen Dichteabnahme des Lungenparenchyms. Eine fokale Minderperfusion einzelner Lungenabschnitte (chronisch-rezidivierende Lungenembolie, Vaskulitis, reflektorisch bei fokaler Minderventilation) führt zu einem Nebeneinander von Lungenarealen mit verminderter Lungendichte (die von verschlossenen oder vermindert perfundierten Arteriolen versorgt werden) und vermehrter Lungedichte (die bei unverändertem Herz-Zeit-Volumen zwangsläufig kompensatorisch vermehrt perfundiert werden, da ja das gesamte Blutvolumen des großen Kreislaufs auch die Lunge passieren muss). Wenn vor allem die peripheren kleineren Lungenarterien und -arteriolen von der reduzierten Perfusion betroffen sind, liegen innerhalb eines Lungenlappens oft scharfe Grenzen zwischen vermindert und vermehrt perfundierten Arealen vor („geographische Dichteunterschiede“), die als Mosaikperfusion beschrieben werden (Abb. 6).
Mosaikperfusion

In dieser Situation stellen die vermehrt transparenten, minder perfundierten Bereiche die pathologisch veränderten Lungenareale dar.
Tipp
Die dichteren, kompensatorisch vermehrt perfundierten Bereiche entsprechen normalem Parenchym. Insofern dürfen diese nicht fälschlich als Milchglasareale interpretiert werden.
Hinweisend auf eine Mosaikperfusion ist, dass in den transparenzvermehrten Arealen die Blutgefäße ausgesprochen schmächtig zur Darstellung kommen, während in den hyperdensen Arealen kompensatorisch deutlich weitere Gefäße erkennbar sind.
Im Unterschied zum Air-Trapping (s. u.) nehmen die Dichteunterschiede in Exspirationsaufnahmen nicht auffällig zu.
Air-Trapping
Unter „Air-Trapping“ versteht man eine exspiratorische Überblähung einzelner Lungenareale aufgrund eines exspiratorischen Verschlusses in der Regel kleiner Atemwege
Unter „Air-Trapping“ („Luftfangen“) versteht man eine exspiratorische Überblähung einzelner Lungenareale aufgrund eines exspiratorischen Verschlusses in der Regel kleiner Atemwege („small airways“). Aufgrund der intrathorakalen Druckschwankungen während der Atmung kommt es bereits unter normalen Bedingen aufgrund des negativen intrathorakalen Drucks in Inspiration zu einer Distension der nicht durch Knorpelspangen stabilisierten peripheren Bronchien und Bronchiolen. In Exspiration nimmt der Durchmesser des Lumens der kleinen Atemwege bereits physiologischerweise ab. Ist das Lumen durch Schleimhautschwellung oder Sekretablagerungen bereits reduziert, kommt es in Exspiration zu einem vollständigen Kollaps, sodass eine Entlüftung der peripher des betroffenen Bronchiolus gelegenen sekundären pulmonalen Lobuli nicht stattfindet. Entsprechend bleibt das jeweilige Lungenareal unvermindert transparent. Gegenüber den physiologisch bei Exspiration an Dichte zunehmenden nicht betroffenen Arealen ergibt sich so ebenfalls ein Muster geographisch konfigurierter Dichteunterschiede. In Inspiration stellen sich diese erheblich geringer oder gar nicht dar (Abb. 4a, b).
Air-Trapping ist keine eigenständige Erkrankung, sondern lediglich ein Befund unterschiedlicher Relevanz
Air-Trapping ist keine eigenständige Erkrankung, sondern lediglich ein Befund unterschiedlicher Relevanz. So lässt sich Air-Trapping in geringem Ausmaß (wenige sekundäre Lobuli betroffen) bei jedem Gesunden nachweisen. Bei asymptomatischen Rauchern sind mehr sekundäre Lobuli betroffen als bei Nichtrauchern, und bei den meisten interstitiellen Lungenerkrankungen findet sich ein mehr oder weniger ausgeprägtes Air-Trapping. Besonders deutlich ist es bei Erkrankungen, die mit einer Bronchiolitis einhergehen (exogen allergische Alveolitis, EAA; Hypersensitivitätspneumonitis; obliterative Bronchiolitis; Panbronchiolitis; respiratorische Bronchiolitis etc.) aber auch bei der Sarkoidose, vermutlich aufgrund einer Einengung kleiner Atemwege durch peribronchioläre Granulome im zentralen Interstitium.
Krankheitsbilder mit Milchglasinfiltraten
Bei verschiedenen pulmonalen Erkrankungen treten Milchglasinfiltrate als vorherrschendes oder koexistierendes, differenzialdiagnostisch wichtiges Muster auf. Im Folgenden werden einige häufige Entitäten exemplarisch vorgestellt. Eine vollständige Darstellung aller Krankheitsbilder, die radiologisch mit Milchglasinfiltraten einhergehen (können), ist nicht beabsichtigt und auch nicht möglich.
Interstitielle Pneumonie
Bei verschiedenen Krankheitsbildern aus dem Formenkreis der interstitiellen Pneumonien findet sich häufig ein Nebeneinander von Milchglasinfiltraten und fibrotischen Veränderungen
Bei verschiedenen Krankheitsbildern aus dem Formenkreis der interstitiellen Pneumonien („usual interstitial pneumonia“, UIP; „non-specific interstitial pneumonia“, NSIP; Lungenbeteiligung bei verschiedenen Kollagenosen, z. B. progressive Systemsklerose: Sklerodermie) findet sich häufig ein Nebeneinander von Milchglasinfiltraten einerseits und fibrotischen Veränderungen wie z. B. honigwabenartigem Umbau des Lungenparenchyms („honey-combing“) andererseits. Histologisch entspricht das Honey-Combing einem irreversiblen und therapeutisch daher nicht mehr beeinflussbaren Endstadium, während das Milchglasinfiltrat oft einer floriden Alveolitis entspricht, die unter geeigneter Therapie prinzipiell reversibel ist (Abb. 7a, b).
Honey-Combing

Milchglasartige Veränderungen gehen fibrotischen Veränderungen im gleichen Lungenareal oft voraus
Verlaufskontrollen zeigen oft, dass milchglasartige Veränderungen späteren fibrotischen Veränderungen im gleichen Lungenareal vorausgehen. Insofern wird die Klassifikation der Aktivität solcher Erkrankungen oft aus dem Verhältnis zwischen Milchglasinfiltrat und Honey-Combing abgeleitet. Um nicht fälschlich Milchglasareale, die histologisch einer sehr feinen Fibrose entsprechen (s. o.), als aktive Alveolitis zu interpretieren, muss sorgfältig auf indirekte Fibrosezeichen wie Traktionsbronchiektasen und -bronchiolektasen oder Zeichen der Parenchymdistorsion geachtet werden, wie die Verziehung von bronchovaskulären Bündeln oder Interlobärspalten.
Exogen-allergische Alveolitis
Bei der exogen-allergischen Alveolitis werden klinisch wie radiologisch verschiedene Phasen unterschieden
Bei der exogen-allergischen Alveolitis (EAA, Hypersensitivitätspneumonitis) werden sowohl klinisch als auch radiologisch verschiedene Phasen unterschieden. In der akuten Phase innerhalb der ersten Stunden nach Exposition gegen das inhalierte Allergen kommt es zu ganz diffusen Milchglasinfiltraten, deren sichere Erkennung und Unterscheidung von lediglich zu hell gefensterten Aufnahmen problematisch sein kann (Abb. 3). In der subakuten Phase finden sich dann zusätzlich charakteristische zentrilobuläre Knötchen und Air-Trapping (Abb. 8).
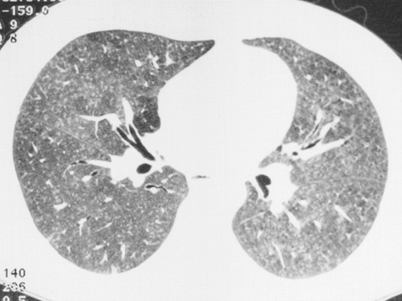
In der chronischen Phase dominieren dann fibrotische Veränderungen sowie ein oft ausgeprägtes Air-Trapping, das Milchglasinfiltrate durch die verminderte Dichte der vom Air-Trapping betroffenen Areale vortäuschen kann (Abb. 9).

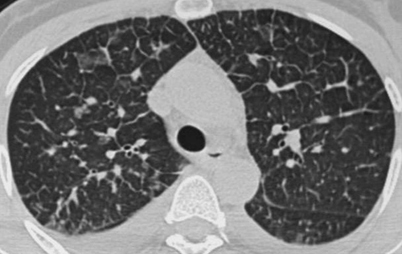
Ödem
Beim Lungenödem kommt es meist nicht zu rein interstitiellen oder rein intraalveolären Veränderungen
Beim Lungenödem kommt es meist nicht zu – in Lehrbüchern aus didaktischen Gründen separat beschriebenen – rein interstitiellen oder rein intraalveolären Veränderungen. Vielmehr findet sich in der Regel eine Kombination aus interstitiellem Ödem mit verdickten Interlobulärsepten, einer Verbreiterung des zentralen peribronchovaskulären Interstitiums mit scheinbarer Verdickung der Bronchialwände und Erweiterung der Arterien und einem intraalveolärem Ödem mit Infiltration der Alveolarräume, das teils als Milchglasinfiltrat und teils als Konsolidierung erscheint. Neben diesen Zeichen der Linksherzinsuffizienz finden sich auch oft Zeichen der Rechtsherzinsuffizienz mit Pleuraergüssen, Perikarderguss, Aszites, Gallenblasenwandödem oder dilatierten Lebervenen.
Ein häufiger Aspekt dieser Befundkombinationen sind Milchglasinfiltrate (Abb. 10), die oft basal und beim liegenden Patienten dorsal lokalisiert sind. Isoliert kommen sie beim Lungenödem praktisch nicht vor.
Atemnotsyndrom
Beim adulten respiratorischen Distress-Syndrom (ARDS) führt der Mangel an Surfactant zu einer Kollapsneigung der Alveolen, denen therapeutisch in der Regel durch eine Überdruckbeatmung entgegengewirkt wird. Unter dem Einfluss des Eigengewichts des Lungenparenchyms kommt es bei in Rückenlage beatmeten Patienten typischerweise zu einem ventrodorsalen Dichtegradienten der meist symmetrisch angeordneten Verdichtungen, der vom Ausmaß der Mikroatelektasen des Parenchyms bestimmt wird: Ganz dorsal finden sich die dichtesten Abschnitte im Sinne von Konsolidierungen, in der Mitte oft Milchglasinfiltrate und am weitesten ventral weitgehend unauffällige oder überblähte Parenchymanteile (Abb. 11).
Adultes respiratorisches Distress-Syndrom (ARDS)

Pneumonitis
Wird bei einer Strahlentherapie Lungenparenchym in das Strahlenfeld einbezogen, kommt es nach Überschreiten einer Schwellendosis von 30 Gy gelegentlich und von 40 Gy regelhaft zum Auftreten einer so genannten Strahlenpneumonitis . Unterhalb von 30 Gy tritt diese praktisch nicht auf.
Strahlenpneumonitis
Typischerweise folgen die auftretenden Veränderungen in ihrer Lokalisation exakt dem Strahlenfeld und überschreiten dabei anatomische Grenzen (z. B. Interlobärspalten). Die Beziehung zwischen dem Lungenareal, in dem die Schwellendosis überschritten wurde, und der Lokalisation der Pneumonitis ist allerdings bei modernen Therapieformen wie der intensitätsmodulierten Strahlentherapie (IMRT) nicht immer offensichtlich. Die Pneumonitis folgt in ihrem Ablauf einem relativ strengen zeitlichen Schema: So kommt es wenige Wochen nach Überschreiten der Schwellendosis (nicht nach Beendigung der Strahlentherapie!) zunächst zu einer Alveolitis, die sich als Milchglasinfiltrat darstellt. Innerhalb einiger Wochen geht diese in dichte Konsolidierungen über. Nach etwa 6 Monaten folgt eine Fibrosephase mit Traktionsbronchiektasen und Parenchymdystorsion; diese ist dann irreversibel. Das Krankheitsbild kann je nach Ausmaß der betroffenen Lunge asymptomatisch bleiben oder mit Dyspnoe und unproduktivem Husten sowie leichtem Fieber einhergehen. Eine simultan verabreichte Chemotherapie kann die Ausprägung verstärken, eine später verabreichte Chemotherapie kann erst zu diesem Zeitpunkt die Pneumonitis auslösen oder reaktivieren (Rebound-Pneumonitis ).
Rebound-Pneumonitis
Hämorrhagie/Lungeninfarkt/angioinvasive pulmonale Aspergillose
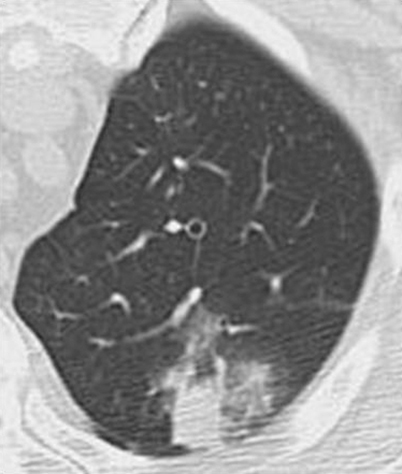
Einblutungen in das Lungenparenchym stellen sich oft unabhängig von ihrer Genese als fokale oder diffuse Milchglasinfiltrate dar
Einblutungen in das Lungenparenchym stellen sich oft – unabhängig von ihrer Genese (spontan bei Antikoagulation, nach transthorakalen oder transbronchialen Biopsien, im Rahmen von Vaskulitiden, bei blutenden Tumoren etc.) als fokale oder diffuse Milchglasinfiltrate dar (Abb. 12).

Beim Lungeninfarkt kommt es in der Regel zur Nekrose des Lungenparenchyms mit einer perifokalen Einblutung in nichtnekrotisches Lungenparenchym. Während sich die Nekrose radiologisch meist als Konsolidierung darstellt, erscheint die perifokale Hämorrhagie oft als Milchglasinfiltrat, das sich im Gegensatz zur allmählichen Rückbildung der Nekrose über viele Wochen meist innerhalb von wenigen Tagen resorbiert (Abb. 13). Ähnlich stellen sich auch die Herde einer angioinvasiven pulmonalen Aspergillose dar, die morphologisch vielfach Lungeninfarkten durch Angioinvasion des Pilzes in Pulmonalarterien entspricht: Nekrotische konsolidierte Areale werden von einem Halo aus Milchglasinfiltraten umgeben (Abb. 14).

Infektionen
Bei den verschiedensten pulmonalen Infektionen kommen Milchglasinfiltrate vor; in der Regel in frühen Phasen, wenn die Exsudation von entzündlichem Sekret noch nicht zur kompletten Verdrängung von Luft aus den Alveolarräumen geführt hat. Darüber hinaus gibt es relativ charakteristische Befunde für bestimmte Erreger, bei deren Vorliegen Milchglasinfiltrate auch differenzialdiagnostisch hilfreich sein können. Neben der angioinvasiven pulmonalen Aspergillose (s. o.) werden zwei weitere Krankheitsbilder hier beispielhaft vorgestellt.
Viruspneumonie
Etwas vereinfacht dargestellt, besteht die typische Befundkonstellation der verschiedenen Viruspneumonien aus einer variablen Kombination nodulärer Veränderungen mit verdickten Interlobulärsepten, Milchglasinfiltraten und Konsolidierungen (Abb. 15). Dabei lassen sich die zugrunde liegenden Viren – Zytomegalievirus (CMV), Varizella-zoster-Virus (VZV), Herpes-simplex-Virus (HSV) etc. – anhand der radiologischen Morphologie nicht differenzieren.

Pneumocystis-jirovecii-Penumonie
Bei der durch Pneumocystis jirovecii (früher Pneumocystis carinii) verursachten Pneumonie (PcP) sind Milchglasinfiltrate in der frühen Phase ein charakteristischer Befund. Sie sind meist bilateral und zentral betont, sparen die Lungenspitzen und Zwerchfellrezessus aus und sind nicht mit Pleuraergüssen oder einer Lymphadenopathie assoziiert (Abb. 16). Bei einer typischen klinischen Konstellation (HIV-infizierter Patient, ausgeprägte Dyspnoe, Hypoxie, diffuse Milchglasinfiltrate) kann die Diagnose ggf. empirisch gestellt werden und die Therapie ohne oder vor der mikrobiologischen Sicherung des Erregers begonnen werden.
Fazit für die Praxis
Milchglasinfiltrate stellen einen radiologischen Befund dar, keine Diagnose.
Sie treten auf durch partielle Verdrängung von Luft aus dem Lungenparenchym durch intraalveoläre oder interstitielle Strukturvermehrungen, einen partiellen Kollaps oder eine vermehrte Perfusion des Lungenparenchyms.
Sie sind auf Thoraxübersichtsaufnahmen gelegentlich zu vermuten, v. a. bei fokaler Anordnung; in der Regel werden sie in der CT diagnostiziert.
Sie können bei physiologischen (Exspiration) oder den verschiedensten pathologischen Prozessen (Infektion, nichtinfektiöse Entzündungen, Hämorrhagie, Ödem, Fibrose, Tumorerkrankungen etc.) isoliert oder als Begleitphänomen anderer Muster auftreten.
Ihre Erkennung kann hilfreich sein zur frühzeitigen Diagnose einer pulmonalen Erkrankung, deren Aktivitätsabschätzung oder differenzialdiagnostischen Einordnung.
CME-Fragebogen
Milchglastrübungen sind definiert als Transparenzminderungen, die …
Gefäße und Bronchuswände durchscheinen lassen.
Gefäße und Bronchuswände verdecken.
Rundherde durchscheinen lassen.
Rundherde verdecken.
an Pleuraergüsse angrenzen.
Milchglastrübungen kann pathomorphologisch nicht zugrunde liegen:
Feine Fibrose.
Alveolitis.
Bronchioloalveoläres Karzinom.
Ödem.
Ein Prozess, der die Luft im Lungenparenchym komplett verdrängt.
Milchglastrübungen werden besonders kontrastreich dargestellt bei …
Fensterweite (WW) von 2000 HE.
Fensterweite (WW) von 1500 HE.
Fensterweite (WW) von 1000 HE.
Fensterlage (WL) von – 200 HE.
Fensterlage (WL) von – 800 HE.
Was gilt als Zeichen einer durch Exspiration bedingen physiologischen milchglasartigen Dichteanhebung des Lungenparenchyms?
Besonders weite Trachea.
Konkave Kontur der Pars membranacea der Trachea.
Konvexe Kontur der Pas membranacea der Trachea.
Vermehrter Transversaldurchmesser des Thorax.
Vermehrter Sagittaldurchmesser des Thorax.
Welche Aussage ist nicht korrekt? Eine „Mosaikperfusion“ der Lunge …
kann bedingt sein durch chronische Lungenembolien.
kann bedingt sein durch eine pulmonale Vaskulitis.
äußert sich durch geographische Areale unterschiedlicher Dichte.
geht mit einer Erweiterung der Blutgefäße in den transparenten Lungenarealen einher.
zeigt in Exspiration keine auffällige Zunahme der Dichteunterschiede.
Was spricht für eine floride entzündliche Manifestation einer interstitiellen Pneumonie?
Überwiegendes Honey-Combing als vorherrschendes Muster.
Überwiegende Milchglastrübungen als vorherrschendes Muster.
Überwiegende Konsolidierungen als vorherrschendes Muster.
Traktionsbronchiektasen.
Parenchymdistorsionen.
Eine Pneumonitis mit Milchglastrübungen tritt nach Radiotherapie der Lunge regelhaft auf oberhalb einer Dosis von …
10 Gy.
20 Gy.
30 Gy.
40 Gy.
50 Gy.
Welche Antwort trifft zu? Bei einem HIV-positiven, dyspnoeischen Patienten mit diffusen Milchglasinfiltraten ohne lineare oder noduläre Läsionen, Pleuraergüsse oder Lyphadenopathie …
liegt am ehesten eine Viruspneumonie vor (Herpes simplex, Varizella zoster, Cytomegalie).
liegt am ehesten eine Pneumocystis-jirovecii-Pneumonie (PcP) vor.
handelt es sich am ehesten um ein interstitielles Lungenödem.
handelt es sich am ehesten um eine therapiebedingte Lungenfibrose.
liegt am ehesten eine Lobärpneumonie vor.
Bei einem febrilen Patienten in Neutropenie sprechen milchglasartige Verdichtungen um einen zentralen Konsolidierungsbezirk herum (Halo-Phänomen) für …
eine Viruspneumonie (Herpes simplex, Cytomegalie, Varizella zoster).
eine angioinvasive pulmonale Aspergillose.
eine Bronchopneumonie.
eine Tuberkulose.
eine toxische Pneumopathie.
Welche Aussage ist falsch ? Beim Lungenödem findet/finden sich oft …
verdickte Interlobulärsepten.
Pleuraergüsse.
eine Verbreiterung des zentalen peribronchovaskulären Interstitiums.
Konsolidierungen.
isolierte Milchglasinfiltrate.
Acknowledgments
Interessenkonflikt
Der korrespondierende Autor gibt an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Biederer Radiologe. 2010;50:553. doi: 10.1007/s00117-010-1978-9. [DOI] [PubMed] [Google Scholar]
- 2.Hansell Radiology. 2008;246:697. doi: 10.1148/radiol.2462070712. [DOI] [PubMed] [Google Scholar]
- 3.Kauczor HU (2003) Systematik der Bildanalyse/Bildmuster. In: Freyschmidt J (Hrsg) Thorax. Handbuch diagnostische Radiologie, Springer, Heidelberg 2003
- 4.Marten Radiologe. 2009;49:873. doi: 10.1007/s00117-009-1829-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Naidich DP, Webb WR, Müller NL et al (Hrsg) (2007) Computed tomography and magnetic resonance of the thorax. 4. Aufl. Wolters Kluwer/Lippincott Williams & Wilkins, Philadelphia
- 6.Reuter Radiologe. 2009;49:159. doi: 10.1007/s00117-008-1735-5. [DOI] [PubMed] [Google Scholar]
- 7.Webb WR, Müller NL, Naidich DP (2008) High resolution CT of the lung. 4th ed. Wolters Kluwer/Lippincott Williams & Wilkins, Philadelphia


