Zusammenfassung
Mit dem Auftreten der Neuen Influenza A/H1N1 2009 als Pandemie hat auch in Deutschland die Zahl der Neuerkrankungen rasch zugenommen. Nach wie vor zeigen die meisten Erkrankten eine milde Ausprägung. In Einzelfällen kommt es jedoch zu schweren Verläufen, die eine stationäre oder intensivmedizinische Behandlung erfordern. Während mittlerweile für die Behandlung von Patienten mit A/H1N1v-Infektion im ambulanten und allgemeinstationären Bereich zahlreiche Empfehlungen und Stellungnahmen vorliegen, ergeben sich bei erforderlicher Intensivbehandlung teilweise vollkommen neue Fragestellungen. Nachfolgend wird daher auf dem Boden der aktuellen Literatur, eigener Erfahrungen und einschlägiger Empfehlungen von Gesundheitsbehörden das Vorgehen bei Patienten mit schwerem intensivpflichtigen Verlauf einer A/H1N1v-Infektion dargestellt. Bereits aus Anamnese und zeitlichem Verlauf der Symptome ergeben sich erste wichtige Schlussfolgerungen hinsichtlich weiterer therapeutischer und hygienischer Maßnahmen. Das Verfahren der Wahl zum diagnostischen Nachweis von A/H1N1v ist die Polymerase-Kettenreaktion (PCR). Liegen bestimmte Risikofaktoren vor (z. B. Schwangerschaft, Immunsuppression, Adipositas), steigt die Wahrscheinlichkeit eines schweren Verlaufs der Influenza A/H1N1v 2009. Noch bevor die Testergebnisse vorliegen, sollten daher bei begründetem Verdacht die antivirale Therapie eingeleitet und Isolations- bzw. Personalschutzmaßnahmen getroffen werden. Die weitere intensivmedizinische Therapie zielt auf die Beherrschung begleitender Organkomplikationen ab (z. B. nichtinvasive bzw. maschinelle Beatmung bei drohender Hypoxämie). Zur Vermeidung einer bakteriellen Sekundärinfektion ist bei schwerer respiratorischer Insuffizienz frühzeitig eine kalkulierte antiinfektive Therapie indiziert. In Anbetracht der hohen Dynamik bei der Entwicklung einer respiratorischen Insuffizienz kann eine extrakorporale Membranoxygenierung notwendig werden. In diesem Fall sollte frühzeitig mit einem entsprechenden Zentrum Kontakt aufgenommen werden.
Schlüsselwörter: Influenza, H1N1, „Acute respiratory distress syndrome“, Intensivmedizin, Extrakorporale Membranoxygenierung
Abstract
The novel pandemic influenza A/H1N1v has also led to a rapid increase in the number of new cases in Germany. In the majority of patients the disease has taken a mild clinical course. However, in isolated cases severe complications requiring hospitalization or intensive care treatment have occurred. Most of the current recommendations refer to outpatients or mild diseases and are not always suitable and practicable for the management of a life-threatening influenza A/H1N1v infection in an intensive care setting. The aim of this review is to present a reliable diagnostic and therapeutic approach for critically ill patients, considering the current literature, case-based experiences from our own intensive care unit and including relevant recommendations of public health authorities. Initial measures regarding therapeutic, diagnostic and isolation precautions arise from past medical history, current anamnesis and characteristic symptoms and their progression. Patients suspected of having acquired an influenza A/H1N1v infection should be isolated. Early laboratory diagnosis of A/H1N1v infection ideally utilizes the reverse transcriptase polymerase chain reaction (RT-PCR) as the most sensitive diagnostic method. Emerging evidence suggests that incidence and severity of life-threatening influenza A/H1N1v infection increase with several risk factors (e.g. pregnancy, immunosuppression, obesity). Treatment decisions should not be delayed to await laboratory confirmation in these patients as early initiation of antiviral therapy is recommended. Elements of supportive care depend on the presentation of complications and secondary organ failure. If rapidly progressive lung dysfunction occurs, refractory to routine mechanical ventilation, early reporting to centers experienced in the use of extracorporeal membrane oxygenation (ECMO) should be established.
Keywords: Influenza, H1N1, Acute respiratory distress syndrome, Intensive care unit, Extracorporeal membrane oxygenation
Die wöchentlichen epidemiologischen Berichte des Robert Koch-Instituts (RKI) belegen, dass Infektionen mit der Neuen Influenza A/H1N1 2009 (nachfolgend „Neue Grippe“ bzw. das Virus im eigentlichen Sinn A/H1N1v genannt) seit dem Herbst auch in Deutschland zunehmen. Während zunächst weitgehend milde klinische Verläufe beobachtet wurden [35], zeigten sich mit Fortschreiten der Grippewelle auch schwere Verläufe mit respiratorischer Insuffizienz und Beatmungspflichtigkeit bis hin zur Notwendigkeit von extrakorporalen Lungenersatzverfahren. Ging man anfangs davon aus, dass schwerere Verläufe speziell auf Patienten mit relevanten Komorbiditäten beschränkt bleiben würden, mehren sich mittlerweile die Fälle (ca. 30%), bei denen auch Patienten schwer erkrankten, die weder zu einer der bekannten Risikogruppen gehörten noch relevante Vorerkrankungen in der Anamnese aufwiesen. Zeitgleich traten die ersten A/H1N1v-assoziierten Todesfälle in Deutschland auf. Der Verlauf der Grippewelle in Deutschland ähnelt damit dem Muster, wie er bereits 6 Monate zuvor in Ländern der südlichen Hemisphäre beobachtet wurde [4, 8].
Faktoren des Behandlungskonzeptes
Die weitere Entwicklung der Pandemie in Deutschland ist schwer vorhersehbar [35]. Mit der Zahl der infizierten Personen steigt auch die Zahl der Patienten, bei denen die Krankheit einen schweren Verlauf nimmt. Erfahrungen aus dem Zentrum der Autoren sowie erste klinisch-epidemiologische Studien aus Australien und Kanada lassen damit eine erheblich höhere Hospitalisierungsrate mit einem entsprechenden notwendigen Bedarf an intensivmedizinischen Ressourcen erwarten [17].
Zum Management von Infektionen mit der Neuen Grippe im ambulanten und allgemeinstationären Bereich liegen zwischenzeitlich Empfehlungen vor [28]. Beim schwerstkranken Intensivpatienten sind diese aber oft nur bedingt anwendbar bzw. praktikabel.
Ziel der vorliegenden Übersicht ist es daher, auf dem Boden aktueller Publikationen und Empfehlungen (Stand Dezember 2009), aber auch eigener Erfahrungen bei bislang 8 intensivpflichtigen Patienten mit A/H1N1v-Infektion ein umfassendes Behandlungskonzept für dieses Patientenkollektiv zu entwickeln. Dazu werden die folgenden Themenkomplexe diskutiert:
virologische und klinische Charakteristik der A/H1N1v-Infektion (Virusstruktur, Übertragung, Inkubationszeit, Infektiosität, Stellenwert des zeitlichen Verlaufs der Symptome),
Indikationen für die Aufnahme auf die Intensivstation (Risikogruppen, Komorbiditäten),
Hygiene und prophylaktische Maßnahmen (Isolation, Schutzkleidung, Impfung, logistische Voraussetzungen),
virusspezifische Diagnostik und Meldepflicht sowie
erregerspezifische und supportive intensivmedizinische Therapie.
Vielfach stehen dabei evidenzbasierte Empfehlungen wegen des Fehlens entsprechender Daten noch nicht zur Verfügung. Neben dem Literaturverzeichnis werden im Folgenden auch wichtige Informationsquellen im World Wide Web angegeben, um den Zugang zu den sich kontinuierlich erweiternden Erkenntnissen und Empfehlungen zu erleichtern. Die regelmäßige Sichtung dieser Informationsquellen ist den behandelnden Ärzten dringend zu empfehlen.
Die regelmäßige Sichtung der Informationsquellen im World Wide Web wird dringend empfohlen
Am Ende des Beitrags wird schließlich anhand eines konkreten Fallbeispiels aus der Klinik erläutert, welche therapeutische Vorgehensweise bei einem Patienten mit einer schweren A/H1N1v-Infektion möglich ist.
Epidemiologie
Die epidemiologischen Wochenberichte des RKI zeigen, dass sich die Pandemie mit der Neuen Grippe in Deutschland zwischen September und Dezember 2009 weiter ausgebreitet hat (http://influenza.rki.de/Wochenberichte/2009-49.pdf). Auch in zwei Drittel der anderen Länder Europas wird für die 48. Kalenderwoche (KW) 2009 noch über eine steigende Aktivität der Neuen Grippe berichtet, während sie u. a. im Vereinigten Königreich und Irland wieder abfiel. Das amerikanische Zentrum für Gesundheitskontrolle (Centers for Disease Control and Prevention, CDC) berichtet für die 47. KW über eine zurückgehende Influenzaaktivität. Auffällig ist dort die hohe Zahl der Todesfälle bei Kindern durch die Neue Grippe.
In einer ersten Übersichtsarbeit aus Deutschland wurden von Winzer et al. [35] retrospektiv Daten einer großen klinischen Kohorte von A/H1N1v-Infektionen im Zeitraum von April bis September 2009 ausgewertet. Tiefe Nasenabstriche von 3372 Personen wurden mithilfe der Polymerase-Kettenreaktion („polymerase chain reaction“, PCR) untersucht; hiervon fielen 450 Befunde (13%) positiv aus. Dabei handelte es sich überwiegend (84%) um Infektionen, die im Ausland erworben worden waren. Die häufigsten Symptome waren Husten (85%), Fieber (65%) und Schnupfen (69%). Es dominierten milde Krankheitsverläufe, ohne dass eine Hospitalisierung notwendig wurde. Schwere intensivmedizinische Verläufe oder gar Todesfälle wurden nicht berichtet. Entsprechende Studien liegen auch im europäischen Raum bis zum Zeitpunkt der Drucklegung dieses Beitrags nicht vor. Im Gegensatz dazu zeigen Studien aus Kanada und Australien ein deutlich anderes Bild [6, 19].
In einer multizentrischen Observationsstudie in Kanada wurden 168 kritisch kranke Patienten mit einer A/H1N1v-Infektion hinsichtlich ihrer demographischen Charakteristik, der Behandlung und des Outcome beschrieben. Als kritisch krank wurde ein Patient definiert, wenn folgende Voraussetzungen zutrafen: Die Notwendigkeit zur Aufnahme auf eine Intensivstation, die Notwendigkeit einer maschinellen invasiven oder nichtinvasiven Beatmung, eine fraktionelle inspiratorische Sauerstoffkonzentration von mehr als 60% und die Notwendigkeit einer Therapie mit Vasopressoren. Das mittlere Alter der Patienten lag bei 32 Jahren. Es waren 113 Patienten weiblich (67%), und die Anzahl der Kinder/Jugendlichen unter 18 Jahren betrug 50 (30%). Primärer Outcome-Parameter war die Letalität nach 28 und 90 Tagen, sekundäre Parameter waren die Häufigkeit und Dauer der maschinellen Beatmung sowie die Länge des Intensivaufenthalts. Fast alle Patienten (98%) hatten leichte Begleiterkrankungen wie arterielle Hypertonie, Bluthochruck, Nikotinabusus oder Adipositas. Schwere Erkrankungen wurden hingegen nur in 30% der Fälle festgestellt. Von den 168 Patienten benötigten 81% eine invasive Beatmung und 4% eine Therapie mit extrakorporaler Membranoxygenierung („extracorporeal membrane oxygenation, ECMO), 17% verstarben innerhalb von 90 Tagen, und die durchschnittliche Verweildauer auf der Intensivstation betrug 12 Tage [19].
In der australischen Observationsstudie wurden 194 Intensivpatienten mit einer schweren A/H1N1v-Infektion untersucht. Hier lag der Anteil von Patienten, die mit einer ECMO behandelt werden mussten, sogar bei 31%. Das durchschnittliche Lebensalter betrug 36 Jahre, und als Begleiterkrankungen dominierten chronische Lungenerkrankungen, Diabetes mellitus, Adipositas oder Schwangerschaft [6].
Ob Adipositas wirklich eine Rolle als Risikofaktor für einen schweren Verlauf der Neuen Grippe spielt, ist nicht hinreichend geklärt. Während Adipositas bei der saisonalen Influenza nicht als Risikofaktor für einen schweren Verlauf identifiziert werden konnte, zeigen die Arbeit aus Australien und eine weitere aus Spanien eine hohe Prävalenz für den schweren Verlauf einer A/H1N1v-Infektion [27, 34].
Aus beiden Studien und aus ersten Auswertungen des RKI wird deutlich, dass v. a. Patienten bestimmter Risikogruppen bzw. Patienten mit bestimmten Risikofaktoren für einen schweren Verlauf der A/H1N1v-Infektion prädisponiert sind. Bezogen auf die jeweiligen Bevölkerungsanteile treten krankenhauspflichtige oder tödliche A/H1N1v-Erkrankungen v. a. bei Kindern unter 4 Jahren, Schwangeren und bei Patienten mit chronischen Vorerkrankungen auf. Trotz des bekannten erhöhten Risikos für die letztere Patientengruppe ist zu bedenken, dass im Vergleich zur saisonalen Influenza der Anteil jüngerer Personen unter den Verstorbenen deutlich höher ist und dass z. B. bei den 0- bis 9-jährigen Kindern und bei den 20- bis 29-jährigen Erwachsenen etwa ein Viertel der Verstorbenen keine chronische Vorerkrankung hatte (http://influenza.rki.de/Wochenberichte.aspx).
Auf der anästhesiologischen Intensivstation am Klinikum der Universität München, Campus Großhadern, wurden bisher 8 Patienten im Rahmen einer schweren A/H1N1v-Infektion behandelt. Die wesentlichen Charakteristika des Patientenkollektivs sind in Tab. 1 zusammengefasst.
| Alter (Jahre) |
Geschlecht (Männlich/weiblich) |
Tag der Aufnahme | Risikofaktoren | Beatmung (Tage) |
ECMO (Tage) |
Outcome |
|---|---|---|---|---|---|---|
| 50 | Männlich | 01.08.2009 | Keine | 24 | 13 | AS |
| 29 | Männlich | 16.10.2009 | Panzytopenie | 39 | 39 | Exitus |
| 39 | Männlich | 28.10.2009 | Keine | 10 | - | AS |
| 36 | Weiblich | 09.11.2009 | Schwangerschaft | 19 | 5 | AS |
| 64 | Männlich | 09.11.2009 | Hypertonus | 31 | 9 | AS |
| 52 | Männlich | 10.11.2009 | Unbekannt | s. A. | 39 | ITS |
| 54 | Männlich | 12.11.2009 | Immunsuppression | 6 | - | AS |
| 15 | Männlich | 02.12.2009 | Keine | s. A. | - | ITS |
AS Allgemeinstation, ECMO extrakorporale Membranoxygenierung, ITS noch auf Intensivstation, s. A. seit Aufnahme.aAnästhesiologische Intensivstation, Klinikum der Universität München.
Eine statistische Auswertung ist bei begrenzter Fallzahl nicht sinnvoll. Tendenziell lässt sich jedoch ein ähnliches Patientenkollektiv feststellen, wie in den Untersuchungen von Kumar et al. [19]. So finden sich Patienten im jüngeren bis mittleren Alter entweder ohne oder mit leichten oder schweren Begleiterkrankungen. Alle benötigten eine invasive Beatmung, über die Hälfte eine Therapie mit ECMO. Ein Patient ist verstorben.
Virologische und klinische Charakteristik
Virale Struktur von A/H1N1v
Influenzaviren gehören zu der Familie der Orthomyxoviren. Von den 3 Virustypen (A, B, und C) ist Typ A der klinisch bedeutsamste. Das Genom des Virus besteht aus 8 RNA-Abschnitten, die unterschiedliche Proteine, u. a. Hämagglutinin (HA) und Neuraminidase (NA) codieren, die sich wiederum in der Hülle des Virus wiederfinden. Mit der entsprechenden Antikörperreaktion lassen sich damit verschiedene Serotypen identifizieren, die u. a. als H1N1 bei der spanischen Grippe 1918, als H2N2 bei der asiatischen Grippe 1957 oder als H3N2 bei der Hong-Kong-Grippe von 1968 zu finden waren. Die Gensegmente der neuen, pandemischen H1N1-Influenza-A 2009 stammen zum überwiegenden Teil aus der eurasischen und nordamerikanischen Schweinegrippepopulation sowie aus Genen der Vogelgrippe. Ein Gen ist homolog zur humanen Influenza A [12].
Übertragung
Influenzaviren finden sich im Sekret des Nasen-Rachen-Raums von infizierten Personen. Dementsprechend erfolgt die Übertragung v. a. durch Tröpfcheninfektion mit einer Partikelgröße von >5 µm beim Sprechen, insbesondere aber beim Husten und Niesen auf die Schleimhäute der Atemwege von Kontaktpersonen. Einzelne Publikationen legen auch die Möglichkeit einer Übertragung durch sog. Tröpfchenkerne nahe, die kleiner sind (<5 µm) und länger in der Luft schweben können (aerogene Übertragung). Neben der Übertragung durch die Luft spielt auch die Kontaktübertragung z. B. in die Hand durch Händeschütteln nach Husten oder Niesen eine Rolle. Vereinzelte Berichte über die Übertragung durch Kontakt mit Oberflächen, Blut oder Stuhl sind beschrieben, konnten aber bisher nicht zweifelsfrei nachgewiesen werden [23].
Basierend auf Untersuchungen der World Health Organization (WHO) zum Ausbruch der Schweinegrippe im April 2009 in Mexiko scheint die Übertragungsrate bei der Neuen Grippe jedoch deutlich höher zu sein als bei der saisonalen Influenza [11]. Im Gegensatz dazu beschreibt das CDC für die USA jedoch eine ähnliche Übertragungsrate wie bei der saisonalen Influenza [36]. Eine abschließende Bewertung der Virulenz wird wohl erst nach Ende der Pandemie möglich sein.
Klinisches Erscheinungsbild und Symptome
Die häufigsten Symptome der Neuen Grippe sind der saisonalen Influenza A ähnlich und umfassen Fieber, Husten sowie Hals- und Gelenkschmerzen. Asymptomatische Verläufe von auf A/H1N1v-positiv getesteten Patienten sind ebenfalls beschrieben [35]. Im Gegensatz zur saisonalen Influenza finden sich bei der Neuen Grippe vereinzelt noch Symptome von Übelkeit, Erbrechen und Durchfall. Bei schweren Verläufen entwickeln sich Hypoxämie, Hämoptysen und feinblasige Rasselgeräusche, die bei der Auskultation zu erfassen sind. Die weiteren Entscheidungen für das klinische Management müssen daher auf der Basis von klinischen Parametern und epidemiologischen Betrachtungen erfolgen, zumal Labortests und Bildgebung in der Frühphase der Infektion nicht spezifisch sind.
Inkubationszeit, Infektiosität und „viral shedding“
Obgleich die genaue Inkubationszeit für die Neue Grippe bisher noch nicht exakt bekannt ist, wird davon ausgegangen, dass ein Zeitraum von 1 bis 7 Tagen möglich ist. Im Mittel werden aber 1 bis 4 Tage nicht überschritten (http://www.cdc.gov/h1n1flu/guidelines_infection_control.htm).
In der englischsprachigen Literatur wird im Zusammenhang mit A/H1N1v der Begriff des „viral shedding“ verwendet. Im engeren Sinne handelt es sich um die Reproduktion und Freisetzung des Virus aus der Wirtszelle sowie die erneute Infizierung weiterer Zellen. Wie lange eine Virenfreisetzung bei A/H1N1v stattfindet, kann derzeit nur aus der Zusammenschau von Erkenntnissen der saisonalen Influenza und den ersten epidemiologischen sowie klinischen Ergebnissen über die Neue Grippe angenommen werden. Sehr wahrscheinlich ist ein immunkompetenter Patient zwischen einem Tag vor Beginn der Symptome bis zum Abklingen des Fiebers als infektiös zu betrachten. Ingesamt umfasst der Zeitraum der Infektiosität damit zwischen 5 und 7 Tage; hierbei scheint die Menge der Viruslast in den ersten beiden Tagen am höchsten und korreliert in dieser Zeit auch mit der Höhe des Fiebers (http://www.cdc.gov/h1n1flu/guidelines_infection_control.htm).
Bei schweren Verläufen, die eine Hospitalisierung notwendig machen, bei immuninkompetenten Patienten und bei kleinen Kindern kann die Dauer der Virusausscheidung verlängert sein. Bei annähernd einem Drittel der Patienten war eine virale Ausscheidung von mindestens 7 Tagen [7] und in einer weiteren Studie bei 8% der Patienten sogar bis zu 10 Tagen nachweisbar [20].
Indikation für die Aufnahme auf die Intensivstation
Bei einer schweren Infektion mit der Neuen Grippe kann der Verlauf durch eine rechtzeitige adäquate intensivmedizinische Therapie günstig beeinflusst werden [19]. Daher muss der Schweregrad der akuten Infektion frühzeitig eingeschätzt werden, um Entscheidungen über Behandlungsmodalitäten sowie das Ausmaß der erforderlichen Überwachung und Therapie treffen zu können. Aufschlüsse darüber lassen sich aus den Untersuchungen an Intensivpatienten mit A/H1N1v-Infektionen in Kanada ableiten [19]. Die Autoren unterscheiden bei den 168 beschriebenen Patienten zwischen leichten (Hypertonus, Adipositas, Schwangerschaft, Nikotinabusus etc.) und schweren Begleiterkrankungen. Der Anteil an Patienten, die eine oder mehrere schwere Komorbiditäten aufwiesen, lag jedoch nur bei 51 Personen (30%). Darunter waren die häufigsten Immunsuppression (19%), chronische Herzinsuffizienz (12%), chronische Niereninsuffizienz (7%), zerebrovaskuläre Erkrankungen (5%) sowie maligne Grunderkrankungen und Leberinsuffizienz. Bemerkenswert an dieser Studie ist, dass zwar 98% der 168 Patienten Begleiterkrankungen hatten, aber nur 30% schwere Komorbiditäten aufwiesen. Trotzdem benötigten aber 81% aller Patienten eine differenzierte Beatmungstherapie und Nierenersatzverfahren bis hin zur ECMO. Die Daten zeigen, dass im Rahmen der A/H1N1v-Pandemie ein schwerer Verlauf auch bei relativ gesunden Menschen jüngeren und mittleren Alters möglich ist. Erstaunlich ist der hohe Anteil (67%) an weiblichen Patienten; dies konnte in bisherigen Influenzapandemien nicht beobachtet werden. Allerdings fand sich in der australischen Publikation zu intensivpflichtigen A/H1N1v-Erkrankten nur ein 52%iger Anteil von Frauen [6]. Eine Erklärung für die unterschiedlichen Erkrankungsraten in den jeweiligen Ländern gibt es zum aktuellen Zeitpunkt nicht, jedoch scheinen Schwangerschaft und Wöchnerinnenstatus in diesem Zusammenhang ein unabhängiger Risikofaktor zu sein. Ähnliche Beobachtungen sind auch in ersten Daten über die „surveillance“ in Deutschland durch das RKI gemacht worden. Schwere Verlaufsformen der A/H1N1v-Infektion traten auch hier überdurchschnittlich häufig bei Schwangeren, Wöchnerinnen und Kindern jünger als 5 Jahre auf.
Dementsprechend gibt das RKI folgende Zustände/Bedingungen an, wie sich eine Infektion mit dem A/H1N1v-Virus im Sinne eines schweren oder gar tödlichen Verlaufs manifestieren kann (http://www.rki.de/nn_200120/DE/Content/Infekt/EpidBull/Merkblaetter/Ratgeber__Mbl__Influenza.html):
akute respiratorische Insuffizienz, mit und ohne bakterielle Superinfektion,
Dekompensation einer begleitenden chronischen Erkrankung, wie Herzinsuffizienz, chronische Nieren- und Leberinsuffizienz, chronische respiratorische Erkrankungen, Tumorleiden, Diabetes mellitus oder Immunsuppression [iatrogen, Neutropenie, Transplantation, „Human-immunodeficiency-virus“- (HIV-)Infektion],
hämodynamische Dekompensation im Rahmen der Infektion oder der zugrunde liegenden Komorbidität bis hin zum septischen Schock und
vorangeschrittene Schwangerschaft und Wöchnerinnenstatus, Kinder bis 5 Jahre.
Prophylaktische Maßnahmen und Hygiene
Beim Umgang mit infektiösen Patienten und insbesondere im Pandemiefall muss jedes Krankenhaus Maßnahmen treffen, die einerseits dem Personalschutz und andererseits der adäquaten Versorgung des Patienten gerecht werden. Zudem muss die Übertragung auf andere Patienten bzw. Angehörige vermieden werden.
Maßnahmen müssen dem Personalschutz und der adäquaten Versorgung des Patienten gerecht werden
Die allgemeinen Regeln für Infektionsschutz und Hygiene am Arbeitsplatz sind einzuhalten. Grundlagen dafür bieten das Arbeitsschutzgesetz (ArbSchG) und das Infektionsschutzgesetz (IfSG) sowie die entsprechenden Richtlinien des Bundesamtes für Arbeitsschutz und Arbeitsmedizin (BAuA). Detaillierte Richtlinien zum Arbeitsschutz im Fall einer Influenza sind unter dem Beschluss 609 der Technischen Regeln für Biologische Arbeitsstoffe (TRBA) hinterlegt (http://www.baua.de/nn_15408/de/Themen-von-A-Z/Biologische-Arbeitsstoffe/TRBA/pdf/Beschluss-609.pdf). In jedem Fall müssen durch eine entsprechende lokale Expertenkommission (Ärztlicher Direktor, Pflegedienstleitung, hygieneverantwortliche Ärzte, Mikrobiologen, Betriebsarzt, Verwaltung) sowohl die personelle als auch die logistische Infrastruktur [z. B. (Intensiv-)Betten-Kapazität, adäquate Schutzkleidung, diagnostische Möglichkeiten, Medikamente und Personalimpfungen] sichergestellt bzw. in einem entsprechenden Strategieplan festgelegt werden.
Implikationen für die Intensivstation bei Verdacht auf A/H1N1v
Bei begründetem Verdacht auf eine A/H1N1v-Infektion werden besondere Anforderungen in Bezug auf Hygiene und Expositionsprophylaxe gestellt. Dies bedeutet für die Intensivstation einen erhöhten Personal- und Arbeitsaufwand. Damit die Kapazitäten bei einer Häufung von potenziell isolationspflichtigen Patienten nicht schnell an ihre Grenzen kommen, ist der zeitliche Verlauf der A/H1N1v-Infektion zu erheben. Ist das Zeitfenster von 7 Tagen seit Beginn der Symptome überschritten, können die Isolationsmaßnahmen im Regelfall beendet werden. Eine längere Isolation kann aber aufgrund der Schwere der Erkrankung und der zugrunde liegenden Komorbiditäten (z. B. Panzytopenie, Immunsuppression) im Einzelfall gerechtfertigt sein.
Räumliche Unterbringung des Patienten
Folgende Aspekte sollten beachtet werden:
Einzelunterbringung, bei Patienten mit gleichem Erregertyp ggf. Kohortenisolation.
Sofern in den Patientenräumen eine raumlufttechnische Anlage betrieben wird, über die eine Weiterverbreitung von dieser Luft auf andere Räume möglich ist, ist diese abzustellen. Unterdruckeinzelpflegeplätze sind zu bevorzugen. Cave: Auf keinen Fall dürfen Überdruckräume benutzt werden.
Bei beatmeten Patienten sind geschlossene Absaugsysteme und Exspirationsfilter zu verwenden, die undurchlässig für A/H1N1v-Viren sind. Entsprechende Informationen sind vom jeweiligen Hersteller einzufordern.
Personalschutzmaßnahmen und Expositionsprophylaxe
Es sind die folgenden Maßnahmen einzuhalten:
Schutzkleidung des Personals: Vor dem Betreten des Behandlungsraums Anlegen einer geeigneten Atemschutzmaske. Ein langärmliger, mit Rückenschluss versehener Schutzkittel und Handschuhe werden im Patientenzimmer angezogen und vor dem Verlassen entsorgt.
Atemschutzmasken: Spezielle Masken sollen die Einatmung von Viren verhindern. Partikelfiltrierende Masken („filtering face piece“, FFP) sind zu verwenden. Bei korrekter Benutzung mit dichtem Abschließen beträgt die nach innen gerichtete Leckage bezüglich Partikel für <5 µm bei FFP-1-Masken 22%, bei FFP-2-Masken 8% und bei FFP-3-Masken 2%. Empfohlen werden FFP-2-Masken bei normalem Kontakt zum Patienten (z. B. Abstrichenahme zur Diagnostik, Pflege- und Mobilisierungsmaßnahmen) und FFP-3-Masken bei invasiven Maßnahmen (Intubation, Bronchoskopie etc.).
Schutzbrillen: Gestellbrillen mit Seitenschutz werden bei Gefahr der Tröpfchenkontamination der Augenschleimhäute im Rahmen von provozierten Hustenstößen z. B. beim Absaugen, im Rahmen der Intubation oder bei der Bronchoskopie empfohlen.
Händedesinfektion: erforderlich nach direktem Patientenkontakt, Kontakt mit erregerhaltigem Material oder kontaminierten Objekten sowie nach Ablegen der Schutzkleidung vor Verlassen des Behandlungszimmers. Entsprechende Desinfektionsmittel mit deklarierter Wirksamkeit für das Wirkspektrum „begrenzt viruzid“ sind zu verwenden (http://www.rki.de/DE/Content/Infekt/Krankenhaushygiene/Desinfektionsmittel/Viruzid.pdf).
Transport des Patienten innerhalb und außerhalb des Krankenhauses
Zur Sicherheit des Patienten und des Personals sollten die folgenden Bedingungen eingehalten werden:
Alle mitwirkenden Bereiche und Personen sind über die Verdachtsdiagnose des Patienten zu informieren (boden- und luftgebundene Transportmittel, diagnostische Einrichtungen wie Radiologie, Herzkatheter etc.).
Alle mitwirkenden Bereiche und Personen haben entsprechende Vorkehrungen hinsichtlich adäquater Arbeitsschutzkleidung und anschließender Wischdesinfektion zu treffen.
Der Transport sollte als Einzeltransport erfolgen; dabei sollte der Patient, sofern das Krankheitsbild dies erlaubt, einen Mund-Nase-Schutz tragen. Eine Standardmaske („OP-Maske“) ist ausreichend.
Beim Transport intubierter und beatmeter Patienten besteht potenziell ein höheres Risiko einer Diskonnektion zwischen Tubus und Respirator mit anschließendem „Verblasen“ der Exspirationsluft in die Umgebung. Daher wird, wie bei invasiven Maßnahmen, das Tragen von FFP-3-Masken empfohlen.
Alle Geräte/Medizinprodukte mit direktem Kontakt zum Patienten (z. B. EKG-Elektroden, Blutdruckmanschetten etc.) sind patientenbezogen zu verwenden bzw. müssen nach Gebrauch verworfen bzw. vor Anwendung bei einem anderen Patienten desinfiziert werden.
Nach dem Transport ist die Schutzkleidung abzulegen und gemäß den Richtlinien über die ordnungsgemäße Entsorgung von Abfällen aus Einrichtungen des Gesundheitsdienstes zu entsorgen (http://www.rki.de/DE/Content/Infekt/Krankenhaushygiene/Kommission/Downloads/LAGA-Rili.pdf). Eine abschließende Händedesinfektion ist durchzuführen.
Personalschutzmaßnahmen und Impfprophylaxe
Auf die Bedeutung der Impfung des ärztlichen und pflegerischen Personals im Krankenhaus zum Eigenschutz und auch zum Schutz der Übertragung auf andere Patienten wird durch die Ständige Impfkommission (STIKO) am RKI ausdrücklich hingewiesen. Sie stellt die wirksamste Präventivmaßnahme dar und wird auch für eine Reihe weiterer Indikationsgruppen empfohlen (http://www.rki.de; Epidemiologisches Bulletin Nr. 50 vom 14.12.2009). Beim neu aufgetretenen Influenza-A/H1N1v-Virus war es erstmals möglich, durch die Entwicklung eines Impfstoffes frühzeitig in das pandemische Infektionsgeschehen einzugreifen. Da das neue Virus jedoch erst im Frühjahr 2009 aufgetreten ist, konnten die für die Influenzasaison 2009/2010 hergestellten Impfstoffe nicht mehr frühzeitig an die neue Variante A/H1N1v angepasst werden. Hieraus ergaben sich initial logistische Probleme bei der Bereitstellung des Impfstoffes und der Notwendigkeit einer Triage von Risikogruppen. Zwischenzeitlich ist dieses Problem wegen der limitierten Nachfrage der Bevölkerung nach der Impfung und der besseren Verfügbarkeit behoben. Ursprünglich war man auch davon ausgegangen, dass die saisonale Influenza-A-Impfung wirkungslos gegenüber der Neuen Grippe ist und umgekehrt. Neuere Untersuchungen des CDC, USA, postulieren jedoch eine mögliche Kreuzreaktivität von 25% nach Impfung für saisonale Influenza in Bezug auf das neue A/H1N1v-Virus [17], und erste größer angelegte Impfstudien zeigen eine ausreichende Immunogenität für einmalig verabreichte, monovalente Impfstoffe [13, 26]. Endgültige Daten zu Effektivität, Nutzen und Nebenwirkungsprofil stehen für die A/H1N1v-Impfung nach wie vor jedoch noch aus und werden wohl erst am Ende der Pandemie verfügbar sein [18].
Derzeit kann das Nutzen-Risiko-Verhältnis für Personal in Bezug auf die Impfung gegen die Neue Grippe nur in Analogie zu Erkenntnissen aus früheren Impfungen gegen die saisonale Influenza A und aus den Empfehlungen der STIKO am RKI geschätzt werden. Die Autoren führten daher nach entsprechender Aufklärung und Diskussion der Problematik in Rücksprache mit dem betriebsärztlichen Dienst und dem Personalrat eine Impfung auf freiwilliger Basis beim Personal der Intensivstation durch. Von den Mitarbeitern beider anästhesiologischen Intensivstationen ließen sich 60% impfen. Davon zeigten mehr als die Hälfte lokal begrenzte Schmerzen an der Injektionsstelle, die nach spätestens 24 h wieder verschwunden waren. Drei Personen waren am nächsten Tag wegen grippaler Symptome nicht arbeitsfähig, konnten aber am übernächsten Tag die Arbeit wieder aufnehmen. Bisher konnte bei keinem Mitarbeiter eine A/H1N1v-Infektion labordiagnostisch nachgewiesen werden.
Diagnostik und Meldepflicht
Durch die rasch ansteigende Zahl an A/H1N1v-Verdachtsfällen ist ein ressourcenschonender Einsatz der erregerspezifischen Diagnostik erforderlich.
Ein ressourcenschonender Einsatz der erregerspezifischen Diagnostik ist erforderlich
Ziel ist es, einerseits den Erreger bei Patienten mit erhöhtem Risiko für Komplikationen zeitnah innerhalb des diagnostischen Fensters zu erkennen und andererseits bei schweren Krankheitsbildern die Möglichkeit einer spezifischen antiviralen Behandlung einschätzen zu können.
Personengruppen für die erregerspezifische Diagnostik
Während eine Diagnostik bei asymptomatischen und klinisch unkomplizierten Verläufen nicht angezeigt ist, besteht nach den Empfehlungen des RKI für folgende Zielgruppen die Indikation zur erregerspezifischen Diagnostik (http://www.rki.de/cln_171/nn_200120/DE/Content/InfAZ/I/Influenza/IPV/Stellungnahme__Diagnostik.html):
Alle Personen mit schwerer Erkrankung und Symptomen, die einen Krankheitsverdacht begründen. Damit sind Fieber und deutliche Zeichen eines respiratorischen Infekts gemeint, die im zeitlichen Zusammenhang mit einer wahrscheinlichen Exposition gegenüber A/H1N1v zu bringen sind. Zu berücksichtigen sind Kontakte im engeren privaten oder beruflichen Umfeld (Auslandsanamnese), bei denen es zu einer Exposition mit A/H1N1v gekommen sein könnte.
- Alle Personen aus gefährdeten Gruppen, bei denen auch bei leichter Erkrankung eine Therapie im Rahmen einer individuellen Abwägung von Nutzen und Risiko in Betracht gezogen werden muss, da innerhalb dieses Kollektivs ein erhöhtes Risiko für einen schweren Verlauf der A/H1N1v-Infektion besteht:
- Schwangere, Säuglinge und Kleinkinder bis 24 Monate (s. gesonderte Empfehlung der entsprechenden Fachgesellschaften: http://www.dgpi.de, http://www.dggg.de),
- Personen ab dem 65. Lebensjahr, Bewohner von Alten- und Pflegeheimen,
- alle Patienten mit chronischen Erkrankungen an Lunge, Herz, Kreislauf, Leber und Nieren, Stoffwechselerkrankungen, Adipositas (Body-Mass-Index >30 kg/m2) und immuninkompetente Patienten.
Alle Personen, die im Rahmen einer Infektion mit A/H1N1v hospitalisiert werden müssen.
Influenzaschnelltest
Es existieren unterschiedliche Antigentests zum Nachweis der Influenza A oder B. Die Sensitivität dieser Tests wird in der Literatur zwischen 18 und 51% angegeben. Sie eignen sich nicht für den Nachweis einer A/H1N1v-Infektion oder die Differenzierung zwischen saisonaler und Neuer Grippe und werden deshalb nicht empfohlen [10].
Influenzaserologie
Die serologischen Tests für die saisonale Influenza können das Neue A/H1N1v-Virus nicht nachweisen. Am nationalen Referenzzentrum des RKI sind serologische Tests für A/H1N1v mittlerweile erhältlich; diese dienen aber letztlich der epidemiologischen Datenerhebung und retrospektiven Diagnosesicherung. Für die akute Diagnostik sind sie nicht geeignet.
„Real-time reverse transcriptase-polymerase chain reaction“
Voraussetzungen und Untersuchungsmaterial
Es sollten PCR-Tests verwendet werden, die ausschließlich das Neue A/H1N1v-Virus nachweisen und keine anderen Influenzaviren miterfassen. Dabei handelt es sich um eine „real-time reverse transcriptase-PCR“ (rRT-PCR), die von allen Laboratorien, die eine spezifische Influenzadiagnostik anbieten, durchgeführt werden kann. Wird dies im Vertragslabor nicht angeboten, kann das örtliche Gesundheitsamt über entsprechende Laboratorien Auskunft geben. Für den Versand an das untersuchende Labor sollte mithilfe eines Abstrichtupfers je eine Probe aus dem Rachen (rechts und links der Uvula) und einem Nasenloch entlang der Nasenscheidewand entnommen werden. Idealerweise sollten auf der Intensivstation „Universal-Transport-Medium-Abstrichtupfer“ (UTM-Abstrichtupfer; http://www.rki.de/cln_179/nn_200120/DE/Content/InfAZ/I/Influenza/IPV/ProbenentnahmeArzt.html) vorgehalten werden, die für die Virusdiagnostik geeignet sind. Alternativ kann der Abstrich auch mit einem trockenen, sterilen Tupfer erfolgen. Dieser wird in ein mit 0,5 ml 0,9%iger NaCl-Lösung befülltes Röhrchen überführt und anschließend flüssigkeitsdicht verschlossen. Cave: Abstrichröhrchen für bakteriologische Untersuchungen sind ungeeignet.
In einigen Fallberichten und Observationsstudien wird beschrieben, dass bei schwer verlaufenden A/H1N1v-Infektionen mit Beteiligung der tiefen Atemwege die PCR aus den nasopharyngealen Abstrichen negativ, in der bronchoalveolären Lavage (BAL) aber positiv getestet wurde [27, 31]. Bei intubierten und beatmeten Patienten sollte daher zusätzlich von der Möglichkeit der endotrachealen Absaugung (ENTA) oder einer BAL Gebrauch gemacht werden, um die Ausbeute an diagnostischem Material zu erhöhen [33].
Beim Versand der Proben ist auf die Einhaltung der Verpackungsrichtlinie für diagnostische Materialien zu achten. Proben verdächtiger A/H1N1v-Patienten sind als biologischer Stoff der Kategorie B (UN3373) zu klassifizieren und nach Maßgabe der Verpackungsanweisung P650 gemäß Accord européen relatif au transport international des marchandises Dangereuses par Route (ADR)/International Air Transport Association (IATA) Regelwerk Dangerous Goods Regulations (DGR) zu verpacken (http://www.rki.de/DE/Content/InfAZ/I/Influenza/IPV/Schweineinfluenza__Transport__Probenmaterial.html). Die Verpackung besteht aus 3 Komponenten:
flüssigkeitsdichtes Probengefäß (Abstrichtupfer),
flüssigkeitsdichtes Schutzgefäß (z. B. verschraubtes Umröhrchen) und
bauartgeprüfte, kistenförmige Verpackung (Außenverpackung). Hier müssen der Text „Biologischer Stoff, Kategorie B“ und „Biological Substance, Category B“, eine Raute mit der Inschrift „UN3373“ sowie Name und Telefonnummer einer verantwortlichen Person erscheinen.
Interpretation der Testergebnisse
Die rRT-PCR gilt als das sensitivste und schnellste diagnostische Verfahren der Wahl, um entsprechend den gewählten Primern die H1-Segmente des Virus in den entnommenen Proben nachzuweisen. Die quantitative Bestimmung ist prinzipiell möglich. Die Interpretation der Viruslast hinsichtlich der klinischen Wertung in Bezug auf Infektiosität, Therapiemonitoring und Anpassung hygienischer Maßnahmen muss jedoch kritisch betrachtet werden, da die Menge an nachweisbaren Viruspartikeln in Abhängigkeit von Abnahmeort, -verfahren und -qualität sehr stark schwankt. So beobachtete das Nationale Referenzzentrum (NRZ) für Influenza am RKI das Phänomen, dass Abstriche aus dem jeweiligen Nasenloch sehr unterschiedliche Virusmengen erbrachten. Eine generelle quantitative Bestimmung könnte also falsche Schlussfolgerungen auslösen. Für klinische Konsequenzen ist die qualitative Angabe ausreichend (positiv/negativ; persönliche Kommunikation des Autors mit Dr. B. Biere RKI, NRZ Influenza).
Bildgebende Verfahren
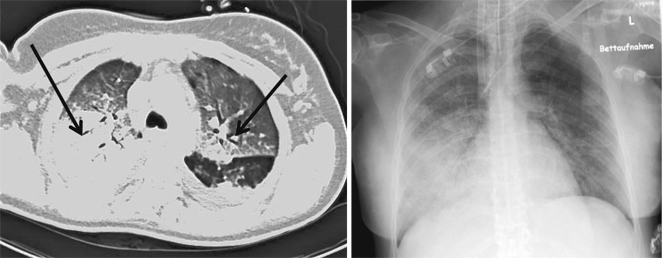
In einer Studie an 66 Patienten beschreiben Agarwal et al. [2] die radiologischen Veränderungen der Lunge [Thoraxröntgenübersichtsaufnahmen und Computertomographie (CT)] im Rahmen einer A/H1N1v-Infektion. Gruppe 1 (n=14) umfasste Patienten, bei denen eine beatmungspflichtige respiratorische Insuffizienz bestand. Die übrigen Patienten (n=52; Gruppe 2) wurden ambulant oder allgemeinstationär behandelt. Alle Patienten der Gruppe 1 zeigten in der Röntgenübersichtsaufnahme radiologische Veränderungen im Sinne von fleckigen, ungleichmäßig verteilten Verschattungen, v. a. in den basalen und zentralen Lungenbereichen. Bei 73% der Patienten aus Gruppe 2 fand sich ein normales Röntgenbild. Im Rahmen der intensivmedizinischen Therapie wurden 10 Patienten der Gruppe 1 mithilfe der kontrastverstärkten CT untersucht. Während sich bei nur einer Patientin ausschließlich sog. Milchglasphänomene darstellen ließen (Abb. 1; inwieweit diese charakteristisch für eine schwere A/H1N1v-Infektion sind, muss in weiteren Studien untersucht werden), fanden sich in den 9 anderen Fällen konsolidierte Areale in Kombination mit milchglasartigen Verschattungen. Allerdings kann bei der begrenzten Anzahl von Untersuchungen keine Aussage über bevorzugt betroffene Lungenareale in der CT gemacht werden.
Meldepflicht
Die aktuelle epidemiologische Lage machte eine Anpassung der Meldepflicht für die Neue Grippe notwendig. Bei stetig ansteigenden Fallzahlen wurde die im April 2009 eingeführte Meldepflicht für Verdachtsfälle und Erkrankungsfälle ohne Diagnostik abgeschafft. Meldepflichtig sind seit dem 14.11.2009 der erregerspezifische Nachweis von A/H1N1v in der PCR [§ 7 (1) Nr. 24 IfSG] und jeder Todesfall, der mit einem A/H1N1v-Nachweis in zeitliche Verbindung gebracht werden kann (§ 6 Abs. 1 Satz 1 Nr. 1 und § 15 Abs. 1 IfSG). Die Meldung des Todes hat unverzüglich nach Feststellung an das für den Wohnort des Patienten zuständige Gesundheitsamt zu erfolgen. Hierfür stellen die Landesbehörden und Gesundheitsämter entsprechende Meldebögen zur Verfügung, die auch über die Homepage des RKI abgerufen werden können (http://www.rki.de/cln_091/nn_200120/DE/Content/InfAZ/I/Influenza/IPV/Erhebungsbogen-GA.html)
Therapeutische Ansätze
Erregerspezifische Therapiemaßnahmen
Weltweit sind verschiedene Influenzastämme mit unterschiedlichen Resistenzmustern im Umlauf. Die aktuelle Variante A/H1N1v ist resistent gegen Amantadin, aber empfindlich gegenüber den NA-Inhibitoren Oseltamivir und Zanamivir. Bisher sind in Deutschland keine neu aufgetretenen Resistenzmechanismen beim neuen Virustyp A/H1N1v bekannt. Die aktuelle lokale Resistenzlage kann sich jedoch schnell ändern und sollte regelmäßig auf den Informationsseiten des RKI überprüft werden [21].
Die aktuelle lokale Resistenzlage soll regelmäßig beim RKI erfragt werden
Bisher publizierte Daten zum Stellenwert von Oseltamivir im Rahmen der schweren A/H1N1v-Infektion sind limitiert. Die empfohlenen Behandlungsstrategien leiten sich weitestgehend aus den Erfahrungen und Daten bei der Behandlung der saisonalen Grippe ab [15]. In einer randomisierten, placebokontrollierten Doppelblindstudie an 629 Patienten reduzierte die frühzeitige Behandlung (<48 h nach Symptombeginn) mit Oseltamivir die Dauer und Schwere der klinischen Symptomatik [32]. In einer prospektiven, 10 Studien umfassenden Metaanalyse mit insgesamt 3564 Teilnehmern von Kaiser et al. [16] reduzierte die Behandlung mit Oseltamivir das Risiko der influenzabedingten Komplikationen (Pneumonie, Bronchitis) in den unteren Atemwegen auf 55%. In einer erneuten Bewertung der Cochrane Collaboration wurden diese Ergebnisse jedoch wegen unzureichender Verfügbarkeit der Rohdaten nicht mehr in eine aktuelle Metaanalyse aufgenommen [5, 14]. Erste Untersuchungen bei Patienten mit schwerem Verlauf der A/H1N1v-Infektion legen jedoch nahe, dass eine frühzeitige antivirale Therapie das Outcome günstig beeinflussen könnte [8, 19]. Daher sollte die Indikation zur antiviralen Therapie frühzeitig nach Symptombeginn (<48 h) aufgrund des klinischen Erscheinungsbildes und der epidemiologischen Überlegungen erfolgen, ohne labordiagnostische Ergebnisse abzuwarten. Ob eine Therapie mit Oseltamivir >48 h nach Beginn der Symptome sinnvoll ist, ist unklar. In Analogie zur saisonalen Influenza wird bei Patienten mit Risikofaktoren und kompliziertem Verlauf im Rahmen einer Nutzen-Risiko-Abwägung jedoch auch in diesem Fall die Therapie empfohlen (http://www.cdc.gov/h1n1flu/recommendations.htm).
Nur wenige Daten liegen bisher zur Dauer der Behandlung mit Oseltamivir bei schwerem Verlauf der A/H1N1v-Infektion vor. Die Dauer der viralen Ausscheidung (Viral shedding) von A/H1N1v wird im Vergleich zu klinisch unkomplizierten Verläufen als verlängert beschrieben [7, 20]. Die Frage, ob der Nachweis von Viruspartikeln mithilfe der PCR überhaupt die geeignete Therapiekontrolle darstellt, ist jedoch ungeklärt. Im Zweifel muss beim schwer kranken Patienten eine Nutzen-Risiko-Abwägung in Verbindung mit den klinischen Symptomen und dem Verlauf erfolgen und die, bei unkompliziertem Verlauf, empfohlene Behandlungsdauer von 5 Tagen individuell verlängert werden. Im Rahmen von kritischen Verläufen bei A/H1N1v-assoziierter Erkrankung wird aktuell durch das CDC eine 10-tägige antivirale Therapie empfohlen (http://www.cdc.gov/h1n1flu/recommendations.htm).
Dosierung und Applikation der antiviralen Medikation leiten sich ebenfalls aus den Untersuchungen zur saisonalen Influenza her. Über die optimale Dosis, die Art der Applikation (inhalativ durch Zanamavir vs. systemisch p.o. durch Oseltamivir) sowie die Resorption bei eingeschränkter pulmonaler und gastrointestinaler Funktion im Rahmen einer schweren Influenzainfektion gibt es nur wenige klinische Daten [30]. Gegenwärtig werden dem erwachsenen Patienten 75 mg Oseltamivir zweimal täglich p.o. verabreicht. Untersuchungen zur saisonalen Influenza legen nahe, dass eine Verdopplung der Dosis gut toleriert wird und ein ähnliches Nebenwirkungsprofil aufweist wie die Standarddosis [32]. Bei Patienten mit H5N1- („Vogelgrippe“-)assoziiertem schweren Lungenversagen wurde eine Dosisverdopplung empfohlen [1]. Bis zum Vorliegen ausreichender Daten hinsichtlich Pharmakokinetik, klinischer Effektivität und Nutzen einer Verdopplung der Dosis kann Letztere zwar in Betracht gezogen werden, eine Empfehlung dafür besteht jedoch nicht.
Der Stellenwert von NA-Inhibitoren im Rahmen der schwer verlaufenden A/H1N1v-Infektion kann derzeit wegen fehlender Studien nur begrenzt beurteilt werden [29]. Die empfohlenen Behandlungsstrategien leiten sich bisher aus den Erfahrungen und Daten bei der Behandlung der saisonalen Grippe ab. Die diskutierten erregerspezifischen Therapiemaßnahmen bei Influenza A mit NA-Inhibitoren stehen aktuell in einer Metaanalyse der Cochrane Collaboration auf dem Prüfstand [14]. Dabei werden Zweifel an der Effektivität der Medikamente im Rahmen einer Influenza-A-Infektion hinsichtlich Prophylaxe, Therapie und Postexpositionsprophylaxe geäußert [9]. Eine aktuelle Änderung der Empfehlung für NA-Inhibitoren zur Therapie der Neuen Grippe vonseiten der WHO, dem CDC oder dem RKI liegt zum Zeitpunkt der Drucklegung dieses Beitrags jedoch nicht vor.
Supportive intensivmedizinische Therapie
Der Großteil der Patienten, die wegen einer schweren A/H1N1v-Infektion auf der Intensivstation behandelt werden müssen, zeigt eine hochgradige respiratorische Insuffizienz bis hin zum akuten Lungenversagen („acute respiratory distress syndrome“, ARDS). Daneben finden sich zusätzlich aber auch Patienten mit Nierenversagen, Myokarditis mit akuter Dekompensation der kardialen Pumpfunktion, bakterieller Superinfektionen mit Pneumonie und septischem Schock sowie Enzephalitis und Rhabdomyolyse [6, 19]. Dabei entwickelt speziell die respiratorische Insuffizienz häufig eine Dynamik, die innerhalb der ersten 24 h nach Symptombeginn eine invasive maschinelle Beatmung zur Aufrechterhaltung einer adäquaten Oxygenierung und Decarboxylierung erfordert. Innerhalb des ersten Tages nach Aufnahme auf die Intensivstation mussten bereits 136 Patienten (81%) aus der Untersuchung von Kumar et al. [19] invasiv beatmet werden. Dabei betrugen der mittlere Oxygenierungsindex 147 mmHg und das mittlere „Positive-end-expiratory-pressure“- (PEEP-)Niveau lag bei über 10 cmH2O. Supportive Maßnahmen zur Verbesserung der Oxygenierung umfassten neuromuskuläre Blockaden (28%), inhalativ verabreichtes Stickstoffmonoxid (13,7%), Hochfrequenzbeatmung (12%) und intermittierende Bauchlagerung (3%). Lässt sich damit keine ausreichende Oxygenierung sicherstellen, muss die ECMO in Betracht gezogen werden.
In der Observationsstudie aus Australien war die Dynamik hinsichtlich der respiratorischen Verschlechterung ähnlich [6]. Von den 194 Patienten mit schwerer A/H1N1v-Infektion benötigten 61 Patienten innerhalb von 2 Tagen nach Beginn der maschinellen Beatmung bereits eine ECMO-Therapie über durchschnittlich 10 Tage. Vor ECMO betrug der Oxygenierungsindex im Mittel 56 mmHg und der arterielle Kohlendioxidpartialdruck (paCO2) lag bei 69 mmHg bei Beatmungsspitzendrücken zwischen 33 und 38 cmH2O und einem PEEP-Niveau von 15–20 cmH2O. Von den insgesamt 68 mit ECMO behandelten Patienten konnten 77% erfolgreich entwöhnt werden, während 13 Patienten (19%) noch während der Therapie verstarben. Das Design der Untersuchung als Observationsstudie erlaubt keine Aussagen hinsichtlich des Outcome der Patienten im Vergleich zu konventionellen Beatmungsstrategien. Die Therapie mit ECMO ist eine hochspezialisierte Technik, die eine entsprechende Expertise sowie die personellen und logistischen Voraussetzungen benötigt und daher nur an wenigen Zentren vorgehalten werden kann. Eine kürzlich publizierte multizentrische Studie aus England konnte jedoch belegen, dass Patienten mit ARDS und schwerer Hypoxie von einem frühzeitigen Transfer an ein ECMO-Zentrum profitieren [25]. Bei einem schweren Verlauf der A/H1N1v-Infektion und in Anbetracht der hohen Dynamik der Entwicklung einer respiratorischen Insuffizienz muss an eine frühe Kontaktaufnahme mit einem entsprechenden Zentrum gedacht werden.
Die Kontaktaufnahme mit einem ECMO-Zentrum soll frühzeitig erfolgen
Die sekundäre bakterielle Pneumonie ist eine weitere lebensbedrohliche Komplikation im Rahmen einer schweren Influenzainfektion. Retrospektive Untersuchungen vergangener Pandemien zeigten, dass die hohe Sterblichkeitsrate durch bakterielle Superinfektionen bedingt war [24]. Generell entspricht das Spektrum bakterieller Erreger dem der primär ambulant erworbenen Pneumonie; in den meisten Studien waren Streptococcus pneumoniae (Pneumokokken) die häufigsten bakteriellen Kopathogene. An zweiter Stelle stehen bei Influenzapatienten allerdings Staphylokokken, die bei nichtinfluenzaassoziierter, ambulant erworbener Pneumonie eher selten sind. In der Studie von Kumar et al. [19] traten in 24% der Fälle sekundäre bakterielle Infektionen auf. Als Erreger konnten hier größtenteils Staphylococcus aureus, Streptococcus pneumoniae, Streptokokken der Gruppe A und Escherichia coli nachgewiesen werden. Verschiedene epidemiologische Arbeiten schlussfolgern, dass die Inzidenz bakteriämischer Pneumokokkenpneumonien im Rahmen einer Influenzaepidemie signifikant ansteigen kann. Als ursächlich hierfür wird eine stark verminderte Immunabwehr bei Patienten mit Influenza-A-Infektion angesehen [22].
Aufgrund der Häufigkeit einer bakteriellen Sekundärinfektion und der damit verbundenen Aggravierung der Erkrankung sollte neben der mikrobiologischen Diagnostik auch die Einstiegsschwelle für eine frühzeitige antiinfektive Therapie bei einem schweren Verlauf einer A/H1N1v-Infektion niedrig gehalten werden. Die einzusetzenden Antibiotika sollten gemäß dem oben genannten Spektrum wirksam sein und ggf. im Rahmen einer Kombinationstherapie auch atypische Erreger (Legionellen, Mykoplasmen, Chlamydien) gemäß den Leitlinien für die ambulant erworbene Pneumonie erfassen (http://www.capnetz.de/html/docs/ll-cap-final.pdf).
Experimentelle Therapieansätze
Peramivir ist eine neuer i.v. zu verabreichender NA-Inhibitor, der im Rahmen einer „emergency use authorization“ (EAU) durch die Food and Drug Administration (FDA) der USA zur Behandlung der Neuen Grippe unter bestimmten Umständen als therapeutische Option zur Verfügung steht [3]. Bisher existieren jedoch weder Daten zur Sicherheit, Wirksamkeit oder zum Nebenwirkungsprofil von Peramivir. Daher wird der Einsatz von der FDA nur während der Pandemie von A/H1N1v unter folgenden Bedingungen autorisiert:
kein Ansprechen auf die Therapie mit oralen oder inhalativen NA-Inhibitoren sowie
Anhalt für eine mangelnde Resorption von oral verabreichtem Oseltamivir und inhalativ zugeführtem Zanamivir.
Informationen über den Bezug von Peramivir können über die Webseite des CDC abgerufen werden: http://www.cdc.gov/h1n1flu/eua/peramivir.htm.
Fallbeispiel
Aus den 8 Patienten, die auf der anästhesiologischen Intensivstation am Klinikum der Universität München zwischen August und Dezember 2009 behandelt wurden, wird nachfolgend exemplarisch ein Fall vom Beginn der Aufnahme bis zur Entlassung vorgestellt. In Verbindung mit den angesprochenen Themenkomplexen dieses Beitrags soll damit das konkrete Handlungsvorgehen bei Patienten mit einer schweren A/H1N1v-Infektion praktisch verdeutlicht werden.
Vorgeschichte
Von der Intensivstation eines externen Krankenhauses wurde Anfang November die Anfrage an unser Zentrum zur Übernahme einer 36-jährigen Patientin mit schwerer respiratorischer Insuffizienz gestellt. Die Patientin befand sich in der 32. Schwangerschaftswoche und hatte sich an der zuverlegenden Klinik mit grippalen Symptomen (Halsschmerz, Husten, Fieber 38,5°C) vorgestellt, die seit ca. 7 Tagen bestanden. Als Nebendiagnose fand sich ein Diabetes mellitus Typ 1 seit dem 19. Lebensjahr. Die initial gemessene Sauerstoffsättigung (SpO2) betrug unter Insufflation von 2 l Sauerstoff/min 80%. Bei respiratorischer Erschöpfung unter nichtinvasiver Beatmung (NIV) war in der erstversorgenden Klinik die orotracheale Intubation und Entbindung des Kindes via Sectio caesarea am folgenden Tag erfolgt. Der Gasaustausch der Patientin hatte sich innerhalb von Stunden dramatisch verschlechtert, sodass Kontakt mit unserer Klinik wegen der bestehenden Option zur ECMO aufgenommen wurde. Bei einem Oxygenierungsindex (nach Horovitz) von 47 mmHg unter invasiver Beatmung [pmax 44 cmH2O, PEEP 20 cmH2O, Tidalvolumen (Vt) 350 ml] wurde von unserem Team vor Ort eine pumpengetriebene venovenöse ECMO etabliert und die Patientin mit einem bodengebundenen Rettungsmittel (Intensivtransportwagen, ITW) auf die anästhesiologische Intensivstation des Klinikums der Universität München (Campus Großhadern) verbracht. Die Bildgebung bei Aufnahme erbrachte die in Abb. 1 dargestellten Befunde.
Therapeutisches Vorgehen
Zum Zeitpunkt der Aufnahme auf unserer Intensivstation lag der Symptombeginn der Patientin bereits 9 Tage zurück. Damit konnte auf erweiterte Isolationsmaßnahmen verzichtet werden. Die im zuverlegenden Krankenhaus über 7 Tage durchgeführte antivirale Therapie wurde nicht weitergeführt. Die nachfolgende Therapie bestand in unterstützenden intensivmedizinischen Maßnahmen. Die Patientin wurde bei Übernahme kalkuliert antibiotisch und antimykotisch behandelt (Meropenem, Moxifloxacin, Caspofungin). Die umfangreichen mikrobiologischen, PCR-diagnostischen und serologischen Untersuchungen erbrachten unter dieser Therapie keinen weiteren Keimnachweis, sodass die antiinfektive Therapie rasch wieder deeskaliert werden konnte. Die im zuverlegenden Krankenhaus positive PCR auf A/H1N1v war in einer Kontrolle am Tag 6 nach Symptombeginn bereits negativ. Mithilfe der ECMO wurde die Hypoxämie behoben, und die Invasivität der Beatmung konnte reduziert werden. Unter lungenprotektiver Beatmung (pmax 26 cmH2O, PEEP 15 cmH2O; Vt 250ml) und mithilfe einer intermittierenden 180°-Lagerung, forcierten Negativbilanz und mukolytischer Therapie besserte sich der Gasaustausch im Verlauf, sodass die Patientin schrittweise von der ECMO entwöhnt und diese bereits 5 Tage nach Anlage beendet werden konnte. Der Gasaustausch war in der Folge noch eingeschränkt. Hierbei war auffallend, dass die Patientin weiterhin auf einen relativ hohen PEEP angewiesen war und von intermittierenden Bauchlagen profitierte. Mit zunehmender Spontanatmung konnte sie schließlich 21 Tage nach Beginn der maschinellen Beatmung wieder extubiert werden. Eine vor Verlegung auf die Allgemeinstation durchgeführte arterielle Blutgasanalyse bei Raumluft ergab folgende Werte: arterieller Sauerstoffpartialdruck (paO2) 64 mmHg, paCO2 30 mmHg, pH 7,36. Es bestanden keine weiteren Organdysfunktionen. Mutter und Kind konnten die Klinik Mitte Dezember verlassen.
Fazit für die Praxis
Die Infektion mit der pandemischen Neuen Influenza A/H1N1 2009 kann sich insbesondere beim Vorliegen von Risikofaktoren oder Begleiterkrankungen schnell zu einer lebensbedrohlichen Erkrankung mit der Notwendigkeit zur intensivmedizinischen Therapie entwickeln. Um dafür einerseits das Risiko und andererseits die therapeutischen Ziele definieren zu können, ist eine genaue Anamnese bzw. die Kenntnis des zeitlichen Verlaufs der Symptome erforderlich. Hieraus ergeben sich Konsequenzen für Diagnostik, Isolationsmaßnahmen und Therapiepläne. Bei begründetem Verdacht auf eine A/H1N1v-Infektion stellt die PCR aus nasopharyngealem oder endotrachealem Probenmaterial das Verfahren der Wahl zur Diagnosesicherung dar. Innerhalb eines Zeitfensters von 7 Tagen nach Beginn der Symptome sind beim intensivpflichtigen Patienten Isolations- und Personenschutzmaßnahmen zu treffen. Diese umfassen die Einzelunterbringung und das Tragen von geeigneter Schutzkleidung. Beim Intra- oder Interhospitaltransfer sind alle Beteiligten über die Diagnose und die ggf. erforderlichen hygienischen Maßnahmen zu informieren. Die Indikation zur antiviralen Therapie sollte frühzeitig nach Symptombeginn (<48 h) unter Berücksichtigung des klinischen Erscheinungsbildes und epidemiologischer Überlegungen erfolgen. Häufigste Komplikation ist die respiratorische Insuffizienz bis hin zum akuten Lungenversagen (ARDS). Zeichnen sich die damit notwendigen Beatmungsstrategien als nicht zielführend ab, sollte Kontakt zu einem Zentrum mit der Option zur ECMO hergestellt werden.
Acknowledgments
Danksagung
Herrn Dr. P.A. Bürkle, betriebsärztlicher Dienst, Wieland Werke Ulm AG, für die zur Verfügung gestellten Vorschriften betreffend Personenschutz beim Umgang mit biologischen Arbeitsstoffen unter spezieller Berücksichtigung der neuen Influenza-A-H1N1-Pandemie 2009.
Interessenkonflikt
Die Autoren geben an, dass kein Interessenkonflikt besteht.
Literatur
- 1.Abdel-Ghafar N Engl J Med. 2008;358:261. doi: 10.1056/NEJMra0707279. [DOI] [PubMed] [Google Scholar]
- 2.Agarwal AJR Am J Roentgenol. 2009;193:1488. doi: 10.2214/AJR.09.3599. [DOI] [PubMed] [Google Scholar]
- 3.Birnkrant N Engl J Med. 2009;361:2204. doi: 10.1056/NEJMp0910479. [DOI] [PubMed] [Google Scholar]
- 4.Bishop N Engl J Med. 2009;361:2591. doi: 10.1056/NEJMp0910445. [DOI] [PubMed] [Google Scholar]
- 5.Cohen BMJ. 2009;339:b5387. doi: 10.1136/bmj.b5387. [DOI] [PubMed] [Google Scholar]
- 6.Davies JAMA. 2009;302:1888. doi: 10.1001/jama.2009.1535. [DOI] [PubMed] [Google Scholar]
- 7.De Serres G, Rouleau I, Hamelin M et al (2009) Shedding of novel 2009 pandemic H1N1 (nH1N1) virus at one week post illness onset. In: 49th Conference on Antimicrobial Agents and Chemotherapy 2009. K1918a, San Francisco, CA, USA
- 8.Domínguez-Cherit JAMA. 2009;302:1880. doi: 10.1001/jama.2009.1536. [DOI] [PubMed] [Google Scholar]
- 9.Doshi BMJ. 2009;339:b5164. doi: 10.1136/bmj.b5164. [DOI] [PubMed] [Google Scholar]
- 10.Faix N Engl J Med. 2009;361:728. doi: 10.1056/NEJMc0904264. [DOI] [PubMed] [Google Scholar]
- 11.Fraser Science. 2009;324:1557. doi: 10.1126/science.1176062. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Garten Science. 2009;325:197. doi: 10.1126/science.1176225. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Greenberg N Engl J Med. 2009;361:2405. doi: 10.1056/NEJMoa0907413. [DOI] [PubMed] [Google Scholar]
- 14.Jefferson BMJ. 2009;339:b5106. doi: 10.1136/bmj.b5106. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Jefferson Cochrane Database Syst Rev. 2006;3:CD001265. doi: 10.1002/14651858.CD001265.pub2. [DOI] [PubMed] [Google Scholar]
- 16.Kaiser Arch Intern Med. 2003;163:1667. doi: 10.1001/archinte.163.14.1667. [DOI] [PubMed] [Google Scholar]
- 17.Kaisers U, Zwißler B, Rossaint R (2010) Neue pandemische A(H1N1)-Influenza – Sind unsere intensivmedizinischen Ressourcen ausreichend? Anaesthesist, doi s00101-009-1668-z [DOI] [PubMed]
- 18.Khazeni Ann Intern Med. 2009;151:829. doi: 10.1059/0003-4819-151-12-200912150-00157. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Kumar JAMA. 2009;302:1872. doi: 10.1001/jama.2009.1496. [DOI] [PubMed] [Google Scholar]
- 20.Lye D, Chow A, Tan A et al (2009) Oseltamivir therapy and viral shedding in pandemic (H1N1) 2009. In: 49th Conference on Antimicrobial Agents and Chemotherapy 2009. V1269c, San Francisco, CA, USA
- 21.Mai N Engl J Med. 2010;362:86. doi: 10.1056/NEJMc0910448. [DOI] [Google Scholar]
- 22.Morens JAMA. 2009;302:679. doi: 10.1001/jama.2009.1127. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Morens N Engl J Med. 2009;361:225. doi: 10.1056/NEJMp0904819. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Morens J Infect Dis. 2008;198:962. doi: 10.1086/591708. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Peek Lancet. 2009;374:1351. doi: 10.1016/S0140-6736(09)61069-2. [DOI] [PubMed] [Google Scholar]
- 26.Plennevaux Lancet. 2010;375:41. doi: 10.1016/S0140-6736(09)62026-2. [DOI] [PubMed] [Google Scholar]
- 27.Rello Crit Care. 2009;13:R148. doi: 10.1186/cc8044. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Schaberg Pneumologie. 2009;63:417. doi: 10.1055/s-0029-1214982. [DOI] [PubMed] [Google Scholar]
- 29.Smith JR, Ariano RE, Toovey S (2009) The use of antiviral agents for the management of severe influenza. Crit Care Med, doi 10.1097/CCM.0b013e3181c85229 [DOI] [PubMed]
- 30.Taylor PLoS ONE. 2008;3:e3410. doi: 10.1371/journal.pone.0003410. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Thorpe BMJ. 2009;339:b5094. doi: 10.1136/bmj.b5094. [DOI] [PubMed] [Google Scholar]
- 32.Treanor JAMA. 2000;283:1016. doi: 10.1001/jama.283.8.1016. [DOI] [PubMed] [Google Scholar]
- 33.Uyeki N Engl J Med. 2009;361:e114. doi: 10.1056/NEJMopv0911052. [DOI] [PubMed] [Google Scholar]
- 34.Webb N Engl J Med. 2009;361:1925. doi: 10.1056/NEJMoa0908481. [DOI] [PubMed] [Google Scholar]
- 35.Winzer Dtsch Arztebl. 2009;106:770. doi: 10.3238/arztebl.2009.0770. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Yang Science. 2009;326:729. doi: 10.1126/science.1177373. [DOI] [PMC free article] [PubMed] [Google Scholar]


