Zusammenfassung
Hintergrund
Es gibt nur wenige strukturierte klinische Erfahrungsberichte zum stationären Management einer saisonalen Influenzaepidemie.
Ziel
Die systematische Beschreibung eines Patientenkollektivs mit saisonaler Influenza an einem Universitätsklinikum zur Verbesserung von Risikostratifikation und klinischer Versorgung.
Methode
In der vorliegenden monozentrischen, retrospektiven Observationsstudie der Influenzasaison 2017/2018 am Universitätsklinikum Hamburg-Eppendorf wurden Patienten mit nachgewiesener Influenzainfektion erfasst.
Ergebnisse
24 % (n = 162/676) der Influenzaabstriche in der Notaufnahme waren positiv. Insgesamt wurde bei 255 Patienten (Median 66 Jahre) eine Influenzainfektion nachgewiesen (Influenza A: n = 79, Influenza B: n = 176); davon waren 27 (15,3 %) nosokomiale Infektionen. 179 (70,2 %) Patienten wurden stationär, davon 51 (20 %) intensivmedizinisch behandelt. Patienten mit Intensivaufenthalt hatten zum Zeitpunkt der Influenzadiagnose einen erhöhten CRP-Wert (69,5 mg/dl [SD 62,8] vs. 141,7 [SD 127,2] mg/dl) und häufiger Infiltrate im Röntgen/CT des Thorax (n = 43 [33,6 %] vs. n = 43 [84,3 %]). Eine antivirale Therapie mit Oseltamivir wurde bei 74 (29,0 %) Patienten durchgeführt. 11 (6,1 %) Patienten wurden mit extrakorporaler Membranoxygenierung (ECMO) behandelt. 23 (9,0 %) Patienten verstarben. Nur 4 der Verstorbenen waren (trivalent) geimpft und waren mit Influenza B infiziert.
Diskussion
Die strukturierte Nutzung von diagnostischen Tests (Influenza-PCR, Röntgen/CT-Thorax und CRP-Wert), antiviraler Therapie (Oseltamivir), gezieltem Management der Aufnahme- bzw. der intensivmedizinischen Kapazitäten sowie die Erhöhung der Impfquoten sind wichtig zur Verbesserung der Patientenversorgung und der Ressourcennutzung während saisonaler Grippeepidemien.
Zusatzmaterial online
Zusätzliche Informationen sind in der Online-Version dieses Artikels (10.1007/s00103-019-02976-0) enthalten.
Schlüsselwörter: Saisonale Influenza, Antivirale Therapie, ECMO, Influenzaimpfung, CRP-Wert
Abstract
Background
There are only few structured reports on inpatient management of a seasonal influenza epidemic.
Objectives
A systematic description of a seasonal influenza patient population at a German university hospital to improve risk stratification and clinical care.
Methods
In this monocentric, retrospective observational study of the 2017/2018 influenza season at the University Medical Center Hamburg-Eppendorf, patients with confirmed influenza infection were included.
Results
Of all influenza swabs performed in the emergency department, 24% (n = 162/676) were positive. A total of 255 patients (median age 66 years) had an influenza infection (influenza A n = 79, influenza B n = 176); 27 (15.3%) were nosocomial infections. Of the 179 (70.2%) patients that were hospitalized, 51 (20%) received intensive medical care. Patients with subsequent need for intensive care had an elevated CRP level (69.5 mg/dl [SD 62.8] vs. 141.7 [SD 127.2] mg/dl) at the time of influenza diagnosis and more frequent infiltrates in X‑ray/CT of the thorax (n = 43 [33.6%] vs. n = 43 [84.3%]). Antiviral therapy with oseltamivir was administered for 74 (29.0%) patients and 11 (6.1%) patients were treated with extracorporeal membrane oxygenation (ECMO). Of the 23 (9.0%) patients who died, only four of them had been vaccinated (trivalent). Those four had an influenza B infection.
Conclusion
The structured use of diagnostic tests (influenza PCR, X‑ray/CT chest and CRP) and antiviral therapy (oseltamivir) as well as targeted management of admission, intensive care capacities, and an increase in vaccination rates are important for improving patient care and optimizing the use of resources during seasonal influenza epidemics.
Keywords: Seasonal influenza, Antiviral therapy, ECMO, Influenza vaccination, CRP
Einleitung
Die saisonale Influenza ist eine akute, impfpräventable respiratorische Erkrankung, die durch das Influenzavirus (RNA, Orthomyxoviridae) verursacht wird [1]. Die Grippewelle der Saison 2017/2018 war die schwerste seit dem Jahr 2001 [2]. Etwa 65,0 % der nachgewiesenen Influenzainfektionen waren vom Influenza Typ B und gehörten fast ausschließlich der Yamagata-Linie an [2]. Die B‑Komponente des während der Influenzasaison überwiegend genutzten, trivalenten Influenzaimpfstoffes basierte auf der Victoria-Linie und bot daher keinen hinreichenden Schutz vor einer Infektion mit der Yamagata-Linie. In der Influenzasaison 2017/2018 wurden in Deutschland etwa 9.000.000 zusätzliche influenzabedingte Arztkonsultationen und 45.000 Hospitalisierungen berichtet. Neben den individuellen, ökonomischen sowie gesellschaftlichen Folgen bedeutete dies auch eine besondere Herausforderung für das deutsche Gesundheitssystem [3].
Die nationale Arbeitsgemeinschaft Influenza am Robert Koch-Institut (RKI) erarbeitet jährlich einen Bericht zur jeweiligen Influenzasaison und stellt kontinuierlich Daten zum Influenzageschehen in Deutschland bereit [2]. In der vorliegenden Arbeit wurden, mittels einer systematischen Beschreibung eines Patientenkollektivs mit saisonaler Influenza an einem deutschen Universitätsklinikum, schwere Verläufe, Todesfälle und damit assoziierte Charakteristika mit dem Ziel erfasst, die zukünftige Risikostratifikation zu optimieren und damit die Triage und Versorgung von Influenzapatienten insgesamt zu verbessern.
Methoden
Studienpopulation und Datenerhebung
In dieser retrospektiven, monozentrischen Observationsstudie wurden alle Patienten erfasst, die sich vom 25.12.2017 bis zum 08.04.2018 (RKI-Definition der Influenzasaison [2]) im Universitätsklinikum Hamburg-Eppendorf (UKE) vorgestellt haben und bei denen eine Influenzainfektion diagnostiziert wurde. Gynäkologische, pädiatrische und psychiatrische Patienten wurden nicht in die Studie eingeschlossen. Nach dem internen Standard des UKE wurde während der Influenzasaison bei jedem neu aufgenommenen Patienten, der sich mit Fieber oder Symptomen einer oberen Atemwegsinfektion vorstellte, ein pharyngaler Abstrich mit Influenza-PCR durchgeführt (Cepheid GeneXpert Xpress System, Sunnyvale, USA). Dieser Test ermöglicht eine zeitnahe Differenzierung zwischen Influenza Typ A und B sowie des RS-Virus [4].
Alle relevanten Informationen wurden strukturiert aus der elektronischen Krankenakte erhoben. Eventuelle Vorerkrankungen wurden durch Arztbriefe, Diagnoseschlüssel und Anamnesebögen erfasst. Bei Laborparametern (z. B. CRP-Wert) wurden die Werte zum Zeitpunkt der Influenzadiagnose erhoben. Der Schweregrad der Komorbiditäten wurde mittels des Charlson-Comorbidity-Index (CCI) erfasst, welcher anhand eines aus 19 Erkrankungen errechneten Punktwertes die Gesamtbelastung durch diese Erkrankungen ausdrückt. Zusätzlich und unabhängig vom Punktwert der jeweiligen Erkrankungen wird ab 50 Lebensjahren für jede weitere Lebensdekade 1 Punkt addiert, sodass sich mittels des CCI die 10-Jahres-Überlebensrate (10-JÜR) von Patienten einschätzen lässt [5]. Die Studie wurde bei der Ethik-Kommission der Ärztekammer-Hamburg angezeigt (WF-017/18).
Statistische Analysen
Die Analysen beschränken sich auf deskriptive Statistik (Häufigkeiten, Median, Mittelwert, Minimum, Maximum und Standardabweichung).
Ergebnisse
Während der Influenzasaison 2017/2018 wurden insgesamt 1786 Influenza-PCR-Untersuchungen am UKE durchgeführt und 255 Patienten mit einer Influenzainfektion diagnostiziert. Von diesen Patienten wiesen 79 (31 %) eine Infektion mit Influenza A auf und 176 (69 %) wurden mit Influenza B diagnostiziert.
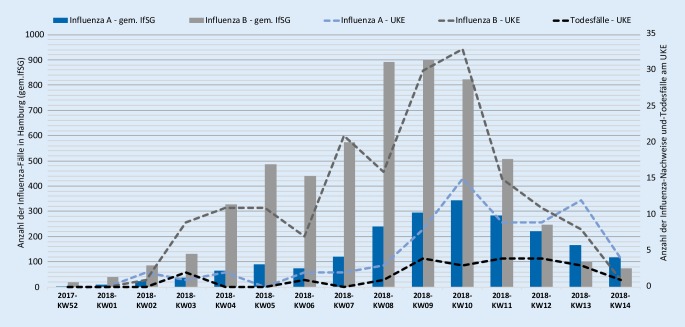
Während der Influenzasaison wurde am UKE bei durchschnittlich 17 Patienten pro Woche eine Influenzainfektion nachgewiesen. Dabei zeigte sich in der 9. und 10. Kalenderwoche eine deutliche Zunahme der diagnostizierten Influenzainfektionen. Abb. 1 zeigt das wöchentliche Aufkommen von Influenza A, Influenza B und Todesfällen am UKE im direkten Vergleich mit den im Rahmen der Meldepflicht nach dem Infektionsschutzgesetz (IfSG) an das RKI übermittelten Influenzafällen für gesamt Hamburg.
Das mediane Alter der Patienten betrug 66 Jahre (min.–max.: 19–97) und 112 (43,9 %) der Patienten waren weiblich. Zu den häufigsten Komorbiditäten zählten: Hypertonus (n = 131, 51,4 %), Diabetes mellitus Typ II (n = 52, 20,4 %), koronare Herzkrankheit (n = 48, 18,8 %) und chronisch obstruktive Lungenerkrankung (COPD) (n = 40, 15,7 %). Der mediane CCI betrug 4 (entsprechend einer 10-JÜR von 53 %). 101 (39,6 %) Patienten hatten Immunsuppressiva in ihrer Dauermedikation. Eine Pneumonie wurde bei 83 Patienten (32,5 %) diagnostiziert. 27 (15,3 %) Patienten infizierten sich nosokomial mit Influenza. Von diesen Patienten mussten 8 (4,5 %) intensivmedizinisch behandelt werden und 3 Patienten (1,7 % der Gesamtpopulation bzw. 11,1 % der nosokomial infizierten Patienten) verstarben.
Vergleich der Patientencharakteristika der ambulant versus stationär behandelten Patienten
Während der Influenzaepidemie (25.12.2017 bis 08.04.2018) wurden 676 Influenzaabstriche in der Zentralen Notaufnahme des UKE durchgeführt, von denen 162 (24 %) in der Influenza-PCR positiv waren. Von den insgesamt 255 – mit einer Influenzainfektion am UKE behandelten Patienten – wurden 24 (9,4 %) aus anderen Krankenhäusern übernommen, z. B. zur Beatmung mittels extrakorporaler Membranoxygenierung (ECMO-Therapie). 76 (29,8 %) Patienten, die in der Notaufnahme bzw. der angeschlossenen Aufnahmestation ambulant behandelt wurden, konnten im Median nach einem Tag (min.–max.: 1–5 Tage) entlassen werden. Keiner dieser 76 aus der Notaufnahme entlassenen Patienten musste zu einem späteren Zeitpunkt wieder aufgenommen werden.
Abb. 2 zeigt eine Gesamtübersicht der klinischen Behandlungspfade und die wichtigsten Patientencharakteristika der am UKE 2017/2018 behandelten Influenzapatienten. Die 76 nicht stationär aufgenommenen Patienten waren im Durchschnitt jünger (medianes Alter 59,5 versus 68 Jahre) und wiesen weniger Vorerkrankungen/Komorbiditäten (medianer CCI: 3) gegenüber den stationär aufgenommenen Patienten (medianer CCI 4) auf. Eine Pneumonie wurde seltener bei den ambulant in der Zentralen Notaufnahme (ZNA) behandelten Patienten diagnostiziert (n = 4 [5,3 %] vs. n = 79 [44,1 %]). Zum Zeitpunkt der Diagnose Influenza zeigten diese Patienten weniger häufig eine Leukozytose (n = 9 [11,8 %] vs. n = 53 [29,6 %]), einen im Mittel niedrigeren CRP-Wert (37,7 mg/dl versus 90,2 mg/dl) und erhielten seltener eine antimikrobielle Therapie (n = 23 [30,3 %] vs. n = 149 [83,2 %]).
Die 179 Patienten, die stationär am UKE behandelt wurden (Abb. 2), waren häufiger Empfänger einer immunsuppressiven Dauertherapie (n = 15 [19,7 %] vs. n = 86 [48,0 %]). Insgesamt wurden 80,6 % (n = 58/72) der Patienten mit chronischen Herzerkrankungen, 89,5 % (n = 34/38) der Patienten mit chronischen Nierenerkrankungen und 95,5 % (n = 2/22) der Patienten mit einem demenziellen Syndrom weiter stationär aufgenommen. Tabelle-S1 (Online-Supplement) vergleicht die Charakteristika der ambulant entlassenen und stationär aufgenommenen Patienten.
Charakteristika der auf der Normalstation behandelten Patienten
Von 179 stationär aufgenommenen Patienten wurden 128 (71,5 %) auf einer Normalstation betreut (Abb. 2). Im Median verbrachten diese Patienten 8 (min.–max.: 1–63) Tage im Krankenhaus. Charakteristika der auf Normalstation betreuten Patienten mit einer Verweildauer (VWD) von über 7 Tagen (n = 66 [51,6 %]) im Vergleich zu Patienten mit einer VWD unter 7 Tagen waren: Infiltrate im Röntgen/CT-Thorax (n = 27 [40,9 %] vs. n = 16 [25,8 %]), ein im Mittel erhöhter CRP-Wert (80,3 mg/dl [SD 58,99] versus 57,8 mg/dl [SD 53,35]), ein medianer CCI von 6 gegenüber 4 sowie aktive Neoplasien (n = 12 [18,2 %] vs. n = 2 [3,2 %]).
Vergleich der Charakteristika der stationär versus intensivmedizinisch versorgten Patienten
51 (28,5 %) der stationär behandelten Patienten (n = 179) wurden während des Aufenthaltes mindestens einmal auf der Intensivstation betreut (Abb. 2). Die mittlere Zeitspanne von Influenzadiagnose bis zur Verlegung auf die Intensivstation betrug 7,5 Tage. Im Median hielten sich die Patienten 7 Tage (min.–max.: 1–94 Tage) auf der Intensivstation auf. Tab. 1 beschreibt die Charakteristika der Patienten mit Intensivaufenthalt im Vergleich zu den Patienten, die sich durchgängig auf der Normalstation aufhielten. Eine mittlere Erhöhung des CRP-Werts bei Influenzadiagnose (69,5 mg/dl [SD 62,75] versus 141,7 mg/dl [SD 127,24]) war neben Infiltraten im Röntgen/CT des Thorax (n = 43 [33,6 %] vs. n = 43 [84,3 %]) wichtiges Charakteristikum für einen darauffolgenden Intensivaufenthalt. Tab. 2 beschreibt die Behandlungsergebnisse der intensivmedizinisch behandelten Patienten im Vergleich zu den Patienten, die auf der Normalstation behandelt wurden.
| Normalstation (n = 128) | Intensivstation (n = 51) | |
|---|---|---|
| Weiblich n (%) | 51 (39,8) | 22 (43,1) |
| Alter Median (Jahre) (min.–max.) | 70,5 (19–97) | 63 (37–87) |
| Alter >65 Jahre n (%) | 81 (63,3) | 25 (49,0) |
| Influenza A n (%) | 30 (23,4) | 23 (45,1) |
| Influenza B n (%) | 98 (76,6) | 28 (54,9) |
| Infiltrate im Röntgen-Thorax/CTan (%) | 43 (33,6) | 43 (84,3) |
| Nosokomiale Transmission n (%) | 19 (14,8) | 8 (15,7) |
| Leukozyten Mittelwert Tsd./µl (n, ± SD)a | 8,00 (127, 5,2) | 10,7 (50, 8) |
| Leukozyten >10 Tsd./µl n (%) | 29 (22,7) | 24 (47,1) |
| PCT Mittelwert (ng/ml) (n, ± SD)a | 2,1 (29, 8,5) | 66,9 (25, 238,3) |
| CRP Mittelwert (mg/dl) (n, ± SD)a | 69,5 (127, 62,8) | 141,7 (51, 127,2) |
| Albumin Mittelwert (g/l) (n, ± SD)a | 26,4 (12, 7,6) | 20,2 (37, 6) |
| Oseltamivir <48 h n. Symptombeginn n (%) | 7 (5,5) | 5 (9,8) |
| Immunsuppressive Medikation n (%) | 56 (43,8) | 30 (58,8) |
| Kortikosteroide n (%) | 46 (35,9) | 29 (56,9) |
| Charlson-Comorbidity-Index Median | 5 | 4 |
| 10-Jahres-Überlebensrate (%) | 24,09 | 45,89 |
| Solid Organ Transplantation n (%) | 17 (13,3) | 3 (5,9) |
| Hämatologische Erkrankung n (%) | 8 (6,3) | 7 (13,7) |
| Aktive Neoplasie n (%) | 14 (10,9) | 4 (7,8) |
| Chronische Herzerkrankung n (%) | 37 (28,9) | 21 (41,2) |
| Herzklappenvitium n (%) | 8 (6,3) | 7 (13,7) |
| Hypertonus n (%) | 76 (59,4) | 32 (62,7) |
| Chronische Nierenerkrankung n (%) | 25 (19,5) | 9 (17,6) |
| Chronische Atemwegserkrankung n (%) | 32 (25,0) | 19 (37,3) |
| Davon Exazerbation n (%) | 10 (7,8) | 6 (11,8) |
| Chronische Lebererkrankung n (%) | 16 (12,5) | 4 (7,8) |
| Diabetes mellitus n (%) | 28 (21,9) | 12 (23,5) |
| Demenz n (%) | 17 (13,3) | 4 (7,8) |
a±2 d zur Influenzadiagnostik
| Normalstation (n = 128) | Intensivstation (n = 51) | |
|---|---|---|
| Hospitalisierungsdauer Median (Tage) (min.–max.) | 8 (1–63) | 21 (1–149) |
| Verweildauer Intensivstation Median (Tage) (min.–max.) | – | 7 (1–94) |
| Davon künstliche Beatmung n (%) | 3 (2,3) | 43 (84,3) |
| Davon ECMO n (%) | 0 (0) | 11 (21,6) |
| Verstorben n (%) | 2 (1,6) | 21 (41,2) |
| Sepsis n (%) | 1 (0,8) | 29 (56,9) |
| ARDS n (%) | 0 (0) | 23 (45,1) |
| Akuter Harnwegsinfekt n (%) | 22 (17,2) | 13 (25,5) |
| Akutes Vorhofflimmern n (%) | 8 (6,3) | 13 (25,5) |
| Pneumonie n (%) | 39 (30,5) | 40 (78,4) |
| Antibiotikum erhalten n (%) | 99 (77,3) | 50 (98,0) |
Rolle der ECMO-Behandlung bei intensivstationär behandelten Patienten
Insgesamt wurden 11 Patienten mittels ECMO behandelt. Dies sind 21,6 % aller intensivmedizinisch behandelten Patienten. Sieben (63,6 %) dieser Patienten verstarben. Der Großteil dieser Patienten (n = 9; 81,8 %) wurde zur ECMO-Versorgung aus externen Krankenhäusern verlegt. Tab. 3 gibt einen Überblick über die Charakteristika der mittels ECMO behandelten Fälle.
| Fall | Diagnose | Altersgruppe | Verweildauer (davon Intensivstation) in Tagen | Aufnahmeart | Influenza | Tod | Oseltamivir | Procalcitonin (ng/ml) | CRP (mg/dl) | Leukozyten (Tsd./µl) |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | ARDS bei bakterieller Pneumonie septischer Schock (MSSA) | 65–70 | 10 (10) | Verlegung | Typ B | Ja | Ja | 128,52 | 447 | 20 |
| 2 | ARDS bei bakterieller Pneumonie, Sepsis (Staphylococcus epidermidis) | 50–55 | 28 (28) | Verlegung | Typ A | Nein | Ja | – | 359 | 3,5 |
| 3 | ARDS, invasive pulmonale Aspergillose, Sepsis (ohne Erregernachweis) | 55–60 | 41 (41) | Verlegung | Typ B | Ja | Nein | 0,9 | 268 | 21,9 |
| 4 | ARDS bei bakterieller Pneumonie, pulmonale Aspergillose im Verlauf | 50–55 | 50 (50) | Verlegung | Typ A | Ja | Nein | – | 99 | 6,7 |
| 5 | ARDS bei bakterieller Pneumonie, septischer Schock (Enterococcus faecium), abdominelles Kompartmentsyndrom (mediane Notfalllaparotomie) | 55–60 | 25 (25) | Verlegung | Typ A | Ja | Nein | – | 99 | 21,8 |
| 6 | ARDS, Mesenterialischämie | 60–65 | 35 (35) | Verlegung | Typ A | Ja | Nein | 0,59 | 42 | 13,4 |
| 7 | ARDS, disseminierte Parenchymblutung mit Zeichen der Einklemmung | 65–70 | 21 (21) | ZNA | Typ A | Ja | Nein | 10,45 | 372 | 28,4 |
| 8 | ARDS bei bakterieller Pneumonie, septischer Schock (multiresistenter Pseudomonas aeruginosa), Z. n. schwerem ARDS | 55–60 | 48 (48) | Verlegung | Typ A | Ja | Nein | 1,77 | 219 | 10,7 |
| 9 | ARDS bei bakterieller Pneumonie (Staphylococcus aureus und Pseudomonas aeruginosa), sekundäre Aspergillose der Lunge | 50–55 | 45 (45) | Verlegung | Typ A | Nein | Nein | – | 142 | 12,2 |
| 10 | ARDS bei bakterieller Pneumonie (MSSA), Sepsis (Acinetobacter baumannii) | 55–60 | 140 (140) | Verlegung | Typ B | Nein | Ja | 1199,4 | 421 | 3,5 |
| 11 | ARDS bei bakterieller Pneumonie mit Pleuraempyem, schweres Antikörper-Mangelsyndrom | 55–60 | 58 (58) | Verlegung | Typ A | Nein | Nein | – | 414 | 7,2 |
Schwerer Verlauf der Influenza-A-Infektionen
Patienten mit Influenza-A-Infektion (n = 79, 31,0 %) wurden im Vergleich zu Patienten mit Influenza-B-Infektion (n = 176, 69,0 %) häufiger auf der Intensivstation behandelt (n = 23 [29,1 %] vs. n = 28 [15,9 %]), häufiger maschinell beatmet (n = 21 [26,6 %] vs. n = 26 [14,8 %]), zeigten häufiger ein Acute Respiratory Distress Syndrome (ARDS; n = 13 [16,5 %] vs. n = 10 [5,7 %]), eine Sepsis (n = 16 [20,3 %] vs. n = 14 [8 %]) und wurden häufiger einer ECMO-Behandlung zugeführt (n = 8 [10,1 %] vs. n = 3 [1,7 %]).
Influenzabedingte Todesfälle
23 (12,8 %) Patienten, die aufgrund einer Influenzainfektion am UKE 2017/2018 stationär behandelt worden sind, verstarben (Tab. 4). In allen Fällen erwies sich die vorangegangene Influenzainfektion als unmittelbare oder mittelbare Todesursache. Zehn (41,7 %) der verstorbenen Patienten waren zuvor aus anderen Krankenhäusern übernommen worden (v. a. geplante Verlegung zur ECMO-Behandlung). Nur 4 (17,4 %) der verstorbenen Patienten waren aktuell gegen Influenza geimpft worden. Diese 4 Patienten hatten jeweils den trivalenten Impfstoff erhalten und verstarben an einer Infektion mit Influenza Typ B. 21 der 23 Todesfälle (91,3 %) betrafen intensivmedizinisch behandelte Patienten. Diese Patienten waren im Median 66 (min.–max.: 47–87) Jahre alt.
| Alter | Influenza | Influenzaimpfung | Todesursache (nach Sterbebrief) | Wichtige Vorerkrankung | Verweildauer Intensivstation (Tage) | Beatmung | CCI (erwartetes 10-JÜR, %) |
|---|---|---|---|---|---|---|---|
| 45–50 | Typ A | Keine |
ARDS, Pneumonie mit pulmonaler Aspergillose, septischer Schock mit Multiorganversagen Positiver Erregernachweis: Blutkultur: Staphylococcus pettenkoferi |
Diabetes mellitus Typ 2, Adipositas per magna (BMI 58), Hypothyreose | 2 | Invasiv/frustrane ECMO-Anlage | 1 (95,9) |
| 55–60 | Typ B | Keine |
ARDS, Sepsis bei invasiver pulmonaler Aspergillose und HSV-1-Pneumonie, hämorrhagische Gastritis, persistierende Hyperbilirubinämie Positiver Erregernachweis: BAL: pulmonale Aspergillose (Kultur, Histologie und Galaktomannantest); HSV-1-PCR |
Diabetes mellitus Typ 1 | 41 | Invasiv/ECMO | 2 (90,2) |
| 50–55 | Typ A | Keine |
ARDS bei Pneumonie und Sepsis bei pulmonaler Aspergillose mit beidseitigem Pneumothorax, paroxysmales Vorhofflimmern, sakraler Dekubitus Grad 3–4 Positiver Erregernachweis: BAL: Influenza-A-PCR; Aspergillus-PCR; HSV-1-PCR; CMV-PCR; Aspergillusantigen Zentrale Venenkatheterspitze: Staphylococcus epidermidis; Vancomycin-resistente Enterokokken (Enterococcus faecium) Blutkultur: Mycobacterium avium; Staphylococcus epidermidis |
Myasthenia gravis, erworbenes IgM-Mangelsyndrom, Z. n. Thymektomie | 50 | Invasiv/ECMO | 2 (90,2) |
| 55–60 | Typ A | Keine |
ARDS bei Pneumonie, septischer Schock mit abdominellem Kompartmentsyndrom (mediane Notfalllaparotomie), akutes Nierenversagen Positiver Erregernachweis: BAL: HSV-1-PCR Blutkultur: Enterococcus faecium |
Asthma bronchiale, Post-Polio-Syndrom (Skoliose, Z. n. Stabspondylodese und Thoraxmagen), Adipositas | 25 | Invasiv/ECMO | 2 (90,2) |
| 55–60 | Typ B | Trivalent |
Bakterielle Pneumonie mit Sepsis, infektiöse Endokarditis, akutes Leber- und Nierenversagen im septischen Schock Positiver Erregernachweis: BAL: HSV-1-PCR Blutkultur: Staphylococcus epidermidis |
Polyarthritis rheumatica mit sekundärem Sjögren-Syndrom, chronischer Osteomyelitis bei Z. n. Unterschenkelamputation und chronischer eitriger Bursitis olecrani, chronische Peritonitis | 77 | Invasiv | 2 (90,2) |
| 55–60 | Typ A | Keine |
ARDS bei bakterieller Pneumonie mit protrahiertem septischen Schock (multiresistenter Pseudomonas aeruginosa), akutes Nierenversagen, paroxysmales Vorhofflimmern, V. a. HIT Positiver Erregernachweis: BAL: Kultur: multiresistenter Pseudomonas aeruginosa Blutkultur: Staphylococcus caprae |
COPD | 48 | Invasiv/ECMO | 2 (90,2) |
| 50–55 | Typ B | Keine | ARDS bei atypischer Pneumonie unter Immunsuppression | Rezidiv eines multiplen Myeloms, allogene Stammzelltransplantation | 9 | Invasiv | 3 (77,5) |
| 65–70 | Typ A | Keine | Septischer Schock und Multiorganversagen, pulmonale Aspergillose | Vorhofflimmern, Asthma bronchiale | 13 | Invasiv | 3 (77,5) |
| 60–65 | Typ A | Keine | ARDS bei bakterieller Pneumonie mit Sepsis, pulmonale Aspergillose | Periphere arterielle Verschlusskrankheit, aktuell Wundheilungsstörung nach Bypass-OP | 1 | Invasiv | 3 (77,5) |
| 65–70 | Typ A | Keine | ARDS, disseminierte Parenchymblutung mit Zeichen der Einklemmung | Dialysepflichtige Niereninsuffizienz | 21 | Invasiv/ECMO | 4 (53,4) |
| 65–70 | Typ B | Trivalent | ARDS, palliatives Vorgehen (keine Intensivtherapie) | IgG-Mangelsyndrom, chronisch lymphatische B‑Zell-Leukämie | Normalstation | Keine | 4 (53,4) |
| 65–70 | Typ B | Keine | ARDS, bakterielle Pneumonie (MSSA) mit Sepsis, akutes Nierenversagen | Sarkoidose Typ 2, Asthma bronchiale, Diabetes mellitus Typ 2 | 10 | Invasiv/ECMO | 5 (21,4) |
| 75–80 | Typ B | Keine | AECOPD Gold IV, kardiale Dekompensation, zweimalige Reanimation | Vorhofflimmern, Herzinsuffizienz, COPD | 1 | Invasiv | 5 (21,4) |
| 60–65 | Typ A | Keine | ARDS, Mesenterialischämie | Koronare Herzkrankheit, COPD | 35 | Invasiv/ECMO | 5 (21,4) |
| 75–80 | Typ B | Keine | Sepsis, septische Myokardiopathie, pulmonale Aspergillose | Diffus großzelliges B‑Zell-Lymphom | 7 | Invasiv | 6 (2,3) |
| 90–95 | Typ B | Keine | Influenza, palliatives Vorgehen (keine Intensivtherapie) | M. Bechterew | Normalstation | Keine | 6 (2,3) |
| 75–80 | Typ A | Keine | Pneumonie – palliatives Vorgehen | Progrediente akute myeloische Leukämie bei Myelofibrose | 34 | Invasiv | 6 (2,3) |
| 80–85 | Typ B | Keine | Bakterielle Pneumonie mit Sepsis, palliatives Vorgehen (keine invasive Beatmung, Dialyse, Reanimation) | Vorhofflimmern, AV-Block 3°, Demenz | 3 | Nichtinvasiv | 6 (2,25) |
| 85–90 | Typ B | Keine | Bakterielle Pneumonie mit Sepsis, kardiale Insuffizienz bei septischer Kardiomyopathie | M. Bechterew, Hypertonus, koronare Herzkrankheit, Vorhofflimmern, vaskuläre Demenz, Normaldruckhydrozephalus, Hemiparese, terminale Niereninsuffizienz | 1 | Invasiv | 7 (0,01) |
| 70–75 | Typ B | Trivalent | ARDS, septischer Schock mit Multiorganversagen | Kryptogene Leberzirrhose, COPD Gold IV | 7 | Invasiv | 7 (0,01) |
| 85–90 | Typ B | Keine | Bakterielle Pneumonie mit Sepsis mit Multiorganversagen, kardiale Dekompensation bei Mitral- und Trikuspidalinsuffizienz | Mitral- und Trikuspidalinsuffizienz, Vorhofflimmern, myelodysplastisches Syndrom, COPD Gold IV, Diabetes mellitus Typ 2 | 3 | Invasiv | 9 (0,0) |
| 75–80 | Typ B | Trivalent | Sepsis (Enterococcus faecalis), hypertensives Lungenödem und kardiogener Schock | Terminale Niereninsuffizienz, koronare Herzkrankheit, Vorhofflimmern, Diabetes mellitus Typ 2, exazerbierte COPD, vaskuläre Demenz | 1 | Invasiv | 11 (0,00) |
| 70–75 | Typ B | Keine | Influenzapneumonie, CMV-Bakteriämie, palliatives Vorgehen (keine invasive Beatmung, Dialyse, Reanimation) | Z. n. zweimaliger allogener Stammzelltransplantation und Graft versus Host Disease | 5 | Keine | 12 (0,0) |
Im Vergleich zu nichtverstorbenen Patienten waren die CRP-Werte zum Zeitpunkt der Influenzadiagnose höher (nichtverstorbene Patienten: 80,3 mg/dl, verstorbene Patienten: 156,4 mg/dl). Eine Behandlung mit Kortikosteroiden war bei Verstorbenen häufiger (n = 14 von 23, 60,8 %) als bei den übrigen stationär behandelten Patienten (n = 60/163, 39,1 %) zu finden. Die Tabelle-S2 (Online-Supplement) vergleicht diejenigen intensivmedizinisch behandelten Patienten, die ihre Influenzainfektion überlebten, mit denjenigen, welche an ihr verstarben.
Therapie mit Oseltamivir
Bei 74 von 255 (29,0 %) Patienten wurde eine antivirale Therapie mit Oseltamivir initiiert. Dabei erhielten nur 12 (15,8 %) Patienten das Medikament innerhalb des empfohlenen Zeitraumes (48 h nach Symptombeginn). Alle Patienten, die das Medikament rechtzeitig erhielten, hatten sich nosokomial infiziert. Im Median wurde die Therapie mit Oseltamivir 1,5 Tage (min.–max.: 0–43 Tage) nach Krankenhausaufnahme begonnen. 51 der 74 (68,9 %) mit Oseltamivir behandelten Patienten erhielten das Medikament innerhalb der ersten zwei Tage nach Krankenhausaufnahme. Patienten, die früh im Verlauf der Saison, d. h. im Januar (bzw. während der ersten 5 Wochen der Saison), mit Influenza diagnostiziert wurden, erhielten häufiger Oseltamivir (n = 17 (54,8 %) vs. n = 57 (25,4 %)).
Diskussion
Die zeitliche Verteilung des Patientenaufkommens (Abb. 1) spiegelt die publizierten Daten des Berichts zur Epidemiologie der Influenza in der Saison 2017/2018 des Robert Koch-Institutes wider [2]. Die Anzahl der über einen Zeitraum von 15 Wochen stationär aufgenommenen Patienten mit Influenza (n = 179) war, bezogen auf die gesamte Bettenkapazität des UKE (n = 1738), relativ gering.
Allerdings wurden 28,8 % der Patienten (n = 51) zum Teil wochenlang intensivmedizinisch behandelt (Bettenkapazität der Intensivstationen n = 146). Unsere Erfahrungswerte haben gezeigt, dass hier eine besonders gezielte Koordination und ein intensiviertes Management der Kapazitäten erfolgen muss, um die Routineversorgung nicht zu gefährden. Vor diesem Hintergrund sollte auch auf den Erfahrungen des deutschen ARDS-Netzwerks mit webbasierten Kapazitätserfassungssystemen in der ECMO-Therapie aufgebaut werden, die während der Influenzapandemie im Sommer 2009 gesammelt wurden [6].
Anhand des etablierten „CRB-65-Scores“ lässt sich die Notwendigkeit einer stationären Aufnahme bei einer ambulant erworbenen Pneumonie abschätzen. Bis dato mangelt es an einer vergleichbaren Möglichkeit zur Einschätzung der Notwendigkeit einer stationären Aufnahme im Falle einer Influenzainfektion [7]. Die sicher (d. h. ohne spätere Wiederaufnahme) ambulant entlassenen Patienten wiesen einen niedrigeren Komorbiditätsindex (CCI) auf. Zusätzlich erwiesen sich ein deutlich erhöhter CRP-Wert und radiologisch nachgewiesene pulmonale Infiltrate zum Zeitpunkt der Influenzadiagnose als Charakteristika, die das Risiko für die Notwendigkeit einer intensivmedizinischen Behandlung erhöhten. Da fast alle Patienten, welche auf der Intensivstation behandelt wurden, beatmet werden mussten (n = 43, 84,3 %), ist nicht davon auszugehen, dass diese Charakteristika lediglich Ausdruck subjektiver Triagekriterien für eine Aufnahme auf die Intensivstation waren, sondern den besonders schweren Krankheitsgrad dieser Patienten widerspiegelten. Dementsprechend sollten diese Befunde – neben eventuellen Vorerkrankungen und der klinischen Einschätzung – früh in die Triageentscheidung einfließen. Der Stellenwert des CRP-Wertes zeigte sich auch in einer anderen retrospektiven Studie, in der der wichtigste Risikoprädiktor zur Vorhersage von schweren Verläufen von (H1N1-)Influenza mit mechanischer Beatmung ein erhöhter CRP-Wert war [8]. Eine weitere Studie konnte zeigen, dass die Kombination aus pSO2 ≥94 % und einem CRP-Wert von unter 50 mg/dl einen sicheren Prädiktor zur Entlassung eines Patienten mit (pandemischer) Influenza darstellt [9]. Hier werden weitere (prospektive) Studien zur Entwicklung einfacher Risikostratifikationsscores und Cut-off-Werte (z. B. für den CRP-Wert) für Notaufnahmen und Arztpraxen benötigt. Eine sich daraus ableitende, praktische Konsequenz zur systematischen Risikoeinschätzung könnte der Einsatz von strukturierten Influenzaaufnahmebögen darstellen.
Bei einem großen Anteil von auf Normalstation behandelten Patienten wurden Blutkulturen (76,5 %) oder Trachealsekrete (31,8 %) gewonnen. Diese Proben sind wichtige Elemente zum Nachweis bakterieller Superinfektionen und ein maßgeblicher Baustein des diagnostischen Algorithmus während einer Influenzaepidemie [10]. Das diagnostische Vorgehen sollte sich hierbei an der S3-Leitlinie (Update 2016) zur ambulant erworbenen Pneumonie orientieren, sodass bei jedem hospitalisierten und mit Influenza diagnostizierten Patienten Blutkulturen und respiratorisches Material (Sputum oder Trachealsekrete) gewonnen werden [11].
Oseltamivir wurde nur selten (29,0 %) – und in der Mehrzahl der Fälle zu spät –, d. h. über 48 h nach Symptombeginn eingesetzt. Ein großer Teil der nosokomial infizierten Patienten erhielt Oseltamivir (n = 12/27; 44,4 %). Ein frühzeitiger Einsatz innerhalb der ersten 48 h hätte die Krankheitsdauer vieler Patienten wahrscheinlich um fast einen Tag und die Anzahl der Komplikationen signifikant reduzieren können [12, 13]. Der Symptombeginn wurde in der aktuellen Studie nicht für alle Patienten systematisch erfasst, sodass nicht sicher differenziert werden kann, ob die rechtzeitige antivirale Therapie aufgrund eines Versäumnisses oder aber wegen einer Überschreitung des Zeitfensters von 48 h unterblieben ist.
28,8 % aller stationär aufgenommenen Patienten mussten im Verlauf intensivmedizinisch behandelt werden, von denen knapp die Hälfte verstarb. Dies ist zum einen auf die hohe Komorbidität (z. B. Immunsuppression) des Patientenkollektivs zurückzuführen oder stand im Zusammenhang mit der Verlegung von Patienten aus umliegenden Krankenhäusern zur ECMO-Therapie an das UKE [14]. Der überproportional hohe Anteil von Patienten mit einer Influenzainfektion Typ A auf der Intensivstation spiegelt vermutlich die in der Literatur beschriebene höhere Mortalität und Morbidität dieses Influenzatyps wider [1]. Mit 12,9 % liegt der Anteil der Verstorbenen unter den influenzabedingt stationär versorgten Patienten am UKE nur gering über einem Anteil von 8,0 %, welcher in einer multizentrischen Auswertung von vier deutschen Universitätskrankenhäusern in der Saison 2014/2015 berichtet worden ist [15].
Die damalige Auswertung beschrieb zudem einen Anteil an nosokomialen Infektionen von 17 % [15]. Mit einem Anteil von nosokomialen Infektionen von 15,3 % liegt der Prozentsatz am UKE in der Influenzasaison 2017/2018 auf einem vergleichbar hohen Niveau. Dass bei diesem Patientenkollektiv mit großer Vorsicht vorgegangen werden sollte, da diese Patienten aufgrund von Vorerkrankungen im besonderen Maße für einen schweren bzw. tödlichen Krankheitsverlauf gefährdet sind, verdeutlichen die 8 (29,6 % der nosokomialen Infektionen) intensivmedizinisch behandelten und die 3 (11,1 % der nosokomialen Infektionen) verstorbenen Patienten dieser Gruppe. Zu diesen Vorsichtsmaßnahmen sollte sowohl eine rechtzeitige Diagnostik neu aufgetretener fieberhafter Atemwegsinfekte im stationären Bereich und die frühzeitige Isolation als auch eine Chemoprophylaxe besonders gefährdeter Mitpatienten in einer Grippeepidemie gehören [16]. Ein Faktor, der zu dieser hohen Anzahl nosokomialer Infektionen geführt haben mag, ist die weiterhin niedrige Impfquote beim medizinischen Personal, welche die nosokomiale Übertragung des Virus begünstigt [17]. Somit werden wirksame Strategien zur Erhöhung der Impfquote benötigt [18].
Lediglich 4 der 23 verstorbenen Patienten waren – trotz Impfindikation gemäß der Empfehlung der Ständigen Impfkommission (STIKO) – gegen Influenza geimpft. Zudem handelte es sich bei diesen Impfungen jeweils lediglich um den trivalenten Impfstoff, welcher keinen Schutz gegen die überwiegend vorkommende Typ-B-Linie „Yamagata“ bot. Diese 4 Patienten verstarben an Influenza Typ B. Allerdings erfolgte keine diagnostische Differenzierung bezüglich der B‑Linien, sodass nicht sicher beurteilt werden kann, ob es sich um ein Impfversagen oder eine Infektion mit der Influenza-B-Linie „Yamagata“ handelte. Seit der Saison 2018/2019 wird der tetravalente Impfstoff von der STIKO empfohlen und auch von der gesetzlichen Krankenversicherung bezahlt [19].
Eine Schwäche der vorliegenden Arbeit ergibt sich aus dem Fehlen z. T. wichtiger Informationen wie dem Impfstatus und den Symptomen der Patienten bei Vorstellung am UKE. Diese Informationen wurden von den aufnehmenden/behandelnden Ärzten bzw. dem Pflegepersonal nicht systematisch erfasst und konnten somit nicht ausgewertet werden. Gynäkologische, pädiatrische und psychiatrische Patienten (n = 20) konnten aufgrund nicht verfügbarer Daten bei anderen klinikinternen Behandlungswegen nicht eingeschlossen werden. Darüber hinaus lassen die Fallzahl sowie der retrospektive Charakter der vorliegenden monozentrischen Arbeit nur eine eingeschränkte Verallgemeinerung zu.
Im Unterschied zum amerikanischen Raum (Infectious Disease Society of America) gibt es zurzeit keine spezifische deutschsprachige Leitlinie zur stationären Behandlung von Patienten mit saisonaler Influenza [10]. Für die letzte Influenzapandemie im Jahr 2009 wurde eine Stellungnahme der Deutschen Gesellschaft für Pneumologie und Beatmungsmedizin veröffentlicht, die konkrete Handlungsempfehlungen enthält [7, 20]. Die Ausarbeitung von nationalen Leitlinien zum Management der saisonalen Influenza im stationären Sektor, basierend auf einer systematischen Würdigung der vorhandenen Evidenz, sollte eine Priorität der zuständigen Gremien und Fachgesellschaften sein. Darüber hinaus verweisen wir auf die Standard Operating Procedure (SOP) des UKE zum stationären Management einer saisonalen Influenzaepidemie.
Die vorliegenden Daten und lokal erarbeiteten Empfehlungen stellen für Kollegen in der stationären Krankenversorgung eine Diskussionsgrundlage dar. Diese kann im Rahmen zukünftiger Influenzaepidemien zu einer Verbesserung bei der Organisation der stationären Versorgung und der individuellen Patientenbetreuung führen.
Caption Electronic Supplementary Material
Acknowledgments
Danksagung
Wir bedanken uns bei den Patienten und betreuenden Hausärzten, den Kollegen der zentralen Notaufnahme, den Kollegen des Zentrums für Innere Medizin, den Kollegen der Klinik für Intensivmedizin und den Kollegen der medizinischen Mikrobiologie – PD Dr. med. Marc Lütgehetmann und Prof. Dr. med. Holger Rohde – für die freundliche Unterstützung. Die vorliegende Arbeit ist Teil der medizinischen Dissertation von Marc van der Meirschen.
Abkürzungen
- AE
Akute rezidivierende Exazerbationen
- ARDS
Acute Respiratory Distress Syndrome
- BAL
Bronchoalveoläre Lavage
- CCI
Charlson-Comorbidity-Index
- COPD
Chronic Obstructive Pulmonary Disease
- CRP
C-reaktives Protein
- CT
Computertomographie
- ECMO
Extrakorporale Membranoxygenierung
- HIT
Heparininduzierte Thrombozytopenie
- IfSG
Infektionsschutzgesetz
- MSSA
Methicillinsensibler Staphylococcus aureus
- PCR
Polymerase Chain Reaction
- PCT
Procalcitonin
- pSO2
Partielle oder funktionelle Sauerstoffsättigung
- RKI
Robert Koch-Institut
- RNA
Ribonukleinsäure
- RS-Virus
Humanes respiratorisches Synzytialvirus
- SD
Standard Deviation
- SOP
Standard Operating Procedure
- STIKO
Ständige Impfkommission
- UKE
Universitätsklinikum Hamburg-Eppendorf
- VWD
Verweildauer
- ZNA
Zentrale Notaufnahme
- 10-JÜR
10-Jahres-Überlebensrate
Einhaltung ethischer Richtlinien
Interessenkonflikt
C. Kraef, M. van der Meirschen, D. Wichmann, M. Kutza, C. Restemeyer, M.M. Addo, A.W. Lohse, S. Schmiedel, S. Kluge und J. Schulze zur Wiesch geben an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Studien gelten die jeweils dort angegebenen ethischen Richtlinien.
Footnotes
Die Autoren C. Kraef und M. v. d. Meirschen haben zu gleichen Teilen beigetragen.
Literatur
- 1.Paules C, Subbarao K. Influenza. Lancet. 2017;390:697–708. doi: 10.1016/S0140-6736(17)30129-0. [DOI] [PubMed] [Google Scholar]
- 2.RKI . Bericht zur Epidemiologie der Influenza in Deutschland, Saison 2017/18. Berlin: Robert Koch-Institut; 2018. [Google Scholar]
- 3.Federici C, Cavazza M, Costa F, Jommi C. Health care costs of influenza-related episodes in high income countries: A systematic review. PLoS ONE. 2018;13:e0202787. doi: 10.1371/journal.pone.0202787. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cohen DM, Kline J, May LS, et al. Accurate PCR detection of influenza A/B and respiratory Syncytial viruses by use of Cepheid Xpert flu+RSV Xpress assay in point-of-care settings: comparison to Prodesse proflu. J Clin Microbiol. 2018;56:e01237. doi: 10.1128/JCM.01237-17. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Charlson ME, Pompei P, Ales KL, MacKenzie CR. A new method of classifying prognostic comorbidity in longitudinal studies: development and validation. J Chronic Dis. 1987;40:373–383. doi: 10.1016/0021-9681(87)90171-8. [DOI] [PubMed] [Google Scholar]
- 6.Weber-Carstens S, Goldmann A, Quintel M, et al. Extracorporeal lung support in H1N1 provoked acute respiratory failure: the experience of the German ARDS Network. Dtsch. Arztebl. Int. 2013;110:543–549. doi: 10.3238/arztebl.2013.0543. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Schaberg T, Bauer T, Dalhoff K, et al. Management of a new influenza A/H1N1 virus pandemic within the hospital. Statement of the German Society of Pneumology. Pneumologie. 2010;64:124–129. doi: 10.1055/s-0029-1243862. [DOI] [PubMed] [Google Scholar]
- 8.Zimmerman O, Rogowski O, Aviram G, et al. C-reactive protein serum levels as an early predictor of outcome in patients with pandemic H1N1 influenza A virus infection. Bmc Infect Dis. 2010;10:288. doi: 10.1186/1471-2334-10-288. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Morton B, Nweze K, O’Connor J, et al. Oxygen exchange and C‑reactive protein predict safe discharge in patients with H1N1 influenza. QJM. 2017;110:227–232. doi: 10.1093/qjmed/hcw176. [DOI] [PubMed] [Google Scholar]
- 10.Harper SA, Bradley JS, Englund JA, et al. Seasonal influenza in adults and children—diagnosis, treatment, Chemoprophylaxis, and institutional outbreak management: clinical practice guidelines of the infectious diseases society of america. Clin Infect Dis. 2009;48:1003–1032. doi: 10.1086/598513. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Ärzteblatt . Ambulant erworbene Pneumonie bei Erwachsenen. 2017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Dobson J, Whitley RJ, Pocock S, Monto AS. Oseltamivir treatment for influenza in adults: a meta-analysis of randomised controlled trials. Lancet. 2015;385:1729–1737. doi: 10.1016/S0140-6736(14)62449-1. [DOI] [PubMed] [Google Scholar]
- 13.Ärzteblatt . Antivirale Arzneimittel bei saisonaler und pandemischer Influenza. 2016. [Google Scholar]
- 14.Campbell A, Rodin R, Kropp R, et al. Risk of severe outcomes among patients admitted to hospital with pandemic (H1N1) influenza. Can Med Assoc J. 2010;182:349–355. doi: 10.1503/cmaj.091823. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Heyd R, Eis-Hübinger AM, Berger A, et al. Retrospective analysis of clinical and virological parameters of influenza cases at four university hospitals in Germany, 2015. Infection. 2017;45:349–354. doi: 10.1007/s15010-017-1008-1. [DOI] [PubMed] [Google Scholar]
- 16.Ärzteblatt . Hochkontagiöse Erreger: Ansteckung effektiv vermeiden. 2018. [Google Scholar]
- 17.Ärzteblatt . Influenza: Ärzte und Pfleger sind selten geimpft. 2018. [Google Scholar]
- 18.Hagemeister MH, Stock NK, Ludwig T, et al. Self-reported influenza vaccination rates and attitudes towards vaccination among health care workers: results of a survey in a German university hospital. Public Health. 2018;154:102–109. doi: 10.1016/j.puhe.2017.10.027. [DOI] [PubMed] [Google Scholar]
- 19.Gemeinsamer Bundesausschuss . Vierfach-Impfstoff für die nächste Grippesaison verbindlich. 2018. [Google Scholar]
- 20.Schaberg T, Bauer T, Dalhoff K, et al. Management of a new influenza A/H1N1 virus pandemic within the hospital: statement of the German Society of Pneumology. Pneumologie. 2009;63:417–425. doi: 10.1055/s-0029-1214982. [DOI] [PubMed] [Google Scholar]
Associated Data
This section collects any data citations, data availability statements, or supplementary materials included in this article.