Zusammenfassung
Klinik
Ein 40 jähriger, desorientierter, HIV- und Hepatitis B positiver Patient wurde mit 40,3°C vorstellig. Es lag eine Sinustachykardie (160/min) mit arterieller Hypotonie (70/60 mmHg) vor.
Untersuchungen
Erhöhte Entzündungsparameter, Retentionsparameter, sowie Proteinurie, Thrombopenie. CD4+ T-Helferzahl: 320/µl (32 %), HIV RNA: < 40 Kopien/ml, Hepatitis B DNA: 20800 Kopien/ml. Hantavirus-Serologie (Immunfluoreszenz-Antikörper-Test): 1:2048; Serotyp Puumala.
Verlauf
Es wurde eine leitliniengerechte Sepsistherapie und Antibiose mit Piperacillin und Tazobactam eingeleitet. Bei respiratorischer Insuffizienz bei Acute Respiratory Distress Syndrome (ARDS ) mit bipulmonalem Infiltrat erfolgte die Intubation. Bei akutem intrarenalem Nierenversagen bei Aufnahme bestand keine Indikation zur Dialysebehandlung.
Bei paralleler HIV Erkrankung und Hepatitis B wurde eine antiretrovirale Therapie begonnen. Bei Fieber, konjunktivalen und petechialen Einblutungen sowie subkutanen Einblutungen und Nierenversagen wurde eine Hantavirus-Infektion (Serotyp Puumala) festgestellt.
Schlussfolgerung
Anhand dieses Fallberichtes zeigt sich der potentiell fulminante Verlauf der Puumala Infektion. Dies ist untypisch für diese oft blande verlaufende Infektionskrankheit.
Schlüsselwörter: Hantavirus, Sepsis, ARDS, Akutes Nierenversagen, HIV
Summary
Symptoms
A 40 year old, disoriented, HIV- and Hepatitis B positive male patient was admitted with 40.3 °C. Clinically he presented a sinustachycardia (160/min) and hypotension (70/60 mmHg).
Investigations/Diagnosis
Laboratory analyses showed elevated infection parameters, azotemia, proteinuria and thrombopenia. CD4+T-helper cells: 320/µl (32 %), HIV RNA: < 40 copies/ml, Hepatitis B DNA: 20800 copies/ml. Hantavirus serology (immunofluorescence antibody assay): 1:2048; serotype Puumala.
Treatment/Course
An early-goal-directed therapy and antibiotic treatment with Piperacillin and Tazobactam was initiated. The patient developed a bipulmonal infiltrate and an acute respiratory distress syndrome (ARDS ) requiring tracheal intubation, as well as a triad of fever, renal failure and profound hemorrhagic symptoms. This led to the diagnosis of the Puumala infection. Due to the parallel HIV- and Hepatits B infection an antiretroviral therapy was initiated.
Conclusion
In summary the Puumala infection bears the potential for a severe multi-organ failure, which is not typical for this usually benign infection.
Keywords: Hantavirus, Sepsis, ARDS, Acute Renal failure
Einleitung
Hantaviren gehören zur Familie der Bunyaviridae. Sie sind in zahlreiche Arten unterteilt von denen einige humanpathogen sind. Ein häufiger Vertreter ist das Puumalavirus, das in Mitteleuropa in einigen Regionen einschließlich Bayerns endemisch ist. Die Infektion mit dem Puumala Virus hat gewöhnlich einen milden klinischen Verlauf.
Das Erregerreservoir sind infizierte Nagetiere, die das Virus über Urin, Speichel und Kot ausscheiden. Eine Übertragung auf den Menschen erfolgt durch Inhalation erregerhaltigen Staubes.
Klinisch unterscheidet man verschiedene Verlaufsformen der Puumalainfektion, das hämorrhagische Fieber mit renalem Syndrom (HFRS) und das Hantavirus-assoziierte kardiopulmonale Syndrom (HPS).
Oft geht die Puumalainfektion mit HFRS, einher was typischerweise Fieber, Flanken- und Adominalschmerzen, Übelkeit und Erbrechen, konjunktivale Einblutungen und Kopfschmerzen verursachen kann [1]. Typischerweise entsteht im Verlauf eine Nierenbeteiligung, die bis zum akuten Nierenversagen führen kann. Es wurden jedoch auch schwere Verläufe mit hämorrhagischen Manifestationen, konjunktivalen Einblutungen, Schock, Enzephalopathie und pulmonaler Beteiligung beschrieben [2, 3]. Oft ist der klinische Verlauf jedoch milde, und die Symptomatik kann leicht mit der einer Influenza verwechselt werden.
Der Verdacht, die Infektion oder der Todesfall durch Hantaviren sind meldepflichtig. In Österreich konnte 1999 bei 1215 Patienten eine Seroprävalenz von 1,2 % für Antikörper gegen Puumala und Hantaan Viren nachgewiesen werden [4]. Im Zeitraum von 2000 bis 2007 konnten in Graz 19 Fälle einer Nephropathia epidemica bei Patienten im Alter von 6 bis 18 Jahren festgestellt werden [5].
Bereits 1996 wurden auch Endemiegebiete für Hantavirus-Infektionen in Süddeutschland beschrieben [2, 6]. Als Risikogruppen für Hantavirus-Infektionen sind Personen mit Kontakt zum Erregerreservoir wie z.B. Jäger, Soldaten oder Camper zu nennen [2].
Die Seroprävalenz in Deutschland reicht je nach Region bis über 5 % [3, 7]. 2007 wurden deutschlandweit die meisten Fälle verzeichnet (n = 1688 Fälle). Etwa 75 % entfielen dabei auf Männer im Alter von 20 bis 59 Jahren [8]. Der Erkrankungsgipfel findet sich im Sommer [2]. Im Frühjahr 2010 wurde ein starker Anstieg der Hantavirus-Infektionen in Deutschland verzeichnet [8]. Die Gründe für die unterschiedlichen Meldezahlen/Jahr sind Schwankungen der Nagerpopulation und deren Durchseuchung mit dem Virus [8]. Außerdem kann aufgrund der unspezifischen influenza-artigen Symptomatik der Erkrankung von einer großen Dunkelziffer ausgegangen werden.
Wir präsentieren den Fall eines wachen, ansprechbaren, aber zunehmend desorientierten, immunsupprimierten Patienten mit klinischen Zeichen sowohl eines HFRS als auch eines vermutlichen HPS.
Kasuistik
Anamnese
Ein 40 jähriger, HIV-positiver Patient mit Hepatitis B wurde in der Ambulanz vorstellig. Er klagte über einen akuten, hochfieberhaften Infekt mit Gliederschmerzen und zunehmender Abgeschlagenheit.
Körperlicher Untersuchungsbefund bei Aufnahme
Der ca. 70 kg schwere und 165 cm große Patient war wach, ansprechbar und zunehmend desorientiert. Die Körpertemperatur betrug 40,3 °C bei einer Sinustachykardie von 160/min und arterieller Hypotonie von 70/60 mmHg. Die körperliche Untersuchung und das EKG waren unauffällig. Es wurde eine Sepsis unklarer Ätiologie diagnostiziert.
Klinisch-chemische Untersuchungen
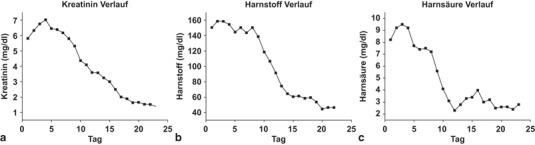
Die Laborwerte sind aus den Abb. 1 und 2 ersichtlich. Zusätzlich auffällig waren bei Aufnahme eine Hyponatriämie (120 mmol/l) und eine Thrombopenie (24000 Thrombozyten/µl).

Therapie und Verlauf
Bei rapider klinischer Verschlechterung erfolgte die Verlegung auf die Intensivstation und Durchführung einer leitliniengerechte Sepsistherapie. Der zentral-venöse Druck wurde mittels intravenöser Volumentherapie auf 8–12 mmHg sowie der Hämatokrit mittels Blutkonserven auf > 30 % eingestellt. Die zentralvenöse Sättigung betrug im Mittel 75 % und die Blutglucose ca. 160 mg/dl. Zusätzlich wurde mehrfach Material zur Keimasservation gewonnen und danach eine empirische antibiotische Therapie mit Piperacillin und Tazobactam durchgeführt. Es wurden umfangreiche serologisch-virologische Untersuchungen zum Nachweis oder zur Verlaufsbeurteilung einer Hepatitis B-, HHV 8-, HIV-, EBV-, Echoviren-, VZV-, CMV-, HSV und HCV-Infektion, sowie serologisch-mikrobiologische Untersuchungen auf Tuberkulose, atypische Mykobakteriosen, Legionellen, Chlamydien, Pneumocystits carinii, Treponema pallidum, Chlamydien und insbesondere Leptospiren aufgrund der Überlappung der klinischer Symptomatik durchgeführt. Insbesondere die Leptospirenantikörper waren negativ.
Sämtliche Untersuchungsergebnisse waren bis auf den Nachweis der bekannten HIV und Hepatitis B-Virusinfektion negativ. Die Enzephalopathie unklarer Ätiologie verstärkte sich und die Liquorpunktion zeigte ein erhöhtes Eiweiß (2557 mg/l). Die initiale Bildgebung mit Thorax-Röntgenbild sowie CCT zeigte keinen pathologischen Befund.
In der transösophagealen Echokardiographie ergab sich kein Anhalt für eine Endokarditis. Eine Sonographie des Abdomens und mehrfache Urinkulturen ergaben ebenfalls keinen Anhalt für einen infektiösen Fokus. Laborchemisch gelang lediglich der Nachweis der bekannten HIV- und Hepatitis B-Virusinfektion. Bei einer CD4+T-Helferzahl von 320/µl (32 %) und einer HIV RNA von weniger als 40 Kopien/ml wurde zunächst eine antiretrovirale Therapie mit Tenofovir aufgrund der parallel bestehenden Hepatitis und HIV Infektionen begonnen. Die Viruslast der bekannten Hepatitis B betrug 20800 Kopien/ml.
Seit Aufnahme bestanden erhöhte Retentionsparameter bei polyurischem, intrarenal bedingten akutem Nierenversagen mit Proteinurie. Aufgrund suffizienter Eigenausscheidung bestand jedoch keine Indikation zur Dialyse.
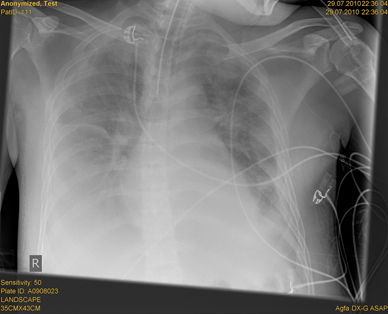
Schließlich wurde der Patient bei ARDS am 3. Krankheitstag respiratorisch insuffizient und intubiert. Im Röntgenbild des Thorax zeigten sich nun bipulmonale Infiltrate (siehe Abb. 3). Es wurde eine druckkontrollierte, lungenprotektive Beatmung mit Tidalvolumina von 6 ml/kg Körpergewicht, ausreichend hohem PEEP und inspiratorischer Druckbegrenzung bei 30 cmH2O durchgeführt.
Das Weaning mit intermittierender CPAP/ASB Beatmung ermöglichte die Extubation nach 6 Beatmungstagen.
Bei Verbesserung der Labor- und Kreislaufparameter (Abb. 1 und 2) sowie des klinischen Zustandes bot der desorientierte Patient eine Konjunktivitis mit ausgeprägten konjunktivalen Einblutungen, Petechien, vereinzelten subkutanen Einblutungen am Körperstamm, eine Thrombopenie von 24.000 Thrombozyten/µl und das bekannte intrarenale Nierenversagen. Fremdanamnestisch wurde nun berichtet, dass der Patient häufig in Mülltonnen stöbert und ein Kontakt zu potentiell infektiösem Mäuseurin möglich wäre. Daraufhin konnte am 7. Krankheitstag die Hantavirus-Infektion mit dem Serotyp Puumala mittels positivem IgG und positivem IgM sowie Immunfluoreszenztest bestätigt werden (Immunfluoreszenz-Antikörper-Test, Titer: 1:2048; Serotyp Puumala, Firma: Progen, Heidelberg, Deutschland). Der IgG Test wurde im Verlauf des stationären Aufenthaltes am 24. Krankheitstag wiederholt und wies ebenfalls ein positives Ergebnis auf. Es wurde seitens der Hantavirus-Infektion keine spezifische Therapie durchgeführt. Der Patient konnte später bei klinischer Verbesserung auf die Normalstation verlegt und nach Eskalation der antiretroviralen Therapie auf Efavirenz, Emtricitabin und Tenofovir bei paralleler Hepatitis und HIV-Infektion nach 26 Tagen kardiopulmonal stabil bei fast normalisierten Retentionsparametern ohne neurologisches Defizit nach Hause entlassen werden. Es wurde zu einer Verhaltensprävention geraten, um eine erneute Exposition mit potentiell erregerhaltigem Mäuseurin-Aerosol zu vermeiden. Die antiretrovirale Therapie wurde mit Efavirenz, Emtricitabin und Tenofovir Fumarat fortgeführt und der Patient verblieb in ambulanter Betreuung der HIV Ambulanz.
Diskussion
Retrospektiv bietet die Infektion mit dem Puumala-Serotyp des Hantavirus eine mögliche Erklärung für die grippeähnlichen Prodromi, das Nierenversagen, die Thrombopenie und die Konjunktivitis mit hämorrhagischen Manifestationen im Sinne von ausgeprägten konjunktivalen Einblutungen, kutanen Petechien und vereinzelten subkutanen Einblutungen im Sinne eines HFRS [2, 9, 10]. Hämorrhagische Symptome sind bei Puumala Infektion selten [2, 11, 12]. Die unspezifische klinische Symptomatik bei Aufnahme mit Fieber, Thrombopenie und Tachykardie allein hätte schon als Hinweis auf eine Hantavirus-Infektion im Übergang von der febrilen in die hypotensive Phase gedeutet werden können.
Das klinische Bild des später aufgetretenen ARDS bei fehlendem Nachweis eines bakteriellen Erregers ist auch durch eine fulminante Puumala-Infektion bei HPS denkbar [2, 9, 10], dies wird bei ca. 20 % der Patienten mit Puumala Infektion beschrieben [2, 11, 13].
Die Enzephalopathie unklarer Ätiologie mit Desorientierung ist ebenfalls durch eine Hantavirus-Infektion erklärbar.
Diese Hypothesen unterstützen der niedrige Serumharnstoff (Abb. 2b), der fehlende Erregernachweis trotz multipler Blutkulturen, das unauffällige CCT sowie der unspezifische Befund der Liquorpunktion und der echokardiographische Ausschluss einer Endokarditis. Der Nachweis des Hantavirus IgG am Tag 7 erscheint relativ früh. In der Literatur werden jedoch positive IgG Nachweise bei Hantavirus Patienten mit HPS bereits ab dem 4. Tag beschrieben [14]. Die frische Infektion wurde mittels positivem IgM belegt. Prinzipiell kann ein Nierenversagen auch durch die Gabe von Tenofovir hervorgerufen werden, der zeitliche Zusammenhang mit dem akutem Nierenversagen welches bereits bei Aufnahme, also vor der Gabe des Medikaments bestand, ist hierfür jedoch nicht gegeben. Auch die im Verlauf fallenden Retentionsparameter unter Tenefovirgabe sprechen dagegen. Der Schockindex und das erhöhte Procalcitonin des Patienten ist prinzipiell auch durch eine bakterielle Sepsis zu erklären, jedoch macht der fehlende Nachweis eines Erregers trotz multipler Blutkulturen und Liquoruntersuchungen vor und nach Beginn der antibiotischer Behandlung sowie die nachgewiesene Hantavirus-Infektion mit dem Serotyp Puumala diese Erklärung unwahrscheinlich. Kritisch anzuführen ist, dass einige mögliche Erreger wie Leptospiren innerhalb der hier aufgetretenen Zeitperiode nur schwer nachweisbar sind. Es ist zusätzlich unklar, wieso bei dem Patienten ein erhöhtes Procalcitonin vorgelegen hat. In der Literatur werden Fälle von Patienten mit Hantavirus-Infektion und erhöhten Procalcitoninwerten insbesondere bei hämorrhagischen Symptomen beschrieben [15].
Der erfreuliche klinische Verlauf der Erkrankung mit niedriger Mortalität ist ebenfalls typisch für die Puumala-Infektion [2], obwohl tödliche Verläufe dokumentiert wurden [16, 17]. Der Fall dieses kritisch erkrankten, immunsupprimierten Patienten gibt klinische Hinweise für die potentielle Virulenz der sonst oft asymptomatischen Puumala Infektion. In der Literatur werden ähnliche Verläufe in einzelnen Fallbeschreibungen aus anderen geographischen Gebieten mit Schock, Nierenversagen und insbesondere zerebraler Beteiligung mit Enzephalopathie und in einem Fall auch gastrointestinaler Symptomatik mit Ileus beschrieben [18, 19, 20]. Unser Patient bot jedoch die ungewöhnliche Kombination aus HFRS sowie möglichen Symptomen eines HPS bei Puumala-Infektion. Diese Symptomatik ist sehr selten und bis dato bisher in der Literatur nicht ausreichend beschrieben. Zusätzlich litt unser Patient gleichzeitig an einer HIV Erkrankung. Nach unserem besten Wissen existieren keine Fallbeschreibungen über den Verlauf der Puumala Infektion bei immunsupprimierten HIV Patienten mit begleitender Hepatitis B.
Die Diagnose der Puumala Infektion darf aufgrund des hier geschilderten Verlaufs bei immunsupprimierten Patienten daher nicht unterschätzt werden.
Es ist kritisch anzumerken, dass keine Hantavirus RNA isoliert wurde.
Retrospektiv stellten das konservative Procedere mit der Durchführung der Sepsistherapie nach den S −2k Leitlinien mit early-goal-directed therapy [21] und lungenprotektiver Beatmung die entscheidenden Behandlungsschritte dar.
Interessenkonflikt
Es besteht kein Interessenkonflikt.
Literatur
- 1.Vapalahti O, Mustonen J, Lundkvist A. Hantavirus infections in Europe. Lancet Infect Dis. 2003;3(10):653–61. doi: 10.1016/S1473-3099(03)00774-6. [DOI] [PubMed] [Google Scholar]
- 2.Heyman P, Vaheri A, Lundkvist A. Hantavirus infections in Europe: from virus carriers to a major public-health problem. Expert Rev Anti Infect Ther. 2009;7(2):205–17. doi: 10.1586/14787210.7.2.205. [DOI] [PubMed] [Google Scholar]
- 3.Mosshammer D, Reichert E, Reichert W. Nephropathia epidemica caused by Puumala hantavirus infection: a case report from the outpatient sector. Dtsch Med Wochenschr. 135(50):2518–22. [DOI] [PubMed]
- 4.Aberle SW, Lehner P, Ecker M. Nephropathia epidemica and Puumala virus in Austria. Eur J Clin Microbiol Infect Dis. 1999;18(7):467–72. doi: 10.1007/s100960050325. [DOI] [PubMed] [Google Scholar]
- 5.Acham-Roschitz B, Aberle SW, Pirker N, et al. Nephropathia epidemica (puumala virus infection) in Austrian children. Pediatr Infect Dis J. 29(9):874–6. [DOI] [PubMed]
- 6.Clement J, Underwood P, Ward D. Hantavirus outbreak during military manoeuvres in Germany. Lancet. 1996;347(8997):336. doi: 10.1016/S0140-6736(96)90519-X. [DOI] [PubMed] [Google Scholar]
- 7.Ulrich R, Meisel H, Schutt M, et al. Prevalence of hantavirus infections in Germany. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2004;47(7):661–70. doi: 10.1007/s00103-004-0858-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Faber MS, Ulrich RG, Frank C, et al. Steep rise in notified hantavirus infections in Germany, April 2010. Euro Surveill. 15(20). [PubMed]
- 9.Mertz GJ, Hjelle BL, Bryan RT. Hantavirus infection. Adv Intern Med. 1997;42:369–421. [PubMed] [Google Scholar]
- 10.Schmaljohn C, Hjelle B. Hantaviruses: a global disease problem. Emerg Infect Dis. 1997;3(2):95–104. doi: 10.3201/eid0302.970202. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Mustonen J, Brummer-Korvenkontio M, Hedman K. Nephropathia epidemica in Finland: a retrospective study of 126 cases. Scand J Infect Dis. 1994;26(1):7–13. doi: 10.3109/00365549409008583. [DOI] [PubMed] [Google Scholar]
- 12.Vaheri A, Vapalahti O, Plyusnin A. How to diagnose hantavirus infections and detect them in rodents and insectivores. Rev Med Virol. 2008;18(4):277–88. doi: 10.1002/rmv.581. [DOI] [PubMed] [Google Scholar]
- 13.Linderholm M, Sandstrom T, Rinnstrom O. Impaired pulmonary function in patients with hemorrhagic fever with renal syndrome. Clin Infect Dis. 1997;25(5):1084–9. doi: 10.1086/516093. [DOI] [PubMed] [Google Scholar]
- 14.Bharadwaj M, Nofchissey R, Goade D. Humoral immune responses in the hantavirus cardiopulmonary syndrome. J Infect Dis. 2000;182(1):43–8. doi: 10.1086/315657. [DOI] [PubMed] [Google Scholar]
- 15.Jereb M, Lunacek NK, Kotar T, et al. Procalcitonin in hantavirus infections. Scand J Clin Lab Invest. 71(4):287–91. [DOI] [PubMed]
- 16.Hautala T, Sironen T, Vapalahti O, et al. Hypophyseal hemorrhage and panhypopituitarism during puumala virus infection: magnetic resonance imaging and detection of viral antigen in the hypophysis. Clin Infect Dis. 2002;35(1):96–101. doi: 10.1086/340859. [DOI] [PubMed] [Google Scholar]
- 17.Linderholm M, Settergren B, Ahlm C. A Swedish fatal case of nephropathia epidemica. Scand J Infect Dis. 1991;23(4):501–2. doi: 10.3109/00365549109075100. [DOI] [PubMed] [Google Scholar]
- 18.Krause R, Aberle S, Haberl R. Puumala virus infection with acute disseminated encephalomyelitis and multiorgan failure. Emerg Infect Dis. 2003;9(5):603–5. doi: 10.3201/eid0905.020405. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Forslund T, Saltevo J, Anttinen J. Complications of nephropathia epidemica: three cases. J Intern Med. 1992;232(1):87–90. doi: 10.1111/j.1365-2796.1992.tb00555.x. [DOI] [PubMed] [Google Scholar]
- 20.Toivanen AL, Valanne L, Tatlisumak T. Acute disseminated encephalomyelitis following nephropathia epidemica. Acta Neurol Scand. 2002;105(4):333–6. doi: 10.1034/j.1600-0404.2002.1c168.x. [DOI] [PubMed] [Google Scholar]
- 21.Reinhart K, Brunkhorst FM, Bone HG, et al. Prevention, diagnosis, therapy and follow-up care of sepsis: 1st revision of S–2k guidelines of the German sepsis society (Deutsche Sepsis-Gesellschaft e. V. (DSG)) and the German interdisciplinary association of intensive care and emergency medicine (Deutsche Interdisziplinare Vereinigung fur Intensiv- und Notfallmedizin (DIVI)). Ger Med Sci. 8:Doc14. [DOI] [PMC free article] [PubMed]


