Resumen
La faringoamigdalitis aguda (FAA) es una de las enfermedades más comunes en la infancia. La etiología más frecuente es vírica. Entre las causas bacterianas, el principal agente responsable es Streptococcus pyogenes o estreptococo beta hemolítico del grupo A (EbhGA). Las escalas de valoración clínica son una buena ayuda para seleccionar a qué niños se deben practicar las técnicas de detección rápida de antígeno estreptocócico (TDR) y/o el cultivo de muestras faringoamigdalares. Sin su empleo, se tiende al sobrediagnóstico de FAA estreptocócica, con la consiguiente prescripción innecesaria de antibióticos, muchas veces de amplio espectro. Los objetivos del tratamiento son: acelerar la resolución de los síntomas, reducir el tiempo de contagio y prevenir las complicaciones supurativas locales y no supurativas. Idealmente, solo deben tratarse los casos confirmados. En caso de no disponibilidad de la TDR, o en algunos casos, ante un resultado negativo, se recomienda obtener cultivo e iniciar tratamiento a la espera de los resultados, solo si la sospecha clínica es alta. Los antibióticos de elección para el tratamiento de la FAA estreptocócica son penicilina y amoxicilina. Amoxicilina-clavulánico no está indicado de forma empírica en la infección aguda. Los macrólidos tampoco son un tratamiento de primera elección; su uso debe reservarse para pacientes con alergia inmediata a penicilina o como tratamiento erradicador, en los casos indicados. Es urgente y prioritario en nuestro país adecuar la prescripción de antibióticos a la evidencia científica disponible.
Palabras clave: Adecuación, Antibióticos, Diagnóstico, Documento de consenso, Estreptococo, Faringoamigdalitis, Niños, Streptococcus pyogenes, Tratamiento, Uso racional
Abstract
Acute tonsillopharyngitis is one of the most common childhood diseases. Viruses are the most frequent origin. Group A Streptococcus (Streptococcus pyogenes) is the main bacterial cause. A culture or a rapid antigen-detection test of a throat-swab specimen should only be done on the basis of clinical scores, in order to avoid over-diagnosis of bacterial origin and unnecessary antibiotic prescription. The objectives of treatment are: the reduction of symptoms, reduce the contagious period, and prevent local suppurative and systemic complications. Ideally, only confirmed cases should receive antibiotics. If there is no possibility to perform a rapid antigen-detection test, or in some cases if the result is negative, it is recommended to perform a culture and, if there is high suspicious index, to prescribe antibiotics. Penicillin is the treatment of choice, although amoxicillin is also accepted as the first option. Amoxicillin/clavulanate is not indicated in any case as empirical treatment. Macrolides are not a first choice antibiotic, and should be reserved for those patients with immediate penicillin allergy reaction or for the treatment of streptococcal carriers. It is of primordial importance to adapt the prescribing of antibiotics to the scientific evidence.
Keywords: Antibiotics, Appropriateness, Children, Consensus document, Diagnosis, Rational use, Streptococcus pyogenes, Tonsillopharyngitis, Treatment
Definición y etiología
La faringoamigdalitis aguda (FAA) se define como un proceso agudo febril, de origen generalmente infeccioso, que cursa con inflamación de las mucosas de la faringe y/o las amígdalas faríngeas, en las que se puede objetivar la presencia de eritema, edema, exudados, úlceras o vesículas1, 2, 3, 4.
La etiología más frecuente es vírica1, 2, 3, 4, 5, 6. Entre las bacterias, la principal es Streptococcus pyogenes o estreptococo betahemolítico del grupo A (EbhGA), responsable del 30-40% de las FAA que se observan en niños de 3-13 años, del 5-10% en niños entre los 2 y 3 años y solo el 3-7% en menores de 2 años1, 2, 3, 4, 5, 6. Aunque ocurran, las FAA por EbhGA son muy raras en niños menores de 2 años, e insólitas en los menores de 18 meses. La mayoría son probablemente portadores de EbhGA que padecen una infección vírica del tracto respiratorio superior y no requieren tratamiento antibiótico1, 2, 3, 7. Se transmite por vía respiratoria a través de las gotas de saliva expelidas al toser, estornudar o hablar desde personas infectadas. También se han descrito brotes transmitidos por contaminación de los alimentos o el agua; por el contrario, los fómites no desempeñan un papel importante como fuente de contagio1, 2, 3.
La edad del niño, la estación del año y el área geográfica en la que vive influyen en el tipo de agente implicado. En la tabla 1 se muestran los microorganismos que pueden producir una FAA. En un 30% de los casos no se identifica ningún patógeno1, 2, 3, 7.
Tabla 1.
Causas infecciosas de faringoamigdalitis aguda
| Microorganismos | Síndrome o enfermedad Hallazgos clínicos y epidemiológicos |
Incidencia (en %) |
|---|---|---|
| Virus | ||
| Rinovirus | Resfriado común. Predominan en otoño y primavera | 20 |
| Coronavirus | Resfriado común. Predominan en invierno | ≥ 5 |
| Adenovirus | Fiebre faringoconjuntival. Predomina en verano | 5 |
| Virus herpes simple tipo 1 y 2 | Gingivoestomatitis (primoinfección): vesículas y úlceras superficiales en el paladar. Puede cursar con exudados faríngeos | 4 |
| Virus influenza | Gripe: fiebre, mialgias, cefalea, tos | 2 |
| Virus parainfluenza | Resfriado, crup | 2 |
| Virus Coxsackie A | Herpangina, enfermedad mano-pie-boca | < 1 |
| Virus de Epstein-Barr | Mononucleosis infecciosa. Los anticuerpos heterófilos generalmente no suelen ser positivos hasta la segunda semana de enfermedad, ni consistentemente positivos en menores de 4 años | < 1 |
| Citomegalovirus | Síndrome mononucleósico. A diferencia del causado por VEB: faringitis menos evidente y mayor elevación de transaminasas | < 1 |
| Virus de la inmunodeficiencia humana | Infección aguda primaria: fiebre, mialgias, artralgias, malestar general, exantema maculopapular no pruriginoso, que se sigue de linfadenopatía y ulceraciones mucosas sin exudado | < 1 |
| Bacterias | ||
| Estreptococo betahemolítico del grupo A | Faringitis, escarlatina | 15-30 |
| Estreptococo beta hemolítico grupos C y G | Faringitis. Serogrupos no reumatógenos | 5 |
| Anaerobios | Angina de Vincent (gingivoestomatitis necrotizante): encías muy inflamadas y dolorosas, con ulceras en las papilas interdentales, que sangran con facilidad. Se acompaña de fiebre, malestar general, halitosis y linfadenopatías | < 1 |
| Fusobacterium necrophorum | Síndrome de Lemierre (tromboflebitis séptica de la vena yugular interna): dolor, disfagia, tumefacción y rigidez de cuello | < 1 |
| Arcanobacterium haemolyticum | Faringitis, exantema escarlatiniforme (en superficie de extensión de los brazos). Más frecuente en adolescentes. Puede cursar con exudados faríngeos | < 1 |
| Neisseria gonorrhoeae | Faringitis | < 1 |
| Treponema pallidum | Sífilis secundaria | < 1 |
| Francisella tularensis | Tularemia faríngea. Consumo de carne poco cocinada de animales silvestres o agua contaminada | < 1 |
| Corynebacterium diphtheriae | Difteria. Puede cursar con exudados faríngeos | < 1 |
| Yersinia enterocolitica | Faringitis, enterocolitis. Puede cursar con exudados faríngeos | < 1 |
| Mycoplasma pneumoniae | Bronquitis, neumonía | < 1 |
| Chlamydophila pneumoniae | Bronquitis, neumonía | < 1 |
| Chlamydophila psittaci | Psitacosis | < 1 |
Clínica
En la mayoría de los casos, es difícil diferenciar, basándose en la clínica, entre etiología vírica y estreptocócica de FAA; no obstante, son orientadoras algunas características2, 7, que se reflejan en la tabla 2 .
Tabla 2.
Hallazgos clínicos y epidemiológicos según etiología
| Sugestivos de infección por EbhGA |
| Dolor de garganta de comienzo brusco |
| Odinofagia |
| Fiebre |
| Exantema escarlatiniforme |
| Cefalea |
| Náuseas, vómitos, dolor abdominal |
| Eritema o exudados faringoamigdalares |
| Petequias en el paladar blando |
| Pequeñas pápulas eritematosas y anulares, con centro pálido (lesiones «donuts»), en paladar blando y/o duro |
| Úvula roja y edematosa |
| Adenopatías cervicales anteriores, aumentadas de tamaño (> 1 cm) y dolorosas |
| Edad: 5-15 años |
| Presentación en invierno o comienzos de la primavera (en climas templados) |
| Historia de exposición a enfermo con FAA en las 2 semanas previas |
| Sugestivos de infección vírica |
| Conjuntivitis |
| Rinorrea |
| Afonía |
| Tos |
| Diarrea |
| Exantemas o enantemas característicos |
| Hepatoesplenomegalia |
| Adenopatías generalizadas |
EbhGA: estreptococo beta hemolítico del grupo A; FAA: faringoamigdalitis aguda.
Son sugestivos de origen estreptocócico el dolor de garganta de comienzo brusco, la fiebre, el malestar general y la cefalea; también lo son el dolor abdominal, las náuseas y los vómitos, especialmente en los niños más pequeños. La existencia de petequias en el paladar no es exclusiva de la FAA por EbhGA, pues también se han descrito en la rubéola y en las infecciones por herpes simple y virus de Epstein-Barr. Más específica es la presencia en el paladar blando y/o paladar duro de pequeñas pápulas eritematosas con centro pálido denominadas lesiones «donuts» y que solo se han señalado en la FAA por EbhGA1, 2, 3, 7. Por lo general, la infección es autolimitada aun sin tratamiento antibiótico; la fiebre remite en 3-5 días y el dolor de garganta en una semana, pero persiste el riesgo potencial de que se presenten complicaciones2.
En menores de 3 años, la FAA por EbhGA se manifiesta de un modo distinto de como lo hace en niños mayores. En lugar de un episodio agudo de faringitis, suelen presentar un comienzo más indolente, con inflamación faringoamigdalar, congestión y secreción nasal mucopurulenta persistente, fiebre (no elevada), adenopatía cervical anterior dolorosa y, a veces, lesiones de tipo impétigo en narinas. A este complejo de síntomas, que suele ser prolongado en el tiempo, se le conoce con el nombre de estreptococosis, fiebre estreptocócica o nasofaringitis estreptocócica, clínicamente difícil de distinguir de las infecciones virales, tan frecuentes en este grupo de edad2.
A cualquier edad, la presencia de conjuntivitis, rinorrea, afonía, tos y/o diarrea es un hallazgo sugestivo de un origen vírico de la infección1, 2, 3, 7, 8. También se pueden evidenciar, además de eritema e inflamación faringoamigdalar, aftas, vesículas o ulceraciones, o exudado de cuantía variable según el tipo de virus responsable. En las FAA por adenovirus, más frecuentes en menores de 3 años, el cuadro clínico típico se presenta con fiebre muy elevada, mayor de 39 °C, asociada a exudado amigdalar en un 50% de los casos y adenopatía cervical anterior, rinorrea, tos y/o conjuntivitis en un 15-25%. Debido a las características clínicas de este tipo de infección viral, capaz de mimetizar una FAA estreptocócica, es muy frecuente que el manejo terapéutico no sea adecuado. El test de detección rápida de adenovirus en exudado nasofaríngeo, en caso de estar disponible, puede ayudar a diferenciar este tipo de FAA y a evitar el uso innecesario de antibióticos8. La mononucleosis infecciosa, más frecuente en la adolescencia, cursa con fiebre, faringoamigdalitis y adenopatías dolorosas de predominio laterocervical. Cuando no se asocian signos sugerentes como hepatomegalia o esplenomegalia, es frecuente confundir esta entidad con la FAA estreptocócica y es también habitual el uso innecesario de antibióticos. La toma de antibióticos puede desencadenar un exantema maculopapular característico hasta en un 90% de los casos. Para realizar el diagnóstico diferencial es útil la realización de una analítica sanguínea; la hipertransaminema y la presencia de linfocitos activados son sugerentes de mononucleosis. Se debe confirmar la infección mediante la detección de anticuerpos heterófilos o test de Paul-Bunnell (monotest), más fiable en mayores de 4 años. En niños pequeños con monotest negativo es necesario realizar la serología específica del virus9, 10, 11.
Otra forma de presentación de la infección por EbhGA es la escarlatina. Si bien esta enfermedad se asocia, por lo común, con infecciones de la faringe, puede ser secundaria a infecciones estreptocócicas de la piel u otras localizaciones12. Es debida a cepas productoras de toxinas eritrogénicas, conocidas como superantígenos estreptocócicos, a las que el paciente no es inmune. Actualmente, es menos frecuente y virulenta que antaño, con una incidencia cíclica que depende de la circulación de las cepas toxigénicas y del estado inmunitario de la población. Cursa con exantema micropapuloso, más acentuado en los pliegues (signo de Pastia), lengua aframbuesada y descamación durante el periodo de convalecencia2. Aunque no es muy frecuente, la escarlatina puede ser recurrente13.
Complicaciones
Las complicaciones supurativas se presentan en el 1-2% de los episodios de FAA por EbhGA no tratados con antibiótico, o bien tras un tratamiento antibiótico inadecuado o no cumplimentado. Ocurren por afectación de las estructuras contiguas o de aquéllas en las que drenan; así, pueden presentarse: celulitis y absceso periamigdalino, absceso retrofaríngeo, otitis media aguda, sinusitis, mastoiditis y adenitis cervical supurativa1, 2.
La existencia de un dolor de garganta intenso, de predominio unilateral y que se acompaña de incapacidad para deglutir, debe orientar el diagnóstico hacia una posible complicación supurativa local, especialmente si los síntomas han progresado a lo largo de varios días. En el absceso periamigdalino es típico el desplazamiento de la úvula y de la amígdala afectada hacia la línea media y el trismo de intensidad variable. La infección en estos casos suele ser polimicrobiana, con la implicación de microorganismos anaerobios como Prevotella spp., Porfiromonas spp., Fusobacterium spp. y Peptostreptococcus spp.. No es fácil distinguir entre celulitis (o flemón) y absceso ya establecido. La instauración precoz de un tratamiento antibiótico intravenoso durante la fase inicial de la celulitis puede evitar la necesidad de drenaje quirúrgico, que es, en cualquier caso, el tratamiento de elección en el absceso ya formado1, 2, 3, 4.
Otras complicaciones supurativas mucho menos frecuentes son: meningitis, absceso cerebral, trombosis de los senos venosos intracraneales, neumonía estreptocócica y focos metastáticos por diseminación hematógena (artritis supurada, osteomielitis, absceso hepático, endocarditis)1, 2, 3, 4.
Entre las complicaciones no supurativas cabe citar la fiebre reumática aguda (FRA), la glomerulonefritis postestreptocócica (GMNPE), la artritis reactiva postestreptocócica, el eritema nodoso, la púrpura anafilactoide y el síndrome PANDAS (acrónimo del inglés pediatric autoinmune neuropsychiatric disorders associated with Streptococcus [síndrome neuropsiquiátrico autoinmunitario asociado a infección por estreptococo en la edad pediátrica])1, 2, 3, 4. La FRA es muy poco frecuente en los países desarrollados, donde la incidencia anual es inferior a 1 caso por cada 100.000 habitantes. En menores de 3 años es prácticamente inexistente antes de que haya madurado completamente su sistema inmunitario, pero se mantiene como la principal causa de enfermedad cardiaca adquirida en niños de países en desarrollo a cualquier edad7.
Orientación diagnóstica
La decisión primordial y también práctica ante una FAA es averiguar si está causada por el EbhGA. La anamnesis detallada, los datos epidemiológicos, los hallazgos de la exploración física y los resultados de las pruebas complementarias, cuando están indicadas, ayudan a diferenciar el origen de la infección. Sin el empleo de los estudios microbiológicos, dada la inespecificidad de los síntomas, se tiende al sobrediagnóstico de la FAA estreptocócica, con la consiguiente prescripción innecesaria de antibióticos1, 2. Los estudios de sensibilidad y especificidad sugieren que el diagnóstico solo mediante la clínica es erróneo en un 25-50% de los casos, por lo que debería basarse en pruebas objetivas que detecten el microorganismo14, 15, 16, 17. Estas pruebas se recomiendan en pacientes bien seleccionados, que reúnan criterios de infección estreptocócica probable y que no hayan recibido tratamiento antibiótico previo, evitándolas cuando se sospeche un origen vírico2, 7, 18, 19, 20. (Grado de Recomendación A, Nivel de Evidencia I, tal y como se refleja según el sistema de calificación de la Infectious Diseases Society of America y de la US Public Health Service en la tabla 3 ).
Tabla 3.
Sistema de calificación de la Infectious Diseases Society of America y de la US Public Health Service para establecer recomendaciones en guías clínicas
| Fuerza de la recomendación: |
| A Buena evidencia para sostener una recomendación a favor o en contra del uso |
| B Evidencia moderada para sostener una recomendación a favor o en contra del uso |
| C Poca evidencia para sostener una recomendación |
| Calidad de la evidencia |
| I Evidencia de uno o más ensayos controlados debidamente aleatorizados |
| II Evidencia de uno o más ensayos clínicos bien diseñados, sin aleatorización, de estudios analíticos con cohorte o controlados por caso (preferentemente de más de un centro), de series múltiples reiteradas o de resultados considerables de experimentos no controlados |
| III Evidencia de opiniones de autoridades respetadas basadas en experiencia clínica, estudios descriptivos o informes de comités de expertos |
Con el fin de facilitar el diagnóstico, se han propuesto varios sistemas o escalas de puntuación según las manifestaciones clínicas y datos epidemiológicos. Una de las más empleadas es la de McIsaac, basada en los criterios de Centor, pero ponderando la edad21, 22 (tabla 4 ). La probabilidad de un resultado positivo en las pruebas de diagnóstico microbiológico es ≤ 3% en los pacientes que no cumplen ninguno de los criterios clínicos, y de un 38-63% en los que reúnen 4 o 5 puntos2, 21, 22 (AI). La presencia de síntomas virales, aunque la puntuación en la escala sea mayor de dos puntos, anula la indicación de realizar pruebas microbiológicas. Este tipo de valoración clínica puede ser muy útil también en situaciones donde no es posible realizar el examen microbiológico, con la intención de reducir el uso innecesario de antibióticos2, 21, 22.
Tabla 4.
Criterios de McIsaac y actitud según resultado
| Criterios | Puntos |
|---|---|
| 1. Fiebre (> 38 °C) | 1 |
| 2. Hipertrofia o exudado amigdalar | 1 |
| 3. Adenopatía laterocervical anterior dolorosa | 1 |
| 4. Ausencia de tos | 1 |
| 5. Edad | |
| • 3-14 años | 1 |
| • > 15 años | 0 |
0-1 puntos: no estudio microbiológico (riesgo de infección por EbhGA: 2–6%).
2-3 puntos: estudio microbiológico y tratar sólo si es positivo (riesgo: 10–28%).
4-5 puntos: estudio microbiológico e iniciar tratamiento antibiótico, si se realiza cultivo, a la espera del resultado (riesgo: 38–63%).
EbhGA: estreptococo beta hemolítico del grupo A.
Existen dos tipos de pruebas complementarias para la detección del EbhGA: técnicas de detección rápida de antígeno estreptocócico (TDR) y cultivo de muestra faringoamigdalar. Ninguna de ellas diferencia de forma definitiva los pacientes con FAA estreptocócica verdadera de aquellos que padecen una infección viral y son portadores de EbhGA. Sin embargo, en pacientes que están bien seleccionados por los criterios clínicos y epidemiológicos sugerentes de infección estreptocócica, estas pruebas son el mejor argumento para la indicación o no de un tratamiento antibiótico1, 2, 3.
Para la obtención de la muestra faringoamigdalar, se deben frotar con el hisopo la pared posterior de la faringe y ambas amígdalas, incidiendo en las zonas más hiperémicas o con exudado. Debe realizarse utilizando un depresor, sin tocar la lengua, la úvula o cualquier otra parte de la boca, ni diluir con saliva, para evitar la contaminación de la muestra con flora saprofita del tracto respiratorio1, 2, 3. Algunos expertos han propuesto utilizar dos hisopos simultáneamente para mejorar la calidad y cantidad del inóculo23, si bien no existe suficiente evidencia científica como para recomendar esta actuación de rutina.
Las TDR se basan en la extracción ácida o enzimática del antígeno carbohidrato específico de la pared celular del EbhGA y en la posterior detección de este mediante anticuerpos específicos. La principal ventaja de las TDR es su rapidez, disponiendo del resultado en 10-20 min, lo que facilita la toma de decisiones. No son útiles para la identificación de estreptococos betahemolíticos grupos C y G. En pacientes bien seleccionados, con cierta experiencia en su realización, y tras una buena obtención de las muestras, las TDR tienen una elevada especificidad, próxima al 95%, y una sensibilidad que puede variar entre el 70-95%. Aunque está muy discutido, algunos estudios han demostrado que la TDR basada en inmunoanálisis óptico presenta mayor sensibilidad que las basadas en inmunocromatografía6, 24, 25, 26 (CIII).
Basándose en la alta especificidad, si el test es positivo, se acepta que el paciente presenta una FAA por EbhGA, no siendo precisa la confirmación mediante cultivo de muestra faringoamigdalar. En cambio, ante un resultado negativo algunos expertos sugieren realizar siempre cultivo, mientras que otros, dado el menor protagonismo y la significativa disminución de la FRA, solo lo recomiendan cuando se dan ciertos factores de riesgo1, 2, 6, 7, 25, 27, 28, 29, 30, 31 (CIII).
La sensibilidad de la TDR puede verse modificada por diversas variables, como por ejemplo: la habilidad, la pericia y la experiencia en la obtención de la muestra faringoamigdalar, la variabilidad en la interpretación de los resultados, la calidad y la sensibilidad intrínseca del reactivo utilizado, el método de referencia usado para contrastar los resultados e incluso la prevalencia de la infección estreptocócica32. Lo ideal sería que cada centro validara en su entorno la TDR que utiliza y, en función de su sensibilidad, plantear las ventajas y los inconvenientes de la realización sistemática de cultivos en todos los niños con una TDR negativa (CIII).
El cultivo es la prueba de referencia para el diagnóstico definitivo1, 2. En condiciones ideales, la sensibilidad que aporta es del 90-95% y la especificidad llega a ser del 99%. Su mayor inconveniente es que los resultados se obtienen, en el mejor de los casos, en un plazo de 24-48 h. Otro inconveniente es que la cuantificación del número de colonias de EbhGA no es útil para diferenciar entre infección aguda y portador, pues un escaso número de colonias se puede relacionar también con una infección verdadera2, 33. Las principales ventajas del cultivo son: el aislamiento, la identificación y la determinación de la sensibilidad antimicrobiana del EbhGA y/o de otras bacterias causantes de la FAA, vigilar la evolución de las resistencias antimicrobianas y conocer las características de los clones circulantes en cada periodo y sus serotipos, lo que permitiría diferenciar, en caso de ser necesario, entre recidivas y reinfecciones1, 2, 3, 32.
En casos de FAA no debidas a EbhGA, cuando se sospechen otras bacterias que puedan suscitar interés clínico, como por ejemplo Arcanobacterium haemolyticum, Mycoplasma pneumoniae o Fusobacterium necrophorum, debe especificarse al microbiólogo la sospecha etiológica, para utilizar además medios de cultivo específicos1, 7, 34.
Las indicaciones para solicitar pruebas microbiológicas en la FAA (TDR y/o cultivo) que se recomiendan en el presente documento de consenso se muestran en la tabla 5 (CIII).
Tabla 5.
Indicaciones para solicitar pruebas microbiológicas en la FAA (TDR y/o cultivo)
| TDR: |
| • Puntuación ≥ 2 en las escala de McIsaac, en ausencia de sintomatología viral |
| Cultivo: |
| • Puntuación ≥ 2 en las escala de McIsaac, en ausencia de sintomatología viral y cuando no exista la posibilidad de realizar TDR |
| • TDR negativo y presencia de alguno de los siguientes: |
| ∘ Antecedentes de FRA (complicación excepcional en países desarrollados) o GMNPE, tanto en niños con FAA como en contactos domiciliarios |
| ∘ Mayor incidencia en la comunidad de enfermedad estreptocócica invasiva o contacto confirmado con la misma |
| ∘ Alta sospecha de origen bacteriano de la FAA a pesar de TDR negativo (valorar cultivos específicos) |
| ∘ Baja sensibilidad demostrada de la TDR en el centro que realiza la prueba |
| • Para valorar el estado de portador |
| Nota: Cada centro debe validar la prueba de diagnóstico rápido que utiliza, ya que la sensibilidad puede modificarse en función de diversas variables. |
FAA: faringoamigdalitis aguda; FRA: fiebre reumática aguda; GMNPE: glomerulonefritis postestreptocócica; TDR: técnicas de detección rápida de antígeno estreptocócico.
Tratamiento
El tratamiento antibiótico de la FAA estreptocócica está justificado e indicado, al haberse demostrado con su empleo una resolución más rápida de los síntomas, reducción del tiempo de contagio y transmisión del EbhGA en la familia y la escuela, y prevención de las complicaciones supurativas locales y no supurativas, aunque no existe evidencia definitiva en la protección frente a la GMNPE y el síndrome PANDAS1, 2, 7, 19, 20, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48 (AI).
Idealmente sólo se deben tratar los casos confirmados1, 2, 7, 42.
En caso de TDR negativa (en función de la sensibilidad de cada centro y/o la presencia de factores de riesgo) o no disponibilidad de la prueba, se recomienda obtener cultivo, y solo si la sospecha clínica es alta (4-5 puntos de los criterios de McIsaac), se puede iniciar tratamiento antibiótico a la espera de los resultados1, 2, 3, 19, 20, 49, 50. Otros autores, en cambio, sugieren no iniciar el tratamiento hasta conocer los resultados, dado que no existe evidencia de que su empleo precoz disminuya la infección recurrente o prevenga las complicaciones no supurativas51. En este documento de consenso se considera que el tratamiento no debe demorarse en caso de estar indicado; la prevención de las complicaciones no supurativas ya no es el principal objetivo del tratamiento en países desarrollados, sino la resolución de los síntomas y la reducción del tiempo de contagio y transmisión del EbhGA (CIII).
Además de la sospecha clínica elevada, otras indicaciones aceptadas para su instauración precoz son: la presencia de un cuadro de FAA en el contexto familiar, cuando se ha confirmado el origen estreptocócico en alguno de los convivientes, y/o aunque es excepcional en nuestro medio, si existen antecedentes de FRA en el niño o en algún familiar conviviente7, 42, 52 (CIII).
Los criterios para iniciar tratamiento antibiótico en la FAA que se recomiendan en el presente documento de consenso se muestran en la tabla 6 (CIII).
Tabla 6.
Criterios para iniciar tratamiento antibiótico en la FAA
| - Casos confirmados mediante TDR o cultivo |
| - Casos de alta sospecha de origen bacteriano de la FAA (4-5 puntos de los criterios de McIsaac), en caso de TDR negativa o no disponibilidad de la prueba y a la espera de los resultados del cultivo |
| - Presencia de un cuadro de FAA en el contexto familiar cuando se ha confirmado el origen estreptocócico en alguno de los convivientes, con independencia de los resultados de las pruebas microbiológicas |
| - Aunque es excepcional en nuestro medio, si existen antecedentes de FRA en el niño o en algún familiar conviviente |
FAA: faringoamigdalitis aguda; TDR: técnicas de detección rápida de antígeno estreptocócico.
Aunque la penicilina es considerada desde hace años como el antibiótico de elección, varios estudios muestran su infrautilización en niños diagnosticados de FAA estreptocócica. En 2002, se realizó una encuesta en varios centros de atención primaria sobre el tratamiento de elección de la FAA53. Las respuestas no fueron excluyentes. La amoxicilina fue el fármaco seleccionado en primer lugar (54,6%), seguido de amoxicilina-clavulánico (42.7%), macrólidos (12.6%) y cefalosporinas de segunda generación (5.6%). Un año después, un estudio analizó el tratamiento de 1716 casos de FAA en los servicios de urgencias de 11 hospitales españoles51. El antibiótico más utilizado fue la amoxicilina (33.7%), seguido de amoxicilina-clavulánico (22%), cefuroxima (5,5%), penicilina (5%) y azitromicina (4%). Los autores consideraron un 54,8% de las prescripciones como inapropiadas. Estos hallazgos podrían estar relacionados con las escasas presentaciones farmacéuticas de penicilina V existentes, junto a una mayor familiaridad con la posología de la amoxicilina, o bien con el hecho de que muchos pediatras no conocen que en nuestro país está disponible fenoximetilpenicilina benzatina oral en suspensión, fácil de administrar y con mejor sabor que fenoximetilpenicilina potásica.
España ocupa el segundo puesto en cuanto a consumo de antibióticos en la Unión Europea. La prescripción de penicilinas de espectro reducido es 20-60 veces menor que en Alemania o Suecia. Este es uno de los motivos principales por los que las guías terapéuticas en nuestro país deben dar prioridad a mensajes clave como el empleo preferente de penicilina o amoxicilina frente a otros antibióticos54, 55, 56.
Las guías actuales de tratamiento siguen recomendando como antibiótico de elección la penicilina, dado que no se ha documentado ningún aislamiento de EbhGA resistente a la misma2, 42, 49, 57, 58, 59, 60 (AI). Sí se han descrito cepas tolerantes in vitro en las que el efecto del antibiótico ha sido exclusivamente bacteriostático; no obstante, in vivo, no se han demostrado diferencias significativas en los índices de fracaso terapéutico entre cepas tolerantes y susceptibles61, 62, 63. Penicilina V (fenoximetilpenicilina) potásica o benzatina, por vía oral, tiene un espectro de acción más reducido y, administrada durante 10 días, cumple los objetivos de tratamiento señalados. Fenoximetilpenicilina benzatina tiene mejor perfil farmacocinético, mejor sabor que su congénere y se dispensa en suspensión49.
La administración de penicilina G benzatina, por vía intramuscular profunda en dosis única, es dolorosa y hoy día no se recomienda, excepto en caso de vómitos, riesgo de mal cumplimiento del tratamiento prescrito por vía oral, antecedentes de FRA o niños procedentes de países de bajos recursos, con o sin prevalencia de FRA1, 2, 20, 42, 49, 64.
La amoxicilina, en pautas de una o dos dosis diarias durante 10 días, ha demostrado tasas más altas de curación clínica y erradicación del EbhGA que la penicilina V, probablemente en relación con una mayor absorción gastrointestinal y mejor tolerancia de la suspensión. Por ello, actualmente se considera este antibiótico de primera elección, junto con la fenoximetilpenicilina2, 49, 60, 65, 66, 67 (AI).
Se ha constatado en nuestro país la prescripción frecuente de amoxicilina-clavulánico para tratar la FAA estreptocócica51, 53, 56, 68. Esta combinación no es nunca de primera elección pues se trata de un antibiótico de amplio espectro y porque EbhGA no produce betalactamasas1, 2, 7, 49, 60, 65, 66, 67, 69 (AI).
Las cefalosporinas por vía oral de primera (cefadroxilo), segunda (cefaclor, cefuroxima axetilo y cefprozil) y tercera generación (cefixima, ceftibuteno y cefpodoxima) han demostrado, en algunos estudios realizados, tasas de curación clínica y bacteriológica similares e incluso superiores a la penicilina. Por este motivo, hay autores que las recomiendan como antibióticos de primera elección70, 71. Sin embargo, teniendo en cuenta estudios con mejor calidad de diseño, las diferencias en la erradicación bacteriológica con la penicilina no son superiores al 10%, estimación no convincente para justificar que las cefalosporinas se indiquen como primera elección49, 59, 60, 72, 73. Además de su mayor precio, ha de tenerse en cuenta que el empleo de antibióticos de amplio espectro puede favorecer el desarrollo de resistencias a otros microorganismos. Las cefalosporinas por vía oral solo están indicadas en niños con reacción retardada a penicilina, no anafiláctica, y como posible opción en casos de recaídas frecuentes de FAA por EbhGA1, 2, 74 (BII). Se recomienda cefadroxilo, al presentar un espectro de actividad más reducido, excelente tolerancia y buena biodisponibilidad, con una semivida relativamente larga que permite su dosificación cada 12 h1, 2, 7, 49 (BII).
En relación con los macrólidos, no presentan ninguna ventaja frente a los betalactámicos en cuanto a la sensibilidad antibiótica. En España, se ha documentado desde 1992 un aumento significativo del número de cepas de EbhGA resistentes a los macrólidos de 14 átomos de carbono (eritromicina, roxitromicina y claritromicina) y de 15 átomos (azitromicina)49, 50, 51, 75, 76, 77, 78. Estas resistencias están en relación con el aumento de su prescripción, siendo una situación reversible tras la disminución de su uso. También debe tenerse en cuenta la posibilidad de resistencias si el paciente recibió cualquiera de estos macrólidos en los 3 meses anteriores79.
Los macrólidos están indicados en casos de antecedentes de reacción alérgica inmediata o de anafilaxia tras la administración de betalactámicos. Existe evidencia, según un metaanálisis, de que azitromicina a dosis de 20 mg/kg/día durante 3 días, en FAA por EbhGA no resistentes, consigue una mejor erradicación bacteriológica y una mayor eficacia que tratamientos de 10 días con penicilina, claritromicina, amoxicilina/clavulánico o cefaclor80. También pueden utilizarse la claritromicina y los macrólidos de 16 átomos de carbono en el anillo lactónico, como la josamicina y la midecamicina49, 80, 81, 82, 83 (BII). En caso de infección por EbhGA resistente a macrólidos de 14 y 15 átomos de carbono (confirmada o sospechada), el tratamiento depende del resultado del cultivo y antibiograma. Si la elección del antibiótico es empírica, son buenas opciones terapéuticas la clindamicina, la josamicina y la midecamicina1, 84, 85, 86 (BII). Debe tenerse en cuenta el aumento demostrado durante los últimos 5 años de cepas de EbhGA resistentes a eritromicina con fenotipo MLSβ. Esto implica resistencia a todos los macrólidos de 14, 15 y 16 átomos y a la clindamicina. En estos casos, el tratamiento debe guiarse siempre por cultivo y antibiograma78 (BII).
En cuanto a la duración del tratamiento, las pautas inferiores a 10 días presentan un menor porcentaje de erradicación del EbhGA, y no existe suficiente evidencia científica para recomendarlas, salvo en el caso de la azitromicina, antibiótico que debido a sus características farmacocinéticas, persiste en el tejido amigdalar durante más tiempo42, 44, 87, 88 (AI).
Las dosis y las pautas de los antibióticos recomendados para el tratamiento de la FAA estreptocócica en el presente documento de consenso se muestran en la tabla 7 .
Tabla 7.
Tratamiento antibiótico de la FAA estreptocócica
| • Primera elección. Cualquiera de las siguientes dos opciones: |
| ∘ Penicilina V (fenoximetilpenicilina potásica o benzatina) durante 10 días |
| - Menores de 12 años y de 27 kg: 250 mg cada 12 h |
| - Mayores de 12 años o de 27 kg: 500 mg cada 12 h |
| ∘ Amoxicilina durante 10 días |
| - 40-50 mg/kg/día cada 12 o 24 h |
| - Máximo 500 mg cada 12 h o 1 g cada 24 h |
| • En caso de mal cumplimiento vía oral o vómitos |
| ∘ Penicilina G benzatina, dosis única IM profunda |
| - Menores de 12 años y de 27 kg: 600.000 U |
| - Mayores de 12 años o de 27 kg: 1.200.000 U |
| • Alergia a penicilina (reacción retardada) |
| ∘ Cefadroxilo durante 10 días |
| - 30 mg/kg/día cada 12 h. Máximo 1 g cada 24 h |
| • Alergia a penicilina (reacción inmediata o acelerada) |
| ∘ Azitromicina durante 3 días |
| - 20 mg/kg/día cada 24 h. Máximo 500 mg/dosis |
| ∘ Si resistencia a macrólidos, de 14 y 15 átomos (eritromicina, claritromicina y azitromicina) |
| - Clindamicina: 20-30 mg/kg/día cada 8-12 horas, 10 días (máximo 900 mg/día) |
| - Josamicina: 30-50 mg/kg/día, cada 12 h, 10 días (máximo 1 g/día) |
| - Diacetato de midecamicina: 40 mg/kg/día, cada 12 h, 10 días (máximo 1,5 g/día) |
FAA: faringoamigdalitis aguda.
Evolución
La mayoría de los niños presenta mejoría clínica en las primeras 48 h tras la instauración de un tratamiento antibiótico adecuado y bien cumplimentado. La posibilidad de contagio está eliminada en las primeras 24 h de tratamiento con cualquiera de los antibióticos citados. Si la evolución ha sido favorable, y en ausencia de otros factores de riesgo, no está indicado realizar un cultivo ni una TDR como «prueba de curación»1, 2.
Se debe distinguir entre fracaso clínico y fracaso bacteriológico del tratamiento. El primero sucede raramente en niños que, tras la prescripción de un tratamiento adecuado, siguen presentando signos y síntomas de FAA, con persistencia del EbhGA en la faringe. Las causas más frecuentes de fracaso clínico del tratamiento cuando existe confirmación microbiológica son: mal cumplimiento terapéutico, presencia de una FAA vírica en portadores crónicos de EbhGA, desarrollo de una complicación supurativa local o posibilidad de resistencia del EbhGA a macrólidos si el niño fue tratado con alguno de ellos. Cuando el paciente tiene una recaída por EbhGA, menos de 15 días después de terminar el tratamiento, lo más frecuente es que se deba al mismo serotipo que causó la infección inicial1, 89. En estos casos, cabe volver a tratar con un nuevo ciclo del mismo antibiótico, administrar una dosis única de penicilina benzatina con el objeto de descartar el incumplimiento terapéutico, o bien emplear otro antibiótico con mayor estabilidad frente a las betalactamasas, producidas por bacterias distintas del EbhGA que pueden estar presentes en la orofaringe y dificultar la acción de la penicilina1, 2, 33 (BII). Cultivos positivos a EbhGA después de 2 semanas concluido el tratamiento representan adquisiciones de serotipos distintos, o bien el mismo transmitido por contactos próximos1, 89.
El fracaso bacteriológico del tratamiento se refiere a la persistencia de EbhGA en la faringe de niños asintomáticos, tras un tratamiento adecuado y bien cumplimentado. Esto no significa que exista un fracaso real del tratamiento. Para valorar mejor esta colonización, es preferible realizar un cultivo, pues tras el tratamiento pueden persistir en la faringe fragmentos antigénicos de EbhGA que pueden dar un resultado falso positivo con las TDR. Ningún esquema terapéutico, en particular para la FAA, erradica la bacteria en el 100% de los casos. Se trata de un estado de benignidad, sin riesgo tanto para el niño como para sus contactos, y sin posibilidad de complicaciones ni de contagio90. Una explicación para este suceso podría atribuirse a la mayor capacidad de algunas cepas de EbhGA para penetrar en las células epiteliales respiratorias y mantener un reservorio intracelular durante el tratamiento12, 91. La prevalencia del estado de portador puede durar meses y varía según áreas geográficas, afectando desde un 10-40% de los niños escolares sanos durante el invierno y primavera1, 2, 5, 92 hasta una menor prevalencia del 12% en niños de cualquier edad47. Por todo ello, en la actualidad, no se recomienda tratar los fracasos bacteriológicos ni el estado de portador de EbhGA, salvo en casos muy concretos1, 2, 33, 93 (tabla 8 ) (BII).
Tabla 8.
Indicaciones de tratamiento del fracaso terapéutico bacteriológico y del estado de portador de EbhGA
| a) Antecedente de fiebre reumática en el niño o convivientes |
| b) Brotes intrafamiliares recurrentes de FAA por EbhGA |
| c) Enfermedad invasiva por EbhGA en el niño o convivientes |
| d) Portadores que viven en instituciones cerradas o con enfermos crónicos |
| e) Cuando se contempla realizar una amigdalectomía como último recurso de tratamiento |
EbhGA: estreptococo beta hemolítico del grupo A; FAA: Faringoamigdalitis aguda.
Para los casos de portadores o fracasos bacteriológicos que precisen tratamiento, se han empleado algunos antibióticos1, 69 que se muestran en la tabla 9 , sin que exista suficiente evidencia científica para recomendar un tratamiento de elección concreto. La penicilina, tanto por vía oral como intramuscular, es ineficaz. Se han propuesto clindamicina, amoxicilina-clavulánico y cefadroxilo, al haber demostrado tasas altas de erradicación, aunque se sabe que los dos últimos no alcanzan concentraciones intracelulares94 (BII). La azitromicina en dosis altas se ha mostrado como la opción más efectiva en algún estudio, por su excelente concentración intracelular, siempre que no haya sido administrada previamente80, 95 (BII).
Tabla 9.
Tratamiento antibiótico fracaso terapéutico bacteriológico y del estado de portador de EbhGA
| • Opciones terapéuticas: |
| ∘ Clindamicina durante 10 días. |
| - 20-30 mg/kg/día cada 8-12 h. Máximo 900 mg/día |
| ∘ Azitromicina durante 3 días |
| - 20 mg/kg/día cada 24 h. Máximo 500 mg/dosis |
| ∘ Amoxicilina-clavulánico durante 10 días |
| - 40 mg/kg/día cada 8 h. Máximo 1 g cada 24 h |
| ∘ Penicilina G benzatina, inyección única intramuscular profunda. Misma dosis que la indicada en la tabla 4 |
| - Más rifampicina 20 mg/kg/día cada 12 h. Máximo 600 mg/día, los últimos 4 días |
| ∘ Penicilina V (fenoximetilpenicilina) durante 10 días. Misma dosis que la indicada en al tabla 4 |
| - Más rifampicina 20 mg/kg/día cada 12 h. Máximo 600 mg/día, los últimos 4 días |
| ∘ Cefadroxilo durante 10 días. 30 mg/kg/día cada 12 h. Máximo 1 g cada 24 h |
| - Más rifampicina 20 mg/kg/día cada 12 h. Máximo 600 mg/día, los últimos 4 días |
EbhGA: estreptococo beta hemolítico del grupo A.
En cuanto a la amigdalectomía, se recomienda cuando existen más de 7 episodios de FAA por EbhGA documentadas y bien tratadas en un año, más de 5 en cada uno de los 2 años anteriores o más de 3 en cada uno de los 3 años anteriores. Estos criterios se han definido de forma arbitraria. En cada episodio debe presentarse al menos uno de los siguientes 4 criterios: fiebre (> 38,3°C), adenopatía cervical, exudados amigdalares, o evidencia de infección por EbhGA. En los estudios aleatorizados realizados en niños sobre los resultados de la cirugía, en comparación con el tratamiento médico, el número de episodios de FAA tras la amigdalectomía fue menor que en el grupo control; sin embargo, cuando se toman en cuenta el número de días de enfermedad, incluyendo los asociados con cirugía, el beneficio de la amigdalectomía fue menos evidente96, 97, 98, 99 (BII).
En las FAA de repetición con cultivos persistentemente negativos debe plantearse el diagnóstico del síndrome PFAPA (acrónimo del inglés periodic fever, adenopathy, pharyngitis and afthae [fiebre periódica, adenopatías, faringitis y aftas]), cuyos criterios diagnósticos100, 101, 102 se muestran en la tabla 10 .
Tabla 10.
Criterios diagnósticos del síndrome PFAPA
| 1. Episodios recurrentes de fiebre de inicio antes de los 5 años |
| 2. Síntomas constitucionales en ausencia de infección de vías respiratorias altas con al menos uno de los tres siguientes: estomatitis aftosa, linfadenitis cervical y/o faringitis |
| 3. Exclusión de neutropenia cíclica |
| 4. Completamente asintomático entre episodios |
| 5. Crecimiento y desarrollo normales |
En la actualidad, no existe ninguna vacuna para prevenir la FAA por EbhGA. Su desarrollo se encuentra en fase de investigación y existe incertidumbre sobre las implicaciones que podrían tener los anticuerpos inducidos por la vacuna en el posterior desarrollo de complicaciones no supurativas, tal y como ocurriría tras la infección natural no tratada con antibióticos103, 104.
Conclusiones
El objetivo principal del presente documento de consenso es difundir al máximo los siguientes mensajes clave para los pediatras, residentes de pediatría y médicos que atienden a la población pediátrica:
-
1.
La etiología más frecuente de la FAA es vírica. Entre las causas bacterianas, el principal agente responsable es el EbhGA.
-
2.
Para ayudar al diagnóstico etiológico son de utilidad las escalas de valoración clínica, que permiten seleccionar a quiénes se deben practicar los estudios microbiológicos.
-
3.
Sin el empleo de las pruebas microbiológicas, dada la inespecificidad de los síntomas, se tiende al sobrediagnóstico de FAA estreptocócica, con la consiguiente prescripción innecesaria de antibióticos.
-
4.
Los objetivos del tratamiento son: acelerar la resolución de los síntomas, reducir el tiempo de contagio y prevenir las complicaciones supurativas locales y no supurativas, fundamentalmente la fiebre reumática en países de bajos recursos.
-
5.
Idealmente sólo deben tratarse los casos confirmados. En caso de una TDR negativa o no disponibilidad de la prueba, se recomienda obtener cultivo sobre todo en niños con ciertos factores de riesgo y, sólo si la sospecha clínica es alta, iniciar tratamiento a la espera de los resultados (CIII).
-
6.
Los antibióticos de elección para el tratamiento de la FAA estreptocócica son la penicilina y la amoxicilina (AI).
-
7.
La efectividad de la penicilina está demostrada y no se ha descrito, hasta el momento, ningún caso de EbhGA resistente. Su espectro de acción es reducido y su uso adecuado evita el desarrollo de resistencias.
-
8.
Amoxicilina-clavulánico no está indicado de forma empírica en ningún caso en el tratamiento de la FAA estreptocócica. El EbhGA no es productor de betalactamasas. (AI).
-
9.
Las cefalosporinas por vía oral (sobre todo las de segunda y tercera generación) no debe ser utilizadas como antibióticos de primera elección (CIII).
-
10.
Los macrólidos (sobre todo los de más reciente introducción, como azitromicina y claritromicina) no son un tratamiento de primera elección (AI). El abuso de los macrólidos durante los últimos años ha favorecido un aumento de las resistencias del EbhGA frente a este grupo de antibióticos, que además deben reservarse para pacientes con alergia inmediata a penicilina o como tratamiento erradicador, en los casos indicados.
-
11.
Es urgente y prioritario en nuestro país adecuar la prescripción de antibióticos a la evidencia científica disponible.
-
12.
En la figura 1 se propone un algoritmo diagnóstico-terapéutico de la FAA en niños.
Figura 1.
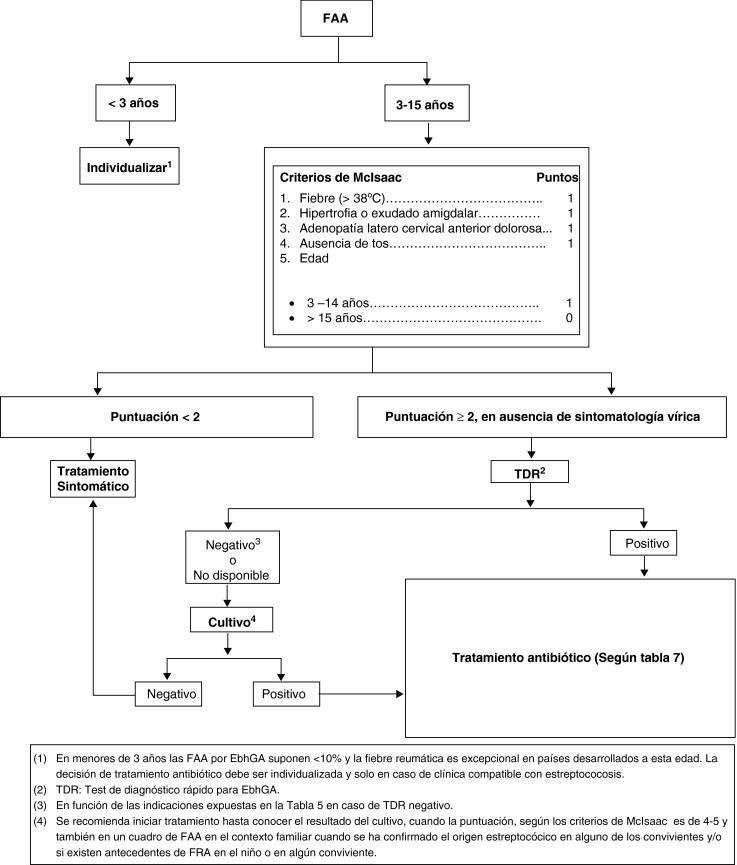
Algoritmo diagnóstico-terapéutico de la FAA.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Agradecimientos
Los autores agradecen de forma muy especial la revisión científica y desinteresada del manuscrito por parte de la Dra. Beatriz Orden Martínez, especialista en microbiología, miembro de la Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC) y de la Sociedad Española de Quimioterapia (SEQ).
Footnotes
Realizado por la Sociedad Española de Infectología Pediátrica, la Asociación Española de Pediatría de Atención Primaria, la Sociedad Española de Urgencias de Pediatría y la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria.
Bibliografía
- 1.Álvez González F, Sánchez Lastres JM. Faringoamigdalitis aguda. Protocolos de Infectología de la Asociación Española de Pediatría. [consultado 1/7/11]. Disponible en: http://www.aeped.es/documentos/protocolos-infectologia..
- 2.Wessels M.R. Streptococcal pharyngitis. N Engl J Med. 2011;364:648–655. doi: 10.1056/NEJMcp1009126. [DOI] [PubMed] [Google Scholar]
- 3.Álvez González F. Faringitis estreptocócica en niños menores de 2 años. An Pediatr (Barc) 2008;68:525–539. doi: 10.1157/13120214. [DOI] [PubMed] [Google Scholar]
- 4.Matas L., Méndez M., Rodrigo C., Ausina V. Diagnóstico de las faringitis estreptocócicas. Enferm Infecc Microbiol Clin. 2008;26:14–18. doi: 10.1157/13128775. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Shaikh N., Leonard E., Martin J.M. Prevalence of streptococcal pharyngitis and streptococcal carriage in children: a meta-analysis. Pediatrics. 2010;126:e557–e564. doi: 10.1542/peds.2009-2648. [DOI] [PubMed] [Google Scholar]
- 6.Flores Mateo G., Conejero J., Grenzner Martinel E., Baba Z., Dicono S., Echasabal M. Early diagnosis of streptococcal pharyngitis in paediatric practice: Validity of a rapid antigen detection test. Aten Primaria. 2010;42:356–361. doi: 10.1016/j.aprim.2010.01.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Gerber M.A., Baltimore R.S., Eaton C.B., Gewitz M., Rowley A.H., Shulman S.T. Prevention of rheumatic fever and diagnosis and treatment of acute Streptococcal pharyngitis: a scientific statement from the American Heart Association Rheumatic Fever. Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young, the Interdisciplinary Council on Functional Genomics and Translational Biology, and the Interdisciplinary Council on Quality of Care and Outcomes Research: endorsed by the American Academy of Pediatrics. Circulation. 2009;119:1541–1551. doi: 10.1161/CIRCULATIONAHA.109.191959. [DOI] [PubMed] [Google Scholar]
- 8.Domínguez O., Rojo P., De las Heras S., Folgueira D., Ruíz Contreras J. Clinical presentation characteristics of pharyngeal adenovirus infections. Pediatr Infect Dis J. 2005;24:733–734. doi: 10.1097/01.inf.0000172942.96436.2d. [DOI] [PubMed] [Google Scholar]
- 9.Carbonero Celis M.J., Torronteras Santiago R., Cintado Bueno C. Mononucleosis infecciosa: estudio en niños hospitalizados. An Esp Pediatr. 1999;51:664–666. [PubMed] [Google Scholar]
- 10.Hervás Angulo A., Arizcuren Domeño M.A., Tiberio López G., Oteiza Olaso J. Características clínico-analíticas y complicaciones de pacientes con mononucleosis infecciosa derivados desde atención primaria a atención especializada. Aten Primaria. 2003;32:311. doi: 10.1016/S0212-6567(03)79282-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Santiago Sánchez Mateos J.L., Aboín González S., García Millán C., Jaén Olasolo P. Mononucleosis infecciosa. Med Clin (Barc) 2008;130:520. doi: 10.1157/13119501. [DOI] [PubMed] [Google Scholar]
- 12.Cunningham M.W. Pathogenesis of group A streptococcal infections. Clin Microbiol Rev. 2000;13:470–511. doi: 10.1128/cmr.13.3.470-511.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Sanz J.C., Bascones M.A., Martín F., Saez-Nieto J.A. Escarlatina recurrente por reinfección reciente causada por cepas no relacionadas de Streptococcus pyogenes. Enf Infec Microbiol Clin. 2005;23:388–389. doi: 10.1157/13076184. [DOI] [PubMed] [Google Scholar]
- 14.Park S.Y., Gerber M.A., Tanz R.R., Hickner J.M., Galliher J.M., Chuang I. Clinicians’ management of children and adolescents with acute pharyngitis. Pediatrics. 2006;117:1871–1878. doi: 10.1542/peds.2005-2323. [DOI] [PubMed] [Google Scholar]
- 15.Rossignoli A., Clavenna A., Bonati M. Antibiotic prescription and prevalence rate in the outpatient paediatric population: analysis of surveys published during 2000-2005. Eur J Clin Pharmacol. 2007;63:1099–1106. doi: 10.1007/s00228-007-0376-3. [DOI] [PubMed] [Google Scholar]
- 16.Ayanruoh S., Waseem M., Quee F., Humphrey A., Reynolds T. Impact of rapid streptococcal test on antibiotic use in a pediatric emergency department. Pediatr Emerg Care. 2009;25:748–750. doi: 10.1097/PEC.0b013e3181bec88c. [DOI] [PubMed] [Google Scholar]
- 17.Madurell J., Balaqué M., Gómez M., Cots J.M., Llor C. Impact of rapid antigen detection testing on antibiotic prescription in acute pharyngitis in adults. FARINGOCAT Study: a multicentric randomized controlled trial. BMC Farm Pract. 2010;11:25. doi: 10.1186/1471-2296-11-25. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Bisno A.L. Acute pharyngitis. N Engl J Med. 2001;344:205–211. doi: 10.1056/NEJM200101183440308. [DOI] [PubMed] [Google Scholar]
- 19.Cooper R.J., Hoffman J.R., Barlett J.G., Besser R.E., Gonzales R., Hickner J.M. Principles of appropriate antibiotic use for acute pharyngitis in adults: background. Ann Intern Med. 2001;134:509–517. doi: 10.7326/0003-4819-134-6-200103200-00019. [DOI] [PubMed] [Google Scholar]
- 20.Snow V., Mottur-Pilson C., Cooper R.J., Hoffman J.R. Principles of appropriate antibiotic use for acute pharyngitis in adults. Ann Intern Med. 2001;134:506–508. doi: 10.7326/0003-4819-134-6-200103200-00018. [DOI] [PubMed] [Google Scholar]
- 21.Centor R.M., Witherspoon J.M., Dalton H.P., Brody C.E., Link K. The diagnosis of strep throat in adults in the emergency room. Med Decis Making. 1981;1:239–246. doi: 10.1177/0272989X8100100304. [DOI] [PubMed] [Google Scholar]
- 22.McIsaac W.J., Kellner J.D., Aufricht P., Vanjaka A., Low D.E. Empirical validation of guidelines for the management of pharyngitis in children adults. JAMA. 2004;291:1587–1595. doi: 10.1001/jama.291.13.1587. [Erratum, JAMA 2005;294:2700]. [DOI] [PubMed] [Google Scholar]
- 23.Kurtz B., Kurtz M., Roe M., Todd J. Importance of inoculum size and sampling effect in rapid antigen detection for diagnosis of Streptococcus pyogenes pharyngitis. J Clin Microbiol. 2000;38:279–281. doi: 10.1128/jcm.38.1.279-281.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Contessotto Spadetto C., Cámara Simón M., Avilés Inglés M.J., Ojeda Escuriet J.M., Cascales Barceló I., Rodríguez Sánchez F. Rational use of antibiotics in pediatrics: impact of a rapid test for detection of beta-haemolytic group As streptococci in acute pharyngotonsilitis. An Esp Pediatr. 2000;52:212–219. [PubMed] [Google Scholar]
- 25.Ruíz-Aragón J., Rodríguez López R., Molina Linde J.M. Evaluación de los métodos rápidos para la detección de Streptococcus pyogenes. Revisión sistemática y metanálisis. An Pediatr (Barc) 2010;72:391–402. doi: 10.1016/j.anpedi.2009.12.012. [DOI] [PubMed] [Google Scholar]
- 26.Giraldez-García C, Rubio B, Gallegos-Braun JF, Imaz I, González-Enríquez J, Sarria-Santamera A. Diagnosis and management of acute pharyingitis in a paediatric population: a cost-effectiveness analysis. Eur J Pediatr. 2011;170:1059-67. [DOI] [PubMed]
- 27.Mayes T., Pichichero M.E. Are follow-up throat cultures necessary when rapid antigen detection tests are negative for group A streptococci? Clin Pediatr (Phila) 2001;40:191–195. doi: 10.1177/000992280104000402. [DOI] [PubMed] [Google Scholar]
- 28.Cohen R., Levy C., Ovetchkine P., Boucherat M., Weil-Olivier C., Gaudelus J. Evaluation of streptococcal clinical scores, rapid antigen detection tests and cultures for childhood pharyngitis. Eur J Pediatr. 2004;163:281–282. doi: 10.1007/s00431-004-1416-y. [DOI] [PubMed] [Google Scholar]
- 29.Gerber M.A., Shulman S.T. Rapid diagnosis of pharyngitis caused by group A streptococci. Clin Microbiol Rev. 2004;17:571–580. doi: 10.1128/CMR.17.3.571-580.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Jaggi P., Shulman S.T., Group A. Streptococcal infections. Pediatr Rev. 2006;27:99–105. doi: 10.1542/pir.27-3-99. [DOI] [PubMed] [Google Scholar]
- 31.Sarikaya S., Aktas C., Ay D., Cetin A., Celikmen F., Sensitivity Specificity of rapid antigen detection testing for diagnosing pharyngitis in the emergency department. Ear Nose Throat J. 2010;89:180–182. [PubMed] [Google Scholar]
- 32.Herranz B., Rodríguez-Salinas E., Orden B. Utilidad de las técnicas de diagnóstico rápido para la detección de Streptococcus pyogenes. An Pediatr Cont. 2007;5:92–95. [Google Scholar]
- 33.Fernández-Cuesta Valcarce M.A. Faringitis aguda. In: Hernández Merino A., Bravo Acuña J., Merino Moína M., Ramos Amador J.T., Rojo Conejo P., Ruiz Contreras J., Saavedra Lonano J., editors. Guía ABE. Infecciones en pediatría. Exlibris Ediciones SL, Asociación Española de Pediatría de Atención Primaria; Madrid: 2010. pp. 153–158. [Google Scholar]
- 34.Piñeiro Pérez R., Cilleruelo Ortega M.J., López Varela E., López López A., Gimeno Díaz de Atauri A., De Lucas Collantes C. Faringoamigdalitis aguda por Mycoplasma pneumoniae ¿Etiología infrecuente o infradiagnosticada? Acta Pediatr Esp. 2011;69:266–267. [Google Scholar]
- 35.Denny F.W., Wannamaker L.W., Brink W.R., Rammelkamp C.H., Jr., Custer E.A. Prevention of rheumatic fever; treatment of the preceding streptococcic infection. J Am Med Assoc. 1950;143:151–153. doi: 10.1001/jama.1950.02910370001001. [DOI] [PubMed] [Google Scholar]
- 36.Catanzaro F.J., Stetson C.A., Morris A.J., Chamovitz R., Rammelkamp C.H., Jr., Stolzer B.L. The role of the streptococcus in the pathogenesis of rheumatic fever. Am J Med. 1954;17:749–756. doi: 10.1016/0002-9343(54)90219-3. [DOI] [PubMed] [Google Scholar]
- 37.Potter E.V., Svartman M., Mohammed I., Cox R., Poon-King T., Earle D.P. Tropical acute rheumatic fever and associated streptococcal infections compared with concurrent acute glomerulonephritis. J Pediatr. 1978;92:325–333. doi: 10.1016/s0022-3476(78)80036-5. [DOI] [PubMed] [Google Scholar]
- 38.Randolph M.F., Gerber M.A., De Meo K.K., Wright L. Effect of antibiotic therapy on the clinical course of streptococcal pharyngitis. J Pediatr. 1985;106:870–875. doi: 10.1016/s0022-3476(85)80228-6. [DOI] [PubMed] [Google Scholar]
- 39.Krober M.S., Bass J.W., Michaels G.N. Streptococcal pharyngitis: Placebo-controlled double blind evaluation of clinical response to penicillin therapy. JAMA. 1985;253:1271–1274. doi: 10.1001/jama.253.9.1271. [DOI] [PubMed] [Google Scholar]
- 40.Pichichero M.E., Disney F.A., Talpey W.B., Green J.L., Francis A.B., Roghmann K.J. Adverse beneficial effect of immediate treatment of group A beta-hemolytic streptococcal pharyngitis with penicillin. Pediatr Infect Dis J. 1987;6:635–643. doi: 10.1097/00006454-198707000-00004. [DOI] [PubMed] [Google Scholar]
- 41.Snellman L.W., Stang H.J., Stang J.M., Johnson D.R., Kaplan E.L. Duration of positive throat cultures for group A streptococci after initiation of antibiotic therapy. Pediatrics. 1993;91:1166–1170. [PubMed] [Google Scholar]
- 42.Bisno A.L., Gerber M.A., Gwaltney J.M., Kaplan E.L., Schwartz R.H. Practice guidelines for the diagnosis and management of group A streptococcal pharyngitis. Clin Infect Dis. 2002;35:113–125. doi: 10.1086/340949. [DOI] [PubMed] [Google Scholar]
- 43.Robertson K.A., Volmink J.A., Mayosi E.M. Antibiotics for the primary prevention of acute rheumatic fever: a meta-analysis. BMC Cardiovasc Disord. 2005;5:11. doi: 10.1186/1471-2261-5-11. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Pichichero M., Casey J. Comparison of European and US results for cephalosporin versus penicilin treatment of Group A streptococcal tonsillopharyngitis. Eur J Clin Microbiol Infect Dis. 2006:354–364. doi: 10.1007/s10096-006-0154-7. [DOI] [PubMed] [Google Scholar]
- 45.Del Mar C.B., Glasziou P.P., Spinks A.B. Antibiotics for sore throat. Cochrane Database Syst Rev. 2006;4:CD000023. doi: 10.1002/14651858.CD000023.pub3. [DOI] [PubMed] [Google Scholar]
- 46.Alcaide M.L., Bisno A.L. Pharyngitis epiglottitis. Infect Dis Clin N Am. 2007;21:449–469. doi: 10.1016/j.idc.2007.03.001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Shulman S.T., Tanz R.R., Dale J.B., Beall B., Kabat W., Kabat K. Seven-year surveillance of north american pediatric group A streptococcal pharyngitis isolates. Clin Infect Dis. 2009;49:78–84. doi: 10.1086/599344. [DOI] [PubMed] [Google Scholar]
- 48.Carapetis J., Steer A. Prevention of rheumatic fever. Pediatr Infect Dis J. 2010;29:92. doi: 10.1097/INF.0b013e3181bf53f3. [DOI] [PubMed] [Google Scholar]
- 49.Álvez F. Uso racional de antibióticos en las infecciones más comunes de los niños. An Pediatr Contin. 2010;8:221–230. [Google Scholar]
- 50.Peñalba Citores A.C., Riaño Méndez B., Marañón Pardillo R., Míguez Navarro C., Vázquez López P., Guerrero Soler M.M. Incidencia de faringitis estreptocócica. An Pediatr (Barc) 2007;67:220–224. doi: 10.1016/s1695-4033(07)70610-0. [DOI] [PubMed] [Google Scholar]
- 51.Ochoa Sangrador C., Vilela Fernández M., Cueto Baelo M., Eiros Bouza J.M., Inglada Galiana L., el Grupo Español de Estudio de los Tratamientos Antibióticos Adecuación del tratamiento de la faringoamigdalitis aguda a la evidencia científica. An Pediatr (Barc) 2003;59:31–40. doi: 10.1016/S1695-4033(03)78145-4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Álvez F., Martín C., Infecciones por estreptococo beta-hemolítico grupo A (EBGHA) y sus complicaciones . Estado de portador y recurrencias. In: Gómez Campedrá J.A., Jiménez Ferreros L., Álvarez Calatayud G., editors. Patología Aguda ORL en Pediatría. GlaxoSmithKline; Madrid: 2004. pp. 83–96. [Google Scholar]
- 53.Casaní Martínez C., Calvo Rigual F., Peris Vidal A., Álvares de Lavida Mulero T., Díez Domingo J., Graullera Millas M. Encuesta sobre el uso racional de antibióticos en atención primaria. An Pediatr (Barc) 2003;58:10–16. doi: 10.1016/s1695-4033(03)77984-3. [DOI] [PubMed] [Google Scholar]
- 54.Moral Gil L., Rubio Calduch E.M. A vueltas con la faringitis estreptocócica: el porqué de las cosas. An Pediatr (Barc) 2004;60:376–387. doi: 10.1016/s1695-4033(04)78293-4. [DOI] [PubMed] [Google Scholar]
- 55.Vázquez Fernández M.E., Luquero Alcalde F.J., Pastor García E., Bachiller Luque M.R., Vázquez Fernández M.J., Eiros Bouza J.M. Análisis del consumo de antibióticos en la población de Castilla y León durante el período 2001 a 2005. An Pediatr (Barc) 2007;67:111–117. doi: 10.1157/13108074. [DOI] [PubMed] [Google Scholar]
- 56.Durán Fernández Feijoo C., Marqués Ercilla S., Hernández-Bou S., Trenchs Sainz de la Maza V., García García J.J., Luaces Cubells C. Calidad de la prescripción antibiótica en un servicio de urgencias pediátrico hospitalario. An Pediatr (Barc) 2010;73:115–120. doi: 10.1016/j.anpedi.2010.02.017. [DOI] [PubMed] [Google Scholar]
- 57.Coonan K.M., Kaplan E.L. In vitro susceptibility of recent North American group A streptococcal isolates to eleven oral antibiotics. Pediatr Infect Dis J. 1994;13:630–635. doi: 10.1097/00006454-199407000-00009. [DOI] [PubMed] [Google Scholar]
- 58.Horn D.L., Zabriskie J.B., Austrian R., Cleary P.P., Ferretti J.J., Fischetti V.A. Why have group A streptococci remained susceptible to penicillin: Report on a simposium. Clin Infect Dis. 1998;26:1341–1345. doi: 10.1086/516375. [DOI] [PubMed] [Google Scholar]
- 59.Van Driel M.L., De Sutter A.I., Keber N., Habraken H., Christiaens T. Different antibiotic treatments for group A streptococcal pharyngitis. Cochrane Database Syst Rev. 2010;6:CD004406. doi: 10.1002/14651858.CD004406.pub2. [DOI] [PubMed] [Google Scholar]
- 60.Baltimore R.S. Re-evaluation of antibiotic treatment of streptococcal pharyngitis. Curr Opin Pediatr. 2010;22:77–82. doi: 10.1097/MOP.0b013e32833502e7. [DOI] [PubMed] [Google Scholar]
- 61.Dagan R., Ferne M., Scheinis M., Alkan M., Katzenelson E. An epidemic of penicillin-tolerant group A streptococcal pharyngitis in children living in a closed community: Mass treatment with erythromycin. J Infect Dis. 1987;156:514–516. doi: 10.1093/infdis/156.3.514. [DOI] [PubMed] [Google Scholar]
- 62.Van Asselt G.J., Mouton R.P. Detection of penicillin tolerance in Streptococcus pyogenes. J Med Microbiol. 1993;38:197–202. doi: 10.1099/00222615-38-3-197. [DOI] [PubMed] [Google Scholar]
- 63.Kaplan E.L., Johnson D.R. Unexplained reduced microbiological efficacy of intramuscular benzathine penicillin G and of oral penicillin V in eradication of group a streptococci from children with acute pharyngitis. Pediatrics. 2001;108:1180–1186. doi: 10.1542/peds.108.5.1180. [DOI] [PubMed] [Google Scholar]
- 64.Gerber M.A., Spadaccini L.J., Wright L.L., Deutsch L., Kaplan E.L. Twice-daily penicillin in the treatment of streptococcal pharyngitis. Am J Dis Child. 1985;139:1145–1148. doi: 10.1001/archpedi.1985.02140130083035. [DOI] [PubMed] [Google Scholar]
- 65.Curtin-Wirt C., Casey J.R., Murray P.C., Cleary C.T., Hoeger W.J., Marsocci S.M. Efficacy of penicilin vs amoxicilina in children with Group A beta hemolytic streptococcal tonsillopharyngitis. Clin Pediatr (Phila) 2003;42:219–225. doi: 10.1177/000992280304200305. [DOI] [PubMed] [Google Scholar]
- 66.Clegg H.W., Ryan A.G., Dallas S.D., Kaplan E.L., Johnson D.R., Norton H.J. Treatment of sptreptococcal pharyingitis with once-daily compared with twice-daily amoxicillin: a noninferiority trial. Pediatr Infect Dis J. 2006;25:761–767. doi: 10.1097/01.inf.0000235678.46805.92. [DOI] [PubMed] [Google Scholar]
- 67.Lennon D.R., Farrel E., Martin D.R., Stewart J.M. Once-daily amoxicillin versus twice daily penicilin V in group A beta-hemolytic streptococcal pharyngitis. Arch Dis Child. 2008;93:474–478. doi: 10.1136/adc.2006.113506. [DOI] [PubMed] [Google Scholar]
- 68.Albañil Ballesteros M.R., Calvo Rey C., Sanz Cuesta T. Variación de la prescripción de antibióticos en atención primaria. An Esp Pediatr. 2002;57:420–426. [PubMed] [Google Scholar]
- 69.Kaplan E.L., Johnson D.R. Eradication of group A streptococci from the upper respiratory tract by amoxicillin with clavulanate after oral penicillin V treatment failure. J Pediatr. 1988;113:400–403. doi: 10.1016/s0022-3476(88)80291-9. [DOI] [PubMed] [Google Scholar]
- 70.Casey J.R., Pichichero M.E. Meta-analysis of cephalosportin versus penicilina treatment of Group A streptococcal tonsillopharyngitis in children. Pediatrics. 2004;113:866–882. doi: 10.1542/peds.113.4.866. [DOI] [PubMed] [Google Scholar]
- 71.Kaplan E.L., Oakes J.M., Johnson D.R. Unexpected individual clinical site variation in eradication rates of group a streptococci by penicillin in multisite clinical trials. Pediatr Infect Dis J. 2007;26:1110–1116. doi: 10.1097/INF.0b013e31814615ac. [DOI] [PubMed] [Google Scholar]
- 72.Shulman S.T., Gerber M.A. So what́s wrong with penicillin for strep throat? Pediatrics. 2004;113:1816–1818. doi: 10.1542/peds.113.6.1816. [DOI] [PubMed] [Google Scholar]
- 73.Álvez F. Eficacia de la penicilina en el tratamiento de las faringoamigdalitis estreptocócicas. An Pediatr Contin. 2004;2:105–117. [Google Scholar]
- 74.Pichichero M.E. A review of evidence supporting the American Academy of Pediatrics recommendation for prescribing cephalosporin antibiotics for penicillin-allergic patients. Pediatrics. 2005;115:1048–1057. doi: 10.1542/peds.2004-1276. [DOI] [PubMed] [Google Scholar]
- 75.Perez-Trallero E., Urbieta M., Montes M., Ayestaran I., Marimon J.M. Emergence of Streptococcus pyogenes strains resistant to erythromycin in Gipuzkoa, Spain. Eur J Clin Microbiol Infect Dis. 1998;17:25–31. doi: 10.1007/BF01584359. [DOI] [PubMed] [Google Scholar]
- 76.Orden B., Perez-Trallero E., Montes M., Martínez R. Erythromycin resistance of Streptococcus pyogenes in Madrid. Pediatr Infect Dis J. 1998;17:470–473. doi: 10.1097/00006454-199806000-00006. [DOI] [PubMed] [Google Scholar]
- 77.Betriu C., Casado M.C., Gómez M., Sanchez A., Palau M.L., Picazo J.J. Incidence of erythromycin resistance in Streptococcus pyogenes: a 10-year study. Diagn Microbiol Infect Dis. 1999;33:255–260. doi: 10.1016/s0732-8893(98)00155-2. [DOI] [PubMed] [Google Scholar]
- 78.Perez-Trallero E., Martín-Herrero J.E., Mazón A., García-Delafuente C., Robles P., Iriarte V. Antimicrobial resistance among respiratory pathogens in Spain: latest data and changes over 11 years (1996-1997 to 2006-2007) Antimicrob Agents Chemother. 2010;54:2953–2959. doi: 10.1128/AAC.01548-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 79.Gagliotti C., Nobilio L., Milandri M., Moro M.L. Macrolide prescriptions and erythromycin resistance of Streptococcus pyogenes. Clin Infect Dis. 2006;42:1153–1156. doi: 10.1086/501460. [DOI] [PubMed] [Google Scholar]
- 80.Casey J.R., Pichichero M.E. Higher dosages of azithromycin are more effective in treatment of group A streptococcal tonsillopharyngitis. Clin Infect Dis. 2005;40:1748–1755. doi: 10.1086/430307. [DOI] [PubMed] [Google Scholar]
- 81.Cohen R., Reinert P., De La Rocque F., Levy C., Boucherat M., Robert M. Comparison of two dosages of azithromycin for three days versus penicilin V. for ten days in acute Group A. Streptococcal tonsillopharyingitis. Pediatr Infect Dis J. 2002;21:297–303. doi: 10.1097/00006454-200204000-00008. [DOI] [PubMed] [Google Scholar]
- 82.Cohen R. Defining the optimum treatment regimen for azithromycin in acute tonsillopharyngitis. Pediatr Infect Dis J. 2004;23:129–134. doi: 10.1097/01.inf.0000112527.33870.0d. [DOI] [PubMed] [Google Scholar]
- 83.Richter S.S., Heilmann K.P., Beekmann S.E., Miller N.J., Miller Al, Rice C.L. Macrolide-resistant Streptococcus pyogenes in the United States, 2002-2003. Clin Infect Dis. 2005;41:599–608. doi: 10.1086/432473. [DOI] [PubMed] [Google Scholar]
- 84.Tanz R.R., Shulman S.T., Shortridge V.D., Kabat W., Kabat K., Cederlund E. Community-based surveillance in the United States of macrolide-resistant pediatric pharyngeal group A streptococci during 3 respiratory disease seasons. Clin Infect Dis. 2004;39:1794–1801. doi: 10.1086/426025. [DOI] [PubMed] [Google Scholar]
- 85.Kim S., Yong Lee N. Antibiotics resistance and genotypic characteristics of group A streptococci associated with acute pharyngitis in Korea. Microb Drug Resist. 2004;10:300–305. doi: 10.1089/mdr.2004.10.300. [DOI] [PubMed] [Google Scholar]
- 86.Tamayo J., Pérez-Trallero E., Gómez-Garcés J.L., Alós J.I. Resistance to macrolides, clindamycin and telithromycin in Streptococcus pyogenes isolated in Spain during 2004. J Antimicrob Chemoter. 2005;56:780–782. doi: 10.1093/jac/dki286. [DOI] [PubMed] [Google Scholar]
- 87.Rodríguez D., Danés I. Nuevas pautas de antibioterapia en la faringoamigdalitis aguda. Med Clin (Barc) 2001;117:115–116. doi: 10.1016/s0025-7753(01)72032-5. [DOI] [PubMed] [Google Scholar]
- 88.Falagas M.E., Vouloumanou E.K., Matthaiou D.K., Kapaskelis A.M., Karageorgopoulos D.E. Effectiveness and safety of short-course vs long-course antibiotic therapy for group a beta haemolytic streptococcal tonsillopharyngitis: a meta-analysis of randomized trials. Mayo Clin Proc. 2008;83:880–889. [PubMed] [Google Scholar]
- 89.Markowitz M., Gerber M.A., Kaplan E.L. Treatment of streptococcal pharyngotonsillitis: reports of penicilińs demise are premature. J Pediatr. 1993;123:679–685. doi: 10.1016/s0022-3476(05)80840-6. [DOI] [PubMed] [Google Scholar]
- 90.Kaplan E.L. The group A streptococcal upper respiratory tract carrier state: an enigma. J Pediatr. 1980;97:337–345. doi: 10.1016/s0022-3476(80)80178-8. [DOI] [PubMed] [Google Scholar]
- 91.Shulman S.T., Gerber M.A., Tanz R.R., Markowitz M. Streptococcal pharyngitis: the case for penicillin therapy. Pediatr Infect Dis J. 1994;13:1–7. [PubMed] [Google Scholar]
- 92.Schwartz R.H., Wientzen R.L., Jr., Pedreira F., Feroli E.J., Mella G.W., Guandolo V.L. Penicillin V for group A streptococcal pharyngotonsillitis: a randomized trial of seven days’ versus ten days’ therapy. JAMA. 1981;246:1790–1795. doi: 10.1001/jama.246.16.1790. [DOI] [PubMed] [Google Scholar]
- 93.Gerber M.A. Treatment failures and carriers: perception or problems? Pediatr Infect Dis J. 1994;13:576–579. doi: 10.1097/00006454-199406000-00036. [DOI] [PubMed] [Google Scholar]
- 94.Wald ER. Approach to diagnosis of acute infectious pharyngitis in children and adolescents. En: Basow DS, Waltham MA, editores. UpToDate 2010. [vonsultado Marzo 2011].
- 95.Kaplan E.L., Chhatwal G.S., Rohde M. Reduced ability of penicillin to eradicate ingested group A streptococci from epithelial cells: clinical and pathogenic implications. Clin Infect Dis. 2006;43:1398–1406. doi: 10.1086/508773. [DOI] [PubMed] [Google Scholar]
- 96.Paradise J.L., Bluestone C.D., Bachman R.Z., Colborn D.K., Bernard B.S., Taylor F.H. Efficacy of tonsillectomy for recurrent throat infection in severely affected children: results of parallel randomized and nonrandomized clinical trials. N Engl J Med. 1984;310:674–683. doi: 10.1056/NEJM198403153101102. [DOI] [PubMed] [Google Scholar]
- 97.Cervera Escario J., Del Castillo Martín F., Gómez Campderá J.A., Gras Albert J.R., Pérez Piñero B., Villafruela Sanz M.A. Indicaciones de adenoidectomía y amigdalectomía: Documento de Consenso entre la Sociedad Española de Otorrinolaringología y Patología Cervicofacial y la Asociación Española de Pediatría. Acta Otorrinolaringol Esp. 2006;57:59–65. doi: 10.1016/s0001-6519(06)78665-4. [DOI] [PubMed] [Google Scholar]
- 98.Alho O.P., Koivunen P., Penna T., Teppo H., Koskela M., Loutonen J. Tonsillectomy versus watchful waiting in recurrent streptococcal pharyngitis in adults: randomised controlled trial. BMJ. 2007;334:939. doi: 10.1136/bmj.39140.632604.55. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 99.Baugh R.F., Archer S.M., Mitchell R.B., Rosenfeld R.M., Amin R., Burns J.J. Clinical Practice Guideline: Tonsillectomy in Children. Otolaryngology Head Neck Surg. 2011;144:S1–S30. doi: 10.1177/0194599810389949. [DOI] [PubMed] [Google Scholar]
- 100.Marshall G.S., Edward K.M., Butter J., Lawton A.R. Syndrome of periodic fever. Pharyngitis and aphtous stomatitis. J Pediatr. 1987;110:43–46. doi: 10.1016/s0022-3476(87)80285-8. [DOI] [PubMed] [Google Scholar]
- 101.Feder H.M., Salazar J.C. A clinical review of 105 patients with PFAPA (a periodic fever syndrome) Acta Paediatr. 2010;99:178–184. doi: 10.1111/j.1651-2227.2009.01554.x. [DOI] [PubMed] [Google Scholar]
- 102.Calvo Rey C., Soler-Palacín P., Muñoz R.M., Lozano J.S., López J.A., Aróstegui J.I. Documento de Consenso de la Sociedad de Infectología Pediátrica y la Sociedad de Reumatología Pediátrica sobre el diagnóstico diferencial y el abordaje terapéutico de la fiebre recurrente. An Pediatr (Barc) 2011;74:e1–e16. doi: 10.1016/j.anpedi.2010.09.022. [DOI] [PubMed] [Google Scholar]
- 103.Pichichero M.E. Group A streptococcal vaccines. JAMA. 2004;292:738–739. doi: 10.1001/jama.292.6.738. [DOI] [PubMed] [Google Scholar]
- 104.McNeil S.A., Halperin S.A., Langley J.M., Smith B., Warren A., Sharratt G.P. Safety and immunogenicity of 26-valent group a streptococcus vaccine in healthy adult volunteers. Clin Infect Dis. 2005;41:1114–1122. doi: 10.1086/444458. [DOI] [PubMed] [Google Scholar]


