Zusammenfassung
Die ambulant erworbene Pneumonie ist die häufigste ernste Infektionserkrankung in Deutschland. Die Mehrzahl der Fälle wird ambulant behandelt. Die Diagnose wird klinisch durch Zeichen der Infektion, respiratorischen Symptomen und dem Auskultationsbefund gestellt und durch den Nachweis eines pneumonischen Infiltrats in der Röntgenaufnahme bestätigt. Der mit Abstand häufigste Erreger bleibt Streptococcus pneumoniae, der in Deutschland unverändert hohe Penicillinempfindlichkeit zeigt. Daneben werden Haemophilus influenzae, Mykoplasmen, Legionellen und Influenza-Viren regelmäßig nachgewiesen. Eine mikrobiologische Diagnostik ist in der Praxis nicht routinemäßig erforderlich. Zur Einschätzung der Prognose und Entscheidung über die Notwendigkeit einer Hospitalisierung dient der CRB65-Score. Die Auswahl der kalkulierten Therapie richtet sich nach Schweregrad der Infektion und Vorliegen von Komorbiditäten. Aminopenicilline sind Mittel erster Wahl bei unkomplizierten Pneumonien. Bei Verdacht auf Mykoplasmen- und Legionelleninfektion ist ein Makrolid oder ein neueres Fluorchinolon indiziert. Wichtige präventive Maßnahmen sind die jährliche Influenzaimpfung und die Pneumokokkenimpfung.
Schlüsselwörter: Pneumonie, antibiotische Therapie, Pneumokokken
Lernziele
Nach Lektüre dieses Beitrages
sind Sie mit der Epidemiologie und dem Erregerspektrum der CAP vertraut,
kennen Sie die Definition der CAP und wissen, wie man sie klinisch diagnostiziert,
sind Sie in der Lage, die Prognose bei CAP anhand des CRB65-Scores und zusätzlicher Parameter zu beurteilen,
sind Sie vertraut mit der rationalen Labordiagnostik und bildgebenden Diagnostik bei CAP,
sind Sie über die kalkulierte Therapie und Prävention der CAP informiert.
Epidemiologie und Einteilung
Die ambulant erworbene Pneumonie (abgekürzt CAP nach community acquired pneumonia) ist unverändert die häufigste ernste Infektionskrankheit in den entwickelten Ländern. In Deutschland werden jährlich 270.000-290.000 stationär behandelte Fälle registriert, die Gesamtzahl inklusive der ambulant behandelten Patienten wird auf 400.000-600.000 Fälle geschätzt. Dabei ist die Altersverteilung sehr unterschiedlich: die Krankenhausstatistik zeigt, dass inzwischen über die Hälfte der Patienten, die mit CAP aufgenommen werden, über 70 Jahre alt sind (Abb. 1).
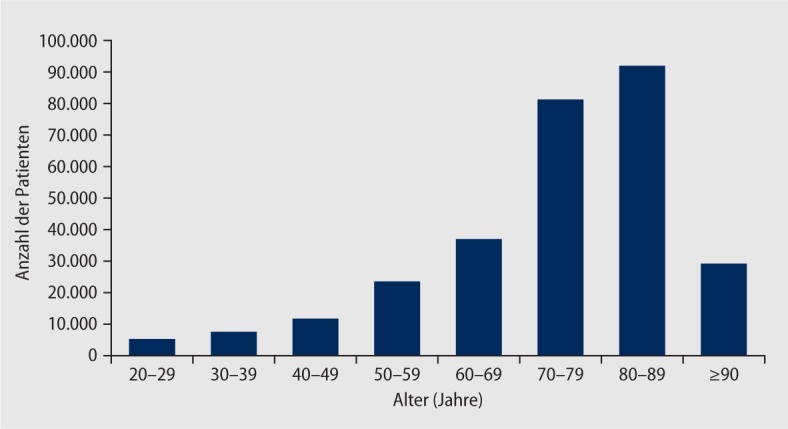
Neben einer allgemein erhöhten Infektanfälligkeit („Immunoseneszenz“), die sich u. a. in einer verminderten Antikörperantwort nach Pneumokokkenimpfung ausdrückt, spielt die Polymorbidität im Alter und der eingeschränkte funktionelle Status vieler Senioren die Hauptrolle. Die demografische Entwicklung in Deutschland lässt daher eine weitere Zunahme der Pneumonieinzidenz in den kommenden Dekaden erwarten.
Das Update der nationalen CAP-Leitlinie von 2016 [1] hat auf diese Entwicklung mit einer neuen Einteilung der CAP reagiert: es werden eine Gruppe 1a mit guter Funktionalität, eine Gruppe 1b mit eingeschränkter Funktionalität, aber kurativem Anspruch und eine Gruppe 2 mit schwerer Komorbidität und infauster Prognose (palliatives Therapiekonzept) unterschieden. Diese Unterscheidung hat praktische Bedeutung im Hinblick auf Versorgungspfade (z. B. Verzicht auf stationäre Einweisung in Gruppe 2) und diagnostische und therapeutische Konzepte.
Abgegrenzt werden gegenüber der CAP...
Nosokomiale Pneumonien: Diese manifestieren sich definitionsgemäß mindestens 48 Stunden nach Krankenhausaufnahme; im ambulanten Bereich auch bis zu drei Monate nach Entlassung von dem letzten Krankenhausaufenthalt, denn solange besteht mindestens ein erhöhtes Risiko für Besiedlung und Infektionen mit Hospitalerregern.
Pneumonien bei Immundefizienz: Im Rahmen des Immundefizits ist ein zusätzlich erweitertes Erregerspektrum unter Einschluss von Erregern wie u. a. Aspergillus spp., Pneumocystis jiroveci , Nokardien oder Zytomegalieviren zu berücksichtigen. In diese Gruppe gehören unter anderem Patienten mit HIV-Infektion im Stadium AIDS, Patienten nach Organ- oder Stammzelltransplantation, Patienten mit hämatologischen oder soliden Neoplasien unter Chemotherapie und die zunehmende Gruppe der Patienten mit Autoimmunopathien unter Therapie mit Immunsuppressiva und/oder Biologika.
Gegenüber der CAP werden die nosokomiale Pneumonie sowie Pneumonien bei Immundefizienz abgegrenzt
Diagnose
Die Diagnose der Pneumonie wird in erster Linie klinisch gestellt. Diagnosekriterien sind
Zeichen der Infektion wie Fieber > 38.0 C; dies kann bei älteren Patienten fehlen,
respiratorische Symptome wie Husten, aber auch Dyspnoe und atemabhängige Thoraxschmerzen bei Pleurabeteiligung,
neurologische Symptome wie Desorientiertheit/Bewußtseinsstörung besonders bei älteren Patienten.
Die Diagnose wird bestätigt durch neu aufgetretene oder progrediente Röntgeninfiltrate. Falls die Durchführung der Röntgenuntersuchung in der Praxis nicht möglich ist, kann ein eindeutiger fokaler Auskultationsbefund als gleichwertig angesehen und auf eine Röntgenuntersuchung initial verzichtet werden (siehe dazu Abschnitt Diagnostik).
Wesentliches Ziel der klinischen Diagnose ist die Abgrenzung der Pneumonie von der in der Praxis wesentlich häufigeren akuten Bronchitis: nur bei etwa 5% der Patienten mit respiratorischen Symptomen, die auf eine Infektion der unteren Atemwege hinweisen, wurde in der Praxis eine Pneumonie diagnostiziert. Diese Unterscheidung ist aber von zentraler Bedeutung, da eine akute Bronchitis im Gegensatz zur Pneumonie nicht mit Antibiotika behandelt werden sollte und weil die Diagnose Pneumonie einen erhöhten Überwachungsbedarf induziert.
Die demografische Entwicklung in Deutschland lässt eine weitere Zunahme der Pneumonieinzidenz in den kommenden Dekaden erwarten
Erregerspektrum und Resistenz
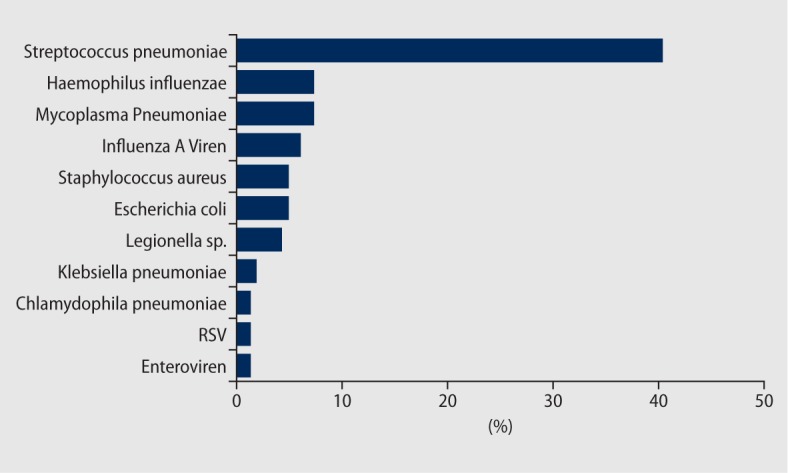
Einen repräsentativen Überblick zeigt Abb. 2 nach den Ergebnissen der CAPNETZ-Kohorte [3], die seit 2002 multizentrisch Patienten mit CAP rekrutiert. Das Erregerspektrum der CAP ist in Mitteleuropa in den letzten Dekaden relativ konstant und umfasst :
Pneumokokken · Sie stehen trotz verstärkter Impfaktivitäten mit weitem Abstand an erster Stelle. Sie werden bei CAP am häufigsten in der Blutkultur gefunden, etwa 25% der Pneumokokkenpneumonien verlaufen bei hospitalisierten Patienten bakteriämisch. Die Erreger sind in Deutschland fast ausnahmslos Penicillin-empfindlich, während im südlichen und östlichen Ausland teils hohe Resistenzraten vorliegen. Auch die Makrolidresistenz hat in der letzten Dekade auf unter 10% abgenommen.
Hämophilus influenzae · Er kolonisiert die Atemwege v. a. bei Rauchern und Patienten mit obstruktiven Lungenerkrankungen. Er verursacht Infektexazerbationen der COPD und Infektionen der oberen Atemwege, aber auch Pneumonien, meist ambulant erworben. Bei Hämophilus influenzae muss in etwa 10% mit Ampicillin-Resistenz gerechnet werden, die durch Einsatz eines durch Betalaktamaseinhibitor geschützten Penicillins umgangen werden kann. Alternativ sind Cephalosporine der II. oder III. Generation wirksam; selten finden sich neuerdings die resistenteren BLNAR-Stämme (Betalactamase-negative antimicrobial resistant).
Mykoplasmen · Sie gehören zu den sogenannten atypischen Pathogenen. Sie besitzen nur eine unvollständige Zellwand und sind einer Therapie mit Betalaktamantibiotika nicht zugänglich. Es erkranken hauptsächlich Kinder, Jugendliche und junge Erwachsene. Der Erreger ist kontagiös, Gruppenerkrankungen bei engem Kontakt kommen vor. Die Inzidenz schwankt in Zyklen von 5-7 Jahren, die letzte größere Welle in Deutschland wurde 2012-2013 beobachtet.
Legionellen · Sie sind Umweltkeime, die intrazellulär in Einzellern in Oberflächenwasser und in Heizungskreisläufen siedeln. Die ideale Wachstumstemperatur für den Erreger besteht bei 40-60°C. Ausbrüche entstehen gehäuft, wenn größere Wassersysteme in Rückkühlwerken, Abwässersystemen, Wellness-Oasen, auf Kreuzfahrtschiffen, in Hotels oder Krankenhäusern besiedelt sind. Diese Bedingungen finden sich häufiger bei Fernreisen, sodass etwa 25% der gemeldeten Fälle reiseassoziiert sind. Umgekehrt bedeutet dies, dass die Mehrzahl der Erkrankungen sporadisch auftritt. Individuelle Risikofaktoren sind Alter, Rauchen, chronische Lungenerkrankungen und Immundefizite. Die Erkrankung ist nicht von Mensch zu Mensch übertragbar.
Influenza A und B-Viren · Sie spielen saisonal eine bedeutende Rolle bei der CAP — einerseits indirekt als Auslöser einer viralen Tracheobronchitis mit Schädigung der Bronchialepithels, die den Boden für eine bakterielle Superinfektion in Form der CAP bereitet, andererseits direkt als ursächlicher Erreger einer primären Viruspneumonie, die sich als interstitielle nichteitrige Pneumonie manifestiert. Das Letalitätsrisiko ist bei beiden Formen erhöht. Eine antivirale Therapie mit Neuraminidaseinhibitoren ist bei nachgewiesener Influenzapneumonie und generell bei Influenza mit schwerem Verlauf und Notwendigkeit der Hospitalisierung erforderlich und sollte möglichst innerhalb der ersten 48 Stunden begonnen werden.
RS-Viren („respiratory syncytial virus“) · Sie werden in den letzten Jahren vermehrt auch bei Erwachsenen als Pneumonieerreger nachgewiesen. Die Klinik ist von der Influenza nicht zu unterscheiden, die Infektion tritt saisonal gehäuft wie die Influenza v. a. in den Wintermonaten auf und kann eine längere Phase von Fatigue, Husten und bronchialer Hyperreaktivität nach sich ziehen.
Staphylococcus aureus und gramnegative Enterobakterien wie Klebsiella pneumoniae · Diese Erreger sind seltener ursächlich bei CAP, meist liegen dann schwere Komorbiditäten oder ein Aspirationssyndrom vor. Multiresistente Erreger wie MRSA und Pseudomonas aeruginosa finden sich bei CAP in Mitteleuropa sehr selten (< 1%); bei ihrem Nachweis liegt meist eine bislang nicht realisierte nosokomiale Infektionsquelle oder eine vorbestehende Besiedlung etwa bei Bronchiektasie vor.
Bei Hämophilus influenzae muss in etwa 10% mit Ampicillin-Resistenz gerechnet werden
Zur Einschätzung der Prognose dient der CRB65-Score
Bei ungewöhnlichen Expositionen und Fernreisen sollte auch an seltene bzw. „exotische“ Erreger gedacht werden (Tab. 1).
| Erreger | Erkrankung | Exposition/Region | Diagnostik | Therapie |
|---|---|---|---|---|
| Chlamydia psittaci | Ornithose | Vögel (Papageien, Sittiche u.a.) | Serologie, PCR | Tetracyclin, Chinolon |
| Coxiella burnetii | Q-Fieber | Schafe | Serologie, PCR | Tetracyclin |
| Francisella tularensis | Tularämie | Hasen, Kaninchen | Serologie, PCR | Tetracyclin |
| Pseudomonas pseudomallei | Melioidose | Südostasien | Kultur | |
| Mycobacterium tuberculosis | Tuberkulose | Hochendemieregionen, Kontaktpersonen | Antituberkulotika | |
| Endemische Pilze (Histoplasma u.a.) | Histoplasmose Kokzidiomykose | USA (gefährdete Regionen), Speleologen | Biopsie + Kultur | Antimykotika |
| Echinococcus granulosus | Echinokokkose | Südosteuropa, Nahost | Serologie | Albendazol, OP |
| Middle East respiratory syndrome (MERS) Coronavirus | MERS | Arabische Halbinsel | PCR | Intensivtherapie |
Risikobeurteilung und Überwachung
Zur Einschätzung der Prognose dient in der Praxis der CRB65-Score, der mit vier einfachen, sofort verfügbaren Variablen eine gute Einschätzung erlaubt, wie hoch das Sterblichkeitsrisiko liegt. Der Score wird aus folgenden Faktoren ermittelt:
C: „confusion“ (neu aufgetretene oder zunehmende Bewußtseinsstörung)
R: „respiratory rate“ ( Atemfrequenz > 30/min)
B: „blood pressure“ (systolischer Blutdruck < 90 mmHg) 65: Alter > 65 Jahre.
Wenn kein Schweregradkriterium erfüllt ist (CRB65 = 0), ist die Letalität minimal (< 1%); eine ambulante Behandlung ist in der Regel möglich. Bei CRB65 1-2 liegt die Letalität um 8%, sodass eine Hospitalisierung zu empfehlen ist. Ein CRB65 von 3-4 geht mit einer Letalität > 10% einher und erfordert einen erhöhten Überwachungsaufwand im Krankenhaus, insbesondere in der Initialphase. Der Score sollte ergänzt werden durch eine Einschätzung der folgenden Zusatzparameter, die Risiken anzeigen, welche durch den CRB65 nicht ausreichend erkannt werden:
Funktioneller Status: bei Patienten mit schlechtem funktionellen Status (> 50% Bettlägerigkeit) ist der Score nicht gut validiert.
Komorbiditäten wie eine instabile Herzinsuffizienz, COPD oder Niereninsuffizienz
Sauerstoffsättigung < 90%: Falls verfügbar sollte eine Messung der Sauerstoffsättigung mittels Pulsoxymeter erfolgen, da eine Hypoxämie zusätzlich zu den CRB65 Kriterien einen unabhängigen Risikofaktor darstellt.
Diagnostik und Differenzialdiagnostik
Labordiagnostik
In der Praxis ist eine umschriebene Labordiagnostik (Blutbild, C-reaktives Protein, in Abhängigkeit von Komorbiditäten ergänzt durch Elektrolyte, Blutzucker, Nieren- und Leberparameter) in der Regel ausreichend, die klinische Diagnose führt.
Mikrobiologische Diagnostik
Eine Erregerdiagnostik ist kulturell, durch serologische oder molekulare Verfahren möglich. Bei ambulant zu behandelnden Patienten ist sie entbehrlich, wenn nicht besondere Aspekte vorliegen wie eine vorausgegangene Fernreise oder Risikofaktoren für eine Besiedlung mit multiresistenten Erregern. Diese finden sich zwar häufiger im nosokomialen Umfeld, spielen aber im ambulanten Umfeld inzwischen auch eine zunehmende Rolle.
Auf eine kulturelle Sputumuntersuchung sollte i. d. R. verzichtet werden, da unter Praxisbedingungen die Kultivierung pathogener Erreger auf diesem Wege selten gelingt und die Wahrscheinlichkeit groß ist, dass stattdessen Mikroorganismen unklarer Relevanz oder eindeutige Nonpathogene isoliert werden. Derartige Befunde verleiten nicht selten zu unsachgemäßen Therapien und finden sich besonders häufig bei Patienten nach frustraner Vorbehandlung. Punktionswürdige Pleuraergüsse werden kulturell zum Ausschluss eines Empyems am besten klinisch abgeklärt, hierzu gehört auch die pH-Bestimmung im Exsudat. Auch die Abnahme von Blutkulturen kann zwar bereits ambulant erfolgen, bei Verdacht auf Bakteriämie und/oder Sepsis ist die umgehende Vorstellung in einer Klinikaufnahme die vordringliche Maßnahme.
Serologische Tests führen bei respiratorischen Erregern selten zum Ziel, da im Akutstadium bei den meisten Erregern nicht mit aussagekräftigen Ergebnissen gerechnet werden kann. Von den Antigentests kann bei klinischem Verdacht der Urin-Antigentest auf Legionellen empfohlen werden, der bei den in Deutschland vorherrschenden Stämmen von Legionella pneumophila meist positiv ausfällt.
Molekulare Verfahren: Eine Influenza wird in der Praxis klinisch diagnostiziert. In Zweifelsfällen, etwa bei Auftreten außerhalb der Saison, untypischer Klinik oder schwerem Verlauf, ist die PCR aus dem Rachenabstrich oder aus nasopharyngealem Sekret hilfreich und effektiver als die alternativ angebotenen Antigentests. Von neuerdings angebotenen Multiplex-PCRs zum simultanen molekularen Nachweis multipler Pneumonie-Erreger ist derzeit abzuraten; diese Tests sind klinisch noch nicht ausreichend validiert, aussagekräftige Kosten-Nutzen-Analysen stehen aus.
Auf eine kulturelle Sputumuntersuchung sollte i.d.R. verzichtet werden
Radiologische Diagnostik
Die Röntgen-Thorax-Aufnahme in zwei Ebenen im Stehen bleibt die Standardmethode zum Nachweis pneumonischer Infiltrate beim gehfähigen Patienten. Insbesondere der Nachweis von Pneumobronchogrammen hat einen hohen diagnostischen Stellenwert, auch in der Abgrenzung zu Konsolidierungen anderer Ätiologie. Der Nachweis multilobärer Infiltrate ist ein wichtiger Indikator schwerer Pneumonien, insbesondere bei jüngeren Patienten, die zu Beginn sonst wenige Einschränkungen zeigen (Abb. 3). Bei bettlägerigen Patienten ist die Behelfsaufnahme im Liegen jedoch nur bedingt aussagekräftig; Studien in Klinikaufnahmen mit simultanem Vergleich durch CT zeigten in jeweils 30% falsch-positive und falsch-negative Resultate. Wo verfügbar, ist die Thoraxsonografie eine empfehlenswerte bedside Methode, mit der periphere Konsolidationen mit und ohne Pleurabeteiligung auch ambulant zuverlässig nachgewiesen werden können. Die radiologische Bildgebung hat weiterhin einen hohen Wert in der Differenzialdiagnose febriler Patienten mit Lungeninfiltraten, wobei Diagnosen wie Lungenembolie, Sarkoidose oder Tumoratelektase eine weiterführende Diagnostik mittels CT erfordern. Zum Ausschluss kardial bedingter Infiltrate kann auch die Echokardiografie hilfreich sein.
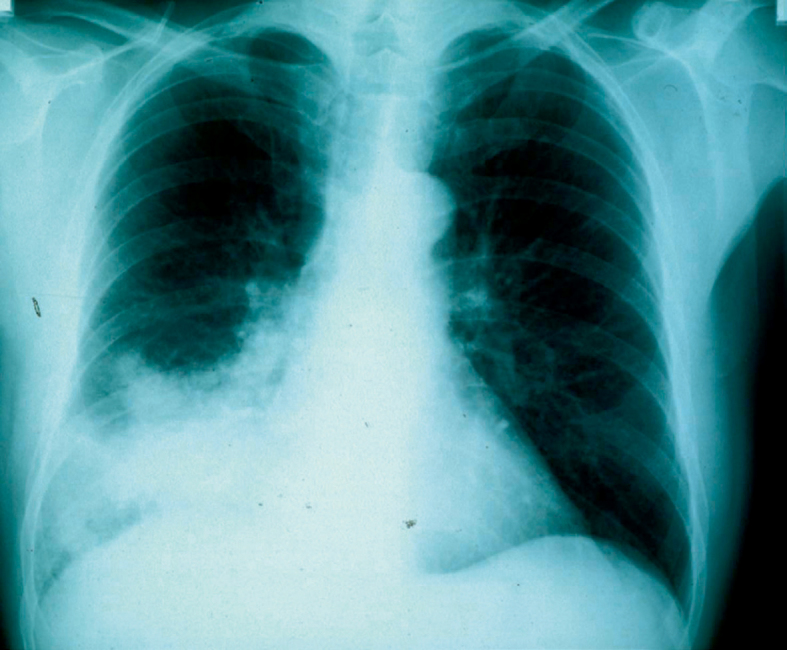
Standardmethode zum Nachweis pneumonischer Infiltrate beim gehfähigen Patienten ist die Röntgenthorax-Aufnahme in zwei Ebenen im Stehen
Eine Kombinationstherapie aus Betalaktamantibiotika und Makroliden ist bei schweren Pneumonien obligat
Aminopenicilline stehen in der ambulanten Therapie der CAP unverändert im Vordergrund
Therapie
Die kalkulierte Therapie der CAP wird leitliniengerecht nach Schweregrad und Vorliegen von Komorbiditäten durchgeführt. Tab. 2 zeigt die Empfehlungen des Leitlinien-Updates der deutschen Fachgesellschaften von 2016 für leichtgradige Pneumonien mit und ohne Komorbiditäten. Aminopenicilline stehen in der ambulanten Therapie unverändert im Vordergrund. Sie erreichen neben den Pneumokokken meist auch Haemophilus influenzae sowie grampositive Anaerobier. Mykoplasmen (im Alter von über 40 Jahren sehr selten), Legionellen und respiratorische Viren werden nicht erfasst. Die Kombination mit einem Betalaktamaseinhibitor verbreitert das Spektrum auf Staphylococcus aureus, Enterobakterien und gramnegative Anaerobier. Diese Erreger sind eher bei Patienten mit schweren Komorbiditäten oder Risikofaktoren für Aspiration zu erwarten, daher wird die Kombination mit dem Betalaktamaseinhibitor in dieser Patientengruppe empfohlen.
| Schweregradklasse | Primärtherapie | Alternativtherapie |
|---|---|---|
| Leichte Pneumonie ohne Komorbidität (orale Therapie) | Amoxicillin | Moxifloxacin, Levofloxacin; Clarithromycin, Azithromycin; Doxycyclin |
|
Leichte Pneumonie mit Komorbidität (orale Therapie) - chronische Herzinsuffizienz - ZNS-Erkrankungen mit Schluck-störungen - Schwere COPD, Bronchiektasen - Bettlägerigkeit, PEG |
Amoxicillin/Clavulansäure | Moxifloxacin, Levofloxacin |
Als Alternativen, etwa bei Penicillinallergie, kommen bei unkomplizierten Infektionen Makrolide und Tetracykline, bei Patienten mit Komorbiditäten auch neuere Fluorchinolone in Betracht. Ciprofloxacin ist nicht pneumokokkenwirksam und wird daher bei CAP in der kalkulierten Therapie nicht empfohlen. Oralcephalosporine werden wegen ihrer unzuverlässigen Bioverfügbarkeit insbesondere bei älteren Patienten für die kalkulierte Initialtherapie nicht mehr empfohlen. In einer Studie der CAPNETZ-Gruppe war ihr Gebrauch im ambulanten Bereich im Vergleich zu anderen Antibiotikagruppen mit einer erhöhten Rate an Therapieversagen, definiert durch die Notwendigkeit einer Hospitalisierung, assoziiert [4]. Gegen ihren Einsatz in der Sequenztherapie nach Entlassung, z. B. nach Initialtherapie mit parenteralen Cephalosporinen, bestehen dagegen keine Einwände.
Eine Kombinationstherapie aus Betalaktamantibiotika und Makroliden wird fakultativ bei mittelschweren und obligat bei schweren Pneumonien (Tab. 3) aus zwei Gründen durchgeführt:
Bei CAP mit erhöhtem Schweregrad sollte immer eine legionellenwirksame Initialtherapie durchgeführt werden, bis diese Ätiologie entweder nachgewiesen oder ausgeschlossen ist.
Makrolide zeigen neben ihren antimikrobiellen Eigenschaften ausgeprägte antiinflammatorische Effekte, die in der Akutphase septischer Pneumonien hilfreich sind und in Metaanalysen von Beobachtungsstudien mit einer Reduktion der Krankenhausletalität assoziiert waren.
| Schweregradklasse | Primärtherapie | Alternativtherapie | |
|---|---|---|---|
| Mittelschwere Pneumonie (in der Regel Sequenztherapie) |
Amoxicillin/ Clavulansäure Ampicillin /Sulbactam Cefuroxim Ceftriaxon Cefotaxim |
+/-Makrolid für 3 Tage +/-Makrolid für 3 Tage +/-Makrolid für 3 Tage +/-Makrolid für 3 Tage +/-Makrolid für 3 Tage |
Moxifloxacin, Levofloxacin |
| Schwere Pneumonie (Beginn immer i.v., Sequenztherapie prinzipiell möglich) |
Piperacillin/ Tazobactam Ceftriaxon Cefotaxim |
jeweils + Makrolid für 3 Tage |
Moxifloxacin, Levofloxacin (Monotherapie nicht bei septischem Schock) |
Während der zweite Effekt in der Praxis selten eine Rolle spielen dürfte, kann das erste Motiv (Verbreiterung des Spektrums auf „atypische“ Pathogene, d. h. insbesondere Mykoplasmen und Legionellen) bei entsprechender Anamnese durchaus von Bedeutung sein. Alternativ kann bei Legionellenverdacht auch primär mit einem neueren Chinolon therapiert werden, das sowohl Pneumokokken als auch Legionellen zuverlässig erfasst. Wenn die Legionellose durch das Ergebnis des Urin-Antigentests ausgeschlossen wurde, kann die Therapie im Verlauf deeskaliert werden.
Therapiekontrolle, Therapiedauer
Nach 24-48 Stunden sollte je nach Situation telefonisch oder durch direkten Kontakt eine Reevaluation erfolgen, um den Therapieerfolg zu kontrollieren und insbesondere ein frühes Therapieversagen mit Progress auszuschließen. Die Therapiedauer der CAP in der Praxis sollte im Regelfall fünf bis sieben Tage betragen, falls keine Komplikationen ein anderes Vorgehen erfordern.
Prävention
Neben allgemeinen Aspekten wie Tabakkarenz, Einschränkung des Alkoholkonsums und Einstellung von Komorbiditäten sind die beiden wichtigsten Maßnahmen zur Prävention der CAP die Influenzaimpfung und die Pneumokokkenimpfung:
Hinsichtlich der Influenzaimpfung wird von der Ständigen Impfkommission (STIKO) und den nationalen Fachgesellschaften übereinstimmend empfohlen, bei Patienten > 60 Jahren und bei allen Patienten mit chronischen Erkrankungen jährlich präsaisonal eine Influenzaimpfung durchzuführen [5]. Diese Maßnahme vermindert nach großen Beobachtungsstudien das Pneumonierisiko, wobei die Effektivität jeweils vom Ausmaß der Influenzasaison und von der Passgenauigkeit der bereits ein halbes Jahr vor Beginn der Saison ausgewählten Vakzine abhängt.Tetravalente Vakzinen sind nach neueren Daten vorzuziehen. Die Diskussion über bessere Effektivität vs. unerwünschte Wirkungen von höher dosierten bzw. stärker adjuvantierten Vakzinen ist noch nicht abgeschlossen.
Die Situation hinsichtlich der Pneumokokkenvakzine ist komplexer: Es stehen zwei Vakzinen mit unterschiedlichen Eigenschaften (Tab. 4) zur Verfügung:
| Polysaccharidvakzine (PPV) | Konjugatvakzine (PCV) | |
|---|---|---|
| Serotypen | 23/94 | 13/94 |
| Immunantwort | B — Lymphozyten | B + T-Zellen, IgA-Switch |
| Invasive Infektionen | Reduziert | Reduziert |
| Pneumonierate | Fraglich reduziert | Reduziert |
| Kolonisation | Unbeeinflusst | Reduziert |
| Replacement | (+) | ++ |
Die Polysaccharidvakzine (PPV23) erfasst 23 Pneumokokken-Serotypen, ist aber nur mäßig immunogen, was sich vor allem bei Senioren, Patienten mit schweren Komorbiditäten und immungeschwächten Personen negativ auswirkt. Dieser Personenkreis ist aber derjenige , welcher vor allem von der Indikationsimpfung profitieren soll. Bei Nachimpfung nach fünf bis sechs Jahren wurde eine Hyporesponsivität beobachtet.
Die Konjugatvakzine (PCV13) ist durch die Kopplung an ein Toxoid deutlich immunogener. Sie hat als Regelimpfung im frühen Kindesalter zu einem deutlichen Rückgang der Vakzineserotypen in dieser Population geführt. Auch bei Senioren zeigte eine randomisierte Studie über drei Jahre die Effektivität des neueren Impfstoffs. Dies ist einerseits erwünscht, führt aber andererseits zum Replacement durch nicht in PCV13 enthaltenen Serotypen.
Zum Schutz vor einer Pneumokokkeninfektion stehen zwei Vakzine mit unterschiedlichen Eigenschaften zur Verfügung
Die STIKO empfiehlt die Impfung mit PPV23 bei Senioren und Komorbiditäten, den Konjugatimpfstoff (PCV13) dagegen nur bei Patienten mit Immundefiziten, lässt aber hier bei der Eingrenzung des betroffenen Personenkreises einen gewissen Spielraum. Die PCV13-Impfung sollte wegen der besseren Abdeckung der Serotypen nach einem Intervall von sechs Monaten bis zu einem Jahr von einer PPV23-Impfung gefolgt werden („Sequenzimpfung“). Es handelt sich hierbei derzeit um die effektivste Lösung, die weitere epidemiologische Entwicklung bleibt abzuwarten.
Fazit für die Praxis
Eine ambulante Behandlung der CAP ist in der Mehrzahl der Fälle möglich, die Diagnose erfolgt klinisch.
Vor der Diagnose CAP sollte klar sein, dass keine nosokomiale Infektion oder Pneumonie bei Immundefizit vorliegt, da diese Diagnosen zu völlig anderen Konsequenzen führen.
Bei der Entscheidung über die Notwendigkeit der stationären Einweisung hilft der mit wenigen klinischen Parametern leicht zu erhebende CRB65-Score. Patienten mit erhöhtem Schweregrad oder instabilen Komorbiditäten sollten in jedem Fall initial hospitalisiert werden.
Eine Röntgen-Thoraxaufnahme erhöht die Sicherheit der Diagnose, ist aber bei eindeutigem Auskultationsbefund nicht essenziell und kann unterbleiben, wenn die logistischen Voraussetzungen nicht gegeben sind.
Eine mikrobiologische Diagnostik ist in der Praxis nur bei besonderen Fragestellungen wie Infektion nach Fernreise oder erfolglosen Vortherapien sinnvoll.
Die leitliniengerechte Therapie der unkomplizierten CAP hat bei rechtzeitiger Diagnose mit über 90% eine hohe primäre Erfolgsquote. Die Therapiedauer sollte im Regelfall auf fünf bis sieben Tage begrenzt bleiben.
Bei Patienten > 60 Jahren und bei allen Patienten mit chronischen Erkrankungen sollte jährlich präsaisonal eine Influenzaimpfung erfolgen

CME-Fragebogen
Ambulant erworbene Pneumonie bei Erwachsenen
Welche Aussage zur Pneumokokkeninfektion ist richtig?
◯ Die Bedeutung der Pneumokokken als Pneumonieerreger hat aufgrund der Pneumokokkenimpfung bei Erwachsenen abgenommen.
◯ Pneumokokkenpneumonien verlaufen sehr selten bakteriämisch.
◯ Die Konjugatvakzine schützt vor Infektionen mit allen relevanten Pneumokokken-Serotypen.
◯ Die Polysaccharidvakzine zeichnet sich durch eine hohe Immunogenität aus.
◯ Bei Patienten mit Immundefiziten ist die Sequenzimpfung derzeit die beste Wahl.
Eine 23-jährige, sonst gesunde Studentin kommt aus einem „Backpacker“-Urlaub im Mittelmeerraum mit Fieber und Husten und einem Lungeninfiltrat im rechten Unterlappen zurück. Eine Vortherapie mit Amoxicillin war ohne Erfolg. An welchen Erreger würden Sie nicht denken?
◯ Penicillin-resistente Pneumokokken
◯ Hämophilus influenzae
◯ Mycoplasma pneumoniae
◯ Legionella pneumophila
◯ Pseudomonas aeruginosa
Zur Diagnose einer CAP ist folgender Test bzw. Material in der Praxis in der Regel ungeeignet:
◯ Sputum
◯ Röntgen-Thorax
◯ Pleurapunktion bei parapneumonischem Erguss
◯ Auskultation
◯ Labor mit Blutbild und CRP
Welche Aussage ist falsch? Für die CAP bei älteren Patienten ist charakteristisch...
◯ eine erhöhte Atemfrequenz.
◯ der Nachweis von Enterokokken im Sputum.
◯ ein produktiver oder unproduktiver Husten.
◯ ein konsolidierendes Infiltrat im Röntgen-Thorax.
◯ ein gestörtes Sensorium.
Ein 78-jähriger Patient mit KHK, COPD (regelmäßige Anwendung inhalativer Steroide) und Adipositas erkrankt fünf Wochen nach Bypass-OP und anschließender Rehabilitation im häuslichen Umfeld an einer Pneumonie. Es handelt sich hierbei am ehesten um eine...
◯ ambulant erworbene Pneumonie.
◯ Pflegeheim-assoziierte Pneumonie.
◯ Pneumonie unter Immunsuppression.
◯ nosokomiale Pneumonie.
◯ atypische Pneumonie.
Ein 55-jähriger Installateur, Zigarettenraucher, kommt mit Fieber und Husten in Ihre Sprechstunde. Der Notdienst hat bereits klinisch eine Pneumonie diagnostiziert und einen Legionellen-Antigentest im Urin veranlasst, der positiv ausgefallen ist. Welche der folgenden Maßnahmen ist nicht sinnvoll?
◯ Röntgen-Thorax
◯ Erhebung des CRB65-Scores
◯ Einleitung einer Antibiotikatherapie mit einem Oralcephalosporin
◯ Einleitung einer Antibiotikatherapie mit Levofloxacin
◯ Einleitung einer Antibiotikatherapie mit Clarithromycin
Bei einer 66-jährigen Patientin haben Sie eine CAP diagnostiziert. Zur Klärung der Prognose und der Hospitalisierung erheben Sie den CRB65-Score. Die Atemfrequenz beträgt 22, der Blutdruck liegt bei 110/70 mmHg, es liegt keine Bewußtseinseinschränkung vor. Der CRB65-Score liegt bei:
◯ 0
◯ 1
◯ 2
◯ 3
◯ 4
Welche Aussage ist richtig? Die Kombination eines Aminopenicillins mit einem Betalaktamase-Inhibitor...
◯ verbessert die Wirkung auf Pneumokokken.
◯ wirkt auch gegen Mykoplasmen und Legionellen.
◯ verbreitert das Spektrum gegenüber gramnegativen Erregern und Staphylokokken.
◯ ist Mittel der Wahl zur Therapie der unkomplizierten CAP.
◯ ist bei Patienten mit Niereninsuffizienz kontraindiziert.
Die Influenzaimpfung soll...
◯ jährlich im Januar durchgeführt werden.
◯ allen Erwachsenen mit akuten Erkrankungen angeboten werden.
◯ Allen Erwachsenen > 60 Jahren angeboten werden.
◯ allen Erwachsenen unabhängig vom Alter angeboten werden.
◯ nach neueren Daten vorzugsweise in ihrer trivalenten Form angeboten werden.
Welche Aussage zu Viren und CAP ist richtig?
◯ Viren spielen in der Ätiologie der CAP keine Rolle.
◯ RS-Viren spielen ausschließlich bei Infektionen im Säuglingsalter eine Rolle.
◯ Die Influenzapneumonie stellt eine Indikation zur Therapie mit Neuraminidasehemmern dar.
◯ Die Pneumonie bei Influenza ist immer Folge einer bakteriellen Superinfektion.
◯ Die Influenza-Diagnostik erfolgt am besten serologisch.
Footnotes
Interessenkonflikt
K. Dalhoff gibt an, in den letzten 5 Jahren Vortragshonorare der Firmen Pfizer und Bayer Vital erhalten zu haben.
Der Verlag erklärt, dass die inhaltliche Qualität des Beitrags von zwei unabhängigen Gutachtern geprüft wurde. Werbung in dieser Zeitschriftenausgabe hat keinen Bezug zur CME-Fortbildung. Der Verlag garantiert, dass die CME-Fortbildung sowie die CME-Fragen frei sind von werblichen Aussagen und keinerlei Produktempfehlungen enthalten. Dies gilt insbesondere für Präparate, die zur Therapie des dargestellten Krankheitsbildes geeignet sind.
Literatur
- 1.S-3 Leitlinie Behandlung erwachsener Patienten mit ambulant erworbener Pneumonie und Prävention — Update 2016. www.awmf.de; AWMF-Registernummer 020 — 020 [DOI] [PubMed]
- 2.Qualitätsreport 2015 des Instituts für Qualitätssicherung und Transparenz im Gesundheitswesen (IQTIG)
- 3.www.CAPNETZ.de
- 4.Creutz P, Kothe H, Braun M, et al. Failure of ambulatory treatment in CAP patients leading to subsequent hospitalisation and its association with risk factors. J Pulmon Resp Med. 2013;3:1–7. [Google Scholar]
- 5.Empfehlungen der ständigen Impfkommission (STIKO): Robert Koch Institut, Epidemiologisches Bulletin 34/2017