Resumen
Objetivo
Describir las características y la evolución de los pacientes con bronquiolitis ingresados en una unidad de cuidados intensivos pediátricos. Comparar el tratamiento administrado pre y pospublicación de la guía de práctica clínica de la Academia Americana de Pediatría.
Diseño
Estudio descriptivo y observacional realizado entre septiembre de 2010 y septiembre de 2017.
Configuración
Unidad de cuidados intensivos pediátricos.
Pacientes
Menores de un año con bronquiolitis grave.
Intervenciones
Se compararon 2 períodos (2010-14 y 2015-17), antes y después de la modificación del protocolo de manejo de la bronquiolitis en el hospital, según las guías de la Academia Americana de Pediatría.
Principales variables
Sexo, edad, comorbilidades, gravedad, etiología, tratamiento administrado, infecciones bacterianas, soporte respiratorio e inotrópico, estancia y mortalidad.
Resultados
Se recogieron 706 pacientes, 414 (58,6%) varones, con una mediana de edad de 47 días (RIC 25-100,25). Mediana de escala de gravedad de bronquiolitis (BROSJOD) al ingreso: 9 puntos (RIC 7-11). La etiología por virus respiratorio sincitial se dio en 460 (65,16%) pacientes. El primer período (2010-14) incluyó 340 pacientes y el segundo (2015-17), 366 pacientes. En el segundo período se administraron más nebulizaciones de adrenalina y suero salino hipertónico, y más tratamiento con corticoides. Se usó más ventilación no invasiva y menos ventilación mecánica convencional y precisaron menos soporte inotrópico, sin diferencias significativas. La tasa de antibioterapia disminuyó de forma estadísticamente significativa (p = 0,003).
Conclusiones
Pese a la disminución en la antibioterapia, se debería limitar la utilización de nebulizaciones y corticoides en estos pacientes, como recomienda la guía.
Palabras clave: Insuficiencia respiratoria aguda, Bronquiolitis, Pediatría, Cuidados intensivos
Abstract
Objective
To describe the characteristics and evolution of patients with bronchiolitis admitted to a pediatric intensive care unit, and compare treatment pre- and post-publication of the American Academy of Pediatrics clinical practice guide.
Design
A descriptive and observational study was carried out between September 2010 and September 2017.
Setting
Pediatric intensive care unit.
Patients
Infants under one year of age with severe bronchiolitis.
Interventions
Two periods were compared (2010-14 and 2015-17), corresponding to before and after modification of the American Academy of Pediatrics guidelines for the management of bronchiolitis in hospital.
Main variables
Patient sex, age, comorbidities, severity, etiology, administered treatment, bacterial infections, respiratory and inotropic support, length of stay and mortality.
Results
A total of 706 patients were enrolled, of which 414 (58.6%) males, with a median age of 47 days (IQR 25-100.25). Median bronchiolitis severity score (BROSJOD) upon admission: 9 points (IQR 7-11). Respiratory syncytial virus appeared in 460 (65.16%) patients. The first period (2010-14) included 340 patients and the second period (2015-17) 366 patients. More adrenalin and hypertonic saline nebulizations and more corticosteroid treatment were administered in the second period. More noninvasive ventilation and less conventional mechanical ventilation were used, and less inotropic support was needed, with no significant differences. The antibiotherapy rate decreased significantly (P = .003).
Conclusions
Despite the decrease in antibiotherapy, the use of nebulizations and glucocorticoids in these patients should be limited, as recommended by the guide.
Keywords: Acute respiratory failure, Bronchiolitis, Pediatrics, Intensive care
Introducción
La bronquiolitis aguda es la causa más frecuente de infección del tracto respiratorio inferior en los lactantes, y de ingreso hospitalario en los menores de un año de vida1, 2. El virus respiratorio sincitial (VRS) es el microorganismo causante más común, aunque son muchos más los que provocan esta entidad, con diferencias en la gravedad3, 4, 5.
Se define como el primer episodio de dificultad respiratoria en lactantes menores de 24 meses, precedido por una infección de vías altas, habitualmente en período epidemiológico6. Hay una falta de consenso con respecto a la definición clínica de la bronquiolitis aguda en niños7, 8. Existe escasa bibliografía acerca de la tasa de ingreso; según la literatura revisada, entre el 2-3% de los pacientes con bronquiolitis aguda precisarán ingreso hospitalario, y de estos, entre el 3-11% requerirán ingreso en una unidad de cuidados intensivos pediátricos (UCIP), aumentando el porcentaje hasta el 50% en poblaciones con factores de riesgo asociados9, 10, 11.
Disponemos de escasas medidas terapéuticas que hayan demostrado eficacia en la bronquiolitis aguda. Numerosos estudios han puesto de manifiesto una amplia variabilidad en el manejo terapéutico12, 13. El tratamiento es meramente de apoyo y un enfoque conservador parece adecuado en la mayoría de los niños, especialmente para los más pequeños. Probablemente el hecho de que la mayoría de los pacientes evolucionen favorablemente, independientemente del tratamiento elegido, hace que sigamos utilizando algunos fármacos sin beneficio clínico demostrado, basándonos en preferencias profesionales o institucionales14, 15, 16, 17, 18. La bronquiolitis genera un gran problema, ya que la mayoría de las terapias farmacológicas han mostrado ser fútiles y las actuales guías recomiendan su restricción en la mayor parte de los casos. En consecuencia, existe una variabilidad extendida tanto de sobre como de infratratamiento. Es muy importante la evaluación del cumplimiento de las recomendaciones internacionales. La bronquiolitis, por tanto, genera un desafío en relación con el manejo general de cada paciente, el tratamiento específico y el soporte ventilatorio.
El objetivo de este estudio fue realizar un análisis epidemiológico, clínico, del tratamiento y de la evolución de los pacientes con insuficiencia respiratoria aguda grave secundaria a bronquiolitis que precisaron ingreso en una UCIP. Por otra parte, se compararon los mismos ítems entre 2 períodos de tiempo —pre y pospublicación de la guía de práctica clínica (GPC) para el diagnóstico, el manejo y la prevención de la bronquiolitis de la Academia Americana de Pediatría (AAP)19— para determinar si se habían seguido las nuevas recomendaciones en nuestra unidad.
Pacientes y métodos
Estudio descriptivo, observacional y de diseño post-hoc, en el que se realizó un análisis retrospectivo de una base de datos de tipo prospectivo de todos los pacientes afectos de bronquiolitis aguda grave menores de un año que ingresaron en la UCIP de un hospital de tercer nivel, durante el período comprendido entre septiembre de 2010 y septiembre de 2017. Se trata de un hospital de referencia, con disponibilidad de 320 camas, con un porcentaje de captura del 30% de todos los pacientes hospitalizados en la comunidad autónoma. Se realizó el diagnóstico de bronquiolitis según los criterios clásicos6. Se excluyeron aquellos pacientes cuyos padres no firmaron el consentimiento informado para su inclusión en la base de datos, y este fue el único criterio de exclusión del estudio.
En el 2010 se creó en la unidad un registro prospectivo de los pacientes con diagnóstico de bronquiolitis. La base de datos está disociada para garantizar el anonimato de los pacientes y se encuentra protegida mediante acceso por contraseña.
Se recogieron datos epidemiológicos, clínicos y microbiológicos: sexo, edad al ingreso, procedencia, comorbilidades (prematuros o exprematuros < 37 semanas de gestación, displasia broncopulmonar según necesidades de oxigenoterapia > 28 días, cardiopatía congénita o enfermedad neurológica), Pediatric Risk Score of Mortality III (PRISM-III)20, Bronchiolitis Score of Sant Joan de Déu (BROSJOD)21, etiología de la insuficiencia respiratoria aguda, tratamiento recibido, soporte respiratorio e inotrópico, necesidad de dispositivos invasivos, duración del ingreso en la UCIP, duración de la hospitalización global y mortalidad.
Se recogió una muestra de aspirado nasofaríngeo de todos los pacientes para estudio de PCR de virus respiratorios, procedimiento habitual en nuestra unidad. Nuestro laboratorio microbiológico determina la presencia de los VRS rinovirus, metapneumovirus, virus influenza y parainfluenza, adenovirus, coronavirus, enterovirus, así como la Bordetella pertussis y parapertussis. Dentro de la infección bacteriana invasiva se consideró la presencia de neumonía, infección del tracto urinario y sepsis, que se definieron según las guías internacionales22. Solo se incluyeron los casos confirmados. Se consideró bronquiolitis de origen nosocomial aquellos pacientes que llevaban más de 72 h ingresados en el hospital en el momento del diagnóstico y comunitaria a todo el resto. Se incluyó la recogida de muestras de hemocultivo, urinocultivo, cultivo de líquido cefalorraquídeo en aquellos pacientes con sospecha de infección bacteriana y aspirado nasofaríngeo o traqueal en aquellos pacientes que cumplieron criterios de sospecha de neumonía bacteriana (radiografía de tórax compatible, fiebre ≥ 38 °C, PCR ≥ 70 mg/dl y/o procalcitonina ≥ 1 ng/ml).
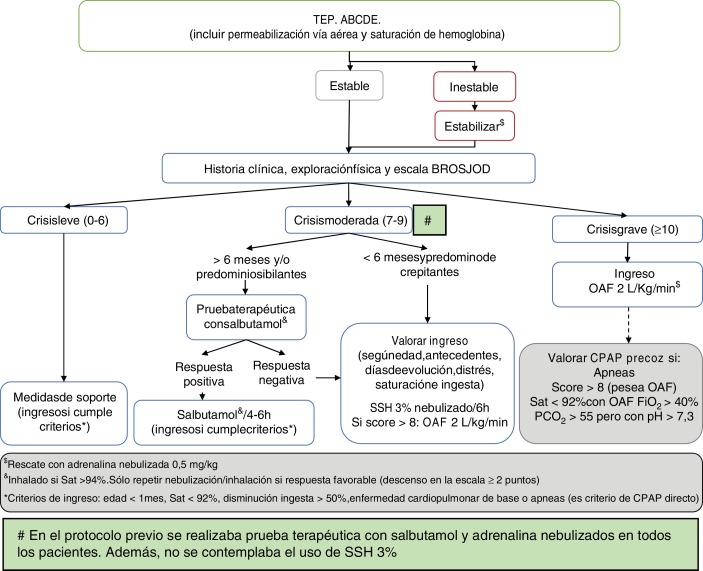
Se compararon los datos descritos en 2 períodos definidos entre 2010-14 y 2015-17, de acuerdo con la modificación del protocolo de tratamiento del hospital (fig. 1 ), según las recomendaciones de la GPC para el diagnóstico, el manejo y la prevención de la bronquiolitis de la AAP19. Como modificaciones a la guía de la AAP, se incluyó la prueba broncodilatadora con salbutamol a los pacientes mayores de 6 meses o con predominio de sibilantes para restringir su uso solo a los pacientes respondedores (descenso de 2 o más puntos en la escala de gravedad), la restricción del uso de adrenalina nebulizada a los casos más graves (los ingresados en la UCIP) como terapia de rescate, el suero salino hipertónico (SSH) al 3% como diluyente de la terapia broncodilatadora o, de forma aislada, en pacientes muy secretores sin respuesta a ningún fármaco y la indicación de corticoterapia solo en casos de crup postextubación, profilaxis de crup en los pacientes con más de 5 días de intubación y en la infección por rinovirus. Esta guía se presentó en una sesión general del servicio y del hospital, se colgó en la intranet de la institución y se enviaron correos electrónicos a todos los profesionales sanitarios para el conocimiento de dichos cambios.
Figura 1.
Algoritmo terapéutico de la bronquiolitis aguda en nuestro hospital tras la publicación de la Guía de Práctica Clínica de la Asociación Americana de Pediatría.
ABCDE: evaluación secuencial; BROSJOD: Bronchiolitis Score of Sant Joan de Déu (escala de gravedad clínica de la bronquiolitis); CPAP: presión positiva continua en la vía aérea; FiO2: fracción inspirada de oxígeno; OAF: oxigenoterapia de alto flujo; PCO2: presión parcial de dióxido de carbono en sangre; Sat: saturación de hemoglobina; SSH 3%: suero salino hipertónico al 3%; TEP: triángulo evaluación pediátrica.
Análisis estadístico
Las variables cualitativas se expresaron como tasas absolutas y relativas, mientras que las variables cuantitativas se definieron como media ± desviación estándar o mediana y rango intercuartil (RIC), según procediera. La comparación entre variables cualitativas se realizó mediante el test χ2, y las variables cuantitativas fueron comparadas mediante el test t de Student o la prueba U de Mann-Whitney, dependiendo de si la distribución de los datos era normal o no. El valor de significación estadística se estableció en 0,05. El análisis estadístico se realizó con el software SPSS® 21.0.
Consideraciones éticas
Este estudio fue aprobado por el Comité de Ética de Investigación Clínica institucional, en cumplimiento de la Declaración de Helsinki (última actualización Fortaleza, 2013).
Resultados
Resultados descriptivos
Se recogieron 706 pacientes con bronquiolitis aguda, 414 varones (58,6%). La edad mediana fue de 47 días (RIC 25-100,25 días). El 66,57% eran lactantes sanos, presentaban antecedentes de prematuridad 168 (23,79%), 43 (6,09%) sufrían algún tipo de cardiopatía, 4 (0,57%) patología pulmonar y 9 (1,27%) enfermedad neurológica. De todos ellos, el 5,38% (38 pacientes) habían recibido inmunoprofilaxis con palivizumab (30 pacientes con prematuridad y 8 pacientes con cardiopatía grave).
La tasa de ingreso en la UCIP de los pacientes que consultaron en urgencias y fueron diagnosticados de bronquiolitis fue del 7,74%. La mayoría de las bronquiolitis que ingresaron en la UCIP fueron de origen comunitario, siendo el 5,66% (40 casos) nosocomiales. Más de la mitad de los casos procedían de la planta de hospitalización (386 casos, 54,67%). Se detalla la procedencia de los pacientes en la tabla 1 . La mediana de la escala de gravedad (BROSJOD) fue de 9 puntos (RIC 7-11) y la mediana del valor PRISM-III, de 0 (RIC 0-3).
Tabla 1.
Características epidemiológicas y etiología
| Total (n = 706) |
Primer período (2010-2014) (n = 340) |
Segundo período (2015-2017) (n = 366) |
p | |
|---|---|---|---|---|
| Sexo masculino, n (%) | 414 (58,64) | 203 (59,70) | 211 (57,65) | 0,579 |
| Edad (días), mediana (RIC) | 47 (25-100,25) | 44 (24-87,75) | 49 (26-109) | 0,23 |
| Comorbilidades, n (%) | ||||
| Ninguna | 470 (66,57) | 224 (65,88) | 246 (67,21) | 0,653 |
| Prematuridad | 168 (23,79) | 81 (23.82) | 87 (23,77) | |
| Enfermedad cardíaca | 43 (6,09) | 23 (6,76) | 20 (5,46) | |
| Enfermedad pulmonar | 4 (0,57) | 2 (0,58) | 2 (0,54) | |
| Neuropatía | 9 (1,27) | 3 (0,88) | 6 (1,64) | |
| Otros | 12 (1,69) | 7 (2,05) | 5 (1,36) | |
| Procedencia, n (%) | ||||
| Urgencias | 95 (13,45) | 45 (13,23) | 50 (13,66) | 0,135 |
| Hospitalización | 386 (54,67) | 196 (57,65) | 190 (51,91) | |
| Otro hospital | 207 (29,32) | 92 (27,06) | 115 (31,42) | |
| Neonatos | 12 (1,69) | 5 (1,47) | 7 (1,91) | |
| Quirófano | 6 (0,85) | 2 (0,59) | 4 (1,09) | |
| Gravedad del ingreso, mediana (RIC) | ||||
| BROSJOD | 9 (7-11) | 8 (7-11) | 10 (8-11) | 0,186 |
| PRISM-III | 0 (0-3) | 1 (0-4) | 0 (0-3) | 0,442 |
| Etiología, n (%) | ||||
| Virus respiratorio sincitial | 460 (65,16) | 220 (64,71) | 240 (65,57) | 0,300 |
| Rinovirus | 102 (14,45) | 44 (12,94) | 58 (15,86) | |
| Metapneumovirus | 21 (2,97) | 9 (2,64) | 12 (3,29) | |
| Gripe (A y B) | 14 (1,98) | 4 (1,17) | 10 (2,73) | |
| Adenovirus | 5 (0,71) | 2 (0,58) | 3 (0,82) | |
| Coronavirus | 5 (0,71) | 2 (0,58) | 3 (0,82) | |
| Enterovirus | 3 (0,42) | 1 (0,29) | 2 (0,54) | |
| Bordetella | 22 (3,11) | 14 (4,41) | 8 (2,19) | |
| Todos negativos | 37 (5,24) | 18 (5,29) | 19 (5,19) | |
| No determinado | 13 (1,84) | 11 (3,23) | 2 (0,54) | |
| Coinfección vírica, n (%) | 153 (21,7) | 53 (15,59) | 100 (27,32) | 0,04 |
| Origen bronquiolitis, n (%) | ||||
| Comunitaria | 666 (94,33) | 322 (94,7) | 344 (93,99) | 0,47 |
| Nosocomial | 40 (5,66) | 18 (5,29) | 22 (6,01) | |
BROSJOD: Bronchiolitis Score of Sant Joan de Déu (escala de gravedad clínica de bronquiolitis); RIC: rango intercuartil.
La etiología por VRS se dio en 460 pacientes (65,16%), seguido de rinovirus y metapneumovirus en 102 (14,45%) y 21 (2,97%) pacientes, respectivamente. Hubo coinfección vírica en el 21,7% de los casos, siendo la más frecuente por VRS y rinovirus (40%), seguida de VRS y coronavirus (12%). En la tabla 1 se detalla el estudio etiológico.
El 60,3% recibieron tratamiento con nebulizaciones de SSH al 3%. Otros tratamientos recibidos se reflejan en la tabla 2 . La tasa de crup postextubación fue del 10,3%.
Tabla 2.
Tratamiento administrado, infección bacteriana y soporte recibido
| Total (n = 706) |
Primer período (2010-2014) (n = 340) |
Segundo período (2015-2017) (n = 366) |
p | |
|---|---|---|---|---|
| Tratamiento, n (%) | ||||
| Broncodilatador | 241 (34,14) | 120 (35,29) | 121 (33,06) | 0,532 |
| Adrenalina | 361 (51,13) | 158 (46,47) | 203 (55,46) | 0,021 |
| SSH 3% | 426 (60,34) | 200 (58,82) | 226 (61,74) | 0,427 |
| Glucocorticoides | 249 (35,27) | 114 (33,53) | 135 (36,88) | 0,348 |
| Antibioterapia, n (%) | 564 (79,9) | 300 (88,2) | 264 (72,13) | 0,003 |
| Antibióticos (días) | ||||
| Media ± DE | 5,7 ± 4,66 | 8,65 ± 4,80 | 5,05 ± 3,178 | 0,023 |
| Infección confirmada, n (%) | ||||
| Comunitaria | 248 (35,13) | 129 (37,94) | 119 (32,51) | 0,11 |
| Nosocomial | 68 (9,63) | 31 (9,12) | 37 (10,11) | |
| Sepsis, n (%) | ||||
| Comunitaria | 70 (9,91) | 37 (10,88) | 33 (9,02) | 0,09 |
| Nosocomial | 12 (1,70) | 6 (1,76) | 6 (1,64) | |
| Neumonía, n (%) | ||||
| Comunitaria | 147 (20,82) | 76 (22,35) | 71 (19,40) | 0,06 |
| Nosocomial | 27 (3,82) | 12 (3,53) | 15 (4,10) | |
| ITU, n (%) | ||||
| Comunitaria | 31 (4,39) | 16 (4,70) | 15 (4,10) | 0,205 |
| Nosocomial | 29 (4,11) | 13 (3,82) | 16 (4,37) | |
| Shock, n (%) | 45 (6,37) | 24 (7,06) | 21 (5,74) | 0,182 |
| VNI, n (%) | 655 (92,78) | 320 (94,12) | 335 (91,53) | 0,229 |
| CPAP | 60 (8,50) | 46 (13,53) | 14 (3,83) | |
| BiPAP | 595 (84,28) | 274 (80,59) | 321 (87,70) | |
| VMC, n (%) | 262 (37,11) | 138 (40,59) | 124 (33,88) | 0,065 |
| Ventilación (días) | ||||
| Mediana (RIC) | 8,06 (5,58-10,66) | 7,4 (5,56-9,88) | 8,93 (5,59-11,67) | 0,254 |
| Inotrópico, n (%) | 118 (16,71) | 63 (18,53) | 55 (15,03) | 0,213 |
| Óxido nítrico, n (%) | 14 (1,98) | 7 (2,05) | 7 (1,91) | 0,889 |
| ECMO, n (%) | 6 (0,85) | 4 (1,18) | 2 (0,55) | 0,368 |
| Éxitus, n (%) | 2 (0,28) | 1 (0,29) | 1 (0,27) | 0,856 |
| Ingreso UCIP (días) | ||||
| Mediana (RIC) | 6 (4-11) | 6 (4-10) | 6 (4-11) | 0,228 |
| Ingreso hospital (días) | ||||
| Mediana (RIC) | 12 (8,75-20) | 12 (8-19) | 13 (9-20) | 0,404 |
BiPAP: ventilación no invasiva con 2 niveles de presión (bilevel); CPAP: presión continua al final de la inspiración; DE: desviación estándar; ECMO: oxigenación por membrana extracorpórea; ITU: infección del tracto urinario; RIC: rango intercuartil; SSH 3%: suero salino hipertónico al 3%; UCIP: unidad de cuidados intensivos pediátricos; VMC: ventilación mecánica convencional; VNI: ventilación no invasiva.
Se inició antibioterapia empírica en el 79,9% (564) de los casos por sospecha de infección, siendo en el 13,6% iniciado por infección previamente documentada. La duración global de la antibioterapia fue de 5,7 días de media (DE 4,66 días). Se recogieron muestras para hemocultivo en 521 pacientes (74,2%), urinocultivo en 391 (55,3%) y se realizó punción lumbar en 99 casos (12%). La infección bacteriana se confirmó en 316 pacientes (44,7%): 82 fueron sepsis (11,6% del total), 174 neumonías (24,6%) y 60 infecciones del tracto urinario (8,5%). Se consideraron infecciones comunitarias 248 (35,13%) y el resto, nosocomiales (68; 9,63%) (tabla 2).
Requirieron ventilación no invasiva (VNI) 655 pacientes (92,78%), 60 con CPAP (8,50%) y 595 con BiPAP (84,28%). La principal indicación de VNI fue por dificultad respiratoria en 500 casos (78,5%), siendo en 65 pacientes (9,21%) por clínica de apneas. Precisaron intubación endotraqueal y ventilación mecánica convencional 262 pacientes (37,1%). La mediana de duración total de la ventilación fue de 8,06 días (RIC 5,58-10,66 días). Estuvieron ingresados en la UCIP durante una mediana de 6 días (RIC 4-11 días). Requirieron soporte inotrópico 118 pacientes (16,7%), con una duración media de 1,16 días (DE 0,4), siendo el fármaco más usado la dopamina. Precisaron soporte con oxigenación por membrana extracorpórea 6 pacientes (0,85%). Finalmente, 2 pacientes fallecieron debido a la bronquiolitis, uno en cada período; uno fue secundario a infección concomitante por herpes tipo 2 y el otro secundario a bronquiolitis por adenovirus con shock séptico viral y evolución a fallo multiorgánico (tabla 2).
Resultados comparativos
El primer período incluyó 340 pacientes y el segundo 366 pacientes. Cuando se compararon los 2 períodos, no se observaron diferencias estadísticamente significativas en cuanto a edad, sexo, presencia de comorbilidades, procedencia, etiología u origen de la bronquiolitis. En el segundo período la puntuación en la escala de gravedad BROSJOD resultó mayor (mediana de 10 vs. 8 puntos), aunque la diferencia no obtuvo significación estadística. Solo en el caso de la coinfección vírica se observó un porcentaje mayor y estadísticamente significativo en el segundo grupo (p = 0,04). Por lo tanto, podemos decir que son grupos bastante homogéneos cara a su comparación (tabla 1).
La administración de nebulizaciones de salbutamol fue igual en ambos períodos. Se utilizó más adrenalina nebulizada en el segundo período (158 vs. 203, p = 0,021), así como más SSH (200 vs. 226, p = 0,427) y tratamiento con corticoides (114 vs. 135, p = 0,348), aunque estos últimos, sin significación estadística. El número de pacientes intubados se constató menor en el segundo período (138 vs. 124, p = 0,065), pero hubo un aumento de los pacientes con VNI (320 vs. 336, p = 0,229) (tabla 2).
La indicación de antibioterapia también disminuyó en el segundo período, siendo del 72,13% frente al 88,2% del primer período (p < 0,05). Al comparar los 2 períodos, la duración de la antibioterapia fue menor en el segundo, con significación estadística (p = 0,023). Los pacientes del segundo período, que recibieron antibioterapia durante menos días, no presentaron empeoramiento clínico ni requirieron mayor estancia en la UCIP.
Variables como la mortalidad, el uso de óxido nítrico o de oxigenación por membrana extracorpórea, la duración de la estancia en la UCIP y hospitalaria global o el soporte inotrópico fueron similares en ambos grupos (tabla 2).
Discusión
La bronquiolitis aguda es una enfermedad muy frecuente y sigue generando un gran desafío en todo el personal sanitario.
En cuanto a las tasas de ingreso, según la literatura revisada, entre un 2-3% de los pacientes afectos de bronquiolitis precisarán ingreso hospitalario, y de estos, entre el 3-11% requerirán ingreso en una UCIP9, 10, 11, lo que coincide con nuestros resultados.
El VRS sigue siendo el principal causante de la bronquiolitis, tal y como se describe en todas las revisiones, seguido de rinovirus y, con menor frecuencia, otros como metapneumovirus, virus influenza y coronavirus3, 4, 5, concordante con nuestros datos. La coinfección vírica no es menospreciable, pudiendo suponer un curso más grave de la enfermedad y una tendencia a la estancia hospitalaria más prolongada5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23.
Tras la publicación de la GPC de la AAP19 se actualizó nuestro protocolo para la indicación de las nebulizaciones. Aunque la guía es muy restrictiva por lo que refiere a la terapia nebulizada, está contemplado el uso de adrenalina o SSH al 3% en los casos más graves. Se mantuvo salbutamol en mayores de 6 meses que respondían bien a la terapia, aun sabiendo que no está contemplado en la nueva guía.
El principal tratamiento nebulizado en nuestro estudio fue el SSH al 3%. Se considera su uso en las recomendaciones de la AAP por su probable efecto en el lavado mucociliar, aunque solo hay evidencia indirecta para apoyar tal afirmación. En contraposición, el más reciente artículo de Zhang et al. no parece evidenciar efectividad en el tratamiento con SSH al 3%24.
A pesar de no recomendarse el uso de adrenalina nebulizada por no haber demostrado mejoría en la evolución de los pacientes con bronquiolitis, se sigue administrando en casi la mitad de ellos por mejoría sintomática en algunos pacientes25, tal y como pasa también en nuestro estudio. Su aumento en el segundo período no se puede atribuir a una mayor gravedad de los pacientes, ya que las escalas no difieren significativamente, pero se observa una tendencia a un mayor uso de VNI y menor ventilación mecánica invasiva (aunque sin diferencias estadísticamente significativas). Una de nuestras hipótesis es que se usó más adrenalina por el mayor uso de VNI (ya que no se nebuliza adrenalina en los pacientes intubados), aunque no se puede descartar que con este fármaco se rescaten más pacientes que se ahorren una intubación. Serían necesarios estudios más extensos y con este propósito para sustentar esta afirmación.
Según la bibliografía, no estaría recomendado el uso de la corticoterapia19, aunque se utilizaba clásicamente en aquellos pacientes con auscultación espástica y mayores de un año. En nuestro protocolo se administró a los pacientes que presentaban crup postextubación (que representaron un 10,3%), como profilaxis del crup a partir de 5 días de ventilación mecánica26 y en aquellos pacientes con aislamiento de rinovirus como germen causal (el 90% de los rinovirus en el segundo período fueron tratados con corticoides), ya que parece útil según algunos resultados publicados en la literatura27, 28, 29. A pesar de la modificación del protocolo, no se observó en nuestro estudio una disminución en el uso de corticoides en los pacientes con diagnóstico de bronquiolitis, por lo que debería reconsiderarse de nuevo su indicación en nuestra unidad.
En cualquier caso, dada la gravedad de los pacientes afectos de bronquiolitis que precisan ingreso en una UCIP, que además suelen ser los de menor edad (en general menores de 3 meses) y en los que la intubación y la ventilación mecánica implicarán una estancia más prolongada y un mayor riesgo de complicaciones, la disminución en la administración de tratamientos es complicada. Probablemente es a nivel de urgencias o de la atención primaria donde se observaría una mayor adherencia a todas las recomendaciones de la GPC de la AAP. Además, es importante recordar el complejo problema con las propias definiciones, que puede dificultar también la clasificación y su manejo.
Con respecto a la tasa de infección bacteriana en pacientes con bronquiolitis que requieren ingreso en una UCIP, se define en alrededor del 40%, similar a nuestros datos30, 31. La incidencia desciende al 3,5-12% en los casos analizados en otros entornos, como en los servicios de urgencias o en la sala de hospitalización, por lo que también suele ser menor el uso de antibióticos32.
El motivo de que el tratamiento antibiótico en pacientes con insuficiencia respiratoria aguda continúe siendo elevado es la preocupación por la presencia de una infección bacteriana no detectada33. La tasa de antibioterapia en nuestro estudio resultó alta (79,9%), especialmente si consideramos que la mayoría de los pacientes no se diagnosticaron finalmente de infección bacteriana. A pesar de ello, dicha tasa es parecida a la que se puede objetivar en otros estudios en UCIP14, 34. Recientemente se ha publicado un estudio en el que Shein et al. justifican el tratamiento antibiótico los 2 primeros días de intubación de pacientes con bronquiolitis grave al ver una disminución en la estancia media35.
En nuestro estudio, al comparar las temporadas, se observó una disminución clara de la indicación de antibioterapia, así como de la duración de la misma. Probablemente este hecho obedeció no solo al cambio del protocolo de manejo de la bronquiolitis con base en las propuestas de la AAP, sino también a la implantación del programa de optimización de la antibioterapia en la UCIP a lo largo de la segunda mitad del año 2014. La implantación de estos programas tiene como objetivo mejorar los resultados clínicos y obtener una mínima toxicidad, con una disminución en el desarrollo de las resistencias36. En el caso de la bronquiolitis grave, las elevadas tasas de indicación de antibioterapia en nuestro estudio y en la literatura en general probablemente precisen de estrategias de retirada precoz de la misma, así como de desescalado. Así pues, la necesidad de una herramienta de diagnóstico para la infección bacteriana invasiva se establece claramente, ya que los signos y síntomas son muy poco específicos y difíciles de diferenciar del propio cuadro viral37. El uso de biomarcadores como la procalcitonina podría ayudar a discriminar entre la respuesta inflamatoria sistémica generada por la infección viral y la sobreinfección bacteriana, con lo que se podría individualizar la indicación y duración de la antibioterapia38. En nuestro estudio, los pacientes del segundo período que recibieron antibioterapia durante menos días no presentaron un empeoramiento clínico ni requirieron una mayor estancia en la UCIP, por lo tanto, el desescalado precoz parece un procedimiento seguro.
El hecho de ser un estudio unicéntrico es una limitación para la observación del cambio de protocolos tras la publicación de las recomendaciones internacionales. Este estudio va dirigido a analizar la actuación en nuestra unidad y los puntos de mejora en un futuro. Sin embargo, debido al elevado número de pacientes incluidos, permite una comparación aceptable de las 2 muestras en 2 períodos de tiempo.
Conclusiones
La bronquiolitis genera un elevado número de ingresos en los lactantes menores de un año. Conocer los datos epidemiológicos, clínicos, microbiológicos y de su evolución nos ha permitido analizar la adhesión a las guías de manejo internacionales, así como detectar puntos débiles y fuertes de los protocolos utilizados a nivel local.
Existen dificultades tanto para aplicar estrictamente las recomendaciones de la AAP en el grupo de bronquiolitis más graves como la universal de modificar pautas terapéuticas ancestralmente arraigadas en la práctica clínica. Probablemente será necesario revisar la indicación de corticoterapia y nebulizaciones en las bronquiolitis graves.
Autoría
Dra. Carmina Guitart llevó a cabo la recopilación de datos y los análisis iniciales, redactó el manuscrito inicial, revisó el manuscrito y aprobó el manuscrito final tal como se presentó.
Dra. Carme Alejandre conceptualizó y diseñó el estudio, llevó a cabo la recopilación de datos y análisis iniciales, redactó el manuscrito inicial, revisó el manuscrito y aprobó el manuscrito final tal como se presentó.
Dra. Isabel Torrús llevó a cabo la recopilación de datos, redactó y revisó el manuscrito y aprobó el manuscrito final tal como se presentó.
Dra. Mònica Balaguer analizó e interpretó los datos, revisó el artículo y aprobó la versión final.
Dra. Elisabeth Esteban analizó e interpretó los datos, revisó el artículo y aprobó la versión final.
Dr. Francisco José Cambra analizó e interpretó los datos, revisó el artículo y aprobó la versión final.
Dra. Iolanda Jordán conceptualizó y diseñó el estudio, llevó a cabo la recopilación de datos y los análisis iniciales, aplicó el análisis estadístico, redactó el manuscrito inicial, revisó el manuscrito y aprobó el manuscrito final tal como se presentó.
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Bibliografía
- 1.Meissner H.C. Viral bronchiolitis in children. N Engl J Med. 2016;374:62–72. doi: 10.1056/NEJMra1413456. [DOI] [PubMed] [Google Scholar]
- 2.Chkhaidze I., Zirakashvili D. Acute viral bronchiolitis in infants. Georgian Med News. 2017;264:43–50. [PubMed] [Google Scholar]
- 3.Smith D.K., Seales S., Budzik C. Respiratory syncytial virus bronchiolitis in children. Am Fam Physician. 2017;95:94–99. [PubMed] [Google Scholar]
- 4.Fretzayas A., Moustaki M. Etiology and clinical features of viral bronchiolitis in infancy. World J Pediatr. 2017;13:293–299. doi: 10.1007/s12519-017-0031-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Mansbach J.M., Piedra P.A., Teach S.J., Sullivan A.F., Forgey T., Clark S. Prospective multicenter study of viral etiology and hospital length of stay in children with severe bronchiolitis. Arch Pediatr Adolesc Med. 2012;166:700–706. doi: 10.1001/archpediatrics.2011.1669. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.McConnochie K.M. Bronchiolitis. What's in the name? Am J Dis Child. 1983;137:11–13. [PubMed] [Google Scholar]
- 7.Megalaa R., Perez G.F., Kilaikode-Cheruveettara S., Kotwal N., Rodriguez-Martinez C.E., Nino G. Clinical definition of respiratory viral infections in young children and potential bronchiolitis misclassification. J Investig Med. 2018;66:46–51. doi: 10.1136/jim-2017-000491. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Hancock D.G., Charles-Britton B., Dixon D.L., Forsyth K.D. The heterogeneity of viral bronchiolitis: A lack of universal consensus definitions. Pediatr Pulmonol. 2017;52:1234–1240. doi: 10.1002/ppul.23750. [DOI] [PubMed] [Google Scholar]
- 9.Hall C.B., Weinberg G.A., Blumkin A.K., Edwards K.M., Staat M.A., Schultz A.F. Respiratory syncytial virus-associated hospitalizations among children less than 24 months of age. Pediatrics. 2013;132:e341–e348. doi: 10.1542/peds.2013-0303. [DOI] [PubMed] [Google Scholar]
- 10.Muñoz-Quiles C., López-Lacort M., Úbeda-Sansano I., Alemán-Sánchez S., Pérez-Vilar S., Puig-Barberà J. Population-based analysis of bronchiolitis epidemiology in Valencia, Spain. Pediatr Infect Dis J. 2016;35:275–280. doi: 10.1097/INF.0000000000000993. [DOI] [PubMed] [Google Scholar]
- 11.Hall C.B., Weinberg G.A., Blumkin A.K., Edwards K.M., Staat M.A., Schultz A.F. Respiratory syncytial virus-associated hospitalizations among children less than 24 months of age. Pediatrics. 2013;132:e341–e348. doi: 10.1542/peds.2013-0303. [DOI] [PubMed] [Google Scholar]
- 12.Nagakumar P., Doull I. Current therapy for bronchiolitis. Arch Dis Child. 2012;97:827–830. doi: 10.1136/archdischild-2011-301579. [DOI] [PubMed] [Google Scholar]
- 13.Lin J.A., Madikians A. From bronchiolitis guideline to practice: A critical care perspective. World J Crit Care Med. 2015;4:152–158. doi: 10.5492/wjccm.v4.i3.152. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Bradshaw M.L., Déragon A., Puligandla P., Emeriaud G., Canakis A.M., Fontela P.S. Treatment of severe bronchiolitis: A survey of Canadian pediatric intensivists. Pediatr Pulmonol. 2018;53:613–618. doi: 10.1002/ppul.23974. [DOI] [PubMed] [Google Scholar]
- 15.Pierce H.C., Mansbach J.M., Fisher E.S., Macias C.G., Pate B.M., Piedra P.A. Variability of intensive care management for children with bronchiolitis. Hosp Pediatr. 2015;5:175–184. doi: 10.1542/hpeds.2014-0125. [DOI] [PubMed] [Google Scholar]
- 16.Flores-González J.C., Mayordomo-Colunga J., Jordan I., Miras Veiga A., Montero-Valladares C., Olmedilla-Jodar M. Prospective multicentre study on the epidemiology and current therapeutic management of severe bronchiolitis in Spain. Biomed Res Int. 2017;2017:2565397. doi: 10.1155/2017/2565397. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Schuh S., Babl F.E., Dalziel S.R., Freedman S.B., Macias C.G., Stephens D. Practice variation in acute bronchiolitis: A pediatric emergency research networks study. Pediatrics. 2017;140 doi: 10.1542/peds.2017-0842. pii: e20170842. [DOI] [PubMed] [Google Scholar]
- 18.Christakis D.A., Cowan C.A., Garrison M.M., Molteni R., Marcuse E., Zeer D.M. Variation in inpatient diagnostic testing and management of bronchiolitis. Pediatrics. 2005;115:878–884. doi: 10.1542/peds.2004-1299. [DOI] [PubMed] [Google Scholar]
- 19.Ralston S.L., Lieberthal A.S., Meissner H.C., Alverson B.K., Baley J.E., Gadomski A.M. Clinical practice guideline: The diagnosis, management, and prevention of bronchiolitis. Pediatrics. 2014;134:e1474–e1502. doi: 10.1542/peds.2014-2742. [DOI] [PubMed] [Google Scholar]
- 20.Pollack M.M., Patel K.M., Ruttimann U.E. The Pediatric Risk of Mortality III—Acute Physiology Score (PRISM III-APS): A method of assessing physiologic instability for pediatric intensive care unit patients. J Pediatr. 1997;131:575–581. doi: 10.1016/s0022-3476(97)70065-9. [DOI] [PubMed] [Google Scholar]
- 21.Balaguer M., Alejandre C., Vila D., Esteban E., Carrasco J.L., Cambra F.J. Bronchiolitis Score of Sant Joan de Déu: BROSJOD Score, validation and usefulness. Pediatr Pulmonol. 2017;52:533–539. doi: 10.1002/ppul.23546. [DOI] [PubMed] [Google Scholar]
- 22.Dellinger R.P., Levy M.M., Rhodes A., Annane D., Gerlach H., Opal S.M. Surviving Sepsis Campaign: International guidelines for management of severe sepsis and septic shock, 2012. Intensive Care Med. 2013;39:165–228. doi: 10.1007/s00134-012-2769-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Ghazaly M., Nadel S. Characteristics of children admitted to intensive care with acute bronchiolitis. Eur J Pediatr. 2018;177:913–920. doi: 10.1007/s00431-018-3138-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Zhang L., Mendoza-Sassi R.A., Wainwright C., Klassen T.P. Nebulised hypertonic saline solution for acute bronchiolitis in infants. Cochrane Database Syst Rev. 2013;7 doi: 10.1002/14651858.CD006458.pub3. CD006458. [DOI] [PubMed] [Google Scholar]
- 25.Plint A., Johnson D.W., Patel H., Wiebe N., Correll R., Brant R. Epinephrine and dexamethasone in children with bronchiolitis. N Engl J Med. 2009;360:2079–2089. doi: 10.1056/NEJMoa0900544. [DOI] [PubMed] [Google Scholar]
- 26.Veldhoen E.S., Smulders C.A., Kappen T.H., Calis J.C., van Woensel J., Raymakes-Janssen P.A.M. Post-extubation stridor in respiratory syncytial virus bronchiolitis: Is there a role for prophylactic dexamethasone? PLoS One. 2017;12 doi: 10.1371/journal.pone.0172096. e0172096. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Jartti T., Smits H.H., Bønnelykke K., Bircan O., Elenius V., Konradsen J.R. Bronchiolitis needs a revisit: Distinguishing between virus entities and their treatments. Allergy. 2019;74:40–52. doi: 10.1111/all.13624. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Koistinen A., Lukkarinen M., Turunen R., Vuorinen T., Vahlberg T., Camargo C.A., Jr. Prednisolone for the first rhinovirus-induced wheezing and 4-year asthma risk: A randomized trial. Pediatr Allergy Immunol. 2017;28:557–563. doi: 10.1111/pai.12749. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Mansbach J.M., Clark S., Teach S.J., Gern J.E., Piedra P.A., Sullivan A.F. Children hospitalized with rhinovirus bronchiolitis have asthma-like characteristics. J Pediatr. 2016;172:202–204.e1. doi: 10.1016/j.jpeds.2016.01.041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Duttweiler L., Nadal D., Frey B. Pulmonary and systemic bacterial co-infections in severe RSV bronchiolitis. Arch Dis Child. 2004;89:1155–1157. doi: 10.1136/adc.2004.049551. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Hishiki H., Ishiwada N., Fukasawa C., Abe K., Hoshino T., Aizawa J. Incidence of bacterial coinfection with respiratory syncytial virus bronchopulmonary infection in pediatric inpatients. J Infect Chemother. 2011;17:87–90. doi: 10.1007/s10156-010-0097-x. [DOI] [PubMed] [Google Scholar]
- 32.Guzmán C., Velasco M., Coroleu A., Vall O., García-Algar Ó. Antibióticos en las infecciones respiratorias en urgencias pediátricas hospitalarias. Arch Bronconeumol. 2014;50:375–378. [Google Scholar]
- 33.Samson L., Cooke C., MacDonald N. Analysis of antibiotic use and misuse in children hospitalized with RSV infection. Paediatr Child Health. 1999;4:195–199. [PMC free article] [PubMed] [Google Scholar]
- 34.McCullough A.R., Pollack A.J., Plejdrup-Hansen M., Glasziou P.P., Looke D.F., Britt H.C. Antibiotics for acute respiratory infections in general practice: Comparison of prescribing rates with guideline recommendations. Med J Aust. 2017;207:65–69. doi: 10.5694/mja16.01042. [DOI] [PubMed] [Google Scholar]
- 35.Shein S.L., Kong M., McKee B., O’Riordan M., Toltzis P., Randolph A.G. Antibiotic prescription in young children with respiratory syncytial virus-associated respiratory failure and associated outcomes. Pediatr Crit Care Med. 2019;20:101–109. doi: 10.1097/PCC.0000000000001839. [DOI] [PubMed] [Google Scholar]
- 36.Doron S., Davidson L.E. Antimicrobial stewardship. Mayo Clin Proc. 2011;86:1113–1123. doi: 10.4065/mcp.2011.0358. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Purcell K., Fergie J. Lack of usefulness of an abnormal white blood cell count for predicting a concurrent serious bacterial infection in infants and young children hospitalized with respiratory syncytial virus lower respiratory tract infection. Pediatr Infect Dis J. 2007;26:311–315. doi: 10.1097/01.inf.0000258627.23337.00. [DOI] [PubMed] [Google Scholar]
- 38.Schuetz P., Wirz Y., Sager R., Christ-Crain M., Stolz D., Tamm M. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev. 2017;10 doi: 10.1002/14651858.CD007498.pub3. CD007498. [DOI] [PMC free article] [PubMed] [Google Scholar]