Abstract
Ser receptor de un trasplante de órgano sólido, así como recibir tratamiento quimioterápico para una enfermedad hematólógica maligna, predispone claramente a padecer infecciones virales tanto comunes como oportunistas, de origen tanto comunitario como procedentes del donante de órganos y/o de una reactivación de un virus latente endógeno. Herpes virus y más especialmente citomegalovirus y virus de Epstein-Barr son los que con más frecuencia afectan a estos enfermos, así como los virus respiratorios. El tratamiento consiste en la combinación de reducir la inmunodepresión inducida junto con tratamiento antiviral. Se ha realizado una revisión de la literatura pormenorizada y actualizada de la epidemiología, la patogenia, las manifestaciones clínicas y la aproximación terapéutica de las infecciones virales en estos enfermos.
Palabras clave: Infección viral, Citomegalovirus, Virus respiratorios, Pacientes inmunodeprimidos, Trasplante
Abstract
Being a solid organ and hematopoietic stem cell transplant recipient as well as receiving chemotherapy for a malignant hematological disease clearly predispose the subject to a variety of viral infections, both common and opportunistic diseases. The patient may have acquired these infections from the community as well as from the donor organ (donor-derived infections) and/or from reactivation of an endogenous latent virus. Herpes viruses and especially the cytomegalovirus and Epstein-Barr virus are among the most common of the opportunistic viral pathogens affecting these patients, in addition to respiratory viruses. Treatment consists in antiviral drug therapies combined with the reduction in the degree of the induced immunosuppression. A review of the literature has been performed in order to update the epidemiology, pathogenesis, clinical manifestations and therapeutic approach of the viral infections in these immunocompromised patients.
Keywords: Viral infection, Cytomegalovirus, Respiratory viruses, Immunodepressed patients Transplant
Enfermos con trasplante de órgano sólido e infecciones por virus
Introducción
En las últimas dos décadas, el trasplante de órgano sólido (TOS) se ha convertido en el tratamiento de elección de muchas enfermedades que previamente llevaban a la muerte de los pacientes a través del fallo de uno o más órganos vitales. Además del refinamiento de las diferentes técnicas quirúrgicas y anestésicas, no cabe duda de que han sido los progresos en el tratamiento inmunosupresor lo que ha permitido este gran avance médico. Las infecciones son las complicaciones más frecuentes del paciente trasplantado1 y la principal causa de muerte durante el primer año postrasplante. Los pacientes receptores de TOS se encuentran especialmente predispuestos a sufrir infecciones clínicas por virus, tanto comunes como oportunistas2, que pueden adquirir del órgano donante (infecciones derivadas del donante) o de la comunidad o mediante la reactivación de los virus latentes endógenos propios. Aparte de los efectos nocivos directos3 de muchos de estos virus, debe destacarse el comportamiento inmunomodulador e inflamatorio de algunos, capaces de producir efectos indirectos de gran importancia4, como rechazo agudo o crónico del injerto, o favorecer otras infecciones oportunistas.
La extensa familia de los virus herpes y muy notablemente el citomegalovirus (CMV) y el virus de Epstein-Barr (VEB) se encuentran entre los patógenos virales oportunistas más frecuentes causantes de infección en los pacientes con TOS5, 6, 7. Les siguen de cerca en frecuencia e importancia el virus del herpes simple (VHS), el virus de la varicela-zoster (VVZ) y el virus del herpes humano tipo 6 (VHH-6) con los síndromes infecciosos habitualmente causados por ellos. En las últimas dos décadas se han añadido dos nuevos tipos de virus herpes8, los virus del herpes humano tipo 7 y el tipo 8 (VHH-7, VHH-8), causantes de enfermedad proliferativa o neoplásica determinada en estos pacientes trasplantados. A una cierta distancia, causando otros tipos de procesos variados y característicos, aparecen otras familias de virus como Papilomavirus (virus del papiloma humano [VPH]), Poliomavirus (virus BK [BKV] y virus JC [JCV]) y Eritrovirus B19 (antes Parvovirus B19).
Por otro lado, no puede olvidarse la relevancia en determinados tipos de TOS, como el trasplante hepático, de los virus hepatotropos, como el virus de la hepatitis B (VHB) y el virus de la hepatitis C (VHC), capaces de condicionar el resultado del propio trasplante.
Entre los virus comunitarios, prácticamente cualquiera de ellos puede causar infecciones en pacientes con TOS, si bien cabe destacar por su relevancia en los últimos tiempos9 virus respiratorios como el virus respiratorio sincitial (VRS), virus influenza y parainfluenza, metapneumovirus (MPV) y bocavirus; virus neurotropos como el virus de la coriomeningitis linfocitaria (VCML), el virus del Nilo oeste (VNO) y el virus de la rabia, así como los virus del sarampión, las paperas, coronavirus y rotavirus.
Factores modificadores
Las infecciones virales en pacientes sometidos a TOS se encuentran condicionadas por, al menos, tres grupos de factores modificadores de su frecuencia, momento y forma de presentación clínica, como son:
-
•
El órgano trasplantado, la modalidad y técnica quirúrgica del trasplante y el protocolo de inmunosupresión utilizado10.
-
•
La relación entre el estado serológico11 del donante y del receptor del trasplante (estado D/R)12.
-
•
Las medidas de prevención elegidas para evitar el desarrollo de enfermedad viral, profilaxis universal, profilaxis selectiva adaptada al riesgo, profilaxis prolongada, profilaxis diferida en su inicio o terapia anticipada13, 14, 15.
Periodos de riesgo de infección
Las infecciones virales, al igual que las causadas por otros microorganismos, siguen en el TOS un patrón cronológico de presentación muy definido que se distribuye en periodos bien determinados (fig. 1 ), los cuales conforman una patocronía concreta16:
-
•
El primer periodo se extiende durante las primeras 4 semanas tras el acto quirúrgico. Aquí el riesgo de infección es muy alto, principalmente por bacterias nosocomiales y en menor medida por hongos (Candida y Aspergillus), con clínica similar a las de otros pacientes posquirúrgicos. Las infecciones virales son infrecuentes en esta fase.
-
•
El segundo periodo ocupa desde el final del postoperatorio hasta el sexto mes. El riesgo de infección es menor y los microorganismos infecciosos suelen ser oportunistas, incluidos ya muchos de los virus antes comentados.
-
•
En el tercer periodo, iniciado a partir del sexto mes tras el trasplante, el riesgo de infección disminuye de manera notable y las infecciones están producidas habitualmente por microorganismos extrahospitalarios. Una minoría de pacientes en los que el órgano trasplantado no evoluciona correctamente pueden padecer durante este periodo infecciones más características de alguno de los dos periodos precedentes.
Figura 1.
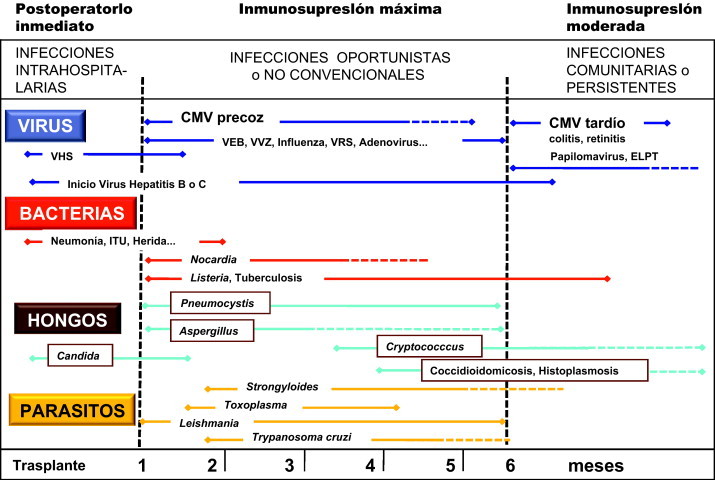
Patocronia y periodos de riesgo de las infecciones en el TOS. CMV: citomegalovirus, VEB: virus de Epstein-Barr, VHS: virus del herpes simple, VVZ: virus varicela-zóster, VRS: virus respiratorio sincitial, ELPT: enfermedad linfoproliferativa postrasplante, ITU: infección del tracto urinario.
Manifestaciones clínicas
Tanto los virus comunes como los oportunistas son capaces de causar en el TOS una variedad extensa de síndromes infecciosos con comportamiento clínico muy diferente. Desde cuadros clínicos poco expresivos u oligosintomáticos, con presencia de tan sólo fiebre y viremia detectable, hasta procesos de enorme gravedad, bien por grave daño estructural y funcional del órgano trasplantado (más predispuesto a la infección y a una mayor lesión) o de otros órganos diana (por especial tropismo de algunos virus), bien por el carácter de enfermedad diseminada y multisistémica que en algunos puede llegar a desarrollarse. Puede destacarse la simple infección por CMV con fiebre y citomegaloviremia, pero también enfermedad grave de órgano específico17 como enterocolitis (hemorrágica en ocasiones), neumonía (llegando a un patrón alveolointersticial bilateral con insuficiencia respiratoria grave o síndrome de distrés respiratorio del adulto [SDRA]), hepatitis, retinitis y encefalitis.
Muy similar comportamiento pueden adoptar otros virus de la familia herpes, como el VHS, el VVZ y el VHH-618, causando enfermedad exantemática mucocutánea más o menos extensa y característica (vesicular o no vesicular), con la particularidad de poder extenderse o afectar a otros órganos. Son especialmente graves las hepatitis, neumonitis, afecciones del tracto digestivo (esofagitis y colitis) y, sobre todo, las formas neurooftalmológicas de meningoencefalitis, encefalomielitis y retinitis. Afortunadamente, esta familia de virus es susceptible de tratamiento con agentes antivirales específicos de eficacia demostrada19. En este contexto, el VEB puede causar varios tipos de síndromes infecciosos muy distintos (tabla 1 ), aunque por su repercusión clínica y su exclusivo manejo, cobra especial importancia la enfermedad linfoproliferativa postrasplante (ELPT)20, 21.
Tabla 1.
Tratamiento de las infecciones por virus de la familia herpes y sus diferentes entidades en pacientes trasplantados.
| Virus | Tratamiento de elección | Opciones alternativas |
|---|---|---|
| CMV | Ganciclovir (5 mg/kg/12 h, i.v.) o valganciclovir (900 mg/12 h, v.o.) [14 días] | Foscarneta (60 mg/kg/8 h, i.v., 14-21 días) |
| Sin afección visceral | Ganciclovir (5 mg/kg/12 h, i.v., 14-21 días) | Cidofovirb (inducción con 5 mg/kg/semanal, primeras 2 semanas) |
| Con afección visceral | Ganciclovir (5 mg/kg/12 h, i.v.) [14-21 días] ± inmunoglobulina específica o polivalentec | |
| Neumonía | ||
| VHH-6 | Ganciclovir (5 mg/kg/12 h, i.v.) o valganciclovir (900 mg/12 h, v.o.) [14 días] | Foscarneta (60 mg/kg/8 h, i.v., 14 días) |
| VHS | Aciclovir (200 mg 5 veces al día, v.o., 7 días) | Famciclovir (250 mg/8 h, v.o., 7 días) |
| Mucocutáneo leve | Aciclovir (5 mg/kg/8 h, i.v., 10-14 días) | Valaciclovir (1 g/12 h, v.o., 7 días) |
| Mucocutáneo grave y visceral | Aciclovir (10 mg/kg/8 h, i.v., 21 días) | Foscarneta (40 mg/kg/8 h) |
| Meningoencefalitis | ||
| VVZ | Aciclovir (800 mg 5 veces al día, v.o., 7 días | Fanciclovir (500 mg/8 h, v.o., 10 días) |
| Localizado en un dermatoma | Aciclovir (10 mg/kg/8 h, i.v., 10-14 días) | Valaciclovir (1 g/8 h, v.o., 7 días) |
| Varicela o zoster diseminado | ||
| VEB | ||
| Mononucleosis infecciosa no complicada | Aciclovir (10 mg/kg/8 h, i.v., 21 días) | |
| Hiperplasia monoclonal polimorfa benigna de células B | Aciclovir + reducción de inmunosupresión | |
| Linfoma polimorfo policlonal de células B | Aciclovir + reducción de inmunosupresión + anticuerpos monoclonales anti-CD20 (rituximab) | |
| Linfoma polimorfo monoclonal de células B | Disminución de inmunosupresión + anticuerpos monoclonales anti-CD20 (rituximab) + quimioterapia y/o radioterapia y/o cirugía |
i.v.: vía intravenosa; v.o.: vía oral.
En caso de sospecha o evidencia de cepas resistentes a aciclovir o a ganciclovir, foscarnet es el tratamiento de elección.
Cuando se produce fallo terapéutico con ganciclovir y el foscarnet causa efectos adversos graves, no es bien tolerado o no alcanza suficiente respuesta. Antes de cada administración, se debe determinar la creatinina en suero y las proteínas en orina y administrar el cidofovir con probenecid por vía oral y solución salina intravenosa como prehidratación.
La utilización conjunta de ganciclovir e inmunoglobulina se ha demostrado eficaz en el trasplante de progenitores hematopoyéticos; la mayor parte de los grupos de TOS extrapolan los resultados a sus pacientes, aunque no existe evidencia definitiva al respecto.
Los poliomavirus producen una pléyade de entidades clínicas relevantes dependientes de su tropismo e invasividad, dando lugar a fenómenos de desmielinización severos como la leucoencefalopatía multifocal progresiva (LMP) en el caso del JCV y una serie de procesos variados en el caso del BKV22, 23, como son la nefropatía intersticial del injerto (en el trasplante renal) con riesgo de pérdida del órgano trasplantado, la estenosis ureteral, la cistitis hemorrágica, la meningoencefalitis o el carcinoma urotelial (tabla 2 ). Una especial atracción manifiesta el eritrovirus B19 por los precursores hematopoyéticos, sobre todo de serie roja, pudiendo causar anemias aplásicas y pancitopenias graves y refractarias24, además de inducir artritis, exantemas y riesgo de producir enfermedad grave de órgano.
Tabla 2.
Virus emergentes en el TOS: métodos diagnósticos, formas de presentación clínica y posibilidades de tratamiento.
| Virus (estacionalidad) | Diagnóstico | Manifestaciones clínicas | Tratamientoa |
|---|---|---|---|
| Bocavirus (otoño tardío, invierno) | PCR | Fiebre, rinorrea, tos, diarrea, infección diseminada | Desconocido |
| Cepas CoV no-SARS | Cultivo, PCR | Infecciones del tracto respiratorio superior e inferior | — |
| Eritrovirus B19 | Serología, PCR, biopsia de médula ósea | Artralgias/artritis, anemia, pancitopenias, hepatitis, neumonitis, miocarditis, glomerulonefritis | IG i.v. |
| VHH-6 | PCRb, cultivo en medios de virus, cultivo en shell-vial, histopatología | Fiebre, hepatitis, neumonitis, pancreatitis, meningoencefalitis, enteritis, gastritis, exantemas (fugaces), pancitopenias, disfunción de células T, microangiopatía trombótica | Ganciclovir (variante A), foscarnet, cidofovir |
| VCML | Serología, PCR, cultivo | Fiebre, diarrea, dolor abdominal, disnea, cefalea, exantema, hepatitis, TP alargado, meningitis aséptica | ¿Ribavirina (i.v.)?c |
| Sarampión (measles) | Serología | Fiebre, exantema, neumonitis | — |
| Metapneumovirus (final invierno) | Cultivo, PCR | Infección tracto respiratorio superior, neumonía, hemorragia alveolar difusa | ¿Ribavirina (i.v.)?c |
| Parotiditis (mumps) | Serología, PCR | Paperas, fiebre | — |
| Papilomavirus (VPH) | Histopatología, citología, PCR, ME | Verrugas y papilomas anogenitales, neoplasias de cérvix | Podofilox o tintura de podofilino, imiquimod, interferón alfa (aplicación local) |
| Poliomavirus (VJC, BKV) | Histopatología, citología, cultivo, PCR, ME | Desmielinización SNC, LMP, meningoencefalitis, nefritis grave con pérdida del injerto renal, estenosis ureteral, cistitis hemorrágica, carcinoma urotelial, neoplasia de próstata | Cidofovird, ¿arabinósido de citosina?c, ¿leflunomida?c |
| Rotavirus | Pruebas de detección de antígeno en heces, PCR, ME | Diarrea, hemorragia gastrointestinal | — |
| Virus del Nilo occidental (final verano, otoño) | Serología, anticuerpos IgM de captura en LCR, PCR | Fiebre, malestar, cefalea, mialgias, meningitis, encefalitis, síndrome seudopoliomielítico, hiporreflexia | ¿IG i.v. anti-VNO?c |
BK-V: virus BK; CoV: coronavirus; i.v.: vía intravenosa; IF: inmunofluorescencia; IG i.v. anti-VNO: inmunoglobulinas intravenosas específicicas contra el virus del Nilo occidental; IG i.v.: inmunoglobulinas intravenosas; LMP: leucoencefalopatía multifocal progresiva; ME: microscopia electrónica; PCR: reacción en cadena de la polimerasa; SARS: síndrome respiratorio agudo severo; SNC: sistema nervioso central; TP: tiempo de protrombina; v.o.: vía oral; VCML: virus de la coriomeningitis linfocitaria; VHH-6: virus del herpes humano tipo 6; VJC: virus JC; VPH: virus del papiloma humano.
Cuando sea posible, el tratamiento debería incluir una reducción en la intensidad del tratamiento inmunosupresor.
Los resultados de PCR deben ser interpretados con cautela cuando es posible que ocurra infección latente.
Terapias cuyo uso es posible, pero no está contrastada suficientemente su eficacia terapéutica.
Puede tener cierta actividad in vitro, desconociéndose su valor in vivo.
Tanto las hepatitis de novo como las reactivaciones, reinfecciones o recurrencias por los VHB y VHC pueden causar serios inconvenientes en los pacientes con TOS e influir en el pronóstico y el resultado del trasplante, especialmente en los trasplantados hepáticos. A diferencia de la recurrencia del VHB, la cual se contiene eficazmente con inmunoglobulinas específicas y antivirales, no se dispone de una profilaxis efectiva frente a la hepatitis C, que se hace recurrente de manera casi segura. La evolución postrasplante depende de la prevención de la reinfección del órgano trasplantado25, limitada por diversos factores del huésped26 y por la toxicidad de estos antivirales contra el VHC, incluidos los interferones pegilados27. Una proporción sustancial de pacientes infectados por el VHC sufren enfermedad hepática terminal recurrente del aloinjerto hepático que conduce a disminución en la supervivencia del injerto, aumento en la necesidad de retrasplante hepático y, finalmente, reducción en la supervivencia del paciente28. Estos hechos aún han cobrado más importancia actualmente, desde que a principios de la década comenzaron a realizarse trasplantes hepáticos en pacientes coinfectados por el VIH y el VHC29, 30, 31, dado que estos enfermos tienen una tasa de progresión a fibrosis más rápida que condiciona mayor frecuencia de aparición de cirrosis, enfermedad hepática terminal y carcinoma hepatocelular.
Tratamiento
El tratamiento de las infecciones por virus en el TOS con fármacos antivirales efectivos debe ser complementado con la reducción en el grado y la intensidad de la inmunosupresión (clave cuando constituye la única estrategia efectiva para el manejo de las infecciones por virus). La prevención de las infecciones virales en el TOS es de capital importancia y puede ser lograda mediante la implementación de diversas medidas como planes de vacunación y determinadas estrategias antivirales como se acepta de forma consensuada para el CMV32, 33.
Infecciones virales en pacientes hematológicos
Introducción
Los pacientes hematológicos presentan distintos tipos de alteración inmunitaria dependiendo de la enfermedad que padecen, su momento evolutivo y el tratamiento que hayan recibido. Este déficit inmunitario predispone al desarrollo de enfermedades infecciosas graves que aumentarán la morbimortalidad de estos pacientes.
En los últimos años las infecciones virales están cobrando una mayor importancia en este grupo de pacientes, que en la práctica clínica podríamos dividir en pacientes oncohematológicos, pacientes receptores de trasplante de progenitores hematopoyéticos (TPH) y receptores de hemoderivados. La epidemiología está cambiando y el espectro de las infecciones virales severas está aumentando en pacientes en los que hace unos años no eran habituales debido en gran medida al uso de nuevos fármacos con marcado efecto inmunosupresor.
Existen tres tipos de déficit inmunitario: neutropenia, déficit de inmunidad celular y déficit de inmunidad humoral. Cada tipo de inmunodepresión se asocia con un determinado tipo de infecciones; no obstante, en las enfermedades hematológicas suelen coexistir diferentes tipos de inmunodeficiencia34.
La neutropenia predomina en pacientes con leucemias agudas, aplasia medular o síndromes mielodisplásicos evolucionados y en pacientes tratados con quimioterapia intensiva. Aquí predominan las infecciones por bacterias Gram-positivas, bacilos Gram-negativos, hongos y virus (herpes, VRS, influenza, parainfluenza).
El déficit de inmunidad celular aparece en pacientes con enfermedad de Hodgkin y otros síndromes linfoproliferativos avanzados, en tratamientos con glucocorticoides, análogos de las purinas y tratamientos con anticuerpos monoclonales. Aquí son frecuentes las infecciones por bacterias intracelulares; infecciones virales (CMV, VHS, VVZ, JCV, HHV-6, VRS), hongos y parásitos.
El déficit de inmunidad humoral predomina en pacientes con mieloma múltiple, macroglobulinemia de Waldeström, leucemia linfática crónica (LLC) y esplenectomizados. Las infecciones son menos frecuentes que en grupos anteriores y son fundamentalmente por bacterias capsuladas.
El TPH es una opción terapéutica en las enfermedades hematológicas, principalmente en las hemopatías malignas. La infección es una complicación importante debido a la inmunodepresión sumatoria que produce la propia enfermedad neoplásica de base, el régimen de acondicionamiento al que se somete al paciente para recibir el trasplante, el tratamiento del rechazo y de la enfermedad del injerto contra el huésped (EICH). También son factores de riesgo de infección si el trasplante es emparentado o no, el estado de la serología viral previa al trasplante del paciente y el momento después del trasplante en el que aparece la infección35.
Periodos de riesgo
Existen tres periodos de riesgo, de deficiencia inmunitaria, predecibles en el TPH:
-
•
Periodo postrasplante inmediato: se inicia con el tratamiento de acondicionamiento y se mantiene hasta 30 días después del trasplante. Es un periodo de profunda neutropenia y linfocitopenia. En cuanto a las infecciones virales en esta fase, la más frecuente es la reactivación del VHS en pacientes previamente seropositivos36.
-
•
Periodo postinjerto precoz: se inicia con la recuperación de los neutrófilos y persiste hasta el día 100, en que se produce la recuperación funcional de los linfocitos T y B; no obstante, la presencia de una EICH y su tratamiento pueden retrasar esta recuperación inmunitaria. El CMV es el agente infeccioso más importante de esta fase. Otras infecciones virales que destacan en esta fase son las producidas por el VRS, los virus influenza y parainfluenza, los rinovirus, gastroenteritis por rotavirus y virus Coxsackie, o reactivaciones por adenovirus y VHH-6.
-
•
Periodo postinjerto tardío: a partir de día 100 hasta que se recupera una inmunidad normal, a los 18-36 meses del TPH, siempre que el paciente no reciba inmunosupresión y siga libre de EICH. Puede aparecer reactivación del VVZ; infección por CMV (sobre todo en pacientes seropositivos con EICH crónica)37.
Principales agentes
Virus del herpes simple: la manifestación clínica más frecuente es la gingivoestomatitis, aunque en ocasiones se puede extender a esófago, laringe o la piel de las regiones perioral y perianal. A veces es difícil de distinguir entre mucositis por VHS o la producida por la propia quimioterapia, motivo por el que se suele indicar tratamiento empírico antiviral. La reactivación del VHS se puede reducir del 80% a menos del 5% en receptores seropositivos durante el primer mes después del trasplante mediante el uso de aciclovir o valaciclovir desde el momento del acondicionamiento y hasta que se recuperan de la mucositis35. (Véase tratamiento y profilaxis en la tabla 3 38, 39.)
Tabla 3.
Prevención y tratamiento de infecciones virales en TPH y otros procesos hematológicos.
| Prevención | Tratamiento | |
|---|---|---|
| VHS | Pacientes VHS seronegativos: No profilaxis | Estomatitis: |
| Pacientes VHS seropositivos receptores de TPH alogénico (y también se recomienda en pacientes receptores de TPH autólogo en los que se espere mucosisits severa durante el acondicionamiento) | • Aciclovir i.v. 250 mg/m2/8 h o 5 mg/kg/8 h | |
| • Aciclovir i.v. 250 mg/m2/12 h o 5 mg/kg/12 h | Si tolera: | |
| • Si tolera: aciclovir oral 400 mg/8–12 h | • Aciclovir oral 400 mg 5 veces al día | |
| Valaciclovir 500 mg/24 h | • Valaciclovir 500 mg/12 h | |
| Si hay resistencia al aciclovir: | ||
| • Foscarnet i.v. 40 mg/kg/8 h | ||
| VVZ | Vacuna: contraindicada, excepto en niños con LAL en remisión | Infección no complicada, localizada: |
| Quimioprofilaxis: no hay consenso | • Aciclovir oral 800 mg 5 veces al día | |
| Tras exposición de riesgo: | • Valaciclovir 1.000 mg/8 h | |
| • Gammaglobulina específica (antes de 96 h) | • Famciclovir 500 mg/8 h | |
| • Alternativa: aciclovir (iniciar 7–9 días tras exposición) 800 mg/6 h durante 7 días | Infección complicada, diseminada: | |
| • Aciclovir i.v. 500 mg/m2/8 h o 10 mg/kg/8 h | ||
| CMV | Bajo riesgo: | Tratamiento anticipado o precoz: |
| • Autólogo/singénico: sin medidas específicas | Ganciclovir i.v. Inducción (I): 5 mg/kg/12 h; mantenimiento (M): 6 mg/kg/24 h | |
| • Alogénico donante y receptor CMV (–): hemoterapia CMV (–) o filtrada | Foscarnet i.v. I: 60 mg/kg × 2/24 h; M: 90 mg/kg/24 h | |
| Intermedio/alto riesgo: | Cidofovir i.v. I: 3 mg/kg 1 vez/semana × 2 dosis; M: 3-5 mg/kg cada 2 semanas | |
| Aciclovir i.v.10 mg/kg/8 h; p.o. 800 mg 5 veces/día (cuando tolere) | Valganciclovir p.o. I: 900 mg/12 h; M: 900 mg/24 h | |
| • Valaciclovir p.o.1.000 mg 4 veces/día | Tratamiento enfermedad: | |
| • Ganciclovir i.v. 5 mg/kg/12 h 5 días, seguido de 5 mg/kg/día | • Neumonía: ganciclovir 5 mg/kg/12 h × 14-21 días, seguidos de 5 mg/kg/24 h × 3–4 semanas + inmunoglobulinas i.v. | |
| • Infección digestiva: ganciclovir 5 mg/kg/12 h × 14-21 días seguidos de 5 mg/kg/24 h × 3–4 semanas |
Virus varicela zóster: aparece como infección primaria (5%) o como reactivación (95%) en un 40% de los pacientes en algún momento del primer año después del trasplante; en pacientes con marcada inmunodeficiencia celular (enfermedad de Hodgkin) y en enfermos en que antes no era habitual (LLC) y que han recibido tratamiento con nuevos fármacos inmunosupresores (fludarabina, rituximab, alemtuzumab). Además de las formas típicas cutáneas de presentación, puede producir neumonía hemorrágica, hepatitis, afectación del SNC, trombocitopenia y necrosis de la retina. Ocasionalmente en pacientes con TPH, puede producir afectación visceral sin lesión cutánea precedente. El EICH es un potente predictor de diseminación. La mortalidad es mayor si existe afectación pulmonar. El tratamiento se resume en la tabla 3 38, 39.
Citomegalovirus: la infección por CMV es una complicación importante en el paciente con TPH, ya que, aunque la incidencia de enfermedad por CMV ha disminuido en los últimos años debido a las estrategias de prevención adoptadas, la seropositividad para el CMV se considera un factor de riesgo independiente de EICH y se asocia con peor supervivencia, mayor mortalidad por bacteriemias e infecciones fúngicas y con mortalidad relacionada con el trasplante40. Las manifestaciones de la infección por CMV en los órganos diana son: neumonía, enterocolitis y más raramente retinitis. La neumonía por CMV es la manifestación más frecuente y más grave, ya que aun con tratamiento la mortalidad oscila entre el 30 y el 50%. Es poco frecuente antes del prendimiento del trasplante. Por otra parte, se está viendo que la neumonía por CMV es una infección emergente en pacientes adultos con leucemia tratados con fármacos inmunosupresores41. Los receptores de TPH se pueden clasificar en distintos grupos de riesgo de sufrir enfermedad por CMV. Se considera que son de alto riesgo los trasplantes alogénicos si hay depleción de células T de la fuente de progenitores, donante no emparentado, antígeno de histocompatibilidad (HLA) no idéntico, uso de corticoides a altas dosis, tratamiento con alemtuzumab y análogos de las purinas; y los trasplantes autólogos con selección CD34+, tratados con análogos de purinas y altas dosis de corticoides (tabla 3 ). Las técnicas diagnósticas de elección para la detección precoz de la infección son la antigenemia y la PCR. En lo referente al diagnóstico, es importante aplicar definiciones de consenso en cuanto a criterios de infección y enfermedad42. Las pautas de profilaxis, tratamiento anticipado y tratamiento dirigido se explican en la tabla 3.
Virus respiratorios comunitarios: los más frecuentes en pacientes con TPH y en pacientes con leucemia tratados con quimioterapia son paramixovirus (VRS, virus parainfluenza1, 2, 3, metapneumovirus), ortomixovirus (influenza A y B), rinovirus, coronavirus NL63 y HKU1, adenovirus y bocavirus, entre otros. Las viriasis respiratorias suelen acontecer en relación con brotes estacionales y se adquieren por contacto con otros individuos infectados. Si se desarrolla neumonía, se asocia con alta mortalidad, sobre todo en el caso del VRS y virus parainfluenza. No existe un tratamiento de eficacia reconocida para estas infecciones, aunque se recomienda ribavirina inhalada en el caso de neumonía por VRS e inhibidores de la neuraminidasa (oseltamivir, zanamivir) para el virus influenza43. No existe ninguna forma de quimioprofilaxis de eficacia probada para estas infecciones en los pacientes oncohematológicos, por lo que es fundamental evitar la exposición de los pacientes a estos virus, incluida la trasmisión nosocomial.
Adenovirus: se puede producir infección por reactivación aproximadamente en el 10% de los receptores de TPH alogénico y en menor porcentaje en los TPH autólogos. La manifestación más frecuente es la cistitis hemorrágica, aunque también puede producir infección sistémica pulmonar, hepática, digestiva y renal44. La EICH es un factor de riesgo de infección por adenovirus después del TPH. No existe tratamiento eficaz para esta infección.
Otros virus: el eritrovirus B19 en pacientes con anemias hemolíticas crónicas produce crisis de aplasia roja. En el TPH es causa poco frecuente de anemia. Los poliomavirus (virus JC y BK) pueden causar LMP y cistitis hemorrágicas, respectivamente. La mayor parte de los casos de reactivación del VEB son subclínicos y no requieren tratamiento, pero en otros casos puede producir una LPT de elevada mortalidad. El VHH-6 en el TPH puede producir cuadros de mielosupresión, exantemas cutáneos, meningoencefalitis y exacerbación de la EICH. El VHH-8 se ha relacionado con cuadros de hipoplasia medular, sarcoma de Kaposi, enfermedad de Castleman multicéntrica y linfoma de células B de cavidades.
Infecciones virales y nuevos fármacos inmunosupresores
El tratamiento con fludarabina (análogo de las purinas) y con alemtuzumab (anticuerpo monoclonal humanizado IgG1 kappa anti-CD52) se asocia con una mayor frecuencia de infecciones por VHS y VVZ, así como de infección y enfermedad por CMV45.
El rituximab (anticuerpo monoclonal quimérico dirigido contra el receptor CD20) se ha asociado con el desarrollo de aplasia roja pura por enterovirus B19, hepatitis fulminante por VHB, reactivación del VHB latente, casos de varicelosis diseminada fatal, neumonía por CMV e infecciones por VHS y VVZ. Su uso peritrasplante se ha asociado en el TPH autólogo a infecciones inusuales como LMP, retinitis y neumonitis por CMV46.
Bibliografía
- 1.Linden P.K. Approach to the immunocompromised host with infection in the intensive care unit. Infect Dis Clin North Am. 2009;23:535–556. doi: 10.1016/j.idc.2009.04.014. [DOI] [PubMed] [Google Scholar]
- 2.Razonable R.R., Eid A.J. Viral infections in transplant recipients. Minerva Med. 2009;100:479–501. [PubMed] [Google Scholar]
- 3.Castón J.J., Cisneros J.M., Torre-Cisneros J. Effects of viral infection on transplant recipients. Enferm Infecc Microbiol Clin. 2007;25:535–548. doi: 10.1157/13109990. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Pérez-Sola M.J., Castón J.J., Solana R., Rivero A., Torre-Cisneros J. [Indirect effects of cytomegalovirus infection in solid organ transplant recipients] Enferm Infecc Microbiol Clin. 2008;26:38–47. doi: 10.1157/13114394. [DOI] [PubMed] [Google Scholar]
- 5.San Juan R., Aguado J.M., Lumbreras C., Fortun J., Muñoz P., Gavalda J. RESITRA Network of the Spanish Study Group of Infection in Transplantation. Impact of current transplantation management on the development of cytomegalovirus disease after renal transplantation. Clin Infect Dis. 2008;47:875–882. doi: 10.1086/591532. [DOI] [PubMed] [Google Scholar]
- 6.Fishman J.A., Emery V., Freeman R., Pascual M., Rostaing L., Schlitt H.J. Cytomegalovirus in transplantation —challenging the status quo. Clin Transplant. 2007;21:149–158. doi: 10.1111/j.1399-0012.2006.00618.x. [DOI] [PubMed] [Google Scholar]
- 7.Dolcetti R. B lymphocytes and Epstein-Barr virus: the lesson of post-transplant lymphoproliferative disorders. Autoimmun Rev. 2007;7:96–101. doi: 10.1016/j.autrev.2007.02.012. [DOI] [PubMed] [Google Scholar]
- 8.Smith J.M., McDonald R.A. Emerging viral infections in transplantation. Pediatr Transplant. 2006;10:838–843. doi: 10.1111/j.1399-3046.2005.00481.x. [DOI] [PubMed] [Google Scholar]
- 9.Fischer S.A. Emerging viruses in transplantation: there is more to infection after transplant than CMV and EBV. Transplantation. 2008;86:1327–1339. doi: 10.1097/TP.0b013e31818b6548. [DOI] [PubMed] [Google Scholar]
- 10.Issa N.C., Fishman J.A. Infectious complications of antilymphocyte therapies in solid organ transplantation. Clin Infect Dis. 2009;48:772–786. doi: 10.1086/597089. [DOI] [PubMed] [Google Scholar]
- 11.Blanes M, Gómez D, Giménez MJ, Salavert M. Evaluación de la infección en el donante y en el receptor de trasplante de órgano sólido y de progenitores hematopoyéticos. Capítulo 8. En: Aguado JM, editor. Infecciones en pacientes trasplantados. 3.a ed. Madrid: Elsevier España; 2009. p. 131–58.
- 12.Opelz G., Daniel V., Naujokat C., Döhler B. Epidemiology of pretransplant EBV and CMV serostatus in relation to posttransplant non-Hodgkin lymphoma. Transplantation. 2009;88:962–967. doi: 10.1097/TP.0b013e3181b9692d. [DOI] [PubMed] [Google Scholar]
- 13.Slifkin M., Doron S., Snydman D.R. Viral prophylaxis in organ transplant patients. Drugs. 2004;64:2763–2792. doi: 10.2165/00003495-200464240-00004. [DOI] [PubMed] [Google Scholar]
- 14.Benmarzouk-Hidalgo O.J., Cordero E., Martín-Peña A., García-Prado E., Gentil M.A., Gomez-Bravo M.A. Prevention of cytomegalovirus disease using pre-emptive treatment after solid organ transplant in patients at high risk for cytomegalovirus infection. Antivir Ther. 2009;14:641–647. [PubMed] [Google Scholar]
- 15.San Juan R., Yebra M., Lumbreras C., López-Medrano F., Lizasoain M., Meneu J.C. A new strategy of delayed long-term prophylaxis could prevent cytomegalovirus disease in (D+/R-) solid organ transplant recipients. Clin Transplant. 2009;23:666–671. doi: 10.1111/j.1399-0012.2009.01077.x. [DOI] [PubMed] [Google Scholar]
- 16.Fishman J.A. Infection in solid-organ transplant recipients. N Engl J Med. 2007;357:2601–2614. doi: 10.1056/NEJMra064928. [DOI] [PubMed] [Google Scholar]
- 17.Fisher R.A. Cytomegalovirus infection and disease in the new era of immunosuppression following solid organ transplantation. Transpl Infect Dis. 2009;11:195–202. doi: 10.1111/j.1399-3062.2009.00372.x. [DOI] [PubMed] [Google Scholar]
- 18.Ljungman P., Singh N. Human herpesvirus-6 infection in solid organ and stem cell transplant recipients. J Clin Virol. 2006;37(Suppl 1):S87–S91. doi: 10.1016/S1386-6532(06)70018-X. [DOI] [PubMed] [Google Scholar]
- 19.Len O., Gavaldà J., Aguado J.M., Borrell N., Cervera C., Cisneros J.M. RESITRA. Valganciclovir as treatment for cytomegalovirus disease in solid organ transplant recipients. Clin Infect Dis. 2008;46:20–27. doi: 10.1086/523590. [DOI] [PubMed] [Google Scholar]
- 20.Hidalgo M., Lumbreras C., Aguado J.M. [Lymphoproliferative syndromes associated to the Epstein Barr virus in organ transplants] Med Clin (Barc). 1996;107:310–316. [PubMed] [Google Scholar]
- 21.Heslop H.E. How I treat EBV lymphoproliferation. Blood. 2009;114:4002–4008. doi: 10.1182/blood-2009-07-143545. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Ramos E., Drachenberg C.B., Wali R., Hirsch H.H. The decade of polyomavirus BK-associated nephropathy: state of affairs. Transplantation. 2009;87:621–630. doi: 10.1097/TP.0b013e318197c17d. [DOI] [PubMed] [Google Scholar]
- 23.Hirsch H.H. BK virus: opportunity makes a pathogen. Clin Infect Dis. 2005;41:354–360. doi: 10.1086/431488. [DOI] [PubMed] [Google Scholar]
- 24.Eid A.J., Brown R.A., Patel R., Razonable R.R. Parvovirus B19 infection after transplantation: a review of 98 cases. Clin Infect Dis. 2006;43:40–48. doi: 10.1086/504812. [DOI] [PubMed] [Google Scholar]
- 25.Watt K., Veldt B., Charlton M. A practical guide to the management of HCV infection following liver transplantation. Am J Transplant. 2009;9:1707–1713. doi: 10.1111/j.1600-6143.2009.02702.x. [DOI] [PubMed] [Google Scholar]
- 26.Berenguer M., Aguilera V., Prieto M., Ortiz C., Rodríguez M., Gentili F. Worse recent efficacy of antiviral therapy in liver transplant recipients with recurrent hepatitis C: impact of donor age and baseline cirrhosis. Liver Transpl. 2009;15:738–746. doi: 10.1002/lt.21707. [DOI] [PubMed] [Google Scholar]
- 27.Berenguer M. Systematic review of the treatment of established recurrent hepatitis C with pegylated interferon in combination with ribavirin. J Hepatol. 2008;49:274–287. doi: 10.1016/j.jhep.2008.05.002. [DOI] [PubMed] [Google Scholar]
- 28.Berenguer M. Recurrent allograft disease: viral hepatitis. Acta Gastroenterol Belg. 2005;68:337–346. [PubMed] [Google Scholar]
- 29.Miró J.M., Torre-Cisneros J., Moreno A., Tuset M., Quereda C., Laguno M. [GESIDA/GESITRA-SEIMC, PNS and ONT consensus document on solid organ transplant (SOT) in HIV-infected patients in Spain (March, 2005)] Enferm Infecc Microbiol Clin. 2005;23:353–362. doi: 10.1157/13076175. [DOI] [PubMed] [Google Scholar]
- 30.Singal A.K., Anand B.S. Management of hepatitis C virus infection in HIV/HCV co-infected patients: clinical review. World J Gastroenterol. 2009;15:3713–3724. doi: 10.3748/wjg.15.3713. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Miro J.M., Aguero F., Laguno M., Tuset M., Cervera C., Moreno A. Hospital Clinic OLT in HIV Working Group. Liver transplantation in HIV/hepatitis co-infection. J HIV Ther. 2007;12:24–35. [PubMed] [Google Scholar]
- 32.Torre-Cisneros J., Fortún J., Aguado J.M., De la Cámara R., Cisneros J.M., Gavaldá J. [Consensus document from GESITRA-SEIMC on the prevention and treatment of cytomegalovirus infection in transplanted patients] Enferm Infecc Microbiol Clin. 2005;23:424–437. doi: 10.1157/13078802. [DOI] [PubMed] [Google Scholar]
- 33.Torres-Madriz G., Boucher H.W. Immunocompromised hosts: perspectives in the treatment and prophylaxis of cytomegalovirus disease in solid-organ transplant recipients. Clin Infect Dis. 2008;47:702–711. doi: 10.1086/590934. [DOI] [PubMed] [Google Scholar]
- 34.Mateos M.C., Arguiñano J.M., Ardaiz M.A., Oyarzábal F.J. [Infections in non-transplanted oncohaematological patiens] An Sist Sanit Navar. 2005;28:59–81. doi: 10.4321/s1137-66272005000100006. [DOI] [PubMed] [Google Scholar]
- 35.Van Burik J.-A., Weisdorf D. Infecciones en los receptores de trasplante de células madre hematopoyéticas. In: Mandell G.L., Bennett J.E., Dolin R., editors. Enfermedades infecciosas. Principios y práctica. 6.a ed. Elsevier España; Madrid: 2006. pp. 3486–3501. [Google Scholar]
- 36.Dykewicz C.A. Sumary of the guidelines for preventing opportunistic infections among hematopoietic stem cell transplant recipients. Clin Infect Dis. 2001;2:139–144. doi: 10.1086/321805. [DOI] [PubMed] [Google Scholar]
- 37.Boeckh M., LeiserinW, Riddell S.R., Bowden R.A., Huang M.L., Myerson D. Late cytomegalovirus disease and mortality in recipients of allogeneic hematopoietic stem cell transplants: importance of viral load and T-cell immunity. Blood. 2003;101:407–414. doi: 10.1182/blood-2002-03-0993. [DOI] [PubMed] [Google Scholar]
- 38.De la Cámara R. [Viral infections in hematologic patients: prevention, diagnosis and treatment] Haematologica (ed. esp.) 2002;87(Supl 1):221–226. [Google Scholar]
- 39.Jancel T., Penzak S.R. Antiviral therapy in patients with hematologic malignancies, transplantation, and aplastic anemia. Semin Hematol. 2009;46:230–247. doi: 10.1053/j.seminhematol.2009.03.004. [DOI] [PubMed] [Google Scholar]
- 40.Broers A.E., Van Der Holt R., Van Esser J.W., Gratama J.W., Henzen-Logmans S., Kuenen-Boumeester V. Increased transplant-related morbidity and mortality in CMV-seropositive patients despite highly effective prevention of CMV disease after allogeneic T-cell-depleted stem cell transplantation. Blood. 2000;95:2240–2245. [PubMed] [Google Scholar]
- 41.Nguyen Q., Estey E., Raad I., Rolston K., Kantarjian H., Jacobson K. Cytomegalovirus pneumonia in adults with leukemia: an emerging problem. Clin Infect Dis. 2001;32:539–545. doi: 10.1086/318721. [DOI] [PubMed] [Google Scholar]
- 42.Ljungman P., Griffiths P., Paya C. Definitions of cytomegalovirus infection and disease in transplant recipients. Clin Infect Dis. 2002;34:1094–1097. doi: 10.1086/339329. [DOI] [PubMed] [Google Scholar]
- 43.Boeckh M. The challenge of respiratory virus infections in hematopoietic cell transplant recipients. Br J Haematol. 2008;143:455–467. doi: 10.1111/j.1365-2141.2008.07295.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 44.Robin M., Marque-Juillet S., Scieux C., Peffault de Latour R., Ferry C., Rocha V. Disseminated adenovirus infections after allogeneic hematopoietic stem cell transplantation: incidence, risk factors and outcome. Haematologica. 2007;92:1254–1257. doi: 10.3324/haematol.11279. [DOI] [PubMed] [Google Scholar]
- 45.Willians T., Roach J., Rugg T., Brettman L. Frequency of cytomegalovirus pneumonia following Alemtuzumab. Treatment in lymphoid malignancies: Rewiew of 1,538 patients. Blood. 2001;98(294b; abstract):4923. [Google Scholar]
- 46.Goldberg S.L., Pecora A.L., Alter R.S., Kroll M.S., Rowley S.D., Waintraub S.E. Unusual viral infections (progressive multifocal leukoencephalopathy and cytomegalovirus disease) after high-dose chemotherapy with autologous blood stem rescue and peritransplantation rituximab. Blood. 2002;99:1486–1488. doi: 10.1182/blood.v99.4.1486. [DOI] [PubMed] [Google Scholar]


