Abstract
El 31 de diciembre de 2019, la Comisión Municipal de Salud y Sanidad de Wuhan (provincia de Hubei, China) informó sobre la existencia de 27 casos de neumonía de etiología desconocida con inicio de síntomas el 8 de diciembre, incluyendo 7 casos graves, con exposición común a un mercado de marisco, pescado y animales vivos en la ciudad de Wuhan. El 7 de enero de 2020, las autoridades chinas identificaron como agente causante del brote un nuevo tipo de virus de la familia Coronaviridae, denominado temporalmente «nuevo coronavirus», 2019-nCoV. El 30 de enero de 2020 la Organización Mundial de la Salud (OMS) declara el brote una Emergencia Internacional. El día 11 de febrero la OMS le asigna el nombre de SARS-CoV2 e infección COVID-19 (Coronavirus Infectious Disease). El Ministerio de Sanidad convoca a las Sociedades de Especialidades para la elaboración de un protocolo clínico de manejo de la infección. La Asociación Española de Pediatría nombra un grupo de trabajo de las Sociedades de Infectología Pediátrica y Cuidados Intensivos Pediátricos que se encargan de elaborar las presentes recomendaciones con la evidencia disponible en el momento de su realización.
Palabras clave: Coronavirus, Infección respiratoria, 2019-nCoV, COVID-19, SARS-CoV2, Niños
Abstract
On 31 December 2019, the Wuhan Municipal Committee of Health and Healthcare (Hubei Province, China) reported that there were 27 cases of pneumonia of unknown origin with symptoms starting on the 8 December. There were 7 serious cases with common exposure in market with shellfish, fish, and live animals, in the city of Wuhan. On 7 January 2020, the Chinese authorities identified that the agent causing the outbreak was a new type of virus of the Coronaviridae family, temporarily called «new coronavirus», 2019-nCoV. On January 30th, 2020, the World Health Organisation (WHO) declared the outbreak an International Emergency. On 11 February 2020 the WHO assigned it the name of SARS-CoV2 and COVID-19 (SARS-CoV2 and COVID-19).
The Ministry of Health summoned the Specialties Societies to prepare a clinical protocol for the management of COVID-19. The Spanish Paediatric Association appointed a Working Group of the Societies of Paediatric Infectious Diseases and Paediatric Intensive Care to prepare the present recommendations with the evidence available at the time of preparing them.
Keywords: Coronavirus, Respiratory infection, 2019-nCoV, COVID-19, SARS-CoV2, Children
Introducción
Según recoge el Ministerio de Sanidad, el 31 de diciembre de 2019, la Comisión Municipal de Salud y Sanidad de Wuhan (provincia de Hubei, China) informó sobre la existencia de 27 casos de neumonía de etiología desconocida con inicio de síntomas el 8 de diciembre, incluyendo 7 casos graves, con exposición común a un mercado de marisco, pescado y animales vivos en la ciudad de Wuhan, sin identificar la fuente del brote. El mercado fue cerrado el día 1 de enero de 2020. El 7 de enero de 2020, las autoridades chinas identificaron como agente causante del brote un nuevo tipo de virus de la familia Coronaviridae, denominado temporalmente «nuevo coronavirus», 2019-nCoV. La secuencia genética fue compartida por las autoridades chinas el 12 de enero de 20201.
El 30 de enero la Organización Mundial de la Salud (OMS) declaró el brote de 2019-nCoV en China Emergencia de Salud Pública de Importancia Internacional2.
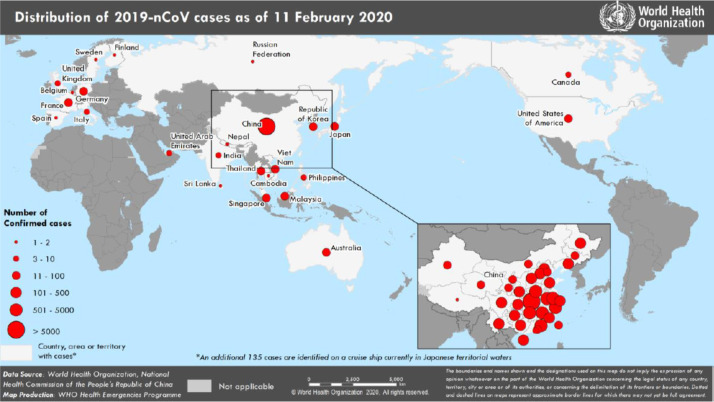
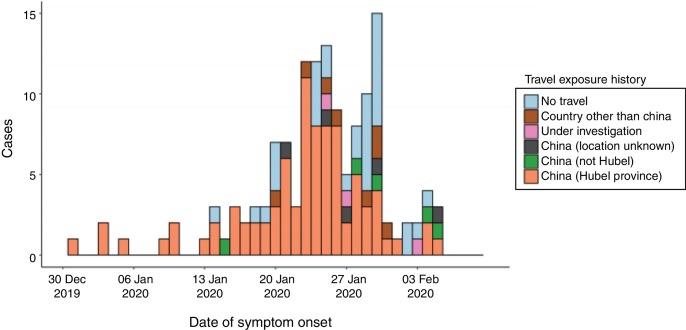
A 12 de febrero se habían diagnosticado más de 45.000 casos en China, siendo la provincia china de Hubei donde se concentran la mayoría de ellos (33.000), notificándose > 450 casos fuera de China (https://www.worldometers.info/coronavirus/), generalmente relacionados con casos importados de este país (Figura 1, Figura 2 ). La proporción de fallecidos entre los casos confirmados ha oscilado entre el 2 y 3%, aunque los datos deben interpretarse con cautela debido a la rapidez con la que evoluciona la epidemia1.
Figura 1.
Países, territorios y áreas con casos confirmados de infección COVID-19, 11 de febrero de 2020.
Fuente: OMS (https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports).
Figura 2.
Casos confirmados de infección COVID-19, fuera de China, por fecha de inicio de síntomas, hasta el 9 de febrero de 2020. Curva epidémica.
Fuente: OMS (https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200209-sitrep-20-ncov.pdf?sfvrsn=6f80d1b9_4).
La distribución por grupos de edad refleja una escasa incidencia en la población pediátrica (0,9%), con un cuadro clínico más leve3, 4. Según las series hospitalarias publicadas hasta el momento, una alta proporción de los pacientes adultos ingresados y casi todos los fallecidos presentaban comorbilidades5, 6.
El 31 de enero se confirmó en La Gomera un caso de infección por 2019-nCoV en un ciudadano alemán, contacto estrecho de otro caso confirmado en Alemania y el 9 de febrero un nuevo positivo en Mallorca, ciudadano británico, contacto de un caso en Francia. Ambos adultos con cuadros leves.
España no dispone de aeropuertos con vuelos con conexión directa a Wuhan. La restricción de vuelos desde la cuidad de Wuhan y China reduce la probabilidad de llegada de personas enfermas. Aun así, no se puede descartar que aparezca algún caso importado en España procedente de la zona de riesgo. En la situación actual, el riesgo de detectar un caso importado en nuestro país se considera moderado1.
Las recomendaciones que se presentan están basadas, con adaptaciones, en las recomendaciones de la OMS del 28 de enero de 20207 para la infección aguda respiratoria grave por 2019-nCoV, que a su vez se fundamenta en las recomendaciones que se hicieron para el síndrome MERS-CoV (síndrome respiratorio del Oriente Medio), y en las recomendaciones del National Clinical Research Center for Child Health de China8 y del comité de expertos9 recientemente publicadas. Estas recomendaciones podrían sufrir cambios según evolucione la epidemia, entre ellos en la definición de caso que puede ampliarse geográficamente, en las pautas de prevención, aislamiento, protección o terapéuticas según las evidencias de las que se disponga. En estas recomendaciones de manejo clínico no se recoge el manejo de los contactos.
El día 11/02/2020 la OMS cambia el nombre temporal 2019-nCoV por SARS-CoV2 y COVID-19 (Coronavirus Infectious Disease).
Coronavirus humano (HCoV)
Desde que los coronavirus humanos (HCoV) se descubrieron en la década de 1960, 6 virus, incluidos HCoV-229E, HCoV-OC43, HCoV-NL63, HCoV-HKU1, SARS-CoV (síndrome respiratorio agudo severo) y MERS-CoV, se han reconocido como agentes causantes de una gama de infecciones de las vías respiratorias.
HCoV NL63 y HCoV HKU1 se describieron en 2004 y 2005, respectivamente, y junto con HCoV 229E y OC43 son los responsables de hasta un 35% de las infecciones respiratorias de vías altas, generalmente en brotes epidémicos. El HCoV OC43 es el más prevalente y se detectan sobre todo en niños menores de 5 años. Se identifican muy frecuentemente en coinfección con otros virus respiratorios, lo que dificulta conocer su verdadero papel. Además se han descrito asociados a cuadros más graves, que precisan hospitalización generalmente por broncoespasmo y en especial en niños con patología de base. Se han descrito casos fatales por HCoV NL63 en inmunodeprimidos10, 11, 12.
El SARS-CoV se describió en 2003 en un epidemia única en China, que causó más de 700 muertos con un 20-30% precisando ventilación mecánica y con una letalidad del 10%, especialmente elevada en pacientes con comorbilidades. El MERS-CoV se detectó por primera vez en 2012 originando un cuadro clínico similar, pero con una mayor letalidad (36%). Esta infección no se ha extinguido y persisten casos esporádicos. Ambas son zoonosis transmitidas al hombre, la primera a través de murciélagos y la segunda originada en dromedarios, si bien, el contagio entre personas está descrito, principalmente en el ámbito sanitario, con baja transmisibilidad13.
SARS-CoV2Al igual que otros HCoV es un virus RNA de una sola cadena, con envuelta, con un diámetro de 60-140 nm, de forma esférica o elíptica y pleomórfico14. Se ha informado que comparte (entre un 86,9 y un 89%) las secuencias de nucleótidos del genoma de un coronavirus similar al SARS en murciélagos (bat-SL-CoVZC45)14, 15. La secuencia de nucleótidos de la proteína principal de la envoltura del virus también es altamente consistente con la de bat-SL-CoVZC45 (84%) y SARS-CoV (78%).
Las propiedades fisicoquímicas del SARS-CoV2 no están totalmente aclaradas, pero se cree que es sensible a la radiación ultravioleta y al calentamiento. Por ejemplo, según las investigaciones sobre SARS-CoV y MERS-CoV, el virus puede inactivarse calentándolo a 56 °C durante 30 min y usando solventes lipídicos como etanol al 70%, desinfectantes que contengan cloro, ácido peroxiacético y cloroformo, pero no por clorhexidina8.
Epidemiología
La principal fuente de infección son los pacientes infectados por SARS-CoV2. La transmisión en periodo de incubación por personas asintomáticas ha sido descrita16. Se transmite a través de las gotas respiratorias (> 5 micras) cuando los pacientes tosen, hablan o estornudan. El contacto cercano también es una fuente de transmisión (por ejemplo, contacto con la boca, nariz o conjuntiva ocular a través de la mano contaminada). La transmisión vertical no está documentada17 pero se ha detectado un recién nacido de una madre infectada que ha sido positivo para el virus a las 30 h de vida. Se desconoce la posible transmisión a través de la leche materna. Los casos pediátricos documentados son menos frecuentes que en adultos y de carácter más leve, aunque todo el espectro de gravedad parece posible. No se han descrito fallecimientos en niños. Se han descrito cuadros de agrupación familiar de casos, destacando entre ellos el de 2 niños, uno leve y otro asintomático con alteraciones radiológicas15.
Definiciones y criterios
En el momento de realizar este documento (11/2/2020) se consideran los criterios recogidos en la tabla 1 .
Tabla 1.
Criterios epidemiológicos, clínicos y de laboratorio para estudio de infección por SARS-CoV2
| Criterios epidemiológicos y clínicos | |
|---|---|
| A | Cualquier persona con síntomas clínicos compatibles con una infección respiratoria aguda, de cualquier gravedad, que presente fiebre y alguno de los siguientes síntomas: disnea, tos o malestar general |
| Y | |
| Historia de viaje a la provincia de Hubei, China, en los 14 días previos al inicio de síntomas | |
| B | Cualquier persona con fiebre o síntomas respiratorios como disnea o tos |
| Y | |
| Historia de contacto estrecho con un caso probable o confirmado en los 14 días previos al inicio de síntomas, definiendo como contacto estrecho: | |
| - Cualquier persona que haya proporcionado cuidados a un caso probable o confirmado mientras el caso presentaba síntomas: trabajadores sanitarios que no han utilizado las medidas de protección adecuadas, miembros familiares o personas que tengan otro tipo de contacto físico similar | |
| - Cualquier persona que haya estado en el mismo lugar que un caso probable o confirmado mientras el caso presentaba síntomas, a una distancia menor de 2 m (p. ej., convivientes, visitas) | |
| - Se considera contacto estrecho en un avión, a los pasajeros situados en un radio de 2 asientos alrededor de un caso probable o confirmado mientras el caso presentaba síntomas y a la tripulación que haya tenido contacto con dichos casos (ver anexo 1) | |
| C | Cualquier persona que requiera hospitalización por fiebre y síntomas clínicos de infección respiratoria aguda grave |
| Y | |
| Historia de viaje a China continental en los 14 días previos al inicio de síntomas | |
| Criterio de laboratorio |
|---|
| RT-PCR de screening positiva y PCR de confirmación en un gen alternativo al de screening también positiva |
RT-PCR: reacción en cadena de polimerasa.
Clasificación de los casos
-
•
Caso en investigación: cuando cumpla uno de los 3 criterios descritos en el cuadro anterior.
-
•
Caso confirmado por laboratorio: caso que cumple criterio de laboratorio.
-
•
Caso probable: caso en investigación cuyos resultados de laboratorio para SARS-CoV2 no son concluyentes o solo son positivos para una PCR genérica de coronavirus.
-
•
Caso descartado: caso en investigación cuyas pruebas de laboratorio no detectan infección por SARS-CoV2.
Diagnóstico microbiológico
El diagnóstico se realiza mediante reacción en cadena de polimerasa (RT-PCR) con la detección de ácidos nucleicos del SARS-CoV2 o mediante la secuenciación del gen viral. Se pueden emplear muestras de frotis faríngeo, frotis nasofaríngeo (más adecuadas en niños), esputo, heces o sangre. El virus se puede aislar en cultivos de células epiteliales respiratorias pero solo se realiza en laboratorios especializados18.
Se recomienda realizar un panel de otros virus respiratorios para descartar una coinfección especialmente con gripe.
Aunque diversos laboratorios en las comunidades autónomas realizan el diagnóstico microbiológico, todos los casos positivos deben ser enviados al Centro Nacional de Microbiología (CNM) para su confirmación definitiva. Las muestras deben mantenerse y enviarse refrigeradas a 4 °C y manejadas como sustancias infecciosas de tipo B.
Cuadro clínico de la infección respiratoria COVID-19
La infección COVID-19 puede presentarse con una enfermedad leve, moderada o grave incluyendo neumonía severa, síndrome de dificultad respiratoria aguda (SDRA), sepsis y shock séptico.
Los casos pediátricos publicados son, hasta la fecha, escasos8, 9 y parece que más leves especialmente en lactantes19. El periodo de incubación se encuentra entre 2-14 días (mediana 3-7 días). La recuperación se ha producido en todos los casos entre 1-2 semanas. No se han documentado fallecimientos hasta la fecha.
La identificación temprana de aquellos con manifestaciones graves (tabla 2 ) permite tratamientos de apoyo optimizados inmediatos y un ingreso (o derivación) seguro y rápido a la unidad de cuidados intensivos que se determine de acuerdo con los requerimientos y protocolos regionales o nacionales. Las alteraciones analíticas y radiológicas que se han descrito más frecuentemente se describen en la tabla 3 . En general los datos son compatibles con una infección viral respiratoria similar a otras, como la gripe.
Tabla 2.
Síndromes clínicos asociados con la infección respiratoria COVID-19
| Infección no complicada | Los pacientes con infección viral no complicada del tracto respiratorio superior pueden presentar síntomas inespecíficos, como fiebre, tos, dolor de garganta, congestión nasal, malestar general, dolor de cabeza, dolor muscular o malestar general. No existen signos de deshidratación, sepsis o dificultad respiratoria |
| Infección leve de vías bajasa | Tos, dificultad respiratoria + polipnea (en respiraciones/min): < 2 meses, ≥ 60; 2-11 meses, ≥ 50; 1-5 años, ≥ 40 y sin signos de neumonía severa |
| Saturación ambiental > 92%. Pueden o no tener fiebre | |
| Infección grave de vías bajasb | Tos o dificultad respiratoria y al menos uno de los siguientes: cianosis central o SatO2 < 92% (< 90% en prematuros); dificultad respiratoria severa (p. ej., quejido, retracción torácica muy severa); incapacidad o dificultad para alimentación, letargo o pérdida de conocimiento o convulsiones. Pueden presentarse otros signos como son: retracciones torácicas, polipnea (en respiraciones/min): ≥ 70 en menores de 1 año; ≥ 50 en mayores de 1 año |
| Gasometría arterial: PaO2 < 60 mmHg, PaCO2 > 50 mmHg. El diagnóstico es clínico; las imágenes de tórax pueden excluir complicaciones (atelectasias, infiltrados, derrame) | |
| Otras manifestaciones asociadas a cuadros graves | Trastornos de la coagulación (tiempo prolongado de protrombina y elevación de dímero D), daño miocárdico (aumento de enzimas miocárdicas, cambios de ST-T en el electrocardiograma, cardiomegalia e insuficiencia cardíaca), disfunción gastrointestinal, elevación de enzimas hepática y rabdomiólisis |
| Síndrome de dificultad respiratoria aguda (SDRA)20 | Inicio: nuevo o empeoramiento del cuadro en los 10 días previos |
| Rx tórax, TC o ECO: nuevo(s) infiltrado(s) compatibles con afectación aguda del parénquima pulmonar | |
| Origen edema pulmonar: insuficiencia respiratoria en ausencia de otra etiología como fallo cardíaco o sobrecarga de volumen | |
| Oxigenación (OI = índice de oxigenación y OSI = índice de oxigenación usando SpO2): | |
| • VNI bilevel o CPAP ≥ 5 cmH2O a través de una máscara facial completa: PaO2/FiO2 ≤ 300 mmHg o SpO2/FiO2 ≤ 264 | |
| • SDRA leve (ventilación invasiva): 4 ≤ OI < 8 o 5 ≤ OSI < 7,5 | |
| • SDRA moderado (ventilación invasiva): 8 ≤ OI < 16 o 7,5 ≤ OSI < 12,3 | |
| • SDRA grave (ventilación invasiva): OI ≥ 16 u OSI ≥ 12,3 | |
| Sepsis21 | Infección sospechada o comprobada y ≥ 2 criterios de SIRS, de los cuales uno debe ser temperatura anormal o recuento leucocitario anormal |
| Shock séptico22 | Cualquier hipotensión (PAS < percentil 5 o > 2 DE por debajo de lo normal para la edad) o 2-3 de los siguientes: estado mental alterado; taquicardia o bradicardia (FC < 90 lpm o > 160 lpm en lactantes y FC < 70 lpm o > 150 lpm en niños); relleno capilar lento (> 2 s) o vasodilatación caliente con pulsos conservados; taquipnea; piel moteada o erupción petequial o purpúrica; lactato aumentado, oliguria, hipertermia o hipotermia |
DE: desviación estándar; FC: frecuencia cardíaca; SIRS: síndrome de respuesta inflamatoria sistémica; VNI: ventilación no invasiva; PAS: presión arterial sistólica.
Equivalente a neumonía leve de la OMS.
Equivalente a neumonía grave de la OMS.
Tabla 3.
Evolución clínica, analítica y radiológica posibles en la infección COVID-19 en niños
| Leve | Grave | |
|---|---|---|
| Cuadro clínico | Fiebre (no siempre presente), tos, congestión nasal, rinorrea, expectoración, diarrea, cefalea | Una semana después malestar, irritabilidad, rechazo de alimentación, hipoactividad |
| En algunos casos progresión rápida (1-3 días) fallo respiratorio no reversible con oxígeno, shock séptico, acidosis metabólica, coagulopatía y sangrados | ||
| Hemograma | Leucocitos normales o leucopenia y linfopenia leves | Linfopenia progresiva |
| Proteína C reactiva | Normal | Normal o elevada (sospechar sobreinfección bacteriana) |
| Procalcitonina (PCT) | Normal | PCT > 0,5 ng/ml (sospechar sobreinfección bacteriana) |
| Bioquímica | Normal | Elevación de transaminasas, enzimas musculares, mioglobina, dímero D |
| Rx tórax | Normal o infiltrados periféricos intersticiales | Opacidades bilaterales en vidrio esmerilado y consolidaciones pulmonares múltiples. Derrame pleural infrecuente |
| TAC tórax | Las imágenes en vidrio esmerilado y los infiltrados son más evidentes en el TAC que en la Rx | Pueden aparecer múltiples consolidaciones lobares |
Para aquellos con enfermedad leve, la hospitalización puede no ser necesaria a menos que exista preocupación por el rápido deterioro. Todos los pacientes dados de alta deben recibir instrucciones de regresar al hospital si desarrollan un empeoramiento de la enfermedad. En el momento actual se recomienda el ingreso de todos los casos positivos.
Recomendaciones de manejo de los casos confirmados
Infección no complicada
-
1.
Observar las medidas generales de protección. Colocar al paciente (si es posible) y a sus familiares mascarilla quirúrgica. Mantener idealmente 2 m (mínimo 1 m de separación) con otros pacientes en todo momento.
-
2.
El personal que atiende al paciente debe seguir las medidas preventivas recomendadas (contacto y respiratorias), empleando mascarilla FPP2, guantes, bata impermeable y gafas de protección, para la exploración y realización de la historia clínica o procedimientos de toma de muestras.
-
3.
Administración de antitérmicos habituales cuando sea necesario (paracetamol o ibuprofeno).
-
4.
Si el paciente presenta fiebre se recomienda realizar Rx tórax, analítica sanguínea para descartar sobreinfección bacteriana: hemograma, hemocultivo, proteína C reactiva (PCR), procalcitonina (PCT), transaminasas, iones y coagulación.
-
5.
Según la situación epidemiológica y las condiciones familiares se decidirá ingreso o vigilancia domiciliaria con instrucciones claras sobre la actuación en caso de empeoramiento. La OMS ha editado unas normas para el seguimiento de pacientes ambulantes23.
Infección leve de vías bajas
-
1.
Medidas generales igual que en el caso anterior.
-
2.
Se recomienda ingreso aislado y vigilancia de todos los pacientes.
-
3.
Monitorización no invasiva de constantes incluyendo SatO2 con pulsioximetría.
-
4.
Realización de Rx tórax, analítica sanguínea (hemograma, PCR, PCT, hemocultivo, bioquímica con transaminasas, iones, coagulación y gasometría) y canalización de vía periférica.
-
5.
Se podrán emplear broncodilatadores cuando la exploración lo sugiera (sibilancias), preferiblemente con cámara espaciadora y dispositivo inhalador de dosis media (MDI).
-
6.
Analgésicos habituales (paracetamol o ibuprofeno).
Se debe contemplar la posibilidad de que el padre o la madre del niño puedan ingresar junto al paciente. Sería recomendable una sola persona, siempre la misma, que debería cumplir en todo momento las medidas de aislamiento (mascarilla, bata, guantes y gafas). Puede darse también la situación de que los padres y el niño estén infectados y pudieran ingresar conjuntamente.
Infección grave de vías respiratorias bajas
-
1.
Además de todas las medidas anteriores:
-
2.
Manejo conservador de fluidos, dado que el manejo agresivo puede empeorar la oxigenación (sueroterapia habitual a 2/3 de necesidades basales). No se recomienda emplear sueros hipotónicos (ni almidones o gelatinas en caso de reanimación).
-
3.
Oxigenoterapia para mantener SatO2 > 92%.
-
4.
Si hay sospecha de sobreinfección bacteriana (leucocitosis y elevación de PCR o PCT) iniciar antibioterapia con amoxicilina-clavulánico i.v.
Cuadros graves con ingreso en unidad de cuidados intensivos (UCIP)
Se debe valorar el ingreso en UCIP si el niño presenta infección de vías bajas con criterios de gravedad, o con manifestaciones extrapulmonares asociadas a cuadros graves (tabla 2) y/o presenta un deterioro progresivo. Se recomienda ingreso en habitación aislada y con presión negativa comprobada. Si se realizan procedimientos que puedan generar aerosoles (tabla 4 ), porque no puedan evitarse para dar una asistencia adecuada, como suponen un mayor riesgo de contaminación, se debe incrementar el nivel de protección. El personal expuesto debe ser el mínimo imprescindible y emplear mascarilla FFP3, además de bata de manga larga impermeable, protección ocular ajusta de montura integral o facial completa y los guantes. En estas situaciones de mayor riesgo en UCIP, dada la información limitada disponible, hasta conocer completamente los mecanismos de transmisión y el riesgo, puede ser razonable incluir en las medidas de protección un mono integral o bata impermeable larga con capucha, evitando tener zonas expuestas a los aerosoles producidos.
Tabla 4.
Procedimientos susceptibles de generar aerosoles y estrategias sugeridas para reducir su riesgo si son estrictamente necesariosa
| Procedimiento | Estrategiab,c |
|---|---|
| Aspiración de secreciones respiratorias | Limitar a las imprescindibles |
| Aspiración cerrada si ventilación mecánica | |
| Aerosolterapia | Emplear cámara espaciadora y dispositivo MDI (inhalador de dosis media) |
| Toma de muestras respiratorias | Limitar a las imprescindibles |
| Lavado broncoalveolar | Evitar si es posible |
| Oxigenoterapia de alto flujo | Evitar |
| Ventilación no invasiva (VNI) | Evitar si es posible |
| En caso necesario asegurar el sellado adecuado de la interfase | |
| Uso de VNI con doble tubuladura | |
| Ventilación manual con mascarilla y bolsa autoinflable | Si se puede, evitar la ventilación con mascarilla y bolsa autoinflable; si se debe utilizar, se hará con un filtro de alta eficiencia que impida la contaminación vírica, entre la bolsa autoinflable y la mascarilla, sin hiperventilar y evitando fugas |
| Intubación | Se utilizarán tubos endotraqueales con balón para evitar las fugas, con presión balón < 25 cm H2O |
| Si es necesario se preoxigenará con mascarilla reservorio de O2 en vez de ventilación con bolsa autoinflable y se realizará con una secuencia rápida de intubación y por personal experto para minimizar el tiempo y el número de intentos del procedimiento de intubación | |
| Ventilación mecánica | Se pondrán los filtros de alta eficiencia que impidan la contaminación vírica tanto en el asa inspiratoria como en la espiratoria |
| Se usará el sistema de aspiración cerrada de secreciones | |
| Uso de intercambiador de calor y humedad con filtro de alta eficacia que impida la contaminación vírica, en vez de humidificación activa | |
| Evitar desconexiones | |
| Reanimación cardiopulmonar |
MDI: inhalador de dosis media.
La influencia de estos procedimientos o estrategias sobre la transmisión de la infección no está suficientemente demostrada, pero son razonables y se han recomendado en infecciones con un mecanismo de transmisión similar.
Evitar si es posible.
Equipos de protección individual (EPI) con mascarilla FFP3 (ver recomendaciones de EPI en el texto).
Todo el equipo asistencial y/o de apoyo, así como el acompañante del niño en UCIP, llevará los equipos de protección individual (EPI) recomendados, siguiendo las normas de colocación y retirada establecidas, de forma supervisada y habiendo recibido formación sobre estos procedimientos.
Estará establecido el circuito del traslado del paciente a/desde la UCIP siguiendo las medidas de protección y control de la infección necesarias, para evitar la diseminación durante el mismo.
Durante su ingreso se minimizará el traslado del paciente realizando, si es posible, las exploraciones necesarias (p. ej., radiología o ecografía) con equipos portátiles en el box de aislamiento; si los equipos no pueden ser dedicados de forma exclusiva a estos pacientes, deben ser desinfectados según las recomendaciones de medicina preventiva. El material empleado debe ser en la medida de lo posible desechable; si no es así, se desinfectará según las recomendaciones establecidas. Los residuos se consideran de clase III y se manipularán y procesarán conforme a las recomendaciones correspondientes.
El personal planificará sus tareas y permanecerá en la habitación el tiempo mínimo necesario que requieran. Si no es necesario estar más cerca, se mantendrán a más de 2 m del paciente. Se debe realizar un registro de cada uno de los profesionales que han entrado en contacto con el paciente.
En nuestros conocimientos actuales el tratamiento de soporte en UCIP en pacientes graves que presenten SDRA, sepsis o disfunción orgánica no difiere de forma significativa de los recomendados internacionalmente para estos procesos24, 25, 26, 27, 28, 29.
Si requiere soporte respiratorio, la ventilación no invasiva tiene un mayor riesgo de contaminación por generación de aerosoles. Se debe valorar en caso de deterioro respiratorio la ventilación mecánica invasiva precoz, con las estrategias recomendadas en SDRA en pediatría (PALICC)24, 26 de ventilación protectora (volúmenes tidal bajos (4-8 ml/kg), PEEP óptima, presión meseta ≤ 28-32 cmH2O, driving pressure < 15 cmH2O, hipercapnia permisiva, etc.), uso de decúbito prono y en caso necesario bloqueo neuromuscular.
Se debe realizar un manejo adecuado de líquidos evitando la sobrecarga hídrica y los balances muy positivos, asociados a una peor evolución respiratoria y a una mayor morbimortalidad. En caso de sepsis, además de la expansión de volumen cuidadosa durante la reanimación inicial, puede requerir soporte con fármacos vasoactivos conforme a las recomendaciones internacionales pediátricas actuales28, 29. Pueden requerir también terapia continua de reemplazo renal.
En caso de fallo respiratorio o cardiorrespiratorio severo refractario a las medidas de tratamiento convencional se puede considerar la utilización de ECMO, cuyas indicaciones actuales no difieren de las de otros procesos.
Antibioterapia empírica
Se empleará antibioterapia si se sospecha sobreinfección bacteriana y en casos de sepsis y shock séptico (siendo en este caso fundamental que se administre en la primera hora o cuanto antes). Se valorará la situación previa del paciente (comorbilidades, paciente sano, ventilación mecánica, etc.), ajustándose a las características de cada caso. Se debe recoger estudio microbiológico siempre que sea posible antes del inicio y no olvidar suspender o desescalar según los resultados.
En las primeras series publicadas6, todos los pacientes tenían infiltrados radiológicos y todos recibieron antibioterapia empírica, pero en el momento actual se recomienda hacer una monitorización estrecha y solo tratar con antibióticos cuando se sospeche sobreinfección bacteriana.
Corticoides sistémicos e inmunomoduladores
Los corticoides sistémicos no están recomendados de forma general. Estudios previos en pacientes con SARM, MERS e incluso gripe han demostrado que no tienen efectos beneficiosos e incluso se ha retrasado el aclaramiento del virus22, 30, 31. Se puede valorar en casos de SDRA, shock séptico, encefalitis, síndrome hemofagocítico y cuando exista un broncoespasmo franco con sibilancias. En caso de indicarse se recomienda: metilprednisolona intravenosa (1-2 mg/kg/día) durante 3 a 5 días, pero no para uso a largo plazo8, 9.
Se han empleado inmunoglobulinas intravenosas en casos graves, pero su indicación y eficacia debe ser evaluada. Las dosis recomendadas son: 1 g/kg/día, 2 días, o 400 mg/kg/día, 5 días.
Tratamiento antiviral específico
No existe ningún antiviral específico que se haya mostrado eficaz en la infección por HCoV, SARM o MERS. La OMS no recomienda ningún antiviral.
Existen diversos fármacos que se están testando de manera experimental32.
-
•
Oseltamivir: los inhibidores de la neuraminidasa se han utilizado en casos de MERS-CoV y oseltamivir ha sido inicialmente empleado en la epidemia de COVID-19 en China. No está clara su eficacia y posiblemente se ha usado para la coinfección con gripe. En el momento actual no está recomendado.
-
•
IFN-alfa inhalado ha sido recomendado asociado a lopinavir/ritonavir como terapia antiviral en adultos y se ha iniciado un ensayo clínico para probar su eficacia. El IFN-alfa es un antiviral de amplio espectro, que se usa para tratar el VHB. En España no hay IFN-alfa inhalado. Las guías chinas recomiendan nebulización con IFN-α2b 100.000-200.000 UI/kg para casos leves, y 200.000-400.000 UI/kg para casos severos, 2 veces/día durante 5-7 días.
-
•
El lopinavir es un inhibidor de la proteasa utilizado para tratar la infección por VIH, con ritonavir como potenciador. Lopinavir y/o lopinavir/ritonavir tienen actividad frente al coronavirus in vitro. En el tratamiento del SRAS, en Hong Kong se encontró que, en comparación con la ribavirina sola, los pacientes tratados con lopinavir/ritonavir y ribavirina tenían un menor riesgo de SDRA o muerte33, 34.
-
•
Remdesivir podría ser el mejor fármaco potencial para el tratamiento de COVID-19. Es un antiviral desarrollado para el Ébola, profármaco análogo de nucleótido. Experimentos con animales han demostrado que en comparación con el grupo de control, remdesivir puede reducir eficazmente el título de virus de ratones infectados con MERS-CoV así como mejorar el daño del tejido pulmonar y su efecto es mejor que el del grupo tratado con lopinavir/ritonavir combinado con IFN-β. El medicamento ha completado el ensayo clínico de fase III para el tratamiento de la infección por el virus del Ébola, y los datos de farmacocinética y seguridad están relativamente completos. Sin embargo, la eficacia y la seguridad de remdesivir en pacientes con infección COVID-19 aún deben confirmarse. Este fármaco no está disponible en España. En Estados Unidos se ha empleado en al menos un caso con buenos resultados35, 36. Se podrá solicitar como uso compasivo a la AEMPS. Las dosis propuestas para la población pediátrica son: ≥ 40 kg de peso: igual que adultos: dosis de carga el primer día de 200 mg/iv seguido de una dosis de mantenimiento de 100 mg/iv al día desde el día 2 al día 10. < 40 Kg de peso: dosis de carga el primer día de 5 mg/kg iv seguido de una dosis de mantenimiento de 2,5 mg/kg iv al día desde el día 2 al día 9.
-
•
Otros fármacos como cloroquina (antipalúdico) o baricitinib (inhibidor de JAK quinasas) se han considerado como posibles opciones terapéuticas, si bien, no se han testado clínicamente37, 38.
La conclusión es que no existen evidencias disponibles para recomendar o no tratamiento, ni un antiviral en concreto. Las dosis de antivirales se recogen en la tabla 5 .
Tabla 5.
Dosis de antivirales. Lopinavir/ritonavir (según ficha técnica)
| Pautas de dosificación pediátrica basadas en peso corporal (> 6 meses-18 años) | ||
|---|---|---|
| Peso corporal (kg) | Dosis en mg/kg c/12 h | Volumen de la solución oral administrada con comida cada 12 h (80 mg lopinavir/20 mg ritonavir por ml) |
| 7 a 15 | 12/3 mg/kg | |
| 7 a 10 | 1,25 ml | |
| > 10 < 15 | 1,75 ml | |
| 15-40 | 10/2,5 mg/kg | |
| 15-20 | 2,25 ml | |
| > 20-25 | 2,75 ml | |
| > 25-30 | 3,50 ml | |
| >30-35 | 4 ml | |
| > 35-40 | 4,75 ml | |
| > 40 | Dosis de adulto | 400 mg/100 mg c/12 h |
| Pauta posológica de 2 semanas a 6 meses para separar esto claramente | ||
|---|---|---|
| Basada en peso (mg/kg) | Basada en ASC (mg/m2) | Frecuencia |
| 16/4 mg/kg (corresponde a 0,2 ml/kg) | 300/75 mg/m2 (corresponde a 3,75 ml/m2) | Dos veces al día con comida |
El volumen de ml de la solución oral corresponde a la media del peso. Las dosis basadas en peso corporal se basan en estudios limitados.
El área de la superficie corporal (ASC) se puede calcular según: √ Altura (cm) × peso (kg) / 3.600. No está indicado en menores de 15 días de vida.
Se podría valorar:
-
•
En casos leves y no complicados no tratar. Oseltamivir se plantearía como opción únicamente si hay coinfección por gripe empleado de forma precoz. Se podría valorar lopinavir/ritonavir.
-
•
En casos graves que requieran hospitalización se podría iniciar lopinavir/ritonavir.
-
•
Si se puede obtener remdesivir, sería útil en pacientes graves.
-
•
Es importante recordar que lopinavir/ritonavir tiene con cierta frecuencia efectos adversos gastrointestinales al inicio del tratamiento (diarrea, vómitos).
Conflicto de intereses
Los autores declaran no tener ningún conflicto de intereses.
Contributor Information
Miembros del Grupo de Expertos de la AEP:
José Tomás Ramos, Fernando Baquero-Artigao, Maria Luisa Navarro, Carlos Rodrigo, Olaf Neth, Victoria Fumadó, Juan José Menendez Suso, María Slocker Barrio, Amaya Bustinza Arriortua, Iolanda Jordán García, and Javier Pilar Orive
Anexo 1. Miembros del Grupo de Trabajo de la AEP
José Tomás Ramos (Unidad de Enfermedades Infecciosas, Servicio de Pediatría, Hospital Clínico San Carlos. Departamento de Salud Pública y Materno-Infantil, Madrid. Sociedad Española de Infectología Pediátrica), Fernando Baquero-Artigao (Servicio de Pediatría, Enfermedades Infecciosas y Tropicales, Hospital Universitario La Paz. Unidad de Aislamiento de Alto Nivel [UAAN], Hospital La Paz-Carlos III, Madrid. Sociedad Española de Infectología Pediátrica), Maria Luisa Navarro (Servicio de Pediatría y Enfermedades Infecciosas, Hospital Universitario Gregorio Marañón, Madrid. Sociedad Española de Infectología Pediátrica), Carlos Rodrigo (Dirección Clínica de Pediatría, Hospital Universitario Germans Trias i Pujol, Badalona, Barcelona. Sociedad Española de Infectología Pediátrica), Olaf Neth (Sección de Enfermedades Infecciosas, Reumatología e Inmunodeficiencias, Hospital Infantil Universitario Virgen del Rocío, Instituto de Biomedicina de Sevilla [IBIS], Sevilla. Sociedad Española de Infectología Pediátrica), Victoria Fumadó (Unitat de Malalties Infeccioses i Importades [CSUR]. Unidad de Alto Aislamiento de Enfermedades Infecciosas [CSUR], Hospital Universitario Sant Joan de Déu, Barcelona. Sociedad Española de Infectología Pediátrica), Juan José Menendez Suso (Servicio de Cuidados Intensivos y de la Unidad de Aislamiento de Alto Nivel [UAAN], H. Universitario La Paz-H. Carlos III, Madrid. Sociedad Española de Cuidados Intensivos Pediátricos), María Slocker Barrio y Amaya Bustinza Arriortua (Unidad de Cuidados Intensivos Pediátricos, Hospital Materno Infantil Gregorio Marañón, Madrid. Sociedad Española de Cuidados Intensivos Pediátricos), Iolanda Jordán García (Unidad de Cuidados Intensivos Pediátricos, Hospital Sant Joan de Déu, Barcelona. Sociedad Española de Cuidados Intensivos Pediátricos), Javier Pilar Orive (Unidad de Cuidados Intensivos Pediátricos, Hospital Universitario de Cruces, Bizkaia. Sociedad Española de Cuidados Intensivos Pediátricos).
Bibliografía
- 1.Centro de Coordinación de Alertas y Emergencias Sanitarias. Dirección General de Salud Pública. Ministerio de Sanidad. Instituto de Salud Carlos III. Procedimiento de actuación frente a casos de infección por el nuevo coronavirus (2019-nCoV) [actualizado 6 Feb 2020]. Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov-China/documentos/Procedimiento_2019-nCoV.pdf
- 2.WHO. Statement on the second meeting of the International Health Regulations (2005) Emergency Committee regarding the outbreak of novel coronavirus (2019-nCoV). 30 January 2020. Disponible en: https://www.who.int/news-room/detail/30-01-2020-statement-on-the-second-meeting-of-the-international-health-regulations-(2005)-emergency-committee-regarding-the-outbreak-of-novel-coronavirus-(2019-ncov)
- 3.Cai J.H., Wang X.S., Ge Y.L., Xia A.M., Chang H.L., Tian H. First case of 2019 novel coronavirus infection in children in Shanghai. Zhonghua Er Ke Za Zhi. 2020;58:E002. doi: 10.3760/cma.j.issn.0578-1310.2020.0002. [DOI] [PubMed] [Google Scholar]
- 4.Li Q., Guan X., Wu P., Wang X., Zhou L., Tonget Y. Early transmission dynamics in Wuhan China, of novel coronavirus-infected pneumonia. N Engl J Med. 2020 doi: 10.1056/NEJMoa2001316. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Chen N., Zhou M., Dong X., Qu J., Gong F., Han Y. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395:507–513. doi: 10.1016/S0140-6736(20)30211-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Huang C., Wang Y., Li X., Ren L., Zhao J., Hu Y. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet. 2020;395:497–506. doi: 10.1016/S0140-6736(20)30183-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.WHO. Clinical management of severe acute respiratory infection when Novel coronavirus (2019-nCoV) infection is suspected: Interim Guidance. WHO/nCoV/Clinical/2020.2.
- 8.Chen Z.M., Fu J.F., Shu Q., Chen Y.H., Hua C.Z., Li F.B. Diagnosis and treatment recommendations for pediatric respiratory infection caused by the 2019 novel coronavirus. World J Pediatr. 2020 doi: 10.1007/s12519-020-00345-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Shen K., Yang Y., Wang T., Zhao D., Jiang Y., Jin R. Diagnosis, treatment, and prevention of 2019 novel coronavirus infection in children: experts’ consensus statement. World J Pediatr. 2020 doi: 10.1007/s12519-020-00343-7. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Lee J., Storch G.A. Characterization of human coronavirus OC43 and human coronavirus NL63 infections among hospitalized children < 5 years of age. Pediatr Infect Dis J. 2014;33:814–820. doi: 10.1097/INF.0000000000000292. [DOI] [PubMed] [Google Scholar]
- 11.Jean A., Quach C., Yung A., Semret M. Severity and outcome associated with human coronavirus OC43 infections among children. Pediatr Infect Dis J. 2013;32:325–329. doi: 10.1097/INF.0b013e3182812787. [DOI] [PubMed] [Google Scholar]
- 12.Konca C., Korukluoglu G., Tekin M., Almis H., Bucak I.H., Uygun H. The first infant death associated with human coronavirus NL63 infection. Pediatr Infect Dis J. 2017;36:231–233. doi: 10.1097/INF.0000000000001390. [DOI] [PubMed] [Google Scholar]
- 13.De Wit E., van Doremalen N., Falzarano D., Munster V.J. SARS and MERS: recent insights into emerging coronaviruses. Nat Rev Microbiol. 2016;14:523–534. doi: 10.1038/nrmicro.2016.81. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Zhu N., Zhang D., Wang W., Li X., Yang B., Song J., Coronavirus Investigating, and Research Team A novel coronavirus from patients with pneumonia in China, 2019. N Engl J Med. 2020 doi: 10.1056/NEJMoa2001017. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Chan J.F., Yuan S., Kok K.H., To K.K., Chu H., Yang J. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020 doi: 10.1016/S0140-6736(20)30154-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Rothe C., Schunk M., Sothmann P., Bretzel G., Froeschl G., Wallrauch C. Transmission of 2019-nCoV infection from an asymptomatic contact in Germany. N Engl J Med. 2020 doi: 10.1056/NEJMc2001468. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Chen H, Guo J, Wang C, Luo F, Yu X, Zhang W. Clinical characteristics and intrauterine vertical transmission potential of COVID-19 infection in nine pregnant women: a retrospective review of medical records. www.thelancet.com Published online February 12, 2020 https://doi.org/10.1016/S0140-6736(20)30360-3 [DOI] [PMC free article] [PubMed]
- 18.Chu D.K.W., Pan Y., Cheng S.M.S., Hui K.P.Y., Krishnan P., Liu Y. Molecular diagnosis of a novel coronavirus (2019-nCoV) causing an outbreak of pneumonia. Clin Chem. 2020 doi: 10.1093/clinchem/hvaa029. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.MinWei, MD Yuan J, Liu Y, Fu T, Yu X, Zhang ZJ. Novel Coronavirus Infection in Hospitalized Infants Under 1 Year of Age in China. JAMA Published online February 14, 2020 doi:10.1001/jama.2020.2131 [DOI] [PMC free article] [PubMed]
- 20.Khemani R.G., Smith L.S., Zimmerman J.J., Erickson S., Pediatric Acute Lung Injury Consensus Conference Group Pediatric acute respiratory distress syndrome: definition, incidence, and epidemiology: proceedings from the Pediatric Acute Lung Injury Consensus Conference. Pediatr Crit Care Med. 2015;16(Suppl. 1):S23–S40. doi: 10.1097/PCC.0000000000000432. [DOI] [PubMed] [Google Scholar]
- 21.Goldstein B., Giroir B., Randolph A. International Consensus Conference on Pediatric Sepsis. International pediatric sepsis consensus conference: definitions for sepsis and organ dysfunction in pediatrics. Pediatr Crit Care Med. 2005;6:2–8. doi: 10.1097/01.PCC.0000149131.72248.E6. [DOI] [PubMed] [Google Scholar]
- 22.Davis A.L., Carcillo J.A., Aneja R.K., Deymann A.J., Lin J.C., Nguyen T.C. American College of Critical Care Medicine Clinical practice parameters for hemodynamic support of pediatric and neonatal septic shock. Crit Care Med. 2017;45:1061–1093. doi: 10.1097/CCM.0000000000002425. [DOI] [PubMed] [Google Scholar]
- 23.WHO. Home care for patients with suspected novel coronavirus (nCoV) infection presenting with mild symptoms and management of contacts. WHO/nCov/IPC_HomeCare/2020.1.
- 24.Khemani R.G., Smith L.S., Zimmerman J.J., Erickson S., Pediatric Acute Lung Injury Consensus Conference Group Pediatric acute respiratory distress syndrome: definition, incidence, and epidemiology: proceedings from the Pediatric Acute Lung Injury Consensus Conference. Pediatr Crit Care Med. 2015;16:S23–S40. doi: 10.1097/PCC.0000000000000432. [DOI] [PubMed] [Google Scholar]
- 25.Rimensberger P.C., Cheifetz I.M., Pediatric Acute Lung Injury Consensus Conference Group Ventilatory support in children with pediatric acute respiratory distress syndrome: proceedings from the Pediatric Acute Lung Injury Consensus Conference. Pediatr Crit Care Med. 2015;16(Suppl. 1):S51–S60. doi: 10.1097/PCC.0000000000000433. [DOI] [PubMed] [Google Scholar]
- 26.Fan E., del Sorbo L., Goligher E.C., Hodgson C.L., Munshi L., Walkeyet A.J. An Official American Thoracic Society/European Society of Intensive Care Medicine/Society of Critical Care Medicine Clinical Practice Guideline: Mechanical ventilation in adult patients with acute respiratory distress syndrome. Am J Respir Crit Care Med. 2017;195:1253–1263. doi: 10.1164/rccm.201703-0548ST. [DOI] [PubMed] [Google Scholar]
- 27.Rhodes A., Evans L.E., Alhazzani W., Levy M.M., Antonelli M., Ferrer R. Surviving Sepsis Campaign: International guidelines for management of sepsis and septic shock: 2016. Intensive Care Med. 2017;43:304–377. doi: 10.1007/s00134-017-4683-6. [DOI] [PubMed] [Google Scholar]
- 28.Weiss S.L., Peters M.J., Alhazzani W., Agus M.S.D., Flori H.R., Inwald D.P. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Crit Care Med. 2020;21:e52–e106. doi: 10.1097/PCC.0000000000002198. [DOI] [PubMed] [Google Scholar]
- 29.Rodrigo C., Leonardi-Bee J., Nguyen-Van-Tam J., Lim W.S. Corticosteroids as adjunctive therapy in the treatment of influenza. Cochrane Database Syst Rev. 2016;3:CD010406. doi: 10.1002/14651858.CD010406.pub2. [DOI] [PubMed] [Google Scholar]
- 30.Delaney J.W., Pinto R., Long J., Lamontagne F., Adhikari N.K., Kumar A. The influence of corticosteroid treatment on the outcome of influenza A(H1N1pdm09)-related critical illness. Crit Care. 2016;20:75. doi: 10.1186/s13054-016-1230-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Arabi Y.M., Mandourah Y., Al-Hameed F., Sindi A.A., Almekhlafi G.A., Hussein M.A. Corticosteroid therapy for critically ill patients with Middle East respiratory syndrome. Am J Respir Crit Care Med. 2018;197:757–767. doi: 10.1164/rccm.201706-1172OC. [DOI] [PubMed] [Google Scholar]
- 32.Lu H. Drug treatment options for the 2019-new coronavirus (2019-nCoV) BioScience Trends. 2020 doi: 10.5582/bst.2020.01020. [DOI] [PubMed] [Google Scholar]
- 33.Chu C.M., Cheng V.C., Hung I.F., Wong M.M., Chan K.H., Chan K.S., HKU/UCH SARS Study Group Role of lopinavir/ritonavir in the treatment of SARS: initial virological and clinical findings. Thorax. 2004;59:252–256. doi: 10.1136/thorax.2003.012658. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Sheahan T.P., Sims A.C., Leist S.R., Schäfer A., Won J., Brownet A.J. Comparative therapeutic efficacy of remdesivir and combination lopinavir, ritonavir, and interferon beta against MERSCoV. Nat Commun. 2020;11:222. doi: 10.1038/s41467-019-13940-6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Agostini M.L., Andres E.L., Sims A.C., Graham R.L., Sheahan T.P., Lu X. Coronavirus susceptibility to the antiviral remdesivir (GS-5734) is mediated by the viral polymerase and the proofreading exoribonuclease. mBio. 2018;9 doi: 10.1128/mBio.00221-18. pii: e00221-18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Holshue M.L., DeBolt C., Lindquist S., Lofy K.H., Wiesman J., Bruce H. First case of 2019 novel coronavirus in the United States. N Engl J Med. 2020 doi: 10.1056/NEJMoa2001191. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Wang M., Cao R., Zhang L., Yang X., Liu J., Xuet M. Remdesivir and chloroquine effectively inhibit the recently emerged novel coronavirus (2019-nCoV) in vitro. Cell Res. 2020 doi: 10.1038/s41422-020-0282-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Richardson P., Griffin I., Tucker C., Smith D., Oechsle O., Phelan A. Baricitinib as potential treatment for 2019-nCoV acute respiratory disease. Lancet. 2020;395:e30–e31. doi: 10.1016/S0140-6736(20)30304-4. [DOI] [PMC free article] [PubMed] [Google Scholar]