Samenvatting
De ademhaling omvat alle processen die betrokken zijn bij de opname van zuurstof en de afgifte van koolzuur. Deze gaswisseling is van doorslaggevende betekenis voor alle metabole gebeurtenissen in het lichaam.
De ademhaling omvat alle processen die betrokken zijn bij de opname van zuurstof en de afgifte van koolzuur. Deze gaswisseling is van doorslaggevende betekenis voor alle metabole gebeurtenissen in het lichaam.
Het ademhalingsquotiënt is de verhouding tussen O2 en CO2 tijdens de verbranding. Omdat er bij de verbranding van koolhydraten evenveel moleculen O2 worden gebruikt als CO2 worden gevormd, heeft het quotiënt de waarde 1. Bij de verbranding van vetten is het ademhalingsquotiënt 0,7 en in een gemiddeld dieet 0,8.
Het is de taak van de ademhaling om te zorgen voor zuurstofrijk bloed dat door de circulatie naar de perifere weefsels wordt gebracht en de eliminatie van het in de weefsels gevormde kooldioxide dat hier vandaan door de circulatie naar de longen wordt getransporteerd (afb. 3.1).

3.1 Anatomie en fysiologie van het ademhalings stelsel
De ademhaling kan worden onderverdeeld in een viertal processen:
ventilatie . Dit is de verplaatsing van lucht van buiten het lichaam via de luchtwegen naar de longblaasjes (alveoli) waar de gaswisseling plaatsvindt;
diffusie . De overgang van O2 en CO2 over het alveolocapillaire membraan heen die de grens vormt tussen het longblaasje en de longcapillairen;
perfusie . De doorbloeding van de capillaire longcirculatie waarbij zuurstofarm (veneus) bloed naar de alveoli wordt getransporteerd en omgekeerd zuurstofrijk (arterieel) bloed naar de weefsels wordt vervoerd;
regulatie van de ademhaling afhankelijk van de metabole behoefte.
3.1.1 Functionele anatomie
De luchtwegen bestaan uit de neus-keelholte, de mond, de larynx, de trachea, de bronchiën met alle vertakkingen en de bronchioli.
Lucht kan zowel via de neus als via de mond in de luchtwegen komen, waarbij de bouw van de neus ervoor zorgt dat de lucht gezuiverd, verwarmd en bevochtigd wordt, wat bij mondademhaling veel minder goed mogelijk is. Bij flinke inspanning, waarbij de gaswisseling aanzienlijk moet toenemen, is de nauwe doorgang van de neus een belemmering voor de snelle ventilatie en vindt voornamelijk mondademhaling plaats. Bij neusademhaling kan zeer koude lucht snel opgewarmd worden tot meer dan 30 graden Celsius in de keelholte. Koude lucht kan bij personen met een aanleg voor astma een aanval bewerkstelligen. Ondanks de nauwe doorgang van de neuspassage die door de neusschelpen (conchae) wordt veroorzaakt, lukt het normaliter goed om een sonde door de neus tot in de farynx te brengen.
De keelholte (farynx ) is een gemeenschappelijke ruimte voor de slokdarm en de luchtwegen. De larynx (strottenhoofd) steekt er als het ware als het mondstuk van een fluit aan de ventrale kant van de farynx in uit. De epiglottis is aan het schildklierkraakbeen verbonden en reikt omhoog tot over het tongbeen. Bij slikken wordt het door de tong naar achteren geduwd waarmee het de larynx afdekt, zodat voedsel het strottenhoofd niet kan binnendringen. Bij sommige hersenstamprocessen (bulbairparalyse) is de coördinatie van de spieren die dit regelen verstoord en is er een flinke kans op de gevaarlijke verslikpneumonie.
De larynx zet zich voort als trachea die zich tussen beide longen in het mediastinum bevindt. Hij is bekleed met trilhaarepitheel waarvan de trilharen (cilia) door hun beweging onbewust verontreinigingen en de kleine hoeveelheid secretiemateriaal, dat onder normale omstandigheden wordt geproduceerd, naar de farynx transporteren.
In de grote bronchustakken bevinden zich ook slijmproducerende slijmbekercellen en hoestprikkelreceptoren. Onder normale omstandigheden is de activiteit van de cilia voldoende om het secretiemateriaal te verwijderen en is hoesten overbodig. Wanneer de hoeveelheid slijm, door welke oorzaak dan ook, toeneemt, is hoesten noodzakelijk. Dit gebeurt vrijwillig of reflexmatig. Hoesten begint met een diepe inspiratie waarna sluiting van de glottis en aanspanning van de uitademingsspieren optreedt. Hierdoor ontstaat er een sterk verhoogde intrathoracale druk die plotseling minder wordt als de glottis zich opent en er een sterke uitademingsstroom ontstaat. Er is hierbij echter een verschil tussen de intrathoracale druk en de druk in de luchtwegen, waardoor het niet-kraakbenige gedeelte van de luchtwegen naar binnen klapt en het lumen sterk vernauwd raakt. De lineaire stroomsnelheid door de vernauwde luchtwegen neemt hierbij zodanig toe dat slijm en dergelijk gemakkelijk losraken.
De trachea splitst zich in de twee hoofdbronchi waarvan de linker bronchus iets meer horizontaal verloopt dan de rechter. Een te lange endotracheale tube komt dus wat eerder in de rechter bronchus terecht en kan de linker dan afsluiten. Ook corpora aliena belanden wat gemakkelijker in de rechter hoofdbronchus.
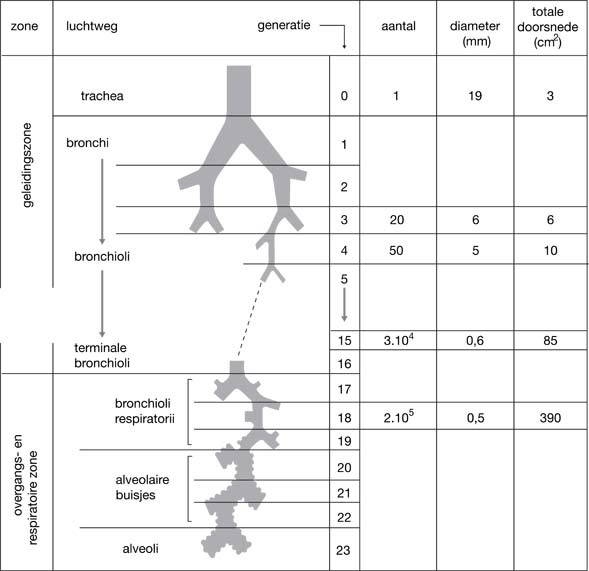
Door de aanwezigheid van het hart is de linkerlong, die uit twee kwabben bestaat, wat kleiner dan de uit drie kwabben bestaande rechterlong. Linker en rechter hoofdbronchus splitsen zich dan ook in twee respectievelijk drie grote bronchustakken. Deze splitsen zich in segmentbronchiën waarvan er acht in de linker en tien in de rechterlong zijn. Deze vertakken zich verder tot uiteindelijk de bronchioli ontstaan waarvan de wand geheel uit bindweefsel, glad spierweefsel en slijmvlies bestaat.
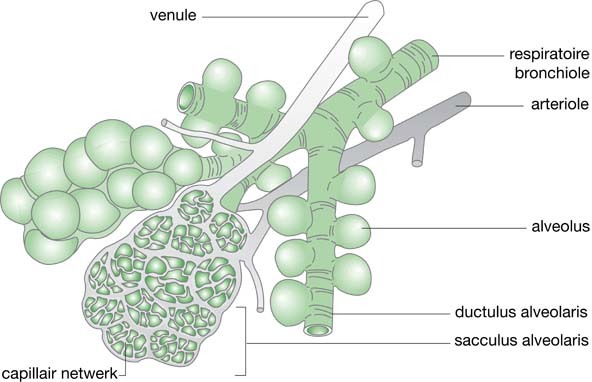
Iedere nieuwe vertakking wordt een generatie genoemd. Er zijn tien tot 23 generaties. Vanaf de zeventiende generatie bevinden zich alveoli tussen de bronchioli die verbonden zijn aan de bronchioli van de twintigste tot tweeëntwintigste generatie. Een mens heeft circa 300 miljoen alveoli en het totale oppervlak, bschikbaar voor gasdiffusie, varieert tussen de vijftig en honderd vierkante meter. Per alveolus zijn er ongeveer duizend capillairen (afb. 3.2 en 3.3).
3.1.2 Ventilatie
Het transport van in- en uitademingslucht van en naar de longblaasjes vindt plaats op basis van de wet van Boyle voor een afgesloten ruimte: P × V = C. De gasdruk (P) in die ruimte is omgekeerd evenredig met het volume (V). Om lucht in of uit te ademen moeten drukverlaging of drukverhoging bewerkstelligd worden die alleen door volumeveranderingen in de thorax tot stand kunnen komen.
We onderscheiden verschillende soorten druk:
PL = intrapulmonale (intra-alveolaire druk) en PB = barometerdruk.
Lucht beweegt van hoge naar lage druk:
Voor inademen geldt: PL < PB. V moet toenemen zodat PL kan dalen.
Voor uitademen geldt: PL > PB. V moet afnemen zodat PL kan stijgen.
Intrapleurale (intrathoracale) druk = druk in de pleuraholte: Pip.
De transmurale druk is de druk over de alveoluswand die de alveolus tot uitzetten brengt. Deze wordt berekend door de intrapleurale druk van de intra-alveolaire druk af te trekken. De intra-alveolaire druk is de druk in de alveoli. De intrapleurale druk is normaliter ongeveer 4 mm Hg lager dan de intra-alveolaire druk (als de intrapleurale druk groter is dan de atmosferische druk, klappen de longen in). De barometerdruk is ongeveer constant, daarom is ademhalen afhankelijk van veranderingen in de intra-alveolaire druk (PL) (afb. 3.4).
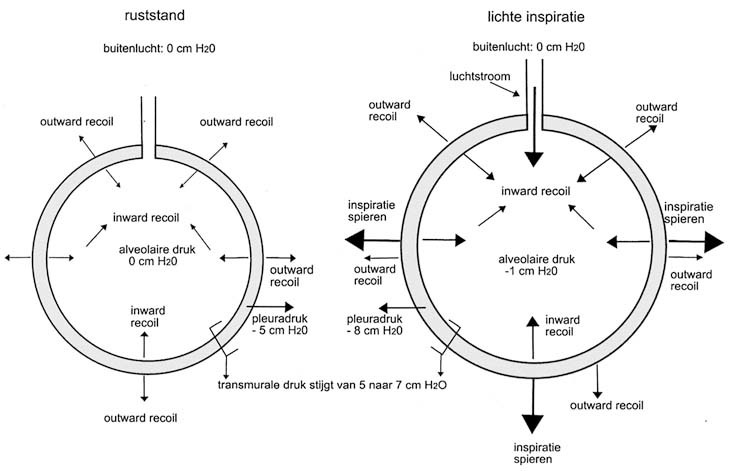
De negatieve druk die zo in de borstkas en dus in de alveoli ontstaat is de drijvende kracht voor de inademing. De alveoli zetten daarbij uit, maar niet allemaal evenveel. De hoeveelheid lucht die de alveoli bereikt, wordt bepaald door de kracht van de ademhalingsspieren, de elasticiteit van het longparenchym, de stijfheid van de borstkas en de doorgankelijkheid van de luchtwegen. Voor het verkrijgen van een inzicht in de ventilatoire mogelijkheden van de longen heeft men een meting ontwikkeld die spirometrie heet en een indeling gemaakt die in de longpathologie nuttig is (afb. 3.5). De totale capaciteit (TC) is de hoeveelheid lucht die de longen bij volledige inademing kunnen bevatten. De vitale capaciteit (VC) is de hoeveelheid lucht die iemand na maximale inademing kan uitademen. De lucht die hierna overblijft, wordt residuair volume (RV) genoemd. Ook bij maximale uitademing blijft er dus een hoeveelheid lucht in de longen achter. De lucht die in rust met een ademteug naar binnen komt heet het tidale volume (TV) en de lucht die in de longen aanwezig is na een uitademing in rust heet de functionele reservecapaciteit (FRC) . Verder onderscheidt men nog de hoeveelheid lucht die ingeademd kan worden na een rustige inademing en lucht die nog uitgeademd kan worden na een rustige uitademing, respectievelijk het inspiratoire en het expiratoire reservevolume (IRV en ERV) .

De belangrijkste parameter is echter de 1 secondewaarde (FEV1). Dat is de hoeveelheid lucht die na maximale inspiratie in één seconde kan worden uitgeblazen. De FEV1 kan als absoluut getal of als percentage van de VC worden opgegeven (tabel 3.1).
| VT | tidaal volume | 0,5 L | |
| IRV | inspiratoir reservevolume | 2,5 L | |
| ERV | expiratoir reservevolume | 1,5 L | |
| IC | inspiratoire capaciteit | 3,0 L | VT + IRV |
| VC | vitale capaciteit | 4,5 L | IRV+ VT + ERV |
| RV | residuair volume | 1,5 L | |
| TLC | totale longcapaciteit | 6,0 L | VC + RV |
| FRC | functionele residuaire capaciteit | 3,0 L | ERV + RV |
| FEV1 | 1 secondewaarde | percentage van de VC dat in 1 seconde kan worden uitgeademd | |
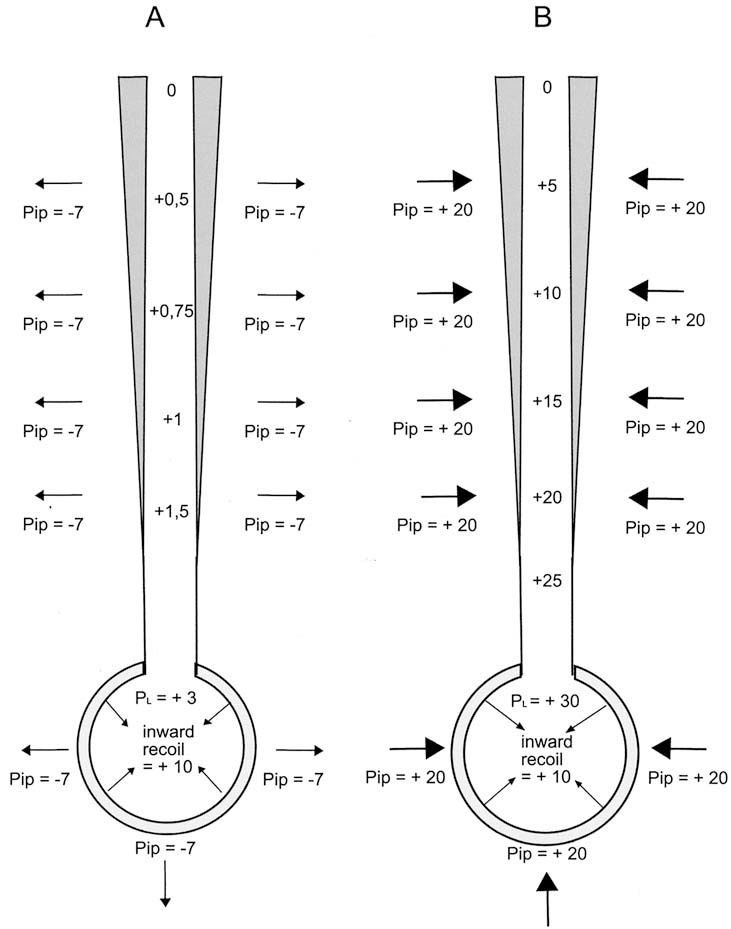
De borstwand en de longen zijn elastische structuren die kunnen uitzetten door aanspannen van de ademhalingsmusculatuur en weer terugvallen in de uitgangspositie als de spieren niet meer aangespannen zijn (‘inward en outward recoil’). In rust zijn outward en inward recoil met elkaar in evenwicht, waarbij er een negatieve druk heerst in de pleuraholte. Tijdens de ademhaling ligt dit ‘rustpunt’ aan het einde van een uitademing in rust. Het dunne filmpje pleuravocht gelegen tussen pleura parietale en pleura viscerale houdt de longen tegen de borstwand aan, de hoeveelheid ligt tussen de 5 en 10 ml. De longen kunnen niet loskomen van de thoraxwand maar zich er wel ten opzichte van bewegen.
De intercostaalspieren trekken de ribben, die in uitademing schuin naar beneden lopen, omhoog en horizontaal. De voor-achterwaartse en de transversale diameter nemen daardoor toe en de inhoud van de borstkas wordt bij inademing dan vergroot. Het diafragma bevat een centrale pees en de spiervezels die eraan hechten lopen naar perifeer waar ze aan de ribbenkas vastzitten. Bij aanspannen van het diafragma wordt de buikinhoud naar beneden geduwd terwijl ook de ribben omhoog en naar buiten worden getrokken. Hierdoor neemt de borstinhoud toe. Bij het ademen in rust kost uitademing geen moeite, maar bij krachtige expiratie (het expiratoire reservevolume) moeten de uitademingsspieren flink aangespannen worden waarbij de intrapleurale druk positief en dus de ‘inward recoil’ versterkt wordt. Bij zware inspanning en bij longziekten met dyspnoe wordt de hulpademhalingsmusculatuur ingeschakeld, bestaande uit de mm. scaleni en mm. sternocleidomastoidei.
De compliance
De elastische eigenschappen van borstkas en longen zijn verschillend, zoals blijkt uit afbeelding 3.6 die het verband aangeeft tussen volumeverandering (ΔV) en drukverandering (ΔP) in de longen. Dit verband heet compliance. De verhouding tussen ΔV en ΔP is geen rechte lijn. Bij hoge longvolumes zijn de rekbare elementen in de alveolaire wand al behoorlijk uitgezet en is er voor een toename van de rek meer kracht nodig. Uit de curve voor de longcompliance blijkt dat voor een uitademing in rust (het tidale of het ademteugvolume) nauwelijks kracht nodig is, maar dat voor een zeer diepe uitademing of inademing de kracht moet toenemen. De curve gaat bij hoge en lage longvolumes steeds meer horizontaal lopen. Bij inademing naar de top van de VC ontmoeten de inspiratiespieren een steeds sterkere tegenkracht van de inward recoil, afkomstig van de longen en de borstkas die niet verder kan uitzetten. Om dezelfde reden kan nooit alle lucht in de longen worden uitgeademd. Hoe krachtig de uitademingsspieren ook werken, op het niveau van het residuaire volume kunnen zij niet op tegen de outward recoil van de thoraxwand.
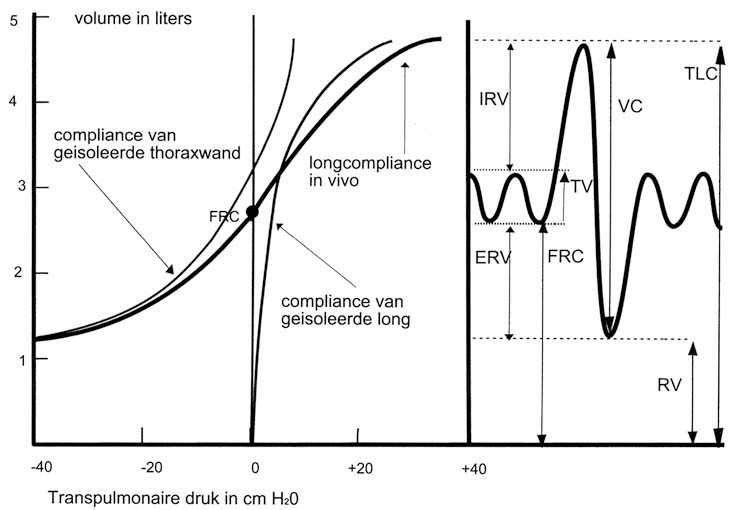
Verder is er een verschil in de compliance bij in- en bij uitademing, een verschijnsel dat hysteresis wordt genoemd. De statische compliance wordt steeds bepaald gedurende momenten dat er geen luchtstroom is. Bij continu ademen, als we een dynamische curve schrijven, wijkt de curve af van de statische compliance: bij inspiratie naar rechts, bij expiratie naar links. Dat komt omdat bij continue ademhaling de luchtstroom een tegenkracht ondervindt, namelijk de stromingsweerstand: er is dan een drukverschil tussen de buitenlucht en de alveolaire druk. Omdat de statische compliance steeds tijdens ademstilstand wordt bepaald, is er geen luchtstroom, want de intra-alveolaire druk is dan gelijk aan die van de buitenlucht.
De surfactant
Tot dusver is de inward recoil alleen besproken als een eigenschap van de elastische structuur van het longweefsel. Er is echter een belangrijke additionele factor, namelijk de oppervlaktespanning .
Gelijksoortige moleculen in de vloeistoffase oefenen een niet-chemische aantrekkingskracht op elkaar uit. Deze kracht wordt cohesiekracht genoemd. In een vloeistof houden de moleculen elkaar in evenwicht, maar op het grensvlak van vloeistof en gas heeft die cohesiekracht tot effect dat het kleinst mogelijke volume door de vloeistof wordt ingenomen omdat er boven het scheidingsvlak geen vloeistofmoleculen zijn. Een plas vloeistof op een glad oppervlak heeft een licht bollend oppervlak, water neemt in zeer kleine hoeveelheid de vorm van een druppel aan.
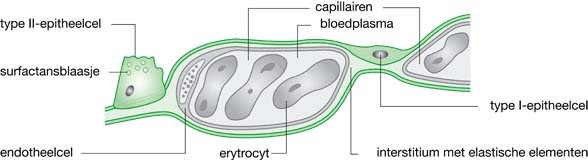
Alveoli kunnen beschouwd worden als bolvormige structuren gevuld met gas; ze zijn verschillend van grootte en staan met elkaar in verbinding. De inward elastic recoil, de wandspanning , wordt niet alleen gevormd door de elastische eigenschappen van het longweefsel maar ook door de oppervlaktespanning. De alveoli zijn aan de gaskant bedekt met een dun vloeistoflaagje (interstitiële vloeistof) en er is dus een grenslaag vloeistof-gas.
De wet van Laplace stelt dat de wandspanning van een bol omgekeerd evenredig is met de straal van die bol, met andere woorden: bij gelijke wandspanning (T) is de druk (P) in een kleine bol groter dan in een grote bol.
T = P × r / 2 h. Aangezien h geen rol speelt bij een alveolus luidt de formule:
T = P × r / 2.
Wanneer de wandspanning van kleine en grotere alveoli overal gelijk zou zijn, zouden de kleine alveoli een hogere druk hebben dan de grote, daarin leeglopen en collaberen. De vloeistoflaag aan de binnenkant van de alveoli bevat echter een detergentachtige stof die de oppervlaktespanning verlaagt. De stof wordt afgescheiden door type 2-epitheelcellen van de alveoli en heet surfactant. Kleine alveoli hebben een lagere oppervlaktespanning dan grote. Daardoor is de druk in alle alveoli gelijk en zullen de kleine niet collaberen.
Door de surfactant vermindert de inward recoil en neemt de compliance van de longen toe. Met andere woorden: de surfactant zorgt ervoor dat kleine alveoli niet geheel collaberen bij uitademing en ook dat zij bij inademing gemakkelijk uitzetten. Het weer ‘opblazen’ van gecollabeerde alveoli zou bijzonder veel kracht van de ademhalingsspieren vragen.
Surfactant is een lipoproteïne dat continu geproduceerd en verwijderd wordt. Een deel wordt gerecycled, een deel wordt door macrofagen opgeruimd.
De betekenis van de surfactant wordt duidelijk in situaties van een tekort ervan, namelijk bij premature babies en bij het ‘adult respiratory distress syndrome’ (ARDS), dat soms optreedt na zware traumata en chirurgische ingrepen die met hypoxie gepaard gaan. Deze patiënten moeten dan zodanig beademd worden dat de alveolaire druk boven de atmosferische druk blijft. Dit heet ‘positive end expiratory pressure’ (PEEP)-beademing.
Ten slotte speelt de onderlinge samenhang van de alveoli een rol: een neiging tot schrompeling van de ene groep alveoli roept elastische krachten in omliggende alveoli op die dit tegengaan.
Het berekenen van de statische compliance
De complianceformule is de volumeverandering gedeeld door de drukverandering (ΔV / ΔP), uitgedrukt in liters per cm H2O-druk. De druk is de transmurale druk, dus het verschil tussen de intra-alveolaire druk en de intrapleurale druk. Voor het in- of uitademen wordt de transmurale druk bepaald. Na het in- of uitademen van een bepaald volume wordt de transmurale druk opnieuw bepaald en de eerste bepaling wordt van de tweede afgetrokken. Daarmee weet men dan de drukverandering bij een bepaalde volumeverandering. De drukken worden gemeten in ademstilstand, dus als de alveolaire druk (PA) gelijk is aan de atmosferische druk, dus 0. De intrapleurale druk (Pip) wordt gemeten met een slokdarmballonnetje, omdat daar de druk gelijk is aan die in de pleuraholte.
Compliance = ΔV / (PA2 − Pip2) − (PA1 − Pip1).
Een voorbeeld: een patiënt heeft aan het einde van een uitademing een intrapleurale druk van −5 cm H2O. Na inademen van 500 ml bedraagt de intrapleurale druk −10 cm H2O.
De compliance is dan 0,5 liter / {0 − (−10)} − {0 − (−5)} = 0,5 / (10 − 5) = 0,10 liter per cm H2O = 100 ml/cm H20. Na een diepe inademing moet de proefpersoon in stappen uitademen waarbij volume en druk gemeten worden tijdens een pauze in de uitademing. Op die momenten is de alveolaire druk namelijk gelijk aan de atmosferische druk.
Bepaling van de statische compliance kan van betekenis zijn bij oudere patiënten die anesthesie moeten ondergaan. Bij veroudering verandert de longfunctie, waarbij zowel restrictieve als obstructieve afwijkingen voorkomen. Problemen ontstaan nogal eens enkele dagen na de operatie (afb. 3.7).

Regionale verdeling van de alveolaire ventilatie
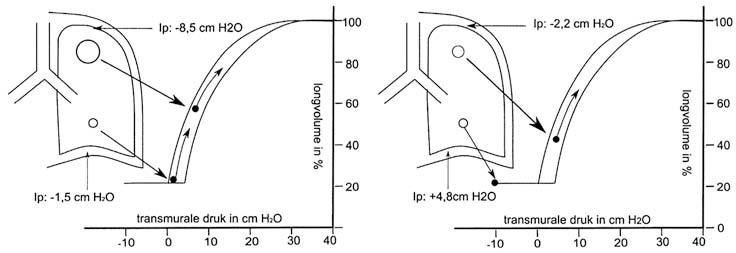
In staande en zittende houding is de intrapleurale druk, Pip, niet gelijkmatig over de long verdeeld. De Pip is groter in de longtoppen dan in de longbases. De verklaring hiervoor is de invloed van de zwaartekracht die aan de toppen een grotere invloed heeft dan aan de bases. Hierdoor is er een drukgradiënt van de Pip van de bases naar de toppen.
In de ruststand zijn de inward en de outward recoil met elkaar in evenwicht. Dit is het punt van de functionele residuaire capaciteit, het volume dat achterblijft in de longen na een uitademing van het tidale volume (circa 500 ml). De intra-alveolaire druk (PL) is dan nul, want gelijk aan de atmosferische druk.
De Pip is in de longtoppen ongeveer −9 cm H2O en in de bases slechts −1,5 cm H2O. De transmurale druk, het verschil tussen Pip en PL, is in de alveoli in de toppen veel groter is dan in die in de longbases. De alveoli in de longtoppen hebben dan ook een veel groter volume dan die aan de bases. Een tweede aspect is echter dat in de ruststand de alveoli in de longtoppen met een hogere transmurale druk zich in een minder steil gedeelte van de compliancecurve bevinden. Daarom is hun volumeverandering geringer bij inademen vanaf de FRC dan die van de alveoli in de longbases: hoewel hun omvang aanzienlijk groter is, worden ze relatief minder goed geventileerd omdat hun compliance veel lager is (afb. 3.8). De gevolgen hiervan zijn:
het grootste deel van de FRC (RV + ERV) bevindt zich in de alveoli in de longtoppen;
het grootste deel van het IRV bevindt zich in de alveoli in de longbases.
Bij liggende patiënten in het ziekenhuis is er een belangrijke afname van alle longvolumina, vooral van de functionele residuaire capaciteit. Hierdoor worden de laaggelegen luchtwegen eerder afgesloten en is de oxygenatie van de betrokken alveoli verminderd.
De luchtwegweerstand
Naast de compliance is de stroomsnelheid van lucht door de luchtwegen een zeer belangrijke factor bij het verplaatsen van lucht van en naar de alveoli. Lucht beweegt van hoge naar lage druk. De luchtstroom is recht evenredig met het drukverschil, de drukgradiënt, en omgekeerd evenredig met de luchtwegweerstand van het buizenstelsel.
Drukgradiënt = luchtstroom × luchtwegweerstand.
P = R × V (vergelijk de wet van Ohm: V = I × R).
De stroming door een buizenstelsel, of dat nu vloeistof is zoals bloed in de circulatie of lucht in de luchtwegen, kent twee typen, namelijk laminaire en turbulente stroming (afb. 3.9).
De luchtweerstand wordt vooral bepaald door het kaliber van de bronchustakken. Hoewel het kaliber bij verdere vertakking afneemt, neemt het aantal takjes toe en netto is de luchtweerstand dan ook hoger op het niveau van de grotere bronchustakjes dan op het niveau van de kleinere, waar de stroomsnelheid ook laag is vergeleken met de grote luchtwegen. Vergelijk dit met een netwerk van slootjes dat via een kanaal uitkomt op een rivier. De kleinste luchtwegen hebben geen kraakbeen in hun wand en kunnen daardoor zowel wijder als nauwer worden. Omdat de luchtwegweerstand omgekeerd evenredig is met de vierde macht van de straal van de luchtwegen, hebben veranderingen in de diameter grote gevolgen voor de luchtweerstand.
De smalle luchtwegen met glad spierweefsel maar zonder kraakbeenringen staan onder controle van het autonome zenuwstelsel. De parasympathische vezels veroorzaken bronchoconstrictie, de sympathische stimuleren de β2-adrenerge receptoren en bewerkstelligen bronchodilatatie. Talrijke andere stoffen veroorzaken ook bronchoconstrictie, zoals sigarettenrook, stof en chemische prikkels zoals histamine.
De luchtwegweerstand is sterk afhankelijk van het longvolume. Bij diep inademen (groot longvolume) worden de kleine luchtwegen uitgerekt door de vergrote transmurale druk en omdat de luchtwegweerstand omgekeerd evenredig is met de vierde macht van de straal, vermindert deze aanzienlijk. Het tegengestelde gebeurt bij krachtig uitademen.
Dynamische luchtwegcompressie ontstaat bij krachtige expiratie (dus bij lage longvolumes) waarbij de Pip zo sterk wordt dat de kleine luchtwegen worden dichtgedrukt en de daarbij behorende alveoli worden afgesloten (‘air trapping’). Bij gezonde mensen treedt dit pas op bij zeer sterke expiratie, maar bij emfyseempatiënten en bejaarden al veel eerder. Het punt waarop de dynamische luchtwegcompressie begint heet het sluitingsvolume (‘closing volume’) (afb. 3.10). Naarmate de krachtige expiratie doorzet, komt het punt waarop dit in de kleine brochustakjes begint dichter bij de alveoli te liggen. De enige kracht die dit kan tegengaan is de alveolaire recoil omdat deze aan de omliggende kleine luchtwegen trekt. Deze kracht neemt echter af bij veroudering. Door de dynamische compressie collaberen kleine luchtwegen en worden de daarop drainerende alveoli, die nog lucht bevatten, afgesloten. Deze lucht moet aan het RV worden toegevoegd.
Bij gezonde jonge mensen is het sluitingsvolume gelijk aan het residuaire volume, maar bij veroudering gaat het een deel van de FRC in beslag nemen. Zoals later bij de gaswisseling wordt besproken, heeft de FRC een belangrijke functie. Een ander aspect is echter de zware arbeid die moet worden verricht om de gecollabeerde alveoli weer open te krijgen. Vergelijk dit maar met het opblazen van een lege ballon: in het begin is dat zeer zwaar, maar als er een beetje lucht in zit gaat het veel gemakkelijker.
Vernauwing van de luchtwegen komt bij tal van ziekten voor, door bronchospasmus (kramp van de gladde spieren), secretiemateriaal en oedeem van het slijmvlies. De vernauwing manifesteert zich vooral bij expiratie, omdat dan ook onder normale omstandigheden al een lichte bronchoconstrictie optreedt. De belangrijkste parameter is de 1 secondewaarde. Een daling ervan kan niet alleen veroorzaakt worden door vernauwing van de luchtwegen, maar ook door verminderde elasticiteit van de longen.
Aan het ziekbed wordt ook vaak een peak-flowmeter gebruikt, die dan wat beter te hanteren is. Hierbij wordt de stroomsnelheid in een buisje met een draaiend vinnetje gemeten en gerelateerd aan het geïnspireerde of geëxpireerde volume. Het is dezelfde methodiek als de 1 secondewaarde, maar kan ook aan het ziekbed of voor zelfmonitoring worden gebruikt.
Het maximale ademminuutvolume is de hoeveelheid lucht of zuurstof die een persoon per minuut kan ventileren. Deze kan bij gezonde jonge mensen wel 100 liter bedragen. Dit getal correleert sterk met de 1 secondewaarde (afb. 3.11).

Onder normale omstandigheden is er in rust een ongelijkmatige ventilatie: de lage longdelen ventileren sterker dan de toppen. Deze ongelijkmatigheid verdwijnt normaal bij diepe respiratie en bij inspanning; dit heet recruitment .
Bij inademing wordt de lucht in de alveoli niet volledig ververst, het residuaire volume wordt immers niet uitgeademd en alleen door menging met nieuw geïnspireerde lucht treedt verversing op. Daardoor wisselt de gasspanning in de alveoli ook veel minder sterk dan het geval zou zijn bij volledige verversing van het longvolume. Het effect van ademhalen is het toevoegen van O2 en het uitwassen van CO2. Daarbij wordt de lucht dus niet in zijn geheel vervangen. Het residuair volume kan niet met spirometrie worden bepaald. De functionele residuaire capaciteit heeft een bufferfunctie tegen grote veranderingen in de alveolaire PO2 en pCO2 bij elke ademhaling. Het is een reservoir voor O2 en een stortkoker voor CO2.
Ventilatiestoornissen
Ventilatiestoornissen worden verdeeld in restrictieve en obstructieve stoornissen. Restrictieve ventilatiestoornissen hebben betrekking op een afname van de longcapaciteit, voornamelijk de totale longcapaciteit. Deze komt tot uitdrukking in een daling van de VC. Beperkingen in de longcapaciteit kunnen veroorzaakt worden door afwijkingen in de borstkas zoals kyfoscoliose. Andere voorbeelden zijn ziekten van de ademhalingsspieren, aandoeningen van het longparenchym (pneumonieën, longfibrose, longoedeem) en de pleura (pleura-exudaat). Obstructieve ventilatiestoornissen betreffen afwijkingen in de uitademing, veroorzaakt door vernauwingen in de tracheobronchiaalboom en verlies aan elasticiteit. Dit komt voor bij bronchitis en emfyseem. De verzamelnaam is ‘chronic obstructive pulmonary disease’ (COPD) .
De meest gebruikte en eenvoudigste test is de 1 secondewaarde in absoluut getal of als percentage van de VC (tabel 3.2). Met een 1 secondewaarde van 600 ml kan iemand nog van zijn bed naar de tafel komen. Als bijvoorbeeld een patiënt wegens longkanker een pneumectomie moet ondergaan en hij heeft een 1 secondewaarde van 1.200 ml, dan is een dergelijke operatie niet goed mogelijk (afb. 3.12).
| longfunctietest | restrictief | obstructief |
| vitale capaciteit | verminderd | verminderd of normaal |
| residuair volume | verminderd of normaal | toegenomen |
| totaal longvolume | verminderd | normaal of toegenomen |
| FEV1 / VC | normaal of toegenomen | verminderd |
| FEV1 absoluut | verminderd | verminderd |

3.1.3 Diffusie
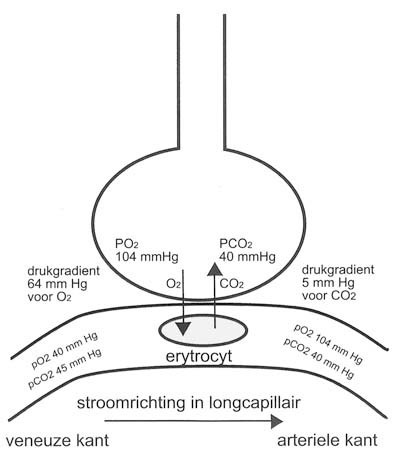
Onder diffusie verstaat men de beweging van moleculen van een hogere naar een lagere concentratie. Het is een passief proces. In de perifere weefsels gaat de zuurstof door diffusie vanuit het bloed de cellen in en gaat het koolzuur in omgekeerde richting vanuit de cellen naar het bloed. In de longen gaat zuurstof vanuit het alveolaire gasmengsel naar de longcapillairen en omgekeerd gaat de CO2 vanuit de longcapilairen naar de alveoli.
Op zijn weg vanaf de buitenlucht naar de weefsels wordt zuurstof verdund (met waterdamp) en overgedragen aan de weefsels, zodat van de oorspronkelijke 159 mm Hg in de buitenlucht er op cellulair niveau (in de mitochondriën) soms maar 4 tot 20 mm Hg overblijft. Op deze weg zijn er talrijke hindernissen die de zuurstofoverdracht kunnen belemmeren.
Het deel van de long dat niet aan de gaswisseling deelneemt, dat wil zeggen het totale volume van de luchtwegen, heet anatomische dode ruimte en bedraagt ongeveer 150 ml. De alveolaire dode ruimte is dat deel van de alveoli dat wel geventileerd maar niet doorbloed wordt. Samen vormen zij de fysiologische dode ruimte. De uitademinglucht bevat lucht uit beide compartimenten.
VT is het tidale volume, VE is het ademminuutvolume : de hoeveelheid die per minuut wordt uitgeademd:
VE = VT × F (F is de ademfrequentie).
De hoeveelheid lucht die de alveoli per minuut bereikt en deelneemt aan de gaswisseling is:
VA = VE − VD, waarin VA is de alveolaire ventilatie en VD is de doderuimteventilatie: doderuimtevolume × F.
De alveolaire en doderuimteventilatie zijn wel te meten maar daarmee is nog niet bekend of de VA voldoende is om de in het lichaam geproduceerde CO2 te verwijderen. In rust is de CO2-productie (VCO2 ) ongeveer 200 ml per minuut, dat is 288 liter per 24 uur. Afgezien van 1% die als bicarbonaat door de nieren wordt uitgescheiden, moet dit door de longen worden verwijderd.
Partiële gasdruk in ademhalingsgassen
De normale druk van de buitenlucht is 1 atmosfeer, wat ongeveer overeenkomt met 760 mm Hg.
Volgens de wet van Dalton betreffende gasmengsels wordt de druk van een afzonderlijk gas bepaald door het percentage (fractie) van dat gas in het gasmengsel. De buitenluchtsamenstelling is onder normale omstandigheden: zuurstof 21%, stikstof 79% en 0,04% CO2. De bijbehorende partiële gasdrukken zijn dus respectievelijk 159 mm Hg, 600 mm Hg en 0,3 mm Hg. De CO2-spanning van de buitenlucht is dus verwaarloosbaar. F staat voor fractie (bij zuurstof dus 0,21), de letters I, E en A duiden aan of het om inspiratie, expiratie of alveolaire lucht gaat. Zoals we zullen zien zijn al die luchtsoorten verschillend van samenstelling.
Stikstof is een inert gas waarvan de diffusie uitsluitend door de oplosbaarheid in vloeistof en weefsel wordt bepaald. Daardoor is er nauwelijks verschil in percentage stikstof in de in- en uitademinglucht, respectievelijk 79 en 77%. Het zuurstofgehalte van de in- en uitademinglucht daalt van 21 naar 16%, van koolzuur stijgt het van 0 naar 3% (tabel 3.3).
| gas | inspiratielucht | alveolaire lucht | expiratielucht | buitenlucht |
| PO2 | 149 | 104 | 120 | 159 |
| PCO2 | 0,3 | 40 | 27 | 0,3 |
| PN2 | 564 | 569 | 566 | 600 |
| PH2O | 47 | 47 | 47 | wisselend |
De lucht wordt bij inademing volledig met waterdamp verzadigd en deze waterdamp heeft een partiële druk van 47 mm Hg. Omdat het hier geen afgesloten ruimte betreft zal de druk niet toenemen maar nemen de fracties van de andere gassen af wat tot ‘verdunning’ van stikstof en zuurstof leidt.
De PO2 van met waterdamp verzadigde inspiratielucht (PiO2) is gelijk aan de fractie van de zuurstof (FiO2) in de buitenlucht maal de barometerdruk minus de spanning van de waterdamp:
PiO2 = FiO2 × (760 − 47) → 0,21 × 713 = 149 mm Hg.
Het verschil tussen de alveolaire lucht en de expiratielucht komt op rekening van de menging van de inspiratielucht en alveolaire lucht in de fysiologische dode ruimte.
Onder de diffusiecapaciteit van de longen verstaat men de hoeveelheid gas die, onderhevig aan het verschil in relatieve gasdruk tussen de alveoli en het pulmonaire capillaire bed, over het alveolocapillaire membraan verplaatst wordt per tijdseenheid. Dit is geheel verschillend van de gasverplaatsing in de luchtwegen die plaatsvindt op basis van een totaal drukverschil over het hele traject. Van de grotere luchtwegen naar de kleine toe neemt de stroomsnelheid sterk af en wordt op het niveau van de alveoli nihil. Verdere verplaatsing van het gasmengsel vindt niet plaats door drukverschil maar door diffusie, wat een passief proces is. Diffusie tussen twee gebieden vindt plaats door moleculaire bewegingen en gebeurt in beide richtingen, waarbij moleculen als het ware ‘ontsnappen’. Bij een hogere partiële gasspanning zijn er meer moleculen en daardoor meer ‘ontsnappingen’.
Zuurstof zal door diffusie het alveolocapillaire membraan passeren en daarvoor eerst overgaan van de gasfase in de vloeistoffase. Dit gebeurt in overeenstemming met de wet van Henry die stelt dat de oplosbaarheid van een gas in een vloeistof direct evenredig is met de partiële gasdruk en een voor elk gas specifieke oplossingsconstante.
De diffusiesnelheid door de alveolocapillaire membraan volgt het principe van Fick:
Vgas = A × D × (P1 − P2) / T waarin Vgas is de hoeveelheid gas per tijdseenheid (ml/min).
A is het oppervlak van de membraan; D is de diffusieconstante; T is de dikte van de membraan; P1 is alveolaire partiële spanning en P2 is capillaire partiële spanning van de gassen die de membraan passeren.
De diffusieconstante van een gas is recht evenredig met de oplosbaarheid van een gas en omgekeerd evenredig met de vierkantswortel van het moleculaire gewicht:
D = oplosbaarheidscoefficiënt / √ moleculair gewicht (MW).
De oplosbaarheidscoëfficiënt van zuurstof is 0,00003 ml / ml H2O / mm Hg, voor CO2 is deze 0,0006 ml / ml H2O / mm Hg. Zo lost bij 100 mm Hg, de normale partiële gasspanning van O2 in arterieel bloed (de PO2), 0,3 ml O2 op in 100 ml bloed. Voor CO2 geldt dat in arterieel bloed de normale gasspanning van CO2 (PCO2) 40 mm Hg bedraagt, waarbij dan 2,4 ml CO2 is opgelost.
Het MW van O2 is 32 en van CO2 is dit 44. CO2 heeft een iets grotere dichtheid dan O2 en de diffusiesnelheid van O2 is iets groter (een factor 1,2) dan de diffusiesnelheid van CO2 in de gasfase. Bij de passage door de alveolocapillaire membraan is echter de oplosbaarheid van CO2 24 maal groter dan die van O2, zodat de totale diffusiesnelheid van CO2 ongeveer twintig maal groter is. Dit verklaart waarom ongeveer gelijke hoeveelheden O2 en CO2 de membraan in tegengestelde richting passeren ondanks het grote verschil in drukgradiënt die voor CO2 maar 5 mm Hg bedraagt en voor O2 64 mm Hg.
Afwijkingen in de membraanfunctie leiden eerder tot hypoxie dan tot CO2-retentie (hypercapnie) omdat CO2 zo veel beter oplost.
Het oppervlak dat zowel geventileerd als geperfundeerd wordt, ligt tussen de 50 en 100 m2. Ook onder normale omstandigheden zijn er verschillen in de perfusie van de longtoppen en de bases. Bij rustige inspiratie worden de alveoli in de longbases niet alleen beter geventileerd, maar ook beter doorstroomd. Er is sprake van een ongelijkmatige ventilatie-perfusieverhouding: VA/Qc, waarbij VA staat voor de alveolaire ventilatie en Qc voor de capillaire doorbloeding. Deze verhouding is dus ook onder normale omstandigheden niet overal gelijk: er zijn alveoli die wel geventileerd maar niet doorbloed worden en omgekeerd. Bij inspanning neemt het aantal alveoli dat doorbloed wordt toe. Het wordt minder bij shock en bij ‘positive end expiratory pressure’ (PEEP-)beademing.
Volgens de diffusiewet van Fick is de snelheid van het gastransport over de membraan heen bij constant blijven van de andere factoren, afhankelijk van de partiële drukken van de gassen aan weerszijden van de membraan.
Zuurstof moet oplossen in de surfactant, de alveolaire epitheelcellen, het interstitium en de capillairwand. Vervolgens moet het diffunderen door het plasma, waarna het de erytrocyt binnendringt en met hemoglobine een chemische reactie aangaat. Voor koolzuur is de gang van zaken precies omgekeerd (afb. 3.13).
In het geval van stikstof en lachgas zal het verschil tussen de partiële druk in de alveolaire lucht en in het longcapillaire bloed snel opgeheven zijn omdat het evenwicht meteen tot stand komt. Beide gassen passeren de membraan gemakkelijk en de partiële gasspanning van de gassen in de capillairen is snel gelijk aan die in de alveolaire lucht. In dit geval zal de hoeveelheid gas die getransporteerd wordt voornamelijk door de circulatie worden bepaald.
Volgens de hemoglobine-zuurstofdissociatiecurve (zie verder) stijgt de PO2 in de longcapillairen snel tot 100 mm Hg en bij verzadiging van het hemoglobine is de diffusiegradiënt dan verdwenen. De hoeveelheid zuurstof die wordt opgenomen is daarom mede bepaald door de stroomsnelheid van het bloed door de longcapillairen, want een vergroting van de transportcapaciteit kan alleen tot stand komen door meer erytrocyten te verzadigen. Het zuurstoftransport is perfusiebepaald (afb. 3.14).

Met koolstofmonoxide (CO) ligt dat totaal anders. Dit gas wordt gebruikt om te onderzoeken of er een stoornis in het alveolaire membraan is. De affiniteit van CO voor hemoglobine is meer dan 250 keer zo sterk als die van zuurstof. Deze is zo groot dat er bij inademing van CO nauwelijks een fractie CO in het plasma opgelost is omdat het meteen de erytrocyt in gaat. De stroomsnelheid van het bloed − het bloed blijft in rust maar 0,75 seconde in de longcapillairen − oefent op de getransporteerde hoeveelheid geen invloed uit. Het CO-transport is diffusiebepaald, dat wil zeggen: alleen de eigenschappen van de alveolocapillaire membraan zijn hierbij van belang (afb. 3.16).

De diffusiecapaciteit wordt Dlgas genoemd en uitgedrukt in ml/min/mm Hg. De formule is afgeleid van het principe van Fick:
DLgas = Vgas / (P1 − P2) of: DLgas = Vgas /ΔPgas.
Vgas is de snelheid van het gastransport, (P1 − P2) is de partiële drukgradiënt voor dat gas. Omdat er voor CO geen gasspanning in het bloed wordt opgebouwd, geldt voor CO:
DLCO = VCO / PA CO.
PA CO is de partiële gasspanning voor CO in alveolaire ruimte. De bepaling vindt gewoonlijk plaats een zogenoemde ‘1 teugmethode’ waarin de patiënt een mengsel van zuurstof en (een heel klein beetje) CO inademt. De overdracht van CO kan berekend worden uit het verschil in CO-concentratie tussen het geïnspireerde en uitgeademde CO nadat de proefpersoon de adem tien seconden heeft vastgehouden.
De bepaling is bij een aantal ziekten van belang, zoals pneumonie en longoedeem, waarbij er vocht in de alveoli is. Bij longembolie is het longcapillaire bed verkleind. Bij sarcoïdose en longfibrose zijn de interalveolaire septa aangetast en capillairen verwoest.
NB Een koolmonoxide-intoxicatie is buitengewoon gevaarlijk. Veel mensen die bij een brand in eerste instantie gered zijn overlijden later nog door het CO in hun bloed. De weefselanoxie door de verdringing van de zuurstof door CO uit het hemoglobine wordt nog versterkt door het feit dat de hemoglobine-zuurstof dissociatiecurve naar links verschuift. De zuurstof die aan dit type Hb gebonden is komt bij een daling van de PO2 van 100 naar 40 mm Hg nog maar voor de helft vrij. Als meer dan 20% van het hemoglobine aan CO is gebonden, is behandeling met hyperbare zuurstof (3 atm) aangewezen.
Het zuurstoftransport in het bloed
Onder normale omstandigheden en bij een temperatuur van 37 graden Celsius heeft arterieel bloed ongeveer een PO2 van 100 mm Hg (PaO2) en is daarin, in overeenstemming met de wet van Henry, 0,3 ml zuurstof per 100 ml bloed fysisch opgelost (0,3 volumeprocent). Omdat onder basale condities circa 250 ml zuurstof per minuut nodig is, is de op deze wijze getransporteerde hoeveelheid volstrekt onvoldoende: er is dan 3 ml zuurstof per liter bloed beschikbaar en er zou dan in rust 83,3 liter bloed per minuut door de weefsels moeten stromen. De normale cardiac output is in rust 5 liter per minuut en bij inspanning een veelvoud hiervan.
Dankzij het hemoglobine kan echter een veel grotere hoeveelheid zuurstof in het bloed getransporteerd worden. Hemoglobine (Hb) is een ingewikkeld molecuul met een moleculair gewicht van 64.500, dat bestaat uit een viertal ruimtelijk geordende ketens, die elk weer met een zogenoemde haemgroep verbonden zijn. Elke haemgroep heeft een ijzeratoom in het centrum. Het atoom heeft één bindplaats over voor zuurstof (of CO) en aangezien er vier haemgroepen zijn, kan elk molecuul Hb vier zuurstofmoleculen binden:
Hb + 4 O2 → Hb(O2)4
Deze binding is omkeerbaar: er treedt binding met de zuurstof op in het capillaire bed van de longen, de zuurstof wordt vastgehouden tijdens het transport door de circulatie en wordt weer losgelaten in de weefsels met een lage zuurstofspanning. Bij volledige saturatie (verzadiging, SaO2) bevat bloed bijna 20 volumeprocent zuurstof. In minder dan 1/100 seconde is de helft van het Hb verzadigd als het aan zuurstofrijke lucht wordt blootgesteld. Omdat de transportcapaciteit van bloed voor zuurstof niet alleen door de saturatie, de SaO2, maar ook door het Hb-gehalte wordt bepaald, is voor de zuurstoftransportcapaciteit de term CaO2 ingevoerd.
De transportcapaciteit van Hb is 1,34 ml zuurstof per gram Hb. Bij een normaal Hb van 15 gr% (10 mmol/l) is deze capaciteit dus ongeveer 20 ml O2 per 100 ml bloed (20 vol%). Theoretisch moet daarbij het fysisch opgeloste zuurstof nog worden opgeteld, te weten 0,3 ml O2 per 100 ml bloed. Het veneuze bloed dat in de longcapillairen komt heeft een PO2 van 40 mm Hg en is dan voor 75% verzadigd. Het fysisch opgeloste zuurstof buiten beschouwing latend (wegens de geringe hoeveelheid), kan de volgende berekening gemaakt worden: transportcapaciteit O2 (CaO2): 20 ml O2 per 100 ml bloed.
Bij een verzadiging van 75%, dus bij een PO2 van 40 mm Hg, is de transportcapaciteit 75/100 × 20 ml O2 per 100 ml bloed. De zuurstofdragende capaciteit van veneus bloed heet CvO2. De CvO2 = 15 ml O2 per 100 ml bloed. In de longcapillairen komt het bloed in evenwicht met de alveolaire PO2 van 100 mm Hg waarbij het bloed voor 97% verzadigd is: 97/100 20 ml O2 = 19,4 ml O2 per 100 ml bloed. Dit is dus de zuurstof die nu aan het Hb gebonden is.
Na passage door de longen is het bloed dus met 19,4 − 15 = 4,4 ml O2 per 100 ml bloed verrijkt, waarbij het fysisch opgeloste zuurstof niet is mee berekend. De laatste factor is wel van belang bij toediening van 100% zuurstof. Verhoging van de alveolaire PO2 tot boven de 100 mm Hg doet de transportcapaciteit niet toenemen omdat de verzadiging bij 100 mm Hg al praktisch volledig is.
In de weefsels is de PO2 veel lager en het oxyhemoglobine zal de zuurstof loslaten. Volgens de curve is het traject tussen 40 en 20 mm Hg zeer steil en de hoeveelheid zuurstof die vrijkomt tamelijk veel: bij PO2 van 40 mm Hg is de saturatie 75% en is het O2-gehalte 15 ml per 100 ml bloed. Bij een PO2 van 20 mm Hg is de saturatie 34% wat neerkomt op 34/100 × 20 = 6,8 ml O2 per 100 ml bloed. Wanneer door weefselanoxie de PO2 van 40 naar 20 mm Hg is gedaald, kan er nog 8,2 ml O2 per 100 ml bloed afgestaan worden, namelijk 15 − 6,8 = 8,2 ml O2 per 100 ml bloed. Een lichte daling van de PO2 maakt nog veel zuurstof vrij. Alleen de coronaircirculatie maakt van deze grote reservecapaciteit onder normale omstandigheden gebruik (afb. 3.16).
Het 2,3-difosfoglyceraat (2,3-DPG) wordt in de erytrocyten gemaakt en bindt zich aan het hemoglobine. Het voorkomt een verhoging van de affiniteit van Hb voor zuurstof waardoor de overdracht van zuurstof aan de perifere weefsels niet gestoord wordt. Dit is een probleem bij transfusiebloed, waarin 2,3-DPG laag is.
Als meer dan 5 gr Hb per 100 ml arterieël bloed in gereduceerde staat is, dat wil zeggen geen zuurstof bevat, treedt cyanose op. Dit is een blauw-paarse verkleuring van lippen, huid en nagelbed. Dit kan zowel door hypoxie als door stoornissen in de bloeddoorstroming veroorzaakt worden. Cyanose wordt gewoonlijk pas manifest bij een PO2 van 50 mm Hg. Bij anemie, waarbij het absolute Hb-gehalte verminderd is, kan dit dan niet manifest worden. Bij patiënten met ‘te veel bloed’, zoals polycythemie, komt cyanose vaak voor terwijl de PO2 normaal is. Een CO-vergiftiging veroorzaakt geen cyanose omdat CO-hemoglobine dezelfde kleur heeft als oxyhemoglobine. Het bijtijds herkennen van cyanose moet geleerd worden.
Wanneer bij verminderde doorbloeding de PO2 daalt tot 20 mm Hg, kan de saturatie tot 25% dalen en daarbij nog 10 ml O2 afstaan.
Bij een patiënt met anemie is de CaO2 ondanks een goede saturatie verminderd. Het ademhalingscentrum reageert niet op veranderingen in de PO2, dat is de taak van de perifere chemoreceptoren. Deze zijn alleen gevoelig voor daling van de PO2 en niet voor de CaO2. Dit wordt verder besproken bij de regulatie van de ademhaling. Een ventilatoire respons kan bij anemie uitblijven.
NB 15 g% Hb = 10 mmol Hb/l. De meeste laboratoriumwaarden worden in mmol/l uitgedrukt.
Het CO2-transport in het bloed
Van de CO2 is 5 tot 10% fysisch opgelost in water. De oplossingsconstante voor CO2 in water is 0,0006 ml/mm Hg. Dit betekent:
Bij pCO2 40 mm Hg in 100 ml bloed: 2,4 ml (40 × 100 × 0,0006)
Bij pCO2 45 mm Hg in 100 ml bloed: 2,7 ml (45 × 100 × 0,0006)
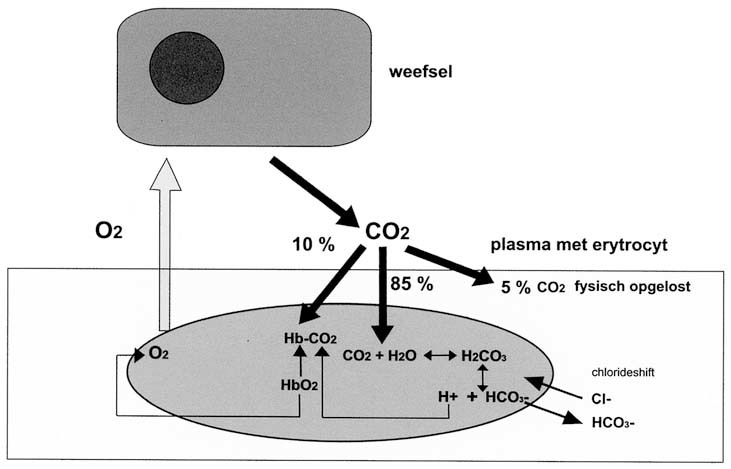
Deze hoeveelheden hebben dus alleen betrekking op het fysisch opgeloste CO2. Het totale CO2-gehalte van veneus en arterieel bloed bedraagt respectievelijk 52,5 en 48 ml CO2/100 ml bloed dat zich daar in drie vormen bevindt:
fysisch opgelost (iets meer dan 5%);
80 a 90% in de vorm van bicarbonaat;
5 tot 10% gebonden aan hemoglobine en plasma-eiwitten.
In rust wordt ongeveer 250 ml CO2 door het weefselmetabolisme geproduceerd en dat moet door het bloed naar de longen worden getransporteerd. Het fysisch opgeloste CO2 dringt in de perifere weefsels de erytrocyt binnen. Erytrocyten bevatten het enzym carboanhydrase dat H2CO3 vormt uit CO2 en water. Dit enzym versnelt de reactie, die anders zeer traag zou zijn, met een factor duizend.
Het H2CO3 splitst zich in H+ en HCO3 - volgens:
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3 -.
Het betreft hier een chemisch evenwicht dat hetzij naar links, hetzij naar rechts verloopt afhankelijk van het verdwijnen van één de componenten uit het evenwicht. Dit is het bohr-haldane-effect: in de weefsels met een hoge pCO2 en een lage PO2 diffundeert de CO2 de erytrocyt in en wordt deels omgezet in bicarbonaat terwijl de H+-ionen zich aan het Hb binden (afb. 3.17). Daardoor vermindert de affiniteit voor zuurstof dat wordt losgelaten. In de longen gebeurt het omgekeerde: hier combineert zuurstof zich met Hb waardoor het H+ wordt losgelaten, dat met HCO3 - in verbinding gaat. Daarbij wordt H2CO3 gevormd dat als CO2 via de longen het lichaam verlaat.
De formule kan dan ook zo geschreven worden:
H Hb + O2 ↔ H+ + HbO2.
In de weefsels verloopt de reactie naar links en in de longen naar rechts, omdat in de weefsels de PO2 laag is en de pCO2 hoog, terwijl in de longen het omgekeerde het geval is.
De alveolaire ventilatie en de pCO2
Inspiratielucht bevat praktisch geen CO2. De lucht in de alveoli bevat CO2 die over het alveolocapillaire membraan is gediffundeerd door de drukgradiënt die bestaat tussen de veneuze pCO2 (PVCO2) en de alveolaire pCO2 (PACO2).
De hoeveelheid lucht die de alveoli per minuut bereikt en deelneemt aan de gaswisseling is:
VA = VE − VD, waarin VA is de alveolaire ventilatie en VD is de doderuimteventilatie (VE is het ademminuutvolume).
De hoeveelheid CO2 die per minuut door de longen wordt uitgescheiden is geheel afkomstig uit de alveoli en kan VCO2 worden genoemd (dit is ook de hoeveelheid die in een minuut wordt geproduceerd door het lichaam). Deze maakt dus een fractie uit van het totale gasmengsel (VA) in de alveoli: FACO2, dus: VCO2 = VA × FACO2 waaruit bij herschikking volgt: FACO2 = VCO2 / VA.
Omdat de partiële gasspanning van een gasmengsel gelijk is aan de fractie van de totale druk in dit mensel (wet van Dalton) geldt:
alveolaire pCO2 (PACO2) = (PB − PH2O) × FACO2.
PB − PH2O is de druk van de buitenlucht die verdund is met waterdamp, dus: 760 – 47 = 713 mm Hg (inspiratielucht). Omdat PB − PH2O min of meer constant is geldt:
PACO2 ∞ VCO2 / VA.
Dit betekent dat de PACO2 zal verdubbelen als hetzij de productie toeneemt bij gelijkblijvende ventilatie, bijvoorbeeld bij inspanning, hetzij de ventilatie afneemt bij gelijkblijvende productie. Dit is een belangrijke formule.
Omdat CO2 zeer goed diffundeert kan de PACO2 gelijk worden gesteld aan de PaCO2, de arteriële CO2-spanning. Dit is niet helemaal juist omdat een kleine fractie (3%) van de cardiac output vanuit de pulmonale arteriën direct ‘geshunt’ wordt naar de grote circulatie. Voor een groot deel gebeurt dit ook door passage van het bloed door wel geperfundeerde maar niet geventileerde alveoli.
Als inspiratielucht in de alveoli komt is het een mengsel van O2, N2 en waterdamp. Stikstof en waterdamp nemen niet aan de gaswisseling deel. De totale alveolaire druk is gelijk aan de druk van de inspiratielucht. Dit betekent dat de daling van de partiële gasspanning van zuurstof van 149 naar 104 Hg gelijke tred houdt met de stijging van de partiële CO2-spanning in de alveoli. In formule: PAO2 = PIO2 − PACO2.
De opgenomen O2 en de afgegeven CO2 zijn echter alleen aan elkaar gelijk bij verbranding van koolhydraten waarbij het ademhalingsquotient (RQ) 1 is. Gemiddeld, bij een normaal dieet, is het echter 0,8.
Er wordt meer zuurstof aan de longcirculatie toegevoegd dan dat daaruit CO2 wordt verwijderd. In rust respectievelijk 250 ml O2 en 200 ml CO2.
De alveolaire gasvergelijking geeft dit in een formule weer, waarbij voor het RQ wordt gecorrigeerd:
PAO2 = PIO2 − PACO2 / R waarbij PIO2 de partiële gasspanning van de O2 in de inspiratielucht is en PACO2 de partiële spanning van de alveolaire CO2 is.
Bijvoorbeeld: iemand met een RQ van 0,8 heeft een PACO2 van 40 mm Hg en een PAO2 van 104 mm Hg bij een barometer van 760 mm Hg. Door te hijgen verdubbelt hij zijn alveolaire ventilatie. Wat zijn dan de nieuwe waarden?
PACO2 ∞ VCO2 / VA. Als VA verdubbeld is wordt de PACO2 gehalveerd: PACO2 = 20 mm Hg.
PAO2 = PIO2 − PACO2 / R. De partiële spanning van waterdamp is 47 mm Hg: PIO2 = 0,21 × (760 − 47) = 149 mm Hg. PAO2 = 149 − 20 / 0,8 = 124 mm Hg.
Deze formule is van groot belang omdat van de PACO2 wordt aangenomen dat die gelijk is aan de PaCO2. Dat is vaak, maar niet altijd juist. De PAO2 kan van de PaO2 echter belangrijk verschillen, wat in de P(A-a)-gradiënt tot uitdrukking komt. Deze kan bij de later te bespreken mismatchproblemen flink verhoogd zijn.
De fysiologische dode ruimte
De fysiologische dode ruimte bestaat uit de anatomische dode ruimte en de alveolaire dode ruimte . De laatste betreft lucht die in niet-geperfundeerde alveoli is gekomen en daardoor verloren is gegaan voor de ademhaling. Bij gezonde mensen is deze ruimte gering, maar bij tal van ziekteprocessen kan de alveolaire dode ruimte belangrijk toenemen, zoals bij een verlaagde cardiac output.
De omvang van deze ruimte kan berekend worden met de vergelijking van Bohr . Het uitgangspunt is het principe dat alle CO2 in de expiratielucht afkomstig moet zijn uit alveoli die zowel geventileerd als geperfundeerd zijn. Expiratielucht uit de anatomische en alveolaire dode ruimte wordt weer onveranderd uitgeademd in de samenstelling die deze had bij inademing. De berekening is tamelijk ingewikkeld en wordt hier verder niet besproken.
3.1.4 De longperfusie
Omdat de longcirculatie en de systemische circulatie in serie geschakeld zijn in een gesloten systeem, is de hoeveelheid bloed die door de longen wordt gepompt gelijk aan de cardiac output (hartminuutvolume); circa vijf liter per minuut. De longen bevatten bijna een halve liter bloed, waarvan zich ongeveer 100 ml bevindt in de longcapillairen. In rust stroomt het bloed in ongeveer vijf seconden door de longen onder basale condities, het verblijf in de capillairen duurt 0,75 seconde.
Vergeleken met de grote circulatie zijn de bloedvaten in het longvaatstelsel dunwandig met weinig glad spierweefsel en er zijn geen arteriolen. Daardoor zijn ze comprimeerbaar en uitrekbaar. De druk in de longcirculatie is dan ook veel lager dan in de grote circulatie en de rechterkamer hoeft veel minder werk te doen dan de linker. De wand van de rechterkamer kan daarom veel dunner zijn.
De hoge druk in de aorta garandeert dat in het hele lichaam voldoende druk aanwezig is om aan de talrijke en variërende eisen van de organen onder wisselende omstandigheden te kunnen voldoen. In de longen heeft de circulatie maar één taak, namelijk de alveoli met bloed te doorstromen.
De pulmonaire vaatweerstand is slechts een fractie van de systemische perifere vaatweerstand. De wet van Ohm, eigenlijk in dit geval wet van Poiseuille, geldt ook voor de circulatie:
V = I × R → R = V / I.
De stroom I kan vergeleken worden met de stroom in de circulatie. Deze is voor grote en kleine circulatie gelijk. V (het potentiaalverschil) is echter in de grote circulatie circa 100 mm Hg en in de kleine circulatie maar circa 10 mm Hg, zodat de vaatweerstand (R) in de longen een factor tien kleiner is.
De geringe pulmonaire vaatweerstand heeft een tweetal aspecten:
onder normale omstandigheden neemt bij inspanning het hartminuutvolume (cardiac output) aanzienlijk toe zonder dat de bloeddruk in de longslagaders belangrijk stijgt. De pulmonaire vaatweerstand daalt sterk. Deze daling is een gevolg van recruitment. Tevoren niet- of ondergeperfundeerde capillairen worden bij inspanning ‘gerekruteerd’ en ingeschakeld bij de gaswisseling. Het totale oppervlak beschikbaar voor gaswisseling wordt groter en de diffusiecapaciteit (DLgas) neemt hierbij dan ook toe. In het hooggebergte is dit na acclimatisering ook het geval;
gelet op de anatomische verhoudingen is het begrijpelijk dat de uiterst fijne interalveolaire capillaire netwerkjes worden dichtgedrukt als de alveoli uitzetten tijdens inademing. Daartegenover staat dat de grotere arteriën en venen onder invloed van de intrapleurale druk bij inspiratie uitzetten en bij expiratie vernauwen. Het netto-effect is onder fysiologische omstandigheden nihil, maar bij ‘positive end expiratory pressure’-beademing kan de perifere longvaatweerstand belangrijk toenemen doordat de intrapleurale en intra-alveolaire druk steeds positief zijn en de longvaten gecomprimeerd worden. De cardiac output kan hierdoor in het gedrang komen.
Pulmonaire vasoconstrictie en pulmonale hypertensie
Alveolaire hypoxie kan lokaal of in de hele long optreden. Lokaal is dat het geval bij obstructie in een luchtweg met atelectase; in de hele long bij alveolaire hypoventilatie of op grote hoogte. De hypoxie werkt direct op de gladde spiervezels van de longvaatjes wat tot contractie aanleiding geeft. Bij gelokaliseerde hypoxie stroomt veneus bloed naar een gebied waar geen gaswisseling is; het bloed ondergaat dus geen oxygenatie. In het linker atrium aangekomen mengt dit veneuze bloed zich met geoxygeneerd bloed waardoor een daling van de gemiddelde PO2 en een stijging van de gemiddelde pCO2 ontstaat. Door lokaal, dus in het hypoxische gebied, de vaatweerstand te verhogen, wordt het veneuze bloed naar wel-geventileerde gebieden gestuurd. Verhoging van de pulmonale bloeddruk zal bij algemene hypoxie een aantal eerder niet-geperfundeerde capillairen ‘rekruteren’ en zo de oxygenatie verbeteren. Bij hypercapnie is dat eveneens het geval.
De ventilatie-perfusieverhouding
In rust is de alveolaire ventilatie ongeveer even groot als de cardiac output, namelijk beide vier tot zes liter per minuut. De opname van O2 en de eliminatie van CO2 voltrekken zich alleen goed als de ventilatie en de perfusie op capillair niveau op elkaar zijn afgestemd. Genoemde processen vinden bijvoorbeeld niet plaats als al het bloed naar de ene long en al de lucht naar de andere long gaat.
De verhouding tussen de alveolaire ventilatie en perfusie wordt de VA/Qc genoemd (afb. 3.18).

Een lichte ongelijkmatige ventilatie-perfusieverhouding is ook bij gezonde mensen aanwezig. Idealiter is deze in rust 0,8. Een gestoorde mismatch is de meest voorkomende oorzaak van hypoxie in de kliniek. Bijna alle longziekten gaan gepaard met een aantoonbaar gestoorde ventilatie-persfusieverhouding. Bij een mismatch van enige omvang moet de PO2 in het arteriële bloed dalen. De pCO2 stijgt, maar kan niet stijgen boven de veneuze pCO2. Op de hypoxie wordt gereageerd met redistributie van bloed naar de goedgeventileerde longgedeelten. Daardoor zal de VA/Qc-verhouding daar toenemen en wordt het teveel aan CO2 geëlimineerd door een stijging van de drukgradiënt. In deze gebieden kan, door de S-vorm van de hemoglobine-zuurstofdissociatiecurve, echter niet méér zuurstof worden opgenomen. In deze situaties is hypercapnie dan ook zeldzaam, maar is hypoxie een probleem.
Ongelijkmatige ventilatie heeft in het algemeen twee oorzaken, namelijk luchtwegobstructie en ongelijke compliance in verschillende longregio’s.
Een gestoorde ventilatie-perfusieverhouding (VA/Qc-mismatch , de verhouding tussen de alveolaire ventilatie en de capillaire doorstroming) omvat een heel spectrum dat alveoli omvat die wel geventileerd maar niet doorbloed worden, en alveoli die wel doorbloed maar niet geventileerd worden. In het eerste geval is er sprake van doderuimteventilatie, in het tweede geval hebben we met een echte shunt te maken: het bloed komt in de systemische circulatie terecht zonder dat het aan gaswisseling heeft deelgenomen.
Klinisch is het van groot belang om te weten aan welke kant van het spectrum de VA/Qc-mismatch zich bevindt. Ligt het accent op de gestoorde ventilatie (VA/Qc gedaald) of is deze oneindig groot (VA/Qc ∞)? In beide gevallen treedt een daling van de PaO2 op. In het eerste geval worden alveoli slecht geventileerd, in het tweede geval is er overwegend een shunt van rechts naar links, waardoor het geoxygeneerde bloed vermengd wordt met veneus bloed, waarbij de saturatie daalt. Door de vorm van de zuurstofdissociatiecurve komt de PO2 in het steile gedeelte en ontstaat er hypoxie.
Een deel van de veneuze systemische circulatie komt normaliter terecht in het linkerhart, circa 2 tot 5%, zoals via de bronchiale venen. Daarnaast zijn er, behalve deze anatomische shunts, ook ‘shuntachtige toestanden’ omdat er ook alveoli zijn met een slechte VA/Qc. De shuntfractie kan berekend worden, maar is eenvoudiger te bepalen uit de P(A-a)-gradiënt. Men gebruikt hiervoor de alveolaire gasvergelijking.
Het alveolair-arteriële PO2-verschil
Onder fysiologische omstandigheden is er slechts een gering A-a PO2-verschil omdat de normale mismatch slechts 0,8 bedraagt.
Bijvoorbeeld: alveolaire ventilatie 6 liter per minuut, cardiac output 4,8 liter/minuut. De normale P(A-a)O2 = < 10 mm Hg. Nogmaals de alveolaire gasvergelijking:
PAO2 = PIO2 − PACO2 / 0,8.
PaO2 en PaCO2 zijn bekend uit de bloedgasanalyse. PACO2 is gelijk aan de PaCO2 (er is geen A-a verschil voor CO2).
Casus
Een jonge vrouw komt met hyperventilatie op de afdeling Spoedeisende Hulp en een bloedgasanalyse geeft de volgende waarden:
PaO2 = 83 mm Hg en PaCO2 = 31 mm Hg.
Dan geldt: PAO2 = PIO2 − PaCO2 / 0,8 = 0,21 × 713 − 31 / 0,8 = 149 − 39 = 110 mm Hg.
PAO2 − PaO2 = 110 − 83 = 27 mm Hg.
P(A-a)O2 = 27 mm Hg (normaal < 10 mm Hg).
Deze patiënt hyperventileert niet zomaar, waarschijnlijk is er een longembolie in het spel.
Het verschil tussen een ventilatie-perfusiemismatch en een belangrijke shunt kan vastgesteld worden door de patiënt 100% zuurstof toe te dienen. Als na enige tijd alle stikstof is verdwenen raakt de PaO2 in evenwicht met de PAO2 (circa 600 mm Hg) en zal de PaO2 stijgen. Bij een aanzienlijke shunt gebeurt dat niet.
Capnografie
Deze techniek berust op de absorptie door CO2 van bepaalde golflengten in het infrarode spectrum. De concentratie van CO2 in de uitademingslucht kan zo worden gemeten. De alveolaire concentratie van CO2 wordt bepaald door de VA/Qc-verhouding.
Aan het einde van een inspiratie zijn de luchtwegen gevuld met CO2-vrije lucht (de anatomische dode ruimte). Als de patiënt weer uitademt zal een CO2-sensor, bijvoorbeeld in de mond, in het begin geen CO2 detecteren. Bij voortzetten van de uitademing stijgt het CO2-gehalte en bereikt het een plateau als de alveolaire lucht de sensor bereikt. De concentratie zakt weer snel tot nul als de inademing begint (afb. 3.19).

Het plateau toont normaliter een geringe stijging wat wijst op een lichte toename van de CO2-concentratie in de alveolaire lucht doordat de VA/Qc-verhouding ook onder normale omstandigheden wisselt. Fase 3 eindigt bij de het begin van de inspiratie en de top wordt PET CO2 genoemd: de eindtidale pCO2.
De PET CO2 is onder fysiologische omstandigheden een goede maatstaf voor de PaCO2. Bij een aanzienlijke toename van de alveolaire dode ruimte kan de PET CO2 echter lager zijn als gevolg van de menging van de alveolaire lucht afkomstig uit wel- en niet-geventileerde alveoli. Het plateau loopt ook schuin omhoog door de ongelijkmatige ventilatie-perfusieverhouding, waardoor de hoek α groter wordt. Het gebied onder het capnogram, de area under curve, is een maatstaf voor de effectieve alveolaire ventilatie-perfusieverhouding. Het gebied tussen het plateau en de gebroken lijn die de PaCO2 aangeeft, is een aanwijzing voor de omvang van de alveolaire dode ruimte.
In de anesthesie wordt de capnograaf veel gebruikt, onder meer ter controle van de juiste plaatsing van de endotracheale tube. Ook een daling van de cardiac output en bronchospasmus worden direct gesignaleerd, evenals het effect van spierverslappers.
3.2 De regeling van de ademhaling
De steeds wisselende eisen die onder allerlei omstandigheden, zoals inspanning, aan de ademhaling worden gesteld maken de aanwezigheid van een integrerend systeem dat informatie uit het lichaam ontvangt en verwerkt onmisbaar. De belangrijkste taak van dit respiratoire controlesysteem is het handhaven van de homeostase van O2, CO2 en de pH. Het systeem kan gezien worden als een cybernetisch (terugkoppeling) principe dat impulsen uit het lichaam ontvangt en daarop reageert. Het is een cyclisch proces, dat door allerlei processen verandert, versterkt en onderdrukt kan worden.
De ademhaling is dus een spontaan en automatisch proces, dat door de activiteit van de hogere hersencentra gemodificeerd kan worden. Ademen vindt vooral automatisch plaats, maar kan ook bewust geregeld worden. Gezonde mensen kunnen rustig gaan slapen en hoeven niet bang te zijn dat ze vergeten te ademen. Ook spreken, dat deels via de ademhaling plaatsvindt, is een proces waarbij men niet aan ademhalen hoeft te denken.
De ademhalingsspieren, namelijk de intercostaalspieren, de buikspieren, de mm. scaleni en de mm. serrati worden geïnnerveerd door zenuwtakken vanuit de motorische voorhoorncellen in het cervicale en thoracale deel van het ruggenmerg. Het diafragma ontvangt zijn prikkels van de n. frenicus waarvan de voorhoorncellen zich in het ruggenmerg van de halswervels bevinden (C3 tot C5).
Een overzicht van de afkortingen die in de (patho)fysiologie worden gebruikt:
PAO2 = alveolaire O2-spanning in mm Hg
PaO2 = arteriële O2-spanning in mm Hg
PACO2 = alveolaire CO2-spanning in mm Hg
PaCO2 = arteriële CO2-spanning in mm Hg
PvO2 = veneuze O2-spanning in mm Hg
PvCO2 = veneuze CO2-spanning in mm Hg
SaO2 = saturatie in %
CaO2 = transportcapaciteit in ml O2/ml bloed
In de medulla oblongata (het verlengde merg) ligt de formatio reticularis, waarin zich groepen neuronen bevinden die met elkaar een netwerk vormen waarin de prikkels voor de ademhaling worden gegenereerd. Dit wordt het ademcentrum genoemd. Hiervandaan loopt in het ruggenmerg de tractus reticulospinalis naar bovengenoemde motorische voorhoorncellen.
Een bewuste ademinspanning vindt plaats buiten het verlengde merg om: de prikkels van de hersenschors gaan dan direct naar de motorische voorhoorncellen in het ruggenmerg. Het automatisme kan door een bewuste inspanning voor enige tijd volledig onderdrukt worden, zoals bij parelduiken, totdat de prikkels van hoge pCO2, lage PO2 en lage pH de overhand krijgen en de ademhaling weer begint. Het grootste deel van de tijd is het ademen onbewust en is het feedbackmechanisme continu operationeel.
In het ademhalingscentrum wordt de input van sensorsystemen geïntegreerd en verwerkt en ontstaan de effectorprikkels die uiteindelijk via het ruggenmerg en de innerverende zenuwen de ademhalingsspieren tot activiteit brengen. Het ademhalingscentrum staat echter ook onder invloed van hogere centra in de hersenen zoals de thalamus, het limbische systeem en de pons.
3.2.1 Het ademhalingscentrum
In het ademhalingscentrum bevinden zich een tweetal bilaterale verzamelingen van neuronen, respectievelijk aan de dorsale en de ventrale kant gelegen. Deze verzamelingen heten de dorsale respiratoire groep (DRG) en de ventrale respiratoire groep (VRG) .
In de DRG wordt vermoedelijk het ritme gegenereerd tijdens ademen in rust. Tijdens een rustige inspiratie van het tidale volume vuren de neuronen in deze groep prikkels af en vallen dan stil tijdens een passieve expiratie. De DRG bevat dus voornamelijk inspiratoire neuronen.
De centrale chemoreceptoren liggen vlak bij de neuronen van de inspiratoire cellen in de DRG. De afferente (aanvoerende) zenuwvezels van de n. glossofaryngeus en de n. vagus uit de sinus caroticus en de aortaboog komen hier ook uit met informatie van chemoreceptoren betreffende PO2, pCO2 en pH. Informatie komt eveneens van de baroreceptoren en de rekkingreceptoren in de longen (afb. 3.20 en 3.21).
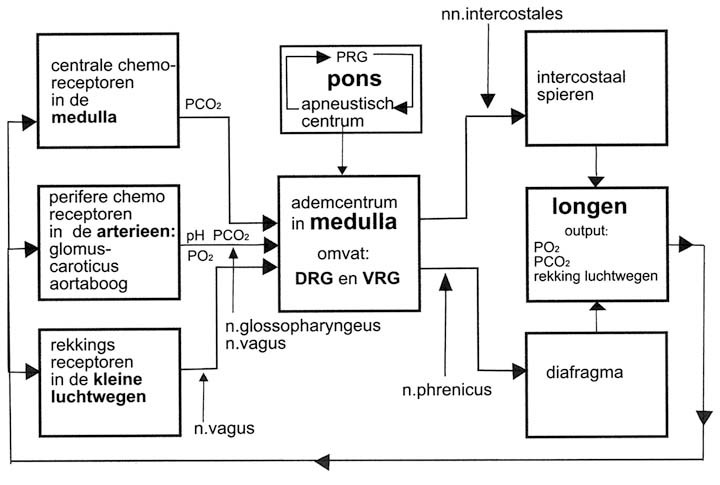

Er zijn drie groepen sensoren die de input leveren: de centrale chemosensoren , de perifere chemosensoren en de de pulmonale rekkingreceptoren.
De centrale chemosensoren
In de medulla oblongata bevinden zich ventrolaterale chemosensoren die in nauw contact staan met de liquor cerebrospinalis. De pCO2 van de liquor is in evenwicht met de PaCO2. Omdat H+ en HCO3 - geladen deeltjes zijn, kunnen zij de bloed-liquorbarrière niet passeren. CO2 kan dit echter wel en verbindt zich met water tot H2CO3 dat zich deels splitst in H+- en HCO3 --ionen. De liquor heeft slechts een geringe bufferfunctie (alleen bicarbonaat) door het ontbreken van eiwitten, zodat de verandering in de pCO2 direct in de pH tot uitdrukking komt. De pH stimuleert de effectorcellen in het ademcentrum. De ventilatoire reactie is lineair, zoals het verband tussen alveolaire ventilatie en productie ook aangeeft:
PACO2 ∞ VCO2 / VA.
Deze sensoren zijn niet gevoelig voor veranderingen in de PO2. Dit circuit reageert dus alleen op veranderingen in de PaCO2 en neemt 70 tot 80% van de onbewuste ventilatoire controle voor zijn rekening. Een stijging van de PaCO2 doet de ademfrequentie toenemen.
De perifere chemosensoren
De perifere chemosensoren zijn kleine organen gelegen op de bifurcatie van de aa. carotides en heten glomus caroticum. De bloedstroom door de glomera is zeer hoog en zij zijn daarmee gevoelig voor veranderingen in de PO2. Andere lichaampjes liggen in de aortaboog: glomera aortica. Deze sensoren zijn iets minder gevoelig.
De sensoren reageren op de pH, de PaCO2 en de PO2, de prikkels worden overgebracht naar de medulla via de n. vagus en de n. glossofaryngeus. Dit zijn de enige sensoren die reageren op veranderingen in de PaO2 en de pH.
De pulmonale rekkingreceptoren
Deze zijn gelegen in het gladde spierweefsel van de luchtwegen:
de Hering-Breuer-inflatiereflex reageert op rekking door overmatige inspiratie met bronchodilatatie, vertraging van de respiratie en uiteindelijk apneu. Overrekking van de alveoli wordt daarmee voorkomen;
de Hering-Breuer-deflatiereflex is een reactie op sterk verminderde rekking van de receptoren en het effect is hyperventilatie. Mogelijk is deze reflex verantwoordelijk voor de diepe zuchten die af en toe bij een normale ademhaling optreden en misschien zijn deze reflexen ook van belang bij het optreden van de hyperventilatie in aansluiting op een pneumothorax;
reflexen uit de longcirculatie. De sensors hiervan zijn gelegen in de wand van longcapillairen en worden geprikkeld door longembolie, longstuwing of oedeem. Het effect is een snelle oppervlakkige ademhaling (tachy-hypopneu).
3.2.2 Het effect van veranderingen in de pCO2
Ook bij zware inspanning verandert, onder normale omstandigheden, de PaCO2 minder dan 1 mm Hg. Er is een lineair verband tussen de alveolaire PaCO2 en de ventilatie in het gebied tussen 35 en 50 mm Hg, daarboven neemt de ventilatoire respons af.
Bij hypoxie wordt de respons versterkt: de curve gaat naar links en wordt steiler. Dit geldt eveneens voor metabole acidose.
De perifere en de centrale chemoreceptoren dragen elk bij aan ventilatierespons op een verhoging van de PaCO2, waarbij de perifere receptoren vooral op acute veranderingen reageren en de centrale meer op termijn, dus op een steady-state-hypercapnie. De rol van de centrale receptoren is echter overheersend in de respons op CO2-stijging.
Tijdens de slaap is er een enigszins vertraagde respons van de ventilatie op de PaCO2, die dan licht verhoogd is. Bij sommige mensen kan tijdens de slaap apnoe optreden doordat de CO2-prikkel dan onvoldoende is om de normale ventilatoire respons te bewerkstelligen. De ademhaling wordt dan pas weer hervat als de PaCO2 flink gestegen is. De wiegendood wordt wel met dit fenomeen in verband gebracht: bij een aantal baby’s blijken dan de carotislichaampjes slecht ontwikkeld te zijn.
Deze centrale apnoe dient onderscheiden te worden van de obstructieve apnoe, waarbij de tonus van de spieren rond de keelholte tijdens de slaap zodanig afneemt, dat obstructie van de luchtwegen ontstaat. Dit manifesteert zich als zwaar snurken, waarna de patiënt wakker wordt. Het beeld wordt gekenmerkt door snurken, ontwaken, slaaptekort en sufheid overdag. Deze verschijnselen vormen samen het pickwicksyndroom, naar de bekende dikke Joe uit de Pickwickpapers van Charles Dickens. Het komt echter ook bij volwassenen voor die aan vetzucht lijden.
Slaapmiddelen, opiaten en anesthetica kunnen de ventilatoire respons sterk verlagen. Overdosering met opiaten is een bekend overlijdensrisico voor drugsverslaafden, de zogenoemde ‘drug overdose’ (DOD) (afb. 3.22).

De combinatie van opiaten met benzodiazepines is niet ongevaarlijk. Ademdepressie kan het gevolg zijn. Dit wordt op de verkoeverkamer nog wel eens gezien en het fenomeen vraagt om extra waakzaamheid.
Zeer hoge PaCO2-spiegels (> 70 mm Hg) kunnen ademdepressie veroorzaken door het ongevoelig worden van het ademcentrum: bewustzijnsdaling, krampen en convulsies komen hierbij voor. Hoofdpijn is een belangrijke klacht bij chronische hypercapnie, door de vaatverwijdende werking van CO2.
3.2.3 Het effect van veranderingen in de PO2
De ventilatoire respons op hypoxie is een taak van de perifere chemoreceptoren, de centrale receptoren spelen hierin geen rol. Voor wat de PaO2 betreft lijkt de responscurve van de glomus caroticum ongeveer op de Hb-dissociatiecurve. Er is slechts een bescheiden reactie op een daling van de PaO2 tussen 100 en 60 mm Hg. Daaronder wordt de curve veel steiler zodat de ventilatie pas aanzienlijk toeneemt wanneer de PaO2 tot beneden de 60 mm Hg gedaald is. De ventilatieprikkel is maximaal bij een aanzienlijke PaCO2-stijging en een PaO2-daling.
Bij afwezigheid van de perifere chemoreceptoren heeft hypoxie ademdepressie tot gevolg. De respons wordt bepaald door de PO2 en niet door de saturatie, omdat de bloeddoorstroming van de glomera zo hoog is. Dit betekent dat in gevallen van anemie een ventilatierespons kan uitblijven.
3.2.4 Het effect van veranderingen in de pH
De ventilatierespons van metabole acidose is direct afkomstig van de perifere chemoreceptoren en toont een lineair verband met de daling van de pH. Omdat noch H+, noch HCO3 - de bloed-liquorbarrière snel passeren duurt het lang voordat de pH in de liquor bij metabole acidose of alkalose verandert (uren tot dagen). De perifere chemosensoren versterken of verzwakken echter direct de ventilatoire drive van veranderingen in de PaCO2 bij respectievelijk metabole acidose of alkalose. Metabole acidose doet de ventilatie dus toenemen en metabole alkalose vermindert de ventilatoire respons (zie verder par. 3.3).
3.2.5 Het effect van grote hoogte
Bij toenemende hoogte daalt de atmosferische druk omdat deze wordt bepaald door het gewicht van de luchtkolom op die hoogte. Het aandeel van de zuurstof daarin verandert niet en blijft 21%.
Indachtig de formule [PIO2 = 0,21 × (PB − PH2O)], kan de PIO2 op bijvoorbeeld vijfduizend meter berekend worden:
Pb = 429 mm Hg; PH2O = 47 mm Hg; PIO2 = 80 mm Hg.
Deze daling leidt tot een versterkte ventilatie waardoor de PACO2 gaat dalen, stel tot ongeveer 32 mm Hg volgens: PACO2 ∞ VCO2 / VA.
Gebruikmakend van de alveolaire luchtvergelijking wordt de PAO2 dan (bij een RQ van 0,8):
PAO2 = PIO2 − PACO2 / R.
PAO2 = 80 − 32 / 0,8 = 40 mm Hg. Hierbij is de saturatie slechts 80%. De PACO2 zal dus door versterkte ventilatie veel meer moeten dalen om nog een redelijke saturatie te bewerkstelligen.
Op vijftienduizend meter is de barometerdruk slechts 100 mm Hg. Minus de partiële druk van de waterdamp wordt de PIO2 dan slechts 0,21 × 53 = 11 mm Hg. Omdat dit gelijk moet zijn aan PAO2 + PACO2 is deze situatie niet met het leven verenigbaar.
Het acclimatiseren in het hooggebergte begint met een versterkte ventilatie; de respiratoire alkalose die dan ontstaat wordt binnen een dag renaal gecompenseerd. Een ander gevolg is versterkte erytropoëse: binnen vijf dagen worden onder invloed van versterkte secretie van erytropoëtine in de nieren, extra erytrocyten geproduceerd waardoor het zuurstofdragend vermogen van het bloed toeneemt. De alveolaire respons op stijging van de PACO2 neemt toe door de lagere PAO2.
3.2.6 Het effect van lichamelijke inspanning
Gedurende korte periodes van zware lichamelijke inspanning kan het maximale ademminuutvolume (MAMV) wel 150 liter per minuut bedragen. De cardiac output is maximaal twintig tot dertig liter. Daarom is het hartvaatstelsel en niet de ademhaling de beperkende factor. Training berust dan ook voornamelijk op veranderingen in het cardiovasculaire systeem, waarbij vooral het slagvolume toeneemt. Daarnaast gaan de spieren efficiënter met zuurstof om. Bij maximale inspanning neemt het tidale volume toe tot circa 60% van de vitale capaciteit. De longvaatweerstand neemt af door recruitment, vooral in de bovenste longgebieden.
3.2.7 Het effect van duiken
Bij het afdalen in water speelt de hydrostatische druk een doorslaggevende rol. Iemand die alleen met zijn hoofd boven water uitsteekt, ervaart al een druk van 20 cm H2O boven de atmosferische druk, waardoor het ERV tot 70% kan afnemen. De ademinspanning bij inspiratie neemt ook toe. Op een diepte van één meter kan men niet via een buisje ademen, het heeft dus geen zin om een snorkelpijpje te verlengen.
Op een diepte van tien meter is de druk al 2 atmosfeer. Lichaamsweefsel is niet goed samendrukbaar, maar gas wel, zodat de longvolumina volgens de wet van Boyle gehalveerd worden. De partiële drukken van de luchtcomponenten zijn verdubbeld en er kan CO2-retentie optreden.
Als een duiker niet uitademt tijdens het opstijgen kunnen alveoli te veel gerekt raken en barsten.
Tijdens de afdaling gaat er veel meer stikstof in oplossing, die bij stijgen als belletjes vrij komt. Deze bellen kunnen de bloedvaten verstoppen. Daarom moet een duiker altijd zeer langzaam opstijgen naar het wateroppervlak, anders ontstaat decompressieziekte (caissonziekte).
3.3 Het zuur-basenevenwicht
Water is een polair molecuul. De twee waterstofatomen zijn met een covalente binding aan het zuurstofatoom gebonden. Er is een ongelijkmatige verdeling van de elektrische krachten in het watermolecuul, omdat positieve lading aan de ene kant van het molecuul ligt en de negatieve lading aan de andere kant (zie hoofdstuk 10.1007/978-90-313-9630-6_1).
3.3.1 Zuren en basen
In water bestaat er een evenwicht waarbij protonen (H+-ionen) heen en weer springen tussen de ongesplitste watermoleculen, waarbij een uiterst klein deel van het water gesplitst is in een hydroniumion, H3O+ en een OH--ion. Voor het gemak noemen we het hydroniumion het H+-ion.
Omdat het H+-ion zich zo snel aan andere moleculen kan hechten is het noodzakelijk dat de zuurgraad, de H+-concentratie, binnen nauwe grenzen bewaakt blijft. Eiwitten in de cel kunnen door verandering in de zuurgraad namelijk van conformatie, van ruimtelijke structuur, veranderen wat gevolgen kan hebben voor hun functie. Tal van metabole en transportprocessen van de cel gaan dan anders verlopen.
Slecht één op de tien miljoen watermoleculen is gesplitst in de ionen H+ (proton) en OH- (hydroxylion). De concentratie van deze ionen in zuiver water bedraagt dan ook voor beide 10-7 mmol/l. Het ionenproduct bedraagt 10-14, dit product moet constant zijn want een toename van de H+-ionenconcentratie betekent een daling van de OH--ionenconcentratie omdat er dan water wordt gevormd. Stoffen die, als ze in water worden opgelost, hun protonen gemakkelijk afstaan worden zuur genoemd, terwijl stoffen die gemakkelijk protonen opnemen en dus een OH--ion achterlaten basisch heten. Voorbeelden hiervan zijn HCl en NaOH. Deze stoffen zijn een sterk zuur en een sterke base, die volledig gesplitst zijn. Azijnzuur en koolzuur zijn zwakke zuren die de neiging hebben hun proton vast te houden en dit alleen los te laten als de H+-concentratie [H+] laag is. Omgekeerd zijn er ook zwakke basen die alleen in een zure omgeving een proton van een H2O-molecuul kunnen opnemen en een OH- overlaten, bijvoorbeeld stoffen met een aminogroep NH2:
NH2 + H2O → NH3 + OH-.
3.3.2 De pH
Omdat de [H+] van zuiver water 1 × 10-7 mmol/l is, worden volgens afspraak concentraties die hoger zijn zuur en concentraties die lager zijn alkalisch genoemd.
In het lichaam zijn er compartimenten die een zeer lage en een zeer hoge zuurgraad hebben, bijvoorbeeld maagsap dat een [H+] van 10-1 mmol/l kan hebben en pancreasvocht dat sterk alkalisch is met een [H+] van 10-7,5. Om het berekenen te vereenvoudigen wordt gewerkt met de negatieve logaritme van de waterstofionenconcentratie, dit wordt pH genoemd.
Als [H+] = 10-7 dan is de pH -log[H+] = 7. Een zuur milieu wordt dus aangegeven met een pH die lager is en een alkalisch milieu door een verhoging van de pH. Normaal ligt de pH tussen 7,38 en 7,42 (tabel 3.4). Overschrijding van deze grenzen naar beneden tot 6,8 en naar boven tot 7,8 zijn niet met het leven verenigbaar.
| pH | [H + ] nmol/l |
| 7.7 | 20 |
| 7.5 | 31 |
| 7.4 | 40 |
| 7.3 | 50 |
| 7.1 | 80 |
| 7.0 | 100 |
| 6.8 | 160 |
De vorming van zuur in het lichaam vindt ongeveer als volgt plaats:
-
bij de verbranding van koolhydraten tot CO2 en water in de perifere weefsels ontstaat zuurvorming volgens:
C6H12O6 + 6 O2 = 6 CO2 + 6 H2O.
Erytrocyten bevatten het enzym carboanhydrase. Dit zet CO2 met H2O om in koolzuur (H2CO3) dat weer deels uiteenvalt in H+ en HCO3 - volgens de vergelijking:
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3 -.
Hierbij wordt dus ‘gasvormig’ zuur geproduceerd waarbij de H+-ionen in de erytrocyten aan hemoglobine worden gebonden en het HCO3 --ion de erytrocyt uitgaat naar de extracellulaire vloeistof in ruil voor een chloorion. Dit heet chlorideshift.
In de longen gaat HCO3 - weer de erytrocyt in, verbindt zich met het aan Hb gebonden H+ en vormt volgens:
H+ + HCO3 - ↔ H2CO3 ↔ CO2 + H2O waarbij het CO2 via de ademhaling weer het lichaam verlaat. Dagelijks wordt circa 15.000 tot 25.000 mmol CO2 door de longen uitgescheiden. Alleen wanneer door hypoventilatie de CO2 niet wordt verwijderd zal de pH dalen. Een eventuele daling van de pH stimuleert echter de ventilatie evenals een PO2 lager dan 60 mm Hg;
bij het intracellulair afbreken van aminozuren en andere stoffen worden onder andere zwavelzuur en fosforzuur geproduceerd. Dit is het niet-gasvormige zuur. De excretie van dit zuur vindt plaats in de nieren. De tubuluscel bevat namelijk ook carboanhydrase dat CO2 omzet in H2CO3 en dat zich dan weer splitst in H+ en HCO3 -. Daarbij moet een onderscheid worden gemaakt tussen de proximale en de distale tubulus. In de proximale tubulus wordt al het HCO3 - uit het glomerulusfiltraat teruggeresorbeerd en hierin vindt geen netto H+-secretie plaats. In de distale tubuli kunnen H+-ionen direct worden uitgescheiden waarbij HCO3 - wordt gegenereerd en teruggeresorbeerd en waarbij de pH flink daalt. In de proximale tubulus wordt NH3 geproduceerd en dit diffundeert naar de verzamelbuisjes waar het H+ wordt ‘weggevangen’ en als NH4 + in de urine wordt uitgescheiden. In de urine kan een pH tussen 4 en 5 onder normale omstandigheden worden bereikt. Om de elektrische neutraliteit te handhaven wordt Na+ tegen H+ in de distale tubulus uitgewisseld en er functioneert ook een H+/K+-pomp in de verzamelbuisjes. Vandaar dat stoornissen in het zuur-basenevenwicht ook consequenties hebben voor de K+-huishouding. Ongeveer 50 tot 100 mEq niet-gasvormig zuur wordt dagelijks door de nieren uitgescheiden, terwijl 70 mEq bicarbonaat worden teruggeresorbeerd.
3.3.3 Het buffersysteem
Een buffer is een waterige oplossing van een zwak zuur en zijn zout. Een dergelijk mengsel kan een verhoging van [H+] opvangen en ervoor zorgen dat de H+-concentratie veel minder stijgt dan wanneer het zuur aan zuiver water zou worden toegevoegd.
Voor een continue bewaking van de pH beschikt het lichaam over buffersystemen die een verhoging of een verlaging van de zuurgraad kunnen opvangen en de pH constant houden. De belangrijkste extracellulaire buffer is het bicarbonaatsysteem , omdat beide componenten, namelijk CO2 en HCO3 -, door respectievelijk de longen en de nieren uitgescheiden respectievelijk geretineerd kunnen worden. Daarnaast hebben het hemoglobine en de eiwitten een bufferfunctie, evenals de fosfaatbuffer. Deze buffers werken voornamelijk intracellulair.
Eiwitten zijn opgebouwd uit aminozuren die amfoteer zijn, dat wil zeggen dat zij in zuur milieu H+-ionen binden en in alkalisch milieu loslaten. Intracellulair is dit buffersysteem belangrijk.
Een zuur kan voorgesteld worden als: HA ↔ H+ + A-.
Elk zwak zuur heeft zijn eigen dissociatieconstante K die de verhouding aangeeft tussen het niet-gesplitste zuur, het proton en de zuurrest. Dit is in overeenstemming met de wet van de massawerking:
K = [H+] × [A-] / [HA] waaruit volgt:
[H+] = K × [HA] / [A-].
Wanneer dit alles in logaritme wordt genoteerd luidt de formule:
Log [H+] = log K + log [HA] / [A-] of −log [H+] = −log K + log [A-] / [HA]
−log [H+] = pH, terwijl −log K de Pk wordt genoemd. Deze bedraagt voor de bicarbonaatbuffer 6,1.
pH = pK + log {[A-] / [HA]}.
Alle buffersystemen hebben hun eigen evenwichtsconstante K. Echter, omdat alle K’s gerelateerd zijn aan [H+] geldt:
H+ = K1 × HA1/ A1 - = K2 × HA2 /A2 - et cetera. Dat wil zeggen dat veranderingen in de andere buffersystemen ook in de bicarbonaatbuffer afgespiegeld worden. Dit heet het isohydrische principe.
Voor de bicarbonaatbuffer geldt dan:
CO2 (in gasvorm) ↔ CO2 (opgelost in water) + H2O ↔ H2CO3 ↔ HCO3 - + H+, waarbij het evenwicht sterk naar links is gericht en het fysisch opgeloste CO2 als het niet-gedissocieerde zuur kan worden beschouwd. Er is circa vierhonderd maal meer fysisch opgelost CO2 dan H2CO3.
De formule voor de bicarbonaatbuffer luidt dan:
pH = pK + log [HCO3 -] / [CO2].
De oplossingsconstante voor CO2 dient nu echter niet in ml/100 ml te worden genoteerd maar in millimol per liter. De omrekeningsfactor is 0,03. De formule luidt dan:
pH = pK + log [HCO3 -] / 0,03 × pCO2. Dit is de bekende formule van Henderson en Hasselbalch .
Kennis van deze formule is van groot belang voor het beoordelen van stoornissen in het zuur-basenevenwicht.
De pH is recht evenredig met HCO3 - en omgekeerd evenredig met de pCO2.
Wanneer de koolzuurspanning 40 mm Hg bedraagt, dan is de H2CO3-concentratie: 0,03 × 40 = 1,2 mmol/l. Normaal ligt het bicarbonaatgehalte rond 24 mmol/l.
Vullen we dit in, dan blijkt: pH = 6,1 + log 24 / 1,2 = 6,1 + log 20 = 6,1 + 1,3 = 7,4.
Uit de formule blijkt voorts dat de pH daalt als de teller van de breuk kleiner of de noemer groter wordt en omgekeerd stijgt de pH als de teller groter of de noemer kleiner wordt. Ook is duidelijk dat de pH constant blijft als teller en noemer van de breuk in gelijke mate toe- of afnemen. Bijvoorbeeld als bij daling van het bicarbonaat in het plasma ook de CO2-spanning omlaag gaat en omgekeerd als bij hypoventilatie de CO2-spanning stijgt en het bicarbonaatgehalte ook stijgt.
De buffercapaciteit is gigantisch. In een experiment werd zuur toegevoegd aan plasma met een pH van 7,44 in een hoeveelheid van 14 millimol H+ per liter. De pH daalde tot 7,14 dat wil zeggen dat [H+] slechts steeg van 36 naar 72 nanomol per liter of 0,002% van het toegevoegde zuur.
3.3.4 Stoornissen in het zuur-basenevenwicht
Op basis van het quotiënt {HCO3 -} / 0,03 × pCO2 kunnen stoornissen primair als respiratoir of metabool worden ingedeeld. Alveolaire hypoventilatie verhoogt de pCO2 en verlaagt daarmee de pH. Er is dan een respiratoire acidose. Omgekeerd is bij hyperventilatie de pCO2 verlaagd, stijgt de pH en is er dan een respiratoire alkalose. Bij vermindering van de [HCO3 -] door zuurbelasting daalt de pH, men spreekt dan van metabole acidose terwijl bij toename hiervan, bijvoorbeeld bij langdurige maagzuigdrainage met chloorverlies, de pH stijgt en metabole alkalose ontstaat.
Bij al deze verstoringen treden compensatiemechanismen in werking. Afwijkingen op respiratoire basis met veranderingen in de pCO2 leiden ertoe dat de nier meer of minder HCO3 - terugresorbeert om het quotiënt gelijk te houden. Stijging van de pCO2 betekent een toename van [HCO3 -] en omgekeerd. Het renale compensatiemechanisme is echter traag en vergt uren (twaalf tot achttien). Primaire metabole afwijkingen veroorzaken een verandering in de ventilatie met stijging of daling van de pCO2 die veel sneller is. De compensatie is overigens gewoonlijk niet compleet (afb. 3.23 en 3.24).

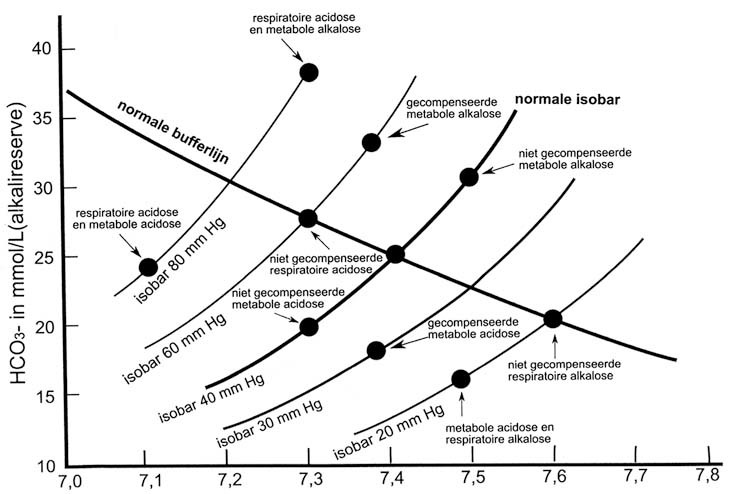
Respiratoire acidose
Deze ontstaat als de alveolaire ventilatie relatief te laag is ten opzichte van de CO2-productie. Er bestaan een acute en een chronische vorm.
-
Acuut. De renale compensatie is niet snel genoeg om pH-daling te voorkomen:
- depressie van het ademcentrum door drugs, narcotica, sedativa, ziekten van het centraal zenuwstelsel (CZS), schedeltrauma;
- gedecompenseerde chronisch obstructieve longziekten (COLD) en status astmaticus;
- neuromusculaire ziekten waarbij de ademhalingsspieren niet goed werken.
-
Chronisch. Renale compensatie is hier wel aanwezig want er was voldoende tijd voor het op gang komen van de HCO3 --respons. Omgekeerd kan het bij herstel van de ventilatie enige tijd duren voordat dit weer is uitgescheiden met tijdelijke pH stijging als gevolg:
- longemfyseem;
- ernstige kyfoscoliose;
- zware vetzucht: pickwicksyndroom.
Respiratoire alkalose
Wanneer de alveolaire ventilatie hoger is dan de productie van CO2 zal de pH licht stijgen en in de volgende dagen de renale excretie van HCO3 - op gang komen.
Er zijn verschillende oorzaken.
-
Hypoxie (PO2-daling ) is de voornaamste prikkel voor hyperventilatie bij:
- verblijf op grote hoogte;
- pneumonie;
- longembolie;
- longoedeem.
-
Centraal zenuwstelsel:
- angst: hyperventilatiesyndroom;
- aandoeningen van de hersenstam: CVA, tumoren, infecties;
- medicijnen: salicylaten, theofylline, gramnegatieve sepsis (in het begin).
Metabole acidose
Deze wordt gekenmerkt door vermindering van het bicarbonaat in het lichaam door:
verlies via urine of feces;
verminderd vermogen van de nier om HCO3 - te genereren;
vorming van zuur bij metabole processen, bijvoorbeeld ketonlichamen bij diabetes mellitus type I en melkzuur bij weefselanoxie;
opname van zuur, bijvoorbeeld methanol en ethyleenglycol.
In al deze gevallen treedt respiratoire compensatie op volgens de henderson-hasselbalchformule. De acidose stimuleert de chemoreceptoren centraal en perifeer en er ontstaat hyperventilatie. De pCO2 zal dalen om het quotiënt gelijk te houden, al lukt dat niet helemaal en is er altijd wel een lichte pH-daling. De hyperventilatie bij metabole acidose heet het ademtype van Kussmaul.
In dit verband is de ‘serum anion gap’ van belang. De concentratie van kationen in het serum moet gelijk zijn aan het aantal anionen. Het voornaamste kation is Na+ en de voornaamste anionen zijn HCO3 - en Cl-. Het zijn voornamelijk deze ionen die bij laboratoriumonderzoek worden gemeten. Nu is de som van HCO3 - en Cl- niet gelijk aan Na+ en het verschil heet niet-gemeten anionen oftewel anion gap.
Serum anion gap = Na+ − (Cl- + HCO3 -). De normale anion gap bedraagt 10 tot 16 mmol/l en komt op rekening van fosfaten, sulfaten afkomstig van het celmetabolisme, lactaat en ketozuren afkomstig van incomplete verbranding van koolhydraten en vetzuren in de cellen. Een toegenomen anion gap komt gewoonlijk op rekening van endogene zuurproductie zoals ketozuren en lactaat of exogene zuuropname van bijvoorbeeld ethyleenglycol.
Metabole acidose kan dus onderscheiden worden in twee typen, namelijk met en zonder anion gap.
Metabole acidose met toegenomen anion gap
-
Verminderde zuuruitscheiding met retentie van sulfaten en fosfaten:
- acute nierinsufficiëntie, bijvoorbeeld door acute tubulusnecrose, waarbij de tubuluscellen kapot zijn en geen zuur meer uitgescheiden wordt;
- chronische nierinsufficiëntie, waarbij de hoeveelheid functionerend nierweefsel is afgenomen en de NH3-synthese gestoord is.
-
Overproductie van zuur door gestoord celmetabolisme:
- diabetische ketoacidose. Het glucosemetabolisme is door insulinetekort gestoord. Intracellulair is er een glucosetekort en de cel gaat over op vetverbranding. In de lever hopen zich dan ketonlichamen op. Omdat door de hyperglykemie volumedepletie is ontstaan, is ook de nierperfusie gestoord, wat weer verminderde zuuruitscheiding veroorzaakt;
- lactaatacidose als gevolg van gestoorde weefselpersfusie met zuurstof zoals bij shock, hypoxemie en sepsis;
- uithongering (opbranden van het lichaamsvet).
Metabole acidose met een normale aniongap
Hierbij gaat bicarbonaat verloren via de nier of darm of is er onvoldoende productie van bicarbonaat door de nier. Er is dus geen overproductie van zuur. Het serumbicarbonaat is verlaagd en het Cl- is verhoogd.
Via de darm bij langdurige en ernstige diarree.
-
Via de nier:
- chronische nierinsufficiëntie;
- enkele zeldzame tubulaire ziekten zoals renale tubulaire acidose (RTA);
- aldosteronantagonisten (spironolacton). Deze beperken de H+- en de K+-secretie.
Metabole alkalose
Metabole alkalose is niet zeldzaam bij ziekenhuispatiënten. Deze ontstaat als er primair een verhoging is van de HCO3 --concentratie en de bijbehorende stijging van de pCO2 niet voldoende is om de pH normaal te houden (tenzij er ook sprake is van lactaatacidose door hypoxie). Er is geen anion gap en het Cl- is verlaagd. De stijging van de pCO2 is niet van respiratoire aard, maar compensatoir en pogingen om deze te verlagen, bijvoorbeeld door beademing, kunnen verkeerd uitpakken. De fundamentele stoornis is het onvermogen van de nier om het geretineerde bicarbonaat uit te scheiden. De belangrijkste oorzaken hiervan zijn:
verlies van Cl - door langdurig braken of langdurige maagdrainage. Hierdoor ontstaat metabole alkalose die vervolgens door de nier wordt onderhouden omdat er ook volumedepletie is wat leidt tot verhoogde terugresorptie van bicarbonaat;
verlies van K + uit de cellen gaat gepaard met een shift van H+ naar de cellen, ook in de tubuli, waardoor de versterkte terugresorptie van bicarbonaat wordt onderhouden;
te hoge productie van mineralocorticoïden, zowel primair (primair hyperaldosteronisme, ziekte van Cushing) als secundair (door volumedepletie). Hierbij is er verhoogde zuuruitscheiding in de urine en tegelijkertijd wordt bicarbonaat gegenereerd;
iatrogeen door ongecontroleerde toediening van NaHCO3 of citraat;
langdurig diureticumgebruik leidt niet alleen tot verlies van Na+, maar ook van K+ en Cl-;
gestoorde glomerulaire filtratie.
3.4 Ademhalingsinsufficiëntie (respiratory failure )
Het is de taak van de longen om voldoende O2 naar de circulatie te transporteren en daaruit zoveel CO2 te verwijderen dat de PaO2 en de PaCO2 binnen normale grenzen blijven. Daarom kan gesteld worden dat respiratoire insufficiëntie een stoornis betekent in de gaswisseling van alveoli naar de longcapillairen en omgekeerd, en wel zodanig dat de PaO2 verlaagd en/of de PaCO2 verhoogd is. De diagnostiek van ademhalingsinsufficiëntie berust op de bepaling van deze waarden in het arteriële bloed. Het is daarom geen klinische maar een laboratoriumdiagnose. Er zijn op deze uitspraak twee uitzonderingen, namelijk de lage PaO2 bij niet-pulmonaire rechts-linksshunts en de hoge PaCO2 als compensatoir effect bij metabole alkalose. Deze afwijkingen zijn niet van respiratoire aard.
Ventilatie, diffusie, perfusie en regulatie van de ademhaling kunnen alle een rol spelen in het ontstaan van respiratoire insufficiëntie.
3.4.1 Hypoxie
Hypoxie treedt voornamelijk op in de volgende situaties (in volgorde van belangrijkheid):
ongelijkmatige ventilatie-perfusieverhouding . Dit is de meest voorkomende oorzaak. Zoals eerder is opgemerkt helpt een verhoogde ventilatie slechts beperkt door de vorm van de hemoglobine-O2-curve. Atelectases, afsluiting van bronchussegmenten, treden onder andere op bij een pneumonie en een pneumothorax. Het inademen van zuivere zuurstof doet het verschil tussen de PAO2 en de PaO2 verdwijnen omdat daarmee de PAO2 stijgt in slecht tot matig geventileerde alveoli en er dus een grotere diffusiegradiënt is;
rechts-linksshunts treden op bij allerlei ziekten die ertoe leiden dat alveoli helemaal niet geventileerd worden, zoals atelectase, longontsteking, longoedeem et cetera. Het toedienen van zuurstof heeft hier een veel geringer effect, omdat de shunt het bloed dat langs niet-geventileerde alveoli is gegaan, blijft doorgeven aan de systemische circulatie;
hypoventilatie . Deze wordt gekenmerkt door een stijging van de PaCO2 en een bijna even grote daling van de PaO2. Als de PaCO2 bijvoorbeeld 70 mm Hg is en de PaO2 50 mm Hg, dan zijn beide ongeveer evenveel in tegengestelde richting veranderd. Als bij deze hypercapnie de PaO2 30 mm Hg is, dan is er een complicerende factor, meestal een mismatch;
diffusiestoornissen geven alleen in ernstige gevallen een toename van het PAO2-PaO2-verschil. Afwijkingen van het alveolocapillaire membraan (het zogenoemde alveolocapillaire block) zijn zeldzaam als oorzaak van hypoxie.
3.4.2 Hypercapnie
Hypercapnie is een gevolg van alveolaire hypoventilatie (PACO2 ∞ VCO2 / VA). Het koolzuurgehalte stijgt en de pH daalt, waarbij acute afwijkingen eerst de pH verlagen en pas na enkele dagen het bicarbonaatgehalte door renale compensatie stijgt en de pH weer omhoog gaat.
3.4.3 De verschijnselen van ademhalingsinsufficiëntie
Een groot aantal ziekten kan tot ademhalingsinsufficiëntie leiden, waarbij geldt dat de symptomen van deze ziekten het klinische beeld kunnen domineren. Zoals gezegd: de diagnose berust op laboratoriumonderzoek.
Hypoxie toont een beeld dat lijkt op alcoholintoxicatie. Er is motorische onrust en de patiënt is verward. Aanvankelijk is er tachycardie en verhoogde bloeddruk, bij toename is de hersenstam aangetast, daalt de tensie en treedt bradycardie op. Ten slotte ontstaan cardiale insufficiëntie en shock.
Bij chronische hypoxie is polyglobulie (verhoogde hematocriet) een markant verschijnsel. Cyanose kan zowel een pulmonale als een cardiale oorzaak hebben. Meestal kan dit pas klinisch waargenomen worden als de PO2 tot beneden de 50 mm Hg is gedaald.
Bij hypercapnie worden de verschijnselen voornamelijk bepaald door de snelheid waarmee het syndroom zich ontwikkelt.
Bij acute hypercapnie staan angst, slaperigheid en verwardheid op de voorgrond. Bij verdere voortgang wordt de patiënt comateus en volgt overlijden. Bij chronische hypercapnie is er tijd voor compensatoire mechanismen om zich te ontwikkelen. In deze situatie komen bloedgaswaarden voor die in acute gevallen niet met het leven verenigbaar zijn. Bij patiënten met chronische respiratoire insufficiëntie is het niet ongewoon dat zij rondlopen met een pCO2 die in de acute situatie dodelijk zou zijn, bijvoorbeeld 100 mm Hg. Deze patiënten krijgen ter bestrijding van hypoxie extra zuurstof uit een zuurstofcilinder die in een tasje om de schouders wordt gedragen. Veel patiënten klagen over hoofdpijn, een gevolg van de vaatverwijdende werking van CO2.
3.4.4 Oorzaken van ademhalingsinsufficiëntie
Ademhalingsinsufficiëntie wordt gedefinieerd als de aanwezigheid van hypoxie, al of niet samengaand met hypercapnie. Daarom zijn er twee hoofdgroepen, te weten stoornissen in de ventilatie , waarbij de PaO2 verlaagd en de PaCO2 verhoogd zijn, en stoornissen in de oxygenatie , waarbij alleen de PaO2 verlaagd is.
Een blokkade van de luchtwegen kan overal langs de tracheobronchiaalboom optreden, waarbij een vernauwing in de luchtwegen die buiten de borstkas gelegen zijn inspiratoire stridor veroorzaakt, terwijl intrathoracale blokkades bronchospasmus teweegbrengen, dat wil zeggen expiratoir piepen. Tot de oorzaken behoren corpora aliena (pinda’s zijn berucht), acute ontstekingen zoals difterie en verbrandingen door hete gassen, astma en bronchiolitis en (pseudo)kroep.
Parenchymateuze afwijkingen komen vooral voor in het kader van longontstekingen, maar er zijn talloze andere oorzaken.
Aan longoedeem en het acute respiratory distress syndrome (ARDS) , dat gezien wordt bij sepsis, ligt een verhoogde permeabiliteit van de longcapillairen ten grondslag. Als gevolg hiervan worden belangrijke delen van de longcirculatie geshunt. ARDS is vaak (40-60% van de gevallen) dodelijk.
Longembolie wordt gekenmerkt door een verlaging van zowel de PaO2 als de PaCO2. De eerste is een gevolg van de shunting en de tweede van de hyperventilatie die hierbij altijd optreedt.
Sedativa en anesthetica zijn een belangrijke oorzaak van ademhalingsinsufficiëntie omdat zij de prikkeldrempel van het ademcentrum verhogen. Actieve euthanasie wordt soms met behulp van deze middelen uitgevoerd, maar een ‘drug overdose’ (DOD) door opiaten komt veel meer voor en is een belangrijke doodsoorzaak bij heroïneverslaafden.
3.4.5 Therapie van de ademhalingsinsufficiëntie
Er zijn verschillende behandelmogelijkheden voor ademhalingsinsufficiëntie.
-
Verbeterde oxygenatie. De PaO2 kan verbeterd worden door drie determinanten te beïnvloeden, te weten de PaCO2, de PiO2 en het alveolocapillaire verschil: de (PA-Pa)O2-gradiënt. De laatste is bijna altijd het gevolg van shunting. Bij ademhalingsdepressie kunnen naloxon tegen opiaten en flumazenil (Annexate®) tegen benzodiazepines als antidotum levensreddend zijn.
Het toedienen van zuurstof verhoogt de PiO2 bij hypoxie door hypoventilatie of door ventilatie-perfusiemismatch en dit kan de PaO2 aanzienlijk verbeteren. Daarbij moet ernaar worden gestreefd om deze niet boven de 60 mm Hg te laten stijgen, omdat in dit gebied van de Hb-dissociatiecurve de zuurstofafgifte het meest effectief is. Dat voorkomt dat een hogere PaO2 de ademhalingsprikkel weer zodanig afremt dat de PaCO2 stijgt. Grote shunts kunnen gewoonlijk niet met 100% zuurstof behandeld worden, al kan het aandeel van het fysisch opgeloste O2 wel worden verhoogd.
Verbeterde ventilatie. De VA kan verbeterd worden door via bronchoscopie of, bij beademde patiënten, via endotracheale afzuiging eventuele blokkades door slijmproppen te verwijderen. Soms kan door een tijdelijke tracheostomie de anatomische dode ruimte verkleind worden. Als het niet lukt om de ventilatie te verbeteren is mechanische beademing aangewezen.
Verbeterd zuurstoftransport. De belangrijkste factoren voor de zuurstofdragende capaciteit (CaO2) van het bloed zijn de saturatie en het Hb. Daarnaast is optimaliseren van de cardiac output van grote betekenis. Een CO-vergiftiging wordt soms met hyperbare zuurstof (3 atm) behandeld, teneinde de PaO2 zo veel mogelijk te verhogen.
Zuurstoftoediening
Er zijn twee mogelijkheden om non-invasief zuurstof toe te dienen, namelijk het variabele en het gefixeerde aanbod. Het variabele aanbod omvat twee mogelijkheden, namelijk de neuskatheter en het gelaatsmasker. Met een neuskatheter wordt gebruikgemaakt van de dode ruimte in de nasofarynx die hierbij gevuld wordt met zuurstof. Als een patiënt dit inademt wordt de inademingslucht met deze zuurstof gemengd. Een verhoging van de FiO2, de fractie van de zuurstof in de inspiratielucht die normaliter 21% is, kan zo bereikt worden. De toename is afhankelijk van de flow: met 1 liter O2 per minuut is de FiO2 24%, met 2 liter/min bedraagt deze 28%. Een hogere flow, bijvoorbeeld zes liter, waardoor een FiO2 kan worden bereikt van 44% heeft geen zin door versterkte turbulentie.
Met een venturimasker kan een aanzienlijk hogere FiO2 worden bereikt als daaraan tenminste een reservoir is toegevoegd.
Het gefixeerde aanbod geeft een gasstroom die de inspiratoire flow van een patiënt overschrijdt. De flow kan wel zestig liter per minuut bedragen. Deze apparatuur is gewoonlijk alleen op een intensivecareafdeling aanwezig.
O2 en pCO2
Lange tijd heeft de vrees bestaan dat bij patiënten met COLD en CO2-retentie het geven van zuurstof tot ademstildtand zou kunnen leiden omdat de ‘hypoxic drive’ dan wegvalt. Toch valt dit in de praktijk erg mee, zeker als niet naar een optimale PaO2 wordt gestreefd maar genoegen wordt genomen met 60 mm Hg. De toename van de PaCO2 die bij zuurstoftoediening wordt waargenomen, komt voor een deel op rekening van de toename van de (alveolaire) dode ruimte, dus van VD/VT. De lokale pulmonale vasoconstrictie, die als gevolg van de hypoxie was ontstaan, wordt namelijk opgeheven.
Indicaties voor intuberen en beademing
De indicaties voor intuberen en beademing zijn:
acute hypercapnie (PCO2 > 50 mm Hg);
acute hypoxie (PO2 < 50 mm Hg);
als de P(A-a)O2 niet verbetert bij inspiratie van zuurstof met een FiO2 van 1.0. Waarschijnlijk is er dan intrapulmonale shunting;
uitputting. Het werk van de ademhalingsspieren wordt overgenomen waardoor de VCO2 daalt;
ernstige luchtwegobstructie (astma, COPD). Met PEEP gaan gecollabeerde alveoli weer open. Bij PEEP: cave pneumothorax, decompensatio cordis;
tracheobronchiaal toilet: afzuigen van secretiemateriaal kan via de tube;
ARDS.
Indicaties voor tracheotomie zijn:
intubatie langer dan 14 dagen;
bij fracturen van de larynx. NB. hogere incidentie van tracheastenose (echter zeldzaam).
3.5 Longpathologie
Slechts de meest voorkomende ziekten op de intensivecareafdeling en anesthesieafdeling worden besproken.
3.5.1 Obstructieve stoornissen
Deze categorie wordt gekenmerkt door vernauwing van de luchtwegen met als gevolg een verhoogde stroomweerstand voor lucht. Er kan een onderscheid gemaakt worden tussen acute en chronische luchtwegobstructie.
Acute luchtwegobstructie
Astma bronchiale. Hierbij zijn er steeds terugkerende periodes van luchtwegobstructie die hetzij spontaan, hetzij door therapie eindigen. De aanvallen vinden plaats op basis van hyperreactiviteit. De vernauwing heeft een drietal aspecten:
contractie van de gladde musculatuur van de kleinere luchtwegen. Een aantal actieve stoffen (mediatoren) spelen hierbij een rol, zoals histamine, acetylcholine en bradykinine, waarvan histamine de belangrijkste is. De laatste worden geproduceerd in de mestcellen, die in de bronchuswand overvloedig aanwezig zijn;
verdikking van het bronchusepitheel. Er is hyperemie en oedeem van de mucosa en een toename van de slijmbekercellen;
ophoping van slijm in het lumen. Het slijm is viskeus en bevat afgestoten epitheelcellen.
Pathofysiologisch is er tijdens een aanval luchtwegobstructie over het hele traject van de vitale capaciteit. De intrapleurale druk daalt bij inspiratie veel meer dan enkele cm H2O negatieve druk en stijgt bij expiratie tot waarden van tientallen cm H2O positieve druk. Deze laatste versterkt de vernauwing bij expiratie, verhoogt de dynamische compressie en daarmee het closing volume.
De peakflow en de FEV1 zijn verlaagd, vaak is spirometrie niet mogelijk.
Tijdens een (middel)zware aanval is er meestal hypoxie en soms hypercapnie. Door de hypoxie is er hyperventilatie en zal er aanvankelijk een lage PaCO2 zijn met een respiratoire alkalose als gevolg die na enige tijd renaal gecompenseerd wordt. Als de patiënt dan door oververmoeidheid toch hypercapnie krijgt en de PaCO2 gaat stijgen, zijn de bicarbonaatreserves uitgeput. Daarom wordt bij deze patiënten frequent een bloedgasanalyse verricht. Er is dan sprake van een status astmaticus waarvoor de patiënt naast medicamenteuze behandeling soms ook beademd moet worden. In dodelijk verlopende gevallen blijken de kleine luchtwegen dan door taaie slijmpluggen te zijn afgesloten en is er door de beademing alleen maar lucht of zuurstof in de dode ruimte heen en weer geblazen.
Fysische diagnostiek
Tijdens een aanval is er een piepende en bemoeilijkte uitademing, bij verergering ook van de inademing. Bij zeer ernstige bronchusobstructie worden geen bronchospastische geruisen meer waargenomen, de patiënt is dan in levensgevaar.
Therapie
Inhalatietherapie met corticosteroïden, β2-agonisten en cromoglycaat. Dit laatste medicament blokkeert de afgifte van histamine, leukotriënen et cetera uit de mestcellen.
Chronische luchtwegobstructie
De verzamelnaam is chronic obstructive lung disease (COLD). Afhankelijk van het instituut wordt ook de term chronic obstructive pulmonary disease (COPD) gebruikt. Een goede Nederlandse benaming is er niet, maar bedoeld wordt: een spectrum van ernstige en minder ernstige aandoeningen; chronische en astmatische bronchitis, chronisch obstructieve bronchitis en emfyseem.
Chronische bronchitis wordt gekenmerkt door enkele maanden durende productieve hoest die vaak gecompliceerd wordt door recidiverende luchtweginfecties en gerelateerd is aan roken. Het komt voor bij circa 25% van de bevolking. Bij oudere rokers ontwikkelt zich soms een bronchitis met astmatische trekken: chronische astmatische bronchitis . Het inhaleren van bronchus irritantia leidt tot verhoogde slijmproductie in de luchtwegen (de slijmbekercellen nemen tot het tienvoudige in omvang toe), het verminderen of verdwijnen van het trilhaarepitheel en verhoogde gevoeligheid voor luchtweginfecties.
Bij 15% van de rokers treedt luchtwegobstructie op die aanvankelijk nog omkeerbaar is. Het is niet duidelijk welke additionele factoren hierbij een rol spelen, mogelijk is onvoldoende ‘clearance’ van geretineerd slijm een oorzaak.
Chronisch obstructieve bronchitis en emfyseem zijn een belangrijke doodsoorzaak en ook nauw met roken verbonden. Rokers hebben veel granulocyten en macrofagen die proteases produceren. Deze proteolytische enzymen lossen het elastine van de alveoli op. Een zeer kleine groep patiënten heeft een deficiëntie van α1-antitrypsine (een stof die proteases) remt.
De FEV1 neemt normaliter jaarlijks af met 20 ml, bij rokers is deze afname versterkt tot 50 ml.
Bij emfyseem is de kenmerkende afwijking verwoesting van de alveolaire wand waardoor grote longblaasjes ontstaan. Pathofysiologisch is het voornaamste kenmerk een uitademingsstoornis op basis van drie factoren, nameliljk luchtwegvernauwing, dynamische compressie van de luchtwegen en een verminderde ‘elastic recoil’. De stoornis komt tot uiting in een relatieve en absolute daling van de FEV1. Bij dit ziektebeeld is er ventilatie-perfusiemismatch met shunting en dus een daling van de PO2 en een stijging van de PaCO2 door een toename van de alveolaire dode ruimte, met name als de patiënt te uitgeput is voor het optimale gebruik van de ademhalingsspieren.
Omdat de vernauwde luchtwegen eerder sluiten bij maximale expiratie stijgt het residuaire volume. Dyspnoe d’effort treedt op bij een FEV1 tussen 1.200 en 1.500 ml, bij een daling beneden 600 ml zijn de patiënten nauwelijks in staat om van een stoel naar het bed te gaan.
Fysische diagnostiek
Dyspnoe, hyperinflatie van de longen, zacht ademgeruis met een verlengde uitademing. De ademhaling kost veel energie, waardoor de patiënt snel uitgeput raakt.
Therapie
Een proefbehandeling met anticholinergica (omdat acetylcholine bij emfyseem de gladde spiercellen in de bronchuswand stimuleert), inhalatiecorticosteroïden en β2-agonisten wordt meestal gegeven om te zien of een deel van de uitademingsstoornis omkeerbaar is. Roken moet uiteraard worden gestopt. De frequente luchtweginfecties worden antibiotisch behandeld. Continue of intermitterende zuurstoftoediening verlengt de levensverwachting, maar is gecontraïndiceerd bij rokers (explosiegevaar). Een indicatie is een PaO2 < 55 mm Hg. Hoewel de vroeger bestaande vrees voor hypercapnie door het wegvallen van de hypoxemische ‘drive’ ongegrond blijkt, moeten wel de bloedgaswaarden regelmatig worden gecontroleerd.
3.5.2 Restrictieve stoornissen
Het kenmerk van deze ziekten is een verlaging van de longcapaciteit en een vermindering van het ventilerende oppervlak.
Pneumonie
Pneumonie is een ontsteking van de distale luchtwegen, de alveoli en het interstitium. Men onderscheidt pneumonie naar de verwekker, bijvoorbeeld bacterieel of viraal, naar de setting waarin deze optreedt, bijvoorbeeld aspiratie, en naar de lokalisatie, bijvoorbeeld lobaire of bronchopneumonie.
De twee belangrijkste elementen bij een pneumonie zijn infectie door micro-organismen en de individuele weerstand.
De voornaamste weg voor een infectie is door aspiratie van geïnfecteerd materiaal uit de neus-keelholte, dat daar terechtgekomen is door overbrenging van persoon op persoon door hoesten, niezen et cetera.
Het lichaam heeft verscheidene defensiemechanismen, zoals de activiteit van het trilhaar epitheel, de fagocytaire activiteit van alveolaire macrofagen en granulocyten en antilichamen in het bronchusslijmvlies (IgA).
Patiënten die na operatie naar de intensivecareafdeling moeten, hebben een kans van 10% om een pneumonie te krijgen. Dit getal loopt op tot 20% voor mensen die geïntubeerd moeten worden. De mortaliteit hiervan kan tot 50% bedragen, namelijk als het hier een infectie betreft met gramnegatieve staven, zoals Pseudomonas aeruginosa of Aerobacter aerogenes. Deze bacteriën komen veel voor bij patiënten die al uitgebreid met antibiotica zijn behandeld. Vooral op een intensivecareafdeling zijn zeer virulente bacteriën aanwezig.
Fysiche diagnostiek
Op basis van een thoraxfoto (in twee richtingen) kan vaak al iets gezegd worden over de aard van de pneumonie. Wanneer een homogeen infiltraat de lijnen van een longkwab of een segment volgt, is er meestal een lobaire pneumonie. Deze wordt vaak door bacteriën van het type Streptococcus pneumoniae, Klebsiella of Haemofilus influenzae veroorzaakt.
Als de infiltraten een meer vlekkig en verspreid karakter hebben, spreekt men van bronchopneumonie. Deze wordt door talrijke bacteriën en virussen veroorzaakt, evenals de bescheiden pneumonie die kan optreden bij de eerste infectie met Mycobacterium tuberculosis en die vroeger Frühinfiltrat werd genoemd. Legionella (veteranenziekte) en Pneumocystis carinii (bij hiv-geïnfecteerden) kunnen allerlei röntgenbeelden veroorzaken, terwijl het zeer lastig kan zijn om andere ziektebeelden zoals longoedeem, ARDS en interstitiële longziekten van pneumonie te onderscheiden.
Hypoxie kan optreden door shunting, maar hypercapnie is in ongecompliceerde gevallen zeldzaam.
Het klinische beeld is extreem variabel. Een gewoonlijk gezonde persoon met een pneumonie kan zich presenteren met de bekende verschijnselen van koorts, pleuritische pijn bij zuchten en productieve hoest. Bij een bejaarde patiënt met meerdere ziekten kan verwardheid op de voorgrond staan en worden er bij auscultatie alleen hier en daar rhonchi gehoord.
Therapie
De therapie is gericht op het uitschakelen van de verwekker(s), correctie van de bloedgassen en behandeling van eventuele comorbiditeit. Bij bejaarden kan het soms erg moeilijk zijn om sputum voor kweek te verkrijgen. Een fiberbronchoscopie kan dan uitkomst bieden.
Longembolie
Longembolie ontstaat doordat trombi in perifere venen losschieten en via de circulatie naar de longen worden gebracht. Het betreft hier vooral trombi uit de diepe venen van de dijbenen en de onderste extremiteiten, soms het bekken. Niet zelden klonteren trombi samen in het rechter atrium (bij boezemfibrilleren) waarna zij in kleine fragmenten longembolieën veroorzaken (zogenoemde ‘pluie des embolies’).
Longembolieën verstoppen takken van de arteriële longcirculatie, maar zelden ontstaat een longinfarct doordat de nabijheid van de gaswisselingseenheden en de bronchiale circulatie echte necrose voorkomt.
Zonder profylactische antistollingstherapie kan zich bij 1% van de postoperatieve patiënten ouder dan veertig jaar longembolie ontwikkelen, maar na orthopedische operaties stijgt dit tot 10%, vooral na knie-en heupoperaties. Ook in het kraambed is er een verhoogd risico, vooral na keizersnede.
Een derde van alle longembolieën is dodelijk, veelal binnen een uur na de eerste verschijnselen. De sterfte neemt beduidend af bij profylactische antistolling .
De verstopping van de longvaten leidt tot een toename van de alveolaire dode ruimte, maar de hyperventilatie die ontstaat kan hiermee niet volledig worden verklaard, omdat de pCO2 naar verhouding vaak zeer sterk verlaagd is. De hyperventilatie komt waarschijnlijk door rekkingreceptoren in het longparenchym in het geëmboliseerde gebied. Hyperventilatie is een kenmerkend verschijnsel dat ook optreedt bij normale saturatie. Wanneer er hypoxie ontstaat, is deze een gevolg van shunting op basis van bijkomende atelectase en longoedeem.
Longembolie is de belangrijkste oorzaak van acute pulmonale hypertensie. Deze ontstaat door blokkade van het vaatbed en vasoconstrictie. Bij obstructie tussen 50 en 75% kan de longdruk tot 40 mm Hg stijgen. Er is dan kans op het ontstaan van acuut cor pulmonale.
Fysische diagnostiek
De diagnose aan het bed is buitengewoon moeilijk, er zijn geen duidelijke kenmerkende verschijnselen. De meeste symptomen worden ook bij andere ziektebeelden gezien. Een plotseling versnelde ademhaling zonder begeleidende andere verschijnselen moet doen denken aan longembolie. Als er sprake is van pijn op de borst en soms pleurapijn, wordt het beeld al duidelijker. Dat is echter zeldzaam, evenals hemoptoë.
Eigenlijk zijn alleen beeldvormende technieken als arteriografie, spiraal-CT en een ventilatie-perfusiescan in staat om de nodige helderheid te verschaffen, maar deze zijn vaak bij deze ernstig zieke mensen niet goed uitvoerbaar. De bloedgasanalyse levert echter belangrijke informatie: PaO2 en PaCO2 zijn beide verlaagd.
Pneumothorax
Dit is een accumulatie van gas (lucht) in de pleuraholte. Men onderscheidt primaire en secundaire pneumothorax. De fysisch-diagnostische verschijnselen zijn gewoonlijk duidelijk, maar een enkele keer moeilijk vast te stellen als de patiënt slechts oppervlakkig ademt. Een thoraxfoto moet altijd ook een opname in expiratie omvatten. Er wordt onderscheid gemaakt tussen:
primaire pneumothorax . Deze ontstaat bij gezonde jonge mensen, meestal mannen, door knappen van een subpleurale bulla in de longtop, rechts meer dan links. Wanneer het lek als een ventiel werkt, kan een spanningspneumothorax ontstaan waardoor de circulatie in het gedrang komt en zich heftige dyspnoe ontwikkelt. Als de pneumothorax meer dan de helft van de hemithorax beslaat, moet deze worden afgezogen via een thoraxdrain die uitkomt onder een waterslot. Bij een spanningspneumothorax moet in de acute situatie soms een injectienaald tussen de ribben worden gestoken om de overdruk af te laten lopen tijdens uitademing;
secundaire pneumothorax ontstaat als complicatie bij andere longziekten (vooral astma en emfyseem) en door trauma. De behandeling van pneumothorax bij deze patiënten dient agressief te zijn, omdat zij weinig ventilatoire reserves hebben. Dit geldt temeer voor patiënten die beademd worden en een spanningspneumothorax krijgen. Een belangrijke oorzaak wordt gevormd door het inbrengen van centrale lijnen. Daarom moet na deze ingreep altijd een thoraxfoto worden gemaakt, maar soms ontstaat de pneumothorax toch vele uren later. Als een pneumothorax recidiveert, kan de laesie met talk worden geplakt.
Hematothorax
Dit komt nogal eens voor na verkeersongevallen, maar kan ook het gevolg zijn van uitzaaiingen in de pleura, bijvoorbeeld bij een gemetastaseerd mammacarcinoom. Het bloed stolt niet en kan gemakkelijk worden afgezogen.
Adult respiratory-distress syndrome (ARDS)
Dit ernstige ziektebeeld komt vaak voor binnen het kader van septische shock, waarbij de afwijkingen in de longen in grote trekken gelijk zijn aan die op andere plaatsen in het lichaam. De klinische kenmerken van ARDS zijn:
dubbelzijdige infiltraten op de röntgenopnamen van de thorax;
afwezigheid van een verhoogde druk in het linker atrium, die tot uitdrukking komt in een normale wiggedruk van < 18 mm Hg;
de ernst van de intrapulmonaire shunting wordt tegenwoordig op de intensivecareafdeling afgeleid uit de verhouding tussen de PaO2 en de FiO2. Bij ARDS is de PaO2 / FiO2 < 200, in milder verlopende situaties wat groter. Dat betekent dat een patiënt met een PaO2 van 60 mm Hg bij een FiO2 van 0,30 een ratio heeft van 60/0,30 = 180 en dus aan dit criterium voldoet.
De afwijkingen in de longen lijken sterk op de veranderingen in de microcirculatie die op talrijke plaatsen in het lichaam bij sepsis worden aangetroffen. Het gaat hierbij vooral om een tweetal processen:
er is een sterke productie van cytokines en cytotoxische enzymen die het vaatwandendotheel beschadigen. Daardoor verlaat eiwitrijke vloeistof de bloedbaan en komt vervolgens in de omliggende weefsels terecht. Hierdoor daalt de colloïdosmotische druk en ontstaan hypovolemie en oedeem;
-
door het beschadigde endotheel wordt weefseltromboplastine geactiveerd waardoor de stollingscascade in gang wordt gezet. Daardoor ontstaat een zogenoemde consumptiecoagulopathie omdat de stollingsfactoren worden opgebruikt: de patiënt gaat bloeden.
In de longen gebeurt hetzelfde: het alveolocapillaire membraan wordt vernield en er komt eiwitrijke vloeistof in de alveoli. Hoewel de EP2-cellen iets resistenter zijn tegen deze aanslagen, neemt ook de productie van de surfactant af. Alveoli collaberen, de long wordt stijver en heeft dus een verlaagde compliance, terwijl de VA-Qc-mismatch aanzienlijk toeneemt.
Vaak ontwikkelt zich bij de patiënt die dit overleeft longfibrose.
Hoewel sepsis als oorzaak op de eerste plaats komt, zijn er nog tal van andere oorzaken. Algemeen wordt verondersteld dat de pathofysiologie van ARDS een meer algemene reactie is op een acuut en ernstig trauma. Deze traumata kunnen van velerlei aard zijn, de reactie is in grote trekken hetzelfde. Comorbiditeit, dus de aanwezigheid van een of meer andere, vaak chronische ziekten, is hierbij natuurlijk van groot belang.
Tot de andere frequente oorzaken behoren pneumonie, pancreatitis, incompatibele bloedtransfusie, uitgebreide traumata, vetembolie en brandwonden.
Recentelijk zijn mensen geïnfecteerd met het influenza-A-vogelgriepvirus type H5N1. Een dergelijk virus veroorzaakte de grote pandemie van 1918 waaraan 21 miljoen mensen zijn overleden. Bij een aantal patiënten ontwikkelde zich ARDS. Het virus heeft twee kenmerken:
antigene drift: een veranderde genetische samenstelling;
antigene shift: het kan zich mengen met een voor mensen besmettelijk influenzavirus. Dat is theoretisch mogelijk als iemand tegelijk door beide virussen wordt geïnfecteerd. Er kan dan een virus ontstaan met de eigenschappen van beide virussen; het wordt van mens op mens overdraagbaar.
Er zijn twee virusremmers die het beloop kunnen mitigeren, waaronder oseltamivir (Tamiflu). De meeste regeringen hebben voorraden van deze virusremmers aangelegd.
De behandeling is primair gericht op verbetering van de PaO2 waarvoor bijna altijd beademing noodzakelijk is. Daarbij wordt gestreefd naar een PaO2 van 60 mm Hg. Gewaarschuwd wordt voor een FIO2 van > 0,50 omdat deze collaps van alveoli zou kunnen veroorzaken. Ook hoge tidale volumes zijn gevaarlijk vanwege de kans op overrekking van deze gaswisselingseenheden.


