Résumé
Nous rapportons le cas d’un nourrisson de 3 mois hospitalisé pour une bronchiolite. Les troubles respiratoires s’étaient aggravés en 48 heures et compliqués d’un état de choc. L’association d’une tachycardie, d’une cardiomégalie et d’une acidose à prédominance métabolique évoquait en premier lieu un choc cardiogénique. L’échocardiographie montrait une défaillance ventriculaire gauche sévère et l’électrocardiogramme mettait en évidence une tachycardie atriale rapide et irrégulière d’aspect chaotique. La recherche étiologique identifiait un coronavirus NL63 dans les aspirations naso-pharyngées, pouvant être à l’origine du trouble du rythme ou d’une atteinte myocardique. L’évolution était favorable en une dizaine de jours après une prise en charge en unité de réanimation comprenant un traitement diurétique (furosémide), anti-arythmique (amiodarone et digoxine) et inotrope (association milrinone–lévosimendan), associé à une ventilation mécanique. Le rythme et la fonction cardiaques s’étaient normalisés à la sortie d’hospitalisation.
Summary
We report the case of a 3-month-old boy hospitalized with acute bronchiolitis. Respiratory distress was associated with cardiogenic shock caused by chaotic atrial tachycardia. The cause of bronchiolitis was a coronavirus NL63 viral infection, confirmed in nasopharyngeal aspirations. The patient required intensive care including diuretics (furosemide), anti-arrhythmic drugs (amiodarone and digoxin), and inotropic drugs (milrinone and levosimendan) associated with mechanical ventilation. The outcome was favorable in 10 days and the sinusal cardiac rhythm was completely restored at discharge.
1. Introduction
Les troubles respiratoires du nourrisson observés au cours des épidémies virales saisonnières sont le plus souvent la conséquence d’une atteinte bronchique ou parenchymateuse pulmonaire. Ils sont plus rarement dus à une insuffisance cardiaque. La recherche de signes d’insuffisance circulatoire, d’une hépatomégalie et de crépitants à l’auscultation pulmonaire permet cependant de repérer les enfants ayant une atteinte cardiaque. La présence d’une tachycardie supérieure à 200/min évoque, soit une insuffisance, soit un trouble du rythme cardiaque. Nous rapportons le cas d’un nourrisson de 3 mois hospitalisé pour un choc cardiogénique et une tachycardie atriale chaotique chez lequel un coronavirus était identifié dans les voies respiratoires.
2. Observation
Ce nourrisson de 3 mois avait été hospitalisé au début de l’automne pour un tableau de bronchiolite aiguë évoluant depuis 48 h. Il était issu d’une grossesse triple et était né à 35 semaines d’aménorrhée, avec un poids de naissance à 2475 g. Durant la période néonatale, il avait présenté une insuffisance respiratoire nécessitant une ventilation mécanique invasive pendant les 48 premières heures de vie. L’évolution clinique de l’enfant dans les 48 h suivant son admission avait été marquée par une majoration de la détresse respiratoire avec une polypnée à 75 c/min et des signes de lutte, par une détérioration hémodynamique et des accès de tachycardie entre 180 et 200 c/min, justifiant son transfert en service de réanimation pédiatrique pour mise en place d’un support ventilatoire. L’enfant était en état de choc avec une tachycardie à 220 c/min, des marbrures généralisées, un temps de recoloration cutanée allongé et une pression artérielle conservée (71/45 mmHg avec une pression artérielle moyenne à 51 mmHg). Le reste de l’examen notait une polypnée à 70/min, un balancement thoraco-abdominal, un tirage intercostal, un battement des ailes du nez et un débord hépatique de 3 cm. La saturation pulsée en oxygène était à 95 % sous 27 % d’oxygène en ventilation non invasive et l’auscultation pulmonaire notait des crépitants bilatéraux. La mesure des gaz du sang capillaire mettait en évidence une acidose métabolique avec un potentiel hydrogène (pH) à 7,28, une capnie à 34,3 mmHg et des bicarbonates à 15,9 mmol/L avec une lactatémie à 6,9 mmol/L. L’ionogramme sanguin était sans particularité. Les globules blancs étaient à 12 G/L (polynucléaires neutrophiles à 6,64 G/L), la protéine C-réactive sérique à moins de 3 mg/L, le TP à 44 % et le fibrinogène à 2,38 g/L. L’électrocardiogramme (ECG) réalisé à l‘entrée authentifiait une tachycardie atriale chaotique caractérisée par une activité auriculaire très rapide variable avec une onde P présentant au moins 3 morphologies différentes et une cadence ventriculaire entre 200 et 250/min. Des accès de tachycardie régulière en rapport avec un flutter auriculaire étaient aussi observés (fig. 1) . La radiographie du thorax mettait en évidence une cardiomégalie avec un rapport cardiothoracique à 0,71 (fig. 2) et une surcharge pulmonaire. L’échographie cardiaque montrait une altération de la contractilité avec une fraction de raccourcissement à 15 % (normale entre 28 et 40 %) et une fraction d’éjection à 35 % (normale entre 55 et 75 %) associée à une dilatation importante des cavités gauches avec un diamètre télédiastolique du ventricule gauche mesuré à 34 mm (Z score à +4,43) [1].
Figure 1.
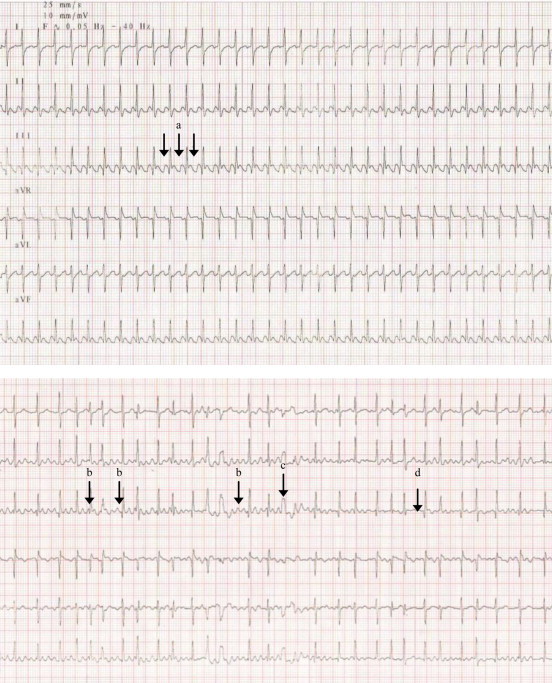
Électrocardiogramme montrant en haut un aspect de flutter auriculaire (a) 1/1 à 300/min et en bas un aspect de tachycardie atriale chaotique comportant des ondes P de morphologies différentes (b) avec aberrations ventriculaires (c) et complexes sinusaux (d).
Figure 2.
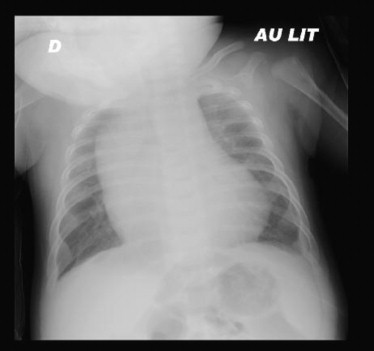
Radiographie du thorax montrant une cardiomégalie (index cardiothoracique à 0,71) et un œdème pulmonaire.
Un traitement diurétique par furosémide par voie intraveineuse était instauré devant les signes de précharge élevée. L’état de choc cardiogénique était traité par inotropes et anti-arythmiques associés à une ventilation mécanique invasive. Les inotropes utilisés étaient la milrinone jusqu’à 0,6 γ/kg/min associée au lévosimendan (0,2 γ/kg/min pendant 24 h). Les constantes de ventilation mécanique initiale étaient, en mode pression contrôlée, une pression d’insufflation de 28 mmHg, une fréquence machine de 50/min, une pression expiratoire positive (PEEP) de 5 mmHg et une fraction en oxygène des gaz inspirés (FiO2) de 100 %. Le trouble du rythme était réduit progressivement après une semaine de traitement par amiodarone per os et par digoxine. Le brain natriuretic peptide (BNP) mesuré initialement à 4069 ng/L diminuait à 914 ng/L après 48 h de traitement médical. L’extubation était possible au bout de 7 j et l’arrêt du support inotrope après 9 j, relayé par captopril per os. Les examens virologiques à visée étiologique ne mettaient pas en évidence le virus respiratoire syncitial (VRS) dans les aspirations nasopharyngées mais un coronavirus NL63. L’échographie cardiaque réalisée avant la sortie montrait une récupération de la fonction du ventricule gauche avec une fraction d’éjection à 61 % et une fraction de raccourcissement à 32 %. Le diamètre télédiastolique du ventricule gauche était encore augmenté à 27 mm (Z score à +2,13).
3. Discussion
Cette observation illustre la difficulté d’établir le diagnostic d’une atteinte cardiaque au cours d’un épisode de bronchiolite aiguë du nourrisson en pleine période épidémique. Une tachycardie à plus de 200 c/min ne résulte pas en général d’une détresse respiratoire isolée et doit toujours faire rechercher une cardiopathie associée. L’ECG et la radiographie du thorax ont toute leur place pour la recherche d’une atteinte myocardique ou d’un trouble du rythme. L’échographie cardiaque permet d’éliminer une cardiopathie congénitale sous-jacente et d’évaluer la fonction cardiaque. La découverte d’une myocardiopathie dilatée fait envisager plusieurs diagnostics : myocardite aiguë virale, myocardiopathie dilatée d’autre origine préexistante, myocardiopathie secondaire à un trouble du rythme. La tachycardie atriale chaotique est la plus rare des tachycardies supraventriculaires en pédiatrie (0,2 % des arythmies pédiatriques) [2]. Elle survient le plus souvent chez les nouveau-nés ou dans les premiers mois de vie et disparaît au cours de la première année [3]. Ce trouble du rythme est caractérisé par une activité auriculaire multifocale très instable avec de nombreuses extrasystoles auriculaires, des accès de fibrillation auriculaire très rapide, des alternances de rythme auriculaire rapide avec le rythme sinusal et parfois des épisodes de flutter. La tachycardie atriale chaotique comme toute tachyarythmie peut entraîner une diminution du débit cardiaque en raccourcissant le temps de remplissage et affecter la perfusion myocardique. La tachycardie atriale chaotique survient rarement chez des enfants atteints d’une cardiopathie congénitale [4] ou après chirurgie [5].
Dans le cas présent, la tachycardie atriale chaotique a possiblement été déclenchée par l’infection virale à coronavirus NL63. Si son rôle pathogène est actuellement bien défini dans les infections à tropisme respiratoire, on ne peut éliminer son influence dans la genèse du trouble du rythme ou de la myocardite même si le rôle du coronavirus NL63 dans la maladie de Kawasaki semble peu probable [6], [7]. Le VRS peut aussi être la cause de troubles du rythme même si peu de cas ont été décrits [8].
Le traitement du choc cardiogénique dû à une tachycardie consiste à réduire au plus vite ce trouble du rythme. En cas de tachycardie atriale chaotique, le choc électrique externe est inefficace et la réponse aux médicaments anti-arythmiques est lente et retardée [9]. Les agents anti-arythmiques les plus utilisés dans ce cas sont l’amiodarone et la digoxine, plus rarement un agent anti-arythmique de la classe IC type flécaïnide, contre-indiqué si la fonction ventriculaire est altérée [10]. Si le trouble du rythme est résistant aux thérapeutiques médicamenteuses, il convient de prendre en charge le choc cardiogénique par des diurétiques par voie intraveineuse (furosémide 1–2 mg/kg/j), par des inotropes peu tachycardisants du type inhibiteurs des phosphodiestérases de type 3 (milrinone), et par une ventilation non invasive avec une pression expiratoire positive afin de diminuer la post-charge du ventricule gauche, voire par une ventilation mécanique invasive pour diminuer le travail cardiaque [11]. En cas de choc cardiogénique réfractaire malgré les premières mesures, une assistance circulatoire extracorporelle peut être indispensable tant que le trouble du rythme persiste. L’alternative choisie dans notre cas devant l’absence d’amélioration initiale et la persistance de l’insuffisance circulatoire aiguë avait été l’adjonction d’un autre inotrope : le lévosimendan qui sensibilise la troponine au calcium et améliore la contractilité du myocarde sans augmenter la consommation en oxygène [12]. Ce médicament est administré par voie veineuse continue pendant 24 heures, sans dose de charge, limitant ainsi le risque d’hypotension. Sa durée d’action est de 7 à 10 j ce qui avait probablement permis une récupération progressive de la fonction cardiaque en attendant la réduction complète de la tachycardie grâce à l’utilisation conjointe du traitement anti-arythmique.
4. Conclusion
La survenue d’une tachycardie atriale chaotique compliquée de choc cardiogénique au cours de l’évolution d’une bronchiolite aiguë virale est une situation exceptionnelle. La prise en charge intensive avec diurétiques, inotropes et ventilation mécanique permet de restaurer une hémodynamique stable avant la réduction plus tardive du trouble du rythme. Le mécanisme exact du déclenchement de la tachycardie atriale au cours de l’infection virale reste mal connu.
Déclaration d’intérêts
Les auteurs déclarent ne pas avoir de conflits d’intérêts en relation avec cet article.
Financement : aucun.
Références
- 1.Pettersen M.D., Du W., Skeens M.E. Regression equations for calculation of Z scores of cardiac structures in a large cohort of healthy infants, children, and adolescents: an echocardiographic study. J Am Soc Echocardiogr. 2008;21:922–934. doi: 10.1016/j.echo.2008.02.006. [DOI] [PubMed] [Google Scholar]
- 2.Salim M.A., Case C.L., Gillette P.C. Chaotic atrial tachycardia in children. Am Heart J. 1995;129:831–833. doi: 10.1016/0002-8703(95)90339-9. [DOI] [PubMed] [Google Scholar]
- 3.Salame E., Osta H., Antonios S. La tachycardie atriale chaotique compliquée de cardiomyopathie : à propos d’un cas insolite. Ann Cardiol Angeiol (Paris) 2005;54:292–295. doi: 10.1016/j.ancard.2005.04.009. [DOI] [PubMed] [Google Scholar]
- 4.Bouziri A., Khaldi A., Hamdi A. Multifocal atrial tachycardia: an unusual cause of cardiogenic shock in a newborn. Tunis Med. 2011;89:59–61. [PubMed] [Google Scholar]
- 5.Bisset G.S., 3rd., Seigel S.F., Gaum W.E. Chaotic atrial tachycardia in childhood. Am Heart J. 1981;101:268–272. doi: 10.1016/0002-8703(81)90189-7. [DOI] [PubMed] [Google Scholar]
- 6.Vabret A., Dina J., Brison E. Coronavirus humains. Pathol Biol (Paris) 2009;57:149–160. doi: 10.1016/j.patbio.2008.02.018. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Lehmann C., Klar R., Lindner J. Kawasaki disease lacks association with human coronavirus NL63 and human bocavirus. Pediatr Infect Dis. 2009;28:553–554. doi: 10.1097/inf.0b013e31819f41b6. [DOI] [PubMed] [Google Scholar]
- 8.Thomas J.A., Raroque S., Scott W.A. Successful treatment of severe dysrhythmias in infants with respiratory syncytial virus infections: two cases and a literature review. Crit Care Med. 1997;25:880–886. doi: 10.1097/00003246-199705000-00027. [DOI] [PubMed] [Google Scholar]
- 9.Fish F.A., Mehta A.V., Johns J.A. Characteristics and management of chaotic atrial tachycardia of infancy. Am J Cardiol. 1996;78:1052–1055. doi: 10.1016/s0002-9149(96)00536-x. [DOI] [PubMed] [Google Scholar]
- 10.Dodo H., Gow R.M., Hamilton R.M. Chaotic atrial rhythm in children. Am Heart J. 1995;129:990–995. doi: 10.1016/0002-8703(95)90121-3. [DOI] [PubMed] [Google Scholar]
- 11.Biarent D., Bourdages M., Berner M. Choc cardiogénique. In: Lacroix J., Gauthier M., Hubert P., Leclerc F., Gaudreault P., editors. Urgences et soins intensifs pédiatriques. Éditions du CHU Sainte-Justine ; Masson; Montréal: 2007. [Google Scholar]
- 12.De Luca L., Colucci W.S., Nieminen M.S. Evidence-based use of levosimendan in different clinical settings. Eur Heart J. 2006;27:1908–1920. doi: 10.1093/eurheartj/ehi875. [DOI] [PubMed] [Google Scholar]


