Résumé
Les coronavirus humains sont des virus enveloppés à ARN de la famille des Coronaviridae avec deux sérogroupes identifiés : 229-E et OC-43. Ces virus possèdent le plus grand ARN viral connu. Ce génome est un ARN simple brin positif associé à une protéine phosphorylée de la nucléocapside, la protéine N. L’enveloppe des coronavirus humains contient deux ou trois glycoprotéines membranaires : S ou spike protein, M ou protéine de membrane et HE ou hémagglutine-estérase. Le rôle pathogène de ces virus est mal connu en raison des difficultés diagnostiques. Cependant la mise au point de l’immunofluorescence avec anticorps monoclonaux et des techniques d’amplification génique permet de nouvelles recherches épidémiologiques. Les coronavirus peuvent survivre jusqu’à six jours en suspension et trois heures après séchage, ce qui suggère un rôle nosocomial potentiel. Deux études prospectives réalisées dans une unité de réanimation néonatale et pédiatrique ont révélé une relation significative entre l’existence de prélèvement nasopharyngés positifs et la survenue de symptômes respiratoires. Des prélèvements positifs chez le personnel suggèrent une contamination patient-personnel ou personnel–patient. En raison de leur survie possible sur les surfaces et de l’efficacité démontrée des agents désinfectants, des mesures universelles de prévention associant lavage des mains et désinfection des surfaces peuvent être proposées.
Mots-clé: infection nosocomiale, coronavirus, nouveau-né
Abstract
Human coronaviruses, with two known serogroups named 229-E and OC-43, are enveloped positive-stranded RNA viruses. The large RNA is surrounded by a nucleoprotein (protein N). The envelop contains 2 or 3 glycoproteins: spike protein (or protein S), matrix protein (or protein M) and a hemagglutinin (or protein HE). Their pathogen role remains unclear because their isolation is difficult. Reliable and rapid methods as immunofluorescence with monoclonal antibodies and reverse transcription-polymerase chain reaction allow new researches on epidemiology. Human coronaviruses can survive for as long as 6 days in suspension and 3 hours after drying on surfaces, suggesting that they could be a source of hospital-acquired infections. Two prospective studies conducted in a neonatal and paediatric intensive care unit demonstrated a significant association of coronavirus-positive naso-pharyngal samples with respiratory illness in hospitalised preterm neonates. Positive samples from staff suggested either a patient-to-staff or a staff-to-patient transmission. No cross-infection were observed from community-acquired respiratory-syncitial virus or influenza-infected children to neonates. Universal precautions with hand washing and surface desinfection could be proposed to prevent coronavirus transmission.
Keywords: cross infection; infant, newborn; coronavirus
Les infections nosocomiales représentent un problème important de santé publique en raison de leurs conséquences médicales et économiques. La fréquence des infections d’origine virale est habituellement évaluée à 5 % de l’ensemble des infections nosocomiales, avec un tropisme essentiellement pulmonaire et digestif. Dans les hôpitaux pédiatriques, ces infections virales respiratoires se rencontrent avec prédilection en période épidémique, avec une incidence pouvant atteindre 23 à 35 % des infections nosocomiales 1, 2, 3.
Les facteurs de risque de survenue d’une infection respiratoire virale sévère sont le jeune âge (inférieur à 3 mois), les antécédents de prématurité, l’existence d’une pathologie chronique respiratoire (dysplasie bronchopulmonaire par exemple) ou cardiaque ou d’un déficit immunitaire. Les nouveau-nés hospitalisés dans les unités de médecine néonatale présentent un ou plusieurs de ces facteurs de risque. Cependant, la fréquence, le type, et les conséquences des infections virales respiratoires survenant dans les unités de néonatalogie sont mal connus. Seules des descriptions ponctuelles d’épidémies sont disponibles dans la littérature 4, 5.
Les agents pathogènes les plus fréquemment incriminés sont le virus respiratoire syncytial (VRS), les virus Influenza et Parainfluenza, l’adénovirus et les rhinovirus 〚1〛. Des recherches récentes évoquent également la responsabilité potentielle des coronavirus humains (HCoV) dans la survenue d’infections virales respiratoires chez le nouveau-né prématuré 〚6〛. Le pouvoir pathogène réel des HCoV reste cependant mal connu.
Virologie
Isolés pour la première fois en 1965–1967 7, 8, 9 chez des patients atteints de rhinite, les coronavirus humains sont des virus enveloppés à ARN de la famille des Coronaviridae, leur appartenance aux Coronaviridae étant basée sur leur morphologie, l’organisation de leur génome (homologie des séquences nucléotidiques et propriétés des protéines structurales), et leur stratégie de réplication et de maturation. Il existe de nombreux coronavirus animaux bien connus en médecine vétérinaire (bovine coronavirus, feline enteric coronavirus, mouse hepatitis virus…) 〚10〛. Seuls deux sérogroupes humains ont été identifiés : 229-E 〚8〛 et OC-43 〚9〛.
Les HCoV ont un aspect arrondi de 100 à 160 nm de diamètre, avec en surface des péplomères d’une longueur de 20 nm en forme de massue correspondant à des glycoprotéines de surface (telle que la glycoprotéine S). Ces péplomères sont à l’origine de l’aspect caractéristique en couronne noté en microscopie électronique (figure 1) . Les HCoV possèdent le plus grand ARN viral connu, d’une taille de 27 à 32 kb ; ce génome est un ARN simple brin positif associé à une protéine phosphorylée de la nucléocapside, la protéine N 10, 11. Leur enveloppe contient deux ou trois glycoprotéines membranaires (figure 2) : S, M et HE, cette dernière étant spécifique du sérogroupe II (dont le HCoV OC-43). La protéine S ou spike protein est une protéine multifonctionnelle jouant un rôle complexe dans la pathogénie des infections à coronavirus : liaison à des récepteurs cellulaires spécifiques de la cellule hôte, fusion de l’enveloppe virale et de la membrane cellulaire, induction de la production d’anticorps neutralisants. La protéine de membrane ou protéine M possède un domaine cytoplasmique qui interagirait avec la nucléocapside virale 〚12〛.
Figure 1.
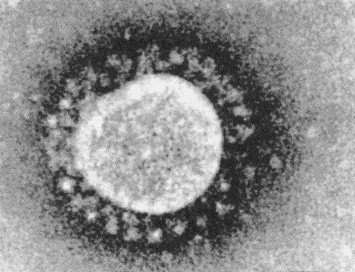
Aspect du coronavirus humain OC43 en microscopie électronique (cliché P.J. Talbot, INRS-Institut Armand-Frappier, Canada).
Figure 2.
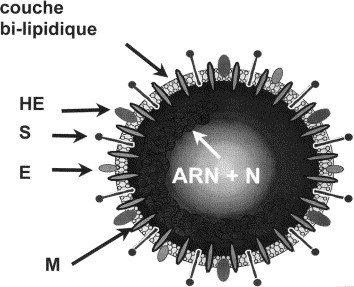
Structure des coronavirus. N : protéine de la nucléocapside. Glycoprotéines membranaires : S : spike protein ou protéine de surface ; M : protéine de membrane ; E : petite protéine d’enveloppe ; HE : hémagglutine-estérase.
Méthodes diagnostiques
Si certaines souches de HCoV sélectionnées en laboratoire peuvent être cultivées sur des lignées cellulaires spécifiques (human embryonic lung fibroblast L132, human rectal tumor HRT-18), en revanche la culture n’est pas possible sur les lignées cellulaires utilisées en routine pour le diagnostic des infections respiratoires virales 〚10〛. Les techniques sérologiques, principalement basées sur l’Elisa, ont été utilisées dans des études pédiatriques déjà anciennes 〚13〛. Cependant, ces méthodes manquent de sensibilité et sont peu utiles pour le diagnostic d’infections respiratoires car nécessitant deux prélèvements sanguins successifs.
L’immunofluorescence est la méthode de référence pour le diagnostic des infections virales respiratoires en raison de sa simplicité, de sa rapidité et de son coût. Mettant en évidence les particules virales dans la cellule du tractus respiratoire, elle permet de s’assurer de la réalité de l’infection. Le seul anticorps monoclonal commercialisé (Argène, France) ne reconnaît que le groupe sérologique 229-E et n’est plus actuellement disponible. Sa sensibilité n’est pas précisée par le fabricant. La sensibilité et la spécificité de deux anticorps monoclonaux (5-11H6 pour 229-E et 1-10C1 pour OC-43) produits par hybridome au Centre de recherche INRS-Armand-Frappier (Laval, Québec) ont été testées sur un modèle expérimental d’infection cellulaire. Ils reconnaissent la protéine S de chaque sérogroupe considéré, et permettent la détection du virus en culture cellulaire pour une multiplicité d’infection (MOI) de 10-2 soit un titre infectieux en culture cellulaire (TCID 50/mL) de 10-4,25 pour 229-E et 10-2 pour OC-43 (figure 3) . Chacun de ces deux anticorps monoclonaux est spécifique du sérogroupe considéré et ne présente pas de faux positif pour les virus influenza, VRS et adénovirus 〚14〛.
Figure 3.
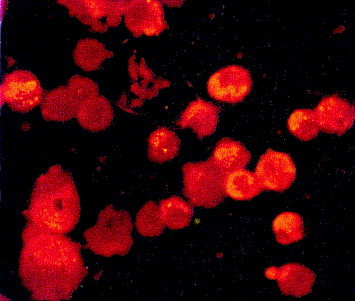
HCoV 229-E en immunofluorescence après culture sur lignées L132 (× 250). Cliché M.C. Legrand, virologie, Brest.
La microscopie électronique a été utilisée essentiellement pour l’étude des particules coronaviriformes (coronavirus-like particles) dans les prélèvements digestifs. De réalisation délicate, elle ne peut être utilisée en routine pour l’analyse de prélèvements d’origine respiratoire.
Les techniques de biologie moléculaire apparaissent prometteuses pour l’étude des agents pathogènes difficiles à mettre en évidence par les techniques usuelles tant en recherche fondamentale 〚15〛 que clinique 〚16〛. L’amplification de l’ARN par les techniques de RT-PCR permet ainsi la détection du génome viral en culture cellulaire pour une multiplicité d’infection (MOI) de 10-4 soit un titre infectieux en culture cellulaire (TCID50/mL) de 1,75 pour 229-E et 1,5 pour OC-43 (log PFU/mL = 2,3 pour HCoV 229-E et 1,34 pour OC-43) avec une bonne spécificité de groupe 〚14〛.
Il reste que la mise en évidence de matériel génomique viral dans un prélèvement de sécrétions respiratoires pose le difficile problème d’un lien de causalité avec des signes d’infection pulmonaire 〚16〛.
Épidémiologie
La majorité des études épidémiologiques concernant les HCoV sont basées sur la sérologie, et montrent la présence d’anticorps spécifique chez près de 100 % des adultes de plus de 30 ans, la prévalence variant cependant selon les pays et les techniques sérologiques utilisées 17, 18. Dans une étude de bassin de population réalisée en 1968–1969, Monto et al. rapportent une incidence d’infection récente de 29 % chez l’enfant âgé de moins de quatre ans, incidence diminuant progressivement avec l’âge (22 % chez l’adulte) 〚19〛. Les infections à HCoV surviennent essentiellement pendant l’hiver et le printemps, avec des variations de sérotypes suivant les années ce qui justifie la réalisation d’études longitudinales pluriannuelles. Les techniques sérologiques manquant de sensibilité, il est probable que la prévalence des infections à HCoV est sous-estimée 〚20〛. L’absence de réactifs commerciaux ne fait qu’amplifier cette situation.
Pouvoir pathogène chez l’enfant
Le pouvoir pathogène réel des HCoV est mal connu en raison des difficultés diagnostiques. D’autre part, la majorité des études publiées présentent des biais de recrutement importants. L’évaluation du rôle pathogène d’un agent infectieux repose sur des études en cohorte ou des comparaisons avec des groupes témoins 〚21〛. Dans une évaluation systématique de la littérature réalisée en 1999 selon la méthodologie préconisée par l’Agence nationale d’accréditation et d’évaluation en santé (ANAES), aucune étude pédiatrique publiée entre 1966 et 1999 ne présentait un niveau de preuve de grade III 〚22〛. Aucune de ces études ne permet d’affirmer la responsabilité des HCoV dans les pathologies observées, soit du fait de limites méthodologiques (études rétrospectives, absence de groupe témoins), soit par manque de puissance. Enfin la fréquence potentielle des coinfections virales rend difficile l’établissement du lien entre un agent pathogène et la survenue d’une maladie 〚23〛.
Le tropisme des HCoV est essentiellement respiratoire. Leur rôle dans la survenue d’une rhinite a été évoqué par leur mise en évidence dans les sécrétions nasales de sujets malades 〚5〛 et confirmé expérimentalement par inoculation intranasale chez des volontaires sains 〚20〛. En revanche, leur responsabilité dans la survenue d’une infection respiratoire basse est moins bien documentée, les résultats des différentes études publiées étant contradictoires. Dans une étude réalisée par immunofluorescence dans la région lyonnaise pendant l’hiver 1994–1995, Lina et al. ont mis en évidence une prévalence des infections communautaires à HCoV de 18,4 % chez les sujets consultant pour syndrome grippal ; la prévalence chez des sujets témoins asymptomatique n’a cependant pas été précisée 〚24〛. Le rôle déclenchant des infections respiratoires à HCoV dans la survenue d’une crise d’asthme ou d’une bronchite avec wheezing est diversement évalué selon les conditions d’inclusion (âge, type de recrutement, antécédents des patients) et les techniques virologiques utilisées 25, 26, 27. Le taux élevé de co-infections (20 % dans l’étude de Freymuth et al.) 〚26〛 ne permet pas de conclure de façon certaine à la responsabilité des HCoV. Le mécanisme d’atteinte respiratoire pourrait être, non pas une infection directe de l’arbre bronchique, mais une réaction en cascade impliquant les médiateurs de l’inflammation (cytokines…) comme cela a été évoqué pour le rhinovirus 〚28〛. Une étude a mis en évidence des HCoV par PCR sur produit de paracentèse chez des enfants atteints d’otite moyenne aiguë 〚29〛 ; aucune population témoin n’était cependant décrite.
Le tropisme digestif des HCoV a été essentiellement exploré par microscopie électronique, permettant la mise en évidence des particules virales Corona-like. Une étude a démontré l’isolement d’un coronavirus entérique 〚30〛. Le lien entre gastroentérite de l’enfant et HCoV est contesté, en raison de la fréquence importante des prélèvements positifs dans la population saine 〚31〛. Des observations isolées de pancréatite et de péricardites ont également été rapportées 〚32〛. La relation entre entérocolite du nouveau-né et HCoV est analysée plus loin.
Les coronavirus présenteraient également un tropisme neurologique évoqué par des résultats de recherche clinique (mise en évidence de matériel génomique viral dans le cerveau de patient atteint de sclérose en plaque) et expérimentale (infectabilité de lignées cellulaires cérébrales humaines par les HCoV) 33, 34, 35. Aucune donnée n’est cependant disponible chez l’enfant à l’exception d’observations isolées de méningite et de radiculite 〚32〛.
Mode de transmission et porte d’entrée
Les virus à tropisme respiratoire sont classiquement transmis selon trois mécanismes parfois associés : aérosols de particules aériennes de diamètre inférieur à 5 μ pouvant diffuser à distance (virus influenza), aérosols de particules aériennes de plus grande taille dont la transmission nécessite un contact étroit (VRS), transmission directe par les mains ou par l’intermédiaire de surfaces 〚36〛. Ijaz et al ont démontré la possibilité d’une survie des HCoV 229-E en aérosol pendant 86 heures sous certaines conditions d’hygrométrie et de température 〚37〛. Expérimentalement, les HCoV 229-E et OC-43 en suspension peuvent survivre à température ambiante jusqu’à 6 jours, avec une demi-vie de 5 jours dans le tampon PBS et deux à trois jours dans un milieu de culture. La survie après séchage sur une surface (compresse, gant chirurgical ou aluminium) est plus courte mais la contagiosité du 229-E est détectable pendant une période de 3 heures 〚38〛. La survie possible des HCoV en aérosol et en suspension plaide en faveur de la possibilité de transmission par particules aériennes et/ou par voie manuportée.
La porte d’entrée des HCoV dans l’organisme est nasale 〚20〛. Leur contamination par voie conjonctivale, démontrée pour le VRS, n’a pas été documentée.
Les coronavirus, agents d’infections nosocomiales ?
Travaux personnels
Observations d’apnées sévères du prématuré associées à une colonisation nasale par HCoV
En 1991, nous avons rapporté quatre cas d’infections respiratoires à HCoV chez des nouveau-nés prématurés hospitalisés en unité de réanimation pédiatrique polyvalente 〚39〛. Ces enfants présentaient des épisodes d’apnées sévères, de survenue brutale, résistant aux méthylxanthines, associés à des bradycardies, sans cause neurologique, digestive, ou cardiaque. Une ventilation assistée a été nécessaire dans deux cas. L’évolution a été spontanément favorable sous dix jours. Les prélèvements bactériologiques étaient négatifs. L’analyse des sécrétions nasopharyngées par immunofluorescence était négative pour l’adénovirus, le VRS et les virus Influenza et Parainfluenza, mais positive pour le HCoV 229-E (anticorps monoclonal Biosoft, Clonatec).
Étude prospective chez les nouveau-nés en unité de réanimation
Ceci nous a conduit à réaliser une étude prospective dans la même unité de réanimation sur une période de 18 mois comprenant deux hivers 〚40〛, chez les nouveau-nés d’âge gestationnel inférieur ou égal à 32 semaines et admis dans l’unité avant l’âge de trois jours. Un prélèvement nasal était fait par aspiration à l’admission puis de façon hebdomadaire. Les prélèvements étaient analysés par immunofluorescence indirecte avec une série d’anticorps monoclonaux (Clonatec, France) spécifiques des virus influenza A et B, Parainfluenza 1, 2 et 3, adénovirus, VRS et HCoV 229-E. Quarante enfants ont été inclus. Treize prélèvements se sont révélés positifs chez dix nouveau-nés : dix pour le HCoV 229-E, 2 pour le virus Influenza type A et un pour l’adénovirus. Aucun prélèvement n’était positif à l’admission. Tous les enfants infectés par le HCoV 229-E étaient symptomatiques à la date d’infection, avec une symptomatologie dominée par les apnées, les bradycardies et une distension abdominale. Le nombre de jours d’hospitalisation avec apnées, avec bradycardie, et avec oxygène, était plus important chez les enfants infectés par HCoV comparés aux enfants non infectés, sans que toutefois la différence soit statistiquement significative, peut être en raison de la petite taille des groupes ou de la dispersion des valeurs.
Étude de l’incidence des infections nosocomiales et communautaires à HCoV en unité de réanimation
L’infection nosocomiale symptomatique par HCoV semblait donc possible et non exceptionnelle. Cependant plusieurs points restaient à explorer :
-
•
ces résultats pouvaient-ils être confirmés par l’utilisation d’autres techniques diagnostiques notamment de PCR ?
-
•
Ces virus étaient-ils introduits dans l’unité de réanimation polyvalente par les personnels soignants ou par les nourrissons ou les enfants hospitalisés ?
-
•
L’épidémiologie était-elle variable en fonction des années ? Pour répondre à ces questions, nous avons entrepris à partir de novembre 1997 une nouvelle étude prospective. L’objectif était de déterminer l’incidence des infections nosocomiales et communautaires à HCoV chez les nouveau-nés (définis par un âge inférieur ou égal à 28 jours) et les enfants (âge > 28 jours) hospitalisés dans l’unité de réanimation, ainsi que la prévalence des infections respiratoires chez le personnel soignant. Tous les patients hospitalisés dans l’unité pendant l’hiver 1997–1998 (décembre 1997 à avril 1998) ont été inclus. Les prélèvements nasals faits à l’admission et de façon hebdomadaire ont été analysés par culture virale et immunofluorescence indirecte. Les cultures virales ont été réalisées sur lignées cellulaires MDCK, HEp-2 et MRC5, avec lecture de j2 à j10 suivant les lignées par immunofluorescence ou par recherche d’effet cytopathique. L’immunofluorescence a été réalisée avec les anticorps monoclonaux spécifiques pour les virus VRS, virus Influenza type A et B, Parainfluenza type 1, 2 et 3, et adénovirus (Argène, France), et avec des anticorps commerciaux (Argène, France) et les anticorps 5-11H6 pour 229-E et 1-10C1 pour OC-43 du Centre de recherche INRS-Armand-Frappier (Laval, Québec, Canada pour les HCoV) 〚14〛. Une infection communautaire était définie par un prélèvement positif à l’admission, et une infection nosocomiale par un prélèvement négatif à l’admission et positif ultérieurement. Des prélèvements nasals ont été réalisés chez le personnel médical et infirmier un jour par mois (point de prévalence) et analysés de façon anonyme.
Durant le premier hiver, 120 patients ont été inclus : 64 nouveau-nés et 56 enfants (âge moyen : 3,8 ans ; sex-ratio M/F : 1,6). Chez les 56 enfants, aucun cas d’infection virale nosocomiale n’a été mis en évidence. Par contre 15 prélèvements chez 13 enfants (deux coinfections) étaient positifs à l’admission, témoin d’une infection communautaire (incidence : 23 %) : sept VRS, cinq Influenza, et trois adénovirus (figure 4) . Chez les nouveau-nés, sept prélèvements ont été positifs durant l’hospitalisation, tous pour le HCoV (incidence des infections nosocomiales à HCoV chez les nouveau-nés : 11 %). Les nouveau-nés étaient tous symptomatiques au moment de l’infection (bradycardies, apnées ou augmentation des besoins en oxygène). Les facteurs de risque d’infection virale nosocomiale, en analyse univariée, étaient les durées d’hospitalisation, de traitement antibiotique, et de nutrition parentérale (tableau I) .
Figure 4.
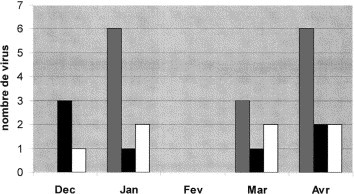
Répartition mensuelle du nombre de virus détectés chez les nouveau-nés (infections nosocomiales à HCcoV : colonnes noires), chez les enfants (infections communautaires à VRS, influenza et adénovirus : colonnes grises), et chez le personnel (infections à HCoV sauf le mois d’avril avec une infection grippale et une infection à HCoV : colonnes blanches). Il n’est pas trouvé de transmission croisée entre les infections communautaires chez les enfants et les infections nosocomiales chez les nouveau-nés. Par contre, à l’exception du mois de février (fév), des infections à HCoV sont détectées chez le personnel et les nouveau-nés en décembre (déc), janvier (jan), mars (mar), et avril (avr).
Tableau I.
Facteurs de risque d’IRVN à HCoV chez les nouveau-nés.
| HCoV+ (n = 7) | HCoV- (n = 57) | p | |
|---|---|---|---|
| Age gestationnel (SA) | 32,8 ± 6,1 | 33,9 ± 4,2 | ns |
| Poids de naissance (g) | 1895 ± 1320 | 2164 ± 920 | ns |
| Durée de ventilation (j) | 9,1 ± 7,9 | 4,9 ± 10,2 | 0,052 |
| Durée d’oxygénation (j) | 14 ± 13,4 | 7 ± 15,9 | ns |
| Durée de cathéter central (j) | 23,8 ± 23,8 | 9,1 ± 15,7 | < 0,01 |
| Durée de nutrition parentérale (j) | 26 ± 24,6 | 11,5 ± 17,5 | < 0,01 |
| Durée d’antibiothérapie (j) | 17,9 ± 15,7 | 5,1 ± 6,5 | < 0,001 |
| Durée d’hospitalisation (j) | 27,1 ± 24,4 | 12,8 ± 17,8 | < 0,01 |
ns : non significatif ; SA : semaines d’aménorrhée.
Chez le personnel, cinq points de prévalence ont été réalisés, incluant 19 à 24 soignants selon les mois. Un ou deux prélèvements ont été positifs à HCoV chaque mois, sauf le dernier mois de l’étude avec un prélèvement positif à Influenza également 〚41〛.
Les conclusions de l’analyse des premiers mois de cette étude sont les suivantes :
-
•
les infections respiratoires d’origine communautaire sont fréquentes chez les enfants hospitalisés en unité de réanimation, quel que soit le motif d’hospitalisation 〚42〛. Cependant, les virus incriminés, en particulier le VRS, ne paraissent pas transmis aux nouveau-nés hospitalisés dans la même unité ;
-
•
les infections des voies aériennes respiratoires par HCoV semblent fréquentes et sont généralement asymptomatiques chez le personnel soignant.
La réalité des infections nosocomiales par ces HCoV semble confirmée
Les prélèvements réalisés pendant les hivers 1998 et 1999 sont en cours d’analyse, notamment par de nouvelles techniques de RT-PCR. Ceci permettra également de mieux appréhender les variations épidémiologiques inter annuelles.
Données de la littérature
La responsabilité des HCoV dans la survenue d’infections nosocomiales digestives ou respiratoires chez l’enfant ou l’adulte a été rapportée par d’autres auteurs. Chez le nouveau-né, des particules virales coronaviriformes ont été mises en évidence par microscopie électronique chez des enfants présentant des diarrhées aiguës ainsi que chez des nouveau-nés à terme atteint d’entérocolite ulcéronécrosante 〚43〛. Vabret et al. ont trouvé 17 prélèvements positifs à HCoV 229-E dans l’analyse par immunofluorescence de 107 échantillons de lavages bronchoalvéolaires réalisés chez des sujets immunodéprimés ; l’utilisation de techniques d’amplification génique leur a ensuite permis de détecter la positivité de 7 prélèvements supplémentaires 〚44〛. Dans une étude prospective concernant des personnes âgées fréquentant un hôpital de jour, le HCoV 229-E apparaît comme un agent nosocomial non négligeable, responsable de 8 % des infections respiratoires 〚45〛.
Prévention
La connaissance de l’épidémiologie et des voies de transmission permettent de définir des mesures de préventions des infections nosocomiales. La prévention de la transmission des HCoV est identique à celle des VRS dans les services de néonatalogie 46, 47. En raison de leur survie prolongée possible sur différentes surfaces et de l’efficacité des agents antiseptiques habituels (alcool, eau de javel domestique, polyvidone iodée) 〚38〛, les mesures habituelles de prévention peuvent être proposées : lavage des mains et désinfection des surfaces. L’éviction du personnel soignant atteint d’affection aiguë du tractus respiratoire paraît difficile à mettre en œuvre et d’efficacité limitée en raison de la fréquence des porteurs sains. Le regroupement géographique des enfants atteints en « cohorte » n’a pas été validé.
Conclusion
Les données fondamentales disponibles et les données épidémiologiques suggèrent que les HCoV sont à l’origine d’infections nosocomiales respiratoires dans les services de néonatalogie. L’utilisation en diagnostic de routine de l’immunofluorescence avec anticorps monoclonaux spécifiques en cas de symptomatologie évocatrice (apnée, bradycardie) pourrait permettre de conforter cette hypothèse.
Cependant de nombreux aspects restent mal connus et justifient la réalisation de nouvelles études prospectives. Ces travaux à venir, de préférence multicentriques et pluriannuels, pourront préciser la prévalence et les conséquences à long terme en particulier sur la fonction pulmonaire. Le tropisme digestif, en particulier le lien avec l’entérocolite, méritera également d’être étudié.
Footnotes
Travail financé en partie par la Société française de pédiatrie (bourse de DEA), le ministère de la santé (PHRC 97) et le CCLIN–Ouest. A. Gagneur est boursier de la Société française de pédiatrie.
Références
- 1.Turner R.B. Nosocomial viral respiratory infections in pediatric patients. In: Mayhall C.G, editor. Hospital epidemiology and infection control. Williams and Wilkins; Baltimore: 1996. pp. 485–493. [Google Scholar]
- 2.Lee Ford-Jones E., Mindorff C.M., Langley J.M., Allen U., Navas L., Patrick M.L. Epidemiologic study of 4 684 hospital-acquired infections in pediatric patients. Pediatr Infect Dis J. 1989;8:668–675. doi: 10.1097/00006454-198910000-00002. [DOI] [PubMed] [Google Scholar]
- 3.Lee Ford-Jones E. The special problems of nosocomial infection in the pediatric patient. In: Wenzel R.P, editor. Prevention and control of nosocomial infections. Wiliams and Wilkins; Baltimore: 1993. pp. 812–896. [Google Scholar]
- 4.Moisiuk S.E., Robson D., Klass L., Kliewer G., Wasyliuk W., Davi M. Outbreak of Parainfluenza virus type 3 in an intermediate care neonatal nursery. Pediatr Infect Dis J. 1998;17:49–53. doi: 10.1097/00006454-199801000-00011. [DOI] [PubMed] [Google Scholar]
- 5.Valenti W.M., Clarke T.A., Hall C.B., Menegus M.A., Shapiro D.L. Concurrent outbreaks of rhinovirus and respiratory syncytial virus in an intensive care nursery : epidemiology and associated risk factors. J Pediatr. 1982;100:722–726. doi: 10.1016/s0022-3476(82)80571-4. [DOI] [PubMed] [Google Scholar]
- 6.Gagneur A., Legrand M.C., Talbot P.J., Sizun J. Nosocomial viral respiratory tract infections in a NPICU. Pediatr Crit Care M. 2000;17:16–16. [Google Scholar]
- 7.Tyrrell D.A.J., Bynoe M.L. Cultivation of a novel type of common-cold virus in organ cultures. Br Med J. 1965;1:1467–1470. doi: 10.1136/bmj.1.5448.1467. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Hamre D., Procknow J.J. A new virus isolated from the human respiratory tract. Proc Soc Exp Biol M. 1966;121:190–193. doi: 10.3181/00379727-121-30734. [DOI] [PubMed] [Google Scholar]
- 9.McIntosh K., Becker W.B., Chanock R.M. Growth in suckling mouse brain of “IBV-like” viruses from patients with upper respiratory tract disease. Proc Natl Acad Sci USA. 1967;58:2268–2273. doi: 10.1073/pnas.58.6.2268. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Holmes K.V., Lai M.M.C. Coronaviruses. In: Fields B.N, Knipe D.M, Howley P.M, editors. Fields Virology. Lippincott-Raven; Philadelphia: 1996. pp. 1075–1093. [Google Scholar]
- 11.Enjuanes L., Brian D.A., Cavanagh D., Holmes K.V., Lai M.C., Talbot P.J. Coronaviridae. In: Murphy F.A, Fauquet C.M, Bishop D.H.L, Ghabrial S.A, Jarvis A.W, Martelli G, editors. Virus taxonomy, Seventh report of the International Committee on Taxonomy of Viruses. Academic Press; New York: 1999. pp. 835–849. [Google Scholar]
- 12.Lai M.M.C., Cavanagh D. The molecular biology of coronaviruses. Adv Vir Res. 1997;48:1–100. doi: 10.1016/S0065-3527(08)60286-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.McNaughton M.R., Flowers D., Isaacs D. Diagnosis of human coronavirus infections in children using aenzyme-linked immunosorbent assay. J Med Virol. 1983;11:319–325. doi: 10.1002/jmv.1890110407. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Sizun J., Arbour N., Talbot P.J. Detection of human coronaviruses by fluorescent monoclonal antibody staining and reverse transcription-PCR in cell cultures. J Virol Methods. 1998;72:145–152. doi: 10.1016/S0166-0934(98)00013-5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Stewart J.N., Mounir S., Talbot J.P. Detection of conaviruses by the polymerase chain reaction. In: Becker Y, Daraï G, editors. Diagnosis of human viruses by polymerase chain reaction technology. Springer Verlag; New York: 1995. pp. 316–327. [Google Scholar]
- 16.Ieven M., Goossens H. Relevance of nucleic acid amplification techniques for diagnosis of respiratory tract infections in the clinical laboratory. Clin Microbiol Rev. 1997;2:242–256. doi: 10.1128/cmr.10.2.242. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Dick E.C., Inhorn S.L. Coronaviruses. In: Feigin R.P, Cherry J.D, editors. Textbook of pediatric infectious diseases. WB Saunders Company; Philadelphia: 1992. pp. 1498–1506. [Google Scholar]
- 18.Myint S.H. Human coronaviruses. A brief review. Rev Med Viol. 1994;4:35–46. [Google Scholar]
- 19.Monto A.S., Lim S.K. The tecumseh study of respiratory illness. VI. Frequency of and relationship between outbreaks of coronavirus infections. J Infect Dis. 1974;129:271–271. doi: 10.1093/infdis/129.3.271. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Myint S.H. Human coronavirus infections. In: Siddell S.G, editor. TheCoronaviridae. Plenum Press; New York: 1995. pp. 389–401. [Google Scholar]
- 21.Mortimer E.A., Jr, Fox J.P. Epideliology of infectious disease. In: Feigin R.P, Cherry J.D, editors. Textbook of pediatric infectious disease. WB Saunders Company; Philadelphia: 1992. pp. 67–90. [Google Scholar]
- 22.Vernotte E., Gagneur A., Salmon J., Legrand M.C., Sizun J., Parscau L., de Rôle pathogène des coronavirus humains chez l'enfant. Analyse systématique de la littérature. Arch Pédiatr. 1999;6(Suppl 2):533–533. [Google Scholar]
- 23.Brouard J., Freymuth F., Vabret A., Jokic M., Guillois B., Duhamel J.F. Co-infections virales lors des bronchiolites du nourrisson immunocompétent : étude prospective épidémiologique. Arch Pediatr. 2000;7(Suppl 3):531–535. doi: 10.1016/s0929-693x(00)80180-3. [DOI] [PubMed] [Google Scholar]
- 24.Lina B., Valette M., Foray S., Luciani J., Stagnara J., See D.M. Surveillance of community-acquired viral infections due to respiratory viruses in Rhone-Alpes (France) during winter 1994 to 1995. J Clin Microbiol. 1996;34:3007–3011. doi: 10.1128/jcm.34.12.3007-3011.1996. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Mertsola J., Ziegler T., Ruuskanen O., Vanto T., Koivikko A., Halonen P. Recurrent wheezy bronchitis and viral respiratory infections. Arch Dis Child. 1991;66:124–129. doi: 10.1136/adc.66.1.124. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Freymuth F., Vabret A., Brouard J., Toutain F., Verdon R., Petitjean J. Detection of viral, Chlamydia pneumoniae and Mycoplasma pneumoniae infections in exacerbations of asthma in children. J Clin Virol. 1999;13:131–139. doi: 10.1016/S1386-6532(99)00030-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Vernotte E., Legrand M.C., Gagneur A., Salmon J., Sizun J., Parscau L., de Exacerbation de l'asthme : le rôle déclenchant des coronavirus humains n'est pas confirmé. Arch Pédiatr. 1999;6(Suppl 2):583–583. [Google Scholar]
- 28.Johnston S.L. Natural and experimental rhinovirus infections of the lower respiratory tract. Am J Respir Crit Care M. 1995;152(Suppl):46–52. doi: 10.1164/ajrccm/152.4_Pt_2.S46. [DOI] [PubMed] [Google Scholar]
- 29.Pitkaranta A., Virolainen A., Jero J., Arruda E., Hayden F.G. Detection of rhinovirus, RSV and coronavirus infections in acute otitis media by RT-PCR. Pediatrics. 1998;102:291–295. doi: 10.1542/peds.102.2.291. [DOI] [PubMed] [Google Scholar]
- 30.Resta S., Luby J.P., Rosenfeld C.R., Siegel J.D. Isolation and propagation of a human enteric coronavirus. Science. 1985;229:978–981. doi: 10.1126/science.2992091. [DOI] [PubMed] [Google Scholar]
- 31.Kidd A.H., Esrey S.A., Ujfalusi M.J. Shedding of coronavirus-like particles by children in Lesotho. J Med Virol. 1989;27:164–169. doi: 10.1002/jmv.1890270219. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Riski H., Hovi T. Coronavirus infections in man associated with diseases other than the common cold. J Med Virol. 1980;6:259–265. doi: 10.1002/jmv.1890060309. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Arbour N., Cote G., Lachance C., Tardieu M., Cashman N.R., Talbot P.J. Acute and persistent infection of human neural cell lines by human coronavirus OC43. J Virol. 1999;73:3338–3350. doi: 10.1128/jvi.73.4.3338-3350.1999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Arbour N., Ekande S., Cote G., Lachance C., Chagnon F., Talbot P.J. Persistent infection of human oligodendrocytic and neuroglial cell lines by human coronavirus 229E. J Virol. 1999;73:3326–3337. doi: 10.1128/jvi.73.4.3326-3337.1999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Arbour N., Day R., Newcombe J., Talbot P.J. Neuroinvasion by human respiratory coronaviruses. J Virol. 2000;74:8913–8921. doi: 10.1128/jvi.74.19.8913-8921.2000. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Graman P.S., Hall C.B. Nosocomial viral respiratory infections. Semin Respir Infect. 1989;4:253–260. [PubMed] [Google Scholar]
- 37.Ijaz M.K., Brunner A.H., Sattar S.A., Nai R.C., Johnson-Lussenburg C.M. Survival characteristics of airborne human coronavirus 229-E. J Gen Virol. 1985;66:2743–2748. doi: 10.1099/0022-1317-66-12-2743. [DOI] [PubMed] [Google Scholar]
- 38.Sizun J., Yu M.W.N., Talbot P.J. Survival of 229-E and OC-43 human coronaviruses in suspension and on surfaces after drying. Effect of chemical disinfection. J Hosp Infect. 2000;46:55–60. doi: 10.1053/jhin.2000.0795. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Sizun J., Soupre D., Giroux J.D., Alix D., de Parscau L., Legrand M.C. Nasal colonisation with coronavirus and apnea of the premature newborn. Acta Paediatr. 1993;82:238–238. doi: 10.1111/j.1651-2227.1993.tb12650.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.Sizun J., Soupre D., Legrand M.C., Giroux J.D., Rubio S., de Parscau L. Neonatal nosocomial respiratory infection with coronavirus : a prospective study in a neonatal intensive care unit. Acta Paediatr. 1995;84:617–620. doi: 10.1111/j.1651-2227.1995.tb13710.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 41.Sizun J., Gagneur A., Legrand M.C., Salmon J., Baron R., Talbot P.J. Prospective evaluation of community-acquired and nosocomial viral respiratory tract infections in a NPICU. Pediatr Res. 1999;45:174A–174A. [Google Scholar]
- 42.Goldwater P.N., Martin A.J., Ryan B., Morris S., Thompson J., Burrell C.J. A survey of nosocomial respiratory viral infections in a children's hospital : occult respiratory infections in patients admitted during an epidemic season. Infect Control Hosp Epidemiol. 1991;12:231–238. doi: 10.1086/646330. [DOI] [PubMed] [Google Scholar]
- 43.Chany C., Moscovici O., Lebon P., Rousset S. Association of coronavirus with neonatal necrotizing enterocolitis. Pediatrics. 1982;69:209–214. [PubMed] [Google Scholar]
- 44.Vabret A., Brouard J., Petitjean J., Eugene-Ruellan G., Freymuth F. Infections à coronavirus humains. Importance et diagnostic. Presse M. 1998;27:1813–1817. [PubMed] [Google Scholar]
- 45.Falsey A.R., McCann R.M., Hall W.J., Criddle M.M., Formica M.A., Wycoff D. The « common cold » in frail older persons : impact of rhinovirus and coronavirus in a senior daycare center. J Am Geriatr Soc. 1997;45:706–711. doi: 10.1111/j.1532-5415.1997.tb01474.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Sizun J., Baron R., Soupre D., Giroux J.D., de Parscau L. Infections nosocomiales liées au virus respiratoire syncytial : quelles mesures d'hygiène ? Arch Pédiatr. 1996;3:723–727. doi: 10.1016/0929-693x(96)87097-7. [DOI] [PubMed] [Google Scholar]
- 47.Centers for Disease Control and Prevention Guidelines for prevention of nosocomial pneumonia. MMWR. Morb Mortal Wkly Rep. 1997;46:1–79. [Google Scholar]


