Abstract
En Normandie, le virus respiratoire syncytial (hRSV) est trouvé dans 64,1 % des cas de bronchiolites aiguës chez l’enfant hospitalisé, les rhinovirus dans 26,8 %, le métapneumovirus humain (hMPV) dans 7,6 % et les virus para-influenza (PIV) dans 3,4 %. Dans les bronchiolites aiguës communautaires, on a une répartition différente : hRSV : 42 %, rhinovirus : 19,5 %, coronavirus : 8 %, PIV : 3,5 %, hMPV : 2,5 %. Le hRSV infecte les nourrissons (86,9 %), dont 53,7 % ont moins de 6 mois et 48,2 % des hRSV sont détectés en novembre et décembre, et 44,5 % en janvier et février. L’épidémie débute la 1re ou 2e semaine d’octobre, mais elle varie d’une année à l’autre et d’une région à l’autre. À l’hôpital, les bronchiolites à hRSV sont passées de 261 cas par épidémies de 1999 à 2003, à 341 cas de 2004 à 2009. Les rhinovirus sont associés à des bronchiolites aiguës dans 38,4 % des cas ; 54,6 % des souches étant identifiées en septembre et octobre, et 38,5 % en mars et avril ; 34,2 % infectent des nourrissons de moins de 6 mois, 37,8 % entre 6 mois et 2 ans, et 19,5 % des enfants entre 2 et 5 ans. Les épidémies à hMPV coïncident avec celles du hRSV mais ont 6 fois moins de cas hospitalisés. Le hMPV infecte les nourrissons (74 %) mais plus âgés que ceux infectés par le hRSV. Il entraîne une bronchiolite aiguë dans 59 % des cas, une pneumonie dans 17 %. Les infections à PIV (environ 100 cas hospitalisés par an) se répartissent en PIV3 : 62,7 %, PIV1 : 25,3 % et PIV2 : 7,3 %. Les PIV1 apparaissent tous les 2 ans, à l’automne. Les infections à PIV3 sont automnales et hivernales, avec des infections au printemps les années sans PIV1. Il y a des bronchiolites aiguës dans 29,8 % des infections à PIV3 et 18,3 % à PIV1.
Mots clés: Bronchiolite, Virus respiratoire syncytial, Métapneumovirus humain, Rhinovirus, Para-influenza
Abstract
In Normandy (France), human respiratory syncytial virus (hRSV) was detected in 64.1% of acute bronchiolitis in hospitalized children, rhinovirus in 26.8%, human metapneumovirus (hMPV) in 7.6%, and parainfluenza virus (PIV) in 3.4%. The viruses causing acute bronchiolitis in the community were hRSV (42%), rhinovirus (19.5%), coronavirus (8%), PIV (3.5%), and hMPV (2.5%). In 53.7% of the cases, hRSV infected infants (86.9%), 53.7% being less than 6 months of age. Of the hRSV cases, 48.2% were detected in November and December and 44.5% in January and February. The hRSV epidemic started the 1st or 2nd week of October but it varied from one year to another and from one region to another. hRSV acute bronchiolitis increased from 261 cases in epidemics from 1999–2003 to 341 cases from 2004–2009. Rhinoviruses gave acute bronchiolitis in 38.4% of cases. A rate of 54.6% of viruses was detected in September and October and 38.5% in March and April. A total of 34.2% of infected infants were under 6 months of age, 37.8% between 6 months and 2 years, and 19.5% were between 2 and 5 years old. hMPV epidemics coincided with hRSV epidemics, but they accounted for one-sixth the number of cases. HMPV infected infants (74%) who were older than those infected with hRSV, and the diagnosis was bronchiolitis (59%) and pneumonia (17%). PIV infections (about 100 cases per year) included PIV3 (62.7%), PIV1 (25.3%), and PIV2 (7.3%). PIV1 infections occurred every 2 years in the fall. PIV3 infections were observed every year during the fall and winter, with peaks of infections in the spring in the years without PIV1. There were acute cases of bronchiolitis in 29.8% of PIV3 infections and 18.3% in PIV1 infections.
1. Introduction
La bronchiolite aiguë (BA) du nourrisson représente une forme très fréquente et potentiellement grave des infections virales respiratoires de l’enfant. Une conférence de consensus l’a définie comme « un premier épisode survenant en période épidémique chez un nourrisson de plus de 1 mois et de moins de 2 ans, au décours immédiat (48 à 72 h) d’une rhinopharyngite peu ou pas fébrile, associant une toux, une dyspnée obstructive avec polypnée, tirage, surdistension thoracique (clinique ou radiologique), un wheezing ou des râles sibilants ou sous-crépitants à prédominance expiratoire » [1]. On estime que 300 000 à 400 000 enfants sont hospitalisés chaque hiver en France pour une BA. Cet article précise quelques aspects de l’épidémiologie virale de ces BA notamment à la lumière d’observations recueillies dans plusieurs hôpitaux de Normandie.
2. Quels virus, quelles bronchiolites ?
Le plus connu des virus des BA est le virus respiratoire syncytial humain (hRSV), décrit pour la première fois en France en 1961 par Breton et al. dans une épidémie chez des prématurés [2]. Encore aujourd’hui, beaucoup le considèrent comme l’agent unique de cette atteinte respiratoire. Cependant, un certain nombre d’autres virus respiratoires ont été isolés dans les BA, parmi les virus traditionnels : virus influenza, virus para-influenza (PIV), adénovirus, quelques rhinovirus et les « nouveaux » virus respiratoires : métapneumovirus humain (hMPV), coronavirus, bocavirus et de nombreux rhinovirus.
Tous ces virus n’ont pas la même importance dans l’étiologie des BA. Leur prévalence est évidemment fonction du type d’outils virologiques utilisés pour les rechercher. La fréquence de leur détection peut aller de 57,6 % à 72,3 % et 92 %, selon que l’on utilise un test d’immunofluorescence (IFA), l’IFA et la culture, ou l’IFA, la culture et la biologie moléculaire [3]. Toutes les études effectuées en Normandie et rapportées ici ont utilisé la même méthodologie virale : une recherche virale initiée en IFA sur des secrétions nasales et, en cas d’IFA négative, une seconde recherche virale en culture et en polymerase chain reaction (PCR), le tout permettant de détecter les virus influenza, PIV, hRSV, hMPV, adénovirus, les 4 coronavirus et les rhinovirus. Cette méthodologie était celle de l’étude prospective rouennaise évaluant l’étiologie virale des BA vues dans les services d’urgence pédiatrique [4] ; étude qui avait inclus 209 enfants de moins de 1 an (âge moyen : 2,4 mois). Elle montrait que le hRSV restait le virus dominant : il était trouvé dans 64,1 % des cas. Les autres virus les plus fréquemment détectés étaient les rhinovirus (26,8 %), le hMPV (7,6 %) et les PIV (3,4 %). Le rôle des autres virus était extrêmement réduit.
La majorité des données sur l’étiologie des BA sont issues d’observations hospitalières. Que représentent les enfants consultant aux urgences pédiatriques ou hospitalisés pour une BA par rapport à l’ensemble des enfants atteints ? Les évaluations faites en France estiment que, chaque hiver, environ 30 % des enfants de moins de 2 ans font une BA et qu’environ 2 % d’entre eux sont hospitalisés [5], [6]. Une étude américaine a estimé à 18 % la fréquence des infections à hRSV chez les enfants de moins de 5 ans atteints d’une infection respiratoire aiguë ; 20 % de ces infections conduisant à une hospitalisation, 18 % à une consultation dans un service d’urgence pédiatrique et 15 % à la visite d’un médecin [7]. Une étude caennaise a comparé les BA observées chez des enfants de moins de 1 an, 81 étant suivis par des médecins de ville et 77 étant hospitalisés [8]. L’épidémie était celle de l’hiver 2005–2006 et, entre les 2 groupes, il n’y avait pas de différences significatives dans les facteurs prédisposant ou l’âge des enfants, bien que les enfants hospitalisés fussent plus jeunes (40 % ayant moins de 3 mois). En revanche, les BA vues en ville étaient moins graves que celles des enfants hospitalisés, comme l’attestaient les différences significatives dans la fréquence des signes de lutte, des distensions thoraciques, des retentissements alimentaires et la prise en charge qui restait ambulatoire. Le fait marquant était l’étiologie virale. Le hRSV ne représentait que 42 % des virus identifiés chez les enfants suivis en ville contre 85 % chez ceux hospitalisés (p < 0,01). Puis venaient les rhinovirus (19,5 %), les coronavirus (8 %), les PIV (3,5 %) et les hMPV (2,5 %).
3. Virus hRSV
Le hRSV est donc l’agent majeur des BA vues à l’hôpital. Il représentait 33,9 % (1819) des 5356 virus isolés chez les enfants hospitalisés pour une infection respiratoire aiguë au centre hospitalo-universitaire (CHU) de Caen et à l’hôpital de Flers, de 2000 à 2006, devant les virus influenza (33 %) et les rhinovirus (20,8 %).
Les BA à hRSV ont 3 caractéristiques, partagées d’ailleurs par d’autres viroses respiratoires : elles atteignent en priorité les nourrissons, sont hivernales et évoluent par épidémies. À Caen, entre 2006 à 2008, les 695 infections à hRSV identifiées chez les enfants hospitalisés touchaient pour 53,7 % d’entre elles des nourrissons de moins de 6 mois et pour 33,2 % des nourrissons âgés de 6 mois à 2 ans (fig. 1) . L’épidémie à hRSV est centrée sur l’automne et le début de l’hiver : entre 2000 et 2006, 48,2 % des souches ont été détectées en novembre et décembre, et 44,5 % en janvier et février (fig. 2) . Le début de l’épidémie à hRSV se situe en général au cours de la 1re ou de la 2e semaine d’octobre, mais il peut varier de quelques semaines, d’une année à l’autre et d’une région à l’autre (fig. 3) . Au CHU de Caen par exemple, les premiers hRSV avaient été détectés durant la 45e semaine de l’hiver 2004 et la 36e semaine de l’hiver 2005. Le décalage dans l’apparition de l’épidémie à hRSV selon les régions décrit aux États-Unis existe aussi en France [9]. Ainsi, au cours du dernier hiver 2008–2009, les premières souches de hRSV ont été décelées à la 44e semaine chez les enfants hospitalisés à Dijon et à Tours, aux 41e et 39e semaines chez les enfants hospitalisés à Lille, Nice et Caen, mais aux semaines 36 et 37 à Strasbourg et à Paris (hôpital Saint-Vincent-de-Paul). Il n’y a pas de gradient nord-sud ou est-ouest dans l’apparition des épidémies à hRSV. Tout au plus a-t-on observé que les 5 dernières épidémies avaient démarré plus tôt à Paris (hôpital Saint-Vincent-de-Paul) (38e semaine), à Strasbourg (38e semaine) et à Caen (40e semaine).
Figure 1.
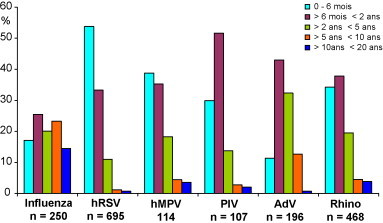
Âge des enfants infectés par un virus respiratoire. Enfants infectés par les virus respiratoires de septembre 2006 à mai 2007, et de septembre 2007 à mai 2008, et hospitalisés au CHU de Caen et à l’hôpital de Flers. En ordonnée : pourcentage de chaque virus par tranches d’âge : 0 à 6 mois, 6 mois à 2 ans, 2 à 5 ans, 5 à 10 ans, 10 à 20 ans. En abscisse : influenza A et B, virus respiratoire syncytial humain (hRSV), métapneumovirus humain (hMPV), virus para-influenza 1, 2, 3 (PIV), adénovirus (AdV) et rhinovirus (rhino).
Figure 2.
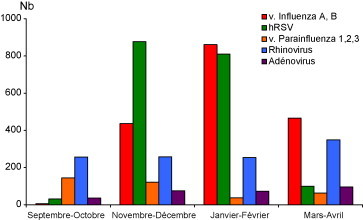
Distribution saisonnière des virus respiratoires. En ordonnée : nombre de virus cumulés sur une période de 2 mois chez les enfants hospitalisés au CHU de Caen. En abscisse : septembre et octobre, novembre et décembre, janvier et février, mars et avril, de 2000 à 2006. Le métapneumovirus humain (hMPV) n’était pas recherché à cette date. hRSV : virus respiratoire syncytial humain.
Figure 3.
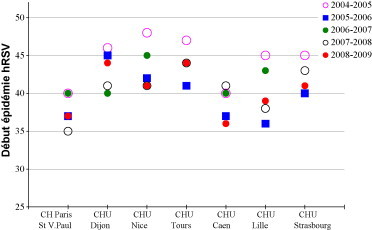
Début des épidémies à virus respiratoire syncytial humain (hRSV) en France : semaines du premier isolement du hRSV chez les enfants hospitalisés. En ordonnée : chiffres identifiant la semaine, et en cercles ou carrés colorés, épidémies de 2004 à 2008. En abscisse : localisation des CHU.
L’épidémie à hRSV précède 8 fois sur 10 l’épidémie à virus influenza (fig. 4) . Cette séquence des épidémies avait déjà été rapportée par Glezen et al. il y a plus de 20 ans [10]. La situation inverse est très rare. L’épidémie de grippe semble donc interrompre l’épidémie d’infections à hRSV. Il n’y a pas d’explication à ce phénomène. Ces virus n’étant pas apparentés sur le plan antigénique, un mécanisme d’origine immunitaire est exclu. Théoriquement, et parce que les épidémies de grippe démarrent chez les enfants, on pourrait imaginer que les secrétions d’interféron induites par les infections à virus influenza inhibent l’extension des infections à hRSV dans les communautés d’enfants qui n’ont pas encore été touchées par le hRSV au cours de l’hiver. Ou alors l’épidémie à hMPV qui coïncide fréquemment avec celle due au hRSV joue-t-elle un rôle ?
Figure 4.
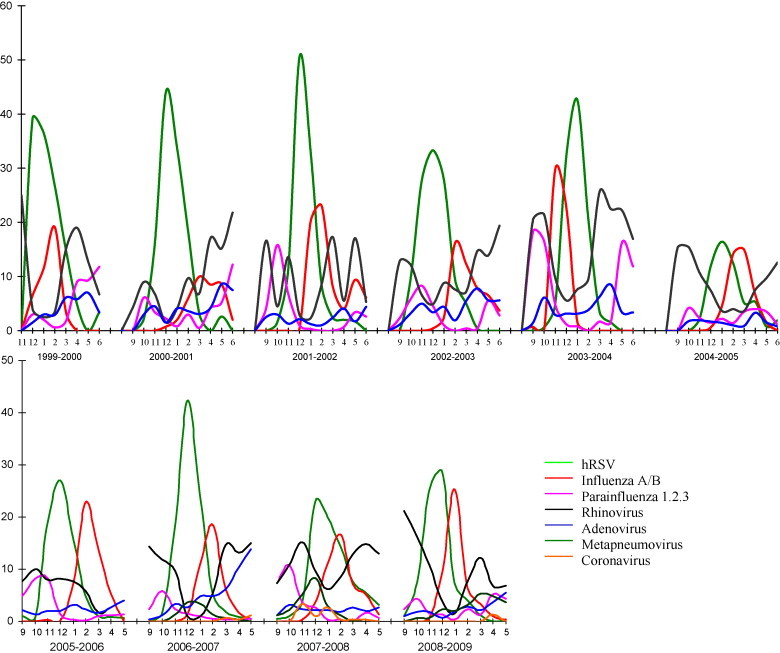
Évolution des infections virales respiratoires. En ordonnée : pourcentage des virus respiratoires isolés par mois chez les enfants hospitalisés au CHU de Caen et à l’hôpital de Flers. En abscisse : répartition mensuelle entre le 1er septembre et le 30 mai de 1999 à 2009. hRSV : virus respiratoire syncytial humain ; PIV : virus para-influenza.
L’apparition constante du pic d’infections à hRSV pendant l’hiver dans les pays à climat tempéré a souvent été considérée comme liée aux conditions météorologiques, en particulier à la température atmosphérique. Soit directement, parce que le froid favorise la survie du virus ou son infectivité par ralentissement du flux muco-ciliaire et diminution de la phagocytose leucocytaire [11], soit indirectement, parce que la modification de la vie sociale à cette période facilite les contaminations virales croisées. La réalité d’un lien entre l’intensité d’une épidémie à hRSV et la moyenne des températures n’est pas évidente. Trois études ont trouvé un tel lien [12], [13], d’autres l’ont infirmé [14]. Plus récemment, il a été montré que la fin des épidémies à hRSV était accélérée par une montée de la température atmosphérique [15], et que la détection des souches virales était liée au taux d’humidité et inversement proportionnelle à l’ensoleillement [16].
Le hRSV disparaît entre les épidémies et sa réapparition à l’automne reste mystérieuse. Le virus n’ayant jamais été isolé chez les animaux, son réservoir est strictement humain. Mais sous quelle forme l’infection virale persiste-t-elle dans la population entre les épidémies ? On observe très rarement des bronchiolites à hRSV au printemps ou en été [16]. Il existe donc certainement une forme de persistance asymptomatique. Le maintien du hRSV dans les tissus après l’infection initiale n’est pas définitivement prouvé. On sait que le hRSV infecte d’autres cellules que les cellules cylindriques ciliées de l’arbre respiratoire où il se multiplie. Ce sont les cellules T, les cellules dendritiques, les monocytes ou macrophages qui expriment des récepteurs sur lesquels la gpG du virus peut se fixer : le CX3CR1, la L-sélectine (CD62L) et l’annexine II. Expérimentalement, il a été montré que le génome et des ARNm du hRSV étaient détectés dans les macrophages alvéolaires pulmonaires de souris infectées plus de 100 j après l’infection, alors que le virus n’était pas décelable au-delà du 14e jour [17], et que le hRSV bovin pouvait persister jusqu’à 71 j dans les ganglions lymphatiques médiastinaux et trachéo-bronchiques après l’infection d’un veau [18]. Une fois le virus réactivé chez un sujet porteur, les facteurs qui déclenchent l’épidémie sont inconnus. Le rôle amplificateur de la reprise d’une vie en collectivité pour les enfants, à l’automne, dans les crèches ou les écoles, est très important. Le hRSV infecte évidemment les nourrissons non immunisés, en dépit de la présence d’anticorps maternels. Mais ce virus a la capacité de réinfecter facilement les sujets de tous les âges, y compris les nourrissons et les jeunes enfants [19]. Ces réinfections facilitent la diffusion du virus dans les populations d’enfants.
D’une année à l’autre, le nombre de BA à hRSV observées chez les enfants hospitalisés semble assez stable. Pourtant, certains auteurs ont noté l’alternance de fortes épidémies à début précoce, avec des épidémies plus modérées et plus retardées [20]. Nous n’avons pas observé ce phénomène. En revanche, à une plus grande échelle de temps, on constate une augmentation régulière du nombre de cas de BA. Chez les enfants hospitalisés au CHU de Caen et à l’hôpital de Flers durant les 6 derniers hivers (2003 à 2009), le nombre moyen de hRSV détectés par épidémie était de 341 (extrêmes : 300–401), soit 30,6 % de plus que les 261 hRSV détectés en moyenne par épidémies (extrêmes : 219–298) au cours des 4 hivers précédents (1999 à 2003). Dans cette observation, il n’existait pas de biais dans le recrutement hospitalier de ces enfants. Cette augmentation avait déjà été constatée à Caen entre les années 1983 à 1986 et 1993 à 1996 [21] et par le réseau Épidémiologie et recueil des bronchiolites en urgence pour surveillance (ERBUS) de l’Assistance publique–Hôpitaux de Paris (AP–HP) entre les années 1992 et 1996 [22]. L’accroissement du nombre de BA hivernales n’est pas propre à la France ; il est signalé dans la plupart des pays industrialisés [23]. Il n’y a probablement pas d’explication simple au phénomène. S’agit-il d’une augmentation de la virulence des souches virales ou d’une modification des conditions de vie des nourrissons liée notamment à la fréquentation précoce des collectivités d’enfants et des lieux publics, ou des 2 ?
Il existe 2 sous-groupes A et B de virus [24]. La différenciation est pertinente si on estime que la souche virale peut influencer la gravité de la BA, car les formes graves sont plus fréquentes au cours de certains hivers. L’existence d’un lien entre le sous-groupe de hRSV et la gravité de la bronchiolite est discutée. Nous avons observé que la durée de l’hospitalisation et la saturation en oxygène étaient corrélées aux infections à hRSV A [25]. Hall et al., dans une étude portant sur 1209 infections à hRSV observées sur une période de 15 ans, ont montré qu’il y avait significativement plus d’enfants admis en soins intensifs lorsqu’ils étaient infectés par un hRSV A : 15,4 contre 8,3 % pour le hRSV B [26]. Walsh et al. ont précisé que la mise sous ventilation assistée ou un index de gravité élevé étaient significativement associés aux infections à hRSV A par rapport aux infections à hRSV B [27]. D’autres auteurs n’ont pas trouvé cette association [28], [29]. Une des raisons qui peut expliquer ces différences tient aux critères retenus pour le calcul d’un score de gravité, très différents d’une étude à l’autre. Par ailleurs, à l’intérieur de chaque sous-groupe A ou B de hRSV, on observe la circulation de plusieurs génotypes dans les épidémies. Il n’y a pas non plus, aujourd’hui, de liens évidents entre les génotypes et la gravité des BA. L’existence de ces génotypes est sûrement la conséquence d’un processus d’évolution des souches par pression immunologique, certains génotypes survivant, d’autres étant éliminés. Le phénomène est comparable, bien que beaucoup plus lent et limité, au glissement antigénique des souches de virus influenza A. Plusieurs sites du gène G localisés dans la partie extracellulaire de la protéine sont soumis à cette pression immunologique positive ; ils correspondent plus ou moins à des épitopes reconnus par les anticorps anti-hRSV ou à des sites de glycosylation [30].
4. Les autres virus des BA
4.1. Les rhinovirus
Plus de 110 souches de rhinovirus ont été identifiées sur la base de parentés antigéniques. On les classe aujourd’hui en 3 génotypes, A, B et C, récemment identifiés. La pathologie et la fréquence des infections à rhinovirus ont été largement sous-estimées. À Caen, chez les enfants hospitalisés entre 2000 et 2006, les 1118 infections à rhinovirus occupaient la troisième position en fréquence (20,8 %), après les infections à hRSV et à virus influenza. Sur l’année, les infections à rhinovirus variaient peu en nombre entre septembre et avril (fig. 2), mais elles représentaient 54,6 % des virus identifiés en septembre et octobre, et 38,5 % en mars et avril. Elles évoluaient en pics successifs, correspondant à la circulation de sérotypes différents (fig. 4). Chez les enfants hospitalisés elles étaient surtout observées chez les nourrissons. Sur 468 infections à rhinovirus identifiées entre 2006 et 2008, 34,2 % étaient détectées chez les nourrissons de moins de 6 mois, 37,8 % chez des nourrissons entre 6 mois et 2 ans, et 19,5 % chez des enfants entre 2 et 5 ans (fig. 1).
Du point de vue clinique, et contrairement à une idée répandue, les rhinovirus ne sont pas que des agents de rhinites aiguës. Une étude caennaise a été menée entre septembre 1998 et octobre 2000 chez 211 enfants hospitalisés pour une infection respiratoire aiguë dans laquelle seul un rhinovirus était détecté dans les voies respiratoires, alors que la recherche des virus influenza, PIV, hRSV, adénovirus était négative [31]. L’âge moyen de la cohorte était de 21 mois, avec des âges extrêmes de 15 j à 16 ans. Chez les enfants infectés, on recensait 60 cas (28,4 %) d’atteintes des voies aériennes supérieures isolées, 81 cas (38,4 %) de bronchiolites ou bronchites, 25 pneumopathies (11,9 %) et 12 (5,7 %) crises d’asthme. Une autre étude plus récente, toujours chez des enfants hospitalisés, retrouvait des chiffres comparables : 22 % de BA, 13 % de bronchites sifflantes, 9 % de pneumonies et 26 % de crises d’asthme [32]. La gravité des BA à rhinovirus est diversement appréciée. L’étude de Papadopoulos et al. concernait 118 enfants hospitalisés pour BA, chez lesquels un hRSV seul avait été détecté dans 42,3 % des cas, un rhinovirus seul dans 10,1 % des cas et l’association des 2 dans 8,4 % des cas [33]. Dans un modèle de régression statistique contrôlant l’âge, le sexe, le poids de naissance, la présence de fièvre et le jour de la maladie à l’admission, ces auteurs montraient que la présence d’un rhinovirus augmentait de près de 5 fois le risque de BA grave. L’étude de Marguet et al. portait sur 209 enfants également hospitalisés pour BA [4]. Un hRSV seul était identifié dans 45,8 % des cas, un rhinovirus seul dans 7,2 % des cas et l’association des 2 dans 14,3 % des cas. Cette étude montre clairement que la BA à rhinovirus est significativement moins grave que celle à hRSV ou celle causée par l’association des 2, avec un score clinique inférieur, un besoin en oxygène et une durée d’hospitalisation plus courts. La différence de gravité des BA à rhinovirus entre ces 2 études tient peut-être aux sérotypes, certainement différents, qui circulaient pendant les périodes considérées. De plus, la première étude ne concernait qu’une seule saison : 1999–2000 et la seconde 3 saisons : 2002 à 2004. Par ailleurs, le nouveau génotype C de rhinovirus est associé, pour certains auteurs, à des formes plus graves de bronchiolites et pneumonies chez l’enfant [34].
4.2. Le métapneumovirus humain
Les infections à hMPV évoluent sous forme d’épidémies qui coïncident avec celles dues au hRSV (fig. 5) . Sur les 4 épidémies illustrées sur la fig. 5, le nombre d’infections à hMPV était inversement proportionnel à celui des infections à hRSV. Cette observation, qui mérite d’être validée par le suivi d’autres épidémies, témoigne certainement des parentés antigéniques existant entre ces 2 virus, appartenant respectivement aux pneumovirus et métapneumovirus à l’intérieur de la sous-famille des Pneumovirinae. Le nombre d’infections à hMPV par épidémie est en moyenne 6 fois plus petit que le nombre d’infections à hRSV. Dans une étude prospective portant sur les enfants hospitalisés au CHU de Caen au cours des hivers 2006, 2007 et 2008, 114 infections à hMPV avaient été détectées, contre 698 infections à hRSV. La répartition dans les tranches d’âge des 114 infections à hMPV ressemblait à celle des infections à hRSV et à rhinovirus (fig. 1). Elles atteignaient surtout le nourrisson, avec une fréquence de 74 % pour les hMPV, et de 86,9 % et 72,1 % pour les hRSV et rhinovirus ; mais les enfants atteints par le hRSV étaient plus jeunes de 3 à 6 mois que ceux atteints par le hMPV ou les rhinovirus.
Figure 5.
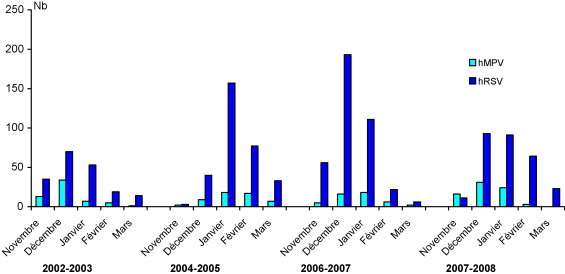
Épidémies à virus respiratoire syncytial humain (hRSV) et métapneumovirus humain (hMPV). En ordonnée : nombre d’infections à virus détectées chez les enfants hospitalisés au CHU de Caen et à l’hôpital de Flers. En abscisse : réparation mensuelle du 1er novembre au 30 avril entre 2002 et 2008.
Le diagnostic principal retenu dans les infections à hMPV est celui de BA [35]. Une étude clinique a été effectuée au CHU de Caen sur 2 groupes égaux de 88 enfants présentant une infection à hMPV ou à hRSV, au cours des hivers de 2006 à 2008. Le diagnostic final était celui de rhinopharyngite dans respectivement 11,3 % et 7,8 % des cas pour le hMPV et le hRSV, de bronchite dans 4,3 % et 2,5 % des cas, de BA dans 59 % et 78,5 % des cas, de pneumonie dans 17 % et 4,5 % des cas, de crise d’asthme dans 6 % et 0,8 % des cas, et de laryngite dans 2,6 % et 0 % des cas. Les pneumonies semblaient donc significativement plus fréquentes dans les infections à hMPV que dans les infections à hRSV. La gravité des BA causées par ces 2 virus n’est pas la même. La BA à hMPV est, a priori, moins sévère que celle liée au hRSV. Dans l’étude précédente, 34,9 % des enfants infectés par le hMPV avaient nécessité une oxygénothérapie contre 41,3 % des enfants infectés par le hRSV. Dans une comparaison des BA à hRSV et à hMPV, Marguet et al. ont montré que les seules différences entre les 2 atteintes étaient le risque d’une hospitalisation de plus de 5 j, qui était moindre avec le hMPV, et le risque d’avoir une saturation en oxygène (SaO2) inférieure à 92 % à l’admission, qui était augmenté avec ce virus [4].
4.3. Les virus para-influenza
Le type 4 étant très rare, les PIV des types 1, 2 et 3 sont les responsables principaux des infections respiratoires dues à cette famille de virus chez les enfants hospitalisés. Ils représentaient 6,8 % de tous les virus respiratoires détectés entre 2000 et 2006. Les infections à PIV étaient plus fréquentes en novembre et décembre, où elles représentaient 39,4 % et 33,1 % des souches, qu’entre les mois de janvier et avril (fig. 2). Comme pour le hRSV et le hMPV, elles prédominaient chez le nourrisson (85,1 %), mais contrairement à ceux-ci, elles atteignaient moins souvent le petit nourrisson (29,9 %) (fig. 1).
Comme le montre l’étude de 973 cas identifiés au CHU de Caen entre décembre 1999 et octobre 2009, les infections à PIV conservent leurs caractéristiques épidémiologiques anciennes [36]. Le nombre annuel moyen d’infections à PIV est assez constant, même s’il s’est accru légèrement entre les années 2000 à 2004 (90 par an) et 2005 à 2009 (103 par an). Les infections à PIV 3 sont les plus fréquentes (62,7 %) devant les infections à PIV 1 (25,3 %), à PIV 2 (7,3 %) et à PIV 4 (4,6 %). Ces fréquences ont été retrouvées dans une étude américaine récente de 40 630 infections à PIV observées entre 1990 et 2004 : PIV 3 (52 %), PIV 1 (26 %), PIV 2 (12 %), PIV 4 (2 %) [37]. Comme le montre la fig. 6 , les infections à PIV 1 surviennent tous les 2 ans, à l’automne, un peu avant l’épidémie à hRSV. Les infections à PIV 2, moins fréquentes, s’observent également en automne. Mais, contrairement à l’image classique de leur alternance avec les infections à PIV 1, on note ici qu’elles coïncident souvent avec celles-ci. Les infections à PIV 3, fréquentes, s’observent chaque année, pendant l’automne et l’hiver. Ce qui est remarquable, c’est qu’elles donnent souvent un pic d’infections au printemps les années sans PIV 1. Parallèlement elles sont moins fréquentes les années d’infections à PIV 1. L’existence de parentés antigéniques entre les 2 types de PIV, qui appartiennent au même sous-groupe des Paramyxovirinae en est une explication possible.
Figure 6.
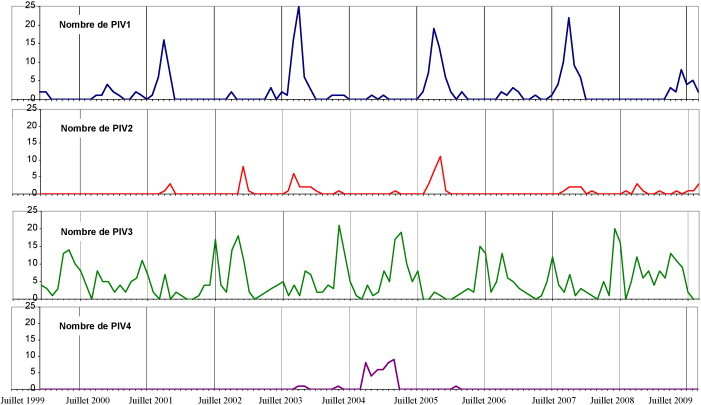
Infections à virus para-influenza. En ordonnée : nombre d’infections à virus para-influenza (PIV) 1, 2, 3 et 4 détectées chez les enfants hospitalisés au CHU de Caen et à l’hôpital de Flers. En abscisse : répartition mensuelle entre 1999 et 2009. Les infections à PIV 4 ne sont pas recherchées systématiquement.
L’expression clinique des infections à PIV est assez classique. Le PIV 3 est, avec le hMPV, un agent fréquent de BA et de pneumonies chez l’enfant. Ainsi, on le trouve associé à des BA et des pneumonies respectivement dans 29,8 % et 9,6 % des cas chez le nourrisson, et dans 26,6 % et 26,6 % des cas chez l’enfant entre 2 et 5 ans ; le PIV 1 est associé à des BA dans 18,3 % des cas [38]. Mais les PIV sont surtout des agents de laryngites : 48,1 % avec le PIV 1, 17,5 % avec le PIV 2 et 8,6 % avec le PIV 3 [39]. Une étude récente de 95 infections à PIV 3, 73 infections à PIV 1 et 23 infections à PIV 2 a confirmé, respectivement pour chacun de ces 3 virus, un diagnostic de BA dans 19 %, 14 % et 0 % des cas, de pneumonie dans 19 %, 16 % et 17 % des cas, de laryngite dans 11 %, 42 % et 48 % des cas [40]. Par ailleurs, ces 3 virus avaient été identifiés dans des crises d’asthme : 28 %, 22 %, 22 % et dans des syndromes fébriles d’allure septicémique : 13 %, 7 %, 4 %.
4.4. Les virus influenza
Les 1770 virus influenza A et B (33 %) venaient en deuxième position après le hRSV parmi les 5356 virus isolés chez les enfants hospitalisés au CHU de Caen et à l’hôpital de Flers, de 2000 à 2006. Pour autant, leur rôle dans l’étiologie des BA du nourrisson est beaucoup plus réduit que celui des hRSV, rhinovirus, hMPV et PIV. Une étude américaine conduite dans les années 1980 leur attribuait 4 % des causes virales de BA chez l’enfant de moins de 1 an [41]. Plus récemment, Poehling et al. ont détecté un virus influenza dans 25 %, 20 % et 3 % des cas de BA observées chez des nourrissons âgés respectivement de moins de 5 mois, 6 à 23 mois et 23 à 59 mois [42]. Il n’existait pas de différences cliniques entre les BA à virus influenza et à hRSV. La gravité de la BA, mesurée en fréquence respiratoire ou en SaO2, n’est pas statistiquement différente entre les 2 atteintes virales [43]. Les BA à virus influenza sont plus hivernales que les bronchiolites à hRSV : 25 % des virus influenza A et B sont isolés en novembre et décembre, 49 % en janvier et février, et 26 % en mars et avril (fig. 2). Globalement les infections à virus influenza A et B ont une distribution selon l’âge très différente de celles des infections à hRSV, rhinovirus et PIV. Elles se répartissent presque également entre toutes les tranches d’âge : 0 à 6 mois, 6 à 24 mois, 2 à 5 ans, 5 à 10 ans, 10 à 20 ans (fig. 1).
4.5. Les coronavirus
L’épidémiologie et l’expression clinique des infections respiratoires liées aux 4 coronavirus humains (229E, OC43, NL63 et HKU1) sont encore peu connues. Une étude menée à Caen entre septembre 2004 et mai 2005 a évalué à 9,8 % leur fréquence chez les enfants hospitalisés pour lesquels la recherche des virus respiratoires classiques était négative [44]. Sur les 100 coronavirus détectés, 35 appartenaient au groupe 1 (33 NL63 et 2 229E) et 65 au groupe 2 (27 OC43 et 38 HKU1). Plusieurs coronavirus co-circulaient donc au cours de la saison des virus respiratoires, surtout en hiver ; 63 % des infections à coronavirus avaient été détectées chez des nourrissons. Les maladies respiratoires à coronavirus sont dans l’ensemble moins sévères que celles dues au hRSV. L’atteinte des voies aériennes inférieures était plus fréquente dans les infections à coronavirus NL63 (44,4 %) et OC43 (33,3 %) que dans celles à coronavirus HKU1 (14,7 %). Un diagnostic de BA et de pneumonie avait été porté dans respectivement 29,5 % et 11,1 % des infections à coronavirus NL63, 16,6 % et 12,5 % des infections à coronavirus OC43 et 0 % et 5,9 % des infections à coronavirus HKU1. Mais comme le montre une étude récente réalisée à Hong Kong, la fréquence des infections liées à chacun de ces coronavirus et leur saisonnalité peuvent varier d’une année à l’autre et probablement aussi d’un pays à l’autre [45].
4.6. Le bocavirus
Chez les enfants hospitalisés pour une infection respiratoire, le bocavirus est détecté avec une fréquence qui varie de 1,4 % à 10 % selon les études [46]. Ce virus circule chaque hiver sans nette prédominance annuelle ou saisonnière et la BA est son expression majeure. Dans une étude parisienne de 32 enfants infectés au cours de l’hiver 2005–2006, 22 avaient été hospitalisés pour une atteinte respiratoire basse (8 BA, 9 crises d’asthme, 5 pneumonies) et l’état de 12 enfants avait nécessité une oxygénothérapie de plus de 24 h [47]. Une étude caennaise de 16 infections à bocavirus a trouvé 7 BA, 2 crises d’asthme et 1 pneumonie [46]. Cette étude soulignait que 22 % des enfants présentaient des signes de gastroentérites. Elle confirmait également la fréquence des co-infections virales dans les atteintes à bocavirus.
4.7. Les adénovirus
Les adénovirus représentaient 5,2 % des virus respiratoires isolés chez les enfants hospitalisés entre 2000 et 2006 à Caen. Dans leurs atteintes les plus graves (liées notamment à l’adénovirus 7), ils entraînent des pneumonies hypoxémiantes, mais ils sont rarement associés à des tableaux de BA : moins de 2 % des cas [48]. En revanche, une autre forme anatomoclinique de la bronchiolite, la bronchiolite oblitérante, peut être la conséquence tardive d’une infection à adénovirus. En effet, l’existence d’une bronchiolite à adénovirus chez un nourrisson et la nécessité d’une ventilation mécanique sont des facteurs fortement et indépendamment associés au risque de survenue d’une bronchiolite oblitérante [49].
5. Conclusion
Bien qu’elle ait conservé ses caractéristiques épidémiologiques traditionnelles (atteinte prépondérante des enfants, saisonnalité…), la pathologie respiratoire courante vue à l’hôpital a changé. Elle s’est enrichie de la connaissance de virus « émergents », de l’impact des infections à rhinovirus et de l’augmentation des cas de BA hospitalisés. C’est un élément important que les médecins et les autorités sanitaires doivent prendre en considération. Mais l’attrait suscité par la pathologie virale émergente ne doit pas faire oublier certaines propriétés de base de ces virus : résistance dans le milieu extérieur (plus élevée pour les virus nus : rhinovirus, adénovirus…, que pour les virus enveloppés : virus influenza PIV, hRSV, hMPV), taux élevé de transmission inter-humaine. Leur connaissance est essentielle pour contrôler la diffusion de ces infections, notamment dans les collectivités d’enfants ou de personnes âgées fragilisées, grâce à des mesures préventives systématiquement proposées [50].
Conflit d’intérêt
Aucun.
Remerciements
Les auteurs remercient les Pr V. Giordanengo (Nice), A. Goudeau (Tours), P. Lebon (Paris), P. Pothier (Dijon), F. Stoll-Keller (Strasbourg), le Dr A. Dewilde (Lille) pour leur participation à l’étude des épidémies à hRSV, et le Pr G. Weinberg (Rochester, États-Unis) pour son avis sur les bronchiolites à PIV.
Références
- 1.Stagnara J., Balagny E., Cossalter B. Prise en charge de la bronchiolite du nourrisson. Texte des recommandations. Arch Pediatr. 2001;8(Suppl. 1):11–23. doi: 10.1016/s0929-693x(01)80151-2. [DOI] [PubMed] [Google Scholar]
- 2.Breton A., Samaille J., Gaudier B. Isolement du virus syncytial (virus CCA de Morris) au cours de manifestations respiratoires bénignes chez des prématurés. Arch Fr Pediatr. 1961;18:459–467. [PubMed] [Google Scholar]
- 3.Freymuth F., Vabret A., Cuvillon-Nimal D. Comparison of multiplex PCR assays and conventional techniques for the diagnostic of respiratory virus infections in children admitted to hospital with an acute respiratory illness. J Med Virol. 2006;78:1498–1504. doi: 10.1002/jmv.20725. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Marguet C., Lubrano M., Gueudin M. In very young infants severity of acute bronchiolitis depends on carried viruses. PLoS ONE. 2009;4:e4596. doi: 10.1371/journal.pone.0004596. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Grimprel E. Épidémiologie de la bronchiolite du nourrisson en France. Arch Pediatr. 2001;8(Suppl. 1):83–92. doi: 10.1016/s0929-693x(01)80162-7. [DOI] [PubMed] [Google Scholar]
- 6.Sannier N. Organisation des soins au cours des épidémies de bronchiolites. Arch Pediatr. 2001;8(Suppl. 1):174–179. doi: 10.1016/s0929-693x(01)80177-9. [DOI] [PubMed] [Google Scholar]
- 7.Hall C.B., Weinberg G.A., Iwane M.K. The burden of respiratory syncytial virus infection in young children. N Engl J Med. 2009;360:588–598. doi: 10.1056/NEJMoa0804877. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Fuentes M. Bronchiolites aiguës du nourrisson en ville : prise en charge par les praticiens, connaissances parentales, épidémiologie virale caennaise comparative avec celle hospitalière [thèse]. Caen: université; 2007.
- 9.Panazzo C.A., Fowlkes A.L., Anderson L.J. Variation in timing of respiratory syncytial virus outbreaks: lessons from national surveillance. Pediatr Infect Dis J. 2007;26(Suppl):41–45. doi: 10.1097/INF.0b013e318157da82. [DOI] [PubMed] [Google Scholar]
- 10.Glezen W.P., Paredes A., Taber L.H. Influenza in children. Relationship to other respiratory agents. JAMA. 1980;243:1345–1349. doi: 10.1001/jama.243.13.1345. [DOI] [PubMed] [Google Scholar]
- 11.Eccles R. An explanation for the seasonality of acute upper respiratory tract viral infections. Acta Otolaryngol. 2002;122:183–191. doi: 10.1080/00016480252814207. [DOI] [PubMed] [Google Scholar]
- 12.Martin A.J., Gardner P.S., McQuillin J. Epidemiology of respiratory viral infection among paediatric inpatients over a six-year period in north-east England. Lancet. 1978;2:1035–1038. doi: 10.1016/s0140-6736(78)92351-6. [DOI] [PubMed] [Google Scholar]
- 13.Yusuf S., Piedimonte G., Auais A. The relationship of meteorological conditions to the epidemic activity of respiratory syncytial virus. Epidemiol Infect. 2007;135:1077–1090. doi: 10.1017/S095026880600776X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Reyes M., Eriksson M., Bennet R. Regular pattern of respiratory syncytial virus and rotavirus infections and relation to weather in Stockholm, 1984–1993. Clin Microbiol Infect. 1997;3:640–646. doi: 10.1111/j.1469-0691.1997.tb00471.x. [DOI] [PubMed] [Google Scholar]
- 15.Donaldson G.C. Climate change and the end of the respiratory syncytial virus season. Clin Infect Dis. 2006;47:677–679. doi: 10.1086/500208. [DOI] [PubMed] [Google Scholar]
- 16.Wasburne J.F., Bocchini J.A., Jr, Jamison R.M. Summertime respiratory syncytial virus infection: epidemiology and clinical manifestations. South Med J. 1992;85:579–583. doi: 10.1097/00007611-199206000-00004. [DOI] [PubMed] [Google Scholar]
- 17.Schwarze J., O’Dannell D.R., Rohwedder A. Latency and persistence of respiratory syncytial virus despite T cell immunity. Am J Respir Crit Care Med. 2004;169:801–805. doi: 10.1164/rccm.200308-1203OC. [DOI] [PubMed] [Google Scholar]
- 18.Valarcher J.F., Bourhy H., Lavenu A. Persistent infection of B lymphocytes by bovine respiratory syncytial virus. Virology. 2001;291:55–67. doi: 10.1006/viro.2001.1083. [DOI] [PubMed] [Google Scholar]
- 19.Hall C.B., Walsh E.E., Long C.E. Immunity to and frequency of reinfection with respiratory syncytial virus. J Infect Dis. 1991;163:693–698. doi: 10.1093/infdis/163.4.693. [DOI] [PubMed] [Google Scholar]
- 20.Terletskaia-Ladwig E., Enders G., Schalasta G. Defining the timing of respiratory syncytial virus (RSV) outbreaks: an epidemiological study. BMC Infect Dis. 2005;5:20. doi: 10.1186/1471-2334-5-20. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Freymuth F.V.A., Vabret A., Petitjean J. Diagnostic de l’infection humaine à virus respiratoire syncytial. J Pediatr Puericult. 1999;12:81–84. [Google Scholar]
- 22.Thélot B.B.J., Cheron G., Chevallier B. Surveillance épidémiologique hospitalière de la bronchiolite du nourrisson par le réseau ERBUS. Rev Epidemiol Sante Publique. 1998;46:277–288. [PubMed] [Google Scholar]
- 23.Law B.J., Carbonell-Estrany X., Simoes E.A. An update on respiratory syncytial virus epidemiology: a developed country perspective. Respir Med. 2002;96(Suppl. B):1–7. [PubMed] [Google Scholar]
- 24.Freymuth F., PetitjeanJ, Pothier P. Prevalence of respiratory syncytial virus subgroups A and B in France from 1982 to 1990. J Clin Microbiol. 1991;29:653–655. doi: 10.1128/jcm.29.3.653-655.1991. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Brouard J., Freymuth F., Constantini S. Prévalence et aspects cliniques de l’infection par les sous-types A et B du virus respiratoire syncytial. Arch Fr Pediatr. 1993;50:639–643. [PubMed] [Google Scholar]
- 26.Hall C.B., Walsh E.E., Schnabel K.C. Occurence of groups A and B of respiratory syncytial virus over 15 years: associated epidemiologic and clinical characteristics in hospitalized and ambulatory children. J Infect Dis. 1990;162:1283–1290. doi: 10.1093/infdis/162.6.1283. [DOI] [PubMed] [Google Scholar]
- 27.Walsh E.E., McConnochie K.M., Long C.E. Severity of respiratory syncytial virus infection is related to virus strain. J Infect Dis. 1997;175:814–820. doi: 10.1086/513976. [DOI] [PubMed] [Google Scholar]
- 28.Kneyber M.C., Brandenburg A.H., Rothbarth P.H. Relationship between clinical severity of respiratory syncytial virus infection and subtype. Arch Dis Child. 1996;75:137–140. doi: 10.1136/adc.75.2.137. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.McIntosh E.D., De Silva L.M., Oates R.K. Clinical severity of respiratory syncytial virus group A and B infection in Sydney. Australila. Pediatr Infect Dis J. 1993;12:815–819. doi: 10.1097/00006454-199310000-00004. [DOI] [PubMed] [Google Scholar]
- 30.Woelk C., Holmes E.C. Variable immune-driven natural selection in the attachment (G) glycoprotein of respiratory syncytial virus (RSV) J Mol Evol. 2001;52:182–192. doi: 10.1007/s002390010147. [DOI] [PubMed] [Google Scholar]
- 31.Guittet V., Brouard J., Vabret A. Rhinovirus et infections respiratoires aiguës chez l’enfant hospitalisé. Étude rétrospective 1998–2000. Arch Pediatr. 2003;10:417–423. doi: 10.1016/S0929-693X(03)00090-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Peltola V., Jartti T., Putto-Laurila A. Rhinovirus infections in children: a retrospective and prospective hospital-based study. J Med Virol. 2009;81:1831–1838. doi: 10.1002/jmv.21590. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Papadopoulos N.G., MoustakiM, Tsolia M. Association of rhinovirus infection with increased disease severity in acute bronchiolitis. Am J Respir Crit Care Med. 2002;165:1285–1289. doi: 10.1164/rccm.200112-118BC. [DOI] [PubMed] [Google Scholar]
- 34.Renwick N., Schweiger B., Kapoor V. A recently identified rhinovirus genotype is associated with severe respiratory-tract infection in children in Germany. J Infect Dis. 2007;196:1754–1760. doi: 10.1086/524312. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Freymuth F., Vabret A., Legrand L. Metapneumovirus humain. Pathol Biol. 2009;57:133–141. doi: 10.1016/j.patbio.2008.04.005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Freymuth F., Quibriac M., Petitjean J. Les virus responsables d’infections respiratoires en pédiatrie. Bilan de 3480 aspirations nasales réalisées chez l’enfant en une période de six ans. Paris. Ann Pediatr. 1987;34:493–501. [PubMed] [Google Scholar]
- 37.Fry A.M., Curns A.T., Harbour K. Seasonal trends of human parainfluenza viral infections: United States, 1990–2004. Clin Infect Dis. 2006;43:1016–1022. doi: 10.1086/507638. [DOI] [PubMed] [Google Scholar]
- 38.Henderson F.W. Pulmonary infections with respiratory syncytial virus and the parainfluenza viruses. Semin Respir Infect. 1987;2:112–121. [PubMed] [Google Scholar]
- 39.Denny F.W., Murphy T.F., Clyde W.A. Croup: an 11-year study in pediatric practice. Pediatrics. 1983;71:871–876. [PubMed] [Google Scholar]
- 40.Weinberg G.A., Hall C.B., Iwane M.K. Parainfluenza virus infection of young children: estimates of the population-based burden of hospitalization. J Pediatr. 2009;154:694–699. doi: 10.1016/j.jpeds.2008.11.034. [DOI] [PubMed] [Google Scholar]
- 41.Wright A.L., Taussig L.M., Ray G. The Tucson children's respiratory study. II. Lower respiratory tract illness in the first year of life. Am J Epidemiol. 1989;129:1232–1246. doi: 10.1093/oxfordjournals.aje.a115243. [DOI] [PubMed] [Google Scholar]
- 42.Poehling K.A., Edwards K.M., Weinberg G.A. The under recognized burden of influenza in young children. N Engl J Med. 2006;355:31–40. doi: 10.1056/NEJMoa054869. [DOI] [PubMed] [Google Scholar]
- 43.Garafalo R.P., Hintz K.H., Hill V. A comparison of epidemiogic and immunologic features of bronchiolitis caused by influenza virus and respiratory syncytial virus. J Med Virol. 2005;75:282–289. doi: 10.1002/jmv.20268. [DOI] [PubMed] [Google Scholar]
- 44.Vabret A., Dina J., Gouarin S. Human (non-severe acute respiratory syndrome) coronavirus infections in hospitalized children in France. J Pediatr Child Health. 2008;44:176–181. doi: 10.1111/j.1440-1754.2007.01246.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 45.Leung T.F., Li C.Y., Lam W.Y. Epidemiology and clinical presentations of human coronavirus NL63 infections in Hong Kong children. J Clin Microbiol. 2009;47:3486–3492. doi: 10.1128/JCM.00832-09. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 46.Dina J., Vabret A., Gouarin S. Detection of human bocavirus in hospitalised children. J Pediatr Child Health. 2009;45:149–153. doi: 10.1111/j.1440-1754.2008.01442.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 47.Catalano-Pons C., Bue M., Laude H. Human bocavirus infection in hospitalized children during winter. Pediatr Infect Dis J. 2007;26:1–2. doi: 10.1097/INF.0b013e3181256583. [DOI] [PubMed] [Google Scholar]
- 48.Edwards K.E., Thompson J., Paolini J. Adenovirus infection in young children. Pediatrics. 1985;76:420–424. [PubMed] [Google Scholar]
- 49.Colom A.J., Teper A.M., Vollmer W.M. Risk factors for the development of bronchiolitis obliterans in children with bronchiolitis. Thorax. 2006;61:503–506. doi: 10.1136/thx.2005.044909. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 50.Bourrillon A. Bronchiolites aiguës du nourrisson. Rev Prat. 2007;57:1902–1912. [PubMed] [Google Scholar]


