Abstract
Le bocavirus humain (HBoV) a été récemment identifié dans les sécrétions respiratoires de sujets présentant une atteinte respiratoire aiguë grâce à l’utilisation de techniques de criblage moléculaire. Ce virus qui appartient à la famille des Parvoviridae a été retrouvé dans toutes les régions du monde avec une prévalence de l’ordre de 5 à 10 % chez les enfants présentant des atteintes respiratoires hautes ou basses, essentiellement en période hivernale. Une étude séroépidémiologique a montré que pratiquement tous les enfants étaient porteurs d’anticorps à l’âge de cinq ans et l’infection paraît rare chez l’adulte. Ce virus est souvent retrouvé en association avec d’autres virus respiratoires. Le virus a été retrouvé également dans les selles, mais son rôle dans les gastroentérites n’a pas été établi. Le diagnostic virologique repose sur la détection d’ADN viral par PCR. La charge virale, déterminée dans les sécrétions respiratoires par quantification de l’ADN viral, pourrait permettre de différencier une infection symptomatique d’un simple portage du virus.
Mots clés: Bocavirus humain, HBoV, Infection respiratoire
Abstract
The human bocavirus (HBoV) has been recently identified by means of molecular screening techniques in respiratory tract secretions from children with acute respiratory tract disease. This virus, which belongs to the Parvoviridae family, has been detected worldwide with a 5 to 10% prevalence among children with upper or lower respiratory tract infections, essentially during the winter period. A seroepidemiological study has shown that almost all the children have antibodies to HBoV by the age of five years, and HBoV infection seems to be rare in adults. HBoV is often detected in association with other respiratory viruses. This virus has also been detected in stools, but its role in gastroenteritis has not been yet established. Virological diagnostic of HBoV infection is based on the detection of viral DNA by PCR. Viral load determination by viral DNA quantitation in respiratory tract secretions could be a tool to differentiate between symptomatic HBoV infection and virus carriage.
Keywords: Human bocavirus, HBoV, Respiratory tract infection
1. Introduction
Au cours des 20 dernières années, les progrès dans les techniques de biologie moléculaire ont permis l’identification de très nombreux nouveaux virus. Ainsi, les découvertes du virus de l’hépatite C (HCV), du virus du sarcome de Kaposi (HHV8), mais également du virus de l’hépatite G ou du TTV, sont le résultat de l’application de techniques moléculaires telles que l’hybridation de banque de ADNc par des immuns sérum [1], l’utilisation de stratégies d’amplification avec des amorces dégénérées ou encore les techniques d’hybridation soustractive dénommées representational difference analysis (RDA) [2]. Dans le domaine des infections respiratoires, le recourt extensif à la biologie moléculaire a également apporté des progrès très significatifs, avec les découvertes respectives depuis 2001 du metapneumovirus humain (HMPV) [3], du SARS-Co [4], [5], des nouveaux coronavirus humains HCoV-NL63 et HCoV-HKU1 [6], [7], [8] et du bocavirus humain (HBoV) [9]. Cette liste s’est de plus encore allongée cette année avec la description de nouveaux types de rhinovirus [10] et l’identification de deux nouveaux polyomavirus humains, les polyomavirus KI (KIPyV) [11] et WU (WUPyV) [12] dans des prélèvements respiratoires.
L’identification exhaustive de nouveaux virus est un progrès indéniable dans notre connaissance des virus capables d’infecter l’homme. Toutefois, d’un point de vue médical, ces découvertes moléculaires posent de nombreuses questions sur l’implication réelle de ces nouveaux virus en pathologie infectieuse. En effet, même si la virologie médicale n’est plus réellement tributaire des postulats de Koch (du moins dans leur formulation historique) pour affirmer la pathogenèse d’un nouveau virus, il est souvent bien difficile d’établir les liens de causalité entre la présence d’un génome viral dans un prélèvement et des signes cliniques associés à une pathologie. La description récente du bocavirus humain illustre bien cette problématique. Ainsi, dans cette revue seront décrites les connaissances acquises depuis la découverte de ce virus en 2005 et analysées les questions relatives à la pathogenèse de ce nouveau virus.
2. La découverte du bocavirus humain
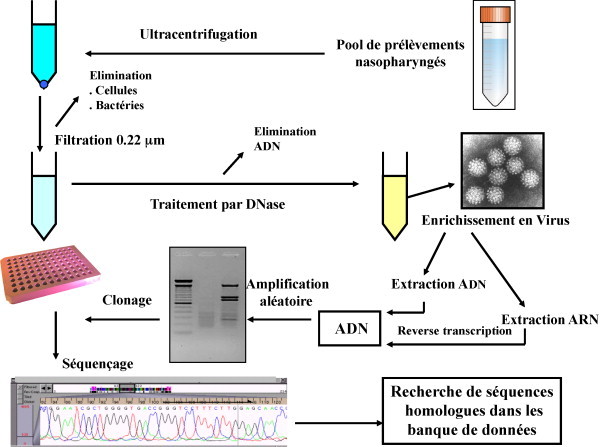
Des auteurs suédois ont décrit une approche moléculaire particulièrement élégante et efficace pour la détection de nouvelles séquences virales. Cette méthode présente l’avantage d’être, notamment, directement utilisable sur des prélèvements biologiques. Elle autorise donc la détection d’agents viraux difficilement cultivables ou des variants viraux dont les séquences échappent aux techniques classiques d’amplification génomique [13]. Dans cette technique appelée DNase sequence independant single primer amplification pour (DNase-SISPA), des prélèvements sont préalablement ultracentrifugés, filtrés et traités à la DNase pour éliminer toutes traces possibles de contamination par les cellules humaines ou bactériennes et obtenir un enrichissement en particules virales. Les acides nucléiques sont alors extraits et amplifiés à l’aide d’amorces dégénérées universelles permettant d’amplifier de manière randomisée toutes les séquences nucléiques présentes dans le milieu. Les produits d’amplification sont clonés et séquencés et l’identification des séquences obtenues s’effectue par comparaison dans les banques de données (Fig. 1 ). En appliquant cette stratégie sur des pools de prélèvements respiratoires, Allander et al., ont identifié de nouvelles séquences virales. L’analyse de ces séquences ainsi que l’organisation génomique de ce nouveau virus ont révélé une proximité phylogénétique avec deux virus animaux ; le parvovirus bovin (BPV) et le virus minute canin (MCV). Ces virus sont des membres du genre Bocavirus (bovine/canine) de la sous-famille des Parvovirinae, famille des Parvoviridae. Les auteurs ont donc proposé le nom de bocavirus humain (HBoV) [9].
Fig. 1.
3. HBoV : aspects virologiques
3.1. Classification
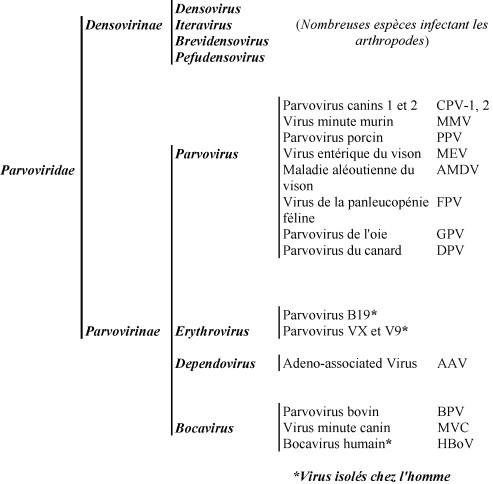
La famille des Parvoviridae regroupe deux sous-familles, les Densovirinae dont les représentants infectent essentiellement les arthropodes et les Parvovirinae qui infectent les mammifères et certains oiseaux. La sous-famille des Parvovirinae est elle même subdivisée en de nombreux genres regroupant de nombreuses espèces pathogènes chez les animaux (Fig. 2 ). Dans cette famille, figure notamment le genre Erythrovirus, qui comprend des espèces présentant un tropisme pour les lignées érythrocytaires et dont le parvovirus B19 est le seul représentant qui infecte l’homme. Le genre Bocavirus ne comptait jusqu’à présent que deux représentants avec le virus minute canin et le parvovirus bovin [14].
Fig. 2.
3.2. Morphologie
Étymologiquement le terme parvovirus évoque des virus de petite taille. Les Parvoviridae sont en effet des virus à ADN non enveloppés parmi les plus petits caractérisés. Des observations récentes en microscopie électronique, conduites sur des prélèvements respiratoires dans lesquels l’ADN du virus avait pu être détecté, ont confirmé que le bocavirus humain présentait toutes les caractéristiques structurales des Parvoviridae. Ainsi, le bocavirus humain est un petit virus nu d’environ 25 nm présentant une capside isocaédrique (Fig. 3 ). Cette observation est d’autant plus intéressante que le virus n’était à ce jour caractérisé que par son génome [15].
Fig. 3.

3.3. Structure génomique
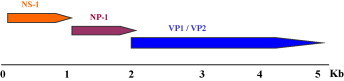
Les Parvoviridae présentent un génome de petite taille (environ 5 kb) constitué d’un ADN simple brin. Du point de vue de leur organisation génomique, on retrouve essentiellement des séquences codantes pour des protéines non structurales en 5′ du génome (gènes NS, NP…) et une succession de cadres de lecture chevauchants en 3′, codant pour deux à trois protéines de capside (gènes VP1, VP2 et VP3) [14]. Ces protéines de capside s’organisent en une capside icosaédrique résistante au pH, aux solvants et à des températures de l’ordre de 50 °C.
Le génome du bocavirus humain contient un gène codant pour des protéines non structurales NS1 et deux gènes codant pour les protéines de capside VP1 et VP2. Un troisième cadre de lecture est également présent, dénommé NP1 mais le rôle de la protéine NP1 demeure inconnu (Fig. 4 ) [9].
Fig. 4.
De nombreuses séquences de bocavirus humains sont désormais disponibles dans les banques de données et montrent une stabilité génétique importante de ce virus à ADN. Toutefois, de nombreux auteurs s’accordent à décrire deux génotypes très proches [16], [17]. Il est encore trop tôt pour savoir si ces deux génotypes définissent également d’éventuels sérotypes distincts.
3.4. Épidémiologie
Depuis la découverte initiale du virus en Suède, le HBoV s’est révélé être un virus largement cosmopolite comme en témoigne sa détection dans de nombreux pays [18], [19], [20], [21], [22], [23]. Le virus peut être détecté tout au long de l’année avec toutefois un pic lors de la période hivernale et le début du printemps. Le virus est essentiellement détecté dans les prélèvements respiratoires avec une prévalence comprise entre 5 et 10 % chez de jeunes enfants avec une infection respiratoire [24], [25], [26], [27]. Dans les différentes études, l’âge médian des enfants infectés par le HBoV est de l’ordre de 12 mois. Cette prévalence place le HBoV selon les études et les régions au deuxième ou troisième rang des agents viraux détectés dans ces prélèvements, derrière le virus respiratoire syncytial mais à une fréquence comparable avec les rhinovirus ou le HMPV. Une particularité de la détection du HBoV dans les prélèvements respiratoires est qu’elle s’accompagne très fréquemment de la codétection d’un autre agent pathogène dans des proportions importantes, de l’ordre de 30 % mais pouvant atteindre plus de 50 % des cas [28].
Quelques études rapportent également la détection du HBoV dans les selles d’enfants présentant une gastroentérite. Si l’on considère, d’une part, la physiopathologie des virus animaux proches tels que le BPV et le MVC, notamment responsables de pathologies digestives chez la vache ou le chiot [29], [30] et d’autre part, la résistance des parvovirus dans l’environnement, le rôle entéropathogène du HBoV mérite des études supplémentaires. De plus, les fréquences de détection dans les selles sont très variables selon les études ; 0,8 % pour une étude en Corée du Sud [31] ou 2 % à Hong Kong [32] et au Brésil [33] alors qu’une équipe espagnole rapporte une prévalence de 9,1 % [34]. Ainsi, le rôle du HBoV dans des pathologies digestives est encore loin d’être prouvé, mais cette présence du virus dans les selles doit faire évoquer une possible transmission de type orofécale du virus en plus de la très vraisemblable transmission aérienne. Enfin, certaines études décrivent une phase virémique chez quelques patients, notamment en phase aiguë de l’infection, [35] suggérant que le HBoV puisse induire des infection systémiques comme cela est d’ailleurs observé avec les autres parvovirus [35], [36].
Il n’existe à ce jour qu’une seule étude séroépidémiologique étudiant la prévalence d’une réponse anticorps dirigée contre le HBoV. Cette étude japonaise très récente, basée sur l’utilisation d’une protéine recombinante de capside (protéine VP1), a analysé par immunofluorescence la présence d’anticorps anti-HBoV dans le sérum de patients issus de différentes classes d’âge [37]. Les résultats de cette étude confirment l’acquisition très précoce du virus dans la vie, le plus souvent avant deux ans, avec une séroprévalence à cinq ans proche de 90 % pour atteindre 100 % à l’âge adulte. Cette étude montre également une séroprévalence de 90 % chez les nourrissons de moins de trois mois, suggérant une acquisition transplacentaire d’anticorps maternels vraisemblablement protecteurs, car cela peut être corrélé à la très faible fréquence de détection du virus observée dans cette classe d’âge.
3.5. Aspects cliniques
De nombreuses études rétrospectives décrivent la détection du HBoV dans des cohortes de patients présentant une infection respiratoire. Dans toutes ces études, le virus a été retrouvé dans une proportion notable – globalement de l’ordre de 5 à 10 % – d’infections respiratoires hautes ou basses particulièrement chez les enfants. L’âge médian des enfants infectés est compris entre 12 et 24 mois et elle semble rare chez les nourrissons de moins de six mois, ce qui laisse supposer qu’il existe une protection conférée par les anticorps d’origine maternelle comme récemment corroboré par une étude de séroprévalence au Japon. De rares cas ont été rapportés chez l’adulte, notamment chez des sujets immunodéprimés [38]. Les signes cliniques les plus fréquemment observés sont une toux quasi constante, de la fièvre et une rhinorrhée. Dyspnée, sifflements et détresse respiratoire sont également des signes fréquemment observés. Des signes d’otites moyennes aiguës sont également souvent décrits [35]. Certaines études rapportent des manifestations digestives associées fréquentes ainsi que quelques manifestations cutanées. Enfin, le rôle du bocavirus dans l’exacerbation des crises d’asthme a également été évoqué dans plusieurs études [35], [39].
Les tableaux cliniques associés à l’infection par le HBoV sont d’intensité variable, allant de l’atteinte respiratoire mineure à la bronchiolite sévère ou la pneumopathie. Il n’est pas possible d’après les données actuelles de distinguer, au niveau de leur présentation clinique, les infections à HBoV des infections dues aux autres virus respiratoires. Des infections à HBoV ont été rapportées chez des prématurés ou des sujets présentant une maladie sous-jacente [18], [20], [25]. Il se pourrait donc que cette infection soit favorisée par des conditions prédisposantes.
Des signes digestifs sont assez fréquemment décrits chez les enfants infectés par le HBoV [24], [25], [27]. Plusieurs études ont mis en évidence la présence du HBoV dans les selles d’enfants souffrant de gastroentérite [31], [32], [33], [34]. Comme dans le cas des infections respiratoires, le HBoV est également souvent détecté dans les selles en situation de co-infection [34]. Cette présence du virus dans les selles pourraient être simplement expliquée par la déglutition de sécrétions nasopahryngées présentant du HBoV. Toutefois, certaines études où les enfants avec des signes respiratoires ont été exclus suggèrent que la présence du HBoV dans les selles soit bien due à la réplication du virus dans les entérocytes [32], [34]. Ainsi, le rôle entéropathogène du HBoV reste controversé et mérite de plus amples études.
À ce jour la plupart des études conduites sur le HBoV sont des approches rétrospectives par techniques moléculaires, sur des populations sélectionnées de patients hospitalisés pour une infection respiratoire. Même si un ensemble d’éléments concourt à faire du HBoV humain un probable agent d’infection respiratoire, un biais méthodologique persiste dans toutes ces approches. De plus, le HBoV est détecté de façon assez fréquente avec d’autres virus respiratoires et il n’existe pas, à ce jour, de modèle animal ni même de modèle cellulaire disponible. Il existe toutefois quelques études qui ont apportées des contributions significatives en incluant des populations témoins pour lesquelles le virus n’était pas ou peu détecté par rapport aux sujets atteints de pathologies respiratoires [24], [25]. Récemment, il a été proposé, dans une étude clinique sur l’implication du HBoV dans les sifflements aigus de l’enfant, de considérer la charge virale HBoV dans les prélèvements respiratoires pour tenter d’appréhender la pathogenèse du virus [35]. Ainsi, lorsque le HBoV est présent avec des charges virales fortes il serait probablement responsable des signes respiratoires. Au contraire, des charges virales faibles, significativement associées aux situations de coinfections, seraient liées à une sécrétion asymptomatique du virus ou pourraient être le reflet d’une excrétion virale prolongée comme cela est fréquemment observé avec les parvovirus. Cette dernière hypothèse, non vérifiée à ce jour, permet également d’expliquer les forts taux de co-infections observés, l’infection par un second virus survenant pendant une phase d’excrétion asymptomatique prolongée du HBoV ou induisant une réactivation du virus.
3.6. Mise en évidence du virus et diagnostic
À ce jour, aucun modèle cellulaire ou animal ne permet la culture du virus. La mise en évidence du virus peut donc passer par de fastidieuses observations en microscopie électronique, mais c’est actuellement la biologie moléculaire qui est employée dans toutes les études sur le bocavirus humain. Des techniques quantitatives de PCR en temps réel sont désormais disponibles [20], [40] et des solutions commerciales commencent à être proposées.
Il n’y a pas à ce jour d’indication pour une recherche du HBoV en pratique courante. Toutefois, lorsqu’une infection respiratoire aiguë est explorée pour une étiologie virale, le HBoV mériterait d’être ajouté au panel des virus recherchés, notamment par des approches quantitatives, la charge virale pouvant constituer un marqueur de pathogénicité.
4. Conclusion
Depuis la découverte du bocavirus humain et les nombreuses études publiées, son rôle en pathologie humaine est encore discuté. Toutefois, certaines évidences commencent à émerger. Ce virus apparaît hautement prévalent quelles que soient les régions du monde considérées. L’infection est précoce puisque les individus de plus de cinq ans présentent presque tous des anticorps. Le virus est très fréquemment détecté dans les prélèvements respiratoires de jeunes enfants où son rôle comme agent étiologique de l’infection respiratoire est très probable, notamment lorsqu’il est isolé seul ou avec une charge virale élevée. Des études sont encore indispensables pour explorer le rôle du virus dans les situations de co-infection ou lorsqu’il est excrété en faible quantité dans le tractus respiratoire. De plus, la responsabilité du HBoV dans d’autres infections comme les gastroentérites reste à établir par de plus amples études.
Références
- 1.Choo Q.L., Kuo G., Weiner A.J., Overby L.R., Bardley D.W., Houghton M. Isolation of cDNA clone derived from a blood borne non-A non-B viral hepatitis genome. Science. 1989;244:359–361. doi: 10.1126/science.2523562. [DOI] [PubMed] [Google Scholar]
- 2.Chang Y., Cesarman E., Pessin M.S., Lee F., Culpepper J., Knowles D.M. Identification of Herpes virus-like DNA sequences in aids-associated Kaposi's sarcoma. Science. 1994;266:1865–1869. doi: 10.1126/science.7997879. [DOI] [PubMed] [Google Scholar]
- 3.Van Den Hoogen B.G., De Jong J.C., Groen J., Huiken T., De Groot R., Fouchier R.A.M. A newly discovered human pneumovirus isolated from young children with respiratory tract disease. Nat Med. 2001;7:719–724. doi: 10.1038/89098. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Ksiazek T.G., Erdman D., Goldsmith C.S., Zaki S.R., Peret T., Emery S. A novel coronavirus associated with severe acute respiratory syndrome. N Engl J Med. 2003;348:1953–1966. doi: 10.1056/NEJMoa030781. [DOI] [PubMed] [Google Scholar]
- 5.Peiris J.S.M., Lai S.T., Poon L.L.M., Guan Y., Yam L.Y.C., Lim W. Coronavirus as a possible cause of severe acute respiratory syndrome. Lancet. 2003;361:1319–1325. doi: 10.1016/S0140-6736(03)13077-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Fouchier R.A., Hartwig N.G., Bestebroer T.M., Niemeyer B., De Jong J.C., Simon J.H. A previously undescribed coronavirus associated with respiratory disease in humans. Proc Natl Acad Sci USA. 2004;101:6212–6216. doi: 10.1073/pnas.0400762101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Van Der Hoeck L., Pyrc K., Jebbink M.F., Vermeulen-Oost W., Berkhout R.J., Wolthers K.C. Identification of a new human coronavirus. Nat Med. 2004;10:368–373. doi: 10.1038/nm1024. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Woo P.C., Lau S.K.P., Chu C., Chan K., Tsoi H., Huang Y. Characterization and complete genome sequence of a novel coronavirus, coronavirus HKU1, from patients with pneumonia. J Virol. 2005;79:884–895. doi: 10.1128/JVI.79.2.884-895.2005. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Allander T., Tammi M.T., Erickson M., Bjerkner A., Tiveljung-Lindell A., Andersson B. Cloning of a human parvovirus by molecular screening of respiratory tract samples. Proc Natl Acad Sci USA. 2005;102:12891–12896. doi: 10.1073/pnas.0504666102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Mc Erlean P., Shackelton L.A., Lambert S.B., Nissen M.D., Sloots T.P., Mackay I.M. Characterization of a newly identified human rhinovirus HRV-QPM, discovered in infants with bronchiolitis. J Clin Virol. 2007;39:67–75. doi: 10.1016/j.jcv.2007.03.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Allander T., Andreasson K., Gupta S., Bjerkner A., Bogdanovic G., Persson M.A.A. Identification of a third polyomavirus. J Virol. 2007;81:4130–4136. doi: 10.1128/JVI.00028-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Gaynor A.M., Nissen M.D., Whiley D.M., Mackay I.M., Lambert S.B., Wu G. Identification of a novel polyomavirus from patients with acute respiratory tract infections. PLoS Path. 2007;3:e64. doi: 10.1371/journal.ppat.0030064. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Allander T., Emerson S.U., Engle R.E., Purcell R.H., Bukh J. A virus discovery method incorporating Dnase treatment and its application to the identification of two bovine parvovirus species. Proc Natl Acad Sci USA. 2001;98:11609–11614. doi: 10.1073/pnas.211424698. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Hueffer K., Parrish C. Parvovirus host range, cell tropism and evolution. Curr Opin Microbiol. 2003;6:392–398. doi: 10.1016/s1369-5274(03)00083-3. [DOI] [PubMed] [Google Scholar]
- 15.Brieu N., Gay B., Segondy M., Foulongne V. Electron microscopy observation of human bocavirus (HBoV) in nasopharyngeal samples from HBoV-infected children. J Clin Microbiol. 2007;45:3419–3420. doi: 10.1128/JCM.00545-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 16.Bastien N., Brandt K., Dust K., Ward D., Li Y. Human bocavirus infection, Canada. Emerg Infect Dis. 2006;12:848–850. doi: 10.3201/eid1205.051424. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Smuts H., Hardie D. Human bocavirus in hospitalized children, South Africa. Emerg Infec Dis. 2006;12:1457–1458. doi: 10.3201/eid1209.051616. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Arnold J.C., Singh K.K., Spector S.A., Sawyer M.H. Human bocavirus: prevalence and clinical spectrum at a children hospital. Clin Infect Dis. 2006;43:283–288. doi: 10.1086/505399. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Chung J.Y., Han T.H., Kim C.K., Kim S.W. Bocavirus infection in hospitalized children, South Korea. Emerg Infect Dis. 2006;12:1254–1256. doi: 10.3201/eid1208.060261. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Foulongne V., Olejnik Y., Elaertz S., Perez V., Rodière M., Segondy M. Human bocavirus in French children. Emerg Infect Dis. 2006;12:1251–1253. doi: 10.3201/eid1208.060213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Kaplan N.M., Dove W., Abu-Zeid A., Shamoon H.E., Abd-Eldayem S., Hart A. Human bocavirus among children, Jordan. Emerg Infect Dis. 2006;12:1418–1420. doi: 10.3201/eid1209.060417. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Ma X., Endo R., Ishiguro N., Ebihara T., Ishiko H., Ariga T. Detection of human bocavirus in Japanese children with lower respiratory tract infections. J Clin Microbiol. 2006;44:1132–1134. doi: 10.1128/JCM.44.3.1132-1134.2006. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Qu X.-W., Duan Z.-J., Qi Z.-Y., Xie Z.P., Gao H.C., Liu W.P. Human bocavirus infection, People's Republic of China. Emerg Infect Dis. 2007;13:165–168. doi: 10.3201/eid1301.060824. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Kesebir D., Vasquez M., Weibel C., Shapiro E.D., Ferguson D., Landry M.L. Human bocavirus infection in young children in the United States: molecular epidemiological profile and clinical characteristics of a newly emerging respiratory virus. J Infect Dis. 2006;194:1276–1282. doi: 10.1086/508213. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Manning A., Russel V., Eastick K., Leadbetter G.H., Hallam N., Templeton K. Epidemiological profile and clinical associations of human bocavirus and other human parvoviruses. J Infect Dis. 2006;194:1283–1290. doi: 10.1086/508219. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Sloots T.P., McErlean P., Speicher D.J., Arden K., Nissen M.D., Mackay I.A. Evidence of human coronavirus HKU1 and human bocavirus in Australian children. J Clin Virol. 2005;35:99–102. doi: 10.1016/j.jcv.2005.09.008. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 27.Weissbrich B., Neske F.F., Schubert J., Blath K., Blessing K., Kreth H.W. Frequent detection of bocavirus DNA in German children with respiratory tract infections. BMC Infect Dis. 2006;6:109–115. doi: 10.1186/1471-2334-6-109. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 28.Foulongne V., Segondy M. Human bocavirus: a new respiratory pathogen. Future Virol. 2007;2:173–181. [Google Scholar]
- 29.Carmichael L.E., Schlafer D.H., Hashimoto A. Minute virus of canines (MVC, canine parvovirus type-1): pathogenicity for pups and seroprevalence estimate. J Vet Diagn Invest. 1994;6:165–174. doi: 10.1177/104063879400600206. [DOI] [PubMed] [Google Scholar]
- 30.Carmichael L.E., Schlafer D.H., Hashimoto A. Pathogenicity of minute virus of canines (MVC) for the canine fetus. Cornell Vet. 1991;81:151–171. [PubMed] [Google Scholar]
- 31.Lee J.I., Chung J., Han T.H., Song M., Hwang E. Detection of human bocavirus in children hospitalized because of gastroenteritis. J Infect Dis. 2007;196:994–997. doi: 10.1086/521366. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 32.Lau S.K.P., Yip C.C.Y., Que T., Lee R.A., Au-Yeung R.K.H., Zhou B. Clinical and molecular epidemiology of human bocavirus in respiratory and fecal samples from children in Hong Kong. J Infect Dis. 2007;196:986–993. doi: 10.1086/521310. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Albuquerque M.C.M., Rocha L.N., Benati F.J., Soares C.C., Maranhao A.G., Ramirez M.L. Human bocavirus infection in children with gastroenteritis. Braz Emerg Infect Dis. 2007;13:1756–1758. doi: 10.3201/eid1311.060671. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Vicente D., Cilla G., Montes M., Perez-Yarza E.G., Perez-Trallero E. Human bocavirus a respiratory and enteric virus. Emerg Infect Dis. 2007;13:636–637. doi: 10.3201/eid1304.061501. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.Allander T., Jartti T., Gupta S., Niesters H.G.M., Lehtinen P., Osterback T. Human bocavirus and acute wheezing in children. Clin Infect Dis. 2007;44:904–910. doi: 10.1086/512196. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 36.Schenk T., Strahm B., Kontry U., Hufnagel M., Neumann-Haefelin D., Falcone V. Disseminated bocavirus infection after stem cell transplant. Emerg Infect Dis. 2007;13:1425–1427. doi: 10.3201/eid1309.070318. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Endo R., Ishiguro N., Kikuta H., Teramoto S., Shirkoohi R., Ma X. Seroepidemiology of human bocavirus in Hokkaido prefecture, Japan. J Clin Microbiol. 2007;45:3218–3223. doi: 10.1128/JCM.02140-06. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Kupfer B., Vehreschild J., Cornely O., Kaiser R., Plum G., Viazov S. Severe pneumonia and human bocavirus in adult. Emerg Infect Dis. 2006;12:1614–1616. doi: 10.3201/eid1210.060520. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Gendrel D., Guedj R., Pons-Catalano C., Emerian A., Raymond J., Rozenberg F. Human bocavirus in children with asthma. Clin Infect Dis. 2007;45:404. doi: 10.1086/519505. [DOI] [PubMed] [Google Scholar]
- 40.Lu X., Chittaganpitch M., Olsen S.J., Mackay I.M., Sloots T.P., Fry A.M. Real-time PCR assay for detection of bocavirus in human specimens. J Clin Microbiol. 2006;44:3231–3235. doi: 10.1128/JCM.00889-06. [DOI] [PMC free article] [PubMed] [Google Scholar]


