Abstract
Les enfants voyageurs sont des millions dans le monde et sont exposés à de nombreux risques, infectieux ou non, dont les praticiens n’ont pas toujours l’expérience. La consultation d’un enfant fébrile après un voyage est de plus en plus fréquente. Ainsi, la notion d’antécédent de voyage doit être recherchée devant tout enfant fébrile. La démarche diagnostique prend en compte prioritairement des pathologies intertropicales potentiellement graves, comme le paludisme, qui exigent d’être recherchées et traitées efficacement sans délai. Rapidement sont recherchées des infections contagieuses à risque épidémique qui nécessitent la mise en place de mesures d’hygiène et de santé publique. L’interrogatoire évalue les caractéristiques de la fièvre, les vaccinations réalisées, les antécédents médico-chirurgicaux et les risques d’exposition aux infections lors du voyage d’après les données géographiques, saisonnières, environnementales, socioculturelles et épidémiologiques. Il oriente avec les données cliniques et paracliniques élémentaires certains examens complémentaires qui permettent un diagnostic étiologique et un traitement optimal dans près de 75 % des cas. La majorité des causes de fièvre des enfants au retour de voyage sont des infections cosmopolites. En cas de paludisme, le traitement antipaludique est une urgence. Cet article décrit la démarche diagnostique et la prise en charge recommandée en France devant un enfant fébrile de retour de voyage.
Abstract
Child travelers are numerous, exposed to the risk of diseases, both infectious and noninfectious, for which practitioners often lack experience. The assessment of febrile returning child travelers is becoming more frequent and challenging. The question of previous travel should be foremost in the checklist of the interview of any febrile child traveler, because this implies a possible tropical disease such as malaria that may be life-threatening. These need to be investigated and treated effectively and rapidly. There are highly contagious infections that could pose public health risks requiring implementation of hygienic and public health measures. A detailed immunization, medical, and travel history for exposure to infectious risks using geographic, seasonal, environmental, sociocultural, and epidemiological data are needed. Along with clinical examination and elementary first-line investigations, the history should guide second-line exams, which will provide the etiology and optimal treatment in approximately 75 % of cases. The majority of children will have a cosmopolitan infection that resolves spontaneously or is simple to treat. Malaria will need urgent and specific treatment. This article describes guidance on first-line evaluation and management of febrile child travelers as recommended in France.
1. Épidémiologie
Le nombre d’enfants voyageurs augmente chaque année. Les enfants migrants sont estimés à plusieurs millions dans le monde, incluant les expatriés et les touristes (http://mkt.unwto.org/fr/publication/faits-saillants-omt-du-tourisme-edition-2014). La probabilité d’examiner un enfant fébrile après un voyage est ainsi de plus en plus grande. En Suisse, le taux d’incidence de la fièvre dans le mois suivant le retour d’un voyage tropical des enfants voyageurs ayant consulté préalablement une clinique de médecine des voyages était de 1,7 % [0,8–3,1] [1]. La fièvre était le 3e motif de consultation des enfants arrivant de voyage dans un réseau international de cliniques sur une période de 10 ans (n = 1591 : digestifs [28 %], cutanés [25 %], fièvre [23 %], respiratoires [11 %]) [2]. Près de la moitié des causes de fièvres chez l’enfant arrivant d’un voyage dans les 3 mois précédents et consultant à l’hôpital est cosmopolite, infectieuse ou non [3], [4], [5]. En France, la majorité des enfants consultant à l’hôpital dans les 3 mois suivant un voyage tropical ou subtropical n’avaient pas consulté avant de partir ou avaient eu une observance insuffisante des recommandations de prévention et des prescriptions prophylactiques préalables au voyage [3], [6]. Parmi ces enfants et particulièrement parmi ceux ayant eu un paludisme d’importation, il y a une surreprésentation d’enfants d’immigrés visitant leur famille et les amis dans le pays d’origine de leurs parents [7]. Cet article décrit la démarche diagnostique et la prise en charge recommandée en France devant un enfant fébrile de retour de voyage.
2. Évaluation et démarche diagnostique
Devant un enfant présentant un état septique grave, les diagnostics urgents (paludisme, méningite, septicémie) doivent être évoqués, recherchés, diagnostiqués et s’ils sont confirmés, traités sans délai. Il est utile au clinicien de guider sa démarche diagnostique à l’aide d’un algorithme (Fig. 1 ).
Fig. 1.
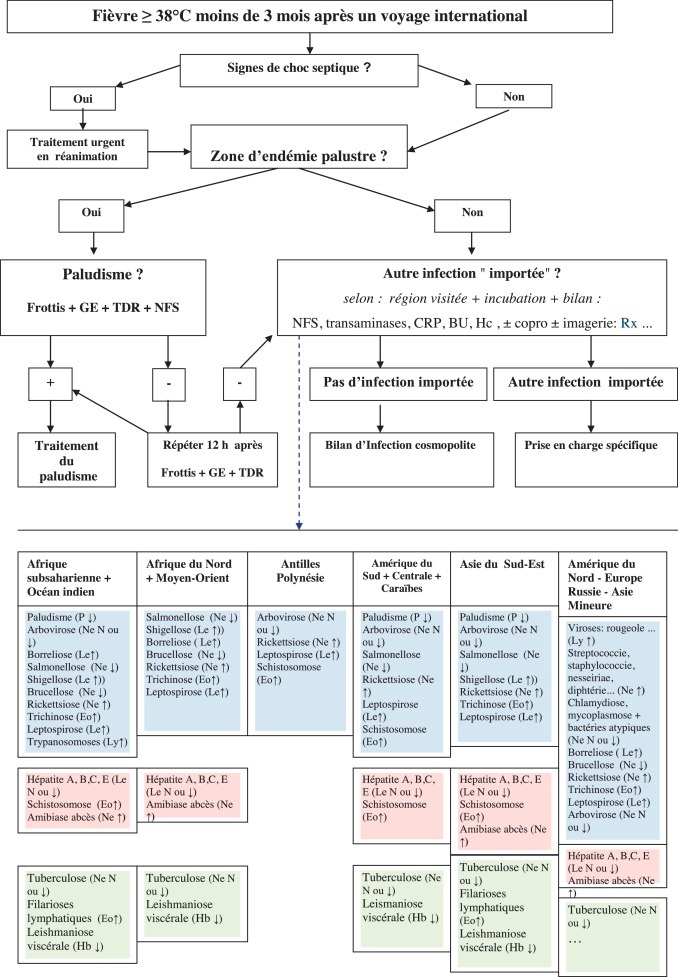
Algorithme de diagnostic d’une fièvre chez l’enfant de retour de voyage et principales causes. BU : bandelette urinaire ; Copro : examen de selles + coproculture ; CRP : protéine C réactive ; Eo : éosinophile ; Hb : hémoglobine ; Hc : hémoculture ; Imagerie : radio, échographie, tomodensitométrie, résonance magnétique nucléaire ; Le : leucocytes ; Ly : lymphocytes ; N : normal ; Ne : neutrophiles ; NFS : numération formule sanguine ; P : plaquettes ; TDR : test de diagnostic rapide ; GE : goutte épaisse ; sem : semaine. Période d’incubation moyenne (couleurs) :  : < 14 j ;
: < 14 j ;  : 2–6 sem ;
: 2–6 sem ;  : > 6 sem.
: > 6 sem.
2.1. Interrogatoire
L’interrogatoire est déterminant pour orienter la stratégie diagnostique, étiologique et thérapeutique devant un enfant fébrile. La notion d’antécédent de voyage dans l’année précédente doit être systématiquement recherchée. Il est important de s’assurer d’une bonne compréhension des informations données par les parents, au moyen si nécessaire d’un interprète fiable (par exemple : Inter Service Migrant). L’anamnèse permet d’analyser les caractéristiques de la fièvre (température rectale ≥ 38 °C ; intensité, variations, sensibilité aux traitements), de rechercher les signes fonctionnels associés (frissons, sueurs, vomissements, diarrhée, toux, dyspnée, éruptions, polyalgie, céphalées, convulsions, troubles de l’appétit…) et de préciser la chronologie des symptômes. L’observation du carnet de santé et de vaccination est indispensable pour vérifier que les vaccins recommandés en France et ceux recommandés pour les risques du voyage ont été effectués [8], [9]. Elle recherche des antécédents médicaux (maladie inflammatoire, traitement antipyrétique, antipaludique présomptif, immunosuppresseur…) et chirurgicaux, la prescription d’une prophylaxie antipaludique (d’exposition et médicament) dont l’observance doit être précisée.
L’interrogatoire permet d’évaluer l’exposition aux risques infectieux pyrogènes durant le voyage en fonction de l’environnement, de la durée et des activités (Tableau 1 ) :
-
•
lieu(x) de séjour et de transit durant le voyage : environnement local (rural, plage, montagne, urbain), type d’activité (résidence familiale autochtone, centre de vacances, campement et randonnée aventureuse, bain en eau douce…) ;
-
•
durée d’exposition aux risques (dates de séjour et saison) ;
-
•
piqûres ou morsures d’insectes, d’arthropode ou d’autre animal ;
-
•
épidémies locales ;
-
•
notion de syndrome infectieux chez les proches durant le voyage ;
-
•
notion d’une hospitalisation à l’étranger (risque d’infection nosocomiale par une bactérie hautement résistante [BHR]) ;
-
•
injections parentérales ou transfusion.
Tableau 1.
Principales infections fébriles à évoquer selon les activités et l’environnement de l’enfant durant son voyage.
| Condition d’exposition | Infections fébriles à évoquer |
|---|---|
| Ingestion d’eau non potable ou d’aliments ni pelés, ni cuits, ni bouillis | Amibiase, typhoïde, salmonelloses, shigellose, E. coli, choléra, hépatites A, E ; poliomyélite |
| Ingestion de laitages crus | Brucellose, salmonellose, shigellose, tuberculose, coxiellose, listériose |
| Ingestion de viande insuffisamment cuite | Trichinose, salmonelloses, shigellose, E. coli entérohémorragique, campylobactériose, toxoplasmose |
| Ingestion de plantes (cresson) | Fasciolose |
| Ingestion de crustacés crus | Hépatite A, choléra |
| Piqûres de moustique | Paludisme, filarioses lymphatiques Arboviroses : dengue, chikungunya, encéphalite japonaise, virus du Nil occidental, virus zika, fièvre jaune, fièvre de la vallée du rift |
| Piqûres de mouche glossines (tsé-tsé) | Trypanosomiase brucei rhodesiense (Afrique de l’Est) Trypanosomiase gambiense (Afrique de l’Ouest) |
| Piqûres de phlébotome | Leishmanioses, virose Toscana |
| Morsure de tique | Borrélioses, rickettsioses, coxiellose, babésiose, erlichiose, tularémie Arboviroses : encéphalites à tique, FHV (Crimée, Congo) |
| Morsure de poux | Rickettsioses (typhus exanthématique), borrélioses, bartonelloses |
| Morsure de puce | Yersiniose (peste), rickettsioses (typhus murin) |
| Morsure de réduve (triatome) | Trypanosomiase cruzi (Chagas) |
| Contact eau douce et baignade | Schistosomoses, leptospirose, mélioïdose |
| Contact pieds-nus sur sol de terre, sable | Leptospirose, mélioïdose, histoplasmose, coccidiomycose |
| Contact avec des chiens, singes, chats | Rage, toxoplasmose |
| Contact avec des bovins, ovins… | Coxiellose (fièvre Q), anthrax, fièvre de la vallée du rift |
| Contact avec des rongeurs (ou leurs excréments) | Leptospirose, rickettsioses, tularémie, sodoku, FHV : virus Hantaan… |
| Contact avec des oiseaux | Psittacose, grippe aviaire… |
| Contact avec liquides humains, direct (sexe) ou indirect (tatouages…) | Hépatites B, C, VIH, herpès, virus d’Epstein Barr, syphilis, gonococcie, chlamydia, virus Ebola |
| Proximité d’un malade (transmission aérienne) | Méningite à méningocoque, tuberculose, rougeole, pneumococcie |
VIH : virus immunodéficience humaine ; FHV : fièvre hémorragique virale.
Certains risques sont assez spécifiques de zones d’endémie et de la saison (paludisme et dengue pendant la saison des pluies et méningite en Afrique durant la sécheresse…), d’autres sont ubiquitaires mais devenus rares en Europe de l’Ouest (typhoïde, rage…) et les plus fréquents sont des affections cosmopolites des voies aériennes et urinaires qui sont favorisées par les conditions et l’environnement du voyage (déshydratation, air conditionné, hygiène négligée, fatigue…). Il faut comparer le temps écoulé depuis l’exposition présumée et le début des signes et les périodes d’incubation extrêmes des causes possibles (Fig. 1).
2.2. Examen clinique
L’examen physique doit être complet et rechercher d’emblée des signes d’un choc septique qui doit être traité en urgence. Il recherche particulièrement une raideur méningée, une hépatosplénomégalie, des signes cutanés ou muqueux, un syndrome hémorragique, des adénopathies, des signes d’infection respiratoire, une diarrhée… (Tableau 2 ). La connaissance des affections fébriles du retour de voyage chez l’enfant, l’expérience clinique, la connaissance des facteurs de risque (jeune âge, sexe, visiteur de la famille et des amis, durée de séjour, environnement) [3] et celle des données épidémiologiques internationales actualisées [6] sont nécessaires pour estimer les risques selon une hiérarchie d’urgence individuelle et collective afin de choisir les tests de diagnostic étiologique.
Tableau 2.
Principales infections à évoquer selon les signes cliniques.
| Signes cliniques | Infections fébriles à évoquer |
|---|---|
| Adénopathies | Tuberculose, leishmaniose viscérale, rickettsioses, brucellose, filarioses lymphatiques, VIH, yersiniose (peste), trypanosomiase africaine… |
| Diarrhée | Paludisme, salmonellose, shigellose, campylobacter, E. coli, virose, trichinose |
| Signes cutanés | Arboviroses, rickettsioses, hépatite, leishmaniose viscérale, filarioses, trypanosomiase africaine, bilharziose, trichinose |
| Hémorragies : pétéchies, ecchymoses, saignements muqueux… | Arbovirose (dengue), méningite, leptospirose, rickettsioses, hépatite, FHV : ébola… |
| Hépatomégalie | Paludisme, hépatite, leishmaniose viscérale, brucellose, abcès amibien du foie, borréliose, leptospirose, bilharziose (invasion), fasciolose |
| Ictère | Paludisme, hépatite, leptospirose, arbovirose, angiocholite |
| Signes neuropsychiques : syndrome confusionnel, ataxie, paresthésies, parésies… | Paludisme, arbovirose, méningite, typhoïde, neurocysticercose, VIH, rage, typhus, trypanosomiase africaine |
| Signes respiratoires | Virus, streptocoques, mycoplasme, légionellose, tuberculose, coxiellose (fièvre Q), bilharziose ou ascaridiose (syndrome de Loeffler) (invasion), histoplasmose, coccidiomycose, ecchinococose |
| Splénomégalie | Paludisme, leishmaniose viscérale, brucellose, borréliose, bilharziose (invasion), typhoïde |
VIH : virus immunodéficience humaine ; FHV : fièvre hémorragique virale.
D’après Spira [12].
2.3. Examens complémentaires
Ils sont nécessaires et peuvent se limiter initialement à ceux dont les indices de performance diagnostique ont été validés [4], [5] : hémocultures, frottis avec goutte épaisse et test de diagnostic rapide (TDR) (si exposition possible au paludisme dans les 2 années précédentes, en dépit de la bonne observance prétendue de la prophylaxie, qui n’est pas efficace à 100 % ; délai du résultat ≤ 2 heures, à répéter dans les 12 h si négatif), numération formule sanguine (NFS), transaminases, protéine C réactive (CRP), bandelette urinaire [3]. Ces examens de première ligne sont à peu près consensuels en Europe [10]. Les résultats des premières investigations peuvent donner des arguments en faveur d’une infection (Tableau 3 ). Par exemple, l’association thrombopénie, anémie et hypoglycémie est évocatrice de paludisme, tandis qu’une thrombopénie associée à une leucopénie évoque la dengue.
Tableau 3.
Principales infections à évoquer selon les signes biologiques.
| Signes biologiques | Infections fébriles à évoquer |
|---|---|
| Anémie | Paludisme, leishmaniose viscérale, borréliose, trypanosomiase africaine |
| Anémie + syndrome hémorragique | FHV, leptospirose |
| Cytolyse hépatique | Hépatite virale A, B, C, E, FHV (dengue, fièvre jaune…), paludisme, leptospirose, coxiellose (fièvre Q), borréliose |
| Créatinine élevée | Leptospirose, FHV (fièvre jaune…) |
| Hyperbilirubinémie | Paludisme, hépatite virale, arbovirose, leptospirose |
| Hyperéosinophilie | Filarioses lymphatiques, fasciolase, trichinose, bilharziose (invasion), ascaridiose (invasion), toxocarose, anguillulose maligne |
| Hypergammaglobulinémie | Leishmaniose, trypanosomiase africaine, VIH, paludisme viscéral évolutif |
| Leuconeutropénie | Paludisme, leishmaniose, typhoïde, brucellose, viroses dont FHV |
| Lymphomonocytose | Hépatite virale, CMV, HIV (primo-infection), EBV |
| Polynucléose neutrophile | Amibiase hépatique, borréliose, trypanosomiase africaine, pyogènes, leptospirose |
| Thrombopénie | Paludisme, leishmaniose viscérale, arboviroses (dengue), FHV, leptospirose |
| Syndrome inflammatoire très important | Amibiase hépatique, leishmaniose viscérale, abcès bactériens, trypanosomiase africaine |
VIH : virus immunodéficience humaine ; FHV : fièvre hémorragique virale ; EBV : virus d’Epstein Barr ; CMV : cytomégalovirus.
Selon l’orientation clinique, des prélèvements et des analyses biologiques peuvent être faits immédiatement (TDR : paludisme, streptotest…) ou prescrits (liquide cérébrospinal, articulaire ou pleural, sécrétions pharyngées, crachats, selles, urine, ou prélèvement cutané…). Dans les premiers jours de la fièvre, les sérologies ne sont pas significatives. En revanche, l’amplification génique en temps réel (RT-PCR) pour certaines pathologies (arboviroses) pourrait être contributive selon le diagnostic envisagé. Des examens parasitologiques ou mycologiques spécifiques peuvent être indiqués selon l’avis d’un infectiologue ou d’un microbiologiste expérimenté.
Dans certains cas, des examens d’imagerie, comme une échographie abdominopelvienne (amibiase hépatique…) ou une radio de thorax, peuvent être utiles au diagnostic (Fig. 1).
3. Maladies infectieuses fébriles les plus fréquentes
Devant un enfant fébrile qui revient de voyage, il est important d’éliminer d’abord les maladies graves qui nécessitent un traitement immédiat (paludisme, méningite bactérienne, typhoïde, leptospirose, certaines rickettsiose [Rickettsia rickettsii] et borrélioses) et celles qui sont contagieuses et dépourvues de traitement spécifique (virus Ebola, coronavirus MERS (syndrome respiratoire du Moyen-Orient) ; syndrome respiratoire aigu sévère (SRAS), virus de la grippe aviaire…) (Tableau 4 ).
Tableau 4.
Caractéristiques des principales infections subtropicales et tropicales fébriles.
| Infection | Incubation (extr.) | Contamination | Signes cliniques | Signes biologiques | Diagnostic |
|---|---|---|---|---|---|
| Amibiase hépatique | 14 j plusieurs mois | Orofécale | Hépatomégalie douloureuse Autres localisations viscérales possibles |
Polynucléose | Sérologie Imagerie |
| Arboviroses : dengue, chikungunya, zika, virus Nil occidental, encéphalite japonaise | 4–8 j | Moustiques Zone endémique ou épidémique |
Syndrome viral Éruption Déficit neurologique |
Leucopénie Thrombopénie |
RT-PCR, Ag NS1 Sérologie |
| Borréliose | 1–10 j | Tiques | Éruptions, céphalées, troubles digestifs, splénomégalie | Polynucléose, cytolyse hépatique, méningite lymphocytaire | Frottis sanguin PCR Sérologie |
| Brucellose | 7–28 j | Lait, viande Mouton, chèvre |
Hépatosplénomégalie, adénopathies Foyer ostéoarticulaire |
Leucopénie | Hémoculture Sérologie |
| Fasciolose | 1 mois | Végétaux crus | Ictère récurrent | Hyperéosinophilie | Sérologie |
| Hépatite : A, E,B… | 1 mois | Orofécale, aliment, sang, sexe, injection… | Ictère | Cytolyse hépatique | Sérologie |
| Leishmaniose viscérale | 2–6 mois | Plébotome | Hépatosplénomégalie, adénopathies | Pancytopénie ± complète Hyper-IgM |
Frottis moelle osseuse Leucoconcentration Sérologie |
| Leptospirose | 7–12 j | Morsure rongeurs, baignade ou contact lésion cutanée, eaux contaminées | Ictère, conjonctivite, myalgies, syndrome méningé | Hyperpolynucléose, cytolyse hépatique, méningite LCR clair | Sérologie |
| Paludisme | 6 j–3 ans | Moustiques (anophèle) | Troubles digestifs Splénomégalie |
Thrombopénie | Antigénémie (TDR) Frottis sang Goutte épaisse |
| Rickettsioses | 7–21 j | Tiques | Exanthème | Polynucléose | Sérologie |
| Schistosomose | 4–8 semaines | Baignade ou contact eau douce stagnante | Manifestations allergiques | Hyperéosinophilie | Sérologie Œufs bilharzies urine |
| Trichinose | 2 j–1 mois | Viande de porc, cheval | Myalgies Œdème face extrémités |
Hyperéosinophilie | Sérologie |
| Trypanosomoses | 5–20 j | Glossines | Hépatosplénomégalie, adénopathies, signes neurologiques | Hyperlymphocytose, hyper-IgM | Frottis sang, LCR, goutte épaisse, sérologie sang, LCR |
| Tuberculose | 1 mois–plusieurs années | Aérienne Ingestion (rare) |
Signes respiratoires, amaigrissement | Leucopénie | Quantiféron BK Recherche BK IDR tuberculine Rx thorax |
| Typhoïde | 7–18 j | Orofécale | Asthénie, céphalée, éruption, tuphos | Leucopénie | Hémoculture Coproculture Sérologie |
RT-PCR : amplification génique en temps réel ; Ag : antigène ; TDR : test de diagnostic rapide ; IDR : intradermoréaction à la tuberculine : j : jour ; Ig : immunoglobulines ; LCR : liquide céphalorachidien ; Rx : radiographie.
Chez les enfants consultant à l’hôpital pour une fièvre au retour d’un voyage, les pathologies non tropicales sont majoritaires (54 % pour West et al. : viroses, diarrhée, infection respiratoire basse ou haute, infection urinaire, méningite, tuberculose, infection cutanée ou sous-cutanée, syndrome de Kawasaki, ostéomyélite…). Elles le sont aussi pour ce motif de consultation en pédiatrie communautaire [3]. Dans la plupart des études le paludisme est la principale cause tropicale de fièvre (1/3), avec la gastro-entérite fébrile (majoritairement virale). Les autres maladies fébriles d’importation fréquentes sont la dengue et les autres arboviroses, les hépatites virales, les shigelloses, les salmonelloses, les campylobacter et autres infections bactériennes (Escherichia coli…) et plus rarement l’amibiase hépatique, la coxiellose (fièvre Q) et la leptospirose. Malgré une enquête étiologique quasi exhaustive, 15 à 25 % des fièvres restent inexpliquées, probablement virales [3], [5], [11], [12]. Des causes non infectieuses sont parfois identifiées comme une phlébite, une maladie immunopathologique (maladie périodique, lupus…) ou une néoplasie.
3.1. Paludisme
Après une diminution régulière du taux d’incidence du paludisme d’importation en France depuis 10 ans, il est croissant depuis 2013, concernant environ 800 enfants par an avec une létalité déclarée nulle [7]. Il est dû au Plasmodium falciparum dans 87 % des cas, qui se manifeste principalement dans le mois suivant le retour. Les signes associés à la fièvre ne sont pas spécifiques (troubles du transit, nausées, syndrome algique, pâleur, subictère, toux et hépatosplénomégalie). Le paludisme d’importation concerne surtout des enfants d’émigrés visitant leur famille et leurs amis. Les jeunes enfants primo-arrivants symptomatiques présentent une forme anémique plutôt qu’un neuropaludisme. Toute fièvre dans les 3 mois suivant le retour de zone d’endémie doit faire rechercher en urgence un paludisme y compris quand un foyer infectieux a été identifié.
3.2. Typhoïde
Le taux d’incidence des salmonelloses d’origine non typhique est supérieur à celui des salmonelloses typhiques en France. Elles sont majoritairement importées d’Afrique et d’Asie. Chez le jeune enfant, la symptomatologie n’est souvent pas spécifique, comme elle peut l’être chez l’enfant plus âgé (céphalée, toux, douleur abdominale, troubles du transit, éruption cutanée rosée, hépatosplénomégalie et absence de tachycardie).
3.3. Arboviroses
La dengue est une infection virale qui se propage avec les moustiques Aedès et les voyageurs dans toutes les zones intertropicales et parfois même en zone tempérée durant l’été [13]. Son taux d’incidence est croissant parmi les enfants voyageurs [11]. Sa symptomatologie est un syndrome grippal non spécifique. Son évolution est le plus souvent bénigne en 7 à 10 jours. Le risque de choc hypovolémique et de syndrome hémorragique est rare mais grave. Il justifie une surveillance et un traitement symptomatique [14]. Le chikungunya a une répartition géographique qui tend à correspondre à celle de la dengue. Sa symptomatologie est également celle d’un syndrome viral fébrile avec des signes cutanés et des arthralgies parfois invalidantes. Les formes graves sont rares [14]. Le virus Zika tend à se répandre aussi dans les régions où prolifèrent les Aedès. Sa symptomatologie est proche de celle du chikungunya et son évolution est généralement bénigne.
3.4. Rickettsioses
Les rickettsioses sont transmises dans le monde entier par des arthropodes et sont de plus en plus souvent diagnostiquées au retour de voyage (Afrique, méditerranée, montagnes rocheuses américaines…). Le diagnostic repose sur la clinique (céphalées, photophobie, malaise, myalgies, éruption cutanée, adénopathies) et la sérologie ou la PCR. Leur évolution peut être grave sans traitement antibiotique adapté [14].
3.5. Schistosomoses
La phase invasive de la bilharziose peut entraîner une fièvre associée à un rash cutané et une hyperéosinophilie. Une exposition à l’eau douce dans une région endémique (Afrique, Asie Sud-Est, Amérique du Sud et Caraïbes) doit faire réaliser une sérologie et rechercher des œufs dans les urines, mais cette recherche est rarement contributive à ce stade de la maladie [14].
3.6. Tuberculose
La prévalence de la tuberculose est importante dans les pays en développement et ce diagnostic devrait être évoqué chez un enfant, même vacciné par le bacille de Calmette et Guérin, qui présente une fièvre et une toux persistant plus de 3 semaines, des sueurs nocturnes, un amaigrissement, une ou des adénopathies [14].
4. Traitement
L’enfant présentant une fièvre avec une altération de l’état général, a fortiori avec des signes de gravité, doit être pris en charge selon les recommandations des soins avancés en réanimation pédiatrique. L’accès palustre simple doit être mis en observation et traité à l’hôpital par un antipaludique oral. Les accès à P. falciparum justifient une hospitalisation d’au moins 24 h. La présence de signes de gravité ou de vomissements itératifs limitant la prise d’un traitement oral nécessite une prise en charge en unité de soins intensifs ou en réanimation et un traitement parentéral par artesunate selon les recommandations nationales [15]. Après l’élimination d’un paludisme et la réalisation des prélèvements bactériologiques, une antibiothérapie probabiliste à large spectre par voie parentérale peut être instaurée en ciblant son efficacité sur les pneumocoques, les salmonelles, les shigelles et les spirochètes (leptospirose), par exemple la ceftriaxone. La présence de signes cutanés évocateurs de rickettsioses ou de diarrhée peut faire préférer l’azithromycine, plutôt qu’une fluroquinolone (exemple : ciprofloxacine) en raison de la résistance importante des germes aux fluoroquinolones en Asie du Sud. Les prescriptions doivent être adaptées à la résistance identifiée des germes [14]. Une hospitalisation, brève le plus souvent, a été nécessaire chez 21,5 % des enfants consultant pour fièvre au retour d’un voyage à l’hôpital Debré à Paris [3]. Cette proportion était de 36 % dans les consultations du réseau international « géosentinelle » [2]. La prise en charge des enfants présentant une diarrhée ou une dengue est généralement symptomatique. Cependant les signes de gravité doivent être dépistés et ces enfants doivent être surveillés (hypovolémie, syndrome hémorragique) et traités en unité de soins intensifs.
5. Mesures d’hygiène et de santé publique
Si le patient a été hospitalisé dans un pays à risque de bactérie hautement résistante (BHR), il doit être isolé selon les recommandations nationales [http://www.sante.gouv.fr/fichiers/bo/2014/14-02/ste_20140002_0000_0064.pdf]. Un enfant fébrile revenant de voyage présentant des signes hémorragiques ou respiratoires devrait être pris en charge dans une salle de consultation individuelle et isolée par du personnel mettant en pratique les règles d’hygiène universelles. Certaines infections, suspectées ou confirmées, comme par exemple les fièvres hémorragiques virales (Ebola…), nécessitent des mesures de prévention et d’hygiène de niveau supérieur. Les prélèvements biologiques de ces patients doivent codés à l’attention du personnel de laboratoire (laboratoire P4 pour les fièvres hémorragiques virales).
Le risque qu’un enfant de retour de voyage soit infecté par un virus responsable de fièvre hémorragique (ou pas), contagieux, sans traitement spécifique et avec une létalité importante comme le virus Ebola est faible mais doit être envisagé si l’enfant revient d’une zone d’endémie depuis moins de 21 jours, même s’il a un paludisme (coinfection fréquente selon Médecins Sans Frontière : http://www.epicentre.msf.org/programme-journee-scientifique-2015). La liste des infections importées à déclaration obligatoire est accessible sur le site de l’Institut de veille sanitaire (http://www.invs.sante.fr/Espace-professionnels/Maladies-a-declaration-obligatoire/31-maladies-a-declaration-obligatoire). Certaines infections nécessitent une recherche des cas contacts et la mise en place d’un traitement prophylactique [13].
6. Conclusion
La fièvre de retour de voyage chez l’enfant peut être associée à une maladie grave. Elle nécessite une évaluation diagnostique anamnestique, clinique et paraclinique rigoureuse afin d’orienter le traitement initial. La majorité de ces enfants a une infection cosmopolite spontanément résolutive. Cependant une connaissance actualisée des causes de fièvre de retour de voyage en fonction des régions visitées est nécessaire pour un diagnostic et un traitement rapides. Ces informations sont disponibles sur quelques sites internet fiables. Cette connaissance est essentielle pour prévenir au mieux ces pathologies lors de la consultation de pédiatrie des voyages [6], [14].
Déclaration de liens d’intérêts
Les auteurs déclarent ne pas avoir de liens d’intérêts.
Références
- 1.Newman-Klee C., D’Acremont V., Newman C.J. Incidence and type of illness when travelling to the tropics. A prospective controlled study of children and their parents. Am J Trop Med Hyg. 2007;77:764–769. [PubMed] [Google Scholar]
- 2.Hagman S., Neugebauer R., Eli Schwartz E. Illness in children after international travel: analysis from the geosentinelle Surveillance Network. Pediatrics. 2010;125:e1072–e1080. doi: 10.1542/peds.2009-1951. [DOI] [PubMed] [Google Scholar]
- 3.Naudin J., Blondé R., Alberti C. Aetiology and epidemiology of fever in children presenting to the emergency departement of a french paediatric tertiary care center after international travel. Arch Dis Child. 2012;97:107–111. doi: 10.1136/archdischild-2011-300175. [DOI] [PubMed] [Google Scholar]
- 4.West N.S., Riordan F.A.I. Fever in returned travellers: a prospective review of hospital admissions for a 2 1/2 year period. Arch Dis Child. 2003;88:432–434. doi: 10.1136/adc.88.5.432. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Bottieau E., Clerinx J., Van den Enden E. Fever after a stay in the tropics: diagnostic predictors of the leading tropical conditions. Medicine (Baltimore) 2007;86:18–25. doi: 10.1097/MD.0b013e3180305c48. [DOI] [PubMed] [Google Scholar]
- 6.Sorge F., Deschamps N. Consultation de l’enfant voyageur. EMC Pediatr Mal Inf. 2012 [4-211-A-10] [Google Scholar]
- 7.Centre national de référence (CNR) 2015. Paludisme France Rapport activité 2013. [ http://www.cnrpalu-france.org/docs/rapport_activites_cnr_paludisme_2013.pdf] [Google Scholar]
- 8.Haut conseil de santé publique (HCSP) 2015. Calendrier des vaccinations et recommandations vaccinales 2015. [ http://www.sante.gouv.fr/IMG/pdf/Calendrier_vaccinal_2015.pdf] [Google Scholar]
- 9.HCSP-CMVI . BEH; 2015. Recommandations sanitaires pour les voyageurs, 2015; pp. 21–22. [ http://www.invs.sante.fr/beh/2015/reco/pdf/2015_reco.pdf] [Google Scholar]
- 10.Halbert J., Shingadia D., Zuckerman J. Fever in the returning child traveller: approach to diagnosis and management. Arch Dis Child. 2014;99:938–943. doi: 10.1136/archdischild-2012-303196. [DOI] [PubMed] [Google Scholar]
- 11.Herbinger K., Derup L., Alberer M. Spectrum of infectious dieases among children and adolescents returning from the tropics and subtropics. J Trav Med. 2012;19:150–157. doi: 10.1111/j.1708-8305.2011.00589.x. [DOI] [PubMed] [Google Scholar]
- 12.Spira A. Assessment of travellers who return home ill. Lancet. 2003;231:1459–1469. doi: 10.1016/S0140-6736(03)13141-8. [DOI] [PubMed] [Google Scholar]
- 13.La Ruche G., Souarès Y., Armengaud A. First two autochthonous dengue virus infections in metropolitan France. Euro Surveill. 2010;15:19676. [PubMed] [Google Scholar]
- 14.Imbert P., Minodier P. Ed Doin; 2012. Pédiatrie tropicale et des voyages. [Google Scholar]
- 15.Société de pathologie infectieuse de langue française . 2007. Prise en charge et prévention du paludisme d’importation à Plasmodium falciparum. Recommandations pour la pratique clinique. [texte court accessible : http://www.infectiologie.com/site/medias/_documents/consensus/2007-paludisme-court.pdf] [DOI] [PubMed] [Google Scholar]


