Abstract
À la fin des années 1970 on a parlé « de la fin des maladies infectieuses ». Avec l'apparition du sida et la découverte de nouveaux agents infectieux le « retour des maladies infectieuses » a été prononcé 15 à 20 ans après, donnant naissance aux « infections émergentes ». L'émergence est ce qui « dépasse le niveau moyen, retient l'attention ou sort du lot… ». En terme épidémiologique il s'agit d'une maladie qui apparaît ou dont l'incidence augmente en un lieu donné. Les infections dont l'incidence pourrait augmenter du fait de conditions propices à leur transmission doivent y être ajoutées. Différents scénarios peuvent être proposés selon que la maladie apparaît de novo (sida ou SRAS) ; apparaît là où elle n'existait pas (West Nile aux États-Unis) ; existait sans pouvoir être diagnostiquée de manière précise ou être rattachée à un agent infectieux donné (hépatite C avant la découverte du VHC) ; sort plus ou moins rapidement des fluctuations habituelles (épidémie) ; est causée par un agent dont les conditions de transmission sont propices à sa résurgence (baisse de la couverture vaccinale...). Le bioterrorisme fait partie des scénarios d'émergence. Des modifications qualitatives des agents infectieux (résistance aux anti-infectieux…) peuvent par un mécanisme de sélection donner lieu à des émergences. Les émergences infectieuses résultent de l'interaction entre l'agent, l'hôte et l'environnement qui évolue avec l'activité humaine. La lutte contre les infections émergentes est fondée sur la surveillance, l'expertise microbiologique de haut niveau et la capacité de réponse du système de santé publique.
Mots clés: Infections émergentes, Environnement, Santé publique
Abstract
At the end of the 70s, it was said that eradicating infectious diseases was possible. With the occurrence of AIDS and the discovery of new pathogens the come-back of infectious diseases was noted, 15 to 20 years later, and the concept of emerging infections was defined. An emerging infection is the appearance of a new infection or the increase of its incidence if not new. It also includes infections for which the incidence could increase because of favorable conditions. Several scenarios can be proposed: 1) the appearance of a new infection (AIDS or SARS); 2) the appearance of a known infection where it did not exist previously (West Nile virus infection in the USA); 3) an infection that existed but that was not diagnosed or could not be linked precisely to a particular infectious agent (hepatitis C before the discovery of the hepatitis C virus; 4) a known infection that increases its usual incidence (outbreaks…); 5) infectious diseases for which current conditions may facilitate transmission (decrease of immunization coverage...). The deliberate release of a biological agent is one of the possible scenarios of emergence. Qualitative changes of infectious agents such as the resistance to anti-infectious agents may also contribute, through a selection mechanism, to the emergence of new infectious threat. Emerging infections result from the interaction between the agent, the host, and environment evolving according to human activity. Surveillance, research, laboratory capacity, and an effective public health system are key factors for their control.
Keywords: Emerging infections, Transmission, Environment, Public health
À la fin des années 1970 on a parlé « de la fin des maladies infectieuses ». Cet optimisme résultait des succès de la lutte contre les maladies infectieuses dus au développement de l'hygiène, l'assainissement de l'environnement, à l'avènement des anti-infectieux et des vaccins et programmes de vaccination, dont celui contre la variole a permis son éradication, et du progrès social [1]. Avec l'identification de nouveaux agents infectieux (Legionella, rotavirus, virus Ebola, virus Hantaan, Campylobacter, le prion…), l'apparition du syndrome de l'immunodéficience acquise (sida) et sa diffusion planétaire, la progression de la résistance bactérienne aux antibiotiques, la prise de conscience de l'importance des infections acquises lors des soins et la mise en évidence du lien entre certains agents infectieux et des maladies chroniques considérées jusque-là non infectieuses tel que pour Helicobacter pylori l'ulcère et le cancer gastrique… le « retour des maladies infectieuses » a été prononcé, avec pas moins de retenue 20 ans après. Un rapport de l'Institute of Medicine « Emerging Infections : microbial threats to health in the United States » [2] concluait que dorénavant les maladies infectieuses devaient être analysées comme un des éléments d'une dynamique complexe influencée, certes par les modifications et l'adaptation des agents infectieux mais tout autant par les modifications technologiques, environnementales, sociales et démographiques. Les « Centers for Disease Control and Prevention » américains ont alors développé un plan stratégique de lutte contre les infections émergentes en 1994 [3] fondé sur la surveillance, l'alerte et la réponse, la recherche appliquée, la prévention et le contrôle et le renforcement des structures de santé publique. L'Organisation mondiale de la santé (OMS) a ensuite initié un plan au niveau mondial fondé sur les mêmes principes [4]. À partir de ces deux initiatives, le concept des « maladies infectieuses émergentes » a diffusé très largement dans la communauté scientifique, médicale et de santé publique internationale, sans toutefois être toujours utilisé à bon escient. Dans cette synthèse nous définirons le concept de « maladies infectieuses émergentes » que nous illustrerons par des exemples récents, en analyserons les principaux déterminants et son importance potentielle en santé publique et discuterons de l'approche préventive.
1. Définition
Il n'existe pas de définition univoque des maladies infectieuses émergentes. Ce terme est en effet utilisé de manière très large pour qualifier une maladie « dont on parle » ou bien souvent « dont on souhaiterait que l'on parle ». Selon le dictionnaire Larousse® « l'émergence » est l'état de ce qui émerge à savoir « dépasse le niveau moyen, retient l'attention ou sort du lot… ». En termes épidémiologiques il s'agit d'une maladie qui apparaît ou dont l'incidence augmente en un lieu donné [5]. Dans une perspective d'anticipation on se doit aussi d'inclure dans cette définition les maladies infectieuses dont l'incidence pourrait augmenter du fait de conditions propices à leur transmission. Quand il s'agit d'une maladie connue qui avait diminué ou disparu et qui réapparaît ou augmente on parlera alors de « résurgence ».
2. Modes et déterminants de la transmission des agents infectieux
2.1. Modes de transmission
Avant d'analyser les différents types d'émergence nous ferons un rappel sur les modes et déterminants de la transmission des agents infectieux, ceux-ci étant les facteurs fondamentaux des émergences ou résurgences. Nous reprendrons la classification proposée par Chin [6] qui fait la distinction entre la transmission directe, indirecte et la transmission par l'air (aérienne). La transmission directe a lieu par transfert d'un agent infectieux, sans élément intermédiaire, d'un hôte infectieux (humain ou animal) à une porte d'entrée d'un hôte humain susceptible (toucher, mordre, rapports sexuels, projection directe de gouttelettes pharyngées lors d'éternuements, la toux, crachat…). La transmission indirecte nécessite l'intervention d'un élément intermédiaire, au niveau duquel l'agent se multiplie ou pas, qui peut être un véhicule contaminé (eau, aliment, objet, produit biologique, sang, organe, ustensile médical, main contaminée d'un soignant…) ou un vecteur vivant qui peut assurer la transmission par transport mécanique ou biologique de l'agent avec dans ce dernier cas un cycle plus ou moins complexe de maturation avant que le vecteur devienne infectieux. La transmission aérienne permet l'acquisition, le plus souvent par voie respiratoire, d'un agent infectieux présent dans l'air. L'agent est soit en suspension dans la partie sèche, après évaporation, des gouttelettes de Pflügge émises lors de la toux par un hôte infectieux (elles peuvent y rester en suspension de manière prolongée) soit par l'intermédiaire de poussière émise du sol ou d'autres sources et contenant l'agent (spores de champignon, virus Puumala excrétés par le campagnol roussâtre dans le milieu extérieur et aérosolisé dans les poussières…). Épidémiologiquement on peut aussi différentier la transmission de personne à personne (grippe, rougeole…) et la transmission de source commune par un véhicule commun contaminé tel les aliments (salmonellose, listériose…), l'eau (Cryptosporidium parvum, norovirus…). Ces deux modalités peuvent être intriquées ou se succéder comme pour l'hépatite A ou la shigellose.
2.2. Déterminants de la transmission des agents infectieux
La nature et les caractéristiques de l'agent influencent la transmission. La dose infectieuse minimale joue directement sur l'efficacité de la transmission. La résistance de l'agent dans le milieu extérieur en favorisera la persistance et sa transmission. Le virus de l'hépatite B a une résistance élevée dans le milieu extérieur ce qui y favorise sa persistance et sa transmission indirecte lors des soins à partir de micro-souillures de sang d'une personne infectieuse. La résistance aux anti-infectieux en augmentant la période infectieuse d'une personne infectée malgré le traitement anti-infectieux, tel que pour la shigellose à Shigella dysenteriae 1 multirésistante, est aussi un facteur qui pourra intervenir.
Le réservoir est un point essentiel. Il est défini [6] comme toute personne, animal, vecteur, plante, sol ou substance ou leur combinaison au sein duquel un agent infectieux vit normalement et se multiplie, et sur lequel repose sa survie et sa reproduction d'une manière telle qu'il peut être transmis à un hôte susceptible. Il peut être animal, humain, environnemental et ce de manière plus ou moins strict. Il faudra aussi prendre en compte le fait qu'il existe un état de portage prolongé ou pas. Ainsi pour certains agents humains le fait que le réservoir soit principalement (grippe, SRAS) ou uniquement (rougeole…) le sujet malade ou le sujet porteur chronique (virus d’hépatite C, d’hépatite B, le VIH…) sera déterminant pour sa transmission à court, moyen et long terme. Pour la rougeole, en l'absence de patients malades au sein d'une population, il ne peut y avoir de transmission alors que la présence de porteurs chroniques asymptomatique du virus de l'hépatite C pourra permettre la transmission prolongée à bas bruit et même explosive, dans des conditions environnementales ou comportementales favorables tel que parmi les usagers de drogue par voie veineuse [7], les hémodialysées [8] ou en Égypte dans les années 1960 à 1980 [9].
En cas de réservoir environnemental, comme pour Legionella, toute action sur celui-ci pourra créer des conditions favorables à sa transmission à l'homme, notamment en favorisant la prolifération de la bactérie du fait de phénomènes physiques ou biologiques favorables (température de l'eau, stagnation dans des bras morts de canalisation, développement de biofilms favorisant la prolifération dans des installations de réfrigération…) et par la génération de nuages de gouttelettes d'eau contenant une quantité de légionnelles supérieure à la dose infectante [10].
L'existence d'un ou plusieurs réservoirs animaux est aussi un paramètre important à connaître. La capacité d'une salmonelle à être transmise à l'homme est très liée au réservoir animal dans laquelle elle est le plus inféodée. Le développement de la production industrielle des volailles et de la consommation de viande de volaille et d'œufs ont favorisés dans les années 1980 la diffusion épidémique à large échelle de Salmonella enteritidis chez l'homme (Europe de l'Ouest et Amérique du Nord, notamment).
Quand un vecteur obligatoire ou accessoire intervient dans le cycle de transmission, tel que pour les parasitoses tropicales (paludisme, trypanosomiase…), et les arboviroses (dengue, fièvre jaune, l'infection à virus West-Nile…), ses caractéristiques, conditions de développement (température, eau, environnement propice notamment en milieu urbain…) et leur interaction avec le réservoir et l'homme (développement urbain non maîtrisé favorisant la pullulation du vecteur) vont influencer la transmission et la dynamique de l'infection dans la population.
La transmission directe de personne à personne peut donner des chaînes de transmission de plusieurs générations qui peuvent aboutir de proche en proche, en fonction du taux de contact entre susceptibles et infectés et des déplacements des personnes infectées, à la transmission large de l'infection. Ainsi, l'importance des contacts entre individus, notamment au niveau des crèches et des écoles, joue un rôle important pour les maladies infectieuses de l'enfant et du nourrisson. Les voyages aériens, en permettant la circulation rapide de sujets en incubation ou infectieux, favorisent la reproduction et la transmission à de très longues distances du foyer initial des infections, notamment respiratoires mais aussi sexuellement transmises.
Pour la transmission de personne à personne le paramètre essentiel est le taux de reproduction de base (R0) qui est le nombre de nouvelles infections générées par un sujet infectieux au sein d'une population complètement susceptible [11]. Dans une population ayant un certain niveau d'immunité on parlera de taux de reproduction net (R) qui correspond à R0*f ou f est la proportion de sujets susceptibles. Quand R est supérieur à 1 on a une épidémie ou une émergence ; quand il est inférieur à 1 la transmission est en voie de maîtrise et l'épidémie régresse. Le taux de reproduction est fonction du nombre de sujets infectés (I), du taux de contact (c) entre les sujets susceptibles et infectieux, du taux de transmission (t) pour un contact entre un sujet susceptible et un sujet infectieux et de la durée de l'infectiosité du sujet infecté selon la formule R0 = c* × t*× d [11].
La rapidité de transmission d'un agent infectieux dépendra aussi de la durée du cycle de reproduction (durée moyenne entre la survenue de l'infection chez deux sujets distincts, le premier étant la source du second). Ainsi, pour un taux de reproduction aux environs de 3 (approximativement le cas de la grippe et du syndrome respiratoire aigu sévère [SRAS]) le fait qu'un cycle de reproduction soit en moyenne trois fois plus court pour la grippe (3 jours) que pour le SRAS (9 jours) accélérera la transmission de manière exponentielle : pour un cycle de reproduction donnant lieu à trois cas en moyenne pour le SRAS, trois cycles auront eu lieux pour la grippe ce qui aura abouti à en moyenne 27 (33) cas.
La résistance (immunité) des individus à l'infection est un paramètre essentiel de la transmission. Elle peut être innée et spécifique à l'espèce (barrière d'espèce) ou être spécifique à la maladie et acquise naturellement par l'infection ou par la vaccination. L'évolution démographique dans les pays occidentaux, avec l'augmentation des sujets âgés et fragiles ou vivant avec des pathologies graves immunodéprimantes ou recevant des traitements immunodéprimants, favorise la transmission des agents infectieux à des doses infectieuses plus faibles, voire la survenue d'infections opportunistes.
Au niveau d'une population on parlera alors d'immunité de groupe qui permet, à partir d'un niveau critique d'immunité selon le niveau du R0, d'empêcher la transmission. On peut en déduire le niveau critique d'immunité de groupe 1–f (f étant la fraction de la population susceptible), nécessaire à la régression de la transmission qui est égal à 1 – 1/R0 [11]. S'il s'agit d'une immunité acquise par la vaccination, la couverture vaccinale critique nécessaire sera en tenant compte de l'efficacité vaccinale (EV) : 1 – 1/R0 * EV. Ainsi, la baisse du niveau d'immunité de la population par une réduction de la couverture vaccinale au-dessous du seuil de couverture vaccinale critique sera une source de résurgence à plus ou moins long terme. Selon ce même principe, la réintroduction régulière de cohortes de naissances non encore protégées par l'infection naturelle explique les poussées épidémiques annuelles ou pluriannuelles régulières des maladies infectieuses de l'enfance (varicelle) ou qui avaient lieu avant la vaccination (rougeole, oreillons, rubéole…). Le niveau d'immunité d'une population peut aussi être altéré lors des conflits sociaux, notamment par l'afflux vers une zone d'endémie de susceptibles en grand nombre (paludisme, par exemple).
La transmission à l'homme d'agents infectieux pathogènes d'origine animale a une efficacité très variable, celle-ci étant modulée par une résistance ou immunité innée, la « barrière d'espèce » [12]. Elle résulte de l'adaptation des agents aux différentes espèces (végétaux, animaux, homme) avec plus ou moins de spécificité. Certains agents peuvent ainsi passer de l'animal à l'homme (zoonose) en fonction de l'intensité et du mode de contact entre les deux espèces (infections à salmonelles, Campylobacter, Brucella…). À l'opposé, la spécificité d'hôte d'un agent limite (virus grippal purement aviaire, par exemple) voire empêche ce passage (fièvre aphteuse). Trois aspects sont ici à considérer : la capacité de l'agent infectieux d'origine animale à être transmis à l'homme, la capacité de l'agent à ensuite se transmettre d'homme à homme une fois passé de l'animal à l'homme, et la pathogénie de l'agent chez l'homme. Certains agents sont pathogènes chez l'homme sans l'être chez l'animal (cas fréquent des salmonelloses). D'autres agents transmissibles et pathogènes chez l'animal ne sont pas transmis à l'homme comme le virus de la fièvre aphteuse. D'autres agents zoonotiques hautement pathogènes pour l'homme ne sont pas ou sont difficilement transmissibles de personne à personne tel que le virus Nipah [6] ou le virus grippal AH5N1 aviaire en Asie du Sud Est en 1997 et 2004 [13].
L'efficacité de la barrière d'espèce n'est que relative pour un agent donné. Ainsi, l'augmentation du contact entre l'homme et l'animal peut alors compenser cette efficacité relative et contribuer à faire émerger l'agent infectieux chez l'homme. Le recyclage de l'agent de l'ESB au niveau du cheptel bovin britannique par l'utilisation des farines animales dans l'alimentation des bovins a généralisé la présence de ce prion pathogène chez les bovins, engendré l'épidémie d'ESB animale et créé une pression de transmission telle, qu'elle a semble t-il, pu déborder l'efficacité de la barrière d'espèce. Les agents peuvent aussi évoluer et s'adapter à l'homme progressivement, voire brutalement, du fait de mutation ou de réassortiment avec des agents plus adaptés à l'homme et ainsi améliorer sensiblement leur efficacité de transmission interhumaine, mécanisme en cause pour l'émergence d'une pandémie grippale. La barrière d'espèce est donc toute relative et ne vaut qu'à un moment donné de l'évolution et peut donc être dépassée du fait de phénomènes évolutifs génétiques mais aussi environnementaux et comportementaux. Il a pu ainsi être montré, lors de travaux de modélisation récents [14], qu'un agent peu adapté à l'homme, passant la barrière d'espèce (donc avec un R0 d'introduction < 1) et subissant ensuite une évolution brutale ou progressive lors des premières chaînes de transmission chez l'homme, peut entraîner une épidémie avec un R net devenant supérieur à 1 pour des R0 d'introduction inférieurs à 1 (0,4 ou 0,6 par exemple) si le taux d'évolution et d'adaptation de l'agent est suffisant.
3. Les trois phases d'une émergence
Trois phases évolutives ont été décrites dans les émergences d'agents infectieux nouveaux ou préexistants et nouvellement introduits dans une population (Fig. 1 ) : l'introduction de l'agent dans la population humaine, sa diffusion ou dissémination et sa pérennisation [5]. En termes de santé publique, s'il faut pouvoir détecter au plus tôt l'introduction, la question la plus importante est de pouvoir empêcher le passage de l'introduction à la dissémination sinon de la dissémination à la pérennisation. Pour le virus de l'immunodéficience humaine, son introduction silencieuse dans les années 1970 a rapidement été suivie d'une diffusion mondiale avec pérennisation sur l'ensemble des continents, les pays d'Afrique étant maintenant les plus touchés. Dans le cas du SRAS, l'introduction du coronavirus du SRAS en Chine a été suivie d'une diffusion rapide et internationale. La mobilisation efficace de la lutte contre le SRAS indique qu'on a pu, à la date de la rédaction de cet article, en contrôler la diffusion et en empêcher la pérennisation. Toute apparition d'agent nouveau chez l'homme ne donne pas nécessairement lieu à diffusion, en particulier quand cet agent nouveau est peu adapté à l'homme. C'est le cas actuellement pour la grippe aviaire H5N1 en Asie [13], [15], de la grippe aviaire H7N7 en Hollande [16], de l'infection à virus Nipah en Malaisie ou Hendra en Australie et de la « variole du singe » aux États-Unis [17]. En revanche on peut considérer que le virus du Nil occidental (West-Nile virus) qui a diffusé depuis son introduction à New York en 1999 à quasi l'ensemble des États-Unis s'y est pérennisé [17].
Figure 1.

Projection de la structure par âge de la population sans et avec l'épidémie de sida, Botswana, 2020. Source: US Census Bureau, World Population Profile 2000
4. Tentative de typologie des émergences et exemples
4.1. Maladie infectieuse qui apparaît de novo
Elle n'existait pas avant, et a émergé sous une (des) forme(s) clinique(s) inconnue(s) nouvelle(s). La reconnaissance de cette nouvelle entité nosologique a conduit à en identifier le germe responsable, à en décrire les aspects cliniques, les modes de transmission… C'est le cas du sida dont l'impact sur la santé publique est majeur plus particulièrement dans les pays du tiers monde comme l'indique, à titre d'exemple, l'impact prévu par l'OMS de cette maladie sur la structure démographique du Botswana (Fig. 2 ). D'autres exemples de ce type d'émergences sont le variant de la maladie de Creutzfeldt-Jakob, le syndrome respiratoire aigu sévère (SRAS) provoqué par le Coronavirus du SRAS, l'infection à virus Nipah ou Hendra…
Figure 2.
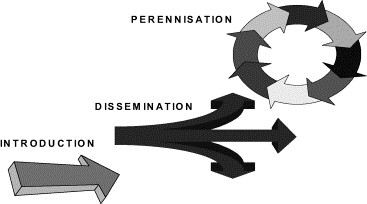
Les trois stades de l'émergence d'un agent nouveau au sein d'une population.
4.2. Maladie infectieuse qui existait sans pouvoir être diagnostiquée de manière précise ou être rattachée à un agent infectieux donné
L'hépatite C en est un exemple caractéristique. Avant la découverte du virus de l'hépatite A et B on distinguait l'hépatite virale transmise par voie féco-orale (qui correspond aux virus A et E) et l'hépatite dite « sérique » transmise par le sang et les fluides corporels. Dés la découverte du virus de l'hépatite B en 1972 on s'est rapidement aperçu que ce dernier n'expliquait qu'une partie des « hépatites sériques », d'où la dénomination hépatite non-A non-B pour laquelle le virus de l'hépatite C découvert en 1989 en était la principale étiologie. Cette hépatite virale C avait en réalité émergé bien avant, probablement au début du XXe siècle pour diffuser ensuite chez l'homme avec le développement de la transfusion et des soins médicaux et ensuite l'usage de drogue par voie veineuse [7]. La légionellose entre aussi en partie dans cette catégorie. La bactérie responsable, Legionella pneumophila fût découverte en 1977. Il a fallu, cependant, le développement de méthodes diagnostiques simples et faciles d'accès (antigène urinaire, notamment) pour que la maladie soit reconnue à sa juste fréquence. Ainsi la progression du nombre de déclarations de légionellose en France qui est passé d'environ 70 cas par an en 1996 à 1044 cas en 2003 ne traduit pas une augmentation de l'incidence en France (une émergence donc) mais une meilleure reconnaissance et surveillance [19], en d'autres termes, « l'émergence de la reconnaissance » de l'importance en santé publique de la légionellose en France.
4.3. Infection connue qui émerge dans une partie du monde où elle n'existait pas
L'exemple le plus spectaculaire est l'apparition de l'infection par le virus du Nil Occidental (West-Nile) en Amérique du Nord. Après une introduction du virus réussie dans l'État de New York en 1999 le virus a diffusé à quasiment l'ensemble du territoire des États-Unis et en partie au Canada et aux pays d'Amérique Centrale [18]. Avec plusieurs milliers de cas et centaines de décès en 2003, l'infection semble s'être maintenant pérennisée dans l'écosystème nord-américain qui a été très favorable au cycle complexe de cette infection qui implique un réservoir aviaire, un vecteur (multiples espèces de moustiques) et un hôte qui développe une forme clinique de la maladie de manière très inconstante sans la transmettre (cheval, homme…). L'existence de nombreuses infections asymptomatiques avec une virémie chez le sujet en bonne santé a ensuite permis la transmission du virus par transfusion et don d'organes [20] nécessitant la mise en œuvre d'un programme de dépistage spécifique des donneurs de sang. En France, le virus West-Nile a été introduit à plusieurs reprises en Camargue à partir du continent africain sans diffusion ni pérennisation dans la population humaine [21]. La compréhension des facteurs qui font que le virus a pu émerger et diffuser dans une zone géographique et pas dans une autre par des projets de recherche appropriés sera très utile pour anticiper les futures émergences de même nature. C'est ainsi que la comparaison des principaux moustiques vecteurs (Culex pipiens) de cette infection entre l'Europe, l'Afrique et les États-Unis suggère que ceux d'Amérique du Nord sont à la fois anthropo- et zoophiles (hybrides) alors qu'en Europe ils sont soit l'un ou l'autre. Cette moindre spécificité d'hôte du principal vecteur aux États-Unis pourrait permettre une transmission croisée des oiseaux à l'homme beaucoup plus efficace, ce qui aurait pu favorisé la dissémination rapide de l'infection sur le territoire américain [22]. L'introduction et l'implantation de ces espèces de moustiques hybrides en Europe pourraient favoriser la diffusion du virus West-Nile chez l'homme en Europe. L'introduction de l'infection à virus Monkey Pox aux États-Unis en 2003 par l'intermédiaire de rongeurs importés d'Afrique qui ont contaminés des chiens des prairies est un autre exemple de ce type d'émergence qui fût vite contrôlé [17].
Dans cette catégorie, parmi d'autres épidémies plus dramatiques encore et ayant abouti à une pérennisation secondaire, on peut citer l'extension importante des zones épidémiques de la dengue en Amérique centrale [23] ou le retour du choléra en Amérique latine en 1991, après une siècle d'absence, notamment avec l'importante épidémie du Pérou [24].
4.4. Infection connue qui sort plus ou moins rapidement des fluctuations moyennes habituelles
Il s'agit des infections ayant un potentiel épidémique, qu'elles soient transmises par une source commune comme les épidémies d'origine alimentaire (salmonellose, listériose) et environnementale (légionellose, épidémie de gastroentérite à norovirus d'origine hydrique…), ou de personne à personne (grippe, bronchiolite à virus syncytial respiratoire, hépatite A, shigellose, infections sexuellement transmissibles…). Cette éventualité peut concerner un sous-type d'un agent infectieux, tel que le sérogroupe W135 du méningocoque chez les pèlerins européens au retour de la Mecque (Fig. 3 ), d'un sérotype de salmonellose tel que le sérotype enteritidis qui a diffusé dans les années 1980 dans toute l'Europe du Nord du fait de la contamination des œufs de la filière ponte [25] ou d'un sérotype qui donne lieu à une épidémie brutale du fait de la contamination d'un aliment au niveau d'une unité de production (Fig. 4 ). Pour ce dernier exemple, l'importance et l'étendue géographique seront liées à la diffusion commerciale du produit contaminé avec possibilité de diffusion internationale très large [25]. Les recrudescences peuvent être moins spectaculaires que celles précédemment citées mais aboutir après plusieurs mois ou années à un nombre important de malades en excès. On peut ainsi citer les infections à gonocoques [26], la syphilis [27], la tuberculose dans certaines populations [28]… De manière paradoxale, en apparence seulement, une résurgence dans un groupe de population peut accompagner un maintien de la baisse de l'infection dans le reste de la population tel que pour la tuberculose en augmentation chez les personnes nées ou migrantes d'Afrique sub-saharienne alors que l'incidence continue de décroître chez les personnes nées en France (Fig. 5 ) [28] ou le sida [29] qui continue de progresser chez les femmes originaires d'Afrique sub-saharienne. Ces deux derniers exemples nous rappellent l'importance des déterminants sociaux dans l'évolution des maladies infectieuses et de la nécessité d'adapter la prévention et la prise en charge aux besoins de ces populations vulnérables identifiées par l'analyse fine des données de surveillance.
Figure 3.
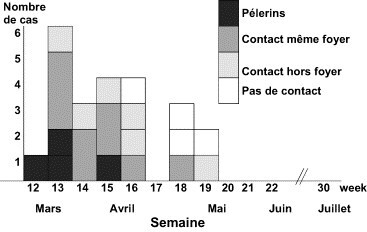
Emergence du méningocoque W135 en France, après le pèlerinage à Mecque, selon le type de contact, France, 2000. Source : Institut de Veille Sanitaire et Centre National de Référence du méningocoque, Institut Pasteur.
Figure 4.
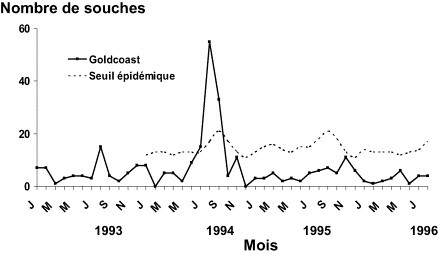
Épidémie de salmonellose à sérotype Goldcoast et seuil épidémique, France, 1993-1996. Source : Centre National de Référence, Institut Pasteur.
Figure 5.
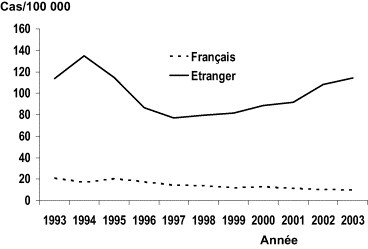
Incidence de la tuberculose selon la nationalité, Ile-de-France, 1993-2003. Source Institut de Veille Sanitaire.
4.5. Maladie dont les conditions de transmission sont propices à son développement ou sa résurgence
Dans le cas présent on se place dans une attitude d'anticipation d'une infection connue dont on connaît les facteurs de risque et les déterminants. Il peut s'agir de la baisse de la couverture vaccinale pour une maladie infectieuse à prévention vaccinale : la chute de la vaccination anticoqueluche au Royaume-Uni suite à la mise en cause, non fondée scientifiquement, du vaccin dans la mort subite du nourrisson dans les années 1970 a été suivie par une recrudescence dramatique de la maladie chez l'enfant (Fig. 6 ) avec l'augmentation du nombre de décès de nourrissons par coqueluche. L'altération de comportements de prévention dans des groupes à risque fait aussi partie de cette catégorie : par exemple le relâchement des comportements de prévention chez les homosexuels masculins documenté en France en 2000 [30] fait craindre une augmentation de l'incidence de l'infection à VIH et a déjà permis la résurgence de la syphilis [27] et plus récemment encore de la lymphogranulomatose vénérienne à Chlamydiae de type L2 chez les homosexuels [31].
Figure 6.
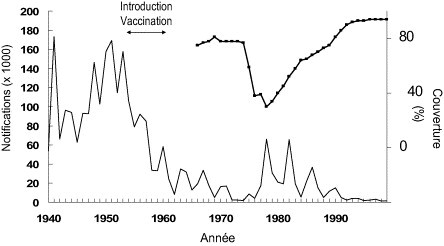
Incidence de la coqueluche et couverture vaccinale. Angleterre et Pays de Galles 1940-1999. Source: PHLS-CDSC.
Il en va de même pour la tuberculose et le sida pour les conditions sociales précaires, notamment celles liées à la migration de personnes venant des pays du tiers monde les plus touchés [28], [29]. Les évolutions démographiques à la fois quantitatives et qualitatives (concentration urbaine) qui ont eu lieu lors des 30 dernières années dans les pays du tiers monde sont favorables au développement de moustiques tel que Aedes aegypti très inféodé aux zones urbaines et périurbaines et favorise ainsi la diffusion et l'extension de la dengue.
Dans le contexte international qui a suivi les attentats du 11 septembre aux États-Unis, l'utilisation délibérée d'un agent infectieux à des fins terroristes ou malveillante fait maintenant partie des scénarios possibles d'émergence ce qui a nécessité le développement de plan de lutte, de réponse et de recherche pour y faire face.
5. Les limites d'une définition purement « quantitative » de l'émergence
Une définition de l'émergence qui ne prendrait en compte que l'aspect quantitatif (augmentation de l'incidence ou apparition de conditions favorables à l'augmentation de l'incidence d'une infection connue) ne permet pas de rendre compte complètement de l'ensemble des phénomènes infectieux émergents. En effet, cette définition n'inclut pas nécessairement des modifications qualitatives de certaines infections liées à des agents infectieux variants par mutation, acquisition de matériel génétique d'un autre agent, réassortiment, pression de sélection…qui, selon la nature de la modification, peuvent avoir un impact important en santé publique.
La résistance aux agents anti-infectieux (résistance aux antibiotiques, aux antiviraux tel que pour le VIH le VHB et le VHC, aux antipaludéens) a émergé dès l'utilisation de ceux-ci. Pour les antibiotiques la résistance est surtout liée à l'importance de leur usage inapproprié aussi bien en médecine humaine (ville ou hôpital) que vétérinaire avec des variations importantes selon les pays. Actuellement, la résistance progresse plus rapidement que la découverte de nouvelles classes d'antibiotiques. L'impact de la résistance et de la multirésistance bactérienne sur la morbidité et la mortalité, bien qu'encore mal documenté [32], apparaît dans certaines études : les infections à salmonelles multirésistantes sont ainsi associées à un excès de mortalité au Danemark [33] et les Campylobacters résistants aux fluoroquinolones entraînent une maladie plus longue avec une hospitalisation plus fréquente que les Campylobacters sensibles [34].
Des modifications antigéniques de certains agents viraux ou bactériens peuvent amener un échappement à l'immunité acquise par les infections passées ou par la vaccination. La pandémie grippale par l'apparition d'un nouveau virus influenza pathogène pour l'homme par réassortiment de virus humain et animal en est l'exemple le plus dramatique puisque l'on peut alors faire face à la diffusion d'un virus extrêmement transmissible au sein d'une population complètement susceptible et sans vaccin efficace, du moins lors des premiers mois de l'émergence. Un phénomène d'échappement à une vaccination par modification de l'agent infectieux est une éventualité qui a été ou est discutée pour le virus de l'hépatite B (mutation précore), la coqueluche, le pneumocoque… L'apparition de souches mutantes de VIH ou VHC peuvent induire une sensibilité moins bonne des tests de dépistage (variant O du VIH…) et réduire, si elles ne sont pas détectées, l'efficacité des programmes de dépistage. Enfin des modifications de pathogénie/virulence par l'acquisition de nouveaux mécanismes pathogéniques (production de toxine, acquisition d'îlots de pathogénicité d'une autre espèce…) peuvent induire l'émergence d'une maladie infectieuse. C'est ce qui semble s'être produit pour les infections à Echerichia coli O157-H7 qui ont émergé en Amérique et Europe du Nord au début des années 1980.
Ces variants, du fait de leur moindre sensibilité ou échappement aux moyens thérapeutiques, de dépistage ou de prévention peuvent prendre le dessus sur la forme habituelle par un mécanisme de sélection. C'est notamment le cas de la résistance aux antibiotiques, aux antituberculeux et aux antipaludéens.
Dans les cas de figure discutés ci-dessus, il n'y a pas nécessairement une augmentation de l'incidence. L'exemple de la résistance aux antibiotiques du pneumocoque en atteste : les infections invasives à pneumocoque ne sont pas en augmentation alors que la proportion de pneumocoque de sensibilité diminuée à la pénicilline augmente. Certains auteurs spéculent sur le fait que l'on pourrait assister à une augmentation de l'incidence des complications des otites à pneumocoque, notamment les mastoïdites comme conséquence de la progression de la résistance [32]. Cependant, la résistance du pneumocoque s'accompagne d'un coût médical plus élevé du fait de l'augmentation de la fréquence des échecs thérapeutiques des traitements de première intention et de la nécessité à recourir à des traitements de deuxième voire de troisième intention plus coûteux. Dans d'autres situations, en revanche, tel qu'un échappement vaccinal, ou l'apparition d'un nouveau virus grippal pathogène pour l'homme ou l'acquisition de facteurs de virulence, on aura une augmentation de l'incidence de la maladie qui peut être très importante (pandémie grippale) et, pour cette dernière déborder les groupes à risque habituel, notamment pour l'âge [35].
Enfin, il faut considérer les maladies infectieuses perçues comme graves ou menaçantes sans que leur incidence ou gravité soit nécessairement à la hausse. Si l'on n'est pas, dans ce cas de figure dans le cadre de la définition d'une infection émergente, il n'en demeure pas moins important de ne pas ignorer cette perception sociale et d'en tenir compte dans la stratégie de communication vers le public et les média. Dans cette catégorie on peut citer l'hépatite C, les infections à méningocoque, la listériose dont l'incidence est à la baisse en France [36], la légionellose…
6. Les déterminants des phénomènes infectieux émergents
Pour comprendre la dynamique des infections et leur capacité à évoluer et « émerger » sous une forme nouvelle, inhabituelle ou là où on ne l'attend pas, il convient de les analyser dans une dimension globale [2] à savoir non seulement l'agent infectieux mais aussi l'environnement (social et politique inclus), l'hôte qu'il soit animal ou humain et surtout les interactions entre ces trois éléments fondamentaux (Fig. 7 ).
Figure 7.

Les trois éléments fondamentaux de la dynamique des maladies infectieuses.
6.1. L'émergence ou la résurgence peut être le fait de modifications de l'agent infectieux lui-même
Elles peuvent survenir aléatoirement (mutation, réassortiments de matériel génétique, transfert de matériel génétique d'une espèce à une autre, délétion de gène…). C'est ce qui se produit lors d'une pandémie grippale où un nouveau virus auquel l'homme n'est pas prémuni naît d'un réassortiment de matériel génétique entre un virus humain et un virus animal. Ainsi, plusieurs pandémies de grippe à virus A ont eu lieux lors du XXe siècle : 1918 (émergence du virus AH1N1 avec 20 millions de morts), 1957 (virus AH2N2) et 1968 (virus AH3N2). Les virus A inféodés à une espèce et pathogènes pour celle-ci (grippe aviaire) ne sont pas transmis efficacement de personne à personne quand ils infectent l'homme par contact de ce dernier avec des élevages de volailles malades comme pour le virus H5N1 de la grippe aviaire du Sud-Est asiatique [13], [15]. Ce virus pourrait s'adapter à l'homme par simple mutation ou par réassortiment de matériel génétique avec des virus pathogènes pour l'homme soit chez l'homme ou chez un autre animal, le porc par exemple. Dans ce cas de figure la transmission interhumaine du virus pourrait devenir efficace engendrant alors de multiples générations de transmission et un développement exponentiel fonction du R0 (de l'ordre de 3 pour la grippe). Un mécanisme semblable est à l'origine de l'apparition de nouveau génotype de norovirus responsable d'épidémie de gastroentérite virale [37].
Le transfert de gènes de résistance d'une espèce bactérienne à l'autre, notamment à partir des espèces commensales peut intervenir dans l'émergence d'une nouvelle résistance ou multirésistance. La pression de sélection des antibiotiques exercée par leur utilisation non raisonnée en médecine humaine et vétérinaire explique ainsi de nombreuses émergences de résistance bactérienne chez l'homme aussi bien communautaire (résistance du pneumocoque aux pénicillines, du streptocoque du groupe A aux macrolides, du Campylobacter aux quinolones par usage excessif chez l'animal d'élevage) ou acquise à l'hôpital (staphylocoque dorée résistant à la méthicilline…).
6.2. Les émergences résultent de causes environnementales
Il s'agit des modifications du milieu, de l'écologie, de la démographie, de l'habitat, des technologies, des conduites humaines et de l'interaction avec le milieu animal ou végétal. Ces changements le plus souvent provoqués par l'homme peuvent créer des conditions biologiques favorables à la transmission à l'homme d'un agent infectieux connu ou nouveau. De nombreux exemples correspondent à cette catégorie. La migration vers les villes et la croissance démographique en zone urbaine dans les pays démunis où les équipements collectifs et d'assainissements ne sont pas développés a favorisé, par exemple l'extension de la dengue [23]. La construction de barrages et des projets d'irrigation qui ont permis le développement d'une agriculture plus performante ont aussi permis l'extension de la bilharziose notamment au Mali [38] et en Egypte [19]. Le déplacement de sujets non immuns en zone d'endémie pour certaines parasitoses (paludisme, Kala Azar, trypanosomiase…) a créé des épidémies catastrophiques (mouvements de populations lors de conflits armés, camps de réfugiés…). Inversement, des sujets infectieux peuvent, en arrivant dans une population n'ayant jamais été en contact avec l'agent et donc susceptible être à l'origine de la diffusion épidémique de la maladie comme cela se produisait pour la rougeole et la syphilis lors de la colonisation du nouveau monde par les colons européens au XVIIIe siècle. Jouent aussi grandement les voyages internationaux qui permettent à un sujet contaminé de développer la maladie et devenir contagieux à l'autre bout du monde comme le SRAS l'a montré [39], le commerce international, notamment des animaux (épidémie d'infection humaine par le virus de la « variole du singe » aux États-Unis par l'importation d'Afrique Centrale de rongeurs infectés par le virus [17]) et des denrées alimentaires (importation de chevaux trichinés en France en provenance du continent américain ou d'Europe Centrale [40]). Les modifications des technologies de l'alimentation humaine (production à grande échelle, l'augmentation des dates limites de consommation, viandes séparées mécaniquement et variant de la maladie de Creutzfeldt-Jakob…), animale (fabrication des farines de viandes et d'os introduites dans l'alimentation bovine, utilisation d'antibiotiques chez l'animal avec apparition d'infections résistantes chez l'homme par transmission alimentaire) ont joué un rôle déterminant dans la dynamique des maladies infectieuses dans les pays développés lors des deux dernières décennies [25]. Les changements climatiques (extension de certaines endémies parasitaires, la déforestation, la guerre et ses conséquences [41], les difficultés socioéconomiques influent sur l'incidence des maladies infectieuses et contribuent, à des degrés variables à leur émergence et réémergence. L'évolution de certains comportements peuvent aussi jouer un rôle important en facilitant la transmission à l'homme, notamment dans le domaine alimentaire (restauration collective, consommation d'aliments crus ou peu cuits…), des loisirs (fréquentation des forêts et maladie de Lyme [4], pratique du canoë kayak et leptospirose [42]…) ou du style de vie (usage de drogue par voie veineuse et risque d'infection à VIH ou VHC).
Le système de santé entre dans cette catégorie. Il favorise la transmission nosocomiale ou iatrogène d'agents infectieux : infection par le VIH ou le VHC et transfusion sanguine, transmission des bactéries multirésistantes à l'hôpital, transmission du SRAS de patient à patient et au personnel de soins, injections avec du matériel réutilisable non stérile dans les pays en voie de développement. Sa contribution aux émergences infectieuses n'est pas que récente et touche aussi de manière dramatique les pays en développement ou les pays de l'Europe de l'Est. L'émergence de l'hépatite C dans bon nombre de pays en développement résulte de la transmission du virus lors d'injections trop souvent réalisées en excès et sans les précautions d'hygiène requises [7]. Historiquement, les campagnes de traitement de masse par injection médicamenteuse ont joué un rôle amplificateur déterminant dans plusieurs pays comme pour contrôler le développement de la bilharziose à Schistosoma mansoni en Egypte suite aux barrages sur le Nil dans les années 1960 à 1980 ou encore au Cameroun lors des campagnes coloniales françaises des grandes endémies contre la maladie du sommeil entre 1920 et 1940.
L'effondrement d'un système de santé public structuré (services de vaccination en particulier) du fait de troubles sociaux est aussi un grand pourvoyeur de réémergences graves (diphtérie en Russie, réémergence de certaines infections tropicales en Afrique (trypanosomiase, Kala-Azar, fièvre jaune…). La recrudescence de la tuberculose aux États-Unis et la progression des formes multirésistantes aux antituberculeux au début des années 1990, notamment dans l'État de New York, a été attribuée en partie à l'insuffisance voire au « délabrement » du système public de lutte contre cette maladie [43]. Les maladies à prévention vaccinale très transmissible (rougeole, rubéole) qui nécessitent un seuil critique élevé de vaccination (de l'ordre de 90–95 %) pour interrompre la transmission peuvent donner lieu, après plusieurs années de vaccination à un niveau inférieur à ce seuil critique, à des épidémies par accumulation de susceptibles avec augmentation de l'âge à la maladie [44]. Ces épidémies ne sont pas le fait d'un vaccin inefficace (efficacité de l'ordre de 95 %) mais de programmes n'ayant pu atteindre un niveau de couverture suffisant pour éliminer la maladie. En France, une enquête sérologique réalisée en 1998 (Fig. 8 ) a montré que, dans les départements du sud, la proportion de sujets séronégatifs pour la rougeole, notamment après l'âge de cinq ans, est nettement supérieure, au niveau à atteindre pour éliminer la transmission. Cette situation permet à terme une accumulation de susceptibles suffisante pour permettre l'éclosion d'épidémies [40].
Figure 8.

Susceptibilité à la rougeole en fonction de l'âge et de la région - Enquête de séroprévalence nationale France, 1998 (N =2469). Source Institut de Veille Sanitaire.
6.3. Les modifications de l'hôte
Elles sont tout aussi importantes, en particulier celles qui modifient sa susceptibilité aux infections du fait de l'âge, de maladies intercurrentes ou de traitements immunosuppresseurs… Il s'agit d'un déterminant important pour des maladies telles que les infections alimentaires comme la listériose [25], la légionellose, les infections acquises à l'hôpital… Ainsi, à l'occasion de l'importante épidémie de légionellose survenue dans le Pas-de-Calais fin 2003 début 2004 [45] on a pu mettre en évidence lors de l'étude cas-témoins que le fait d'avoir une silicose multipliait, au sein de la population exposée à la source de contamination, le risque de légionellose par 3 [46]. La population exposée à la source industrielle de contamination responsable de l'épidémie était constituée en partie d'anciens mineurs de charbon chez qui la silicose était fréquente. Ce facteur d'hôte respiratoire d'origine professionnel a selon toute vraisemblance contribué à l'importance particulière de l'épidémie et au taux de létalité élevé (19 %).
6.4. L'émergence d'un nouveau phénomène infectieux est très souvent le fait d'une conjonction de plusieurs facteurs
C'est ainsi que pour la résistance aux antibiotiques deux phénomènes sont nécessaires : l'émergence d'une souche avec un nouveau profil de résistance et ensuite la transmission de celle ci entre les individus du fait du contact de personne à personne ou par l'intermédiaire des soins (infections nosocomiales à bactéries multirésistantes) ou de l'alimentation (émergence chez l'animal transmis à l'homme par l'alimentation carnée). Pour le virus Ebola, bien que les connaissances sur les réservoirs et l'écologie du virus ne soient pas encore complètement élucidées, une conjonction de facteurs, principalement de nature environnementale est nécessaire à l'éclosion d'une épidémie : contact avec le réservoir du virus, transmission au sein de la communauté par contact étroit, en particulier lors des rites funéraires, amplification lors des soins invasifs à l'hôpital par défaut de précautions standards, déplacements qui peuvent permettre à des personnes contaminées en zone rurale de déclarer la maladie en zone urbaine…
Une interaction de facteurs impliquant l'agent, l'environnement et l'hôte est aussi nécessaire pour la survenue d'une pandémie grippale : le risque d'apparition d'un variant est lié à la biologie du virus mais aussi à la probabilité de réassortiment de virus issus de plusieurs réservoirs (homme, volailles, porc…), donc aux contacts étroits entre l'homme et ces animaux, aux voyages internationaux, et à l'absence d'immunité de l'hôte acquise naturellement ou par la vaccination… La densité de la population humaine, aviaire et animale (porcs) et la densité des contacts entre ces populations que l'on retrouve dans de nombreux pays d'Asie, mais aussi en Europe (épizootie à virus aviaire AH7N7 avec transmission aux employés des élevage de volaille aux Pays-Bas en 2003, [16]) sont des facteurs favorisant. L'élevage intensif et industriel de la volaille qui favorise les épidémies explosives de grippe aviaire et leur diffusion d'élevage à élevage est aussi un paramètre à prendre en compte. Le développement de ce type d'élevage est relativement récent dans les pays à développement économique rapide de l'Asie (Thaïlande notamment) et a certainement contribué à l'émergence de l'épizootie de grippe aviaire AH5N1 et à sa diffusion secondaire par l'exportation, à l'ensemble de l'Asie, et ainsi au danger d'émergence d'un virus adapté à l'homme et d'une nouvelle pandémie.
La conjonction de l'apparition de nouvelles techniques médicales et des modifications des facteurs d'hôte risque de poser des problèmes redoutables. Pour faire face aux besoins croissants de transplantations dans les pays occidentaux, de nombreux travaux sont menés, en particulier par des firmes privées, pour développer les techniques de xénotransplantation. La majorité des émergences de « nouveaux agents » impliquent un réservoir animal. Par ailleurs, les transplantés sont des immunodéprimés du fait de leur maladie sous-jacente et des traitements du rejet ce qui facilite le passage à l'homme d'un agent infectieux habituellement peu ou pas pathogène. On perçoit ainsi le danger potentiel. Un agent infectieux jusqu'alors peu ou pas adapté à l'homme pourrait se reproduire plus facilement dans cette population et y engendrer l'introduction d'une nouvelle maladie infectieuse qui par adaptation secondaire à l'homme pourrait se répandre au reste de la population. Ainsi, les sujets immunodéprimés pourraient permettre les premières phases pour l'évolution et l'adaptation, donc l'émergence, chez l'homme de nouveaux agents pathogènes [14].
7. La lutte contre les infections émergentes
S'il est difficile de se prémunir de l'émergence d'un problème infectieux que l'on ne connaît pas, la compréhension de l'émergence ou de la réémergence des problèmes infectieux fondée sur l'expérience des dernières décennies et les connaissances issues de la recherche sur les mécanismes moléculaires d'évolution des agents infectieux, l'interaction de ceux-ci avec l'environnement, ses modifications et les comportements humains et la modélisation de leur diffusion doivent permettre de définir la base de leur prévention et de leur contrôle. On peut, par ailleurs, anticiper le risque par des actions d'amont tel que, par exemple, la lutte contre l'utilisation irraisonnée des antibiotiques et ainsi la réduction de la pression de sélection pour prévenir l'émergence de nouvelles résistances, ou la préparation de plans de lutte spécifiques (plan de lutte contre une pandémie grippale, par exemple).
Au-delà de ces actions spécifiques fondées sur les connaissances a priori issues de la recherche, il convient de disposer d'une capacité de détection, de maîtrise et prise en charge des émergences au niveau mondial. En tout premier, une infrastructure de santé publique performante et réactive est indispensable et doit être doublée d'une capacité de surveillance et d'investigation épidémiologique, clinique et microbiologique opérationnelle à visée décisionnelle et mobilisable à tout moment. Ce deuxième aspect est, en France, de la responsabilité de l'institut de veille sanitaire dont les missions sont de surveiller l'état de santé de la population, d'alerter les pouvoirs publics de toute menace pour la santé de la population et d'étudier, dans une optique de l'aide à la décision, les déterminants des modifications des tendances et de la survenue des menaces pour la santé. Pour les maladies infectieuses, la surveillance épidémiologique et l'analyse des alertes et phénomènes émergents doit aussi s'appuyer sur une expertise microbiologique de haut niveau scientifique, en France les centres nationaux de référence [47], qui pour être performante et mobilisable en permanence nécessite un financement public spécifique pérenne suffisant.
Car en plus de l'anticipation ou, à défaut, de la détection réactive des émergences, la performance de la maîtrise de la diffusion dépendra de l'identification de la source, du mode de transmission et des facteurs de risque du phénomène, donc de la capacité à proposer aux décideurs les mesures de prévention et de contrôle scientifiquement argumentées. Afin de détecter au plus tôt les nouvelles menaces infectieuses pour la santé publique il est aussi nécessaire de développer une veille prospective scientifique et technologique qui, outre le suivi de l'actualité scientifique du domaine, s'appuiera sur une collaboration étroite avec le monde de la recherche en infectiologie, microbiologie et épidémiologie à la fois humaine et animale. On voit donc que la meilleure réponse que l'on peut apporter aux émergences doit partir du principe que celles ci continueront de survenir ce qui nécessite une préparation a priori avec l'organisation d'un système complexe anticipé de détection, d'investigation, de réponse et de recherche qui doit pouvoir disposer en continu de ressources adaptées au défi.
Malheureusement de nombreux pays dont le système de soins et de santé publique fait défaut ne peuvent disposer, loin s'en faut, des ressources nécessaires pour assurer cette fonction de surveillance, de détection, d'investigation, de recherche, de veille prospective et d'anticipation. Les pays les plus démunis ont connu de nombreux problèmes infectieux émergents ou résurgents. Enfin, l'émergence d'un risque infectieux nouveau dans un lieu de la planète peut diffuser rapidement vers les autres continents par les transports des personnes et des biens. L'OMS a ainsi mis en place un programme de détection, vérification, investigation et de réponse aux risques infectieux émergents [48]. Ainsi, l'OMS peut en cas de risque sérieux détecté proposer une assistance scientifique et technique au pays affecté avant que celui-ci n'en fasse officiellement la demande, le plus souvent quant il est débordé. La transformation du règlement sanitaire international cantonné actuellement à quelques maladies (choléra, peste, fièvre jaune) en un système d'identification de déclaration et de réponses aux menaces internationales à la santé publique quelle que soit leur cause et opposables dans le droit international [49] sera, si l'assemblée mondiale de la santé de 2005 l'adopte, un progrès réel.
L'émergence du SRAS en 2003 illustre bien la problématique des risques infectieux émergents, de leur détection et de la réponse internationale [50]. Après un premier signal d'alerte en février, suggérant une épidémie d'infection respiratoire dans la province de Guangdong, Chine, l'OMS lança une alerte mondiale le 12 mars 2003 suite à la détection de foyers hospitaliers à Hanoi et Hong-Kong. Pour ce nouveau syndrome infectieux, il a fallu, non seulement reconnaître et définir cette nouvelle entité clinique, mais en comprendre rapidement la transmission pour mettre en œuvre les mesures de contrôles (isolement des malades symptomatiques et quarantaine pendant 10 jours de leurs sujets contacts), identifier et caractériser l'agent responsable et développer les premiers outils de diagnostic. La coordination internationale de l'ensemble de ces efforts par l'OMS, la diffusion extrêmement rapide (plus rapide que la diffusion du virus) des connaissances acquises par les équipes médicales et de recherche au contact de l'épidémie et la mobilisation des systèmes de santé publique nationaux ont pu maîtriser cette première vague de l'épidémie à un coût économique direct et surtout indirect très élevé.
8. Conclusion
On perçoit donc que le domaine de l'émergence en pathologie infectieuse embrasse un champ large et complexe, incluant la dimension moléculaire, immunitaire, clinique, épidémiologique, comportementale, sociale (perception du danger et extrême rapidité de la circulation de l'information), économique et politique. Si l'on utilise souvent par excès le terme « émergent » pour caractériser un problème infectieux, il faut cependant reconnaître que la dimension sociale et la communication sont devenue essentielle dans la gestion de ces phénomènes qu'ils soient réellement émergents (réellement nouveau ou en augmentation réelle) ou, comme c'est souvent le cas, des phénomènes dont on parle ou qui suscitent des craintes fondées rationnellement ou pas.
Les agents infectieux sont en constante évolution et l'action de l'homme interagit avec ceux-ci, leur cycle écologique et épidémiologique et favorise ainsi les émergences, sans que l'on puisse réellement affirmer que l'on assiste depuis plusieurs décennies à leur augmentation, leur détection étant maintenant grandement facilitée. Si nous disposons de moyens de lutte efficaces contre les maladies infectieuses répertoriées, nous ne pouvons pas prétendre pouvoir prévoir et empêcher la survenue de toutes les émergences infectieuses. Si nous devons nous résigner à accepter ce postulat, il est néanmoins tout à fait possible d'anticiper certains de ces risques par des plans de préparation, la recherche sur les agents infectieux, la veille prospective et la surveillance épidémiologique. Par ailleurs, dans un monde globalisé la prévention des émergences qui pourraient affecter nos sociétés modernes nécessite aussi une prise en charge et un investissement qui va bien au-delà d'une simple politique de sécurité sanitaire trop souvent mise en avant pour y faire face. Les efforts en direction de la recherche sont donc particulièrement importants. Nous devons aussi agir de manière durable et anticipée en direction des pays les plus démunis plutôt que de manière réactive aux émergences comme c'est trop souvent le cas. Il faut pouvoir développer chez ceux-ci une meilleure capacité de faire face aux conséquences sanitaires, sociales et économiques des émergences qui s'y développent avant tout pour le bien de leur population et pas uniquement pour nous prémunir de la dissémination secondaire de celles-ci dans nos sociétés d'Europe occidentale ou d'Amérique du Nord, comme pour la grippe aviaire en Asie du Sud-Est en 2003–2004.
Références
- 1.Reingold A.J. Infectious disease epidemiology in the 21st century: will it be eradicated or will it reemerge. Epidemiol. Rev. 2000;22:57–63. doi: 10.1093/oxfordjournals.epirev.a018024. [DOI] [PubMed] [Google Scholar]
- 2.Institute of Medicine . In: Emerging infections: microbial threats to health in the United States. Lederberg J., Shope R.E., Oaks S.C., editors. National Academy Press; Washington, DC: 1992. [PubMed] [Google Scholar]
- 3.Centers for Diseases Control and Prevention . Addressing emerging infectious diseases threats: a prevention strategy for the United States, Atlanta Georgia: US Dept of Health and Human Services. Public Health Service; 1994. [Google Scholar]
- 4.Heymann D.L., Rodier G.R. Global Surveillance of Communicable Diseases. Emerg. Infect. Dis. 1998;4:362–365. doi: 10.3201/eid0403.980305. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Morse S.S. Factors in the Emergence of Infectious Diseases. Emerg. Infect. Dis. 1995;1:7–15. doi: 10.3201/eid0101.950102. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Chin J.C. Control of Communicable diseases in man. 17th edition. American Public Health Association; Whashington DC, USA: 2000. pp. 577–579. [Google Scholar]
- 7.Desenclos J.C. L’infection par le virus de l’hépatite C dans le monde : importance en santé publique, modes de transmission et perspectives. Virologie. 2003;7:177–192. [Google Scholar]
- 8.Savey A., Simon F., Lepoutre A., Izopet J., Desenclos J.C., Fabry J. Investigation de 22 cas de contamination parle virus de l’hépatite C dans un centre d’hémodialyse, Béziers, 2001–2002. Bull. Epidemiol. Hebdo. 2003;16:104–107–17. [Google Scholar]
- 9.Desenclos J.C. Les progrès de la surveillance et de la prévention de la légionellose. Bull. Epidemiol. Hebdo. 2002;30:149. –31. [Google Scholar]
- 10.Frank C., Mohamed M.K., Strickland G.T., Lavanchy D., Arthur R.R., Magder L.S., et al. The role of parenteral antischistosomal therapy in the spread of hepatitis C virus in Egypt. Lancet. 2000;355(9207):887–891. doi: 10.1016/s0140-6736(99)06527-7. [DOI] [PubMed] [Google Scholar]
- 11.Anderson R., May R. Infectious diseases of humans: dynamics and controls. Oxford University Press; Oxford: 1995. [Google Scholar]
- 12.Klempner M.S., Shapiro D.S. Crossing the species barier-one small step to man, one giant leap to mankind. NEJM. 2004;305:1171–1172. doi: 10.1056/NEJMp048039. [DOI] [PubMed] [Google Scholar]
- 13.Tinh H.T., Thanh N.L., Dung N.T., San L.T., Mai P.P., Suu P.T., et al. Clinical description of human cases of influenza A (H5N1) in Viet Nam. 2004. NEJM. 2004:305. [Google Scholar]
- 14.Antia R., Regoes R.R., Koella J.C., Bergstrom C.T. The role of evolution in the emergence of infectious diseases. Nature. 2003;426:658–661. doi: 10.1038/nature02104. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.CDC Isolation of avian influenza A (H5N1) viruses from humans-Hong-Kong, 1997-98. MMWR. 1998;26:1245–1247. [PubMed] [Google Scholar]
- 16.Koopmans M, Fouchier R, Wilbrink B, et al. Human infections with highly pathogenic avian influenza virus A/H7N7 during an outbreak in poultry in the Netherlands. Eurosurveillance 2003;7(http://www.eurosurveillance.org/ew/2003/030501.asp).
- 17.Centers for Diseases Control and Prevention Multistate Outbreak of Monkeypox --- Illinois, Indiana, Kansas, Missouri, Ohio, and Wisconsin, 2003. MMWR. 2003;52:561–564. [PubMed] [Google Scholar]
- 18.Centers for Diseases Control and Prevention. West Nile Virus 2002 case count. http://www.cdc.gov/ncidod/dvbid/westnile/surv&controlCaseCount02.htm.
- 19.Campése C., Jarraud S., Decludt B., Jacquier G., Che D. Les légionelloses déclarées en France en 2003. InVS. Bull. Epidemiol. Hebdo. 2003;36:174–176. –37. [Google Scholar]
- 20.Iwamoto M., Jernigan D.G., Guatsch, et al. Transmission of West Nile virus from organ donor to four transplant recipients. N. Engl. J. Med. 2003;348:2196–2203. doi: 10.1056/NEJMoa022987. [DOI] [PubMed] [Google Scholar]
- 21.Perra A., Zientara S., Murgue B. Surveillance du West Nile en France en 2001. Bull. Epidemiol. Hebdo. 2002;33:161–163. [Google Scholar]
- 22.Fonseca D., Keyghobadi N., Malcom C.A., Mehmet C., Schaffner F., Mogi M., et al. Emerging vectors in the culex pipiens complex. Science. 2004;3003:1535–1538. doi: 10.1126/science.1094247. [DOI] [PubMed] [Google Scholar]
- 23.Lifson A.R. Mosquitoes, models, and dengue. Lancet. 1996;347(9010):1201–1202. doi: 10.1016/s0140-6736(96)90730-8. [DOI] [PubMed] [Google Scholar]
- 24.Cholera am latine 91. Seas C., Miranda J., Gil A.I., Leon-Barua R., Patz J., Huq A., et al. New insights on the emergence of cholera in Latin America during 1991: the Peruvian experience. Am. J. Trop. Med. Hyg. 2000;62(4):513–517. doi: 10.4269/ajtmh.2000.62.513. [DOI] [PubMed] [Google Scholar]
- 25.Desenclos J.C., Vaillant V., De Valk H. Risque alimentaire infectieux : les questions de santé publique et de recherche qui se posent dans le domaine justifient elles de nouveaux recueils de données ? Rev Epidemiol. Sante Pub. 2002;50:67–69. [PubMed] [Google Scholar]
- 26.Goulet V., Sednaoui P., Laporte A., Billy C., Desenclos J.C. Augmentation du nombre de gonococcies identifiées par le réseau RENAGO. Bull. Epidemiol. Hebdo. 1999;26:109–111. [Google Scholar]
- 27.Couturier E., Dupin N., Janier M. Résurgence de la syphilis en France 2000, 2001. Bull. Epidemiol. Hebdo. 2001;35:168–169–36. [Google Scholar]
- 28.Caihlol J., Che D., Campese C., Decludt B. Les cas de tuberculose déclarés en France en 2001. Bull. Epidemiol. Hebdo. 2003;10:54–57–11. doi: 10.1016/s0929-693x(03)00165-9. [DOI] [PubMed] [Google Scholar]
- 29.Institut de Veille Sanitaire Surveillance du SIDA en France : situation au 31 mars 2002. Bull. Epidemiol. Hebdo. 2002;27:133–138. [Google Scholar]
- 30.Adam P., Hauet E., Caron C. Recrudescence des prises de risque et des MST parmi les gays. Résultats préliminaires de l’enquête presse gay 2000. Institut de Veille Sanitaire; Paris: 2001. 56 pages. [Google Scholar]
- 31.Institut de Veille Sanitaire. Emergence de la Lymphogranulomatose vénérienne rectale en France : cas estimés au 31 mars 2004. Synthèse réalisée le 1er juin 2004. http://www.invs.sante.fr/actualite/index.htm.
- 32.Desenclos J.C., Guillemot D. Bacterial resistance to antibiotics: public health consequences and risks. Emerg Infect Dis. 2004;10:759–760. doi: 10.3201/eid1004.030754. [DOI] [PubMed] [Google Scholar]
- 33.Gupta A., Nelson J.M., Barrett T., Tauxe R., Rossiter S., Friedman C. Antimicrobial Resistance among Campylobacter Strains, United States, 1997–2001. EID. 2004;10:1102–1109. doi: 10.3201/eid1006.030635. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 34.Engberg J., Neimann J., Moller Nielsen E., Moller Aarestrup F., Fussing V. Quinolone-resistant Campylobacter Infections in Denmark: Risk factors and Clinical Consequences. EID. 2004;10:1056–1063. doi: 10.3201/eid1006.030669. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 35.World Health Organization. Pandemic preparedeness. http://www.who.int/csr/disease/influenza/pandemic/en/ (consulté le 19.10/04).
- 36.Goulet V., De Valk H., Pierre O., Stainer F., Rocourt J., Vaillant V., et al. Important reduction in the reduction of human listeriosis, in a context of preventive efforts in France. Emerg. Infect. Dis. 2001;7:983–989. doi: 10.3201/eid0706.010610. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 37.Vinje J., Vennema H., Maunula L., et al. International collaborative study to compare reverse transcriptase PCR assays for detection and genotyping of noroviruses. J. Clin. Microbiol. 2003;41:1423–1433. doi: 10.1128/JCM.41.4.1423-1433.2003. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 38.Brinkmann U.K., Korte R. Schmidt-Ehry. The distribution and spread of schistosomiasis in relation to water resources development in Mali. Trop. Med. Parasitol. 1988;39:182–185. [PubMed] [Google Scholar]
- 39.World Health Organization. Cumulative number of reported probable cases of SARS. Geneva, Switzerland. http://www.who.int/csr/sarscountry/2003_05_09/en/ (consulté le 13/04/04).
- 40.Ancelle T. Historique des épidémies de trichinellose liées à la consommation de viande chevaline, 1975–1998. Eurosurveillance. 1998;3:86–89. [Google Scholar]
- 41.Valenciano M., Coulombier D., Lopes-Cardozo, et al. Challenges for communicable diseases surveillance and control in southern Iraq, April-June 2003. JAMA. 2003;290:654–658. doi: 10.1001/jama.290.5.654. [DOI] [PubMed] [Google Scholar]
- 42.Institut de Veille Sanitaire . Rapport Institut de Veille Sanitaire. 2002. Enquête cas-témoins sur les facteurs de risque de la leptospirose. [Google Scholar]
- 43.Brudney K., Dobkin J. Resurgent tuberculosis in New York City. Am. Rev. Respir. Dis. 1991;144:745–749. doi: 10.1164/ajrccm/144.4.745. [DOI] [PubMed] [Google Scholar]
- 44.Six C., Franke F., Pieyre A., Zandotti C., Freymuth F., Wild F., et al. Investigation de cas de rougeole en région Provence-Alpes-Côte-d'Azur au cours du premier semestre 2003. Bull. Epidemiol. Hebdo. 2004;16:63–64. [Google Scholar]
- 45.Micquel P.H., Haeghebaert S., Che D., Campese C., Guitard C., et al. Épidémie Communautaire de légionellose, Pas-de-Calais, France, novembre 2003–janvier 2004. Bull. Epidemiol. Hebdo. 2004;36:179–181–37. [Google Scholar]
- 46.Tran Minh N., Ganiaire F., Lapidus N., Che D., Campese C., Ilef D., et al. Enquête cas-témoins de cas groupés communautaires de légionellose, Pas de Calais, France, novembre 2003-janvier 2004. Bull. Epidemiol. Hebdo. 2004;36:181–182–37. [Google Scholar]
- 47.Desenclos J.C. La surveillance des maladies infectieuses et l’expertise microbiologique : complémentarité et interaction à propos de l’expérience du Réseau National de Santé Publique et de l’Institut de Veille Sanitaire. Méd. Mal. Infect. 2000;30:221s–225s. [Google Scholar]
- 48.Grein T.W., Kamara K.B.O., Rodier G., Plant A.J., Bovier P., Ryan M.J., et al. Rumors of Disease in the Global Village:Outbreak Verification. Emerg. Infect. Dis. 2000;6:97–102. doi: 10.3201/eid0602.000201. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 49.Organisation Mondiale de la Santé. Règlement sanitaire international. Document de travail à l’intention des consultations régionales, 12 janvier 2004. http://www.who.int/csr/resources/publications/IGWG_IHR_WP12-03-fr.pdf (consulté le 13/08/04).
- 50.Lévy Bruhl D., Bonmarin I., Desenclos J.C. Les bases épidémiologiques de la maîtrise de la transmission du SRAS. Bull. Epidemiol. Hebdo. 2003;24–25:115–116. [Google Scholar]


