Abstract
Objectifs. – Les rhinovirus sont les principaux agents du rhume, mais la fréquence et la gravité de leurs autres atteintes sont mal connues. Le but de ce travail est d’étudier l’expression clinique et la gravité potentielle des infections à rhinovirus de l’enfant hospitalisé.
Méthodes. – De septembre 1998 à octobre 2000, nous avons étudié rétrospectivement une cohorte hospitalière de 211 enfants infectés par un rhinovirus, celui-ci étant recherché par culture ou RT-PCR.
Résultats. – Chez les enfants infectés par un rhinovirus, 60 cas (28,4 %) d’atteintes ORL, 81 cas (38,4 %) de bronchiolites, 25 cas (11,9 %) de pneumopathies et 12 cas (4,7 %) de crises d’asthme aiguës ont été identifiés. Parmi les signes cliniques on relève 32 % de râles sibilants, 37 % de râles bronchiques et 29 % de signes de détresse respiratoire ; 40 % des radiographies pulmonaires sont anormales. Huit enfants ont été transférés en réanimation et deux sont décédés. Vingt-cinq enfants (11,8 %) avaient une infection à rhinovirus d’origine nosocomiale. Dans 19 cas le rhinovirus (9 %) était associé à un autre virus : 3 VRS, 2 virus influenza, 8 virus para-influenza, 2 adénovirus, 4 entérovirus ; 19 enfants (9 %) présentent une surinfection bactérienne. L’identification virologique des 211 cas d’infections à rhinovirus a été faite par isolement en culture dans 112 cas (53 %) et lorsque celui-ci était négatif par RT-PCR dans 99 cas (47 %).
Conclusion. – En éliminant les cas de co-infections virales et bactériennes, les tableaux cliniques des infections à rhinovirus isolées de l’enfant sont dans notre étude les suivants : 25,6 % d’infections ORL, 25,6 % de bronchiolites ou bronchites, 6,2 % de pneumopathies et 5,7 % de crises d’asthme. Le diagnostic virologique est beaucoup amélioré par les outils moléculaires.
Mots-clé: Rhinovirus, Bronchiolite, Asthme, PCR
Abstract
Objectives. – Rhinoviruses are the most common aetiological agents of colds, but the frequency and the severity of other locations of the infection are not well known. This study describes the clinical aspects and the severity of rhinovirus infections in hospitalised children.
Methods. – Isolation in culture and a RT-PCR were performed for the detection of rhinovirus in nasal aspirates from hospitalised children from September 1998 to October 2000. A group of 211 children found to be positive for rhinovirus was studied.
Results. – Rhinovirus-infected children suffered from the following clinical syndromes: 60 (28.4%) upper airway infections, 81 (38.4%) bronchiolitis, 25 (11.9%) pneumonias and 12 (4.7%) acute attacks of asthma. Clinical symptoms were wheezing (32%), ronchi (37%) and 29% of children presented with acute distress respiratory syndrome; 40% of the available chest X-Ray were abnormal. Eight children were hospitalised in the intensive care unit and two children died. Twenty-five children (10.9%) had a nosocomial infection; a dual infection was observed in 19 cases (9%) with the following viruses: RSV (3), influenza (2) parainfluenza (8), adenovirus (2), enterovirus (4); 19 (9%) children had a secondary bacterial infection. Rhinoviruses were detected in nasal aspirates in 112 cases (53%) according to the culture and in the rhinovirus culture-negative samples in 99 cases (47%) according to the RT-PCR assay.
Conclusion. – After eliminating cases of bacterial or viral dual infections, the clinical aspects of rhinovirus infections in children are the following: upper respiratory tract infections (25.6%), bronchiolitis ou bronchitis (25.6%), pneumonia (6.2%), acute attack of asthma (5.7%). The virological diagnosis according to culture is mainly improved by molecular techniques.
Keywords: Rhinovirus, Child, Lower respiratory tract infection, PCR
Les rhinovirus, dont on décrit plus de 100 sérotypes, sont connus pour être responsables de rhumes, mais moins souvent pour être associés à des atteintes respiratoires basses. Ce sont des virus ubiquitaires, transmis par voie aérienne ou manuelle, présents toute l’année, mais surtout au printemps et en automne. Chez l’enfant ils sont isolés par culture dans 5 à 16 % des infections respiratoires [1], [2], [3], [4]. Ils peuvent se répliquer dans les voies aériennes inférieures en même temps que dans le rhinopharynx [5], [6]. Ils ont été associés à des bronchiolites, des pneumonies, des crises d’asthme, des décompensations de bronchites chroniques, des otites moyennes aiguës, des sinusites. Ils ont été isolés dans des cas de mort subite du nourrisson [7], [8], [9], [10]. La gravité de l’infection à rhinovirus serait corrélée positivement avec la charge virale [11] et avec des facteurs tels que l’asthme, la mucoviscidose, la prématurité, une dysplasie bronchopulmonaire, le tabagisme passif, l’immunodépression [10], [12], [13]. Dans les années 1990, la connaissance du génome viral a permis de développer des outils moléculaires pour le diagnostic utilisant la Reverse-Transcription-PCR (RT-PCR) [14]. Cette technique est plus sensible que la culture et augmente environ de moitié la détection des rhinovirus [10], [14], [15], [16]. Le but de ce travail est d’étudier l’expression clinique et la gravité potentielle des infections à rhinovirus de l’enfant hospitalisé, identifiées par culture et une technique moléculaire.
1. Population et méthodes
1.1. Population
Nous avons étudié rétrospectivement une cohorte de 211 enfants hospitalisés entre les mois de septembre 1998 et d’octobre 2000 et chez lesquels un rhinovirus a été détecté dans le prélèvement respiratoire.
Les prélèvements respiratoires ont été faits systématiquement chez les enfants présentant des signes d’atteinte respiratoire haute ou basse, hospitalisés dans les services pédiatriques du CHU de Caen (n = 177) ou d’autres hôpitaux de Basse-Normandie (n = 16). Quelques enfants hospitalisés en néonatologie (n = 9), oncohématologie (n = 2) et réanimation infantile (n = 7), ont été inclus dans la cohorte.
1.2. Méthodes
Le prélèvement était une aspiration nasale recueillie en flacon stérile ou en milieu de transport virologique. La recherche des rhinovirus était réalisée par isolement sur culture de cellules MRC5 et A-549. Les rhinovirus sont identifiés selon la procédure habituelle par l’aspect de leur effet cytopathogène (ECP) et par un test à l’acide. La technique de RT-PCR était effectuée à partir des cultures sur cellules A-549, lorsque celles-ci présentent un ECP et par une procédure précédemment décrite [15]. Les autres virus respiratoires ont été systématiquement recherchés, par culture et immunofluorescence pour les virus influenza A et B, para-influenza 1, 2 et 3, virus respiratoire syncytial (VRS), adénovirus et par PCR pour les coronavirus 229E et OC43 selon un protocole déjà décrit [18]. En présence de signes cliniques évocateurs, les infections bactériennes respiratoires associées ont été recherchées dans des examens cytobactériologique des crachats (ECBC) effectués parallèlement aux aspirations nasales. La technique PCR a été utilisée pour rechercher Bordetella pertussis, Mycoplasma pneumoniae et Chlamydia pneumoniae.
Sur le plan clinique, les facteurs de risque suivants ont été analysés : prématurité, faible poids de naissance, cardiopathie congénitale, pathologie pulmonaire chronique), antécédents d’atopie personnelle ou familiale, bronchiolite(s) antérieure(s), tabagisme passif, fratrie supérieure à deux. L’évaluation clinique a retenu les éléments suivants : poids, température, saturation transcutanée en oxygène, détresse respiratoire (balancement thoracoabdominal, tirage), signes respiratoires auscultatoires, toux, atteintes ORL (rhinite, otite, laryngite), troubles digestifs (vomissements ou refus alimentaire). Quatre tableaux cliniques ont pu être identifiés à partir de ces éléments selon qu’il s’agissait d’une atteinte des voies aériennes supérieures seule : rhinite et/ou otite et/ou laryngite et/ou sinusite ou d’une localisation au tractus respiratoire inférieur : bronchiolite ou bronchite, pneumopathie, crise d’asthme aiguë. Les examens paracliniques suivants : taux de protéine C réactive, examen cytobactériologique des crachats, radiographies thoraciques, les mesures thérapeutiques (antibiothérapie, nutrition entérale à débit continu NEDC ou perfusion en raison d’une détresse respiratoire, thérapeutiques inhalées, oxygénothérapie, intubations), les transferts en réanimation et la mortalité ont été analysés. Les hospitalisations dues à la seule infection à rhinovirus ont été différenciées de celles où une autre maladie avait entraîné l’hospitalisation.
2. Résultats
2.1. Épidémiologie hospitalière, infections nosocomiales, co-infections
Entre septembre 1998 et octobre 2000, 211 infections à rhinovirus ont été mises en évidence. Ces infections étaient observées toute l’année (Fig. 1 ), avec un premier pic en mars–avril (27,8 %) et un second en octobre–novembre (23,7 %). La fréquence des infections à rhinovirus a pu être calculée dans la deuxième année de l’étude, d’octobre 1999 à octobre 2000. Elle représentait 6 % (n = 121) des 2025 prélèvements respiratoires analysés. Pendant la même période on a recensé 18 % d’infections à VRS (n = 364) et 2,3 % d’infections à virus influenza A ou B (n = 46). Les 211 cas d’infections à rhinovirus ont été identifiés par isolement en culture de cellules MRC5 dans 112 cas (53 %) et lorsque celui-ci était négatif par RT-PCR sur culture A-549 dans 99 cas (47 %).
Fig. 1.
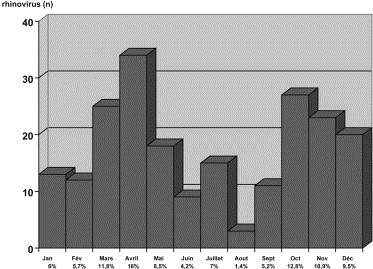
Épidémiologie saisonnière des infections à rhinovirus dans une cohorte de 211 enfants hospitalisés.
La majorité des infections à rhinovirus (82,5 %) étaient détectées dans les trois premiers jours de l’hospitalisation de l’enfant. Si on définit l’origine nosocomiale par un isolement viral à partir du 5e jour d’hospitalisation, 25 enfants (11,8 %), dont huit nouveau-nés, avaient une infection nosocomiale à rhinovirus. Dix-neuf enfants (9 %) ont présenté une co-infection virale respiratoire associant au rhinovirus un VRS (3 cas), un virus influenza A (2 cas), un virus para-influenza type 3 (7 cas), un virus para-influenza type1 (1 cas), un adénovirus (2 cas) et des entérovirus (4 cas). Chez 19 enfants (9 %) une ou plusieurs bactéries étaient détectées en même temps que l’infection à rhinovirus : B. pertussis (4 cas), Haemophilus influenzae (6 cas, dont une association à un Staphylococcus aureus et une autre à un Streptococcus A), M. pneumoniae (2 cas), Moraxella catarrhalis (4 cas, dont une association à un Streptococcus pneumoniae), Streptococcus pneumoniae seul (2 cas), Staphylococcus aureus seul (1 cas). Chez plusieurs enfants où l’on avait détecté un rhinovirus, d’autres atteintes bactériennes ou virales entraînaient des signes cliniques ressemblant à ceux d’une infection à rhinovirus et rendaient ainsi difficile l’imputabilité au rhinovirus de la maladie (au moins de ses signes généraux). On observait ainsi une septicémie à S. aureus (au décours d’une chimiothérapie pour hépatoblastome), deux pyélonéphrites à Escherichia coli, trois méningites à entérovirus, un abcès cervical à S. aureus, quatre coqueluches. Enfin 35 des 211 enfants présentaient des signes de gastroentérite et les analyses des selles ont détecté huit rotavirus, deux adénovirus et un Campylobacter jejuni.
2.2. Âge, sexe, facteurs de risque
Les 211 enfants de l’étude étaient répartis en 70 filles et 141 garçons (sex-ratio : 2,01), d’âge moyen respectif 25 mois (médiane : 11 mois) et 19 mois (médiane : 8 mois) (p = 0,24). L’âge moyen de la cohorte était de 21 mois (médiane 9 mois), avec des âges extrêmes de 15 j à 16 ans (Fig. 2 ). La durée moyenne d’hospitalisation de la cohorte des 211 enfants était de 8,3 j (médiane : 5 j). Cinquante enfants (23,7 %) avaient au moins un facteur de morbidité néonatal, 28,4 % une atopie personnelle, 41,2 % une atopie familiale, 10,4 % un asthme et 36 % des antécédents de bronchiolites. Quarante-six familles (22 %) comportaient un fumeur et 32,7 % avaient au moins deux enfants.
Fig. 2.
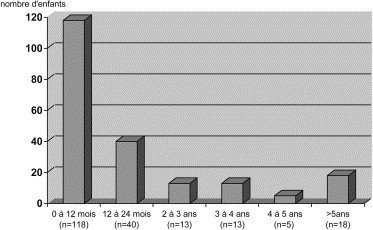
Répartition par tranches d’âge de la cohorte étudiée.
2.3. Sémiologie
Dans 112 cas (53 %) la sémiologie initiale comportait une toux évoluant en moyenne depuis 2 j ; 134 enfants (65 %) avaient une élévation thermique pendant 24 h de 38 °C en moyenne et le rhinovirus était le seul pathogène identifié dans 50,2 % des cas (Tableau 1 ). L’atteinte des voies aériennes supérieures était notée dans 196 cas (92,9 %), dont 150 rhinites (71 %), 33 otites (15,6 %), 12 laryngites (5,7 %) et une sinusite ; l’auscultation respiratoire était anormale dans 149 cas (70,6 %), avec des râles bronchiques dans 69 cas (32 %) et des râles sibilants dans 80 cas (37 %) ; 61 enfants (28,9 %) avaient présenté des signes de détresse respiratoire. On a observé 21 malaises (dont une perte de connaissance avec hypotonie), 13 convulsions avec hyperthermie et une paralysie faciale a frigore. Neuf éruptions érythématopapuleuses et un urticaire ont été constatés ; 99 enfants (47 %) ont présenté un refus alimentaire ou des vomissements, dont 61 sans autre cause que l’infection à rhinovirus. Au total, on recensait 60 cas (28,4 %) d’atteintes ORL isolées, 81 cas (38,4 %) de bronchiolites ou bronchites, 25 pneumopathies (11,9 %) et 12 (5,7 %) crises d’asthme aiguës. Dans 42 cas (19,9 %), l’infection à rhinovirus (sous forme de rhinite ou bronchite) accompagnait une autre pathologie qui avait motivé l’hospitalisation et ces enfants étaient en moyenne plus âgés (30,7 mois). Si on déduit les infections respiratoires pour lesquelles une co-infection bactérienne ou virale a été identifiée, on dénombre 54 bronchites (25,6 %), 13 pneumonies (5,7 %) et 12 crises d’asthme (19,4 %) attribuables au seul rhinovirus.
Tableau 1.
Atteintes respiratoires hautes et basses (signes cliniques, signes de gravité, radiographies pulmonaires) de la cohorte hospitalière étudiée (n = 211 infections à rhinovirus)
| Signes cliniques | Nbre de cas | Fréquence (%) |
| Température ≥ 37,8 °C | 134 | 64,9 % |
| Toux | 112 | 53 % |
| Atteinte respiratoire haute | 196 | 92,9 % |
| Rhinites | 150 | 71 % |
| Otites moyennes aiguës | 33 | 15,6 % |
| Laryngites | 12 | 5,7 % |
| Sinusites | 1 | 4,73 % |
| Atteinte respiratoire basse | ||
| Détresse respiratoire (tirage, cyanose) | 61 | 28,9 % |
| Râles sibilants/cyanose | 69/80 | 32 %/37 % |
| RP* anormales | 85 | 59 % |
| Syndromes bronchiques/foyers | 59/26 | |
| Bronchiolites/bronchites | 81 | 38,4 % |
| Pneumopathies | 25 | 11,9 % |
| Crises d'asthme | 12 | 5,7 % |
| Malaise/convulsion hyperthermique | 21/13 | 10 %/6 % |
| Refus alimentaire, vomissements | 99 | 47 % |
| Assistance nutritionnelle | 12 | 5,7 % |
| NEDC* */perfusion | 2/10 | |
| Aérosolthérapie | 80 | 37 % |
* RP : radiographie pulmonaire
* * NEDC : nutrition entérale à débit continu
Les enfants présentant des facteurs de risque n’avaient pas plus d’atteintes respiratoires basses que l’ensemble de la cohorte (bronchiolites/bronchites 36 %, pneumonies 8 %, asthme 2 %). Cependant l’infection à rhinovirus semble avoir été un facteur de décompensation de cinq états précaires : une leucémie aiguë lymphoblastique, une communication inter-ventriculaire large, une dysplasie bronchopulmonaire, une rechute de syndrome néphrotique, une hypoxémie réfractaire chez un prématuré de 31 semaines décédé d’une pneumonie à rhinovirus.
2.4. Examens complémentaires, prise en charge thérapeutique
Sur les 144 radiographies pulmonaires effectuées, 85 (59 %) présentaient des anomalies, dont 59 syndromes bronchiques et 26 foyers de condensation. La CRP était supérieure à 15 mg l–1 dans 48 cas (26,7 %) sur 180 dosages effectués à l’entrée (85,3 %) ; si on déduit les infections bactériennes ou virales associées, il reste 26 cas (12,3 %) où la CRP est élevée alors que le seul rhinovirus est identifié. Le syndrome infectieux clinique a entraîné une prescription ambulatoire d’antibiotique chez 13 enfants (6,2 %), interrompue lors de leur admission ; 113 enfants (53,6 %) avaient reçu un traitement antibiotique à l’hôpital dès l’admission et 66 d’entre eux avaient a posteriori des CRP inférieures à 15 mg l–1. L’atteinte respiratoire (syndrome obstructif respiratoire ou laryngite) nécessitait une thérapie par aérosol chez 80 patients, pendant en moyenne 1,6 j (β2-mimétiques, adrénaline, corticoïdes inhalés). L’intensité de la détresse respiratoire entraînait un arrêt de l’alimentation per os chez 12 enfants (5,7 %), dont deux bénéficiaient d’une NEDC et dix étaient perfusés.
2.5. Transferts en réanimation, décès
Huit enfants (3,8 %) ont été transférés en unité de soins intensifs puis intubés pour détresse respiratoire aiguë ; trois enfants déjà hospitalisés en réanimation et ventilés présentaient une dégradation de leurs constantes respiratoires (Tableau 2 ). L’hématose pouvait être contrôlée par oxygénothérapie nasale chez sept enfants (3,3 %). Deux décès survenaient secondairement à la décompensation d’un mauvais état clinique sous-jacent : un prématuré porteur d’une dysplasie bronchopulmonaire présentant une hypoxémie réfractaire avec co-infection pulmonaire à S. aureus résistant et un enfant de 3 mois porteur d’une maladie lysosomiale de surcharge (Tay-Sachs), dont la pneumopathie à rhinovirus était le facteur morbide essentiel.
Tableau 2.
Transferts en réanimation pour détresse respiratoire (n = 8) ou aggravation de l’état respiratoire chez des patients intubés en réanimation (n = 3)
| Âge | Facteurs de risque | Transfert en réanimation à j1 ou plus de l'infection | Temps passé en réanimation | |
| Bronchiolite à VRS et rhinovirus | 1 mois | Atopie familiale | j1, intubé | 7 j |
| Bronchiolite à rhinovirus | 2,5 mois | Prématurité, atopie familiale | j1, intubé | 11 j |
| Bronchiolite à rhinovirus | 3,5 mois | Prématurité, atopie familiale | j1, intubé | 7 j |
| Bronchiolite à rhinovirus | 5 mois | Prématurité, atopie familiale | j1, intubé | 19 j |
| Bronchiolite à rhinovirus | 4 mois | Prématurité, | j1, intubé | 9 j |
| atopie familiale, trachéomalacie | ||||
| Bronchiolite à rhinovirus | 17 j | Atopie familiale | j1, intubé | 11 j |
| Bronchiolite à rhinovirus | 17 j | Nouveau-né, atopie familiale | j1, intubé | 10 j |
| Leucémie aiguë, bronchite à rhinovirus | 3,5 ans | Immunodépression, | j1, intubé | 22 j |
| atopie familiale | ||||
| Pneumopathie virale et à staphylocoque résistant | âge corrigé 31SA, | Prématuré, dysplasie bronchopulmonaire | Était intubé en réanimation néonatale | Décès en hypoxémie réfractaire |
| âge civil 1 mois | ||||
| Bronchite au retour d'un cerclage pulmonaire | 3 mois | CIV* | Était intubé en réanimation | 17 j |
| Syndrome de Mendelson et bronchite à rhinovirus | 3,5 ans | Dilatations des bronches | Était intubé en réanimation | 4 mois |
* Communication inter-ventriculaire
Les co-infections virales respiratoires n’entraînaient plus d’atteintes respiratoires basses que les infections dues au seul rhinovirus : dix bronchites/bronchiolites, deux pneumopathies. Aucun décès n’était observé, mais un enfant était transféré en réanimation pour une bronchiolite à rhinovirus et VRS associés. La moyenne d’âge (17 mois), la durée moyenne d’hospitalisation (7,7 j) n’étaient pas différentes dans les co-infections virales et il y avait peu de facteurs de risque associés. Parmi les 19 infections bactériennes respiratoires associées, un enfant qui était hospitalisé en unité néonatale de soins intensifs décédait d’une septicémie et pneumopathie à S. aureus et rhinovirus, en hypoxémie réfractaire.
3. Discussion
Entre 5 et 16 % d’infections à rhinovirus sont identifiées par isolement en culture cellulaire chez les enfants atteints d’infections respiratoires. Fox et al. en 1965–1969 détectent 16 % d’infections à rhinovirus dans 3366 viroses respiratoires communautaires de l’enfant [1]. Chez les enfants hospitalisés, les pourcentages sont comparables : 8,8 % pour Freymuth et al. en 1983–1984 sur 921 enfants [2], 12 % pour Kellner et al. en 1984–1986 sur 519 enfants [3] et 5 % pour Pierrès-Surer et al. en 1993–1995 sur 3152 enfants [4]. Il existe plus de 110 sérotypes de rhinovirus et comme de nombreux sérotypes se développent très difficilement sur les systèmes classiques de culture cellulaire, il n’est pas étonnant que les études récentes utilisant les outils moléculaires fassent apparaître des fréquences deux à trois fois plus élevées d’infections à rhinovirus chez les enfants [16], [17], [18], [19]. Dans notre étude 53 % des infections respiratoires à rhinovirus sont détectées par isolement en culture et 47 % de cas supplémentaires sont identifiés par RT-PCR. Celle-ci a été utilisée dans le respect des contraintes imposées par ce type de technique, sur des cultures de cellules A-549 présentant un effet cytopathogène et l’absence d’inhibiteurs de PCR a été vérifiée par l’amplification du gène de la β-globine.
Conformément aux données épidémiologiques classiques, notre étude confirme que les infections à rhinovirus sont endémiques, avec une très nette augmentation des infections au printemps et en automne, période où les deux principaux virus respiratoires, le VRS et les virus influenza, circulent peu ou sont absents [2], [6].
La médiane de la durée d’hospitalisation des enfants infectés est longue (8 j) au regard de celles données dans d’autres études : 6 j dans l’étude de Andréoletti et al. [18], 3,7 jours dans celle de Kim et al. [10]. Plusieurs facteurs peuvent expliquer cette différence et notamment le jeune âge et la gravité de la pathologie. La prédominance masculine des enfants infectés, surtout ceux de moins de 1 an, est classique [4], [10]. La majorité des aspirations nasales ont été effectuées chez des nourrissons, ce qui est probablement lié au fait qu’il s’agit de la population d’enfants qui présente le plus d’infections respiratoires susceptibles d’entraîner une hospitalisation et chez lesquels on effectue plus souvent des prélèvements respiratoires.
Les signes cliniques observés chez les enfants de notre cohorte sont sensiblement identiques à ceux constatés dans les autres études [4], [20]. Dans une étude précédente comparant les bronchiolites à VRS et celles à rhinovirus nous avions noté que l’infection à VRS entraînait deux fois plus de signes auscultatoires anormaux, de détresse respiratoire et de toux, mais que l’infection à rhinovirus était associée à plus de sibilants (35 % versus 12 %) [20]. Pierres-Surer et al. observent des râles sibilants dans 27,6 % des cas [4]. Nous retrouvons cette particularité dans l’étude actuelle, puisqu’un tiers des enfants ont présenté des sibilants à l’auscultation. Ceci est à rapprocher de l’observation que nous avons faite, à la suite d’autres auteurs, sur le rôle important des rhinovirus dans le déclenchement des crises chez l’enfant asthmatique [21] et des hypothèses physiopathologiques actuelles impliquant une cascade de cytokines déclenchée par l’infection virale [6], [22], [23], [24].
Dans les infections à rhinovirus on observe beaucoup d’anomalies radiologiques pulmonaires, attestant de la fréquence de l’atteinte respiratoire basse. En revanche, on ne trouve pas d’atélectasies, de bronchiolites oblitérantes ou d’œdèmes lésionnels comme cela est vu dans les infections à VRS, à virus de la rougeole ou adénovirus [25]. La CRP est souvent basse, compatible avec une infection virale ; elle est cependant élevée dans 12,3 % des cas de notre étude sans qu’aucune co-infection bactérienne n’ait été notée. Une antibiothérapie a été instituée chez 53,6 % de nos enfants durant l’hospitalisation ; 9,9 % d’entre eux avaient une infection bactérienne prouvée et plus de la moitié avaient une CRP inférieure à 15 mg l–1, mais des signes généraux inquiétants. Ceci souligne l’importance qu’il yaurait à pouvoir disposer d’un test de détection rapide des rhinovirus afin de limiter la prescription d’antibiotiques. Un tel test n’existe malheureusement pas à ce jour. Enfin les transferts en réanimation et les deux décès sont survenus constamment sur des terrains fragilisés.
Dans les infections à rhinovirus le taux de co-infections virales varie de 5 à 40 % selon les auteurs [4], [10], [26]. Nous en rapportons 9 % dans cette étude. Il n’y a pas non plus de différence significative concernant l’âge, les affections néonatales, l’atopie, la gravité clinique, comme le notait également l’étude de Brouard et al. [26]. Nous décrivons cependant un cas de bronchiolite à rhinovirus et VRS dont la gravité est probablement liée à l’association des deux infections virales. Le nombre d’infections bactériennes associées (11,4 %) est superposable aux chiffres trouvés dans la littérature : 5 à 15 % [4], [10] ; concernant les infections respiratoires basses, il est difficile de faire la part entre les symptômes liés au virus et ceux liés aux bactéries, car ils peuvent être intriqués.
Les infections nosocomiales respiratoires sont bien documentées avec le VRS et les virus influenza. Des mesures d’hygiènes simples (lavage des mains, solutions hydro-alcooliques, port de masques et gants) sont préconisées afin de limiter la transmission virale en période épidémique. Nous avons observé huit infections nosocomiales à rhinovirus chez des nouveau-nés. Comme elles sont survenues à distance les unes des autres, l’hypothèse d’une épidémie locale est écartée et le virus a probablement été transmis par les parents ou le personnel soignant.
Au total, les tableaux cliniques des infections à rhinovirus sont les suivants (déduction faite des co-infections virales et bactériennes) : 25,6 % d’infections ORL, 25,6 % de bronchiolites ou bronchites, 6,2 % de pneumopathies et 5,7 % de crises d’asthme. Ces résultats sont à rapprocher de ceux de la littérature, utilisant la culture pour détecter une infection à rhinovirus : 6 à 15 % d’infections ORL [10], 27 % de bronchiolites ou bronchites [4], 38 % de bronchites et pneumopathies [22] et plus récemment la RT-PCR, comme dans l’étude de Steininger et al. [19] qui recense 16,4 % d’infections ORL, 46 % de bronchiolites/bronchites, 18,5 % de pneumopathies et 1,3 % d’asthme.
4. Conclusion
Cette étude montre que les rhinovirus peuvent entraîner des infections respiratoires basses graves chez le nourrisson et l’enfant et décompenser des états précaires sous-jacents (prématurés, immunodéprimés, atteintes respiratoires chroniques). L’amplification génique par RT-PCR augmente considérablement la détection des rhinovirus, mais cette méthode ne constitue pas un outil de diagnostic rapide et des efforts de standardisation de la technique et des études complémentaires sur des populations témoins seront nécessaires pour valider définitivement nos résultats. Ceci est d’autant plus important qu’une molécule anti-virale, le pleconaril, a montré son efficacité in vitro, en bloquant la réplication de plus de 96 % des sérotypes d’entérovirus et de 93 % des sérotypes de rhinovirus [23], [27], [28].
Remerciements
Les auteurs remercient l’ensemble des services pédiatriques contactés de Basse-Normandie, dont le Dr D. Cau (CHG Pasteur, rue Val-de-Saire, 50102 Cherbourg) et le Dr A. Yang Ting (CH Avranches-Granville, rue des Menneries, 50300 Avranches).
Références
- 1.Fox J.P, Cooney M.K, Hall C.E. The seattle virus watch, V Epidemiologic observations of rhinovirus infections, 1965–1969, in families with young children. Am J Epidemiolol. 1975;101:122–143. doi: 10.1093/oxfordjournals.aje.a112078. [DOI] [PubMed] [Google Scholar]
- 2.Freymuth F, Quibriac M, Petitjean J, Pierre C, Duhamel J.F, Le Goas C. Rhinovirus et infections respiratoires aiguës du nourrisson. Arch Fr Pédiatr. 1986;43:677–679. [PubMed] [Google Scholar]
- 3.Kellner G, Popow-Kraupp T, Kundi M, Binder C, Wallner H, Kunz C. Clinical manifestations of respiratory tract infections due to respiratory syncitial virus and rhinoviruses in hospitalized children. Acta Paediatr Scand. 1989;78:390–394. doi: 10.1111/j.1651-2227.1989.tb11098.x. [DOI] [PubMed] [Google Scholar]
- 4.Pierres-Surer N, Beby-Defaux A, Bourgoin A, Venat C, Berthier M, Grollier G. Infections à rhinovirus chez des enfants hospitalisés : étude sur une période de 3 ans. Arch Pédiatr. 1998;5:9–14. doi: 10.1016/S0929-693X(97)83459-8. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Arruda E, Boyle T.R, Winther B, Pevear D.C, Gwaltney J.M, Hayden F.G. Localization of human rhinovirus replication in the upper respiratory tract by in situ hybridization. J Infect Dis. 1995;171:1329–1333. doi: 10.1093/infdis/171.5.1329. [DOI] [PubMed] [Google Scholar]
- 6.Gern J.E, Busse W.W. Association of rhinovirus infections with asthma. Clin Microbiol Rev. 1999;12:9–18. doi: 10.1128/cmr.12.1.9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Abzug M.J, Beam A.C, Gyorkos E.A, Levin M.J. Viral pneumonia in the first month of life. Pediatr Infect Dis J. 1990;9:881–885. doi: 10.1097/00006454-199012000-00005. [DOI] [PubMed] [Google Scholar]
- 8.Cheron G, Rambaud C, Rey C, Mahut B, Canioni D, Lavaud J. Morts subites au berceau, Expérience d'un centre de référence 1986–1991. Arch Fr Pediatr. 1993;50:293–299. [PubMed] [Google Scholar]
- 9.Arola M, Ruuskanen O, Ziegler T, Mertsola J, Nanto-Salonen K, Putto-Laurila A. Clinical role of respiratory virus infection in acute otitis media. Pediatrics. 1990;86:848–855. [PubMed] [Google Scholar]
- 10.Kim J.O, Hodinka R.L. Serious respiratory illness associated with rhinovirus infection in a pediatric population. Clin Diagn Virol. 1998;10:57–65. doi: 10.1016/s0928-0197(98)00004-x. [DOI] [PubMed] [Google Scholar]
- 11.Kellner G, Popow-Kraup T, Binder C, Goedl I, Kundi M, Kunz C. Respiratory tract infections due to different rhinovirus serotypes and the influence of maternal antibodies on the clinical expression of the disease in infants. J Med Virol. 1991;35:267–272. doi: 10.1002/jmv.1890350412. [DOI] [PubMed] [Google Scholar]
- 12.Chidekel A.S, Bazzy A.R, Rosen C.L. Rhinovirus infection associated with severe lower respiratory tract illness and worsening lung disease in infants with bronchopulmonary dysplasia. Pediatr Pulmonol. 1994;18:261–263. doi: 10.1002/ppul.1950180412. [DOI] [PubMed] [Google Scholar]
- 13.Smyth A.R, Smyth R.L, Tong C.Y, Hart C.A, Heaf D.P. Effect of respiratory virus infections including rhinovirus on clinical status in cystic fibrosis. Arch Dis Child. 1995;73:117–120. doi: 10.1136/adc.73.2.117. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Gama R.E, Hornsell P.R, Hughes P.J, North C, Bruce C.B, al-Nakib W. Amplification of rhinovirus specific nucleic acids from clinical samples using the polymerase chain reaction. J Med Virol. 1989;28:73–77. doi: 10.1002/jmv.1890280204. [DOI] [PubMed] [Google Scholar]
- 15.Freymuth F, Vabret A, Galateau-Salle F, Ferey J, Eugene G, Petitjean J. Detection of respiratory syncytial virus, parainfluenzavirus 3, adenovirus and rhinovirus sequences in respiratory tract of infants by polymerase chain reaction and hybridization. Clin Diagn Virol. 1997;8:31–40. doi: 10.1016/s0928-0197(97)00060-3. [DOI] [PubMed] [Google Scholar]
- 16.Brouard J, Freymuth F, Toutain F, Vabret A, Petitjean J, Gouarin S. Exacerbation de l'asthme et identification virale associée à celle du Chlamydiae Pneumoniae et du Mycoplasma Pneumoniae : épidémiologie comparative entre nourrissons et enfants âgés de plus de deux ans. Rev Fr Allergol Immunol Clin. 2001;41:389–395. doi: 10.1016/S0335-7457(01)00042-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 17.Rakes G.P, Arruda E, Ingram J.M, Hoover G.E, Zambrano J.C, Hayden F.G. Rhinovirus and respiratory syncitial virus in wheezing children requiring emergency care. Am J Respir Crit Care M. 1999;159:785–790. doi: 10.1164/ajrccm.159.3.9801052. [DOI] [PubMed] [Google Scholar]
- 18.Andreoletti L, Lesay M, Deschidre A, Lambert V, Dewilde A, Wattre P. Differential detection of rhinoviruses and enteroviruses RNA sequences associated with classical immunofluorescence assay detection of respiratory virus antigens in nasopharyngeal swabs from infants with bronchiolitis. J Med Virol. 2000;6:341–346. doi: 10.1002/1096-9071(200007)61:3<341::AID-JMV10>3.0.CO;2-0. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 19.Steininger C, Aberle S.W, Popow-Kraupp T. Early detection of acute rhinovirus infections by a rapid reverse transcription- PCR assay. J Clin Microbiol. 2001;39:129–133. doi: 10.1128/JCM.39.1.129-133.2001. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Mammes O. 1994. Intérêts et limites de la PCR dans le diagnostic des bronchiolites à rhinovirus chez le nourrisson, [thèse], Paris. [Google Scholar]
- 21.Freymuth F, Vabret A, Brouard J, Toutain F, Verdon R, Petitjean J. Detection of viral, Chlamydiae pneumoniae and Mycoplasma pneumoniae infections in exarcerbations of asthma in children. J Clin Virol. 1999;13:131–139. doi: 10.1016/S1386-6532(99)00030-X. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Carlsen K.H, Orstavick I. Bronchopumonary obstruction in children with respiratory virus infections. Eur J Respir Dis. 1984;65:92–98. [PubMed] [Google Scholar]
- 23.Turner R.B. The treatmemt of rhinovirus infections: progress and potential. Antiviral Res. 2001;49:1–14. doi: 10.1016/S0166-3542(00)00135-2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 24.Johnston S.L. Natural and experimental rhinovirus infections of the lower respiratory tract. Am J Respir Crit Care M. 1995;152(4Pt2):S46–S52. doi: 10.1164/ajrccm/152.4_Pt_2.S46. [DOI] [PubMed] [Google Scholar]
- 25.Brouard J, Freymuth F, Duhamel J.F. Prévention des complications tardives des viroses respiratoires. Rev Fr Allergol Immunol Clin. 2001;41:95–101. [Google Scholar]
- 26.Brouard J, Freymuth F, Vabret A, Jokic M, Guillois B, Duhamel J.F. Co-infections virales lors des bronchiolites du nourrisson immunocompétent : étude prospective épidémiologique. Arch Pédiatr. 2000;7(Suppl 3):531s–535s. doi: 10.1016/s0929-693x(00)80180-3. [DOI] [PubMed] [Google Scholar]
- 27.Rotbart H.A, Webster A.D. Treatment of potentially life-threatening enterovirus infections with pleconaril. Clin Infect Dis. 2001;32:228–235. doi: 10.1086/318452. [DOI] [PubMed] [Google Scholar]
- 28.Yarush L.I, Steele R.W. Diagnosis and prospective treatment of enteroviral infections in children. Clin Pediatr (Phila) 2000;39:209–211. doi: 10.1177/000992280003900403. [DOI] [PubMed] [Google Scholar]


