Abstract
Im Juni 2012 wurde erstmals eine Infektion mit Middle East Respiratory Syndrome Coronavirus (MERS-CoV) in Saudi Arabien diagnostiziert. Seither zirkuliert das Virus weiterhin im Nahen Osten und verursacht dort immer wieder größere nosokomiale Ausbrüche. Auch nach Deutschland wurde das Virus bereits importiert. So stellt sich die Frage, wann man differenzialdiagnostisch an MERS-CoV denken sollte und welche Maßnahmen zu ergreifen sind.
Epidemiologie
Im Juni 2012 wurde erstmalig ein Fall von Middle East Respiratory Syndrome (MERS) bei einem Patienten, der in einem Krankenhaus in Jeddah (Saudi Arabien) an den Folgen einer schweren ungeklärten Atemwegserkrankung verstarb, beschrieben [2]. Das aus dem Sputum des Patienten isolierte Virus zeigte Ähnlichkeiten mit dem SARS (Severe Acute Respiratory Syndrome)-Corona-Virus (CoV), welches in den Jahren 2002–2003 zu einer Pandemie mit weltweit über 8.000 Erkrankungen und knapp 1.000 Todesfällen führte.
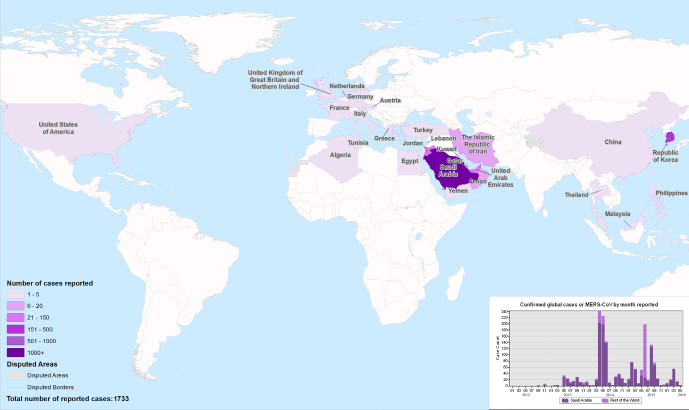
Seither wurden 1.733 Infektionen durch MERS-CoV mit resultierenden 628 Todesfällen (Mortalitätsrate 36 %) registriert (Stand 31. Mai 2016). Der Fokus liegt weiterhin im Nahen Osten, insbesondere in Saudi Arabien, wo bisher mit Abstand die meisten Erkrankungen auftraten. Regelmäßig kommt es jedoch auch zu importierten Erkrankungsfällen in anderen Regionen der Welt (▶Abb. 1, [1]).
Das natürliche Reservoir war anfangs unbekannt und auch heute sind noch einige Fragen unbeantwortet. Ähnlich wie bei SARS und anderen sogenannten Emerging Infectious Diseases vermutete man den Ursprung initial bei Fledermäusen. Es konnten tatsächlich auch Sequenzen des MERS-CoV in verschiedenen Fledermausspezies nachgewiesen werden, jedoch gelang es bis heute nicht, ein vollständiges Virus zu isolieren. Hiermit bleibt die Rolle von Fledermäusen bei der direkten bzw. indirekten Übertragung auf den Menschen unklar [3].
Bei weiteren Untersuchungen fiel auf, dass mehr als 90 % aller Dromedare auf der Arabischen Halbinsel Antikörper gegen MERS-CoV besitzen. Auch bei Dromedaren in anderen Regionen (Nord-, Ost-, Westafrika und den Kanarischen Inseln) wurden positive Antikörpertiter beobachtet, und in archivierten Serumproben bereits aus den frühen 1980er-Jahren wurden Antikörper nachgewiesen. Daher geht man heute davon aus, dass MERS-CoV bei Kamelen schon seit einem längeren Zeitraum zirkuliert [4, 5].
Inzwischen gelang es auch, das Virus selbst bei Dromedaren zu isolieren. Im Falle eines erkrankten Besitzers konnte ein genetisch identisches MERS-CoV bei seinen Tieren nachgewiesen werden [6]. Insbesondere Jungtiere wurden als Virusträger identifiziert, während es bei erwachsenen Tieren zu einer Serokonversion mit resultierender Immunität kommt.
Wann und wie der „Spillover“ – also die Transmission vom tierischen Reservoir auf den Menschen – erfolgte, ist letztlich unklar. In Serumproben von Blutspendern in der Region vor 2012 konnte keine Seroaktivität festgestellt werden [7]. Obwohl die Kamelhaltung in der Region traditionell natürlich weit verbreitet ist, konnte bisher nur bei wenigen Patienten ein direkter Kamelkontakt dokumentiert werden. Eventuell spielen indirekte Übertragungswege über unpasteurisierte Kamelmilchprodukte bzw. Kamelfleisch eine Rolle.
Die Mensch-zu-Mensch-Übertragung spielt daher die wichtigste Rolle bei der Weiterverbreitung, insbesondere bei den gemeldeten nosokomialen Ausbrüchen in Jeddah (2014) und Südkorea (Mai 2015). Bei dem Ausbruch in Südkorea wurde die Infektion durch einen 68-jährigen Patienten, der mehrere Länder auf der Arabischen Halbinsel bereiste, importiert. Im Verlauf der Epidemie kam es zu 186 sekundären und tertiären Erkrankungsfällen mit 36 resultierenden Todesfällen. Die Folgen waren schwere wirtschaftliche Einbußen, da die Bevölkerung Menschenansammlungen (z. B. Einkaufszentren, Restaurants etc.) mied und Schulen geschlossen werden mussten. Auch die Tourismusbranche wurde schwer getroffen.
Die Mensch-zu-Mensch-Übertragung erfolgt via Tröpfcheninfektion oder direkten Kontakt, jedoch ist die Kontagiösität des Virus insbesondere bei Haushaltskontakten begrenzt. So zeigte eine Studie bei 26 Patienten und 280 Angehörigen gerade einmal eine Serokoversionsrate von 4 % [8]. Während des Ausbruches in Südkorea kam es dagegen zu einem sogenannten „Superspreading“ (Superverbreitung), wobei ein einzelner infizierter Patient mehr als 70 Personen in der Rettungsstelle eines Krankenhauses infizierte [9].
Das MERS-CoV benötigt einen DPP4 (dipeptidyl-peptidase 4)-Rezeptor zur Aufnahme in die Zelle. Während DPP4 bei Kamelen in den Epithelzellen der oberen Atemwegen vorkommt, tritt DPP4 beim Menschen nur in den Zellen der unteren Atemwege auf. Dies dürfte die limitierte Mensch-zu-Mensch-Übertragung erklären und macht deutlich, warum bei der Diagnostik Proben aus den tiefen Atemwegen zu bevorzugen sind.
Die Basisreproduktionszahl R0 (definiert als die Zahl der Personen, die im Mittel durch eine infektiöse Person infiziert werden) ist insgesamt aber mit einem R0 von 0,7 bei MERS-CoV eher niedrig (Vergleich R0 bei Masern: ca. 15) [10]. Daher geht man aktuell von sporadischen Übertragungen vom natürlichen Reservoir auf den Menschen mit daraus resultierenden, selbstlimitierenden Ausbrüchen aus.
Nach Deutschland wurden bisher drei Fälle von MERS-CoV importiert: 2012 ein 45-jähriger Patient aus Katar, der zur Therapie bei Acute respiratory distress syndrome (ARDS) nach Essen verlegt wurde (Infektionsquelle: Patient ist Besitzer einer Kamelfarm; Patient überlebte) [11]; im Jahr 2013 ein aus Abu Dhabi stammender 73-jähriger Patient, der zur Therapie bei ARDS nach München verlegt wurde (Grunderkrankung: Multiples Myelom; Infektionsquelle: Kontakt mit erkranktem Kamel; Patient verstarb) [12]; Im Jahr 2015 ein aus Osnabrück stammender Patient, der nach einem Urlaub in Abu Dhabi erkrankte (Infektionsquelle: möglicherweise Kamelmarkt; Patient verstarb).
Klinik
Die klinische Manifestation reicht von asymptomatischen Verläufen über milde, unkomplizierte Atemwegserkrankungen bis hin zu schweren Pneumonien mit ARDS, Nierenversagen und septischem Schock. Die Mortalität der nachgewiesenen Infektionen liegt bei ca. 40 %. Hierbei sind bei den schweren Verläufen und Todesfällen überwiegend Patienten mit chronischen Vorerkrankungen betroffen.
Vor allem Patienten mit Diabetes, Niereninsuffizienz, chronischen Herz- bzw. Lungenerkrankungen und Immunsupprimierte sowie Patienten über 65 Jahre haben ein erhöhtes Risiko für einen schweren Verlauf. So hatten ca. 75 % aller MERS-Patienten mindestens eine relevante Komorbidität, bei den letalen Verläufen sind es über 85 % [13].
MERS beginnt typischerweise nach einer Inkubationszeit von durchschnittlich fünf Tagen (bis maximal 14 Tagen) mit unspezifischen Symptomen wie Fieber (98 %), Husten (83 %), Dyspnoe (72 %), Schüttelfrost bzw. Frösteln (87 %), Myalgien (32 %) und Halsschmerzen (14 %). Bei einem Viertel der Patienten können begleitend gastrointestinale Symptome (z. B. Erbrechen, Diarrhö) auftreten [13].
Bei schweren Infektionen kann eine rapide Verschlechterung eintreten. Die mediane Zeit von Symptombeginn bis zur Hospitalisierung war in einer Studie vier Tage, bis zur Aufnahme auf die Intensivstation fünf Tage, zur Beatmungspflicht sieben Tage und der Tod trat nach etwa zwölf Tagen ein [13].
Radiologisch sieht man, je nach Ausprägung, Zeichen einer viralen Pneumonie mit bilateralen insbesondere basalen Infiltraten, Milchglaszeichnung und Konsolidierungen [14].
Laborchemisch wurden unspezifische Veränderungen beobachtet, wie sie auch bei anderen viralen Erkrankungen auftreten u. a. Leukopenie (14 %), Lymphopenie (32 %), Thrombozytopenie (36 %), erhöhte LDH (48 %) und Transaminasen (AST 15 %, ALT 11 %) [13]. Bei einigen Patienten trat progrediente Niereninsuffizienz bis zum dialysepflichtigen Nierenversagen auf, bei anderen kam es zur Verbrauchskoagulopathie.
Diagnostik
Die Indikation, ob eine diagnostische Abklärung auf MERS-CoV durchgeführt werden sollte, ergib sich aus den Empfehlungen der in ▶Tab. 1 beschriebenen Falldefinitionen des Robert Koch Institutes.
|
1. Patienten mit respiratorischen Symptomen unabhängig von der Schwere UND Kontakt mit einem bestätigten oder wahrscheinlichen Fall* (innerhalb der letzten 14 Tage) |
|
2. Patienten mit erfülltem klinischen Bild** UND Aufenthalt in einem Risikogebiet (innerhalb der letzten 14 Tage). |
*Bestätigter Fall: Person mit labordiagnostischem Nachweis von MERS-CoV. Wahrscheinlicher Fall: Klinisches Bild UND Kontakt zu bestätigtem Fall, aber ohne Nachweis von MERS-CoV
**Als klinisch Bild wir hierbei ein akutes respiratorisches Syndrom (mit oder ohne Fieber und Husten) bei dem klinisch, radiologisch oder histopathologisch der Verdacht auf ein entzündliches Infiltrat (z.B. Pneumonie oder ARDS) besteht.
Das Probenmaterial sollte wenn möglich aus den tiefen Atemwegen (BAL, Trachealsekret) entnommen werden, da hier die Viruslast bei MERS-CoV deutlich höher ist. Alternativ kommt induziertes Sputum infrage; nur wenn dies nicht möglich ist, sollten Proben aus den oberen Atemwegen (Abstrich, Spülung oder Aspirat aus Nasopharynx bzw. Oropharynx) genommen werden.
Weil bei einzelnen Patienten Koinfektionen mit anderen Erregern (z. B. Influenza) beobachtet wurden, sollten Patienten mit schwerer respiratorischer Erkrankung auch dann auf MERS-CoV getestet werden, wenn bereits andere Erreger isoliert wurden, der Patient jedoch trotzdem die in ▶Tab. 1 erwähnten Falldefinitionen erfüllt.
Für die labordiagnostische Bestätigung des Verdachts auf eine Infektion mit dem MERS-CoV stehen verschiedene real time PCR-Nachweissysteme zur Verfügung, auch kommerzielle PCR-Kits sind inzwischen erhältlich. Es sollten immer mindestens zwei Nachweisverfahren unter Verwendung interner und externer Kontrollen herangezogen werden, um ein falsch positives oder negatives Ergebnis zu vermeiden. Labore, die nur begrenzte Erfahrung mit dem Nachweis von Coronaviren haben, sollten zur Bestätigung ein Referenz- bzw. Konsiliarlabor kontaktieren (Konsiliarlabor für Coronaviren: Universitätsklinikum Bonn, Institut für Virologie). Ein negatives PCR-Ergebnis schließt eine MERS-CoV Infektion nicht aus, ursächlich kann unzureichende Probenqualität, unsachgemäßer Transport oder Testdurchführung sein. Bei starkem Verdacht sollte in diesem Fall die Diagnostik wiederholt werden.
MERS-CoV wurde auch in anderen Materialien (Serum, Stuhl und Urin) nachgewiesen, jedoch in geringer Konzentration, sodass sich diese Materialien zur Erstdiagnostik kaum eignen.
Für den serologische Nachweis sollten idealerweise zwei Serumproben, in der ersten Krankheitswoche und im Abstand von zwei bis drei Wochen, untersucht werden [1].
Therapie und Management
Da bisher keine spezifische medikamentöse Behandlung gegen MERS-CoV zur Verfügung steht, bleibt aktuell nur die supportive intensivmedizinische Therapie. In Tierversuchen und in Einzelfällen zeigte die Kombinationstherapie mit Interferon-alpha-2b und Ribavirin einen vielversprechenden Ansatz [15]. Weitere randomisierte und kontrollierte Studien sind notwendig, bevor eine Therapieempfehlung ausgesprochen werden kann.
Bei wahrscheinlichen, bzw. bestätigten Fällen sollten aufgrund des potenziell schweren Verlaufes und des Risikos für nosokomiale Ausbrüche strikte Hygienemaßnahmen eingehalten werden. Diese beinhalten Einzelunterbringung des Patienten und für das Personal Schutzkittel, Einweghandschuhe, Kopfhaube, dicht anliegende Atemschutzmaske (Schutzstufe FFP2 bzw. FFP3; FFP3 oder Respirator insbesondere bei ausgeprägter Exposition, z. B. Bronchoskopie) sowie geeignete Schutzbrille und wasserdichte Einwegschürze bei entsprechenden pflegerischen, diagnostischen oder therapeutischen Tätigkeiten am Patienten. Bei Erkrankungen mit dem MERS-CoV besteht Meldepflicht gemäß § 6 Abs. 1 Nr. 5a IfSG (Auftreten einer bedrohlichen Krankheit) [1].
Bei Patienten mit bestätigten MERS-CoV-Infektionen sollten alle zwei bis vier Tage respiratorische Proben mittels PCR untersucht werden. Tritt eine klinische Besserung ein und bleiben zwei im Abstand von 24 Stunden entnommene Proben negativ, so ist der Patient als virusfrei einzustufen. Patienten scheiden das Virus durchschnittlich drei Wochen lang aus (in Einzelfällen bis zu 6 Wochen).
Prophylaxe
Da weder ein Impfstoff noch eine spezifische Therapie gegen MERS-CoV zur Verfügung stehen, ist die Expositionsprophylaxe und die Identifikation und strikte Isolierung von erkrankten Individuen von vorrangiger Bedeutung. Glücklicherweise sind Patienten erst nach Symptombeginn infektiös.
Unklar bleibt jedoch die Rolle von asymptomatischen bzw. milden Erkrankungsverläufen bei der Weiterverbreitung von MERS-CoV. Jedes Jahr reisen etwa eine Million Menschen aus Deutschland auf die Arabische Halbinsel. Das Auswärtige Amt warnt Reisende vor unnötigen Tierkontakten, auch der Konsum von z. B. unpasteurisierter Kamelmilch oder rohem bzw. ungenügend gekochtem Kamelfleisch sollte vermieden werden.
Es gibt Befürchtungen, dass es durch die Hadsch bzw. Umra, bei der jedes Jahr mehr als zwei Millionen Pilger aus aller Welt zusammenkommen, zu einer weiteren Verbreitung des MERS-CoV kommt. Bisher wurden jedoch keine Infektionen bei Hadsch-Pilgern detektiert. Das Saudische Gesundheitsministerium empfiehlt Risikopersonen (z. B. mit Diabetes, Niereninsuffizienz, chronischen Herz- bzw. Lungenerkrankungen, immunsupprimierten oder älteren Personen), die Pilgerfahrt zur eigenen Sicherheit zur verschieben. Besonders bei symptomatischen Rückkehrern gilt es wachsam zu sein (Hadsch Termin 2016: September). Die WHO empfiehlt aktuell jedoch keine Screeningmaßnahmen bei asymptomatischen Rückkehrern.
Fazit
Das MERS-CoV kann die Ursache einer schweren importierten Atemwegserkrankung mit hoher Mortalität sein. Aufgrund der niedrigen Kontagiösität schätzt die WHO das pandemische Potenzial aktuell als gering ein. Unklar ist, wie sich die Situation in der Zukunft (z. B. durch Mutation des Virus) ändern kann.
Ungeachtet davon besteht schon jetzt die Gefahr für begrenzte insbesondere nosokomiale Ausbrüche mit schweren Verläufen bei Risikopersonen.
Prophylaktisch sollten Reisende, speziell ältere Menschen mit Vorerkrankungen, Kontakte zu Kamelen im Nahen Osten meiden, auch der Kontakt zu Patienten mit Atemwegsinfektionen vor Ort oder nach Rückkehr kann für sie risikobehaftet sein.
Aufgrund der stetig zunehmenden Reisetätigkeit und Migration ist die Reiseanamnese hier imminent wichtig, um gegebenenfalls zeitnah Isolationsmaßnahmen und Diagnostik einzuleiten.

Literatur
- 1.Robert-Koch-Institut. Schwere respiratorische Erkrankungen in Verbindung mit Middle East Respiratory Syndrome Coronavirus (MERS-CoV) FALLDEFINITION zur Fallfindung, Meldung und Übermittlung. 2015.
- 2.Zaki AM, van Boheemen S, Bestebroer TM, et al. Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia. N Engl J Med. 2012;367(19):1814–20. doi: 10.1056/NEJMoa1211721. [DOI] [PubMed] [Google Scholar]
- 3.Memish ZA, Mishra N, Olival KJ, et al. Middle East respiratory syndrome coronavirus in bats, Saudi Arabia. Emerg Infect Dis. 2013;19(11):1819–23. doi: 10.3201/eid1911.131172. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Reusken CB, Messadi L, Feyisa A, et al. Geographic distribution of MERS coronavirus among dromedary camels, Africa. Emerg Infect Dis. 2014;20(8):1370–4. doi: 10.3201/eid2008.140590. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Muller MA, Corman VM, Jores J, et al. MERS coronavirus neutralizing antibodies in camels, Eastern Africa, 1983-1997. Emerg Infect Dis. 2014;20(12):2093–5. doi: 10.3201/eid2012.141026. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Azhar EI, El-Kafrawy SA, Farraj SA, et al. Evidence for camel-to-human transmission of MERS coronavirus. N Engl J Med. 2014;370(26):2499–505. doi: 10.1056/NEJMoa1401505. [DOI] [PubMed] [Google Scholar]
- 7.Aburizaiza AS, Mattes FM, Azhar EI, et al. Investigation of anti-middle East respiratory syndrome antibodies in blood donors and slaughterhouse workers in Jeddah and Makkah, Saudi Arabia, fall 2012. J Infect Dis. 2014;209(2):243–6. doi: 10.1093/infdis/jit589. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Drosten C, Meyer B, Muller MA, et al. Transmission of MERS-coronavirus in household contacts. N Engl J Med. 2014;371(9):828–35. doi: 10.1056/NEJMoa1405858. [DOI] [PubMed] [Google Scholar]
- 9.Kucharski AJ, Althaus CL. The role of superspreading in Middle East respiratory syndrome coronavirus (MERS-CoV) transmission. Euro Surveill. 2015;20(25):14–8. doi: 10.2807/1560-7917.ES2015.20.25.21167. [DOI] [PubMed] [Google Scholar]
- 10.Chowell G, Blumberg S, Simonsen L, et al. Synthesizing data and models for the spread of MERS-CoV, 2013: key role of index cases and hospital transmission. Epidemics. 2014;9:40–51. doi: 10.1016/j.epidem.2014.09.011. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Guberina H, Witzke O, Timm J, et al. A patient with severe respiratory failure caused by novel human coronavirus. Infection. 2014;42(1):203–6. doi: 10.1007/s15010-013-0509-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Drosten C, Seilmaier M, Corman VM, et al. Clinical features and virological analysis of a case of Middle East respiratory syndrome coronavirus infection. Lancet Infect Dis. 2013;13(9):745–51. doi: 10.1016/S1473-3099(13)70154-3. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Zumla A, Rustomjee R, Ntoumi F, et al. Middle East Respiratory Syndrome—need for increased vigilance and watchful surveillance for MERS-CoV in sub-Saharan Africa. Int J Infect Dis. 2015;37:77–9. doi: 10.1016/j.ijid.2015.06.020. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Ajlan AM, Ahyad RA, Jamjoom LG, et al. Middle East respiratory syndrome coronavirus (MERS-CoV) infection: chest CT findings. AJR Am J Roentgenol. 2014;203(4):782–7. doi: 10.2214/AJR.14.13021. [DOI] [PubMed] [Google Scholar]
- 15.Al-Tawfiq JA, Momattin H, Dib J, Memish ZA. Ribavirin and interferon therapy in patients infected with the Middle East respiratory syndrome coronavirus: an observational study. Int J Infect Dis. 2014;20:42–6. doi: 10.1016/j.ijid.2013.12.003. [DOI] [PMC free article] [PubMed] [Google Scholar]