Résumé
Les virus possèdent habituellement une spécificité d’hôte et sont inféodés à une espèce animale. Cette spécificité est conditionnée par la sensibilité des cellules au virus et donc par la présence de récepteurs spécifiques sur la cellule hôte. La permissivité de la cellule, c’est-à-dire sa capacité à permettre la réplication du virus, peut également conditionner cette spécificité d’hôte. Toutefois, pour de nombreux virus, cette spécificité d’hôte n’est pas absolue et des passages inter-espèces sont possibles. Les virus provenant d’un réservoir animal pouvant infecter l’homme sont responsables de zoonoses. L’émergence de ces zoonoses est favorisée par les perturbations des équilibres naturels résultant de l’activité humaine. Des mutations peuvent permettre une meilleure adaptation des virus d’origine animale à l’espèce humaine et favoriser ainsi leur propagation épidémique.
Keywords: Virus, transmission, spécificité d’hôte, passage inter-espèces
Summary
Most viruses are host-specific and thus, they are closely associated to an animal species. This host specificity is conditioned by the cell susceptibility to the virus, given by the host cell receptors, and by the cell permissivity that relies on the availability of cellular factors required for viral replication. However, for many viruses, this host specificity is not absolute and inter-species transmissions are possible. Viruses which can be transmitted from an animal reservoir to humans are responsible for zoonotic diseases. Human activities and their impact on the natural environment dramatically contribute to emergence of zoonoses. Selection of viral mutations that confer better adaptation of animal viruses to humans may lead to epidemic spread of these diseases.
Keywords: Virus, transmission, hots specificity, inter-species crossing
1. Introduction
Les virus sont capables d’infecter tous les organismes vivants, des plus rudimentaires tels que les bactéries jusqu’aux êtres les plus évolués du règne végétal ou du règne animal. Les virus sont le plus souvent inféodés à une espèce. Cette spécificité d’hôte est toutefois variable selon les virus. En ce qui concerne les virus rencontrés chez l’homme, il existe des virus infectant l’espèce humaine de manière très spécifique, comme par exemple le cytomégalovirus humain alors que d’autre virus infectent l’homme parmi bien d’autres espèces animales comme par exemple le virus de la rage.
Dans l’ensemble du règne animal, il existe un nombre incalculable de virus, la plupart d’entre eux restant certainement encore à découvrir. Certains de ces virus sont susceptibles d’être transmis à l’homme en provocant des maladies potentiellement redoutables. Ces infections transmises de l’animal à l’homme portent le nom de zoonoses ou d’anthropozoonoses. Par ailleurs, certains virus ont pu s’établir dans la population humaine à partir d’un réservoir animal. L’histoire récente témoigne de cette possibilité d’émergence de graves maladies humaines dues à des virus d’origine animale : sida, SARS, pandémies de grippe, etc.
Il est donc important de comprendre les bases de la spécificité d’hôte des virus et les mécanismes par lesquels ces virus peuvent émerger au sein d’une autre espèce que leur espèce d’origine.
2. Les bases de la spécificité d’hôte
Pour être infectée par un virus donné, une cellule doit être d’une part sensible au virus – c’est-à-dire qu’elle doit spécifiquement fixer le virus à sa surface pour permettre sa pénétration – et, d’autre part, permissive à ce virus en lui permettant d’accomplir son cycle de réplication.
Une ou plusieurs protéines ou glycoprotéines formant un récepteur à la surface cellulaire conditionnent la sensibilité de la cellule au virus, alors que certaines protéines intracellulaires peuvent conditionner sa permissivité. D’une espèce animale à une autre, les différences existant au niveau des récepteurs ou des protéines impliquées dans la permissivité cellulaire expliquent la spécificité d’hôte qui sera plus ou moins étroite selon le degré de conservation de ces éléments entre les différentes espèces.
2.1. Sensibilité des cellules au virus
La sensibilité d’une cellule à un virus donné est conditionnée par la présence d’un récepteur à la surface cellulaire. Ces récepteurs, constitués par une ou plusieurs protéines ou glycoprotéines, ont la propriété de se lier à des protéines ou glycoprotéines externes du virus. Il en résulte une fixation du virus à la surface cellulaire ; cette fixation est une étape indispensable à la pénétration du virus dans la cellule. Quelques exemples de récepteurs pour des virus rencontrés en pathologie humaine sont présentés dans le tableau I .
Tableau I.
Exemples de virus humains et de leurs récepteurs.
| Virus | Récepteurs | Cellules exprimant le récepteur | Protéines virales reconnues par le récepteur |
|---|---|---|---|
| Poliovirus | Human poliovirus receptor (hPVR)* | Epithélium intestinal, neurones moteurs | VP1 |
| Rhinovirus | ICAM-I: molécule d’adhésion intercellulaire | Diverses | VP1, VP3 |
| Adénovirus | Coxsackievirus and adenovirus receptor (CAR)* Intégrines (co-récepteur) | Diverses | Fibre Base du penton |
| Parvovirus B19 | Antigène P (récepteur primaire) 5 1 intégrines (co-récepteur) | Lignée érythrocytaire Progéniteurs érythroïdes | VP2 VP2 |
| Virus Epstein-Barr | CD21: récepteur pour la fraction C3d du complément | Lymphocytes B | Gp350/220 |
| Virus Influenza A | Acide sialique liée en 2,6 au galactose | Cellules épithéliales des voies respiratoires supérieures | Hémagglutinine |
| VIH | CD4 (récepteur primaire) CCR5, CXCR4 (co-récepteurs) | Lymphocytes, monocytes | Gp120 |
Glycoprotéines de la superfamille des immunoglobulines.
Certaines molécules servant de récepteur sont très répandues d’une espèce à l’autre. C’est le cas par exemple de l’acide sialique qui constitue le récepteur des virus de la grippe en se liant à l’hémagglutinine (glycoprotéine de surface) du virus. L’acide sialique, liée au galactose, termine les chaînes oligosaccharidiques des glycoprotéines ou glycolipides présents à la surface cellulaire ( figure 1 ). La distribution ubiquitaire de cette molécule permet aux virus de la grippe A d’infecter différentes espèces animales. Toutefois, des différences de conformation de ce récepteur ont un impact sur la reconnaissance du récepteur par le virus. En particulier, l’hémagglutinine des virus de grippe A humains reconnaît l’acide sialique liée au galactose en liaison 2-6 (récepteur humain) alors que l’hémagglutinine des virus aviaires reconnaît l’acide sialique en liaison 2-3 (récepteur aviaire). Il a été montré dans le cas de la grippe aviaire H5N1 que des mutations responsables d’un changement d’aminoacide au codon 182 et/ou 192 de l’hémagglutinine permettent au virus aviaire de s’adapter au récepteur humain [1]. Par ailleurs, il a été mis en évidence que le porc possédait les deux types de récepteurs et pouvait être infecté par des souches de grippe aviaire et humaine. De ce fait, le porc est une espèce capable « d’humaniser » les virus aviaires et de faciliter ainsi la transmission à l’homme de virus d’origine aviaire [2].
Figure 1.

Récepteur des virus de la grippe A : acide sialique en liaison 2,3 au galactose.
Ce récepteur est reconnu par l’hémagglutinine des virus aviaires. L’hémagglutinine des virus humains reconnaît comme récepteur l’acide sialique en liaison 2,6 au galactose.
2.2. Permissivité des cellules à l’infection virale
La permissivité d’une cellule à un virus donné est conditionnée par la présence de facteurs cellulaires indispensables à la réplication virale. La spécificité des interactions entre les éléments viraux (acides nucléiques, protéines) et les facteurs cellulaires sera le plus souvent un facteur limitant le spectre des espèces sensibles à un virus donné.
Il peut exister également dans les cellules d’une espèce animale donnée des facteurs inhibiteurs s’opposant à la réplication de certains virus. Ainsi, par exemple, des facteurs inhibant la réplication de rétrovirus ont été mis en évidence dans des cellules humaines. Dès 1960, un facteur conférant la résistance au murine leukemia virus (MLV) a été mis en évidence dans des cellules murines et un tel facteur de restriction inhibant la réplication du MLV a été mis en évidence chez l’homme, il s’agit du restriction factor 1 (Ref1) [3]. Un facteur analogue bloquant la réplication de certains rétrovirus a été également découvert dans des cellules de divers primates : le lentiviral factor 1 (Lv1) [4]. En 2004, des protéines responsables de l’inhibition de l’infection du singe rhésus (protéine TRIM5) ou de singes du nouveau monde du genre Aotus (protéine TRIM5-cypA) par HIV-1ont été mises en évidence [5, 6]. Il a été montré que l’ensemble de ces facteurs de restriction appartenaient à la même famille de protéines et qu’ils étaient spécifiques d’espèce [7]. Ces éléments permettent, tout au moins en partie, d’expliquer pourquoi certaines espèces de primates sont résistantes à l’infection par des virus simiens ou humains de l’immunodéficience (SIV/HIV) malgré la présence des récepteurs correspondants.
3. Facteurs de passages inter-espèces
Au cours de l’histoire de l’humanité, il s’est établi un équilibre entre l’homme et les espèces animales avec lesquelles il est en contact. Une rupture de cet équilibre, liée à des changements climatiques ou à la modification des écosystèmes, peut être à l’origine de l’émergence de nouvelles zoonoses. Par ailleurs, des mutations permettant aux virus d’origine animale de mieux s’adapter à l’espèce humaine peuvent faciliter la propagation épidémique de ces virus.
3.1. Changements climatiques
Le réchauffement climatique peut avoir un impact sur la répartition géographique des vecteurs et des infections qu’ils sont susceptibles de transmettre. À la faveur de ce réchauffement, des vecteurs d’arboviroses d’origine tropicale peuvent s’établir dans des zones tempérées. C’est ainsi que Aedes albopictus, pouvant transmettre la dengue et le chikungunya, est en train de coloniser le littoral méditerranéen français [8]. Il ne s’agit pas d’un risque théorique, une épidémie de chikungunya liée à la présence de ce vecteur s’est déclarée en Italie du Nord en 2007 [9].
Des conditions climatiques inhabituelles, en modifiant la densité ou le comportement d’espèces animales constituant un réservoir ou un vecteur de virus peuvent également représenter un facteur de transmission à l’homme. Ainsi, par exemple, un syndrome pulmonaire cliniquement sévère, associé à des hantavirus non identifiés jusqu’alors, est apparu aux États-Unis en 1993 et s’est répandu sur tout le continent américain [10, 11]. Il a été démontré que le virus infectait des souris sylvestres et qu’il était transmis sous forme d’aérosols à partir de leurs excrétas. L’année 1993 avait été marquée par une pullulation de ces souris en raison d’une pluviosité accrue liée au phénomène El Niño. La survenue d’un hiver rigoureux ayant poussé les souris à pénétrer dans les habitations avait favorisé le contact de la population avec les souris et leurs excrétas, entraînant un nombre important de cas [12]. De la même manière, l’incidence des arboviroses transmises par les moustiques en zone tropicale est très liée à la température et la pluviométrie [13].
3.2. Modifications des écosystèmes
Des modifications majeures, essentiellement induites par l’activité humaine, sont intervenues au cours des dernières décennies. En particulier, l’homme a conquis de nouveaux espaces naturels, augmentant les probabilités de rencontre entre les populations humaines et de nouveaux virus. Un exemple frappant concerne l’exploitation des forêts tropicales. Ces forêts sont de plus en plus exploitées et l’homme pénètre de plus en plus profondément dans ces zones où il peut être en contact avec de nouveaux réservoirs animaux. La figure 2 montre, par exemple, l’extension des concessions forestières au Gabon, une situation identique prévalant dans la plupart des pays d’Afrique centrale, en Asie du Sud-est ou en Amérique du Sud. Les origines de l’épidémie du sida ou la plupart des épisodes épidémiques de fièvre hémorragique due au virus Ebola trouvent leur source dans les contacts de l’homme avec des primates vivant au sein de la forêt dense en Afrique [14, 15].
Figure 2.
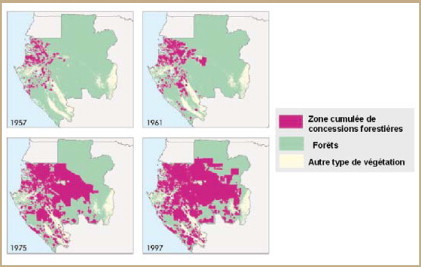
Extension des concessions forestières au Gabon de 1957 à 1997.
Source: http://www.globalforestwatch.org
3.3. Activité humaine
L’activité humaine a également des répercussions sur le développement de zoonoses. Ainsi, en Afrique subsaharienne, les exploitations forestières donnent lieu à d’importants flux migratoires, à l’urbanisation de ces zones et à l’ouverture de routes qui peuvent faciliter la dissémination de l’infection. Le développement de la prostitution dans ces zones nouvellement urbanisées et dans les grandes villes ainsi que la pratique de transfusions sanguines non sécurisées sont des facteurs d’amplification épidémique. La diffusion interhumaine de l’infection à VIH en Afrique, bien antérieure à l’apparition de l’épidémie dans les pays occidentaux, repose essentiellement sur ces modifications concernant à la fois le milieu naturel et l’activité humaine.
Les transports transcontinentaux permettent de propager rapidement des épidémies d’un continent à l’autre. Lors de l’épidémie de SARS en Chine en 2003, la maladie s’est rapidement propagée par les voyages aériens et le Canada a par exemple été sévèrement touché à partir de patients en provenance de Hong Kong [16]. De la même manière, la pandémie de grippe A (H1N1)v s’est propagée beaucoup plus rapidement à l’échelle planétaire que les pandémies précédentes en raison essentiellement du développement du transport aérien.
Les transports aériens ou de marchandises peuvent véhiculer des arthropodes vecteurs d’arboviroses. Ainsi, les Aedes pouvant transmettre la dengue ou le chikungunya prolifèrent dans les pneus usagés et le commerce international de ces pneus a permis la dissémination de ces moustiques en dehors de leur région asiatique d’origine [17].
Les transports d’animaux sont également un facteur de propagation de zoonoses. Le commerce des volailles a joué un rôle majeur dans les épizooties de grippe aviaire. Le virus West Nile, qui était inconnu sur le contient américain, est apparu à New-York en 1999. À partir de ce foyer new-yorkais, le virus s’est répandu sur le continent américain à partir de 2002, occasionnant plusieurs milliers de cas sévères (encéphalites) et plusieurs centaines de décès. Le séquençage des souches new-yorkaises a démontré qu’elles étaient étroitement apparentées à une souche isolée en 1998 en Israël [18]. L’importation illégale d’oiseaux et/ou l’introduction de moustiques vecteurs est l’hypothèse la plus vraisemblable pour expliquer le déclenchement de cette épidémie.
Les animaux de compagnie peuvent également être à l’origine d’infections virales chez l’homme. Les rongeurs (rats, souris, hamsters…) sont des hôtes naturels du virus de la chorio-méningite lymphocytaire aisément transmissible à l’homme et pouvant occasionner des méningo-encéphalites sévères, voire mortelles [19]. La recherche de nouveaux animaux de compagnie (NAC) toujours plus inhabituels et exotiques représente à cet égard un risque d’introduction de nouveaux virus chez l’homme [20]
3.4. Mutations
Le passage d’un virus d’une espèce animale à l’homme peut être favorisé par la sélection de mutants mieux adaptés à l’espèce humaine. La possibilité de l’adaptation de souches de virus de la grippe aviaire à l’espèce humaine par mutations au niveau du gène de l’hémagglutinine permettant à celle-ci de se fixer sur l’acide sialique en liaison 2,6 au galactose a déjà été évoquée. Les récepteurs de type 2,3 pour les virus aviaires existent chez l’homme, mais ils sont situés au niveau des alvéoles pulmonaires, la transmission de virus aviaire à l’homme est de ce fait difficile et il n’y a pas de transmission interhumaine de ces virus. Les mutations permettant à l’hémagglutinine de ces virus d’utiliser les récepteurs de type 2,6, situés au niveau de l’épithélium des voies respiratoires supérieures, sont une étape clé pour permettre la transmission interhumaine et donc la diffusion épidémique de ces virus [21].
Il a été montré avec le coronavirus du SARS, que des mutations sur le gène de la glycoprotéine de surface se liant au récepteur cellulaire permettaient au virus de s’adapter à la multiplication sur cellules d’origine humaine [22].
Il a aussi été expérimentalement démontré qu’un nombre limité de mutations permettaient d’adapter l’entérovirus 71 humain à la souris et à le rendre virulent pour celle-ci [23].
4. Principaux virus pathogènes pour l’homme issus d’un réservoir animal
4.1. Virus transmis par un arthropode vecteur : arbovirus
Les arbovirus (arthropod-borne virus) appartiennent à différentes familles de virus ; ils ont comme caractéristique commune d’être transmis par l’intermédiaire d’un arthropode hématophage vecteur (moustique, phlébotome ou tique). La transmission à l’homme par le vecteur n’est pas la conséquence d’un transfert passif du virus mais elle résulte de la réplication du virus dans les glandes salivaires de l’arthropode. Ces virus ont donc la propriété d’infecter à la fois des mammifères, des oiseaux (pour certains d’entre eux) et des arthropodes. Le réservoir de virus est presque toujours un réservoir animal, les arboviroses sont donc des anthropozoonoses. Les virus de la dengue sont un des rares exemples d’arbovirus n’ayant pas de réservoir animal connu mais seulement un réservoir humain. Les principaux arbovirus rencontrés en pathologie humaine sont présentés dans le tableau II .
Tableau II.
Principaux arbovirus rencontrés en pathologie humaine.
| Virus | Réservoir | Vecteur |
|---|---|---|
| Flaviridae | ||
| V. de la fièvre jaune | Primates, homme | Aedes (africanus, simpsoni, aegypti) |
| V. de la dengue (4 sérotypes) | Homme | Aedes (aegyptii, albopictus) |
| V. West Nile | Oiseaux | Culex |
| V. de l’encéphalite japonaise | Oiseaux, porc | Culex |
| V. de l’encéphalite de St-Louis | Oiseaux, chauves-souris | Culex |
| V. de l’encéphalite à tiques | Rongeurs, ruminants | Ixodes** |
| V. de la FH* d’Omsk | Mammifères sauvages | Ixodes, Dermacentor** |
| V. de la FH de la forêt de Kaysanur | Mammifères sauvages | Haemaphysatis** |
| Togaviridae | ||
| V. Chikungunya | Primates, homme | Aedes (aegypti, albopictus) |
| V. O’nyong-nyong | Homme, animal ? | Anopheles (funestus, gambiense) |
| V. Tahyna | Lièvre, lapin | Aedes, Culex |
| V. de la fièvre de la Ross River | Marsupiaux, rongeurs | Aedes ; Culex |
| V. de l’encéphalite équine de l’Est | Chevaux, oiseaux | Culiseta (melanura, morsitans) |
| V. de l’encéphalite équine de l’Ouest | Chevaux, oiseaux | Culex, Culiseta |
| Bunyaviridae | ||
| V. Toscana | Phlébotomes | Phlébotomus |
| V. de la fièvre de la Vallée du Rift | Bovins, ovins | Aedes |
| V. de l’encéphalite La Crosse | Écureuils | Aedes triseriatus |
| V. de la FH Crimée-Congo | Animaux domestiques | Hyalomma, Amblyomma** |
| Reoviridae | ||
| V. de la fièvre à tiques du Colorado | Rongeurs sauvages | Dermacentor andersoni** |
FH : fièvre hémorragique.
Tiques.
4.2. Virus d’origine animale rencontrés en pathologie humaine non transmis par un arthropode vecteur
Diverses espèces animales sont infectées par des virus transmissibles à l’homme. Ces virus peuvent être transmis accidentellement par contact entre l’homme et l’animal infecté. Le passage de l’animal à l’homme peut être à l’origine d’infections accidentelles rares, comme par exemple le virus B du singe (Cercopithecine herpesvirus 1) qui, transmis accidentellement à l’homme, est responsable d’une encéphalite mortelle. Néanmoins, ce passage au départ accidentel peut être à l’origine d’une propagation épidémique de grande ampleur : on peut citer par exemple les pandémies de grippe A trouvant leur origine dans des virus aviaires et/ou porcins ou la pandémie de sida résultant du passage du SIVcpz du chimpanzé à l’homme [14]. On peut noter que ces dernières années, des infections graves sporadiques ou épidémiques se sont développées chez l’homme à partir d’un réservoir animal constitué par différentes espèces de chauve-souris [24, 25]. Le tableau III présente les principaux virus transmissibles à l’homme à partir de différents réservoir animaux.
Tableau III.
Principaux virus transmissibles de l’animal à l’homme.
| Réservoir animal | Virus | Hôte intermédiaire éventuel |
|---|---|---|
| Oiseaux | • Orthomyxoviridae V. grippe A |
Porc |
| Chiroptères (chauves-souris) | • Rhabdoviridae V. de la rage* • Coronaviridae SARS Coronavirus • Filoviridae V. Ebola • Paramyxoviridae V. Nipah V. Hendra |
Divers mammifères Civette Primates Porc Cheval |
| Rongeurs | • Arenaviridae V. chorioméningite lymphocytaire V. fièvre de Lassa V. Junin V. Machupo V. Guanarito V. Sabia • Bunyaviridae (à vérifier Hantavirus de l’ancien monde (Haantan, Puumala) Hantavirus du nouveau monde (sin nombre) • Poxviridae Monkeypox |
Primates |
| Porc | • Orthomyxoviridae V. Grippe A • Hepeviridae Hépatite E |
|
| Ovins, caprins | • Poxviridae V. Orf V. du Nodule du trayeur V. de la vaccine |
|
| Canidés (renard, chien | • Rhabdoviridae Virus de la rage* |
Mammifères divers |
| Primates | • Herpesviridae Cercopithecine herpesvirus 1 • Retroviridae SIVcpz** SIVsmm*** STLV-1**** Simian foamy virus |
Le virus de la rage est transmis à l’homme par les canidés essentiellement, mais les chiroptères peuvent représenter une source de contamination dans certaines régions du monde [26, 27].
À l’origine du HIV-1 chez l’homme.
À l’origine du HIV-2 chez l’homme.
À l’origine du virus HTLV-1 chez l’homme.
5. Conclusion
Pour de nombreux virus, la spécificité d’espèce n’est que relative et les passages inter-espèces sont fréquents. Des transmissions de l’animal à homme sont à l’origine d’anthropozoonoses représentant souvent un problème majeur de santé publique. Certains virus animaux se sont particulièrement bien adaptés à l’espèce humaine et ils sont devenus d’authentiques virus humains, avec une transmission interhumaine responsable de leur propagation épidémique. Les virus de la grippe A ou du sida en sont un exemple frappant. Fièvres hémorragiques virales, SARS, syndrome pulmonaire à Hantavirus… des épidémies émergentes inquiétantes se sont développées à partir de réservoirs animaux au cours des deux dernières décennies. La liste des virus pouvant émerger chez l’homme n’est certainement pas close. Les profondes modifications des équilibres naturels générées par l’activité humaine doivent à ce titre inciter à la vigilance.
Conflit d’intérêt : aucun.
Références
- 1.Yamada S., Suzuki Y., Suzuki T. Haemagglutinin mutations responsible for the binding of H5N1 influenza A virusses to human-type receptors. Nature. 2006;444:378–382. doi: 10.1038/nature05264. [DOI] [PubMed] [Google Scholar]
- 2.Ito T., Couceiro J.N., Kelm S. Molecular basis for the generation in pigs of influenza A viruses with pandemic potential. J Virol. 1998;72:7367–7373. doi: 10.1128/jvi.72.9.7367-7373.1998. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 3.Towers G., Bock M., Martin S. A conserved mechanism of retrovirus restriction in mammals. Proc Natl Acad Sci USA. 2000;97:12295–12299. doi: 10.1073/pnas.200286297. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cowan S., Hatziioannou T., Cunningham M. Cellular inhibitors with Fv1-like activity restrict human and simian immunodeficiency virus tropism. Proc Natl Acad Sci USA. 2002;99:11914–11919. doi: 10.1073/pnas.162299499. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Sayah D.M., Sokolskaja E., Berthoux L. Cyclophilin A retrotransposition into TRIM5 explains owl monkey resistance to HIV-1. Nature. 2004;430:569–573. doi: 10.1038/nature02777. [DOI] [PubMed] [Google Scholar]
- 6.Stremlau M., Owens C.M., Perron M.J. The cytoplasmic body component TRIM5alpha restricts HIV-1 infection in Old World monkeys. Nature. 2004;427:848–853. doi: 10.1038/nature02343. [DOI] [PubMed] [Google Scholar]
- 7.Hatziioannou D., Perez-Caballero D., Yang A. Retrovirus resistance factors Ref1 and Lv1 are species-specific variants of TRIM5alpha. Proc Natl Acad Sci USA. 2004;101:10774–10779. doi: 10.1073/pnas.0402361101. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Delaunay P., Jeannin C., Schaffner News on the presence of the tiger mosquito Aedes albopictus in metropolitan France. Arch Pediatr. 2009;16(suppl. 2):S66–S71. doi: 10.1016/S0929-693X(09)75304-7. [DOI] [PubMed] [Google Scholar]
- 9.Angelini P., Finarelli A.C., Silvi G. Chikungunya emergency in Emilia-Romagna: learning through experience. Epidemiol Prev. 2008;32:258–263. [PubMed] [Google Scholar]
- 10.Centers for Disease Control and Prevention (CDC) Outbreak of acute illness - Southwestern United States, 1993. Morb Morta. Wkly Rep. 1993;42:421–424. [PubMed] [Google Scholar]
- 11.Hughes J.M., Peters C.J., Cohen M.L. Hantavirus pulmonary syndrome: an emerging infectious disease. Science. 1993;262:850–851. doi: 10.1126/science.8235607. [DOI] [PubMed] [Google Scholar]
- 12.Centers for Disease Control, Prevention (CDC) Update: outbreak of hantavirus infection - Southwestern United States, 1993. Morb Mortal Wkly Rep. 1993;42:816–820. [Google Scholar]
- 13.Brunkard J.M., Cifuentes E., Rothenberg S.J. Assessing the roles of temperature, precipitation, and ENSO in dengue re-emergence on the Texas-Mexico border region. Salud Publica Mex. 2008;50:227–234. doi: 10.1590/s0036-36342008000300006. [DOI] [PubMed] [Google Scholar]
- 14.Hahn B.H., Shaw G.M., de Cock M. AIDS as a zoonosis: scientific and public health implications. Science. 2000;287:607–614. doi: 10.1126/science.287.5453.607. [DOI] [PubMed] [Google Scholar]
- 15.Georges A.J., Leroy E.M., Renaut A.A. Ebola hemorragic fever outbreaks in Gabon, 1997-1997: epidemiologic and health control issues. J Infect Dis. 1999;179(Suppl. 1):S65–S75. doi: 10.1086/514290. [DOI] [PubMed] [Google Scholar]
- 16.Naylor C.D., Chantler C., Griffiths S. Learning from SARS in Hong Kong and Toronto. JAMA. 2004;291:2483–2487. doi: 10.1001/jama.291.20.2483. [DOI] [PubMed] [Google Scholar]
- 17.Grist N.R. Aedes albopictus, the tyre-travelling tiger. J Infect. 1993;27:1–4. doi: 10.1016/0163-4453(93)93418-4. [DOI] [PubMed] [Google Scholar]
- 18.Lanciotti R.S., Roehrig J.T., Deubel V. Origin of the West Nile virus responsible for an outbreak of encephalitis in the northeastern United States. Science. 1999;286:2333–2337. doi: 10.1126/science.286.5448.2333. [DOI] [PubMed] [Google Scholar]
- 19.Amman B.R., Pavlin B.I., Albariño C.G. Pet rodents and fatal lymphocytic choriomeningitis in transplant patients. Emerg Infect Dis. 2007;13:719–725. doi: 10.3201/eid1305.061269. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Pickering L., Marano N., Bocchini J.A. Exposure to nontraditionnal pets at home and to animals public settings: risks to children. Pediatrics. 2008;122:876–886. doi: 10.1542/peds.2008-1942. [DOI] [PubMed] [Google Scholar]
- 21.Shinya K., Ebina M., Yamada S. Avian flu: influenza virus receptors in the human airway. Nature. 2006;440:435–436. doi: 10.1038/440435a. [DOI] [PubMed] [Google Scholar]
- 22.Sheahan T., Rockx B., Donaldson E. Mechanisms of zoonotic severe acute respiratory syndrome coronavirus host range expansion in human airway epithelium. J Virol. 2008;82:2274–2285. doi: 10.1128/JVI.02041-07. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 23.Chua B.H., Phuektes P., Sanders S.A. The molecular basis of mouse adaptation by human enterovirus 71. J Gen Virol. 2008;89:1622–1632. doi: 10.1099/vir.0.83676-0. [DOI] [PubMed] [Google Scholar]
- 24.Leroy E.M., Kumulungui B., Pourrut X. Fuit bats as reservoirs of Ebola virus. Nature. 2005;438:575–576. doi: 10.1038/438575a. [DOI] [PubMed] [Google Scholar]
- 25.Wong S., Lau S., Woo P. Bats as a continuing source of emerging infections in humans. Rev Med Virol. 2007;17:67–91. doi: 10.1002/rmv.520. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Messenger S.L., Smitmh J.S., Rupprecht C.E. Emerging epidemiology of bat-associated cryptic cases of rabies in the humans in the United States. Clin Infect Dis. 2002;35:738–747. doi: 10.1086/342387. [DOI] [PubMed] [Google Scholar]
- 27.Ito M., Arai Y.T., Itou T. Genetic characterization and geographic distribution of rabies virus isolates in Brazil: identification of two reservoirs: dogs and vampire bats. Virology. 2001;284:214–222. doi: 10.1006/viro.2000.0916. [DOI] [PubMed] [Google Scholar]


