Résumé
Les tests de dépistage rapide (TDR) basés sur la technique d’immunochromatographie sont très répandus pour le diagnostic des maladies infectieuses. Dans le cadre des infections respiratoires virales, il s’agit essentiellement de tests pour le diagnostic de la grippe et des infections à virus respiratoire syncytial (VRS). Pour le diagnostic des gastroentérites virales, ce sont des tests de détection des rotavirus, adénovirus, norovirus et astrovirus qui peuvent être utilisés. Les TDR pour les infections à VRS et les gastroentérites sont utilisés essentiellement dans le cadre de la pathologie pédiatrique. Ces tests présentent généralement une spécificité élevée mais une sensibilité modeste par rapport aux techniques moléculaires. Ce sont donc surtout des tests de dépistages et leur négativité ne permet pas d’exclure le diagnostic.
Mots-clés: TDR, immunochromatographie, virus, grippe, VRS, gastroentérite
Summary
Rapid diagnostic tests (RDT), based on immunochromatography, are widely used for the diagnosis of infectious diseases. For viral respiratory infections, RDT target infections by influenza viruses or respiratory syncytial virus (RSV). For diagnosis of gastroenteritis, RDT can be used for the detection of rotavirus, adenovirus, norovirus or astrovirus. RDT for RSV or gastroenteritis are mainly used in a pediatric context. RDT generally present a high specificity, however their sensitivity is only modest by comparison with molecular technics. Consequently, RDT are essentially considered as screening tests, and their negativity does not allow to exclude the diagnostic of respiratory or gastrointestinal viral infection.
Keywords: RDT, immunochromatography, virus, flu, RSV, gastroenteritis
1. Introduction
Les tests de diagnostic rapide (TDR) sont des tests diagnostiques dont la principale caractéristique est, comme leur nom l’indique, de donner un résultat très rapide, le plus souvent dans un délai de quelques minutes.
Une autre caractéristique majeure de ces tests est leur simplicité d’utilisation sous forme de tests unitaires, permettant dans certaines conditions leur utilisation en dehors des laboratoires, à proximité du patient, dans un service hospitalier ou un cabinet médical par exemple. On parle alors de test rapide d’orientation diagnostique (TROD) ou de « point of care test » (POCT). Un certain nombre de ces tests sont d’ailleurs considérés par le législateur comme ne constituant pas un examen de biologie médicale, permettant leur utilisation par du personnel de santé autre que les biologistes ou les techniciens de laboratoire (arrêté du 11 juin 2013).
Les TDR couvrent différents domaines de la pathologie humaine, mais le diagnostic des maladies infectieuses représente une cible privilégiée de ces tests. Parmi les infections virales, des TDR ont été développés pour le diagnostic de l’infection VIH, de l’hépatite C, de la dengue, d’infections respiratoires ou de gastroentérites. Ce sont ces deux dernières applications qui sont abordées ici.
2. Les TDR : aspects techniques
Les TDR développés pour le diagnostic des infections virales reposent essentiellement sur la technique d’immunochromatographie. La technique est basée sur la migration de l’antigène viral présent dans l’échantillon par capillarité sur un support solide de type nitrocellulose. Cet antigène est capturé par un anticorps spécifique immobilisé sur la membrane sous forme d’une fine bande. Le complexe antigène anticorps est révélé par un second anticorps (présent lui aussi au départ sur la membrane et migrant pendant la réaction) marqué à l’or colloïdal ou par des particules de latex colorées. La fixation de cet anticorps marqué sur le complexe antigène anticorps se traduit par l’apparition d’une bande colorée. Une bande contrôle basée sur la capture des anticorps marqués permet de valider le résultat.
La lecture se fait directement à l’œil nu ( figure 1 ). Ces TDR se présentent sous forme de bandelettes dont la base est immergée dans l’échantillon ou sous forme de cassettes communément désignées sous le terme de « savonnette ».
Figure 1.
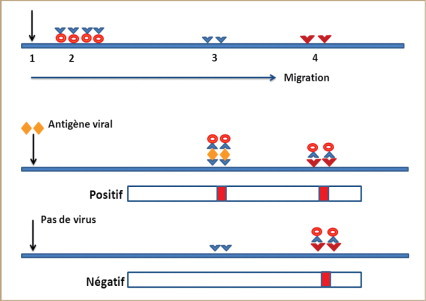
Principe de l’immunochromatographie.
1. Zone de dépôt de l’échantillon. 2. Anticorps anti-antigène viral marqué (non fixé sur le support). 3. Anticorps de capture de l’antigène viral (fixé sur le support). 4. Anticorps de capture des anticorps marqué (contrôle).
À côté de ces TDR à lecture directe visuelle, sont développés des tests donnant un résultat rapide mais nécessitant un appareillage de détection, tels que les tests SofiaTM (Ingen) ou BD VeritorTM system (Becton Dickinson) basés sur une technique d’immunochromatographie avec utilisation d’anticorps fluorescent et qui paraissent plus sensibles que les tests à lecture visuelle [1, 2]. Il convient de signaler également le développement de tests moléculaires présentés sous forme de cassettes individuelles avec un appareillage de détection adapté et donnant un résultat rapide, de l’ordre de 1 à 2 heures, tels que le système GeneXpert™. Ces tests, qui sont amenés à se développer considérablement dans les laboratoires ou les « points of care », ne seront pas développés dans cet article.
3. TDR et infections respiratoires virales
3.1. Infections respiratoires virales
3.1.1. La grippe
3.1.1.1. Contexte épidémiologique et clinique
Parmi les 3 types de virus de la grippe (A, B et C), seuls les types A et B sont responsables de la grippe proprement dite. Le virus de la grippe A est responsable d’épidémies annuelles (grippe saisonnière) touchant 5 à 20% de la population. L’apparition régulière de nouveaux variants (ou souches) liée la variabilité génétique du virus est à l’origine de ces épidémies annuelles. À côté des épidémies annuelles, surviennent périodiquement des épidémies de grande ampleur (pandémies) liées à l’apparition d’un nouveau sous-type de grippe A dans la population humaine. Ce sont des recombinaisons entre des souches humaines et des souches animales qui sont à l’origine de l’apparition de ces sous-types pandémiques. Les pandémies survenues depuis le début du XXe siècle ont été la grippe espagnole (sous-type H1N1) en 1918, la grippe asiatique (sous-type H2N2) en 1957, la grippe de Hong-Kong (sous-type H3N2) en 1968 et la grippe mexicaine (sous-type H1N1v) en 2009. Le virus de la grippe B, spécifiquement humain, présente une variabilité saisonnière moins importante que celle de la grippe A. La grippe B sévit annuellement de manière sporadique et sous forme épidémique à intervalles de quelques années. Les pandémies liées à l’apparition de nouveaux variants n’existent pas avec le virus de la grippe B. La grippe se caractérise par un début brutal, une fièvre élevée, des douleurs et une atteinte respiratoire. La maladie évolue le plus souvent favorablement, mais les risques de complications et de décès dans les formes graves sont réels. Le risque de formes sévères et de décès s’observe essentiellement chez les sujets âgés, les insuffisants respiratoires, les insuffisants cardiaques, insuffisants rénaux, les sujets porteurs de maladies chroniques, mais également les femmes enceintes et les nourrissons.
En raison de l’importance des épidémies et des risques de formes graves, la grippe est une maladie sous surveillance (réseaux sentinelles), en particulier dans les populations à risques : établissements de personnes âgées, services de pédiatrie, de réanimation etc. Les TDR ont un rôle à jouer dans cette surveillance.
3.1.1.2. Grippe et TDR
• Tests disponibles
De nombreuses trousses sont proposées pour le diagnostic rapide de la grippe. Les caractéristiques des principaux tests sont présentées dans le tableau I . Dans la plupart des cas, des dispositifs de prélèvement (écouvillons) sont inclus dans le coffret. Des échantillons de contrôle positifs et négatifs ne sont pas toujours inclus dans les trousses. Il est évidemment très important de valider le bon fonctionnement de la trousse à l’aide d’échantillons de contrôle. La disponibilité d’échantillons de contrôle positifs (grippe A et grippe B) et négatifs est un élément important à prendre en compte dans le choix d’un TDR.
Tableau I.
TDR Grippe (liste non exhaustive).
| Désignation du test | Fabricant/Distributeur | Dispositif de prélèvement | Nombre de tests/coffret |
|---|---|---|---|
| Actim Influenza A et B | Medix Biochemica/Fumouze | Oui | 20 |
| BD Directigen EZ Flu A et B | Becton Dickinson | Non | 30 |
| Binax Now influenza A &B card | Alere | Non | 22 |
| Bionexia Influenza A+B | bioMérieux | Oui | 10 |
| CerTest Influenza A+B | Certes Biotec/Theradiag | Oui | 20 |
| Clearview Exact Influenza A &B | Medimax/Alere | Oui | 20 |
| Espline Influenza A & B-N | Fujirebio | Oui | 10 |
| Influenza A/B Panel test | Gecko Pharma/Eurobio | Oui | 20 |
| Influenza A &B Respi-strip | Coris Bioconcept | Non | 25 |
| Influenza A&B Uni-strip | Coris Bioconcept | Oui | 10 |
| Influenza color | Servibio | Oui | 20 |
| Nadal Influenza A+B | Nal von Minden | Oui | 10 ou 25 |
| QuickVue Influenza A+B | Quidel/Ingen | Oui | 25 |
| Tru Flu | Meridian | Non | 32 |
• Performances des tests
Les performances des TDR pour le diagnostic de grippe sont variables selon les trousses. Chaque fabricant indique pour sa trousse des valeurs de sensibilité et de spécificité mais cela ne permet pas de comparer directement les différentes trousses entre elles. En effet, selon les cas, les trousses sont évaluées par rapport à la culture cellulaire, voire par rapport à un autre TDR, plus rarement par rapport à la PCR qui est la technique la plus sensible. Par ailleurs, la sélection d’échantillons pour la réalisation de ces études varie en termes de nombre et de proportion d’échantillons positifs. La plupart des trousses sont présentées comme ayant une sensibilité supérieure à 80% et une spécificité supérieure à 95%. Une méta-analyse prenant en compte 159 études publiées sur 26 trousses a rapporté une sensibilité globale 62,3% et une spécificité globale de 98,2%. Il ressortait de ces données que la sensibilité était plus élevé pour les prélèvements effectués chez les enfants par rapport à ceux effectués chez l’adulte (66,6% vs 53,9%), que la sensibilité était globalement plus élevée pour le virus Influenza A que pour le virus Influenza B (64,6% vs 52,2%). Il ressortait également que la sensibilité des tests était plus élevée lorsque le test était effectué 24 à 48 heures après le début des symptômes, avec une sensibilité plus faible le premier jour des symptômes et une perte rapide de sensibilité au-delà du troisième jour. La sensibilité globale de ces tests était de 72,3% par rapport à la culture cellulaire, mais de seulement 53,9% par rapport à la PCR [3].
La variabilité antigénique du virus A peut poser problème en termes de détection des antigènes viraux par les TDR. Toutefois, ces tests ciblent généralement des antigènes internes spécifiques de type, beaucoup plus stables que les antigènes d’enveloppe. Il a toutefois été montré que la sensibilité des tests était variable selon les types et sous-types de virus de la grippe [4] et il est extrêmement important que la performance de ces tests soit évaluée de manière approfondie lors de l’émergence de nouveaux sous-types. Le Centre national de référence des virus Influenza à Lyon a entrepris une étude comparative des différentes trousses disponibles en analysant la détection de dilutions successives de 4 souches de virus : 1 souche A H1N1, une souche AH3N2 et 2 souches de grippe B. Le rapport final de cette étude [5] montre que les 2 tests avec dispositif de lecture [Sofia Influenza A+B IFA (Quidel/Ingen) et BD Veritor Flu A+B (Becton Dickinson)] sont les plus sensibles. Parmi les tests à lecture visuelle, la sensibilité des tests était très variable selon les trousses. Ce sont les tests Espline Influenza A&B-N (Fujirebio) et BD Directigen EZ Flu A+B qui se sont révélés les plus sensibles. La praticabilité des différentes trousses a également été évaluée dans ce rapport.
• Indications des TDR de la grippe
En raison de la sensibilité relativement faible des tests, les TDR de la grippe ne peuvent être recommandés comme un test de diagnostic mais ils représentent un atout dans la surveillance épidémiologique et le dépistage de l’infection dans certaines conditions.
Il est à noter que d’après l’arrêté du 11 juin 2013, les TDR grippe font partie des tests qui peuvent être réalisés « par un médecin, ou sous sa responsabilité par un autre professionnel de santé, ou par des pharmaciens d’officine dans un espace de confidentialité ».
Sur le plan épidémiologique, des TDR de la grippe sont réalisés en particulier par les médecins sentinelles des réseaux de surveillance de la grippe.
En ce qui concerne le dépistage des infections grippales, la réalisation de TDR est préconisée dans les établissements d’hébergement des personnes âgées dépendantes (EHPAD). Ces tests doivent être réalisés chez au moins 3 patients, idéalement 24 à 48 heures après l’apparition des symptômes. Un seul test positif permet de confirmer la circulation du virus dans l’établissement et de prendre les mesures préventives et curatives qui s’imposent [6]. Toutefois, la négativité des TDR dans ce contexte ne permet pas d’exclure le diagnostic car leur sensibilité est d’autant plus faible que les sujets sont âgés [7].
En ce qui concerne le dépistage de la grippe, les TDR présentent l’intérêt de leur rapidité et d’une bonne spécificité. En cas de positivité, le sujet peut être considéré comme infecté et orienté en conséquence. Les TDR grippe peuvent donc être utilisés dans les « points of care », les services d’urgence, de pédiatrie, de réanimation etc. [8]. Il importe cependant que les patients négatifs soient contrôlés en deuxième intention par un test moléculaire beaucoup plus sensible.
3.1.2. Infections à virus respiratoire syncytial
3.1.2.1. Contexte épidémiologique et clinique
Le virus respiratoire syncytial (VRS) est un virus responsable d’infections respiratoires sévères chez le nourrisson. C’est l’agent le plus fréquemment responsable des bronchiolites du nourrisson. Il existe deux types, A et B, de VRS qui présentent le même pouvoir pathogène.
Les infections à VRS sévissent chaque année sous forme épidémique pendant la saison hivernale, avec un pic généralement observé en décembre ou janvier. Ces épidémies sont d’intensité sensiblement comparable d’une année sur l’autre. On estime qu’environ 50% des nourrissons sont infectés par le VRS au cours de leur première année de vie et que pratiquement tous les enfants ont été en contact avec le VRS à l’âge de 2 ans. La première infection à VRS chez le nourrisson entraîne une atteinte respiratoire basse (bronchiolite, pneumonie) dans environ 40% des cas. Une hospitalisation est nécessaire dans 1 à 2% des cas et la majorité des enfants hospitalisés ont moins de 6 mois. Il existe un risque de mortalité chez les enfants immunodéprimés ou porteurs d’une cardiopathie ou d’une maladie pulmonaire sous-jacente. Les infections à VRS du nourrisson peuvent avoir un retentissement à long terme avec le développement d’un asthme ou la persistance d’anomalies respiratoires.
Les réinfections à VRS sont fréquentes chez l’enfant et l’adulte et sont en règle générale moins sévères, sous forme de rhinites ou de trachéo-bronchites. Des infections sévères sont toutefois observées chez les sujets âgés ou immunodéprimés.
Le VRS étant très contagieux, il existe un risque élevé d’infection nosocomiale dans les services de pédiatrie. Il y a donc un intérêt évident à dépister rapidement les enfants infectés.
3.1.2.2. Infections à VRS et TDR
• Tests disponibles et performances.
De nombreuses trousses basées sur l’immunochromatographie existent sur le marché ( tableau II ). Il s’agit souvent des mêmes fabricants que pour les TDR grippe et la présentation des trousses est le plus souvent identique. La sensibilité et la spécificité de ces tests annoncées par les fabricants sont souvent élevées, mais il s’agit généralement de comparaisons par rapport à la culture et les résultats, surtout en ce qui concerne la sensibilité, sont moins favorables lorsque la comparaison est effectuée par rapport à la PCR. Dans ce cas des sensibilités allant de 50 à 85% ont été rapportées [9]. Comme pour les virus de la grippe, la sensibilité diminue avec l’âge des patients et une sensibilité de 80% avec une spécificité de 97% par rapport à la PCR ont été rapportées chez les enfants de moins de 3 ans. La sensibilité varie aussi selon la durée d’évolution des symptômes et peut être impactée par le type (A ou B) de VRS en cause [10].
Tableau II.
TDR VRS (liste non exhaustive).
| Désignation du test | Fabricant/Distributeur |
|---|---|
| Actim RSV | Medix Biochemica/Fumouze |
| BD Directigen EZ RSV | Bection Dickinson |
| Binax Now RSV | Alere |
| VRSTOP Optima | All.Diag |
| CerTest RSV + Adenovirus Resp. | CerTest Biotec |
| Clearview RSV | Alere |
| Rapidiag VRS | Theradiag |
| Rapid VRS | DiaMondial/Eurobio |
| RSV K-Set | Coris Bioconcept/Eurobio |
| VRS color | Servibio |
| Nadal RSV | Nal von Minden |
| Nadal RSV-Adenovirus Respiratory | Nal von Minden |
| QuickVue RSV | Quidel/Ingen |
| Tru RSV | Meridian |
• Indication des TDR VRS
Le VRS étant essentiellement pathogène pour le nourrisson, c’est dans cette population que les TDR trouvent leur utilité, d’autant plus que c’est la tranche d’âge pour laquelle ces tests présentent la meilleure sensibilité.
De par leur bonne spécificité, les TDR, en cas de positivité, permettent d’identifier rapidement avec une forte probabilité les enfants infectés, ce qui permet d’optimiser leur prise en charge et d’éviter des traitements antibiotiques inutiles. C’est donc essentiellement dans les services de pédiatrie et les « points of care » que ces tests trouvent leur plus grande utilité. Il faut toutefois garder à l’esprit que leur sensibilité restant modérée, un TDR négatif ne peut en aucun cas exclure le diagnostic d’infection à VRS.
Il est à souligner que, contrairement aux TDR grippe, les TDR VRS ne sont pas concernés par l’arrêté du 11 juin 2013. De ce fait, leur utilisation diagnostique doit être faite sous le contrôle d’un biologiste.
3.1.3. Infections respiratoires à adénovirus
Les adénovirus humains comportent plus de 50 types subdivisés en 6 sous-groupes présentant des pouvoirs pathogènes différents. Ce sont essentiellement les adénovirus des sous-groupes B (en particulier les types 3, 7, 14, 16, 21) et C (types 1, 2, 5, 6) qui sont impliqués dans les infections respiratoires. Des pneumonies virales sévères à adénovirus peuvent être observées chez l’enfant, ces formes sévères sont surtout associées au type 7.
Les tests immunochromatographiques disponibles pour la détection des adénovirus dans les infections respiratoires sont peu nombreux, on peut citer le test Adeno Respi Color (Servibio) et les tests combinés VRS/Adénovirus ( tableau II).
La littérature, peu abondante, sur ces tests paraît indiquer des sensibilités et spécificités variables selon les techniques utilisées comparativement [11, 12]. Comme pour les TDR grippe et VRS, un test négatif ne peut exclure une infection respiratoire à adénovirus.
3.1.4. Autres virus respiratoires
À notre connaissance, il n’y a pas actuellement de TDR disponibles pour les autres virus respiratoires. Un diagnostic rapide peut être réalisé par immunofluorescence à l’aide d’anticorps monoclonaux commercialement disponibles pour les virus parainfluenzae et le metapneumovirus.
Pour la détection des autres virus respiratoires tels que les rhinovirus, coronavirus ou bocavirus, seuls les tests moléculaires permettent de faire le diagnostic virologique en pratique courante.
4. TDR et gastroentérites virales
4.1. Gastroentérites virales
4.1.1. Virus responsables
Les gastroentérites, sévissant souvent sous un mode épidémique, sont dans plus des deux tiers des cas d’origine virale. Les gastroentérites virales sont des affections fréquentes touchant principalement les nourrissons et jeunes enfants. Elles sont le plus souvent bénignes mais il existe des formes sévères et un risque de mortalité lié à la déshydratation du nourrisson. On estime que dans le monde, environ 500 000 nourrissons et jeunes enfants meurent chaque année de ces gastroentérites virales, essentiellement dans les pays à bas niveau socio-économique [13]. Dans les pays à haut niveau socio-économique, la mortalité infantile liée à ces infections est une éventualité beaucoup plus rare. On estime qu’en France, le nombre de ces décès est compris entre 50 et 100 par an et les gastroentérites infantiles représentent une cause fréquente d’hospitalisation des enfants.
Les virus les plus fréquemment en causes sont de loin les rotavirus (famille des Reoviridae) qui représentent environ les trois quarts des cas de gastroentérites infantiles [14] ( figure 2 ). Ce sont presque exclusivement les rotavirus du groupe A qui sont en cause. Les infections à rotavirus touchent virtuellement tous les enfants avant l’âge de 3 ans. Ces gastroentérites peuvent être sévères et les rotavirus sont la cause essentielle des hospitalisations des enfants pour gastroentérite et ils sont à l’origine de la majeure partie des décès du nourrisson par déshydration. Les infections à rotavirus sévissent sur un mode saisonnier avec un pic hivernal généralement observé en janvier-février.
Figure 2.
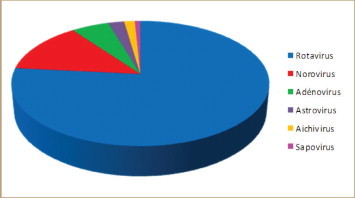
Distribution des virus de gastroentérites.D’après Lorrot, et al. [14].
Les norovirus (famille des Caliciviridae) sont une cause fréquente de gastroentérite. Les norovirus sont subdivisés en 5 génogroupes eux-mêmes subdivisés en génotypes. Ce sont les génogroupes I et II qui sont à l’origine de la majorité des cas de gastroentérites. Contrairement aux rotavirus qui touchent presque exclusivement les jeunes enfants, les norovirus affectent toutes les classes d’âge et ce sont eux qui sont responsables des épidémies de gastroentérites survenant à intervalles plus ou moins réguliers dans la population. Les norovirus représentent la deuxième cause de gastroentérites infantiles et sont responsables d’environ 15% des cas ( figure 2). Ce sont des gastroentérites le plus souvent bénignes, moins sévères en règle générale que celles dues aux rotavirus. Les sapovirus, qui appartiennent également à la famille des Caliciviridae, sont bien moins fréquents que les norovirus.
Les adénovirus représentent environ 5% des gastroentérites virales infantiles ( figure 2). Ce sont les types 40 et 41 qui sont en cause. Les gastroentérites à adénovirus sévissent sur un mode sporadique sans distribution saisonnière marquée. Ce sont des formes généralement moins sévères que les gastroentérites à rotavirus.
Les astrovirus (famille des Astroviridae) sont également associés, dans moins de 5% des cas à des gastroentérites infantiles. Il s’agit de formes habituellement bénignes. Les Aichivirus (famille des Picornaviridae) sont retrouvés avec une incidence faible dans les gastroentérites.
Les entérovirus, parechovirus et bocavirus peuvent être assez fréquemment retrouvés dans les selles mais ils ne semblent pas être responsables de la survenue de gastroentérites.
4.2. TDR dans les gastroentérites virales
4.2.1. Tests disponibles
De nombreux tests sont disponibles pour la détection des rotavirus et des adénovirus, qui sont généralement proposés sous forme de tests combinés. Des TDR sont également proposés par certains fabricants pour la détection des norovirus et des astrovirus ( tableau III ).
Tableau III.
TDR Rotavirus, Adénovirus, Norovirus, Astrovirus (liste non exhaustive).
| Désignation du test | Fabricant/Distributeur |
|---|---|
| Rotavirus + Adénovirus* | |
| Adeno-Rota color | Servibio |
| Biorapid Rota/adeno | Biokit |
| CerTtest Rota-Adeno duo antigen | CerTest/Théradiag |
| Combi-Strip | Coris Bioconcept |
| Combo Rota/Adeno | All.Diag |
| Easy RotaAdeno | Fumouze |
| Nadal Rota-Adenovirus | Nal von Minden |
| Rapid Rota-Adenovirus | DiaMondial/Eurobio |
| Rapids trip Rota/Adeno | Meridian |
| RidaQuick Rotavirus/Adenovirus Combi | R-biopharm |
| SD bioline Rota/Adeno Ag rapid kit | Alere |
| Vikia Rota-Adeno kit | bioMérieux |
| Norovirus | |
| Actim Noro | Medix Biochemica/Fumouze |
| CerTest Norovirus GI-GII | CertTest/Theradiag |
| Nadal Norovirus | Nal von Minden |
| Norocolor | Servibio |
| Ridaquick Norovirus | R-Biopharm |
| SD Bioline Norovirus Ag Test | Alere |
| Astrovirus | |
| Adeno-Rota-Astrovirus Color | Servibio |
| CerTest Astrovirus | CerTest/Theradiag |
| Nadal Astrovirus | Nal von Minden |
Les fabricants de tests combinés Rotavirus/Adenovirus proposent aussi le plus souvent les tests Rotavirus et Adénovirus sous forme séparée.
De manière générale, des échantillons de contrôle positifs et négatifs ne sont pas inclus dans les trousses mais sont disponibles auprès de certains fournisseurs. Il est important d’utiliser des échantillons de contrôle, au minimum à chaque changement de lot, pour valider les résultats fournis par les trousses.
4.2.2. Performances
Il n’existe pas à notre connaissance d’études évaluant l’ensemble des trousses disponibles. Les valeurs de sensibilité et spécificité indiquées par chaque fabricant sont difficilement comparables entre elles, les études réalisées n’étant pas homogènes en termes de techniques de référence (ELISA ou PCR), d’effectifs ou de populations prises en compte pour les études. Une étude réalisée par le Centre national de référence des virus entériques en 2007, comparant 7 tests d’immunochromatographie pour la détection des rotavirus par rapport à une technique ELISA, avait rapporté des sensibilités de 70% à 98,8% selon les trousses et une spécificité de 100% pour toutes les trousses évaluées [15]. Il est toutefois à signaler qu’une de ces trousses ayant montré des valeurs élevées de sensibilité et de spécificité a montré dans une étude australienne un taux très élevé de faux-positifs [16]. D’autres études ont montré que par rapport à des techniques de biologie moléculaire, les TDR présentaient une sensibilité élevée pour la détection des rotavirus et astrovirus et une sensibilité réduite pour la détection des adénovirus et des norovirus [17, 18]. Pour le test Ridaquick Norovirus, qui est internationalement disponible, différentes études ont montré une sensibilité de 60-70% et une spécificité de 95-100% par rapport à la PCR [17, [19], [20], [21].
Il ressort des différentes études que les TDR utilisables pour le diagnostic des gastro-entérites ont une bonne spécificité et que la sensibilité est variable mais souvent élevée pour la détection des rotavirus.
4.2.3. Indications
Ces tests sont indiqués dans les cas de gastro-entérites aiguës. L’indication principale est la gastro-entérite du nourrisson. Ces tests sont pratiqués essentiellement devant les formes sévères faisant l’objet d’une hospitalisation. Dans le cas des gastro-entérites à rotavirus, les TDR présentent des performances souvent proches des tests moléculaires en termes de sensibilité et spécificité, on peut donc considérer ces TDR comme des tests de diagnostic et ils sont très répandus dans les laboratoires. Ces tests sont également adaptés à l’utilisation en « point of care ». Il convient toutefois de préciser qu’ils ne font pas partie de la liste des tests retenus dans l’arrêté du 11 juin 2013 et à ce titre, ne peuvent être utilisés que sous la responsabilité d’un biologiste.
Dans les infections à adénovirus, norovirus et astrovirus, les TDR présentent l’intérêt d’une bonne spécificité mais, en raison d’une sensibilité plus faible, un test négatif ne peut éliminer le diagnostic.
5. Conclusion
Les TDR présentent un certain nombre d’avantages : ils sont rapides, ne nécessitent pas de matériel spécifique ni de compétences techniques particulières. Ils sont donc facilement réalisables en dehors d’un laboratoire. Leur bonne spécificité permet d’identifier rapidement et de prendre en charge les patients infectés en évitant, en cas de positivité, des traitements antibiotiques inutiles. En revanche, leur sensibilité généralement réduite par rapport aux tests de référence moléculaires en fait des tests de criblage plutôt que de véritables tests de diagnostic.
Bien que de réalisation technique très simple, ces tests doivent être exécutés de manière irréprochable pour donner un résultat satisfaisant. Les modes opératoires doivent donc être rigoureusement observés. Cela est particulièrement important lorsque ces tests sont pratiqués par du personnel médical ou soignant en dehors des laboratoires. Des erreurs de manipulation ou de lecture peuvent conduire à de faux positifs ou faux négatifs. Il est donc indispensable que les personnes réalisant ces tests bénéficient d’une formation conduisant à une habilitation et que les résultats fournis par les trousses soient validés par des contrôles de qualité.
Déclaration d’intérêts
l’auteur déclare ne pas avoir de conflits d’intérêts en relation avec cet article.1. Zone de dépôt de l’échantillon. 2. Anticorps anti-antigène viral marqué (non fixé sur le support). 3. Anticorps de capture de l’antigène viral (fixé sur le support). 4. Anticorps de capture des anticorps marqué (contrôle).
Références
- 1.Rath B., Tief F., Obermeier P. Early detection of influenza A and B infection in infants and children using conventional and fluorescence-based rapid testing. J Clin Virol. 2012;55:329–333. doi: 10.1016/j.jcv.2012.08.002. [DOI] [PubMed] [Google Scholar]
- 2.Dunn J., Obuekwe J., Baun T. Prompt detection of Influenza A and B viruses using the BD Veritor System Flu A+B Quidel Sofia Influenza A+B FIA, and Alere BinaxNow Influenza A&B compared to real-time reverse transcription-polymerase chain reaction (RT-PCR) Diagn Microbiol Infect Dis. 2014;79:10–13. doi: 10.1016/j.diagmicrobio.2014.01.018. [DOI] [PubMed] [Google Scholar]
- 3.Chartrand C., Leeflang M.M., Minion J. Accuracy of rapid influenza diagnostic tests: a meta-analysis. Ann Intern Med. 2012;156(7):500–511. doi: 10.7326/0003-4819-156-7-201204030-00403. [DOI] [PubMed] [Google Scholar]
- 4.Taylor J., McPhie K., Druce J. Evaluation of twenty rapid antigen tests for the detection of human influenza A H5N1, H3N2 H1N1, and B viruses. J Med Virol. 2009;81:1918–1922. doi: 10.1002/jmv.21604. [DOI] [PubMed] [Google Scholar]
- 5.Bouscambert M. Rapport final d’évaluation des tests rapides d’orientation diagnostique TROD des virus influenza A et B. 3 octobre 2014. http://www.sante.gouv/IMG/pdf/Rapport_TROD_grippe_CNR.pdf.
- 6.Haut Conseil de la Santé, Publique., Rapport : Conduite à tenir devant une ou plusieurs infections respiratoires aiguës dans les collectivités de personnes, âgées., Juillet 2012
- 7.Steininger C., Redlberger M., Graninger W. Near-patient assays for diagnosis of influenza virus infection in adult patients. Clin Microbiol Infect. 2009;15(3):267–273. doi: 10.1111/j.1469-0691.2008.02674.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Nougairède A., Ninove L., Zandotti C. Point of care strategy for rapid diagnosis of novel A/H1N1 influenza virus. PLoS One. 2010;5(2):e9215. doi: 10.1371/journal.pone.0009215. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 9.Principi N., Esposito S. Antigen-based assays for the identification of influenza virus and respiratory syncytial virus: why and how to use them in pediatric practice. Clin Lab Med. 2009;29:649–660. doi: 10.1016/j.cll.2009.07.006. [DOI] [PubMed] [Google Scholar]
- 10.Papenbourg J., Buckeridge D.L., De Serres G. Host and viral factors affecting clinical performance of a rapid diagnostic test for respiratory syncytial virus in hospitalized children. J Pediatr. 2013;163:911–913. doi: 10.1016/j.jpeds.2013.03.067. [DOI] [PubMed] [Google Scholar]
- 11.Fujimoto T., Okafuji T., Ito M. Evaluation of a bedside immunochromatographic test for detection of adenovirus in respiratory samples by comparison to virus isolation PCR, and real-time PCR. J Clin Microbiol. 2004;42:5489–5492. doi: 10.1128/JCM.42.12.5489-5492.2004. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 12.Romero-Gomez M.P., Lopez R., Gonzalez-Montes R. Immunochromatographic test for detection of adenovirus from respiratory samples: is it a real solution for pediatric emergency department? J Virol Methods. 2014;195:236–239. doi: 10.1016/j.jviromet.2013.09.002. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Parashar U.D., Hummelman E.G., Bresee J.S. Global illness and deaths caused by rotavirus diseases in children. Emerg Infect Dis. 2003;9:565–572. doi: 10.3201/eid0905.020562. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 14.Lorrot M., Bon F., El Hajje M.J. Epidemiology and clinical features of gastroenteritis in hospitalised children: prospective survey during a 2-year period in a Parisian hospital. France. Eur J Microbiol Infect Dis. 2011;30:361–368. doi: 10.1007/s10096-010-1094-9. [DOI] [PubMed] [Google Scholar]
- 15.Bon F., Kaplon J., Metzger M.H. Evaluation de sept réactifs d’immunochromatographie pour détecter les rotavirus humains dans les selles. Pathol Biol. 2007;55:149–153. doi: 10.1016/j.patbio.2006.07.044. [DOI] [PubMed] [Google Scholar]
- 16.Ye S., Roczo-Farkas S., Whiley D.M. Evidence of false-positive results in a commercially available rotavirus assay in the vaccine era Australia, 2011 to 2012. Euro Surveill. 2013;18:20483. [PubMed] [Google Scholar]
- 17.Rovida R., Campanini G., Sarasini A. Comparison of immunologic and molecular assays for the diagnosis of gastrointestinal viral infections. Diagn Microbiol Infect Dis. 2013;75:110–111. doi: 10.1016/j.diagmicrobio.2012.09.016. [DOI] [PubMed] [Google Scholar]
- 18.Bruggink L.D., Catton M.G., Marshall J.A. Evaluation of the Bioline Standard Diagnostics SD immunochromatographic norovirus detection kit using fecal specimens for Australian gastroenteritis incidents. Diagn Microbiol Infect Dis. 2013;76:147–152. doi: 10.1016/j.diagmicrobio.2013.02.018. [DOI] [PubMed] [Google Scholar]
- 19.Battaglioli G., Nazarian E.J., Lamson D. Evaluation of the RIDAQuick norovirus immunochromatographic test kit. J Clin Virol. 2012;53:262–264. doi: 10.1016/j.jcv.2011.12.007. [DOI] [PubMed] [Google Scholar]
- 20.Geginat G., Kaiser D., Schrempf S. Evaluation of third-generation ELISA and a rapid immunochromatographic assay for the detection of norovirus infection in fecal samples from inpatients of a German tertiary care hospital. Eur J Clin Microbiol Infect Dis. 2012;31:733–737. doi: 10.1007/s10096-011-1366-z. [DOI] [PubMed] [Google Scholar]
- 21.Kirby A., Gurgel R.Q., Dove W. An evaluation of the RIDASCREEN and IDEIA enzyme immunoassays and the RIDAQUICK immunochromatographic test for the detection of norovirus in faecal specimens. J Clin Virol. 2010;49:254–257. doi: 10.1016/j.jcv.2010.08.004. [DOI] [PubMed] [Google Scholar]


