Résumé
La protéine HMGB1 (high mobility group box 1) a été originalement identifiée comme une protéine nucléaire capable de se fixer à l’ADN. Elle est considérée comme un facteur architectural de la chromatine. Des travaux récents ont pu montrer qu’HMGB1 pouvait être également présente dans le milieu extracellulaire et ont permis de caractériser les processus cellulaires qui conduisent à la libération de la protéine. HMGB1 peut se retrouver dans le milieu extracellulaire de deux façons : (1) lors d’une sécrétion active par les cellules de l’inflammation ; (2) lors d’une libération passive et rapide lorsque les cellules meurent par nécrose. Dans ces conditions, la protéine HMGB1 est capable d’agir comme un médiateur soluble impliqué dans la coordination de divers mécanismes cellulaires. HMGB1 joue un rôle crucial dans l’amplification de la réponse inflammatoire, dans l’établissement de la réponse immunitaire et dans la réparation tissulaire. Cependant, la protéine HMGB1 dans le milieu extracellulaire serait également capable d’agir comme une cytokine pro-inflammatoire et contribuerait ainsi à la pathogenèse de différentes maladies qu’elles soient d’origine inflammatoire ou infectieuse.
Keywords: HMGB1, inflammation, mort cellulaire, cytokine, réponse immunitaire, DAMP
Summary
HMGB1 (High Mobility group box 1) protein was originally identified as a DNA-binding protein that functions as a structural co-factor. Recent works demonstrated that HMGB1 can be released outside the cell, upon immune activation or primary cell necrosis. In the extracellular space, HMGB1 acts as a potent soluble factor that coordinates cellular events that are crucial for the amplification of inflammation, establishment of early immune responses and tissue repair. However, extracellular HMGB1 also acts as a potent pro-inflammatory cytokine that contributes to the pathogenesis of diverse inflammatory and infectious disorders.
Keywords: HMGB1, inflammation, cellular death, cytokine, immune response, DAMP
1. Introduction
Les agents microbiens (bactéries, parasites ou virus) interagissent avec le système immunitaire par l’intermédiaire de récepteurs appartenant à la famille des TLR (toll like receptors). Ceux-ci reconnaissent, comme signaux de danger, des motifs moléculaires issus des microorganismes et désignés sous le nom de PAMPs (pathogen associated molecular patterns). L’activation des TLR induit la production de médiateurs solubles de l’inflammation, comme les cytokines, qui interviennent dans la régulation de la réponse immunitaire. Cependant, une réaction inflammatoire peut également être provoquée par des agressions tissulaires non infectieuses, dites aseptiques. Divers stress chimiques, mécaniques ou biologiques induisent invariablement la libération de facteurs cellulaires dont certains peuvent activer le processus inflammatoire et fonctionner comme autant de signaux de danger. Cette observation a conduit à proposer, dès 2006, une nouvelle catégorie de médiateurs solubles : les alarmines. Selon les définitions actuelles, les alarmines ou DAMPs (damage associated molecular patterns) constitueraient l’équivalent cellulaire des PAMPs [1] ( figure 1 ). Il n’y a cependant pas encore de consensus sémantique, certains proposant de considérer les alarmines (signaux aseptiques) et les PAMPs (signaux septiques) comme deux catégories des DAMPs (signaux de dangers au sens large). Les caractéristiques des alarmines ne sont pas non plus clairement définies : il s’agirait le plus souvent de molécules qui peuvent être sécrétées (notamment par les cellules de l’immunité) en réponse à des cytokines pro-inflammatoires, ou libérées passivement par les cellules nécrotiques, dont elles signaleraient la présence. Cette catégorie comprend actuellement certaines cytokines comme l’interleukine IL-1β et dans une certaine mesure l’IL-33, des protéines de choc thermique, les défensines ou bien encore l’acide urique. La molécule qui s’inscrit le mieux dans cette définition et qui constitue, à ce titre, le chef de file des alarmines est la protéine HMGB1 (high mobility group box-1), une protéine dont le statut n’a cessé de changer depuis sa découverte, dans les années 70. La reconnaissance de cette nouvelle catégorie de médiateurs solubles constitue une véritable révolution dans notre vision de la biologie, puisqu’elle souligne la pluri-fonctionnalité de facteurs dont la fonction n’était connue à ce jour que dans un seul compartiment biologique.
Figure 1.
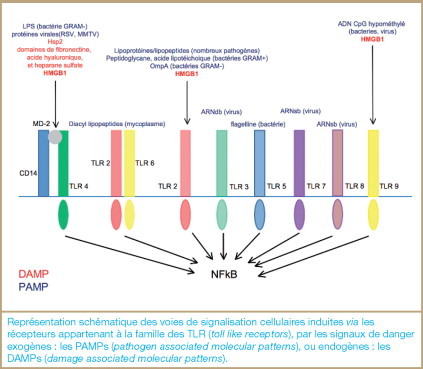
DAMPs, PAMPs et TLRs.
Représentation schématique des voies de signalisation cellulaires induites via les récepteurs appartenant à la famille des TLR (toll like receptors), par les signaux de danger exogènes: les PAMPs (pathogen associated molecular patterns), ou endogènes : les DAMPs (damage associated molecular patterns).
2. HMGB1 : un facteur architectural de la chromatine
Les protéines HMG constituent le principal groupe de protéines non-histones associées à la chromatine. Elles ont été initialement identifiées, en 1973, par H.M. Goodwin comme des composants majeurs de la chromatine, présentant une forte mobilité sur gel d’électrophorèse. La superfamille des protéines HMG comprend trois groupes : HMGA, HMGB et HMGN. Toutes les protéines de cette superfamille, dont le poids moléculaire est compris entre 25 et 30kDa, présentent des domaines de liaison à l’ADN, ou boîtes HMG. La protéine HMGB1 appartient, avec HMGB2 et HMGB3, à la sous-famille HMGB ; elle est ubiquitaire et exprimée à des niveaux particulièrement élevés (106 molécules/cellule). La conservation remarquable de cette protéine au cours de l’évolution et le caractère létal de son extinction chez les souris KO (knock-out) en soulignent le caractère essentiel. La structure d’HMGB1 s’organise autour de trois principaux domaines : deux domaines de liaison à l’ADN (boîtes A et B) et une extrémité C-terminale constituée d’acides aminés acides (boîte C). Deux domaines de localisation nucléaires (NLS1 et NLS2) contrôlent sa translocation nucléaire, et deux clusters de lysines, qui peuvent être ou non acétylés, contrôleraient sa sécrétion ( figure 2 ). HMGB1 s’associe de façon très labile à l’ADN de forme B et manifeste une affinité plus importante pour des structures courbes de l’ADN (hémicaténanes, ADN cruciforme) sans spécificité de séquence. Dans le noyau, HMGB1 interagirait avec les histones et modifierait la topologie et/ou l’accessibilité de certaines régions de l’ADN. Ceci permettrait de faciliter la fixation de facteurs de transcription, de réplication ou de recombinaison. Si HMGB1 peut établir des interactions de forte affinité avec l’ADN cis-platiné ou, pour des raisons différentes, avec la chromatine des cellules apoptotiques, elle est en revanche excessivement mobile dans le noyau et peut également transiter entre le noyau et le cytoplasme.
Figure 2.
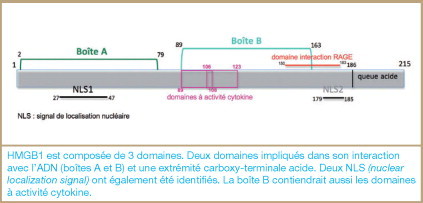
Régions structurales et fonctionnelles de la protéine HMGB1.
HMGB1 est composée de 3 domaines. Deux domaines impliqués dans son interaction avec l’ADN (boîtes A et B) et une extrémité carboxy-terminale acide. Deux NLS (nuclear localization signal) ont également été identifiés. La boîte B contiendrait aussi les domaines à activité cytokine.
3. HMGB1 : un puissant médiateur soluble
H. Rauvala et ses collaborateurs sont les premiers à avoir établi la capacité de la protéine HMGB1 à interagir avec l’héparine et les héparanes sulfates, et à agir hors de la cellule [2]. Leurs observations, qui portaient sur la capacité d’HMGB1 à stimuler la croissance des neurites, ont cependant été minorées par la découverte du rôle d’HMGB1 dans une pathologie de premier plan : le choc septique. Ce sont en effet les travaux menés par le groupe de K.J. Tracey qui ont démontré que les formes extracellulaires d’HMGB1 participent au choc septique en tant que cytokines pro-inflammatoires [3]. Le choc septique est un état grave qui résulte de l’activation anormalement élevée de la réponse inflammatoire, le plus souvent lié à la libération massive de lipopolysaccharide bactérien (LPS) dans le sang. Le LPS stimule la production de cytokines pro-inflammatoires précoces, IL1β (interleukine 1β) et TNFα (tumor necrosis factor), notamment par les macrophages. Ces médiateurs contribueraient secondairement à mettre en place une boucle d’activation autocrine qui provoquerait l’accumulation de cytokines pro-inflammatoires. Plus tardivement, l’activité du LPS et/ou des cytokines précoces induirait la sécrétion d’HMGB1. Cette dernière agirait comme un relai des cytokines exprimées précocement, et amplifierait la réponse inflammatoire en induisant notamment en retour la sécrétion de l’IL-1β et du TNFα. La contribution tardive d’HMGB1 au choc septique est démontrée notamment par l’amélioration de l’état général observé après administration d’anticorps neutralisants la protéine HMGB1 ou de molécules bloquant sa sécrétion, comme l’éthyl-pyruvate, dans des modèles expérimentaux murins [4].
4. HMGB1 dans le milieu extracellulaire
Le rôle de médiateur de l’inflammation décrit depuis une dizaine d’années pour la protéine HMGB1 nécessite que celle-ci se retrouve dans le milieu extracellulaire. Ce sont les travaux de M. Bianchi [5] qui ont permis de caractériser les processus cellulaires qui conduisent à la libération de la protéine HMGB1.
HMGB1 peut se retrouver dans le milieu extracellulaire de deux façons : (1) lors d’une sécrétion active par les cellules de l’inflammation ; (2) lors d’une libération passive et rapide lorsque les cellules meurent par nécrose ( figure 3 ). Ces deux propriétés font partie des critères majeurs retenus pour la classification d’HMGB1 en tant qu’alarmine.
Figure 3.
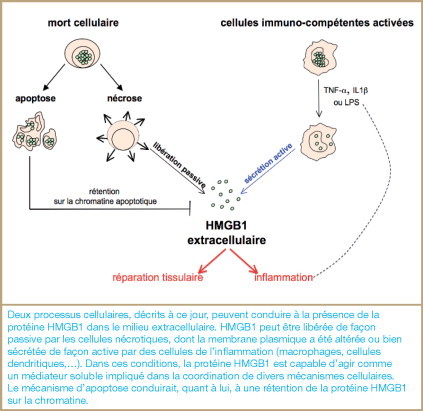
Origines de la protéine HMGB1 extracellulaire.
Deux processus cellulaires, décrits à ce jour, peuvent conduire à la présence de la protéine HMGB1 dans le milieu extracellulaire. HMGB1 peut être libérée de façon passive par les cellules nécrotiques, dont la membrane plasmique a été altérée ou bien sécrétée de façon active par des cellules de l’inflammation (macrophages, cellules dendritiques,…). Dans ces conditions, la protéine HMGB1 est capable d’agir comme un médiateur soluble impliqué dans la coordination de divers mécanismes cellulaires. Le mécanisme d’apoptose conduirait, quant à lui, à une rétention de la protéine HMGB1 sur la chromatine.
4.1. Sécrétion active par les cellules de l’inflammation
Plusieurs stimuli pro-inflammatoires (TNFα, IL-1β, LPS,…) peuvent induire la sécrétion de la protéine HMGB1 par différentes cellules du système immunitaire telles que les macrophages et les monocytes, les cellules dendritiques, les cellules NK (natural killer) et les pituicytes ( figure 3 ). Par rapport aux autres médiateurs de l’inflammation précédemment décrits, comme le TNFα ou l’IL-1β, HMGB1 est considérée comme un médiateur tardif, puisque sa libération se fait 16 à 24 h après stimulation.
Les seuls travaux référencés à ce jour concernant la voie de sécrétion de la protéine HMGB1 tendent à montrer que celle-ci n’emprunterait pas la voie classique (réticulum endoplasmique -> appareil de Golgi). La sécrétion d’HMGB1 serait, en effet, dépendante d’une acétylation de deux groupes de résidus lysine. Cette hyperacétylation de la protéine HMGB1 bloquerait ainsi le transport nucléocytoplasmique de la protéine, qui s’accumulerait alors au sein du cytoplasme dans des vésicules lysosomiales [6]. Les mécanismes qui contrôlent l’acétylation d’HMGB1 ne sont pas encore connus, mais une inhibition des déacétylases pourrait être impliquée. D’autres modifications post-traductionnelles, comme la phosphorylation, pourraient également intervenir dans la séquestration cytoplasmique de la protéine HMGB1.
4.2. Libération passive par les cellules nécrotiques
L’équipe de M. Bianchi a été la première à montrer qu’il existait un lien entre la mort cellulaire et la libération d’HMGB1. Il a été établi, dans un premier temps, que la protéine HMGB1 pouvait être libérée passivement, lorsque les membranes plasmiques étaient lésées, notamment par les cellules nécrotiques. Dans ces cellules, l’interaction de la protéine HMGB1 avec la chromatine est faible. La protéine est alors rapidement libérée dans le milieu extracellulaire où elle stimule diverses réponses pro-inflammatoires. L’hypoacétylation de la chromatine, qui accompagne l’apoptose, induit au contraire une rétention stable d’HMGB1 dans le noyau ; ainsi séquestrée, HMGB1 ne peut sortir de la cellule même si les membranes sont perméables et, de fait, elle ne pourra exercer son activité pro-inflammatoire [5]. La libération d’HMGB1 dépend donc en partie de la forme que revêt la mort cellulaire. Ce mécanisme explique pourquoi l’apoptose est généralement silencieuse, alors que la nécrose est un facteur d’induction de l‘inflammation ( figure 3 ).
Certaines formes d’apoptose semblent néanmoins permettre la libération d’HMGB1, comme l’ont démontré plusieurs travaux récents. Cependant l’HMGB1 libérée dans ces conditions ne semble pas compétente pour activer ses cellules cibles. Cette tolérance apparente pourrait être expliquée par la libération de formes réactives de l’oxygène (ROS) par la mitochondrie [7]. En effet, les ROS pourraient oxyder les cystéines de la protéine HMGB1, qui perdrait alors son pouvoir « immunostimulant ».
5. HMGB1 : ses récepteurs cellulaires et les voies de transduction du signal
L’activité extracellulaire d’HMGB1 est modulée par plusieurs récepteurs : les TLR-2 et -4, et le récepteur RAGE (receptor for advanced glycation end-products) ( figure 4 ).
Figure 4.
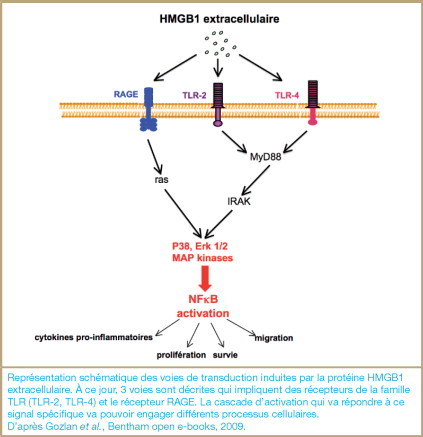
Voies de transduction du signal induites par HMGB1.
Représentation schématique des voies de transduction induites par la protéine HMGB1 extracellulaire. À ce jour, 3 voies sont décrites qui impliquent des récepteurs de la famille TLR (TLR-2, TLR-4) et le récepteur RAGE. La cascade d’activation qui va répondre à ce signal spécifique va pouvoir engager différents processus cellulaires.
D’après Gozlan et al., Bentham open e-books, 2009.
5.1. Les récepteurs TLR-2 et -4
Les TLRs appartiennent à la grande famille des PRRs (pattern recognition receptors). Ce sont des protéines transmembranaires possédant un domaine extracellulaire composé de répétitions riches en leucine. Ils sont impliqués dans la reconnaissance de composants microbiens et dans la morphogenèse. La voie de signalisation impliquant les TLRs aboutit à l’activation de la protéine NF-κB, qui est impliquée dans de nombreux processus cellulaires comme la prolifération, l’apoptose ou la réponse inflammatoire. HMGB1 pourrait interagir avec TLR-2 et -4, et ces interactions seraient particulièrement importantes dans l’activation des leucocytes [8].
5.2. Le récepteur RAGE
RAGE appartient à la superfamille des immunoglobulines. Il a d’abord été identifié comme un récepteur aux produits de glycation avancée ou AGEs (advanced glycation endproducts). Les AGEs constituent un groupe hétérogène de protéines produites lors d’une réaction non enzymatique entre les groupements oses des sucres et les groupements amines des protéines, de l’ADN ou des lipides. Les AGEs sont des molécules qui s’accumulent dans le sang des patients diabétiques. RAGE est exprimé à la surface de nombreuses cellules (les cellules endothéliales, les neurones, les macrophages, les lymphocytes, les cellules dendritiques et les cellules musculaires lisses,…), mais son niveau d’expression est très variable. En effet, on peut voir une forte augmentation de l’expression de RAGE chez les patients souffrants de diabète, de la maladie d’Alzheimer ou d’athérosclérose.
Le domaine d’interaction d’HMGB1 avec RAGE est localisé dans la boîte B de la protéine. Cette interaction induit au moins deux voies de transduction majeures : (1) la première implique Cdc42 et Rac, des triphosphatases à guanosine qui régulent la motilité cellulaire et la croissance neuronale ; (2) la seconde active Ras et les mitogen-activated protein kinases (MAPK) et conduit à l’activation de NF-κB [9].
6. HMGB1 : activités biologiques (figure 5)
Figure 5.
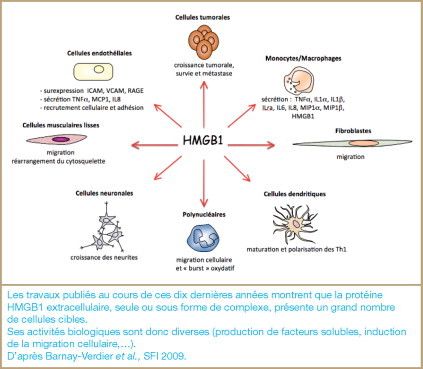
Activités biologiques de la protéine HMGB1.
Les travaux publiés au cours de ces dix dernières années montrent que la protéine HMGB1 extracellulaire, seule ou sous forme de complexe, présente un grand nombre de cellules cibles.
Ses activités biologiques sont donc diverses (production de facteurs solubles, induction de la migration cellulaire,…).
D’après Barnay-Verdier et al., SFI 2009.
6.1. HMGB1, un adjuvant de la réponse immunitaire
L’activation des cellules présentatrices d’antigène est essentielle à la mise en place d’une réponse immunitaire spécifique. Des travaux récents ont montré que la protéine HMGB1, sous forme extracellulaire (qu’elle soit sécrétée ou libérée passivement lors de la nécrose), pouvait induire la maturation des cellules dendritiques et ainsi agir comme une molécule « immunostimulatrice » [10]. HMGB1 peut aussi promouvoir le recrutement des leucocytes à travers la barrière endothéliale en activant les cellules endothéliales (CE). L’augmentation de l’expression des molécules d’adhérence à la surface des CE activées, aboutit à l’adhérence des leucocytes (comme les neutrophiles). Dans un contexte différent, il a été établi que la mort des cellules tumorales en réponse à certains agents anticancéreux peut conduire à la libération de molécules qui vont favoriser, en retour, l’activation des cellules dendritiques et le développement de la réponse cytotoxique dirigée contre les cellules tumorales. Cette réponse pourrait notamment impliquer le récepteur TLR-4 et la protéine HMGB1 [11]. D’autres travaux récents ont montré que l’interaction HMGB1-TLR-2 pourrait, quant à elle, jouer un rôle dans l’évolution clinique des gliomes [12].
6.2. Production de cytokines pro-inflammatoires
De très nombreuses publications ont fait état de la capacité d’HMGB1 à stimuler la sécrétion de cytokines pro-inflammatoires. HMGB1 induirait notamment la production de TNFα, des interleukines IL-1, IL-6 et IL-8, ou encore des protéines MIP-1α et MIP-1β, par des monocytes/macrophages. HMGB1 module l’activité d’autres types cellulaires, dont les polynucléaires neutrophiles, les cellules endothéliales, les cellules musculaires lisses ou encore les cellules dendritiques, stimulant ainsi la production de divers médiateurs solubles associés le plus souvent à la réponse inflammatoire. La sécrétion de TNFα par les macrophages en réponse à HMGB1 s’est rapidement imposée comme un test de référence, dans les laboratoires experts, pour évaluer l’activité des protéines HMGB1 recombinantes purifiées. Il est aujourd’hui largement admis que l’effet observé dans de nombreux travaux publiés ne soit pas directement lié à la réponse des cellules à HMGB1, mais à divers éléments qui contaminent les préparations de protéines recombinantes utilisées : LPS, ADN et ARN bactériens [13, S. Thierry et V. Maréchal, non publié]. Faut-il pour autant conclure à l’absence d’activité des formes solubles d’HMGB1 ? A priori, non. Tout d’abord, plusieurs observations établissent que des inhibiteurs spécifiques d’HMGB1 peuvent bloquer son activité pro-inflammatoire in vitro et dans divers modèles animaux expérimentaux, ce qui confirme l’implication d’HMGB1 dans ce processus. Ce paradoxe a été résolu par plusieurs études récentes qui ont établi qu’HMGB1 peut s’associer de façon non-covalente à diverses molécules pro-inflammatoires (LPS, phosphatidyl sérine, motifs non méthylés de l’ADN, ADN CpG, ARN, IL-β [14], une propriété qui serait l’une des clefs de son activité physiologique. Dans le cas de l’ADN CpG, par exemple, il a été montré qu’HMGB1 formait un complexe non covalent avec celui-ci, interagissait avec RAGE pour finalement interagir avec le récepteur de l’ADN CpG, le TLR-9. En s’associant à ces facteurs, HMGB1 servirait de véhicule et faciliterait, par l’intermédiaire du récepteur RAGE notamment, la présentation de ces molécules à leur(s) récepteur(s) cellulaire(s). Cependant, le débat concernant la capacité d’HMGB1 à induire la production de cytokines pro-inflammatoires, notamment par les macrophages, n’est sans doute pas clos.
6.3. Stimulation de la migration cellulaire et réparation tissulaire
Les activités chimioattractantes d’HMGB1 ne se limitent pas aux cellules du système immunitaire. En effet, HMGB1 induit également la réorganisation du cytosquelette et stimule la migration des cellules musculaires lisses. Elle entraîne aussi la migration et la prolifération des cellules souches endothéliales et de diverses cellules d’origine fibroblastique. Enfin, HMGB1 recrute et induit la prolifération et la différenciation des cellules souches mésenchymateuses et hématopoïétiques. L’ensemble de ces résultats suggère qu’HMGB1 pourrait non seulement signaler les lésions tissulaires, mais également prendre une part active à la reconstitution des tissus lésés. À l’appui de cette hypothèse, un travail récent montre qu’une diminution des concentrations intra-cutanées en HMGB1 pourrait expliquer la difficulté des sujets diabétiques à cicatriser [15]. Sa capacité à recruter les polynucléaires neutrophiles, les monocytes et les macrophages met en lumière la contribution d’HMGB1 à la signalisation des lésions tissulaires (septiques ou aseptiques) et à la coordination locale du processus inflammatoire.
La contribution d’HMGB1 à la migration, à la prolifération et/ou à la différenciation de certaines cellules n’est pas sans évoquer une implication possible de cette protéine dans le processus tumoral. De fait, l’interaction d’HMGB1 avec le récepteur RAGE pourrait moduler la prolifération cellulaire, augmenter la survie et accroître le pouvoir métastatique des cellules tumorales. Dans certains gliomes, le blocage de cette interaction, par l’ajout d’une forme mutée de RAGE, entraîne une suppression de la migration des cellules tumorales et limite la prolifération cellulaire. L’expression de la protéine HMGB1, déjà importante dans les cellules normales, serait accrue dans divers cancers et constituerait un marqueur de mauvais pronostic [16]. En conclusion, le rôle d’HMGB1 dans la progression tumorale est de toute évidence complexe : (1) les mécanismes qui lient la surexpression d’HMGB1, au sein des cellules tumorales, à l’évolution délétère des tumeurs n’ont pas été élucidés à ce jour ; l’accumulation intranucléaire d’HMGB1 pourrait activer des gènes anti-apoptotiques et bloquer l’activité des caspases 3 et 9 ; (2) nous avons rappelé qu’HMGB1, libérée par les cellules qui meurent sous l’action de certains traitements anticancéreux, pourrait à l’opposé jouer un rôle bénéfique en favorisant la mise en place d’une réponse immunitaire anti-tumorale plus efficace.
7. Contribution d’HMGB1 dans les maladies humaines
Libérée passivement par les cellules nécrotiques, mais retenue sur la chromatine des cellules apoptotiques, HMGB1 interviendrait de façon déterminante dans les processus inflammatoires liés à la nécrose et/ou aux agressions tissulaires. Qu’elle soit sécrétée par certaines cellules activées (monocytes/macrophages, pituicytes) ou passivement libérée par les cellules nécrotiques, HMGB1 joue probablement un rôle central dans de nombreuses pathologies aiguës ou chroniques à caractère inflammatoire : choc septique, infections virales (grippe, VIH, hépatites B et C), polyarthrite rhumatoïde, pathologies d’ischémie-reperfusion, athérosclérose, lupus érythémateux [17] ou dans certains types de cancers.
7.1. HMGB1 et pathologies infectieuses
7.1.1. Le VIH
La protéine HMGB1 peut influencer la pathogenèse du VIH en jouant un rôle dans l’infection et/ou la réplication du virus lui-même, ou en ayant un impact sur la réponse immunitaire.
On sait depuis longtemps que des cytokines et/ou des chimiokines (comme le TNFα ou IL6) sont capables de moduler l’expression virale. L’infection par le VIH lui-même ou d’autres conditions physiopathologiques, tels que le stress cellulaire ou les co-infections, peuvent jouer sur la balance de production de ces facteurs. La protéine HMGB1 qui peut avoir, seule ou plus certainement en association avec d’autres protéines, une activité pro-inflammatoire est une très bonne candidate pour moduler l’infection et/ou la réplication du VIH. Nous avons ainsi pu montrer au laboratoire, que la protéine HMGB1 était capable d’activer la réplication du VIH : in vitro, dans des lignées contenant un provirus et in vivo, chez des patients VIH+ contrôlés par des antirétroviraux [18]. En revanche, deux travaux indépendants ont montré qu’HMGB1 a un rôle différent sur l’infection de novo. En effet, dans ce contexte, HMGB1 empêcherait l’infection de nouvelles cellules cibles par l’intermédiaire de cytokines (RANTES, MIP1…) qui se lient au co-récepteur CCR5, empêchant ainsi sa liaison avec le virus [19].
Le VIH étant transmis par voie sexuelle, la première cible qu’il rencontre au niveau de l’épithélium génital sont les cellules dendritiques (CD) de type CCR5, et les cellules de Langherans. Ces cellules ont un rôle clé dans la mise en place de la réponse immunitaire innée contre le VIH. La migration de ces cellules au niveau des organes lymphoïdes induit leurs maturations et va ainsi faire le lien entre la réponse immunitaire innée et adaptative. De nombreux travaux ont montré qu’HMGB1 pouvait activer la maturation des CD [10,20]. La protéine a donc un rôle dans les phases précoces de l’infection car elle est capable de faire le lien entre immunité innée et adaptative.
7.1.2. Sepsis et choc septique
La gravité des infections systémiques impliquant des bactéries à Gram négatif est en grande partie liée aux effets biologiques du lipopolysaccharide bactérien (LPS). Au contact des macrophages, le LPS stimule une production aiguë et précoce de cytokines pro-inflammatoires telles que le TNFα et l’IL-1β. Ces médiateurs jouent un rôle déterminant dans l’emballement de la réponse inflammatoire qui est à la base des signes biologiques qui accompagnent le sepsis et le choc septique. Leur production très précoce (pic à 2 heures post-induction pour le TNFα et 6 heures pour l’IL-1β chez la souris) [21] explique que toute approche thérapeutique utilisant des antagonistes de ces deux cytokines est généralement inefficace car trop tardive. Or, l’équipe de K.J. Tracey a identifié, en 1999, un médiateur beaucoup plus tardif de l’inflammation en mettant en contact des macrophages avec du LPS [3]. Ces derniers sécrètent alors une protéine soluble de 30 kDa capable d’activer les macrophages en culture par voie autocrine. Cette protéine a été purifiée, séquencée et identifiée comme étant la protéine HMGB1. Son rôle pro-inflammatoire en association avec d’autres protéines (activation tardive de la production de TNFα et d’IL-1β par les macrophages), et sa place essentielle dans les processus qui accompagnent le sepsis et le choc septique, sont aujourd’hui aussi bien documentés chez l’homme que dans des modèles animaux. Ainsi l’injection d’une dose sub-létale de LPS chez la souris est associée à l’apparition d’une forme sérique d’HMGB1 avec un pic de concentration observé entre 8 et 32 heures post-injection [3]. D’autre part, une administration systémique d’HMGB1 à des souris est létale et les paramètres biologiques et physiologiques observés montrent des effets en tout point comparables à ceux induits par le LPS. Il a pu être montré, dans des modèles murins, que l’injection, même tardive, d’anticorps anti-HMGB1 peut bloquer partiellement le choc induit par l’injection de LPS [3] et que certains composés anti-inflammatoires, comme l’éthyl-pyruvate, sont capables d’inhiber la libération systémique d’HMGB1 et d’améliorer ainsi la résolution du sepsis expérimental induit dans ces conditions [4].
Si l’on détecte HMGB1 dans le sérum des patients atteints de sepsis ou de choc septique de façon systématique, il n’en demeure pas moins que la corrélation entre les concentrations sériques d’HMGB1 et la sévérité des symptômes dans des cas d’inflammations aiguës (lors de sepsis, de pneumonie ou d’endotoxémie) est souvent très imparfaite.
7.1.3. La grippe
Il existe trois types de virus grippaux : A, B et C. Chez l’homme, l’infection par le virus de la grippe peut être asymptomatique, ou donner des symptômes plus ou moins graves, pouvant aller jusqu’à ceux d’une pneumonie virale potentiellement létale. En plus des cellules du système respiratoire, le virus est capable d’infecter les macrophages et d’induire l’expression de cytokines pro inflammatoires (TNFα, IL1β, IL6, IL8, INF) [22].
Le virus de la grippe induit une mort par apoptose des cellules infectées à la fin de son cycle réplicatif, ce qui aurait pour conséquence de retarder la mise en place de l’inflammation. Cependant, les macrophages infectés peuvent libérer des cytokines pro-inflammatoires [22] qui pourraient en retour induire la libération active d’HMGB1. Ces données ont incité plusieurs groupes à rechercher la contribution d’HMGB1 dans la pathogenèse de la grippe. L’utilisation d’un modèle de grippe chez la souris a, cependant, montré qu’il n’y avait pas de corrélation entre la concentration d’HMGB1 extracellulaire et la gravité de l’infection. De plus, un traitement à l’éthyl-pyruvate (molécule empêchant la sécrétion d’HMGB1), ne réduit pas de manière significative le taux de mortalité de ces souris [23].
7.1.4. La dengue
La dengue est la principale arbovirose des régions tropicales, avec plus de cent millions de cas rapportés par an. Les épidémies de dengue, qui sont en constante augmentation dans les zones intertropicales d’Asie, d’Océanie et des Amériques, sont principalement dues à la transmission inter-humaine du virus par le vecteur Aedae aegypti. L’équipe de Palmer, a montré, in vitro, que la protéine HMGB1 était sécrétée par les cellules dendritiques infectées par le virus de la dengue [24]. De nombreuses cytokines pro-inflammatoires s’accumulent dans le sérum des patients infectés, en particulier au cours des formes les plus graves de la maladie. Une étude menée chez de jeunes enfants vietnamiens confirme qu’HMGB1 est bien produite au cours de l’infection, mais qu’elle ne semble pas, pour autant, signer la gravité de la maladie (Pham Thai Binh et al., en préparation).
7.1.5. Le virus West Nile
Depuis 1999, le virus West Nile (WN) s’est répandu sur le continent américain, tuant environ 500 personnes. Le virus WN peut être responsable d’encéphalites mortelles chez l’homme. Dans sa forme classique, l’infection par le virus WN se manifeste par une fièvre non différenciée, associée à des céphalées et à des douleurs abdominales. Dans certains cas, on peut observer une splénomégalie, une hépatite, une pancréatite ou une myocardite.
Le virus du WN induit la mort des cellules par apoptose à faible dose infectieuse, alors que de forts inocula entraîneraient plutôt, in vitro, une mort cellulaire par nécrose. Cela aurait pour conséquence la libération passive d’HMGB1 dans le milieu extracellulaire au cours de l’infection [25]. D’après les auteurs de cette étude, le pouvoir inflammatoire d’HMGB1 pourrait contribuer à l’apparition des encéphalites, mais cette hypothèse n’a pas été, à ce jour, confirmée in vivo.
7.1.6. Le virus du SRAS
Le SRAS (syndrome respiratoire aigu sévère) est dû à un nouveau coronavirus identifié en 2003. Il infecte les cellules endothéliales des alvéoles ou les macrophages et induit la production d’un grand nombre de cytokines pro-inflammatoires (TNFα, IL1β, IL6, INF). Ces facteurs expliqueraient que les personnes atteintes du virus du SRAS présentent une forte inflammation pulmonaire.
Le rôle potentiel d’HMGB1 dans la pathogenèse du SRAS reste à ce jour incompris. On peut supposer que la présence de cytokines pro-inflammatoires devrait déclencher la libération active d’HMGB1 par les cellules du système immunitaire [26,27]. De plus, HMGB1 pourrait être libérée de façon passive par les macrophages ou les cellules endothéliales infectées. Dans ces conditions, une fois libérée dans le milieu extracellulaire, HMGB1 pourrait alors jouer un rôle dans la réponse inflammatoire au niveau pulmonaire, par exemple en favorisant l’infiltration des neutrophiles et en désorganisant la barrière épithéliale [28].
7.2. HMGB1 et pathologies non infectieuses
HMGB1 est aussi impliquée dans plusieurs maladies non infectieuses. Cependant, des questions demeurent encore sur les mécanismes mis en jeu ainsi que sur le rôle de la protéine HMGB1 dans la progression ou la récupération de ces maladies. Pour certaines de ces pathologies, seules des données cliniques sont actuellement disponibles, parfois sur un nombre de cas extrêmement restreint ou sur une zone géographique bien délimitée. L’apport de données moléculaires et cellulaires à partir de modèles animaux ou de systèmes in vitro sera essentiel à la compréhension du rôle de la protéine HMGB1 dans ces différentes pathogenèses.
7.2.1. La polyarthrite rhumatoïde
La polyarthrite rhumatoïde est une maladie systémique du tissu conjonctif, caractérisée par une inflammation articulaire chronique évoluant par poussées. Elle provoque progressivement des déformations symétriques des articulations touchées et s’accompagne de diverses manifestations touchant d’autres organes que les articulations.
Dans des modèles animaux, HMGB1 est très fortement exprimée dans les tissus et liquides synoviaux et les symptômes sont diminués par l’injection d’anticorps anti-HMGB1 ou de la boîte A recombinante. De plus, l’injection de la protéine HMGB1 chez des animaux sains entraîne l’apparition d’une arthrite rhumatoïde. Enfin, de fortes concentrations d’HMGB1 ont été retrouvées in vivo, dans les liquides synoviaux de patients atteints de polyarthrite rhumatoïde.
7.2.2. Le lupus érythémateux
Le lupus érythémateux systémique est une maladie auto-immune inflammatoire chronique. Elle est caractérisée par une perte de la tolérance et un défaut de contrôle des lymphocytes B et peut entraîner des dommages progressifs dans de nombreux organes.
Des anticorps anti-HMGB1 ont été trouvés dans le sérum de patients qui présentaient un lupus érythémateux. De plus, une augmentation de la quantité de la protéine HMGB1 a pu être mise en évidence dans le derme et l’épiderme des peaux présentant des lésions.
7.2.3. L’athérosclérose
L’athérosclérose est caractérisée par la formation de plaques dans les grosses artères. Ces plaques sont le siège d’une réaction inflammatoire, dont l’agent initiateur le plus probable est le cholestérol-LDL (lipoprotéines de faible densité) sous une forme oxydée (LDL oxydées). Différents arguments étayent l’hypothèse déjà ancienne faisant de l’athérosclérose une maladie inflammatoire. Selon une hypothèse récente, un dysfonctionnement endothélial serait la cause de l’apparition de l’athérosclérose. Il entraînerait l’entrée des lipoprotéines dans la paroi des vaisseaux qui seraient alors modifiées rapidement et conduiraient à la production des AGEs et à l’infiltration des cellules du système inflammatoire. Dans le modèle murin, RAGE et HMGB1 joueraient un rôle important dans le maintien de l’état inflammatoire et la progression des lésions [29].
7.2.4. Les cancers
HMGB1 est très fortement exprimée dans de nombreuses tumeurs mais le lien entre HMGB1 et le développement du cancer reste complexe et en partie incompris [16]. Il semblerait que le développement du cancer soit dû à la capacité de la protéine HMGB1 à moduler l’expression de certains gènes. Par exemple, dans le cancer du côlon, la surexpression d’HMGB1 est associée à une augmentation de la transcription des gènes répondants à NFkB, comme c-IAP2, une protéine anti-apototique [30]. Dans la même étude, les auteurs montrent une corrélation entre l’augmentation de l’expression d’HMGB1 et la diminution de l’activité des caspases-3 et -9 (protéines pro-apoptotique).
La découverte initiale du rôle de l’interaction HMGB1-RAGE dans la modulation de la croissance des neurites a suggéré que le signal HMGB1-RAGE pourrait promouvoir l’état métastasique de différents cancers. Ainsi, l’interaction entre HMGB1 et son récepteur RAGE serait un des facteurs impliqués dans l’invasion et la prolifération cellulaire de gliomes (comme dans le cancer du côlon ou de la prostate) [12]. Le blocage de cette interaction, par l’ajout d’une forme mutée de RAGE, entraîne une suppression de la migration du gliome forçant la tumeur à entrer dans un état de dormance prolongée (recul de la prolifération et de l’invasion cellulaire).
Une augmentation des interactions HMGB1-RAGE est observée dans d’autres types de cancers (cancer du sein, mélanome, cancer du pancréas) et ferait partie des signes de mauvais pronostic, avec un risque métastasique plus élevé. Ceci semble en fait dépendre de la pathologie tumorale concernée puisqu’au cours du cancer du poumon, l’interaction entre HMGB1 et RAGE est au contraire diminuée par rapport à un tissu sain [16].
7.2.5. L’ischémie reperfusion
L’ischémie-reperfusion (IR) induit une carence temporaire des tissus en oxygène. Elle est associée à des dommages tissulaires qui peuvent être à l’origine de dysfonctionnements graves. Ce type de problème est rencontré très fréquemment dans les pathologies aiguës, et notamment au cours de l’infarctus du myocarde et lors de transplantations d’organe.
La protéine HMGB1 a été impliquée dans les pathologies liées à l’IR dans différents organes tels que les reins, le cerveau, le cœur et le foie. Ceci a été démontré notamment en utilisant un modèle de souris présentant une IR suite à une transplantation hépatique. Dans ce modèle expérimental, la concentration locale de la protéine HMGB1 libre augmente de façon très précoce, environ 1 h après la transplantation, et continue d’augmenter 24 h après. De plus, l’ajout d’anticorps neutralisants anti-HMGB1 améliore les dommages causés par l’IR via la voie de transduction TLR4-dépendante.
8. Faut-il doser HMGB1 ?
Plusieurs techniques sont utilisées pour détecter HMGB1 dans des échantillons biologiques comme le sang périphérique, les liquides cervicaux-vaginaux, ou encore les liquides céphalo-rachidiens…
Le western blot sur sérum total, peu sensible et difficilement quantifiable, a été largement utilisé avant l’arrivée d’une méthode beaucoup plus sensible : le test ELISA. Ce type de test permet de faire des études à plus grande échelle, ce qui peut s’avérer très utile dans le cadre d’études cliniques. Les deux techniques ne donnent pas des résultats parfaitement concordants, ce qui suggère que de multiples formes de la protéine pourraient circuler dans le sérum. Des facteurs sériques tels que les anticorps seraient capables de masquer la détection de la protéine HMGB1 dans ces conditions expérimentales. C’est l’une des hypothèses proposée pour expliquer les discordances qui ont pu être observées dans des études visant à corréler le taux d’HMGB1 présent dans le plasma de patients avec la sévérité du sepsis [31].
Notre équipe a développé une technique de retard sur gel, originale et très sensible, qui permet de doser la protéine HMGB1 dans différents types d’échantillons biologiques. Cette technique est basée sur la capacité d’HMGB1 à se lier avec une très forte affinité sur des formes particulières d’ADN double brin : les hémicatenanes [32]. Cette technique inclut une étape de dissociation entre la protéine HMGB1 et d’éventuel(s) partenaire(s). Une étude comparative menée sur une centaine de plasmas provenant de patients atteints de sepsis montre que le dosage par test ELISA sous-estime la quantité d’HMGB1 présente dans les prélèvements (S.Barnay-Verdier et al., manuscrit en préparation).
Quelle que soit la technique utilisée, les concentrations d’HMGB1 dites « normales » oscillent entre 1 et 5 ng/mL, mais dans quelques rares cas, ces concentrations peuvent augmenter sans raison apparente. En revanche, ces concentrations peuvent évoluer entre 1 et près de 200 ng/ml, selon la technique utilisée, au cours du sepsis ou d’un choc sévère.
9. HMGB1 : une nouvelle cible thérapeutique ?
La contribution d’HMGB1 à de nombreux processus inflammatoires aigus ou chroniques, localisés ou systémiques, a ouvert une voie évidente à la conception et/ou à l’identification de molécules susceptibles de moduler son activité extracellulaire ( figure 6 ). Dans le cas du choc septique, les stratégies visant HMGB1 sont justifiées par l’espoir de développer des thérapeutiques applicables dans une fenêtre temporelle plus large et surtout plus tardive que celle qui est aujourd’hui disponible pour inactiver le TNFα.
Figure 6.
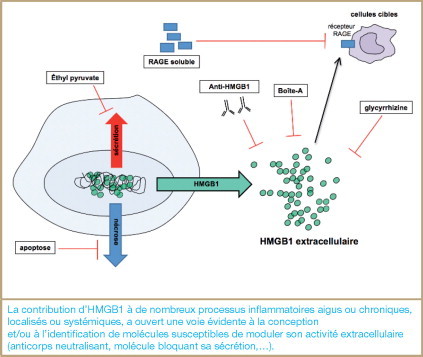
Stratégies thérapeutiques.
La contribution d’HMGB1 à de nombreux processus inflammatoires aigus ou chroniques, localisés ou systémiques, a ouvert une voie évidente à la conception et/ou à l’identification de molécules susceptibles de moduler son activité extracellulaire (anticorps neutralisant, molécule bloquant sa sécrétion,…).
Plusieurs études ont établi la preuve de concept de ces stratégies en démontrant, par exemple, le bénéfice de traitements utilisant des anticorps anti-HMGB1 dans des modèles d’endotoxémie murins. Ces anticorps diminuent, voire préviennent, la létalité induite par le choc septique dans plusieurs modèles murins [3]. Des anticorps monoclonaux capables de neutraliser la protéine ont également été développés et sont aujourd’hui testés dans des modèles expérimentaux de sepsis ou de polyarthrite rhumatoïde. Les résultats très prometteurs obtenus dans les modèles de choc septique ont encouragé le développement d’autres inhibiteurs de la protéine HMGB1. Une forme purifiée de la boîte A, dérivée de la protéine HMGB1, agit comme un antagoniste de la protéine complète. Cette molécule été utilisée avec succès dans plusieurs études et en particulier dans des modèles d’arthrite [33]. L’utilisation de ces molécules serait limitée au traitement des pathologies aiguës.
Une réponse protectrice tardive a également pu être observée dans la progression du sepsis lors de l’administration de l’éthyl-pyruvate. Ce composé, qui est un dérivé lipophile stable, est un additif alimentaire assez peu toxique qui atténue l’inflammation systémique, notamment au cours des pathologies liées à une ischémie reperfusion. In vitro, l’éthyl-pyruvate, est capable d’inhiber la sécrétion du TNFα et d’HMGB1 par les macrophages murins stimulés par le LPS. Le mécanisme moléculaire précis mis en jeu lors de cette inhibition reste, à ce jour, encore méconnu et/ou discuté. Néanmoins, l’administration d’éthyl-pyruvate 24 h après l’induction d’un choc septique chez la souris permet de réduire la mortalité ainsi que les concentrations sériques d’HMGB1. D’autres molécules, souvent dérivées de pharmacopées traditionnelles et connues de façon empirique pour leur activité anti-inflammatoire, se sont avérées capables de bloquer l’activité extracellulaire d’HMGB1, comme certains extraits du thé vert ou la glycyrrhizine, le principe actif de la racine de réglisse.
10. HMGB1 : les questions qui demeurent…
L’histoire même des découvertes qui ont été faites sur HMGB1 souligne les risques des positions les plus dogmatiques : HMGB1 a d’abord été définie comme une protéine nucléaire essentielle avant de gagner ses lettres de noblesse hors de la cellule. L’IL-33 a connu une histoire diamétralement opposée, puisque ses propriétés extracellulaires ont été identifiées avant que ces activités nucléaires ne soient reconnues. Peut-on encore parler de cytokine pro-inflammatoire, à l’instar du TNFα ? D’une part, les concentrations biologiquement actives sont très supérieures à celles des cytokines classiques. D’autre part, la capacité d’HMGB1 à induire la production de cytokines inflammatoires – à partir des macrophages notamment – a longtemps été utilisée comme « gold standard » ; mais cette propriété doit être rediscutée depuis qu’il a été établi que les formes recombinantes d’HMGB1 sont fréquemment associées à des composants pro-inflammatoires d’origine bactérienne. Enfin, il semble essentiel de s’interroger sur la valeur diagnostique ou pronostique des formes sériques d’HMGB1. Utilisée comme un marqueur sérique de l’inflammation, pour lequel il existe un test commercial, HMGB1 n’a pas livré tous ses secrets. Un nombre grandissant d’études souligne que les concentrations sériques d’HMGB1 sont, effectivement, plus élevées en moyenne au cours du choc septique, mais cette observation n’est en aucun cas une règle : des patients peuvent développer un choc avec des concentrations sériques faibles et des individus apparemment sains montrent des concentrations qui s’inscrivent clairement dans des gammes habituellement considérées comme « anormales ». La présence de concentrations élevées d’HMGB1 dans le sérum n’est donc pas, à elle seule, un marqueur fiable. La capacité d’HMGB1 à agir, in vitro, en synergie avec des cytokines, le LPS ou d’autres facteurs solubles et sa neutralisation éventuelle par des facteurs sériques (des auto-anticorps notamment) sont autant de paramètres qui pourraient expliquer ces discordances et mériteraient à ce titre d’être explorés.
Conflit d’intérêt : aucun.
Références
- 1.Bianchi ME, Manfredi AA. High-mobility group box 1 (HMGB1) protein at the crossroads between innate and adaptive immunity. Immunol Rev. 2007;220:35–46. doi: 10.1111/j.1600-065X.2007.00574.x. Review. [DOI] [PubMed] [Google Scholar]
- 2.Parkkinen J, Raulo E, Merenmies J. Amphoterin, the 30-kDa protein in a family of HMG1-type polypeptides. Enhanced expression in transformed cells, leading edge localization, and interactions with plasminogen activation. J Biol Chem. 1993;268:19726–19738. [PubMed] [Google Scholar]
- 3.Wang H, Bloom O, Zhang M. HMG-1 as a late mediator of endotoxin lethality in mice ». Science. 1999;285:248–251. doi: 10.1126/science.285.5425.248. [DOI] [PubMed] [Google Scholar]
- 4.Ulloa L, Ochani M, Yang H, Tanovic Ethyl pyruvate prevents lethality in mice with established lethal sepsis and systemic inflammation. Proc Natl Acad Sci USA. 2002;99:12351–12356. doi: 10.1073/pnas.192222999. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Scaffidi P, Misteli T, Bianchi ME. Release of chromatin protein HMGB1 by necrotic cells triggers inflammation. Nature. 2002;418(6894):191–195. doi: 10.1038/nature00858. [DOI] [PubMed] [Google Scholar]
- 6.Gardella S, Andrei C, Ferrera D. The nuclear protein HMGB1 is secreted by monocytes via a non-classical, vesicle-mediated secretory pathway. EMBO Rep. 2002;3(10):995–1001. doi: 10.1093/embo-reports/kvf198. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 7.Kazama H, Ricci JE, Herndon JM. Induction of immunological tolerance by apoptotic cells requires caspase-dependent oxidation of high-mobility group box-1 protein. Immunity. 2008;29(1):21–32. doi: 10.1016/j.immuni.2008.05.013. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 8.Park JS, Svetkauskaite D, He Q. Involvement of toll-like receptors 2 and 4 in cellular activation by high mobility group box 1 protein. J Biol Chem. 2004;279(9):7370–7377. doi: 10.1074/jbc.M306793200. [DOI] [PubMed] [Google Scholar]
- 9.Huttunen HJ, Fages C, Rauvala H. Receptor for advanced glycation end products (RAGE)-mediated neurite outgrowth and activation of NF-κB require the cytoplasmic domain of the receptor but different downstream signaling pathways. J Biol Chem. 1999;274:19919–19924. doi: 10.1074/jbc.274.28.19919. [DOI] [PubMed] [Google Scholar]
- 10.Messmer D, Yang H, Telusma G. High mobility group box protein 1: an endogenous signal for dendritic cell maturation and Th1 polarization. J Immunol. 2004;173:307–313. doi: 10.4049/jimmunol.173.1.307. [DOI] [PubMed] [Google Scholar]
- 11.Apetoh L, Ghiringhelli F, Tesniere A. Toll-like receptor 4-dependent contribution of the immune system to anticancer chemotherapy and radiotherapy. Nat Med. 2007;13:1050–1059. doi: 10.1038/nm1622. [DOI] [PubMed] [Google Scholar]
- 12.Curtin JF, Liu N, Candolfi M. HMGB1 mediates endogenous TLR2 activation and brain tumor regression. PLoS Med. 2009;6:e10. doi: 10.1371/journal.pmed.1000010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 13.Rouhiainen A, Tumova S, Valmu L. Pivotal advance: analysis of proinflammatory activity of highly purified eukaryotic recombinant HMGB1 (amphoterin) J Leukoc Biol. 2007;81:49–58. doi: 10.1189/jlb.0306200. [DOI] [PubMed] [Google Scholar]
- 14.Ivanov S, Dragoi AM, Wang X. A novel role for HMGB1 in TLR9-mediated inflammatory responses to CpG-DNA. Blood. 2007;110:1970–1981. doi: 10.1182/blood-2006-09-044776. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 15.Straino S, Di Carlo A, Mangoni A. High-mobility group box 1 protein in human and murine skin: involvement in wound healing. J Invest Dermatol. 2008;128:1545–1553. doi: 10.1038/sj.jid.5701212. [DOI] [PubMed] [Google Scholar]
- 16.Ellerman JE, Brown CK, de Vera M. Masquerader: high mobility group box-1 and cancer. Clin Cancer Res. 2007;13:2836–2848. doi: 10.1158/1078-0432.CCR-06-1953. Review. [DOI] [PubMed] [Google Scholar]
- 17.Klune JR, Dhupar R, Cardinal J. HMGB1: endogenous danger signaling. Mol Med. 2008;14:476–484. doi: 10.2119/2008-00034.Klune. Review. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 18.Thierry S, Gozlan J, Jaulmes A. High-mobility group box 1 protein induces HIV-1 expression from persistently infected cells. AIDS. 2007;21(3):283–292. doi: 10.1097/QAD.0b013e3280115b50. [DOI] [PubMed] [Google Scholar]
- 19.Cassetta L, Fortunato O, Adduce L. Extracellular high mobility group box-1 inhibits R5 and X4 HIV-1 strains replication in mononuclear phagocytes without induction of chemokines and cytokines. AIDS. 2009;23(5):567–577. doi: 10.1097/QAD.0b013e328325a47e. [DOI] [PubMed] [Google Scholar]
- 20.Rovere-Querini P, Capobianco A, Scaffidi P. HMGB1 is an endogenous immune adjuvant released by necrotic cells. EMBO Rep. 2004;5(8):825–830. doi: 10.1038/sj.embor.7400205. Epub 2004 Jul 23. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Wang H, Yang H, Czura CJ. HMGB1 as a late mediator of lethal systemic inflammation. Am J Respir Crit Care Med. 2001;164(10 Pt 1):1768–1773. doi: 10.1164/ajrccm.164.10.2106117. [DOI] [PubMed] [Google Scholar]
- 22.Julkunen I, Sareneva T, Pirhonen J. Molecular pathogenesis of influenza A virus infection and virus-induced regulation of cytokine gene expression. Cytokine Growth Factor Rev. 2001;12(2–3):171–180. doi: 10.1016/s1359-6101(00)00026-5. [DOI] [PubMed] [Google Scholar]
- 23.Alleva LM, Budd AC, Clark IA. Systemic release of high mobility group box 1 protein during severe murine influenza. J Immunol. 2008;181(2):1454–1459. doi: 10.4049/jimmunol.181.2.1454. [DOI] [PubMed] [Google Scholar]
- 24.Kamau E, Takhampunya R, Li T. Dengue virus infection promotes translocation of high mobility group box 1 protein from the nucleus to the cytosol in dendritic cells, upregulates cytokine production and modulates virus replication. J Gen Virol. 2009;90(Pt 8):1827–1835. doi: 10.1099/vir.0.009027-0. [DOI] [PubMed] [Google Scholar]
- 25.Chu JJ, Ng ML. The mechanism of cell death during West Nile virus infection is dependent on initial infectious dose. J Gen Virol. 2003;84(Pt 12):3305–3314. doi: 10.1099/vir.0.19447-0. [DOI] [PubMed] [Google Scholar]
- 26.Bermejo JF, Muñoz-Fernandez MA. Severe acute respiratory syndrome, a pathological immune response to the new coronavirus--implications for understanding of pathogenesis, therapy, design of vaccines, and epidemiology. Viral Immunol. 2004;17(4):535–544. doi: 10.1089/vim.2004.17.535. [DOI] [PubMed] [Google Scholar]
- 27.Ward SE, Loutfy MR, Blatt LM. Dynamic changes in clinical features and cytokine/chemokine responses in SARS patients treated with interferon alfacon-1 plus corticosteroids. Antivir Ther. 2005;10(2):263–275. [PubMed] [Google Scholar]
- 28.Chen G, Chen DZ, Li J. Pathogenic role of HMGB1 in SARS? Med Hypotheses. 2004;63(4):691–695. doi: 10.1016/j.mehy.2004.01.037. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 29.Harja E, Bu DX, Hudson BI. Vascular and inflammatory stresses mediate atherosclerosis via RAGE and its ligands in apoE-/- mice. J Clin Invest. 2008;118(1):183–194. doi: 10.1172/JCI32703. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Völp K, Brezniceanu ML, Bösser S. Increased expression of high mobility group box 1 (HMGB1) is associated with an elevated level of the antiapoptotic c-IAP2 protein in human colon carcinomas. Gut. 2006;55(2):234–242. doi: 10.1136/gut.2004.062729. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Gibot S, Massin F, Cravoisy A, Barraud D, Nace L, Levy B. High-mobility group box 1 protein plasma concentrations during septic shock. Intensive Care Med. 2007;33(8):1347–1353. doi: 10.1007/s00134-007-0691-2. [DOI] [PubMed] [Google Scholar]
- 32.Gaillard C, Borde C, Gozlan J. A high-sensitivity method for detection and measurement of HMGB1 protein concentration by high-affinity binding to DNA hemicatenanes. PLoS One. 2008;3(8):e2855. doi: 10.1371/journal.pone.0002855. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 33.Kokkola R, Li J, Sundberg E. Successful treatment of collagen-induced arthritis in mice and rats by targeting extracellular high mobility group box chromosomal protein 1 activity. Arthritis Rheum. 2003;48:2052–2058. doi: 10.1002/art.11161. [DOI] [PubMed] [Google Scholar]


