Résumé
L’objectif de cet article est de présenter les modalités et les applications de l’exploration des éléments figurés du sang et de l’hémostase en médecine vétérinaire des carnivores domestiques (chien et chat). La réalisation technique de l’hémogramme, la morphologie des différentes cellules sanguines normales et l’interprétation des numérations cellulaires seront successivement envisagées. Les modifications pathologiques des numérations cellulaires et des frottis seront également abordées. Les particularités de l’hémogramme normal et pathologique des herbivores domestiques (cheval et bovins) sont mentionnées dans un chapitre séparé.
La difficulté de l’hématologie vétérinaire réside dans les dissemblances, tant qualitatives que quantitatives, entre cellules sanguines des différentes espèces animales.
L’exploration des cellules de la moelle osseuse hématopoïétique ne sera pas abordée dans cet article.
Keywords: Hématologie, hémogramme, hémostase, chien, chat, cheval, bovins
Summary
The goal of this article is to present the technical aspects and the applications of the blood cells examination and haemostasis in dogs and cats. Technical realisation of blood counts, cytology of normal and abnormal blood cells and significance of the pathologic cell counts are successively treated. Distinctive features of cytology and cell counts in herbivores, horses and cattle, are detailed in a separate chapter.
Difficulties of veterinary haematology lie in qualitative and quantitative differences between blood cells of various animal species.
Bone marrow cells exploration is not performed in this review.
Keywords: Haematology, haemostasis, dog, cat, horse, cattle
1. Introduction
L’établissement d’un hémogramme est une analyse courante et essentielle en pratique vétérinaire des animaux de compagnie. L’hémogramme consiste, comme chez l’homme, à la numération des différentes lignées cellulaires sanguines, leucocytes, hématies et plaquettes, et en l’établissement d’une formule leucocytaire permettant de déterminer la proportion de toutes les lignées leucocytaires. En médecine vétérinaire, l’examen microscopique du frottis sanguin est très informatif et peut conduire au typage des anémies, au diagnostic de leucémies ou d’infestations parasitaires, ces dernières étant fréquentes chez les carnivores domestiques. Les particularités de l’hémogramme des herbivores, bovins et équidés, seront envisagées dans une seconde partie. Si les cellules sanguines normales présentent quelques variations morphologiques d’une espèce à l’autre, la principale différence réside dans les numérations et les formules leucocytaires très variables.
Enfin, la pathologie hématologique ainsi que les troubles de l’hémostase seront envisagés en détaillant les spécificités liées à chaque espèce.
2. L’hémogramme : réalisation et aspect descriptif
L’hémogramme correspond à la numération formule (NF) des éléments figurés du sang (hématies, leucocytes et thrombocytes), à l’analyse du frottis sanguin, à la détermination du taux de réticulocytes, de l’hématocrite (Ht), de l’hémoglobinémie (Hb), du volume globulaire moyen (VGM), de la concentration corpusculaire moyenne en hémoglobine (CCMH) et de la teneur corpusculaire moyenne en hémoglobine (TCMH). Ces différentes valeurs sont données pour le chien, le chat, le cheval et les bovins, dans le tableau I .
Tableau I.
Valeurs usuelles pour l’hémogramme chez le chien, le chat, le cheval et le bovin adultes.
| Paramètres | Unités | Chien | Chat | Cheval | Bovins |
|---|---|---|---|---|---|
| Hématies | ×1012/l | 5,5-8,5 | 5-10 | 6,8-12,9 (5,5-9,5) | 5-10 |
| Hémoglobine | g/dl | 12-18 | 8-15 | 11-19 (8-14) | 8-15 |
| Hématocrite | % | 37-55 | 24-45 | 32-53 (24-44) | 24-46 |
| VGM | fl | 60-77 | 39-55 | 37-58 | 40-60 |
| CCMH | g/dl (%) | 32-36 | 31-35 | 31-38,6 | 30-36 |
| TCMH | pg | 19,5-24,5 | 12,5-17,5 | 12,3-19,9 | 11-17 |
| Réticulocytes | ×109/l | 0-127 | 7-1120 | ND | ND |
| Plaquettes | ×109/l | 200-500 | 300-800 | 100-350 | 110-800 |
| Leucocytes | ×109/l | 6-17 | 5,5-19,5 | 5,4-14,3 (6-12) | 4-12 |
| Granulocytes neutrophiles | ×109/l | 3-11,5 | 2,5-12,5 | 2,26-8,58 | 0,6-4 |
| Neutrophiles non segmentés | ×109/l | 0-0,3 | 0-0,3 | 0-0,1 | 0-0,12 |
| Granulocytes éosinophiles | ×109/l | 0,1-1,25 | 0-1,5 | 0-1 | 0-2,4 |
| Granulocytes basophiles | ×109/l | rares | rares | 0-0,29 | 0-0,2 |
| Lymphocytes | ×109/l | 1-4,8 | 1,5-7 | 1,5-7,7 | 2,5-7,5 |
| Monocytes | ×109/l | 0,15-1,35 | 0-0,85 | 0-1 | 0,025-0,84 |
ND = non déterminé
Chez le cheval, les valeurs sont données pour les pur-sang. Les valeurs des chevaux de trait sont indiquées entre parenthèses.
D’après Feldman et al. 2000.
Pour mesurer ces différents paramètres, on dispose de méthodes manuelles, peu précises, mais qui servent de références, et de méthodes automatisées.
2.1. Le prélèvement sanguin
Le prélèvement du sang veineux sur anticoagulant est fondamental pour réaliser la NF. L’EDTA (acide éthylène diamine tétra-acétique) est l’anticoagulant préservant le mieux la morphologie cellulaire. Néanmoins, un excès d’EDTA peut provoquer un rétrécissement des hématies et une diminution de l’hématocrite. Les tubes de prélèvement sur EDTA de 5 ml devraient donc être remplis complètement (on préconise une concentration d’EDTA de 1 mg/ml). Si le sang n’est pas analysé dans les 2 à 3 heures suivant le prélèvement, il est recommandé de réfrigérer l’échantillon à 4 °C pour éviter une augmentation de taille des hématies. Les paramètres de l’hémogramme ne sont pas modifiés après 24 h de stockage à 4 °C.
Les frottis sanguins doivent être réalisés immédiatement. Pour la mise en évidence d’éventuels parasites intra- érythrocytaires, le sang capillaire, obtenu par piqûre à l’oreille, est préférable pour obtenir une concentration supérieure d’hématies parasitées.
2.2. L’hématocrite
L’Ht est déterminé en centrifugeant du sang non coagulé en petits tubes capillaires pendant 5 minutes à une vitesse comprise entre 12 000 et 15 000 rpm. La valeur de l’Ht (en pourcentage) est obtenue en divisant la longueur occupée par les hématies par la longueur totale du tube contenant à la fois les hématies, le « buffy coat » (leucocytes et plaquettes) et le plasma. Plusieurs types d’appareils permettent une lecture automatique de l’Ht. Un examen macroscopique du plasma permet de détecter ictère (couleur jaune), hémolyse (couleur rouge) ou hyperlipémie (aspect lactescent). Un examen microscopique permet également de détecter la présence de microfilaires lors de dirofilariose canine qui se concentrent dans le plasma, juste au-dessous du « buffy coat », ce qui rend plus facile leur détection.
2.3. L’hémoglobinémie
La concentration en hémoglobine (Hb) est un paramètre important de l’évaluation de la lignée érythrocytaire. La technique de mesure de l’Hb est le plus souvent une méthode photométrique à la cyanméthémoglobine (lecture à 546 nm). Usuellement, la valeur rendue est exprimée en grammes pour cent millilitres. Il est à noter qu’une hyperlipidémie ou la présence de corps de Heinz (en particulier dans le sang de chat) peuvent modifier de façon artéfactuelle la mesure de l’hémoglobinémie.
2.4. La numération des cellules sanguines
La méthode manuelle consiste, après dilution du sang veineux, à placer celui-ci dans une chambre de comptage (cellule de Malassez ou cellule de Thoma). La lecture se fait au microscope optique. Le facteur de dilution varie en fonction du type cellulaire (au 1/200 pour les hématies, au 1/20 pour les leucocytes, au 1/100 pour les plaquettes).
Le nombre d’hématies est exprimé en millions de cellules par ml de sang (ou encore 1012 cellules/l de sang). Le nombre de leucocytes ou de plaquettes est exprimé en milliers de cellules par ml de sang (ou 109 cellules/l de sang).
Pour la numération, les méthodes automatisées font appel soit à la mesure de la taille cellulaire par variation d’impédance (principe Coulter), soit à la mesure de la taille et de la structure cellulaire par diffraction de la lumière (principe de détection laser). On parle respectivement d’appareils à impédance et d’appareils à cytométrie en flux.
Les compteurs Coulter nécessitent un ajustement de valeurs seuils pour chaque espèce. En effet, si les cellules sanguines du chien sont proches de celles de l’homme, le sang de chat en revanche pose certains problèmes (taille plus petite des hématies, présence d’amas de plaquettes). Ainsi, la société Beckman Coulter commercialise un appareil (l’analyseur Ac-T diff) présentant en option un logiciel pour les analyses hématologiques chez le chat, le chien, et le cheval. La société Melet Schloesing propose également des automates pour hématologie humaine (MS4®, MS9®) avec des logiciels vétérinaires intégrant une gestion de bases de données. Un certain nombre de marques offrent des appareils à usage exclusivement vétérinaire fonctionnant sur le principe Coulter ou le principe laser (appareil Technicon H1-E® commercialisé par Bayer Diagnostics).
Les appareils à impédance accessibles au praticien en France sont nombreux : le ScilVetABC®, le PocH 100iV® du fabricant Scil, l’Abacus junior vet®, le Medonic 620CA® de Kitvia et les MS4-3®, MS4-e®, MS4-5®, MS9-3®, MS9-5® de Melet Schloesing. On peut ainsi les retrouver chez les praticiens mais aussi dans certains laboratoires pour les modèles les plus évolués.
Le principal appareil à cytométrie en flux agréé pour la médecine vétérinaire et accessible au praticien est le LaserCyte® de chez Idexx. Il en existe d’autres sur le marché, fonctionnant avec cette seule méthode ou en l’associant à d’autres méthodes de comptage, tels que les Advia120® et 210® de Bayer, le XT-2000iV® de Sysmex et le Cell-Dyn 3 500® d’Abbott, mais leur coût les rend surtout présents dans les laboratoires spécialisés.
Il existe enfin un dernier type d’analyseur en hématologie vétérinaire, le QBC (« quantitative buffy coat ») VetAutoread® commercialisé par Idexx. Le comptage cellulaire est déterminé à partir de l’épaisseur des différentes couches cellulaires du « buffy coat » obtenu après centrifugation du sang dans un tube capillaire. On obtient la numération des leucocytes ainsi que la détermination de la formule leucocytaire qui comprend non seulement le nombre de granulocytes neutrophiles, de granulocytes éosinophiles, de lymphocytes et de monocytes, mais aussi le nombre de plaquettes, d’érythroblastes et de réticulocytes. L’appareil détermine également le taux de fibrinogène, l’Ht, l’Hb, et la CCMH. Ce type d’analyse est plus précis que les méthodes manuelles mais moins précis que le système Coulter.
2.5. Les index érythrocytaires : VGM, CCMH et TCMH
Le volume globulaire moyen (VGM) est obtenu en effectuant le rapport entre l’Ht et le nombre d’hématies (en millions par mm3 de sang). Il s’exprime en femtolitre (10-15 l) ou encore en μm3.
En fonction du résultat et de l’espèce considérée, la population des hématies sera dite normocytaire, microcytaire, ou macrocytaire.
La concentration corpusculaire moyenne en hémoglobine (CCMH) est le rapport entre Hb et Ht. Elle s’exprime en g/100 ml. Sa valeur est très constante dans toutes les espèces.
La teneur corpusculaire moyenne en hémoglobine (TCMH) est le rapport entre Hb et le nombre d’hématies (en millions par mm3 de sang). Elle s’exprime en picogramme (10-12 g).
Lorsque la TCMH et la CCMH sont comprises dans les limites de la normale pour l’espèce considérée, la population des hématies est dite normochrome ; lorsque l’une de ces valeurs est inférieure à la normale, la population des hématies est dite hypochrome.
2.6. Le frottis sanguin
L’analyse du frottis sanguin est complémentaire des méthodes automatisées. L’étalement sur lame est réalisé de préférence à partir de sang fraîchement prélevé sur tube EDTA. Après séchage et coloration, le frottis est observé à son extrémité distale pour repérer d’éventuelles cellules anormales, la présence d’amas plaquettaires, ou de parasites.
2.6.1. Les plaquettes
Le frottis sanguin permet d’évaluer approximativement le nombre de plaquettes (très bas, bas, normal, augmenté) avec un objectif de 100×. Les plaquettes sont des cellules anucléées, limitées par une membrane irrégulière émettant de fins pseudopodes ; leur cytoplasme est finement granuleux ( figure 1 ). Leur diamètre est de 2 μm environ, avec un volume plaquettaire moyen de 6 à 8 fl. Leur taille est donc généralement inférieure à celle des hématies, mais on peut parfois observer des mégaplaquettes (parfois plus grandes que des hématies) chez le chat ou lors de thrombopénie régénérative chez le chien (il peut s’agir alors de mégacaryocytes, cellules nucléées). On compte par champ entre 8 et 29 plaquettes chez le chien et entre 10 et 29 chez le chat (la moyenne est faite sur 5 à 10 champs). Les amas plaquettaires sont fréquents chez les carnivores domestiques et gênent cette estimation. On peut éventuellement vortexer le sang, mais cette procédure n’élimine pas tous les amas plaquettaires.
Figure 1.

Sang de chien. Amas plaquettaire et hématies.*
2.6.2. Les leucocytes
La population leucocytaire est divisée en polynucléaires (ou granulocytes), lymphocytes et monocytes. Les polynucléaires regroupent (en fonction de l’affinité tinctoriale de leurs granulations) les neutrophiles, les éosinophiles et les basophiles. Chez le chien, leur diamètre varie de 12 à 18 μm en fonction du type.
On peut estimer le nombre des leucocytes à l’objectif 10× sur plusieurs champs. Normalement, on trouve ainsi en moyenne de 18 à 51 leucocytes par champ chez le chien. Manuellement, la formule leucocytaire relative est déterminée en comptant 100 à 200 leucocytes et en fixant le pourcentage de chaque type de cellule. Seule la valeur absolue (obtenue en multipliant le pourcentage ainsi obtenu par la numération leucocytaire) est interprétable.
-
•
Les polynucléaires neutrophiles sont caractérisés par des granulations nombreuses, de petite taille et peu colorables par les colorants acides et basiques ( figure 2 ). Ils représentent la fraction leucocytaire la plus abondante chez les carnivores domestiques. Jeunes, ils ont un noyau non lobulé (« band cells » en anglais, ou neutrophiles non segmentés [NNS]) qui devient plurilobulé (5 à 6 lobes et plus) avec l’âge. La chromatine a un aspect caractéristique en mottes quadrangulaires denses accolées à la membrane nucléaire. Les neutrophiles du chien ont un diamètre plus important que ceux du chat (12 à 15 μm contre 10 à 12 μm).
-
•
Les polynucléaires éosinophiles ont un diamètre variant de 12 à 18 μm. Chez le chien ( figure 3 ), ils possèdent des granulations de petite taille, sphériques, et peu abondantes (contrairement à l’homme où elles sont abondantes et de grande taille) et faiblement colorés (rose orange). Chez le chat, les granulations sont nombreuses et ont une forme de bâtonnet ( figure 4 ). Le noyau polylobé des éosinophiles est semblable à celui des neutrophiles, mais la chromatine paraît moins compactée.
-
•
Le diamètre des polynucléaires basophiles (à ne pas confondre avec les mastocytes, voir plus loin) varie de 14 à 16 μm. Ils possèdent un noyau similaire à celui des polynucléaire neutrophiles, mais à la différence de ces derniers, leur cytoplasme est pourvu de granulations basophiles. Les granulations basophiles du chien sont en petit nombre et colorées en violet. Les granulations chez le chat sont nombreuses, rondes ou ovales, faiblement (gris beige) à fortement (bleu nuit) colorées. Les basophiles sont les moins nombreux des leucocytes, et l’on n’en observe généralement pas dans le sang circulant chez le chien et le chat.
-
•
Les lymphocytes sont de petites cellules rondes avec un rapport nucléo-cytoplasmique élevé ( figure 5 ). Leur diamètre varie de 10 à 15 μm en fonction de la quantité de cytoplasme, qui apparaît basophile. Leur noyau est circulaire, parfois muni d’une petite encoche. Le cytoplasme de certains grands lymphocytes peut contenir quelques granulations azurophiles correspondant à des lysosomes primaires.
-
•
Les lymphoblastes sont des cellules lymphoïdes immatures contenant des nucléoles clairement visibles. Ils sont rarement observés à l’état normal dans le sang.
-
•
Les monocytes sont de grandes cellules (20 μm de diamètre environ) avec un noyau de forme variable, généralement indenté ( figure 6 ). La chromatine est plus diffuse que dans les noyaux de neutrophiles ; elle apparaît filamenteuse et prend un aspect « peigné ». Le cytoplasme est gris bleuté et hétérogène (en « ciel d’orage ») et l’on note la présence de microvacuoles.
Figure 2.

Sang de chien. Granulocyte neutrophile.*
Figure 3.

Sang de chien. Granulocytes éosinophiles.*
Figure 4.
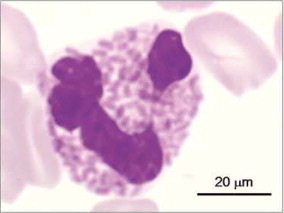
Sang de chat. Granulocyte éosinophile.
Figure 5.

Sang de chien. Lymphocyte.*
Figure 6.

Sang de chien. Monocyte.*
2.6.3. Les hématies
Chez le chien, les hématies ont un diamètre de l’ordre de 5 à 7 μm et un VGM de 64 à 74 fl. Elles sont plus petites chez le chat, avec un VGM de 41 à 51 fl. La durée de vie des hématies est constante dans une espèce donnée. Elle est d’environ 110 jours chez le chien et de 75 jours chez le chat.
L’estimation du nombre d’hématies sur un frottis sanguin ne peut être qu’imprécise. Néanmoins, l’évaluation macroscopique de la couleur du frottis sur un fond blanc peut donner une première impression de la densité érythrocytaire.
La morphologie des hématies peut être étudiée sans coloration pour éviter les artéfacts. La coloration au May-Grünwald-Giemsa (MGG) est néanmoins nécessaire pour visualiser les hématies polychromatophiles (cellules anucléées immatures de couleur bleutée et de taille légèrement supérieure aux hématies matures majoritaires). Il s’agit des précurseurs circulants des hématies matures ( figure 7 ). Ils correspondent aux réticulocytes observés avec une coloration au Nouveau Bleu de Méthylène ou au Bleu de Crésyl brillant.
Figure 7.
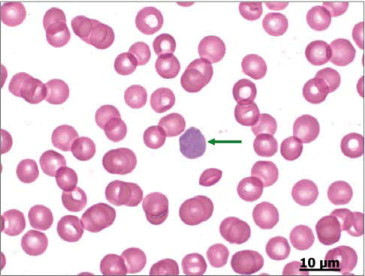
Sang de chien. Hématies et un réticulocyte (flèche verte).*
Avec ces colorations, les réticulocytes sont caractérisés par leurs inclusions punctiformes bleu foncé formant un réseau (complexes ARN-protéines). Chez le chien, une seule catégorie existe ( tableau II ). Les inclusions sont regroupées : on parle de réticulocytes à agrégats. Chez le chat, deux catégories de réticulocytes sont observées : les réticulocytes à agrégats et les réticulocytes ponctués. Les réticulocytes à agrégats possèdent des inclusions regroupées comme chez le chien. Chez le chat, leur nombre augmente modérément et précocement lors d’hémolyse ou d’hémorragie. Ils subissent ensuite une maturation en réticulocytes ponctués. Ces derniers sont caractérisés par des inclusions peu nombreuses et isolées. Leur augmentation est plus tardive et plus massive lors d’hémolyse ou d’hémorragie. La coloration au MGG ne permet pas la mise en évidence de la fraction ponctuée des réticulocytes du chat. La numération des hématies polychromatophiles après coloration au MGG n’est donc pas une bonne méthode de l’évaluation de la réponse médullaire lors d’anémie chez le chat, puisqu’elle ne tient pas compte des réticulocytes ponctués. La lecture du frottis sanguin après coloration spéciale permet de mesurer le pourcentage de réticulocytes dans la population érythrocytaire. Rapporté à la numération d’hématies, il permet le calcul de la numération réticulocytaire absolue.
Tableau II.
Les différents degrés de régénération des anémies chez les carnivores.
| Degré de régénération | Chien Réticulocytes agrégés (par mm3) | Chat Réticulocytes agrégés (par mm3) | Chat Réticulocytes ponctués (par mm3) |
|---|---|---|---|
| Nulle | < 60000 | < 15000 | < 200000 |
| Légère | 150 000 | 50 000 | 500 000 |
| Modérée | 300 000 | 100 000 | 1 000 000 |
| Marquée | > 500 000 | > 200 000 | > 1 500 000 |
Ce tableau met en évidence un nombre de réticulocytes à agrégats bien moindre chez le chat que chez le chien quel que soit le degré de régénération.
D’après Willard et al. 1999.
Exemple. : valeur de la numération réticulocytaire chez un chien présentant une numération globulaire de 7 ×1012/l avec un taux de réticulocytes de 0,5 %.
Numération réticulocytaire = 7 × 0,5 × 10 000 soit 35 000 réticulocytes/mm3.
La numération réticulocytaire peut présenter des variations physiologiques importantes chez le chat et le chien comme le montrent les larges fourchettes de normalité ( tableau I).
Enfin, chez le chat, un faible pourcentage d’hématies (1 %) contient un reliquat nucléaire sous la forme d’une ponctuation basophile appelée corps de Howell-Jolly.
2.6.4. Anomalies qualitatives du frottis sanguin
L’analyse du frottis sanguin permet la mise en évidence d’anomalies cellulaires présentant un intérêt diagnostique pour certaines affections :
-
–
lors de maladie de Carré (virose du chien), des corps d’inclusion sont parfois mis en évidence dans les lymphocytes, les neutrophiles, ou les hématies ;
-
–
lors de leucémies chez le chat et le chien, on peut parfois observer des formes blastiques ou des lymphocytes anormaux avec un cytoplasme vacuolisé et un noyau de forme irrégulière. Chez le chien, on peut également observer une hypersegmentation du noyau des neutrophiles ;
-
–
la présence de vacuoles ou de corps de Döhle (granulations irrégulières, sombres et bleutées) dans le cytoplasme des neutrophiles est un signe de toxémie (septicémie, complications bactériennes d’entérites virales). Le noyau peut être pycnotique et le cytoplasme basophile. On parle de neutrophiles toxiques. Chez le chat, les corps de Döhle sont observés fréquemment à l’état normal. Ils ne constituent pas à eux seuls, dans cette espèce, un critère de toxémie ;
-
–
l’apparition de neutrophiles immatures traduit une régénération de la moelle observée lors de processus inflammatoires, notamment suppurés ;
-
–
la présence de myéloblastes et de promyélocytes, formes précurseurs des granulocytes, est le témoin d’une leucémie myéloblastique pouvant être provoquée chez le chat par le virus leucémogène félin (FeLV). Le myéloblaste et le promyélocyte sont de grandes cellules (15 à 20 μm) qui possèdent un noyau volumineux et excentré. Des nucléoles sont visibles dans le noyau du myéloblaste. Le cytoplasme présente une coloration azur qui s’estompe dans le promyélocyte alors qu’apparaissent des granulations neutrophiles ;
-
–
on peut trouver également des cellules autres que leucocytaires sur un frottis sanguin pathologique : mastocytes chez le chien et le chat (lors de leucémie mastocytaire), plasmocytes chez le chien (myélome multiple), cellules réticulo-endothéliales chez le chat (réticulo-endothéliose provoquée par le FeLV), érythroblastes chez le chien et le chat (lors d’anémie sévère, ou lors d’érythroleucémie provoquée par le FeLV chez le chat), mégacaryocytes chez le chat (lors d’infection au FeLV) ;
-
–
lors d’anémie, l’absence de polychromatophilie est le reflet des états non régénératifs. Chez le chien, la présence de sphérocytes (hématies de petite taille, sphériques, sans décoloration centrale) en nombre élevé peut indiquer une anémie hémolytique à médiation immune. Chez le chat, contrairement à l’homme et au chien, les hématies normales n’ont pas de centre pâle (la forme biconcave est beaucoup moins prononcée) ; ceci rend la détection des sphérocytes très difficile ;
-
–
l’autoagglutination ou la présence de rouleaux peuvent être le signe d’un état inflammatoire chez le chien. Ce phénomène est en effet associé à une synthèse accrue du fibrinogène (protéine de la phase aiguë). Chez le chat, leur présence est davantage normale ;
-
–
les corps de Heinz (inclusions provenant d’une dégénérescence oxydative irréversible de l’hémoglobine, de formes diverses, réfringentes et légèrement protubérantes) sont abondants chez le chat (5 à 10 % des hématies en contiennent). Leur nombre peut augmenter lors d’anémie (en particulier lors d’anémie hémolytique d’origine médicamenteuse). La splénectomie s’accompagne de l’apparition de corps de Heinz chez le chien.
-
–
D’autres modifications morphologiques ont une importance diagnostique moindre, comme l’anisocytose (hématies de taille irrégulière), la poïkilocytose (hématies de forme variable), l’elliptocytose (hématies en majorité ovales), l’échinocytose (hématies en forme d’oursin, avec des aspérités régulières) et la présence d’hématies en cible (le centre et la périphérie sont colorés, l’ensemble prenant l’aspect d’une cible).
3. Valeurs usuelles de l’hémogramme
Les valeurs de références pour l’hémogramme sont données dans le tableau I. Elles concernent les animaux adultes, sachant qu’il existe de nombreuses variations en fonction de l’âge et de l’état physiologique des individus.
3.1. Variations de l’hématocrite et du taux d’hémoglobine
Chez les carnivores domestiques, les valeurs de l’Ht et de l’Hb augmentent pendant la vie fœtale pour atteindre, à la naissance, des valeurs identiques à celles de l’adulte. Pendant les trois premières semaines de vie, on observe une diminution de ces valeurs (de 30 % environ). Cette diminution est liée à une augmentation du volume plasmatique (effet osmotique dû à l’ingestion des protéines du colostrum et effet lié à la croissance rapide du nouveau-né), ainsi qu’à la courte demi-vie des hématies produites in utero. Ces valeurs augmentent ensuite jusqu’à atteindre, vers l’âge de 4 mois, celles de l’âge adulte.
Chez le chiot de 2 à 6 semaines, l’Ht se situe autour de 28 % et la protéinémie peut être inférieure à 60 g/l. Le taux de réticulocytes est supérieur à 3 % pendant les deux premiers mois (avec une valeur très élevée pendant les deux premières semaines : environ 7 %). La capacité de réponse à une hémorragie est généralement bien moindre chez le chiot et le chaton du fait d’une saturation de la production d’hématies par la moelle osseuse pendant cette période de croissance.
Au moment du sevrage, le chaton présente souvent un déficit subclinique en fer qui limite l’érythropoïèse.
Chez le chiot de moins de 5 mois, on peut observer sur le frottis un faible pourcentage d’érythroblastes acidophiles avec un noyau excentré, de petite taille, très fortement basophile (pycnotique).
Après 8 ans, on observe une diminution des valeurs de l’Ht et de l’Hb chez l’animal âgé. Une augmentation est observée chez les animaux séjournant en altitude ou chez la femelle gestante, avec un retour à la normale dans ce dernier cas, 2 à 3 mois après la mise bas.
3.2. Variations leucocytaires
Les variations physiologiques sont plus importantes pour la population leucocytaire. L’état d’excitation et de peur ou un effort physique intense entraînent chez le chien et le chat une augmentation du nombre de neutrophiles circulants. En effet, il existe une balance entre un pool de neutrophiles circulants et un pool de neutrophiles marginés, associés à l’endothélium des capillaires (en particulier pulmonaires). Ces deux pools sont équivalents chez le chien, alors que le pool marginé représente 2 à 3 fois le pool circulant chez le chat. Cette balance est déplacée vers le pool circulant lors de stress. À l’inverse, la tranquillisation s’accompagne d’une diminution des neutrophiles circulants.
À la naissance et jusqu’à l’âge de 6 mois, le nombre de leucocytes est plus élevé chez le chiot que chez le chien adulte (16 × 109/l en moyenne) ; il se produit ensuite une diminution progressive. Les neutrophiles suivent une évolution identique. À l’inverse, le nombre de lymphocytes est plus faible à la naissance que chez l’adulte. Puis, ce nombre augmente progressivement jusqu’à l’âge de 3 mois (6 × 109/l en moyenne) pour diminuer progressivement à partir de 4 à 6 mois. Chez le chat, l’inversion de la formule leucocytaire est assez fréquente jusqu’à l’âge de 8 à 12 mois.
Enfin, la gestation chez la chienne s’accompagne d’une diminution progressive du nombre de neutrophiles.
Dans les chapitres suivants, nous envisagerons successivement l’utilisation de l’hémogramme pour le diagnostic de maladies érythrocytaires ou de maladies leucocytaires.
4. Les maladies érythrocytaires
L’anémie est la maladie érythrocytaire la plus répandue. Elle se caractérise par une insuffisance du taux d’hémoglobine circulante fonctionnelle (Hb < 12 g/dl chez le chien, Hb < 8 g/dl chez le chat). Elle provoque des signes subcliniques (détectés lors d’une approche diagnostique globale) ou cliniques (faiblesse, léthargie, murmure cardiaque, pica).
La valeur de l’hématocrite reflète la gravité de l’anémie. Il faut s’assurer de l’état d’hydratation de l’animal pour interpréter l’Ht (par examen clinique et/ou valeur de la protéinémie). Chez le chien, une anémie est considérée comme légère si l’Ht est compris entre 30 % et 37 %, modérée si l’Ht est compris entre 20 et 29 %, grave si l’Ht est compris entre 13 % et 19 %, très grave si l’Ht est en dessous de 13 %. Chez le chat, l’anémie est considérée comme légère si l’Ht est compris entre 20 % et 26 %, modérée si l’Ht est compris entre 14 % et 19 %, grave si l’Ht est compris entre 10 % et 13 % et très grave si l’Ht est en dessous de 10 %. D’autres critères sont à prendre en compte pour classer l’anémie et décider ou non d’une transfusion sanguine.
La confirmation d’une anémie doit obligatoirement conduire à l’évaluation de l’hématopoïèse. Celle-ci nécessite une quantification des réticulocytes (voir plus haut). La numération réticulocytaire est un bon indicateur de la régénération chez le chat et le chien ( tableau II). Lors d’anémie aigüe régénérative, le délai de réponse médullaire au-delà duquel la réticulocytose apparaît varie de 3 à 5 jours. Le retour à la normale se fait assez rapidement en ce qui concerne les réticulocytes à agrégats (dont la demi-vie n’excède pas une demi-journée). En revanche les réticulocytes à ponctuations du chat ne reviennent à la normale qu’au bout d’un mois (temps de demi-vie de 10 à 12 jours).
4.1. Classification des anémies selon les paramètres érythrocytaires
Le VGM et la CCMH permettent de différencier quatre types d’anémie : normocytaire-normochrome, macrocytaire-hypochrome, microcytaire-hypochrome et macrocytaire normochrome.
4.1.1. L’anémie normocytaire-normochrome
Il s’agit d’une anémie arégénérative (encore appelée anémie centrale) avec trop peu de réticulocytes (ou d’autres macrocytes) pour augmenter le VGM ou diminuer la CCMH. C’est le cas, par exemple, lors d’une anémie par hémorragie ou hémolyse récente.
4.1.2. L’anémie macrocytaire-hypochrome
Il s’agit d’une anémie régénérative (encore appelée anémie périphérique), le plus souvent hémolytique. Les réticulocytes sont à l’origine de l’hypochromie (leur synthèse d’hémoglobine est incomplète) et du caractère macrocytaire (taille légèrement supérieure à celle d’une hématie mature).
4.1.3. L’anémie microcytaire-hypochrome
Ce type d’anémie est souvent diagnostique d’un déficit en fer. Elle est rencontrée par exemple chez le chien avec un shunt porto-systémique.
4.1.4. L’anémie macrocytaire-normochrome
Chez le chat, une anémie macrocytaire-normochrome sans réticulocytose est fréquemment associée aux maladies myéloprolifératives induite par le FeLV. Chez le chien, ce dernier type d’anémie se rencontre lors d’envahissement médullaire tumoral.
4.2. Les anémies régénératives
L’anémie par perte, destruction, ou séquestration des hématies conduit en principe à une régénération par la moelle osseuse. Une numération réticulocytaire chez un chien présentant une anémie hémorragique ou hémolytique peut donner un résultat supérieur à 500 000 réticulocytes/mm3. Dans ce cadre, plus l’anémie est grave, plus la réticulocytose est importante. La production d’hématies peut néanmoins être gênée par un état inflammatoire (qui se surajoute à l’anémie) ou par un déficit protéique ou ferreux consécutif à une hémorragie prolongée. En conclusion, le caractère régénératif d’une anémie est établi par la confrontation du taux d’hémoglobine et de la numération réticulocytaire.
4.2.1. L’anémie par perte
La cause peut être une hémorragie aiguë ou chronique (digestive, uro-génitale, nasale). Il convient d’être attentif à la possibilité d’une hémorragie non apparente, interne ou d’origine digestive.
Les saignements peuvent être liés à un trouble de l’hémostase (voir plus loin). Les hémorragies digestives peuvent reconnaître une origine infectieuse, parasitaire, traumatique (corps étranger) ou pariétale (ulcère, tumeur).
Chez le chien adulte, l’Ht ne reflète pas la sévérité d’une anémie hémorragique pendant les 3 premiers jours après son apparition. En effet, le volume liquidien de l’espace vasculaire n’est pas restauré immédiatement et il n’y a pas encore de dilution des hématies et des protéines plasmatiques. En outre, pendant les premières heures, les contractions spléniques relarguent des hématies dans la circulation sanguine. Le pic de réticulocytose ne se produit que 5 jours après l’hémorragie (délai de réponse médullaire). En cas de résolution de l’hémorragie, le retour à une valeur normale de l’Ht se fait alors en 2 phases. Pendant les 2 premières semaines, l’Ht augmente jusqu’à la valeur basse de l’intervalle de référence ; pendant les deux semaines suivantes, la production d’hématies diminue, mais permet le retour à la normale de l’Ht.
Chez le chat, ainsi que cela a été mentionné plus haut, ce sont les réticulocytes à agrégats qui sont des indicateurs d’une hémorragie récente. Une augmentation des réticulocytes à ponctuations, sans augmentation des réticulocytes à agrégats, permet de dater le début de l’anémie de une à trois semaines.
4.2.2. L’anémie hémolytique
Elle est caractérisée par une anémie régénérative marquée, avec une protéinémie normale, en l’absence d’hémorragie. Elle est souvent associée à un ictère et/ou, chez le chien, à une bilirubinurie.
On distingue les hémolyses extravasculaires et intravasculaires. L’hémolyse extravasculaire résulte de la phagocytose des hématies par les macrophages de la rate, du foie, et de la moelle osseuse ; elle est plus fréquente que l’hémolyse intravasculaire. Elle s’accompagne souvent de splénomégalie et d’hépatomégalie. L’hémolyse intravasculaire s’accompagne d’une anémie souvent plus grave que lors d’une hémolyse extravasculaire. Une hémoglobinurie associée à une hémoglobinémie suggère une hémolyse intravasculaire. L’ictère peut apparaître dans les deux types d’hémolyse. La concentration sanguine de bilirubine non conjuguée augmente lors d’ictère hémolytique, de même que la bilirubine conjuguée dont une partie contribue à l’apparition d’une bilirubinurie.
L’anémie à corps de Heinz et l’anémie hémolytique à médiation immune (AHMI) sont les causes principales d’hémolyse intravasculaire.
L’anémie hémolytique à médiation immune (AHMI) est particulièrement fréquente chez le chien. Les origines d’une AHMI chez les carnivores domestiques sont multiples :
-
–
infectieuses (hémobartonellose féline, virus leucémogène félin [FeLV], piroplasmose ou babésiose canine) ;
-
–
toxiques (propylthiouracyle [antityroïdien de synthèse de la famille des thionamides] chez le chat, lévamisole [anthelminthique de la famille des imidazothiazoles] chez le chien) ;
-
–
incompatibilité transfusionnelle ;
-
–
auto-immunes (lymphome chez le chat, lupus érythémateux disséminé ou polyarthrite rhumatoïde chez le chien).
La babésiose canine et l’hémobartonellose féline peuvent être confirmées par la mise en évidence de Babesia canis (protozoaire)/Haemobartonella felis (rickettsie) sur un frottis sanguin. La ponction d’une goutte de sang périphérique (réalisée à la face interne de l’oreille) est préférable à une prise de sang veineux (les Babesia du chien et Haemobartonella du chat sont plus nombreuses dans les hématies des capillaires périphériques). Après coloration au MGG, les protozoaires (B. canis) apparaissent sous une forme ovale ou piriforme le plus souvent. Leur cytoplasme est très marqué (coloration rouge foncé) et repoussé en périphérie par une vacuole centrale ne prenant pas le colorant. H. felis est plus difficile à voir étant donné sa petite taille. L’agent infectieux se présente à la surface des hématies sous la forme de petits éléments coccoïdes, bacillaires ou annulaires (avec les colorants usuels). L’aspect régénératif peut être absent en début d’infection ou lorsqu’il existe une maladie intercurrente (FeLV, atteinte de la moelle osseuse) limitant la régénération.
Le diagnostic de l’AHMI repose sur le test de Coombs, sur l’identification d’un nombre significatif de sphérocytes ( figure 11), ou sur l’observation d’une auto-agglutination.
-
•
Dans le test de Coombs, des anticorps spécifiques d’espèces réagissent avec les anticorps présents à la surface des hématies, provoquant une hémagglutination. La spécificité et la sensibilité de ce test ne sont pas très fortes. Ainsi, chez le chien, 30 % des animaux atteints d’AHMI présentent un résultat négatif au test de Coombs.
-
•
La sphérocytose est difficile à mettre en évidence chez le chien et ne peut être retenu comme critère diagnostique chez le chat. L’observation se fait à l’objectif 100 et l’on utilise une échelle notée de + à ++++ : + correspond à une moyenne de 5 à 10 sphérocytes par champ (soit 2 à 4 % des hématies), ++ à une moyenne de 11 à 50 (4 à 20 %), +++ à une moyenne de 51 à 150 (20 à 60 %) et ++++ à plus de 150 sphérocytes par champ (> 60 %). À partir de ++ on peut poser le diagnostic d’AHMI, chez le chien, avec un faible risque d’erreur.
-
•
L’autoagglutination spontanée des hématies équivaut à un test de Coombs positif. Afin de distinguer ce phénomène de la présence de rouleaux, on ajoute à une goutte de sang le même volume de sérum physiologique. La solution saline dispersera les cellules formant des rouleaux tandis que l’autoagglutination persistera.
Figure 11.

Quelques exemples de morphologies des hématies sur un frottis sanguin
D’après Willard et al., 2000.
Par ailleurs, des toxines oxydantes peuvent provoquer une précipitation de l’Hb sous forme de corps de Heinz. Ceux-ci apparaissent légèrement plus clairs que les hématies ; ils bourgeonnent parfois à leur surface, et peuvent même s’extruder. L’ingestion d’oignons, le cuivre, la vitamine K3 et le bleu de méthylène induisent l’apparition d’anémie à corps de Heinz chez le chien. L’apparition de corps de Heinz est fréquente chez le chat et n’est donc pas, dans cette espèce, spécifique d’une anémie toxique. Elle peut être liée au régime alimentaire (à base de saumon), associée à des pathologies favorisant l’apparition d’intermédiaires métaboliques oxydants (diabète, hyperthyroïdie, lymphome). Le bleu de méthylène, le propylène glycol et la phénazopyridine (antiseptique urinaire) peuvent provoquer une anémie à corps de Heinz. Par comparaison avec le chien, ceux-ci ont une taille plus importante chez le chat (jusqu’à 3 μm de diamètre).
4.3. Les anémies arégénératives
Elles sont normalement normochromes et normocytaires. Lorsque l’anémie arégénérative est confirmée (le taux de réticulocytes n’a pas augmenté sur deux numérations à une semaine d’intervalle), il est nécessaire d’effectuer un myélogramme (non discuté dans cet article) pour établir le diagnostic étiologique.
En effet, on distingue les anémies centrales primaires et secondaires. L’anémie centrale secondaire représente une complication d’une maladie systémique alors que les anémies centrales primaires sont provoquées par des maladies primitives de la moelle osseuse. Dans le cas d’une anémie secondaire, on trouve dans la moelle osseuse un nombre adéquat de cellules érythroïdes, avec un aspect normal. Dans le cas d’une anémie primaire, on trouve des anomalies d’une ou plusieurs populations cellulaires de la moelle osseuse, selon la pathologie impliquée.
4.3.1. L’anémie secondaire
Elle est due soit à une inflammation chronique, soit à une insuffisance organique chronique (rénale ou hépatique). Durant l’inflammation, la synthèse des cytokines (IL-1, IL-6 et TNF) provoque une séquestration de fer dans les macrophages, limitant ainsi l’érythropoïèse.
Ces anémies secondaires sont souvent légères à modérées (chez le chien, 8 < Hb < 12 g/dl ; chez le chat, 6 < Hb < 8 g/dl), et classées comme hyporégénératives (numération réticulocytaire faiblement élevée).
Dans l’insuffisance rénale chronique, le mécanisme conduisant à l’anémie est plus complexe qu’un simple déficit en érythropoïétine. Une thérapie utilisant cette molécule donnera cependant de bons résultats.
L’anémie lors d’insuffisance hépatique chronique est une conséquence de la baisse de synthèse de facteurs de la coagulation (pouvant provoquer des hémorragies) et d’un déficit en promoteurs de l’hématopoïèse.
4.3.2. L’anémie primaire
4.3.2.1. Les atteintes médullaires
Plusieurs affections sont décrites : on distingue la pancytopénie, la myélofibrose, l’aplasie de la lignée érythroblastique, la dysérythropoïèse, l’envahissement médullaire.
On parle de pancytopénie lorsque l’anémie se complique d’une leucopénie et/ou d’une thrombocytopénie (pancytopénie ou bicytopénie). Du fait de la durée de vie plus longue des hématies, l’anémie arégénérative est généralement détectée plus tardivement que la leucopénie ou la thrombocytopénie. Lors d’infiltration du tissu médullaire par du tissu fibreux, on parle de myélofibrose.
Les causes de pancytopénie sont les intoxications médicamenteuses, les infections, les maladies auto-immunes
L’aplasie de la lignée érythroblastique provoque, en général, une grave anémie. L’étiologie est le plus souvent d’origine immunitaire et la réaction de Coombs est parfois positive.
Lors de dysérythropoïèse, le myélogramme montre une quantité normale à augmentée d’érythroblastes (des altérations morphologiques peuvent être observées). Néanmoins, ces cellules meurent en général avant leur passage dans le sang. Ces dysérythropoïèses peuvent provenir d’un déficit en folates et vitamine B12, d’une carence en fer, d’une intoxication, d’une altération génétique acquise ou héréditaire.
Les maladies myéloprolifératives peuvent être détectées par le myélogramme associées ou non à la présence de cellules atypiques dans le sang.
4.3.2.2. Les érythroblastopénies toxiques
Elles sont peu fréquentes chez le chat et le chien. Une toxicité des œstrogènes est décrite chez le chien (œstrogènes de synthèse, tumeur testiculaire ou ovarienne). Chez le chat, la griséofulvine, antifongique utilisé dans le traitement de la teigne, peut provoquer une anémie lorsqu’elle est surdosée (au-delà de 80 mg/kg). La radiothérapie et la chimiothérapie anticancéreuses peuvent également provoquer une pancytopénie.
4.3.2.3. Les infections
L’ehrlichiose à Ehrlichia canis peut provoquer une thrombocytopénie et une leucopénie en plus de l’anémie arégénérative (on appelle aussi cette rickettsiose la pancytopénie tropicale canine). Elle se rencontre dans les pays du bassin méditerranéen. Le test de Coombs peut être positif chez certains chiens.
L’infection par le virus leucémogène félin (FeLV) est souvent associée à des anémies arégénératives chez le chat. Une macrocytose (VGM supérieur à 52 fl) sans augmentation de la numération réticulocytaire est un signe fortement évocateur d’infection par le FeLV.
4.3.2.4. L’anémie martiale (appelée aussi ferriprive)
Elle est peu fréquente chez le chien. On l’observe plus volontiers chez le chiot et le chaton par carence d’apport ou d’absorption avant le sevrage surtout, éventuellement chez le chien plus âgé porteur d’une lésion (par exemple une tumeur digestive) provoquant des saignements modérés chroniques. Ce type d’anémie est le plus souvent hypochrome et microcytaire.
5. Les maladies leucocytaires
L’hémogramme permet des observations quantitatives et qualitatives des leucocytes circulant dans le sang périphérique. Le leucogramme résulte d’une balance entre la production par la moelle osseuse, la distribution dans le système vasculaire et le passage vers les tissus des leucocytes.
5.1. Leucocytose et neutrophilie
La leucocytose est souvent synonyme de neutrophilie. Parmi les causes de neutrophilie, on retrouve l’inflammation, le stress, le traitement par les corticoïdes, l’exercice, la leucémie granulocytaire (rare).
5.1.1. Inflammation
Plus de 1 000 neutrophiles non-segmentés (immatures)/mm3 ou bien une leucocytose marquée (supérieure à 30 000/mm3 chez le chat ou supérieure à 40 000/mm3 chez le chien) sont évocateurs d’une inflammation.
Le pronostic associé à une maladie inflammatoire dépend de la numération leucocytaire. Ainsi chez le chien, une leucocytose supérieure à 60 000 cellules/mm3 signe un pronostic défavorable. D’autres critères sont à prendre en compte : une prépondérance de formes immatures, une réaction leucémoïde, une fraction significative de leucocytes toxiques, une lymphopénie sévère ou persistante sont de mauvais indicateurs du pronostic. La réaction leucémoïde correspond à une leucocytose élevée associée à une infection sévère localisée (pyomètre, abcès de paroi, etc.) qui ne peut être traitée spontanément par un drainage du pus et dont la lésion n’est pas pénétrée par les antibiotiques. Malgré la production excessive de neutrophiles, la maladie inflammatoire n’est pas corrigée. On peut la confondre avec une leucémie granulocytaire dont elle se distingue cependant par l’absence de cellules blastiques. La présence de neutrophiles toxiques est un signe de toxémie bactérienne. Ainsi, une abondance de neutrophiles toxiques associée à une diarrhée hémorragique chez un chiot suggère une absorption importante de toxines bactériennes à travers l’intestin endommagé.
5.1.2. Stress et traitement aux corticoïdes
Ils induisent fréquemment une leucocytose modérée avec une neutrophilie à cellules matures, une lymphopénie et une éosinophilie. Chez le chien, une monocytose modérée peut également survenir (2 500 cellules/mm3). Dans cette espèce, la numération des leucocytes se situe typiquement entre 15 000 à 25 000 cellules/mm3 en réponse à une corticothérapie. La neutrophilie se développe en 4 à 12 heures pour revenir à sa valeur basale en moins de 24 heures. On peut observer une hypersegmentation nucléaire des neutrophiles liée à une augmentation de leur demi-vie et à une diminution de leur passage du sang vers les tissus.
Une décharge d’adrénaline, consécutive à une peur ou à un exercice violent, provoque une leucocytose transitoire par déplacement des neutrophiles marginés vers le courant sanguin. Ceci est particulièrement visible chez le chat. En effet, le taux de neutrophiles marginés est nettement supérieur à celui des neutrophiles circulants dans cette espèce.
5.2. Leucopénie et neutropénie
Elles sont rarement observées chez les carnivores domestiques. Les deux causes de leur apparition sont soit une inflammation très sévère (péritonite, septicémie) avec consommation tissulaire des neutrophiles (on peut dans ce cas observer l’apparition dans le sang de formes très immatures : myélocytes, promyélocytes), soit une maladie primaire de la moelle osseuse. Le myélogramme est souvent nécessaire pour distinguer entre ces deux causes. Nous ne discuterons pas dans cet article de l’intérêt diagnostique de la ponction de moelle osseuse.
5.3. Monocytose et monocytopénie
La monocytose est plus fréquente chez le chien que chez le chat. Les monocytes contribuent à restaurer le capital tissulaire de macrophages (cellule de Küpffer, macrophages alvéolaires, cellules microgliales, histiocytes, etc.). Les causes d’une monocytose sont multiples : inflammation, nécrose, tumeur, maladie hémorragique ou hémolytique, maladie à médiation immune. Une monocytose extrême peut révéler une leucémie. À l’inverse, une monocytopénie est rarement significative.
5.4. Lymphocytose
Une lymphocytose persistante résulte en général d’une stimulation immunitaire forte, consécutive à une infection chronique, une virémie, une maladie à médiation immune, ou une immunisation récente. La maladie chronique peut être confirmée par une hyperprotéinémie (gammapathie polyclonale), la présence de lymphocytes réactionnels, un examen cytologique caractéristique d’une inflammation, l’hyperplasie des nœuds lymphatiques. Plus rarement, une lymphocytose permanente traduira une tumeur lymphoïde (lymphome, leucémie lymphocytaire chronique).
Les lymphocytes réactionnels ont une taille plus grande que les lymphocytes normaux, avec un cytoplasme bleu-sombre irrégulier. Ils peuvent apparaître chez l’animal jeune en l’absence de leucémie lymphoïde, ou chez l’animal récemment vacciné. Leur nombre ne reflète pas le degré de stimulation antigénique et n’est pas caractéristique d’une maladie spécifique.
5.5. Lymphopénie et éosinopénie
L’éosinopénie est plus difficile à identifier du fait d’une faible participation des éosinophiles au leucogramme. La lymphopénie correspond le plus souvent à un stress important ou à un traitement par les corticoïdes. Le taux de lymphocytes diminue donc rapidement lors d’affection aiguë. Son retour à la normale est un critère de pronostic favorable. La perte de lymphe (chylothorax, lymphangiectasie, entéropathie exsudative) et l’interruption de la circulation lymphatique (lors de maladies inflammatoires, infectieuses ou cancéreuses) peut provoquer une lymphopénie. Certaines maladies virales peuvent également provoquer une lymphopénie (en particulier par destruction de tissus lymphoïdes) : chez le chien, c’est le cas pour la maladie de Carré (paramyxovirus), l’hépatite contagieuse (adénovirus canin de type I), les entérites à parvovirus et coronavirus, et, chez le chat, pour le typhus (panleucopénie à parvovirus) et la maladie leucémogène (FeLV).
5.6. Eosinophilie
Les éosinophiles jouent un rôle important dans la défense contre les parasites intra-tissulaires (divers nématodes et filaire cardio-pulmonaire du chien, douve pulmonaire), dans la régulation des réactions d’hypersensibilité de type I (IgE) et lors d’inflammation. L’éosinophilie tissulaire peut ne pas s’accompagner d’éosinophilie circulante (en raison de la courte demi-vie des éosinophiles dans le sang). Une éosinophilie circulante évoque donc un parasitisme tissulaire, un syndrome éosinophilique chez le chat, ou une réaction d’hypersensibilité. Les leucémies éosinophiliques sont extrêmement rares.
5.7. Basophilie
La basophilie doit représenter 3 à 6 % du leucogramme pour être facilement détectable. En effet, les basophiles sont normalement rares et difficiles à détecter chez le chat et le chien. La basophilie se produit essentiellement en deux occasions : parasitisme (dirofilariose) et réaction d’hypersensibilité.
Quelques règles générales peuvent résumer cette approche étiologique des anomalies leucocytaires chez les carnivores domestiques :
-
–
la neutrophilie traduit une maladie infectieuse (notamment bactérienne) ; une forte neutrophilie est observée lors d’infection suppurée ;
-
–
la neutropénie se produit lors de lésions médullaires graves d’origine virale, tumorale ou toxique ;
-
–
une monocytose indique l’existence d’une affection mais n’est pas spécifique ;
-
–
une lymphocytose persistante résulte d’une infection chronique ;
-
–
la lymphopénie signe un stress ou un traitement par les glucocorticoïdes ;
-
–
l’éosinophilie traduit une hypersensibilité de type I ou des infestations parasitaires tissulaires ;
-
–
enfin, il existe peu de variations des basophiles.
6. L’hémogramme chez les herbivores domestiques
Les normes hématologiques et leurs modifications physiologiques et pathologiques seront étudiées chez les bovins et le cheval.
6.1. Hématologie normale des bovins et du cheval
6.1.1. Hématologie normale des bovins
Les valeurs usuelles sont résumées dans le tableau I. Elles sont influencées par la race : les races allaitantes ont ainsi des valeurs de numération érythrocytaire plus élevées que les races laitières. Les mâles ont des valeurs de numération érythrocytaire significativement augmentées par comparaison aux femelles. Chez ces dernières, la lactation s’accompagne d’une diminution des valeurs de numération leucocytaire et érythrocytaire. Des modifications saisonnières sont aussi observées, affectant la numération érythrocytaire, en relation avec le parasitisme. De même, le pâturage d’altitude peut produire une augmentation de la valeur de l’hématocrite de l’ordre de 10 à 15 %. Chez le veau, la numération globulaire, le volume globulaire moyen et le taux d’hémoglobine sont élevés à la naissance, puis diminuent peu à peu avec l’âge.
L’hématie bovine, biconcave, a un diamètre moyen de l’ordre de 5 à 6 μm et une durée de vie relativement longue, de l’ordre de 130 jours. Elle se caractérise par une anisocytose légère à modérée et parfois des acanthocytes sont visibles sur le frottis d’animaux sains. La formation de rouleaux n’est pas observée en dehors des états inflammatoires.
Chez les ruminants, seule l’hématie mature rejoint la circulation sanguine, contrairement à la plupart des espèces pour lesquelles c’est le réticulocyte. Les réticulocytes sont donc généralement observés chez les ruminants lors d’une anémie. Cette présence est, à elle seule, significative du caractère régénératif de l’anémie. Si l’on n’observe pas de réticulocytes, l’anémie n’est pas toujours arégénérative car l’apparition des réticulocytes est assez tardive chez les ruminants. Seule la présence de réticulocytes est donc interprétable chez le bovin. La présence d’érythroblastes est également possible en cas d’anémie régénérative sévère chez les ruminants. Les hématies à corps de Heinz, à risque d’hémolyse intravasculaire, apparaissent chez les bovins surtout lors d’intoxication par certaines plantes (notamment de la famille des Brassicacées).
Dans la lignée myéloïde, la maturation du myélocyte en métamyélocyte puis en granulocyte non segmenté présente une particularité chez les bovins : dans cette espèce, contrairement aux carnivores, les granulocytes non segmentés ne passent presque pas dans le torrent sanguin. Il est donc rare d’en observer sur un frottis. Les granulocytes neutrophiles sont les plus nombreux des granulocytes. Ils ont un cytoplasme éosinophile en raison de la présence de grandes granulations, de type tertiaire, avec une activité antimicrobienne plus marquée que dans les autres espèces.
Les granulocytes éosinophiles sont moins nombreux, il est même possible de ne pas en observer. Sur un frottis, ces cellules possèdent de nombreuses petites granulations éosinophiles sphériques intensément colorées ( figure 8 ). Une éosinophilie saisonnière reflète les phénomènes d’infestation parasitaire helminthique. Enfin, les granulocytes basophiles sont les granulocytes les moins nombreux, il est même fréquent de ne pas en observer.
Figure 8.
Sang de vache. Granulocyte éosinophile.
Les numérations granulocytaires peuvent varier avec l’âge et le stade physiologique. Chez le veau, les granulocytes neutrophiles ont une numération plus élevée que chez l’adulte, et ce sont les leucocytes les plus nombreux. Ils diminuent peu à peu, cédant la place aux lymphocytes dès deux semaines d’âge. À trois mois, les lymphocytes représentent 70 à 80 % du total des leucocytes. Leur numération subit une diminution avec le vieillissement de l’animal. Les lymphocytes bovins ont un diamètre de 8 à 15 μm. Les plus grands lymphocytes ne sont parfois distinguables des monocytes que sur la base de marquages cytochimiques ou immunocytochimiques. Les monocytes des ruminants ont un diamètre de 13 à 19 μm. Ils contiennent généralement des vacuoles de taille variable et de petites granulations sont parfois visibles.
La gestation n’entraîne pas de modifications majeures dans les comptages granulocytaires. Le stress du vêlage entraîne en revanche une neutrophilie physiologique, due à la libération de corticostéroïdes endogènes. De la même manière tout stress, celui de la contention inclus, peut entraîner une neutrophilie modérée par remise en circulation d’une partie des granulocytes marginés. Ce phénomène est cependant de moindre amplitude que pour le cheval et les carnivores domestiques. Chez le bovin adulte, l’âge a peu d’influence sur le nombre de granulocytes neutrophiles. Les éosinophiles, en revanche, semblent augmenter en nombre durant les 2 à 6 premières années de vie, puis se stabilisent.
Enfin, les plaquettes sanguines des bovins sont de taille et de forme variables avec des granulations azurophiles bien visibles.
6.1.2. Hématologie normale du cheval
Les équidés domestiques (cheval, âne, et leur hybride, la mule) ne présentent que des différences hématologiques mineures ; il en va de même pour les différentes races de chevaux. La principale différence est un hématocrite au repos légèrement supérieur chez les chevaux pur-sang par comparaison avec les chevaux de trait et les poneys.
L’hématie du cheval, de forme biconcave, présente un diamètre de 5 à 6 μm, un VGM de 44 à 52 fl, et une longue durée de vie de 140 à 155 jours (plus élevée que chez les carnivores). Les réticulocytes acquièrent leur maturation complète avant de quitter la moelle osseuse, entraînant une absence de réticulocytes circulant dans cette espèce dans les conditions normales. De ce fait, la numération des réticulocytes ne pourra être effectuée en pratique et seul un myélogramme pourra attester du caractère régénératif ou non d’une anémie.
L’accélération de l’érythropoïèse apparaît plus lente chez le cheval que dans les autres espèces. Lors d’anémie, seuls quelques réticulocytes polychromatophiles pénètrent la circulation périphérique et peuvent suffire à induire une macrocytose. Une anémie avec un hématocrite inférieur à 25 % peut nécessiter une semaine avant que la réponse médullaire ne se traduise par une élévation du VGM.
La formation de méthémoglobine et de corps de Heinz est observable chez les chevaux traités par des molécules oxydatives ou des médicaments contenant des dérivés oxydés et comme la phénothiazine.
Le sang de cheval normal présente un taux de sédimentation rapide des hématies ce qui se traduit par la formation de rouleaux, visibles sur le frottis. De ce fait, un mélange correct de l’échantillon sanguin doit être effectué avant prélèvement de l’aliquote nécessaire au comptage cellulaire.
L’exercice intense induit une augmentation importante de la viscosité sanguine par élévation de l’hématocrite, consécutive aux contractions de la rate (sous l’effet de l’adrénaline) et à une diminution du volume plasmatique. L’Ht passe de valeurs de 32-38 % à des valeurs de 58-72 % après exercice ou excitation. L’élévation de la viscosité sanguine est un des facteurs de causalité de survenue d’hémorragie pulmonaire, de sévérité variable, survenant chez de nombreux chevaux de course. Lors de colique, on peut observer une élévation de l’hématocrite dans les mêmes proportions, augmentant ainsi la viscosité sanguine et la charge cardiaque, et assombrissant en général le pronostic.
Les lymphocytes sont plus nombreux chez le cheval que chez les carnivores. Ils représentent environ 50 % de la population leucocytaire. Chez le poulain nouveau-né, les éosinophiles sont absents, les monocytes sont en nombre variable, et les neutrophiles sont environ 2,5 fois plus nombreux que les lymphocytes (on compte moins de 1 000 lymphocytes par mm3), mais la population lymphocytaire atteint la valeur usuelle de l’adulte en quelques mois. On peut observer une lymphocytose transitoire importante chez des chevaux particulièrement agités. En outre, le groupe de granulocytes neutrophiles marginés étant à peu près aussi important que celui du groupe de granulocytes neutrophiles circulants, la numération leucocytaire est susceptible de doubler avec l’excitation.
Le cheval possède moins de granulocytes neutrophiles immatures, non segmentés, que le chien. Les neutrophiles segmentés ont un noyau aux contours irréguliers qui le distingue du noyau lisse typique du neutrophile canin. Les formes jeunes sont plutôt représentées par des granulocytes neutrophiles au noyau peu lobé ou hyposegmentés. Les étapes de la maturation des granulocytes s’accompagnent en effet d’une lobation nucléaire progressive, résultat d’une condensation de la chromatine. L’hyposegmentation est le signe le plus précoce d’une réponse régénérative accélérée avec passage de granulocytes neutrophiles de la moelle osseuse dans le sang périphérique. Les granulocytes neutrophiles hypersegmentés (cellules âgées) ne sont visibles dans le sang périphérique que sous l’effet des corticoïdes, qui inhibent en effet leur sortie du compartiment vasculaire. Les autres effets des corticoïdes sont, outre la neutrophilie, une lymphopénie (par séquestration des cellules dans les tissus lymphoïdes) et une éosinopénie (par séquestration dans la moelle osseuse).
Les granulocytes éosinophiles comportent de volumineuses granulations caractéristiques masquant parfois le noyau de la cellule ( figure 9 ).
Figure 9.

Sang de cheval. Granulocyte éosinophile.
On peut observer des granulocytes basophiles sur les frottis sanguins chez le cheval. Leurs granulations sont nombreuses, de petite taille et fortement colorées ( figure 10 ).
Figure 10.

Sang de cheval. Granulocyte basophile.
Les lymphocytes et monocytes ont une morphologie similaire à ceux des autres espèces.
Enfin, les numérations sanguines en plaquettes sont, chez le cheval, parmi les plus basses observées chez les mammifères. Leurs granulations sont fines et difficiles à observer.
6.2. La réponse leucocytaire chez les bovins et le cheval
6.2.1. La réponse leucocytaire chez les bovins
La réponse leucocytaire diffère souvent entre les ruminants et les autres espèces. Elle est rarement spécifique d’une pathologie, mais peut orienter le diagnostic, en particulier lors de septicémie ou d’endotoxémie. Une infection bactérienne aiguë se caractérise souvent par une neutropénie plutôt qu’une neutrophilie et la tendance à développer une neutrophilie significative est moindre chez les ruminants. Une numération leucocytaire totale de 20 à 30 × 103/mm3 est significative chez les bovins, comparée à des valeurs de 50 à 100 × 103/mm3 chez le chien dans des conditions similaires. Une concentration augmentée du fibrinogène peut s’avérer un indicateur plus sensible de l’inflammation aiguë ou chronique, chez les bovins, qu’une modification de la numération leucocytaire. Une formule leucocytaire modifiée, associée à une numération leucocytaire totale non modifiée, est souvent caractéristique de l’inflammation. Le rapport « neutrophiles/lymphocytes » normalement bas chez les bovins (0,5) par comparaison avec les autres espèces (3,5 chez le chien, 1,8 chez le chat), peut prédisposer le ruminant à des délais de réponse plus élevés du fait d’un taux plus faible d’accélération de la myélopoïèse. Le facteur limitant, chez le ruminant, s’avère être la vitesse de reconstitution des réserves de granulocytes dans la moelle osseuse. Cette vitesse est environ deux fois moindre par comparaison au chien.
On peut observer les modifications de numération suivantes pour chaque population leucocytaire.
6.2.1.1. Les granulocytes neutrophiles
Une neutropénie peut s’observer au début de phénomènes inflammatoires suppurés, car les bovins ont une réserve médullaire de leucocytes inférieure aux autres espèces (voir ci-dessus). Cependant, cette neutropénie est vite remplacée par une neutrophilie. Lors d’endotoxémie, une neutrophilie « rebond », après une phase de neutropénie est un indicateur d’un bon pronostic.
6.2.1.2. Les granulocytes éosinophiles
L’ésosinopénie est rare et difficile à évaluer, étant donné le faible nombre d’éosinophiles présents chez un individu sain. L’éosinophilie est assez rare chez les bovins, cependant elle se rencontre particulièrement lors d’infestations parasitaires (fréquentes dans cette espèce). On peut ainsi retrouver une éosinophilie saisonnière, qui suit les infestations parasitaires. On observe aussi une éosinophilie lors de maladies respiratoires allergiques, de certaines dermatoses, et une forte éosinophilie est observée lors de réactions d’hypersensibilité de type I.
6.2.1.3. Les granulocytes basophiles
Les variations sont très rares et difficiles à interpréter. Une basophilie peut être observée lors de certaines dermatites allergiques.
6.2.1.4. Les monocytes
Ils sont peu nombreux chez les bovins. La monocytopénie peut s’observer lors de virémies ou lors du relargage d’endotoxines. Une monocytopénie transitoire peut survenir lors de stress (effet des corticostéroïdes), elle est alors suivie d’une monocytose. On peut observer une monocytose lors d’inflammation chronique.
6.2.1.5. Les lymphocytes
À la différence de nombreuses espèces, les lymphocytes sont les leucocytes les plus nombreux. La lymphocytose est peu fréquente et s’observe parfois lors d’infections virales (dans 30 % des cas de leucose bovine) ou lors de maladie auto-immune. Une lymphopénie est présente lors de maladie virale aiguë, d’infection bactérienne sévère, de septicémie, de rickettsioses, de malnutrition, d’immunodéficience. Une lymphopénie persistante est un indicateur d’un pronostic réservé.
6.2.2. La réponse leucocytaire chez le cheval
La leucocytose est considérée comme modérée entre 14 000 et 20 000 leucocytes/mm3, significative entre 20 000 et 30 000 leucocytes/mm3, et extrême au-delà de 30 000 leucocytes/mm3. Une leucocytose significative apparaît chez le cheval pour des valeurs de numération inférieures à celles observées pour le chien et le chat.
La leucopénie est une découverte significative, qui résulte habituellement d’une neutropénie, puisque les neutrophiles sont les leucocytes circulants prédominants chez le cheval sain. Les maladies responsables de leucopénie (neutropénie) sont en général aiguës et sévères. La neutropénie augmente le risque, pour le patient, d’une infection bactérienne secondaire. Les intervalles de référence déterminés par la plupart des laboratoires sont très larges car ils incluent les différents âges et races. Les différences entre sexes sont peu significatives.
L’exposition du neutrophile à des endotoxines modifie l’aspect du cytoplasme (basophilie, vacuolisation, corps de Döhle, granulation toxique pourpre). L’infection à Ehrlichia equi fait apparaître des neutrophiles avec des inclusions en forme de mûres. Les éosinophiles sont plus grands que les neutrophiles et présentent un noyau lobulé avec une chromatine moins condensée que les neutrophiles. Comparés à des framboises, les éosinophiles contiennent de multiples gros granules ronds, de taille uniforme, brillants, et de couleur rouge-orange.
Les modifications du leucogramme peuvent se classer en leucocytoses et en cytopénies.
6.2.2.1. Les leucogrammes caractérisés par une leucocytose
-
◊
Les effets associés à l’inflammation et à l’infection
L’inflammation se caractérise par la présence de neutrophiles immatures dans la circulation : neutrophiles non segmentés (NNS), mais aussi par des précurseurs moins matures. L’aspect significatif du leucogramme correspond à un nombre de NNS supérieur à 300/mm3, et un nombre total de leucocytes supérieur ou à l’intérieur de l’intervalle de référence. Lors de neutropénie (leucopénie), le leucogramme est significatif d’une inflammation si les NNS représentent au moins 10 % de la population des neutrophiles. Si le nombre de NNS excède celui des neutrophiles segmentés, le pronostic est réservé. Si en outre on observe des modifications toxiques des neutrophiles et une neutropénie, le pronostic devient mauvais. Si la source de toxine disparaît, les altérations cytologiques disparaissent à leur tour en 24 h. Leur disparition, associée à une augmentation des neutrophiles est de bon augure.
L’inflammation chronique est plus difficile à reconnaître. La leucocytose s’accompagne d’une neutrophilie mature car la granulopoïèse, lorsqu’elle est augmentée depuis plus d’une semaine, a permis de reconstituer les stocks cellulaires de la moelle osseuse, de telle sorte que seuls les neutrophiles matures sont relargués dans la circulation. Dans ce cas, le rapport entre la concentration en protéines plasmatiques et le fibrinogène, s’il est inférieur à 10, peut conforter le diagnostic d’inflammation.
-
◊
L’éosinophilie
Elle est peu fréquente chez le cheval, et peut passer inaperçue lorsqu’elle est présente. Causée par une exposition à des parasites ou des allergènes, elle peut néanmoins être absente chez des chevaux présentant une forte infestation de parasites intestinaux.
-
◊
Les leucémies
Les leucémies sont rares chez le cheval, la forme la plus fréquente étant la leucémie lymphocytaire. Le plus souvent, elle s’accompagne d’une lymphocytose, et de la présence de cellules anormales sur le frottis sanguin.
6.2.2.2. Les leucogrammes caractérisés par des cytopénies
-
◊
La lymphopénie
La lymphopénie est associée à la réponse au stress et aux corticostéroïdes. Elle peut également être observée lors de maladies inflammatoires sévères, et lors d’infection. Elle est observée rarement lors de chylothorax chez le cheval.
-
◊
La monocytopénie et la basopénie
Si elle est présente, la monocytopénie n’a pas de signification clinique. L’éosinopénie peut correspondre à la réponse au stress et aux corticostéroïdes. La basopénie n’a pas de signification clinique, quand bien même elle serait mise en évidence.
-
◊
La neutropénie
Elle prédispose le patient à l’infection et présente donc un intérêt clinique. Trois mécanismes majeurs provoquent une neutropénie :-
–une absence de production de granulocytes neutrophiles, ce qui est rare ;
-
–une exposition à des endotoxines qui peut provoquer une redistribution des granulocytes neutrophiles circulants vers les neutrophiles marginés ;
-
–et, principal mécanisme, une utilisation périphérique accrue des neutrophiles, ou une survie réduite. La réserve de neutrophiles matures dans la moelle osseuse du cheval sain est suffisante pour environ 5 jours, mais cette réserve peut être rapidement utilisée lors de maladie infectieuse grave.
-
–
7. L’hémostase
L’exploration de l’hémostase se justifie lors de saignement inexpliqué ou disproportionné, ou dans le cadre d’une exploration hépatique. Une anomalie de l’hémostase peut concerner l’un des quatre composants suivants : les vaisseaux sanguins, les plaquettes (hémostase primaire), le système de la coagulation (hémostase secondaire) et le système de la fibrinolyse.
Les tests biologiques permettent, en complément des commémoratifs et des signes cliniques, d’établir une classification du déficit (hémostase primaire ou secondaire). Les petites hémorragies (pétéchies, ecchymoses) suggèrent un défaut vasculaire ou plaquettaire. L’épistaxis est souvent associée à un défaut plaquettaire (thrombopathie). À l’inverse, les défauts de coagulation (coagulopathies) sont caractérisés par des hémorragies importantes et profondes (hématome, épanchements hémorragiques : hémarthrose, hémopéritoine, hémothorax).
Cinq tests sont utilisés en médecine vétérinaire pour l’exploration courante de l’hémostase. Certaines situations ne nécessitent qu’un seul test : facteur von Villebrand (FvW) en préopératoire chez le chien Doberman, taux de prothrombine (TP) lors de suspicion d’intoxication par les rodenticides.
Le profil recommandé inclut :
-
–
la numération plaquettaire (NP) et le temps de saignement de la muqueuse buccale (TSMB), pour l’exploration plaquettaire ;
-
–
le temps de thromboplastine partiellement activé (TTPA), également appelé temps de céphaline activé, pour l’exploration des voies intrinsèque et commune ;
-
–
le TP, aussi appelé temps de Quick, pour l’exploration des voies extrinsèque et commune ;
-
–
les produits de dégradation de la fibrine (PDF), pour l’exploration de l’activité de fibrinolyse).
7.1. Numération des plaquettes
La procédure a déjà été étudiée dans le chapitre sur l’hémogramme. Si une thrombocytopénie est suspectée, il faut être particulièrement vigilant lors de la prise de sang. Il est préférable d’utiliser une deuxième seringue (ou vacutainer) car le premier sang contamine le contenant avec de la thromboplastine tissulaire favorisant ainsi l’agrégation plaquettaire. L’EDTA est un bon anticoagulant et autorise l’envoi de prélèvement par courrier si celui-ci n’excède pas une journée.
En dessous de 20 000 plaquettes/mm3, la thrombocytopénie est grave et, en principe, les signes cliniques apparaissent (pétéchies, ecchymoses, épistaxis, hémorragies gastro-intestinales).
Les causes les plus fréquentes de thrombocytopénies sont :
-
–
la destruction à médiation immune,
-
–
le défaut de production médullaire lors d’intoxication par les œstrogènes,
-
–
la consommation excessive lors de coagulation intravasculaire disséminée (CIVD).
7.2. Temps de saignement de la muqueuse buccale
Le TSMB est un test fonctionnel plaquettaire donnant des résultats interprétables chez le chien. On le mesure sur la lèvre supérieure après avoir pratiqué une petite incision. Il est nécessaire d’effectuer une pression par compression de la lèvre. L’excès de sang doit être absorbé toutes les 30 secondes avec un papier-filtre (sans toucher l’incision). Dans une étude, le TSMB chez des chiens sains (n = 34) a donné une valeur de 2,6 minutes +/- 0,5 minute. On considère qu’un temps de saignement supérieur à 12 minutes est pathologique. Un très grand nombre de molécules thérapeutiques est susceptible d’interagir avec la fonction des plaquettes et de modifier le TSMB.
Une méthode alternative très utilisée est le temps de saignement effectué au lobe interne de l’oreille (à l’aide d’une aiguille). Le temps de saignement normal se situe entre 1 et 5 minutes chez le chien, et entre 1,5 et 3 minutes chez le chat.
7.3. Temps de thromboplastine partiellement activé
Pour le TTPA et les tests suivants (coagulation et fibrinolyse), le citrate est l’anticoagulant de choix. L’échantillon doit être gardé à 4 °C, le plasma rapidement séparé par une centrifugation rapide (3 500 rpm pendant 15 minutes) puis congelé et envoyé en l’état au laboratoire d’analyses. En outre, ces tests doivent être pratiqués en parallèle avec un plasma d’un animal normal de la même espèce. Il existe un analyseur vétérinaire de coagulation sur sang total, le Coag Dx™, commercialisé par la société Idexx.
Le TTPA est le test le plus sensible de la voie intrinsèque (facteurs XII, XI, IX et VIII) et de la voie commune (facteurs X, V, II [prothrombine], thrombine et fibrinogène). Les valeurs de références de TTPA sont très variables d’un appareil à l’autre.
7.4. Taux de prothrombine
Le TP permet l’évaluation des voies extrinsèque (facteur VII) et commune. Il est surtout utilisé pour le diagnostic d’intoxication aux rodenticides (antivitamines K) ou de défaut de synthèse hépatique des facteurs de coagulation dépendants de la vitamine K. Parmi ces derniers, le facteur VII est celui dont la demi-vie est la plus courte. Les valeurs de référence sont, comme pour le TTPA, très variables d’un type d’appareil à l’autre.
Les valeurs de TP et de TTPA inférieures aux valeurs de références sont ignorées. En revanche, une augmentation de quelques secondes peut être significative.
7.5. Produits de dégradation de la fibrine
Les PDF permettent de confirmer une suspicion de CIVD. Celle-ci est une affection acquise, secondaire à une maladie inflammatoire, néoplasique ou nécrotique. La technique d’agglutination au latex, élaborée en médecine humaine, est normalement fiable chez le chien. Elle est basée sur une reconnaissance immunologique des fragments peptidiques à l’aide d’anticorps anti-PDF humains (avec existence de réaction croisée chez le chien). Une concentration des PDF supérieure à 40 μg/ml (dilution 1 : 20) indique une augmentation de l’activité de fibrinolyse et traduit généralement une CIVD.
8. Principales maladies hémorragiques
Il existe un grand nombre de modèles canins pour la plupart des maladies hémorragiques acquises et héréditaires décrites chez l’homme. Récemment, un protocole de thérapie génique s’est avéré efficace dans le traitement de l’hémophilie B (déficit en facteur IX) chez le chien, fondant ainsi un espoir important pour le traitement des coagulopathies héréditaires chez l’homme.
Nous détaillerons dans cette étude trois maladies fréquentes parmi les maladies hémorragiques : la CIVD, la maladie de von Willebrand et enfin, l’empoisonnement aux antagonistes de la vitamine K.
8.1. Coagulation intra-vasculaire disséminée
La CIVD est secondaire à de nombreuses affections, en particulier inflammatoires. Les facteurs de risques primordiaux d’une CIVD sont la stase vasculaire, une lésion de l’endothélium vasculaire (avec exposition du collagène sous-endothélial et activation de la voie intrinsèque), une hypercoagulabilité (par fuite de thromboplastine [facteur tissulaire] à partir de cellules nécrosées, ou par diminution de l’antithrombine III). Les tumeurs présentent souvent des zones nécrosées, inflammatoires, propices à l’installation d’une CIVD. La chimiothérapie anticancéreuse favorise la CIVD par augmentation du processus nécrotique.
La consommation des plaquettes et des facteurs de coagulation par formation de caillots peut être compensée par une production de novo, rendant parfois le diagnostic difficile.
Une diminution de l’antithrombine III (surconsommée lors de CIVD) est un outil diagnostique sensible mais pas très spécifique puisqu’elle peut traduire aussi une insuffisance hépatique, une entéropathie exsudative, ou une glomérulopathie. L’intérêt majeur du dosage de l’antithrombine III (encore peu pratiqué en médecine vétérinaire) est de prédire l’efficacité d’un traitement à l’héparine. Le dosage des PDF est également très utile pour le diagnostic de CIVD (cf. supra).
En résumé, en phase de consommation, la CIVD se caractérise par une thrombocytopénie, un allongement du TP et du TTPA, et par l’augmentation des PDF.
8.2. Maladie de von Willebrand
Il s’agit de la maladie héréditaire (mutation récessive autosomique) de l’hémostase la plus fréquente chez le chien, en particulier dans la race Doberman. Elle se caractérise par des saignements (gastro-intestinaux, uro-génitaux, épistaxis) modérés ou subcliniques. Le tableau clinique est complexe : trois types sont décrits, avec une expression variable de la maladie. Le facteur de von Willebrand (FvW) est une macromolécule multimérique nécessaire à l’adhérence des plaquettes. FvW a également la particularité de se lier au facteur VIII et de retarder ainsi sa clairance rénale. Néanmoins, il est rare d’observer une diminution telle du facteur VIII qu’elle provoque un allongement du TTPA. Inversement, on pourra constater une augmentation du TSMB. Des tests immunologiques (ELISA) existent pour le FvW et permettent le diagnostic différentiel avec l’hémophilie A. Cette autre maladie héréditaire est due à une mutation récessive du gène codant pour le facteur VIII (porté par le chromosome sexuel X). Lors de l’hémophilie A, on observe en général une concentration normale de FvW, une valeur normale du TSMB, mais un allongement du TTPA.
Enfin, une relation encore non expliquée existe, chez l’homme et chez le chien, entre la maladie de von Willebrand et l’hypothyroïdie. Des anomalies de l’hémostase associées à des signes d’hypothyroïdie doivent donc amener le vétérinaire à explorer la fonction thyroïdienne et à doser le FvW.
8.3. Intoxication aux antivitamines K
Les antivitamines K (dicoumarol et dérivés utilisé comme rodenticides) interfèrent avec l’enzyme réductase vitamine K époxide nécessaire à la réactivation de la vitamine K après réaction de -carboxylation de certains facteurs de la coagulation. Cette réaction est nécessaire à l’activité des facteurs II, VII, IX, et X. L’effet toxique des rodenticides de deuxième génération peut persister au moins trois semaines. En outre, il faut noter que la DL50 de ces produits baisse lors d’expositions répétées, et un animal ayant fréquemment accès à de petites doses est susceptible de s’intoxiquer. Une latence de 2 à 12 jours est nécessaire (disparition des formes actives circulantes des facteurs de coagulation) pour atteindre l’effet toxique. Les signes cliniques de ce type d’intoxication sont variés : anorexie, abattement, anémie, hypovolémie, boiterie, hématurie, toux, détresse respiratoire. Des morts subites existent en cas d’hémorragie cérébrale, péricardique, abdominale ou thoracique. Les résultats de laboratoire mettent en évidence une augmentation du TP (en premier, car la demi-vie du facteur VII est courte : 4 h chez le chien) et du TTPA, mais pas des PDF.
9. Conclusion
L’établissement d’un hémogramme est un geste fréquent en médecine vétérinaire, notamment en médecine des carnivores. Il permet d’apporter de nombreuses informations tant qualitatives que quantitatives sur les différentes lignées sanguines et ainsi de diagnostiquer nombre de pathologies fréquentes telles que l’anémie. Chez les herbivores, bien que moins pratiqué, il apporte également des informations non négligeables.
L’établissement d’un hémogramme est un geste fréquent en médecine vétérinaire, notamment en médecine des carnivores. Il permet d’apporter de nombreuses informations tant qualitatives que quantitatives sur les différentes lignées sanguines et ainsi de diagnostiquer nombre de pathologies fréquentes telles que l’anémie. Chez les herbivores, bien que moins pratiqué, il apporte également des informations non négligeables.
Les progrès techniques dans ce domaine permettent maintenant aux laboratoires et aux praticiens de disposer d’appareils sophistiqués autorisant la réalisation de cette analyse facilement, chez toutes les espèces domestiques et avec des résultats fiables. Il existe donc un fort potentiel de développement de la demande en hématologie vétérinaire.
Conflit d’intérêt : aucun
Footnotes
Coloration MGG.
Pour en savoir plus
- 1.Meyer DJ, Harvey JW. 3rd Edition. Saunders; 2004. Veterinary laboratory medicine: interpretation and diagnosis. [Google Scholar]
- 2.Willard MD, Twedten H., Turnwald GH. 3rd Edition. Saunders; 1999. Small animal clinical diagnosis by laboratory methods. [Google Scholar]
- 3.Feldman BF, Zinkl JG, Jain NC. 5th Edition. Lippincott Williams and Wilkins; Philadelphia: 2000. Schalm's Veterinary hematology. [Google Scholar]


