Résumé
Objectif
Offrir aux médecins de famille une approche diagnostique et thérapeutique actualisée de la pharyngite, en décrivant en détail les principaux symptômes, les méthodes d’investigation et un résumé des causes courantes.
Sources d’information
L’approche décrite est basée sur la pratique clinique des auteurs et sur les publications revues par les pairs de 1989 à 2018.
Message principal
Le mal de gorge causé par la pharyngite est couramment observé dans les cliniques de médecine familiale; il est causé par l’inflammation du pharynx et des tissus environnants. La pharyngite est causée par une infection virale, bactérienne ou fongique. Les causes virales sont souvent spontanément résolutives, alors que les infections bactériennes et fongiques nécessitent habituellement l’antibiothérapie. Le test de détection rapide de l’antigène et la culture de gorge sont jumelés aux observations cliniques pour identifier l’organisme en cause. La pharyngite causée par streptococcus pyogenes fait partie des organismes les plus préoccupants en raison de ses complications graves, telles la fièvre rhumatismale aiguë et la glomérulonéphrite. Ainsi, il est nécessaire de poser un diagnostic attentif de pharyngite afin de pouvoir dispenser un traitement ciblé.
Conclusion
L’anamnèse détaillée est la clé du diagnostic de pharyngite. Le test de détection rapide de l’antigène doit être réservé aux cas où l’instauration de l’antibiothérapie est préoccupante. Les médecins doivent user de retenue lorsqu’ils instaurent l’antibiothérapie contre la pharyngite, puisque la retenue ne retarde pas le rétablissement ni n’augmente le risque d’infection à s. pyogenes.
Le mal de gorge et la pharyngite représentent plus de 2 à 5 % de toutes les visites ambulatoires de première ligne des populations adulte et pédiatrique, respectivement1. La pharyngite se caractérise par l’inflammation du pharynx, du rhinopharynx et des amygdales2. L’incidence culmine entre la fin de l’hiver et le début du printemps. Quatre-vingts pour cent des cas sont causés par un virus, alors que le reste des cas découlent d’une infection bactérienne et, rarement, fongique3 (Tableau 1). Vous trouverez ici une revue clinique actualisée de la pharyngite à l’intention des médecins de famille canadiens.
Tableau 1.
Organismes les plus courants à l’origine de la pharyngite
| PHARYNGITE VIRALE | PHARYNGITE BACTÉRIENNE | PHARYNGITE FONGIQUE |
|---|---|---|
| • Rhinovirus | • Streptococcus pyogenes (SGA) | • Candida albicans |
| • Adénovirus | • Haemophilus influenzae | |
| • Virus Coxsackie | • Chlamydophila pneumoniae | |
| • Coronavirus | • Mycoplasma pneumoniae | |
• Respiratory syncytial virus
|
|
|
| • Virus d’Epstein-Barr | • Treponema pallidum | |
| • Orthomyxoviridae |
SGA—streptocoque du groupe A.
Description de cas
Mme S. est une femme de 18 ans qui consulte une clinique de médecine familiale pour mal de gorge et odynophagie depuis 3 jours. Elle dit ne pas avoir de toux ni d’écoulement nasal, mais a été fiévreuse avec des frissons intermittents. Elle dit ne pas avoir été en contact avec des personnes malades récemment et n’a pas voyagé dans les 2 derniers mois. Elle a présenté des symptômes semblables quelques années plus tôt, et elle a alors reçu des antibiotiques. Elle espère pouvoir obtenir une ordonnance d’antibiotiques pour soulager ses symptômes. Vu les symptômes de Mme S. et sa fièvre probable en l’absence de toux et de rhinorrhée, la pharyngite est soupçonnée.
Sources d’information
L’approche décrite est basée sur la pratique clinique des auteurs, et sur la recherche et les articles de revue clinique publiés entre 1989 et 2018.
Message principal
Bien que la pharyngite virale soit habituellement spontanément résolutive et qu’elle laisse peu de séquelles, les infections bactériennes et fongiques sont plus graves. Les infections à streptococcus pyogenes, un streptocoque du groupe A (SGA), surviennent dans jusqu’à 30 et 15 % des maux de gorge des populations pédiatrique et adulte, respectivement2. Les infections à streptocoque du groupe A entraînent des complications menaçant la vie chez moins de 0,015 % des patients pédiatriques et 0,05 % des patients adultes4,5. Ces complications sont non suppurées (fièvre rhumatismale aiguë, glomérulonéphrite, affections neuropsychiatriques auto-immunes associées à une infection à streptocoques) et suppurées (abcès périamygdalien, thrombose jugulaire fébrile, angine de Vincent) qui justifient une intervention médicale ou chirurgicale d’urgence2,6.
Les complications sont prévenues par l’antibiothérapie, mais la résistance croissante aux antibiotiques a mis l’accent sur une réduction au minimum du recours aux antibiotiques7. Il est malheureusement difficile de faire la différence entre une pharyngite bactérienne et d’autres infections.
Signes et symptômes.
Il est difficile de différencier en clinique la pharyngite virale de la pharyngite bactérienne et fongique en raison des similarités du tableau clinique. Mal de gorge, odynophagie et fièvre en sont toutes des caractéristiques communes. Ces symptômes culminent habituellement en 3 à 5 jours, puis disparaissent au jour 108. Bien que certains symptômes spécifiques aux pathogènes aient été rapportés, les valeurs prédictives n’ont été formulées que pour la pharyngite à SGA (Tableau 2)2,3,9–14.
Tableau 2.
Résumé des signes et des symptômes courants des pharyngites virale, bactérienne et fongique : Les signes et les symptômes de la pharyngite bactérienne peuvent chevaucher ceux de la pharyngite à streptocoque
| PATHOGÈNE | SIGNE OU SYMPTÔME | RV POSITIF (IC À 95 %) | SPÉCIFICITÉ (IC À 95 %) | SENSIBILITÉ (IC À 95 %) |
|---|---|---|---|---|
| Viral | Toux3,9,10 | n.d. | n.d. | n.d. |
| Rhinorrhée3,9,10 | ||||
| Diarrhée3,9,10 | ||||
| Fatigue3,9,10 | ||||
| Conjonctivite3,9,10 | ||||
| Hypertrophie amygdalienne2 | ||||
| Érythème ou oedème oro-pharyngé2 | ||||
| Pavimentation pharyngée2 | ||||
| Bactérien | Nausées et vomissements3,10,11 | n.d. | n.d. | n.d. |
| Céphalée3,10,11 | ||||
| Douleur abdominale3,10,11 | ||||
| Streptocoque du groupe A | Éruption scarlatinique3,10–12 | 3,91 (2,00–7,62) | 0,98 (0,95–0,99) | 0,08 (0,05–0,14) |
| Pétéchie du palais11–13 | 2,69 (1,92–3,77) | 0,95 (0,91–0,97) | 0,15 (0,10–0,21) | |
| Exsudat amygdalien11–13 | 1,53 (1,00–2,24) | 0,74 (0,64–0,83) | 0,38 (0,27–0,51) | |
| Arthralgie ou myalgie11–13 | 1,42 (1,00–1,91) | 0,87 (0,70–0,95) | 0,18 (0,06–0,44) | |
| Adénopathie cervicale11–13 | 1,40 (1,12–1,89) | 0,40 (0,23–0,61) | 0,82 (0,71–0,89) | |
| Fongique | Perte gustative14 | n.d. | n.d. | n.d. |
| Engourdissement de la bouche14 | ||||
| Plaques blanches de l’oropharynx14 | ||||
| Plaques rouges lisses de l’oropharynx14 | ||||
| Chéilite angulaire14 |
RV—ratio de vraisemblance, n.d.—non disponible.
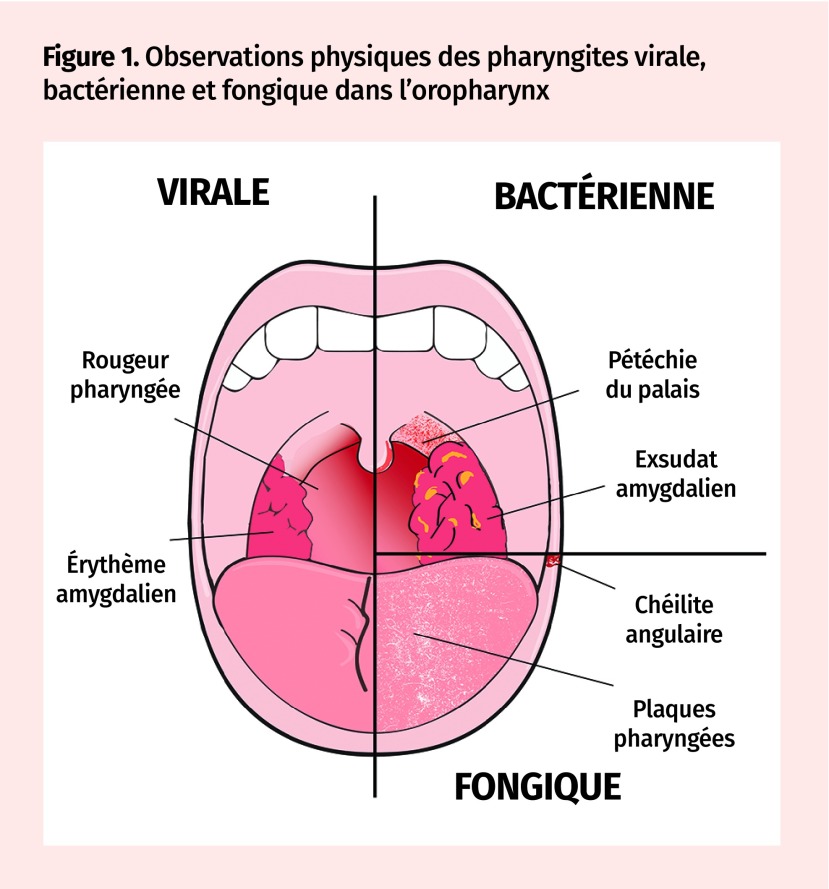
Les observations physiques aident à orienter le diagnostic (Figure 1). L’hypertrophie amygdalienne, l’érythème, l’oedème ou l’aspect pavimenteux de la muqueuse pharyngée pointent vers une infection virale2. Des observations telles qu’oedème de la lèvre supérieure, splénomégalie, adénopathie cervicale postérieure et éruptions polymorphes aiguisent les soupçons d’infection à virus d’Epstein-Barr (VEB)9,15. Les pathogènes bactériens pourraient causer la lymphadénopathie cervicale antérieure, une éruption scarlatinique (en papier sablé), des exsudats amygdaliens et la pétéchie du palais16. La pharyngite fongique se manifeste par chéilite angulaire et plaques blanches douloureuses ou plaques lisses rouges dans l’oropharynx14.
Figure 1.
Observations physiques des pharyngites virale, bactérienne et fongique dans l’oropharynx
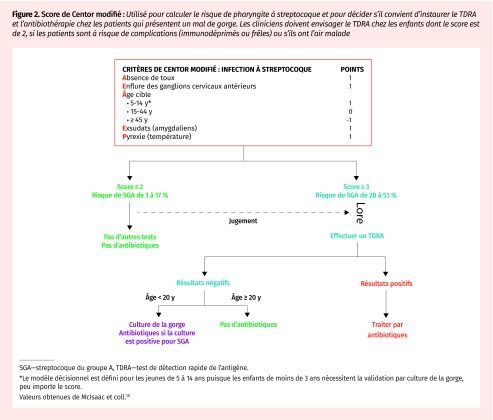
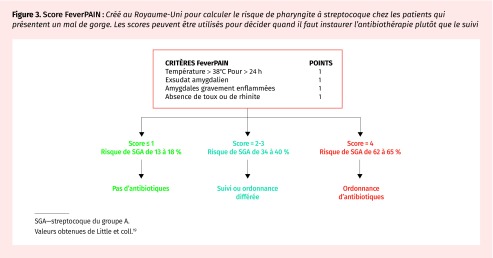
Les patients présentent certains de ces signes et symptômes ou n’en présentent aucun. Des algorithmes prédictifs ont été créés pour orienter les investigations et prévenir la surprescription d’antibiotiques en assignant aux signes et symptômes une probabilité prétest agrégée de pharyngite bactérienne17. Le score de Centor modifié (Figure 2) demeure la méthode la plus utilisée pour élaborer le diagnostic de pharyngite à streptocoque18. Les personnes qui obtiennent un score de 1 ou moins présentent un risque très faible (< 10 %) d’infection à streptocoque, alors que les personnes qui obtiennent un score de 4 ou plus présentent un risque élevé (53 %). Le score FeverPAIN (Figure 3), quant à lui, est populaire au Royaume-Uni19. Il prédit une infection à streptocoque en fonction de l’apparition des symptômes aigus (< 3 jours), fièvre récente (< 24 heures), absence de toux ou de rhinite et purulence ou inflammation des amygdales. Les scores en deçà de 2 ou 3 présentent un risque de jusqu’à 40 % d’infection à streptocoque, et le risque augmente à jusqu’à 65 % en présence d’un score de 419. Cette approche serait équivalente sinon supérieure au score de Centor modifié pour réduire le besoin d’un test diagnostique et d’antibiotiques sans répercussions négatives sur le patient19.
Figure 2.
Score de Centor modifié : Utilisé pour calculer le risque de pharyngite à streptocoque et pour décider s’il convient d’instaurer le TDRA et l’antibiothérapie chez les patients qui présentent un mal de gorge. Les cliniciens doivent envisager le TDRA chez les enfants dont le score est de 2, si les patients sont à risque de complications (immunodéprimés ou frêles) ou s’ils ont l’air malade
SGA—streptocoque du groupe A, TDRA—test de détection rapide de l’antigène.
*Le modèle décisionnel est défini pour les jeunes de 5 à 14 ans puisque les enfants de moins de 3 ans nécessitent la validation par culture de la gorge, peu importe le score.
Valeurs obtenues de McIsaac et coll.18
Figure 3.
Score FeverPAIN : Créé au Royaume-Uni pour calculer le risque de pharyngite à streptocoque chez les patients qui présentent un mal de gorge. Les scores peuvent être utilisés pour décider quand il faut instaurer l’antibiothérapie plutôt que le suivi
SGA—streptocoque du groupe A.
Valeurs obtenues de Little et coll.19
Analyses de laboratoire.
La culture de la gorge demeure le critère standard du diagnostic de pharyngite bactérienne, avec une spécificité de 97 à 100 %20 et une sensibilité de 90 à 95 %10. Malheureusement, le prélèvement pour culture de la gorge est difficile, et ce test peut retarder l’antibiothérapie21. Les cultures influencent rarement le choix de l’antibiotique, puisque les pratiques de prescription couvrent actuellement le SGA. Elles peuvent plutôt éliminer les infections atypiques telles que les pharyngites non à SGA et fongiques, qui nécessitent d’autres schémas antimicrobiens22.
Le test de détection rapide de l’antigène (TDRA) permet de poser un diagnostic la journée même. Ce test effectué au point de service détecte les antigènes bactériens et viraux par écouvillonnage de la gorge prélevé sur les exsudats amygdaliens ou l’oropharynx postérieur à l’aide d’un coton-tige. Pour l’heure, il sert à éliminer les infections à streptocoque, le virus respiratoire syncytial et la grippe23–25. La spécificité et la sensibilité du TDRA varient grandement de 54 à 100 % et de 38 à 100 %, respectivement2,23,25–27. Bien que les résultats soient immédiats, chaque trousse est spécifique à un pathogène, et le test ne peut faire la différence entre les pharyngites virale et bactérienne. Ainsi, des résultats négatifs n’éliminent pas la pharyngite bactérienne non-SGA.
Le test des titres d’antistreptolysine O est utilisé chez les patients pour lesquels on soupçonne des complications suppurées liées à SGA. Il n’est toutefois pas recommandé dans les cas aigus, puisque les marqueurs sérologiques culminent de 3 à 8 semaines après l’apparition des symptômes28,29.
Les personnes pour lesquelles on soupçonne une infection à VEB doivent subir le test MNI de mononucléose infectieuse. Malgré une sensibilité de 70 à 92 % et une spécificité de 96 à 100 %30, le taux de faux négatif s’élève à 25 % lorsque le test est effectué dans les 10 premiers jours suivant la présentation31. Le diagnostic de pharyngite à Neisseria gonorrhoeae était auparavant posé par écouvillonnage oral; récemment, les tests d’amplification des acides nucléiques ont été homologués par Santé publique Ontario, la Food and Drug Administration et les Centers for Disease Control and Prevention pour tests extra-génitaux 32,33.
Prise de décision clinique.
La prise en charge de la pharyngite est axée sur le choix entre la surveillance vigilante, le traitement symptomatique ou l’antibiothérapie. Cette décision repose sur la différenciation exacte entre les infections bactérienne et virale. Les cultures identifient les pathogènes avec exactitude, mais elles ne doivent pas retarder ni guider le traitement initial dans les cas où le tableau clinique est atypique, puisque les résultats sont latents pendant 5 à 10 jours et ne font pas la différence entre les infections aiguës et les porteurs. Par ailleurs, le TDRA est spécifique, mais il ne doit pas non plus guider la prise en charge à lui seul, en raison de sa sensibilité variable, et le TDRA n’est pas étayé par des données probantes de bonne qualité chez les enfants23. Un TDRA négatif chez les patients de 5 à 15 ans doit être confirmé par culture de la gorge34. De plus, il ne faut pas effectuer le test chez les enfants de moins de 3 ans, à moins qu’il y ait de grandes chances qu’ils aient été exposés au SGA, puisque l’incidence au sein de cette population est inférieure à 14 % et que l’infection cause rarement la fièvre rhumatismale35.
Quelque 7 % des enfants et 20 % des adultes sont des porteurs asymptomatiques et non contagieux du SGA36. Le recours superflu aux antibiotiques entraîne des effets secondaires inutiles et augmente les coûts de santé. Les lignes directrices 2012 de l’Infectious Diseases Society of America suggèrent que le score de Centor modifié guide les analyses de laboratoire et l’antibiothérapie10,34. Le traitement symptomatique est recommandé à un score de 1, alors que l’antibiothérapie guidée par le TDRA ou la culture est conseillée lorsque les scores s’élèvent à 2 ou 3 (Figure 2)18. Malheureusement, la spécificité de cet outil s’élève à 54 % chez les patients de 3 à 14 ans37. Les cliniciens doivent user de prudence lorsqu’ils appliquent ce schéma dans la population, en raison de l’inexactitude du diagnostic12,37.
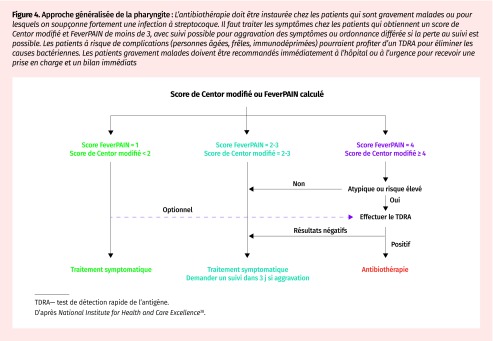
Le National Institute for Health and Care Excellence préconise de jumeler les scores de Centor modifié et FeverPAIN pour guider le suivi et l’instauration de l’antibiothérapie (Figure 4)38. Le traitement symptomatique est conseillé chez les patients à faible risque, avec suivi à 1 semaine. Il est conseillé de remettre une ordonnance différée à exécuter si les symptômes ne sont pas atténués en 3 à 5 jours aux patients à risque intermédiaire d’infection à SGA38.
Figure 4.
Approche généralisée de la pharyngite : L’antibiothérapie doit être instaurée chez les patients qui sont gravement malades ou pour lesquels on soupçonne fortement une infection à streptocoque. Il faut traiter les symptômes chez les patients qui obtiennent un score de Centor modifié et FeverPAIN de moins de 3, avec suivi possible pour aggravation des symptômes ou ordonnance différée si la perte au suivi est possible. Les patients à risque de complications (personnes âgées, frêles, immunodéprimées) pourraient profiter d’un TDRA pour éliminer les causes bactériennes. Les patients gravement malades doivent être recommandés immédiatement à l’hôpital ou à l’urgence pour recevoir une prise en charge et un bilan immédiats
TDRA—test de détection rapide de l’antigène.
D’après National Institute for Health and Care Excellence38.
Le seuil thérapeutique de la pharyngite est traditionnellement bas en raison du risque de complications bactériennes. Des données probantes émergentes indiquent que l’antibiothérapie différée de 3 jours ne prolonge pas le rétablissement39,40 et que les diagnostics confirmés en laboratoire ne différencient pas adéquatement les porteurs subcliniques de bactérie41. L’approche antimicrobienne plus prudente préconisée par les lignes directrices du National Institute for Health and Care Excellence serait bénéfique (Figure 4)38. En se concentrant sur la prise en charge des symptômes avec suivi étroit des cas dont la probabilité prétest est faible et les ordonnances différées dans les groupes à risque intermédiaire, cette stratégie réduirait le recours aux antibiotiques au Canada de jusqu’aux 27 % observés au Royaume-Uni, sans augmenter le taux de complications ou de mortalité41.
Ces cadres de travail devraient guider le jugement clinique du médecin, sans le remplacer. Les tests et le traitement empirique des personnes gravement malades ou à risque élevé de complications (p. ex. personnes âgées, frêles ou immunodéprimées) ne doivent pas tarder. Les médecins doivent aussi soupçonner rapidement les complications suppurées, puisqu’elles menacent le pronostic vital si elles ne sont pas traitées. Elles doivent être traitées immédiatement et susciter une consultation urgente en oto-rhino-laryngologie.
Traitement.
La prise en charge clinique dépend de la cause de la pharyngite, mais elle peut ultimement être divisée en traitement symptomatique et antibiotique. Il est essentiel de bien s’hydrater, peu importe la stratégie thérapeutique.
Pharyngite virale : Le traitement est prudent, puisque ces infections sont généralement spontanément résolutives. La corticothérapie orale pendant 1 ou 2 jours a montré pouvoir réduire l’odynophagie (nombre de patients à traiter [NPT] : 4), mais elle n’a aucun effet sur l’évolution clinique6,42. Les pastilles et le rince-bouche contenant de la benzocaïne ou de la lidocaïne soulagent légèrement la douleur en engourdissant l’oropharynx10. Les anti-inflammatoires non stéroïdiens comme l’ibuprofène, de même que l’acétaminophène soulagent la douleur et la fièvre chez les adultes et les enfants43. L’acide acétylsalicylique est contre-indiqué chez les enfants en raison du risque de syndrome de Reye10. Les patients pour lesquels on soupçonne une infection à VEB doivent savoir qu’il faut éviter les sports de contact en raison du risque accru de rupture splénique secondaire au VEB. Pour l’heure, la durée de la restriction ne fait pas consensus44.
Pharyngite bactérienne : Le traitement de la pharyngite bactérienne se concentre sur l’éradication de SGA. Un traitement de 6 à 10 jours par amoxicilline est le traitement de base des candidats à l’antibiothérapie. Une dose intramusculaire unique de benzathine pénicilline G est une option si l’observance est douteuse3,27. Le NPT pour empêcher 1 mal de gorge à 1 semaine à l’aide d’antibiotiques est de 21 chez les patients dont l’écouvillonnage de la gorge est positif. Les données historiques antérieures à 1975 laissent aussi croire que les antibiotiques réduisent de 67 % le risque de fièvre rhumatismale, mais d’autres études portant sur cette complication sont nécessaires45. L’association antibiotique-corticostéroïde n’est pas indiquée, puisqu’elle ne soulage pas la douleur et pourrait retarder le rétablissement de la pharyngite bactérienne46.
Les patients qui présentent une hypersensibilité (éruption) de type 4 à la pénicilline ou à l’amoxicilline et qui nécessitent des antibiotiques doivent recevoir la céphalexine, la clindamycine ou la clarithromycine pendant 10 jours3. Par ailleurs, une ordonnance de cefdinir ou de cefpodoxime pendant 5 jours est indiquée chez les patients qui présentent une hypersensibilité de type 1 (anaphylaxie) aux β-lactamases3. Il faut éviter la céphalexine chez ces patients en raison d’un risque de 2,5 % d’hypersensibilité conjointe aux céphalosporines de deuxième génération47. L’exanthème maculopapulaire non lié à l’hypersensibilité est possible chez 70 % des patients ayant contracté le VEB après l’amoxicilline, mais il ne nécessite pas un traitement48. Aucune différence statistique n’a été rapportée quant à la réduction des symptômes entre les traitements par céphalosporine ou macrolide, et les traitements à la pénicilline49.
Pharyngite atypique : Les patients dont l’infection est réfractaire aux traitements de première intention peuvent être traités pendant 72 heures par amoxicilline-acide clavulanique ou clindamycine. Si l’on soupçonne la présence de bactéries telles N. gonorrhoeae ou Corynebacterium diphtheriae, il faut instaurer un traitement par ceftriaxone ou érythromycine, respectivement3. Il faut soupçonner la pharyngite fongique chez les patients immunodéprimés et les personnes âgées, pour lesquels le traitement par le fluconazole et le miconazole est indiqué14.
La pharyngite récidivante doit être traitée par pénicillinerifampicine ou cefpodoxime proxétil. Les patients atteints d’amygdalite à streptocoque récidivante (> 7 au cours des 12 derniers mois, > 5 par année depuis 2 ans ou > 3 par année depuis 3 ans) sont recommandés en oto-rhinolaryngologie-chirurgie de la tête et du cou afin d’envisager l’amygdalectomie35. L’éradication chez les porteurs asymptomatiques n’est pas indiquée pour le moment50. Les poussées doivent cependant être traitées comme des infections concomitantes exigeant un traitement de 10 jours par la clindamycine ou la pénicilline-rifampicine ou 1 dose de benzathine pénicilline G et rifampicine51,52.
Résolution du cas
L’absence de toux et de rhinorrhée chez Mme S. a permis d’éliminer la sinusite et l’écoulement rhinopharyngé. Elle semble souffrir à la déglutition, mais ne semble pas être gravement malade. Elle est fiévreuse, et l’examen révèle l’enflure des ganglions cervicaux gauches, de même que l’hypertrophie bilatérale des amygdales sans exsudat. Son pharynx est rouge et enflammé. Le score de Centor modifié et FeverPAIN est de 2 dans les deux cas. La pharyngite virale est soupçonnée, et le TDRA n’est donc pas réalisé. On demande à Mme S. de prendre de l’ibuprofène pour soulager la douleur et de bien s’hydrater. On lui demande de revenir si ses symptômes s’aggravent dans les 3 jours suivants.
Conclusion
La pharyngite est une préoccupation courante observée en première ligne; elle est causée par des agents viraux, bactériens ou fongiques. Les infections les plus préoccupantes sont les infections à streptococcus pyogenes, qui peuvent entraîner des complications suppurées et non suppurées. La cause de la pharyngite est diagnostiquée principalement à l’aide des caractéristiques cliniques clés présentes dans les systèmes de pointage Centor ou FeverPAIN jumelés au TDRA. La bonne gestion des antibiotiques et la faible incidence des complications de la pharyngite à streptocoques indiquent que le traitement peut s’en tenir principalement au soutien. L’emploi empirique d’antibiotiques doit être réservé aux patients qui sont gravement malades, qui présentent un risque élevé de complications ou qui ne montrent aucun signe d’amélioration 5 jours après la présentation.
Points de repère du rédacteur
▸ Le mal de gorge et la pharyngite représentent plus de 2 à 5 % de toutes les visites ambulatoires de première ligne des populations adulte et pédiatrique, respectivement. Bien que la pharyngite virale soit habituellement spontanément résolutive et qu’elle laisse peu de séquelles, les infections bactériennes et fongiques sont plus graves. Les plus préoccupantes sont les infections à streptococcus pyogenes, qui peuvent entraîner des complications suppurées et non suppurées.
▸ La cause de la pharyngite est diagnostiquée principalement à l’aide des caractéristiques cliniques clés présentes dans les systèmes de pointage Centor ou FeverPAIN et, plus rarement, par test de détection rapide de l’antigène.
▸ La bonne gestion des antibiotiques et la faible incidence des complications de la pharyngite à streptocoques indiquent que le traitement peut s’en tenir principalement au soutien. L’emploi empirique d’antibiotiques doit être réservé aux patients qui sont gravement malades, qui présentent un risque élevé de complications ou qui ne montrent aucun signe d’amélioration 5 jours après la présentation.
Footnotes
Collaborateurs
Les Drs Sykes et Wu ont contribué également à l’examen de la littérature et à son interprétation. Tous les auteurs ont contribué à l’interprétation de la littérature et la préparation du manuscrit aux fins de soumission.
Intérêts concurrents
Aucun déclaré
Cet article donne droit à des crédits d’autoapprentissage certifiés Mainpro+. Pour obtenir des crédits, rendez-vous sur www.cfp.ca et cliquez sur le lien Mainpro+.
Cet article a fait l’objet d’une révision par des pairs.
The English version of this article is available at www.cfp.ca on the table of contents for the April 2020 issue on page 251.
Références
- 1.Sadeghirad B, Siemieniuk RAC, Brignardello-Petersen R, Papola D, Lytvyn L, Vandvik PO, et al. Corticosteroids for treatment of sore throat: systematic review and metaanalysis of randomised trials. BMJ. 2017;358:j3887. doi: 10.1136/bmj.j3887. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 2.ESCMID Sore Throat Guideline Group. Pelucchi C, Grigoryan L, Galeone C, Esposito S, Huovinen P, et al. Guideline for management of acute sore throat. Clin Microbiol Infect. 2012;18(Suppl 1):1–28. doi: 10.1111/j.1469-0691.2012.03766.x. [DOI] [PubMed] [Google Scholar]
- 3.Yoon YK, Park CS, Kim JW, Hwang K, Lee SY, Kim TH, et al. Guidelines for the antibiotic use in adults with acute upper respiratory tract infections. Infect Chemother. 2017;49(4):326–52. doi: 10.3947/ic.2017.49.4.326. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 4.Cars T, Eriksson I, Granath A, Wettermark B, Hellman J, Norman C, et al. Antibiotic use and bacterial complications following upper respiratory tract infections: a population-based study. BMJ Open. 2017;7(11):e016221. doi: 10.1136/bmjopen-2017-016221. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 5.Nakhoul GN, Hickner J. Management of adults with acute streptococcal pharyngitis: minimal value for backup strep testing and overuse of antibiotics. J Gen Intern Med. 2013;28(6):830–4. doi: 10.1007/s11606-012-2245-8. Publ. en ligne du 6 oct. 2012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 6.Sigra S, Hesselmark E, Bejerot S. Treatment of PANDAS and PANS: a systematic review. Neurosci Biobehav Rev. 2018;86:51–65. doi: 10.1016/j.neubiorev.2018.01.001. Publ. en ligne du 6 janv. 2018. [DOI] [PubMed] [Google Scholar]
- 7.Linder JA. Editorial commentary: antibiotics for treatment of acute respiratory tract infections: decreasing benefit, increasing risk, and the irrelevance of antimicrobial resistance. Clin Infect Dis. 2008;47(6):744–6. doi: 10.1086/591149. [DOI] [PubMed] [Google Scholar]
- 8.Wolford RW, Schaefer TJ. Pharyngitis. Treasure Island, FL: StatPearls Publishing; 2018. [Google Scholar]
- 9.Cunha BA. A positive rapid strep test in a young adult with acute pharyngitis: be careful what you wish for! IDCases. 2017;10:58–9. doi: 10.1016/j.idcr.2017.08.012. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 10.Shulman ST, Bisno AL, Clegg HW, Gerber MA, Kaplan EL, Lee G, et al. Clinical practice guideline for the diagnosis and management of group A streptococcal pharyngitis: 2012 update by the Infectious Diseases Society of America. Clin Infect Dis. 2012;55(10):e86–102. doi: 10.1093/cid/cis629. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 11.Thai TN, Dale AP, Ebell MH. Signs and symptoms of group A versus non-group A strep throat: a meta-analysis. Fam Pract. 2018;35(3):231–8. doi: 10.1093/fampra/cmx072. [DOI] [PubMed] [Google Scholar]
- 12.Shaikh N, Swaminathan N, Hooper EG. Accuracy and precision of the signs and symptoms of streptococcal pharyngitis in children: a systematic review. J Pediatr. 2012;160(3):487–93.e3. doi: 10.1016/j.jpeds.2011.09.011. Publ. en ligne du 1er nov. 2011. [DOI] [PubMed] [Google Scholar]
- 13.Ebell MH, Smith MA, Barry HC, Ives K, Carey M. The rational clinical examination. Does this patient have strep throat? JAMA. 2000;284(22):2912–8. doi: 10.1001/jama.284.22.2912. [DOI] [PubMed] [Google Scholar]
- 14.Pankhurst CL. Candidiasis (oropharyngeal) BMJ Clin Evid. 2013;2013:1304. [PMC free article] [PubMed] [Google Scholar]
- 15.Mohseni M, Boniface MP. Mononucleosis. Treasure Island, FL: StatPearls Publishing; 2018. [PubMed] [Google Scholar]
- 16.Anthony R, Flores MTC. Pharyngitis. In: Bennett JE, Dolin R, Blaser MJ, editors. Mandell, Douglas, and Bennett’s principles and practice of infectious disease. 8th ed. Philadelphia, PA: Elsevier Saunders; 2015. pp. 753–9. [Google Scholar]
- 17.Shapiro DJ, Lindgren CE, Neuman MI, Fine AM. Viral features and testing for streptococcal pharyngitis. Pediatrics. 2017;139(5):e20163403. doi: 10.1542/peds.2016-3403. [DOI] [PubMed] [Google Scholar]
- 18.McIsaac WJ, Kellner JD, Aufricht P. Empirical validation of guidelines for the management of pharyngitis in children and adults. JAMA. 2004;291(13):1587–95. doi: 10.1001/jama.291.13.1587. Errata dans : JAMA 2005;294(21):2700. [DOI] [PubMed] [Google Scholar]
- 19.Little P, Hobbs FR, Moore M, Mant D, Williamson I, McNulty C, et al. PRImary care Streptococcal Management (PRISM) study: in vitro study, diagnostic cohorts and a pragmatic adaptive randomised controlled trial with nested qualitative study and cost-effectiveness study. Health Technol Assess. 2014;18(6):vii–xxv. 1–101. doi: 10.3310/hta18060. Errata dans : Health Technol Assess 2018;18(6):103–4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 20.Little P, Hobbs FD, Mant D, McNulty CA, Mullee M, PRISM investigators Incidence and clinical variables associated with streptococcal throat infections: a prospective diagnostic cohort study. Br J Gen Pract. 2012;62(604):e787–94. doi: 10.3399/bjgp12X658322. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 21.Tang S, Cowen U, Fader R, Duncan D, Quezada T, Walker K, et al. Diagnosis and antibiotic treatment of group a streptococcal pharyngitis in children in a primary care setting: impact of point-of-care polymerase chain reaction. BMC Pediatr. 2019;19(1):24. doi: 10.1186/s12887-019-1393-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 22.Kocoglu E, Karabay O, Yilmaz F, Ekerbicer H. The impact of incubating the throat culture for 72 h on the diagnosis of group A beta-hemolytic streptococci. Auris Nasus Larynx. 2006;33(3):311–3. doi: 10.1016/j.anl.2005.11.011. Publ. en ligne du 23 janv. 2006. [DOI] [PubMed] [Google Scholar]
- 23.Cheung L, Pattni V, Peacock P, Sood S, Gupta D. Throat swabs have no influence on the management of patients with sore throats. J Laryngol Otol. 2017;131(11):977–81. doi: 10.1017/S002221511700189X. Publ. en ligne du 6 sept. 2017. [DOI] [PubMed] [Google Scholar]
- 24.Cohen JF, Bertille N, Cohen R, Chalumeau M. Rapid antigen detection test for group A streptococcus in children with pharyngitis. Cochrane Database Syst Rev. 2016;(7):CD010502. doi: 10.1002/14651858.CD010502.pub2. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 25.Moesker FM, van Kampen JJA, Aron G, Schutten M, van de Vijver DA, Koopmans MP, et al. Diagnostic performance of influenza viruses and RSV rapid antigen detection tests in children in tertiary care. J Clin Virol. 2016;79:12–7. doi: 10.1016/j.jcv.2016.03.022. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 26.Hogan CA, Caya C, Papenburg J. Rapid and simple molecular tests for the detection of respiratory syncytial virus: a review. Expert Rev Mol Diagn. 2018;18(7):617–29. doi: 10.1080/14737159.2018.1487293. Publ. en ligne du 29 juin 2018. [DOI] [PubMed] [Google Scholar]
- 27.Gonzalez RM, Varnum SM, Zangar RC. Sandwich ELISA microarrays : generating reliable and reproducible assays for high-throughput screens. In: Wang F, editor. Biomarker methods in drug discovery and development. Methods in pharmacology and toxicology. Totowa, NJ: Humana Press; 2008. pp. 273–90. [Google Scholar]
- 28.Cohen R, Haas H, Lorrot M, Biscardi S, Romain O, Vie Le Sage F, et al. Traitement antimicrobien des infections ORL. Arch Pediatr. 2017;24(12S):S9–16. doi: 10.1016/S0929-693X(17)30512-2. [DOI] [PubMed] [Google Scholar]
- 29.Stewart EH, Davis B, Clemans-Taylor BL, Littenberg B, Estrada CA, Centor RM. Rapid antigen group A streptococcus test to diagnose pharyngitis: a systematic review and meta-analysis. PLoS One. 2014;9(11):e111727. doi: 10.1371/journal.pone.0111727. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 30.Matthys J, De Meyere M, Van Driel ML, De Sutter A. Differences among international pharyngitis guidelines: not just academic. Ann Fam Med. 2007;5(5):436–43. doi: 10.1370/afm.741. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 31.Russell BL, Steele JC., Jr. Infectious mononucleosis testing at the point-of-care. Point Care. 2009;8(1):29–31. [Google Scholar]
- 32.Womack J, Jimenez M. Common questions about infectious mononucleosis. Am Fam Physician. 2015;91(6):372–6. [PubMed] [Google Scholar]
- 33.Agence de la santé publique du Canada . Lignes directrices canadiennes sur les infections transmissibles sexuellement. Ottawa, ON: Gouvernement du Canada; 2016. [Google Scholar]
- 34.US Food and Administration Drug . FDA clears first diagnostic tests for extragenital testing for chlamydia and gonorrhea[news release] Silver Spring, MD: US Food and Drug Administration; 2019. Accessible à : https://www.fda.gov/news-events/press-announcements/fda-clears-first-diagnostic-tests-extragenital-testingchlamydia-and-gonorrhea. Réf. du 6 mars 2020. [Google Scholar]
- 35.Workowski KA, Bolan GA, Centers for Disease Control and Prevention Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep. 2015;64(RR-03):1–137. Errata dans : MMWR Recomm Rep 2015;64(33):924. [PMC free article] [PubMed] [Google Scholar]
- 36.Randel A, Infectious Disease Society of America IDSA updates guideline for managing group A streptococcal pharyngitis. Am Fam Physician. 2013;88(5):338–40. [PubMed] [Google Scholar]
- 37.Randel A. AAO-HNS guidelines for tonsillectomy in children and adolescents. Am Fam Physician. 2011;84(5):566–73. [PubMed] [Google Scholar]
- 38.Oliver J, Malliya Wadu E, Pierse N, Moreland NJ, Williamson DA, Baker MG, et al. Streptococcus pharyngitis and pharyngeal carriage: a meta-analysis. PLoS Negl Trop Dis. 2018;12(3):e0006335. doi: 10.1371/journal.pntd.0006335. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 39.Cohen JF, Cohen R, Levy C, Thollot F, Benani M, Bidet P, et al. Selective testing strategies for diagnosing group A streptococcal infection in children with pharyngitis: a systematic review and prospective multicentre external validation study. CMAJ. 2015;187(1):23–32. doi: 10.1503/cmaj.140772. Publ. en ligne du 8 déc. 2014. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 40.National Institute for Health and Care Excellence . Sore throat (acute): antimicrobial prescribing. London, UK: National Institute for Health and Care Excellence; 2018. NICE guideline [NG84] [Google Scholar]
- 41.Dumkow LE, Axford KL, Suda KJ, Draper HM, Brandt KL. Impact of a stewardship-focused culture follow-up initiative on the treatment of pharyngitis in the emergency department and urgent care settings. Diagn Microbiol Infect Dis. 2018;92(2):136–42. doi: 10.1016/j.diagmicrobio.2018.05.014. Publ. en ligne du 28 mai 2018. [DOI] [PubMed] [Google Scholar]
- 42.Spurling GKP, Del Mar CN, Dooley L, Foxlee R, Farley R. Delayed antibiotic prescriptions for respiratory infections (review) Cochrane Database Syst Rev. 2017;(9):CD004417. doi: 10.1002/14651858.CD004417.pub5. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 43.Jaggi P, Leber A. Molecular testing for group A streptococcal pharyngitis: to test or not to test, that is the question. J Pediatric Infect Dis Soc. 2018 Apr 27; doi: 10.1093/jpids/pix106. Publ. en ligne avant impression. [DOI] [PubMed] [Google Scholar]
- 44.Hayward G, Thompson MJ, Perera R, Glasziou PP, Del Mar CB, Heneghan CJ. Corticosteroids as standalone or add-on treatment for sore throat. Cochrane Database Syst Rev. 2012;(10):CD008268. doi: 10.1002/14651858.CD008268.pub2. [DOI] [PubMed] [Google Scholar]
- 45.Thomas M, Del Mar C, Glasziou P. How effective are treatments other than antibiotics for acute sore throat? Br J Gen Pract. 2000;50(459):817–20. [PMC free article] [PubMed] [Google Scholar]
- 46.O’Connor TE, Skinner LJ, Kiely P, Fenton JE. Return to contact sports following infectious mononucleosis: the role of serial ultrasonography. Ear Nose Throat J. 2011;90(8):E21–4. doi: 10.1177/014556131109000819. [DOI] [PubMed] [Google Scholar]
- 47.Spinks A, Glasziou PP, Del Mar CB. Antibiotics for sore throat. Cochrane Database Syst Rev. 2013;(11):CD000023. doi: 10.1002/14651858.CD000023.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 48.Quintana EC. Effectiveness of oral dexamethasone in the treatment of moderate to severe pharyngitis in children. Ann Emerg Med. 2005;46(2):210. [Google Scholar]
- 49.Campagna JD, Bond MC, Schabelman E, Hayes BD. The use of cephalosporins in penicillin-allergic patients: a literature review. J Emerg Med. 2012;42(5):612–20. doi: 10.1016/j.jemermed.2011.05.035. Publ. en ligne du 13 juill. 2011. [DOI] [PubMed] [Google Scholar]
- 50.Ónodi-Nagy K, Kinyó Á, Meszes A, Garaczi E, Kemény L, Bata-Csörgő Z. Amoxicillin rash in patients with infectious mononucleosis: evidence of true drug sensitization. Allergy Asthma Clin Immunol. 2015;11(1):1. doi: 10.1186/1710-1492-11-1. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 51.Van Driel ML, De Sutter AIM, Habraken H, Thorning S, Christiaens T. Different antibiotic treatments for group A streptococcal pharyngitis. Cochrane Database Syst Rev. 2016;(9):CD004406. doi: 10.1002/14651858.CD004406.pub4. [DOI] [PMC free article] [PubMed] [Google Scholar]
- 52.Pontin IP, Sanchez DC, Di Francesco R. Asymptomatic group A streptococcus carriage in children with recurrent tonsillitis and tonsillar hypertrophy. Int J Pediatr Otorhinolaryngol. 2016;86:57–9. doi: 10.1016/j.ijporl.2016.03.044. Publ. en ligne du 12 avr. 2016. [DOI] [PubMed] [Google Scholar]
- 53.Tanz RR, Shulman ST, Barthel MJ, Willert C, Yogev R. Penicillin plus rifampin eradicates pharyngeal carriage of group A streptococci. J Pediatr. 1985;106(6):876–80. doi: 10.1016/s0022-3476(85)80229-8. [DOI] [PubMed] [Google Scholar]
- 54.Chaudhary S, Bilinsky SA, Hennessy JL, Soler SM, Wallace SE, Schacht CM, et al. Penicillin V and rifampin for the treatment of group A streptococcal pharyngitis: a randomized trial of 10 days penicillin vs 10 days penicillin with rifampin during the final 4 days of therapy. J Pediatr. 1985;106(3):481–6. doi: 10.1016/s0022-3476(85)80687-9. [DOI] [PubMed] [Google Scholar]